需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
利用微流体装置进行机械刺激和高分辨率成像的研究C.线虫
* 这些作者具有相同的贡献
摘要
美国匹茨堡研究的新工具需要了解机械应力是如何激活生化通路并引起生物学反应的。在这里, 我们展示了一种新的方法, 选择性机械刺激固定化动物与微流控器陷阱, 允许高分辨率成像的细胞反应。
摘要
美国匹茨堡的一个中心目标是了解机械应力对蛋白质和细胞的相互作用。尽管它的重要性, 机械应力对细胞功能的影响仍然是不太清楚。在某种程度上, 这种知识差距之所以存在, 是因为很少有工具能使组织和细胞同时变形, 活动物的细胞活动成像, 以及在其他高度流动的模型生物体中有效限制运动, 如线虫秀丽线虫。小的C. 线虫使它们与基于微流体的研究设备非常匹配, 并利用微流控装置提出了固定化解决方案。虽然这些设备允许高分辨率成像, 该动物是完全包裹在烷和玻璃, 限制物理访问提供机械力或电生理记录。最近, 我们创建了一个设备, 集成气动执行器与陷阱设计兼容高分辨率荧光显微镜。所提出的驱动通道是由一个薄的, 由一个小的反式的双膜片分离的蠕虫捕获通道。这种隔膜通过施加外部源的压力偏转到蠕虫的一侧。该装置可以针对单个 mechanosensitive 神经元。这些神经元的活化是用基因编码的钙指标进行高分辨率成像的。本文介绍了在触摸受体神经元 (TRNs) 中, 使用线虫菌株表达钙敏感活性指标 (GCaMP6s) 的一般方法。然而, 该方法并不局限于 TRNs 或钙传感器作为探针, 但可以扩展到其他机械敏感的细胞或传感器。
引言
触觉为动物提供了关于环境的关键信息。根据施加的力量, 触摸被认为是无害的, 愉悦的, 或痛苦的。在接触过程中的组织变形是由嵌入在皮肤中的专门 mechanoreceptor 细胞检测到的, 表达受体蛋白, 最常见的离子通道。在接触和疼痛过程中, 连接力知觉与离子通道活化的步骤没有完全理解。对于皮肤组织如何过滤机械变形以及 mechanoreceptors 检测应变或应力变化的情况 (如1、2、3), 更甚了解。这种理解上的差距, 部分是由于缺乏适当的工具, 在观察细胞水平的反应时, 对活着的动物的皮肤表面施加精确的机械刺激。虽然原子力显微镜已广泛用于应用和测量孤立细胞中的作用力4,5和激活 Piezo1 受体在活细胞6, 类似的实验使用活体动物, 特别是C. 线虫, 由于这个主题的内在流动性, 而臭名昭著的挑战性。这一挑战传统上绕过使用兽医或外科级氰胶水固定在琼脂垫上的个别动物,1,7,8,9。这种方法是有成效的, 但有限制与固定的技能所需的胶合和软琼脂表面上的机械依从性。微流体策略是一种免费的替代方法, 可以避免一些与胶合有关的并发症。
线虫线虫是一个基因模型有机体与完全映射神经系统, 由于动物的大小, 是一个很好的适合微流体技术. 微流体的设备提供的优势, 否则极端移动动物可以克制, 而执行高分辨率成像和提供相关的神经调节刺激。在微流控技术的帮助下, 活着的动物可以不受伤害地固定化10,11, 启用对整个生存期1213和高分辨率的行为活动的监视神经元活动的成像14,15,16,17。此外, 许多 mechanoreceptor 神经元需要的触觉和疼痛的特点, 可以在他们的生理1,8, 机械4,18,19, 和分子级别20,21,22。
C. 线虫用六 TRNs 对其体壁进行柔和的机械刺激, 其中三支配动物的前 (ALML/r 和 AVM), 三支配动物的后部 (PLML/r 和 PVM)。在它的 TRNs8中广泛研究了传感所需的离子通道分子在生化信号中的应用。本文介绍了一个微流控平台23 , 使研究人员能够将精确的机械力应用于固定化的C. 线虫蛔虫的皮肤, 同时通过光学成像读取其内部组织的变形。除了提供良好定义的机械刺激, 钙瞬变可以记录在 mechanoreceptor 神经元的亚细胞分辨率和相关的形态学和解剖特征。该设备由一个中央补漏白通道组成, 它包含一个动物, 并在六个气动驱动通道 (图 1和图 2) 旁边呈现其外观。六通道沿陷印通道定位, 为蠕虫的六 TRNs 提供机械刺激。这些通道通过薄的可由外部气压源 (图 1) 驱动的薄壁膜片与陷印室隔开。我们对压力的偏转进行了校准, 并提供了本文的测量结果。每个执行器可以单独解决, 并用于刺激 mechanoreceptor 的选择。压力是通过压电驱动的压力泵提供的, 但任何替代装置都可以使用。我们表明, 压力协议可以用来激活 TRNs在体内和演示的操作设备, 以提供机械刺激成人C. 线虫, 加载成年动物进入设备, 执行钙成像实验, 分析结果。器件制造包括两个主要步骤: 1) 光刻, 使模具从 SU-8;2) 模压成型机制造设备。为了简洁明了, 读者可以参考以前发布的文章和协议24,25 , 了解如何生成模具和设备的说明。
研究方案
1. 设备制造
- 下载附加的掩码文件 (补充文件 1), 并使用商业服务或内部设施生成 chrome 掩码。由于器件的最小尺寸为10µm (执行器膜厚度), 确保掩模具有足够高的分辨率, 在0.25 µm 内, 可靠地产生特性。
-
遵循标准的 SU-8 光刻方法 (例如, 引用24,25,26), 以制造随后生产的注塑设备的模具;下面列出了步骤的摘要.
注: SU-8 是一种光敏材料, 在紫外线照射下 crosslinks (最大吸收量约 365 nm)。使用制造商说明作为起点, 确定软烘烤、曝光 (UV) 和后烘烤的加工参数。- 将 SU-8 2002 存入硅片, 将其纺成大约2µm 的厚度, 以更好地粘合小结构。软烘烤在热的板材为1分钟在95°c, 轻微地暴露 (UV) 整个表面 (~ 100 mJ/cm2) 和在热板材烘烤在2摄氏度的95分钟。
- 自旋涂层 47-µm 厚层 SU-8 2050 用于定义设备功能。使用 500 rpm 的旋转速度为十五年代 (130 rpm/秒加速), 然后 2000 rpm 九十年代 (260 rpm/秒加速)。如有必要, 重复并调整旋转速度, 以获得适当的光刻胶厚度。
- 软烘烤在热的板材2分钟在65°c, 然后7分钟在95°c。根据制造商指令 (〜160兆焦耳/cm2) 公开光刻胶, 使用铬面具和长通滤波器确保直边墙。
- 在热板上取出硅片, 后烘烤1分钟, 65 摄氏度, 7 分钟95摄氏度。
- 溶解未暴露的 SU-8 与开发商, 和清洁与2丙醇。
- 在180摄氏度的热板上烘烤硅片30分钟 (硬烘烤) 以稳定光刻胶的特性。
-
使用标准的副本成型方法27, 从 SU-8 模型中制作一个来自该产品的。
- 用 trichloromethylsilane (中药) 蒸气处理 SU-8 霉菌, 以降低其附着力 (硅烷化)。
注意: 中药毒性和水反应。- 将图案化的晶片放在一个钟罐真空干燥内的晶片架内, 不含水或水溶性试剂。
- 在引擎盖下, 用吸管将1滴中药在玻璃盘子里, 放在干燥内。
- 关闭干燥盖, 允许中药蒸气将晶片涂上至少20分钟。
- 通风口, 然后打开干燥。打开钟罐盖子, 用塑料镊子取下晶片。将其放入培养皿或铝箔船上, 用于塑料制品的复制成型。在适当的危险废物中处理中药涂层材料。
- 采用基聚合物40克和4克聚硅固化剂进行混合 (比例为 10:1)。
- 将混合物倒入 SU-8 模具上, 将混合物加在真空室至少30分钟。
- 在烤箱中至少6小时的70摄氏度的固化。
- 用 trichloromethylsilane (中药) 蒸气处理 SU-8 霉菌, 以降低其附着力 (硅烷化)。
- 将晶圆片水平放在平坦的表面上, 并仔细剥离该硅烷, 将其从晶片上提起。在这一步, 不要弯曲晶片向上, 因为它可以打破模具。
注意: SU-8 与晶片或不完全硅烷化的不完全粘附会导致 SU-8 结构在这一步骤中被破坏。 - 将这些设备上的盖玻片切割成单个芯片, 这样设备就能适应24毫米 x 60 毫米的产品。
- 使用1毫米活检冲床, 在入口, 两个插座, 和六执行机构使用1毫米活检打孔。瞄准设备边缘周围2毫米直径的圆圈。
-
将该芯片与玻璃罩片结合在一起。
- 将两个表面暴露在 80 W 氧等离子体中 (三十年代)。
- 轻轻地将暴露在外的表面表面放在盖板滑动面上, 用于保形密封。
- 在热板上退火设备 (100 °c, 10 分钟)。
注: 粘结不足会导致设备因渗漏而失效。
2. 显微镜的制备
注: 转基因动物: 表达钙指示器, 如 GCaMP6s28或其他基因编码活动探头 (例如, TRN);与活动无关的荧光蛋白发射在不同的波长, 以纠正小的横向和外焦点运动工件出现由于机械刺激。自动分析软件跟踪和补偿活动探针强度的运动引起的变化。蠕虫菌株 GN69223 (或 AQ323629) 表示 GCaMP6s (或 GCaMP6m) 和 tagRFP mec-7 控制下的钙独立助剂。此外, GN692 包含突变简装-1 (ce314), 它防止由于蓝光传感器lite-130在 GCaMP6s 荧光23的激发期间激活 TRNs。
-
建立了 GCaMP 和 RFP 同时激发的显微系统。
- 使用连续光源和双波段励磁过滤器, 仅传输青色和黄色光, 或者使用光源, 仅在定义的带宽中发出波长, 如同时青色 (0.77 兆瓦) 和黄色 (1.21 兆瓦) LED 励磁源, 用于同时激发钙依赖性和独立荧光, 分别。
- 使用数码相机来记录显微图像。
注: 大多数照相机都带有用于图像采集的软件。另外, 也有免费的软件, 可以用来控制相机和可能也有其他部分的显微系统。 - 根据荧光强度调整励磁强度, 避免相机饱和。
-
使用一个荧光立方体, 根据激发源的选择需要配备一个励磁过滤器。
注: 488 纳米 GFP 和580纳米 mCherry 励磁过滤器在这里使用。- 将分束器添加到立方体中, 以反射青色和黄色光, 并传送绿色和红色光。
- 用10X 目标和一个高放大目标 (例如, 63 x/1.32 NA 油) 装备显微镜, 将励磁灯聚焦到样品上。
- 在摄像机前安装一个光束分配器, 同时记录 GCaMP 和与钙无关的信号。确保光束分配器有一个分色镜 (长通行证, 切割在 570 nm), 以分离绿色和红光使用一个发射过滤器为绿色 (通径中心在525毫微米以50毫微米宽度) 和一个发射过滤器为红灯 (通入中心在632毫微米与60毫微米 宽度)。
- 将绿色和红色荧光投影到上半部分 (绿色) 和下半 (红色), 分别为摄像机芯片 (请参见图 3)。此方向是提供的分析软件的先决条件。
3. 动物制剂
- 准备年龄同步的年轻成人或成年日一个线虫, 如前所述的 "门"-- . 31
- 准备微流控芯片。
- 将重力流储层 (60 厘米以上的芯片级) 连接在一起, 包含过滤 (0.2-µm 聚醚砜注射器过滤器) M9 缓冲器到芯片的一个出口。将另一个插座连接到两个出口废物容器的一个出口,即, 一个过滤瓶。将废物容器的其他出口连接到蠕动泵。
注: 对所有连接使用聚乙烯 (PE) 油管, 并使用金属管接头将 PE 油管连接到芯片上。这样, 所有的废物解决方案都将从芯片中冲出, 并收集在废物容器中。通过出口通道的流量创建一个温和的吸力, 将保持蠕虫在以后的诱捕过程中舒适。 - 用金属管 (规格尺寸 23TW, 0.635 毫米外径) 在两端准备 50 mm 长 PE 油管 (0.9652 毫米外径, 0.5842 毫米 ID) 的互连线。按下-将这些互连插入到六个驱动手指和蠕虫入口 (请参见图 1)。将这些联网装置放在芯片中, 因为重复的拆卸会导致在其上的孔上磨损。
- 将重力流储层 (60 厘米以上的芯片级) 连接在一起, 包含过滤 (0.2-µm 聚醚砜注射器过滤器) M9 缓冲器到芯片的一个出口。将另一个插座连接到两个出口废物容器的一个出口,即, 一个过滤瓶。将废物容器的其他出口连接到蠕动泵。
- 把芯片放在显微镜上。将2–5蠕虫放入一滴过滤 (0.2-µm 注射器过滤器) M9 缓冲液中, 并使用1毫升注射器将其绘制成 PE 油管 (0.9652 毫米外径, 0.5842 毫米 ID), 通过轻轻拉动活塞将其连接到1毫升注射器上。把动物放在 PE 管里, 而不是放在注射器里。
注意: 芯片中过多的蠕虫或未过滤的解决方案会导致堵塞。 - 将注射器的 PE 油管连接到芯片的蠕虫入口 (图 1和图 2) 的互连。打开阀门启动蠕动泵, 激活重力流。然后轻轻按注射器的注射器柱塞, 以移动动物进入诱捕通道, 同时观察在显微镜下与10X 透镜在 brightfield 模式下的通道。
注: 偶尔出现气泡不构成问题;它们通常会自动移到插座中。一些动物可以 "停放" 在候诊室, 并按顺序使用。- 将动物装入陷印通道后 (请参见图 2), 通过轻轻推或拉动注射器的柱塞来调整其位置, 将动物头部定位在通道前面的锥形形状中。
- 确保蠕虫 (成人日 1) 有合适的大小被困在芯片。
- 如果蠕虫不填充通道的整个横断面从鼻子到接近身体的末端 (不包括尾巴尖端) 或蠕虫沿渠道的轴移动, 不用移动注射器的柱塞, 请按注射器的柱塞, 直到它从陷印通道中消失, 然后加载一个新的蠕虫 (参见步骤 3.8)。
- 切换到显微镜的荧光模式和更高的放大透镜 (40X 或更高), 并检查感兴趣的神经元的突起是否位于一个执行器的膜片上。如果没有, 通过拉或推活塞来调整动物的位置。如果这没有帮助, 请删除该蠕虫并加载一个新的。
- 聚焦于感兴趣神经元的细胞体, 并将与细胞体前侧神经元最接近的传动器的互连连接到可编程压力泵, 使用 PE 管。
- 如果实验需要测量执行器和神经元之间的距离, 请移动视图场, 以便两者都在视图领域, channelwall 与图像的上下边缘平行。
- 使用可编程压力泵定义压力协议。
注意: 此协议可以调整为所需的实验。- 以0帕的恒定压力开始, 时间对应于图像序列的至少50幅图像 (规范化的必要)。为 10 Hz 的成像率这对应于 5 s. 添加一个期望的刺激波形和压力, 并定义刺激的长度作为第二步。
注: 为刺激 TRNs, 建议在生成一个大的神经元响应时, 使用一个与步骤 (即, 275 帕) 叠加的正弦波形 (即, 75 帕, 10 Hz)。 - 如果实验需要额外的刺激, 包括至少十年代的期间在0帕在刺激之间的恒定的压力。在开关压力泵之前, 要确保仪器压力在恒定的0帕, 以避免在实际实验之前意外地刺激蠕虫。
- 以0帕的恒定压力开始, 时间对应于图像序列的至少50幅图像 (规范化的必要)。为 10 Hz 的成像率这对应于 5 s. 添加一个期望的刺激波形和压力, 并定义刺激的长度作为第二步。
- 运行成像和压力协议。
- 在相机的图像采集软件中, 在压力协议的持续时间内, 使用100毫秒的曝光时间在10赫兹上设置图像序列。调整激发强度, 使最大荧光增加不饱和相机。将图像另存为 *. tif 文件, 在第一次规范化刺激之前至少有50张图像。
- 在可编程泵软件中, 启动图像采集软件和压力协议中的成像协议。在录制过程中, 观察感兴趣的神经元是否是 10 x 10 像素区域中最亮的点, 在序列图像中不超过10个像素, 并且在录制期间停留在视图领域。
注意: 如果未完成此操作, 分析软件将失败。神经元周围的明亮斑点 (即自发荧光) 使神经元的清洁记录变得困难。要纠正此错误, 请从陷阱中取出蠕虫并将新蠕虫加载到芯片中。如果蠕虫移动太多, 尝试一个新的记录相同的蠕虫和观察蠕虫运动。如果问题仍然存在, 则蠕虫可能太小而无法被捕获。在这种情况下, 删除此蠕虫和加载一个稍大的蠕虫进入陷阱。 - 如果需要, 只要神经元在整个录音过程中至少被10像素隔开, 就能同时在视场中的多个神经元记录信号。
- 为了调查习惯, 对动物进行反复实验。
- 从陷印通道中移除蠕虫。
- 如果希望将蠕虫用于后续的研究, 请断开芯片的插座朝向重力流和废物容器。轻轻按压注射器的柱塞, 直到整个蠕虫通过陷印通道进入流道。
- 继续按注射器柱塞直到动物出现在芯片外的水滴。从蠕虫入口拔下包括 PE 油管在内的注射器, 用它来吸入液滴中的蠕虫并将其转移到琼脂盘上。
- 如果不需要保留蠕虫, 则通过按注射器的柱塞来去除蠕虫, 直到将整个蠕虫通过陷印通道推入流通道;蠕动泵的重力流和吸力会将动物从芯片中取出, 进入废物容器。
4. 分析
- 下载并安装最新的斐济版本32。
- 下载并安装最新的 java SDK 版本。
注意: 如有必要, 请删除或重命名斐济文件夹中的 java 文件夹, 以使用新安装的 java 编译器。 -
打开斐济软件。
- 通过打开 "插件" 来检查软件是否正在运行新安装的 java 编译器 |公用事业 |ImageJ |属性 "。
- 下载 pokinganalyzer 文件 (https://github.com/HFehlauer/Poking-Analyzer, 请参阅补充文件 2)。
- 将. java 文件拖放到 "软件" 窗口中, 将其作为插件打开。
-
通过在斐济按 Ctrl + R 键编译并运行 pokinganalyzer 文件;将打开图形用户界面 (戳分析器) (图 3)。
- 单击 "帮助" 选项卡, 阅读有关软件的要求以及如何执行分析。要开始, 请选择 "打开视频" 选项卡. 指定分析器的视频文件位置: 单击 "打开视频" 按钮, 导航到视频的位置, 然后打开它。
注意: 软件从打开该选项卡开始。如果在启动新分析时未打开, 请单击 "打开视频" 选项卡。如果视频是. tif 格式, 程序将在内部打开视频并在界面下部显示第一个图像。如果图像不是需要分析的视频, 请单击 "打开视频" 按钮打开另一个视频。 - 要继续, 请单击 "定义 ROIs" 选项卡。在此选项卡中, 定义 TRN 的位置。请注意, 打开的视频的第一个图像显示在该选项卡的下部. 点击 "定义 TRN" 按钮, 点击显示图像上部的神经元, 显示 GCaMP 荧光。
- 可选: 如果执行器在图像的上半部分可见, 程序可以自动跟踪神经元和执行器之间的距离 (如果需要)。为此, 请检查 "定义执行器"。-框中, 单击 "定义执行器" 按钮, 然后单击图像上半部分的执行器。
- 单击 "分析" 选项卡. 定义图像获取速率。请在字段中输入一个数字, 或单击向上或向下按钮以增加或减少数字。如果在上一个选项卡 "定义驱动器?-复选框, 定义相机单元格大小、放大倍数和 binning 因子, 这样程序就可以计算出距离。
- 点击 "开始分析" 按钮。
注: 该程序现在将跟踪神经元的荧光在图像序列中的上半部分 (钙依赖) 和在较低的一半 (钙独立) 的图像序列。为了解释在记录平面中的神经元运动, 该程序将调查前一幅图像中神经元位置周围 10 x 10 像素的区域, 以查找下图中神经元的位置。它将通过校正背景荧光 (Fbg) 并除以前50图像 (F0) 中的荧光来计算两半中的荧光: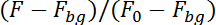
在绿色、与活动相关的通道 (FCa2 +) 中由神经元运动引起的荧光变化, 然后使用红色的、与活动无关的通道中的荧光来校正 (f对) 和依赖钙 ( sdCa2 +) 和独立荧光 (sd) 的预刺激标准偏差通过:
- 该程序将显示其在接口下部状态栏中的进度;当状态栏达到100% 时, 单击 "结果" 选项卡。如果状态栏在100% 之前停止, 程序将给出一条错误消息, 指出程序无法分析视频的原因。
- 如果信噪比过低, 则程序无法识别神经元;调整后续录制中的成像参数。
- 如果神经元在录制过程中离开了视野, 程序就无法跟踪它, 并且会停止。对于后续录制, 将神经元放置在该记录开始处的视图区域中间。
- 如果视图领域中的某些区域是饱和的, 则自动分析将产生无效结果。对于后续记录, 请确保荧光信号不饱和相机传感器。
- 在 "结果" 选项卡中, 结果显示在上半部分。通过单击 "保存结果表", 保存结果表的制表符分隔的 .txt 文件。
注: 该表包括时间以秒为单位, 规范化的钙依赖性荧光 (由钙无关荧光校正)。如果先前定义, 它还包含在µm 中的 TRN 和执行器之间的总距离以及与µm 中的通道壁垂直的 TRN 与执行器之间的距离. 荧光强度增加后的代表性结果在图 4中绘制了刺激与单元体与最接近的驱动器的距离。 - 如果一个记录中有多个神经元 (用超过10个像素隔开), 请再次单击 "定义 ROIs" 选项卡, 然后返回到第二个神经元的步骤4.6.2。
- 单击 "帮助" 选项卡, 阅读有关软件的要求以及如何执行分析。要开始, 请选择 "打开视频" 选项卡. 指定分析器的视频文件位置: 单击 "打开视频" 按钮, 导航到视频的位置, 然后打开它。
结果
SU-8 光刻与芯片粘合
光刻协议和注塑工艺遵循标准程序。详细信息可在其他地方找到23,24,25,26。在固化后, 应将硅片剥离, 无问题。如果 SU-8 的特性在其剥离过程中脱落, SU-8 黏附层或硅烷化是不够的。如果等离子活化的玻璃盖玻片和非晶硅芯片是不够的, 弱粘结?...
讨论
该协议说明了一种方法, 提供精确的机械刺激的皮肤的蛔虫被困在微流控芯片。它的目的是促进物理刺激的综合回答生物学问题, 并旨在简化生物实验室的美国匹茨堡研究。这种方法扩展了以前的化验, 以评估 mechanosensory 神经元在C. 线虫中的作用。以前测量的定量和半定量技术力1、34和行为35, 但很难与神经元活动的高分辨率成像...
披露声明
作者没有什么可透露的。
致谢
我们感谢桑德拉 n. Manosalvas-Kjono, 普珥节 Ladpli, 法拉梅蒙, Divya Gopisetty, 和维罗妮卡支持在设备设计和产生变种动物。这项研究得到了 NIH 赠款 R01EB006745 (BLP)、R01NS092099 (MBG)、K99NS089942 (至 MK)、F31NS100318 (氮化铝) 的支持, 并获得欧洲联盟2020研究和创新计划 (协调委员会) 的资助 (授予 MK 715243 号协议)。
材料
| Name | Company | Catalog Number | Comments |
| Chrome mask | Compugraphics (http://www.compugraphics-photomasks.com/) | 5'', designed in AutoCAD (Autodesk, Inc.) | |
| Chrome mask | Mitani-Micronics (http://www.mitani-micro.co.jp/en/) | 5'', designed in AutoCAD (Autodesk, Inc.) | |
| Chrome mask | Kuroda-Electric (http://www.kuroda-electric.eu/ | 5'', designed in AutoCAD (Autodesk, Inc.) | |
| 4'' Silicon wafer (B-test) | Stanford Nanofabrication Facility | ||
| SU-8 2002 | MicroChem | ||
| SU-8 2050 | MicroChem | ||
| Spin-coater | Laurell Technologies | WS-400BZ-6NPP/LITE | |
| Exposure timer | Optical Associates, Inc | OAI 150 | |
| Illumination controller | Optical Associates, Inc | 2105C2 | |
| SU-8 developer | MicroChem | ||
| 2-Propanol | Fisher Scientific | A426F-1GAL | |
| Acetone | Fisher Scientific | A18-4 | |
| Trichloromethylsilane (TCMS) | Sigma-Aldrich | 92361-500ML | Caution: TCMS is toxic and water-reactive |
| Sylgard 184 Elastomer Kit | Dow Corning | PDMS prepolymer | |
| Biopsy punch, 1 mm | VWR | 95039-090 | |
| Oxygen Plasma Asher | Branson/IPC | ||
| Small metal tubing (0.635 mm OD, 0.4318 mm ID, 12.7 mm long); gage size 23TW | New England Small Tube Corporation | NE-1300-01 | |
| Nalgene syringe filter, 0.22 μm | Thermo Scientific | 725-2520 | to filter all solution, small particles would clog the chip |
| Polyethylene tubing; 0.9652 mm OD, 0.5842 mm ID | Solomon Scientific | BPE-T50 | |
| Syringe, 1 ml | BD Scientific | 309628 | for worm trapping and release |
| Syringe, 20 ml | BD Scientific | 309661 | for gravity-based flow |
| Gilson Minipuls 3, Peristaltic pump | Gilson | to suck solutions and worms out of the chip | |
| Microfluidic flow controller, equipped with 0–800 kPa pressure channel | Elveflow | OB1 MK3 | pressure delivery |
| Water-Resistant Clear Poly- urethane Tubing, 4 mm ID and 6 mm OD | McMaster-Carr | 5195 T52 | connection from house air to pressure pump |
| Water-Resistant Clear Polyurethane Tubing, 2.6mm ID and 4mm OD | McMaster-Carr | 5195 T51 | connect pressure pump to small tubng |
| Push-to-Connect Tube Fitting for Air | McMaster-Carr | 5111K468 | metric - imperial converter |
| Straight Connector for 6 mm × 1/4″ Tube OD | McMaster-Carr | 5779 K258 | |
| Leica DMI 4000 B microscopy system | Leica | ||
| 63×/1.32 NA HCX PL APO oil objective | Leica | 506081 | |
| Hamamatsu Orca-Flash 4.0LT digital CMOS camera | Hamamatsu | C11440-42U | |
| Lumencor Spectra X light engine | Lumencor | With cyan and green/yellow light source | |
| Excitation beam splitter | Chroma | 59022bs | in the microscope |
| Hamamatsu W-view Gemini Image splitting optics | Hamamatsu | A12801-01 | to split green and red emission and project them on different areas on the camera chip |
| Emission beam splitter | Chroma | T570lpxr | in the image splitter |
| Emission filters GCamp6s | Chroma | ET525/50m | in the image splitter |
| Emission filters mCherry | Chroma | ET632/60m | in the image splitter |
参考文献
- Eastwood, A. L., et al. Tissue mechanics govern the rapidly adapting and symmetrical response to touch. Proc. Natl. Acad. Sci. 15 (50), E6955-E6963 (2015).
- Katta, S., Krieg, M., Goodman, M. B. Feeling Force: Physical and Physiological Principles Enabling Sensory Mechanotransduction. Annu. Rev. Cell Dev. Biol. 31, 347-371 (2015).
- Krieg, M., Dunn, A. R., Goodman, M. B. Mechanical systems biology of C. elegans touch sensation. BioEssays. 37 (3), 335-344 (2015).
- Krieg, M., Dunn, A. R., Goodman, M. B. Mechanical control of the sense of touch by β-spectrin. Nat. Cell Biol. 16 (3), 224-233 (2014).
- Krieg, M., et al. Tensile forces govern germ-layer organization in zebrafish. Nat Cell Biol. 10 (4), 429-436 (2008).
- Gaub, B. M., Müller, D. J. Mechanical stimulation of Piezo1 receptors depends on extracellular matrix proteins and directionality of force. Nano Lett. 17 (3), 2064-2072 (2017).
- Geffeney, S. L., et al. DEG/ENaC but not TRP channels are the major mechanoelectrical transduction channels in a c. Elegans nociceptor. Neuron. 71 (5), 845-857 (2011).
- O'Hagan, R., Chalfie, M., Goodman, M. B. The MEC-4 DEG/ENaC channel of Caenorhabditis elegans touch receptor neurons transduces mechanical signals. Nat. Neurosci. 8 (1), 43-50 (2005).
- Suzuki, H., et al. In Vivo Imaging of C. elegans Mechanosensory Neurons Demonstrates a Specific Role for the MEC-4 Channel in the Process of Gentle Touch Sensation. Neuron. 39 (6), 1005-1017 (2003).
- Kopito, R. B., Levine, E. Durable spatiotemporal surveillance of Caenorhabditis elegans response to environmental cues. Lab Chip. 14 (4), 764-770 (2014).
- Chokshi, T. V., Ben-Yakar, A., Chronis, N. CO2 and compressive immobilization of C. elegans on-chip. Lab Chip. 9 (1), 151 (2009).
- Hulme, S. E., Shevkoplyas, S. S., McGuigan, A. P., Apfeld, J., Fontana, W., Whitesides, G. M. Lifespan-on-a-chip: microfluidic chambers for performing lifelong observation of C. elegans. Lab Chip. 10 (5), 589-597 (2010).
- Li, S., Stone, H. a., Murphy, C. T. A microfluidic device and automatic counting system for the study of C. elegans reproductive aging. Lab Chip. 15 (2), 524-531 (2015).
- Chokshi, T. V., Bazopoulou, D., Chronis, N. An automated microfluidic platform for calcium imaging of chemosensory neurons in Caenorhabditis elegans. Lab Chip. 10 (20), 2758-2763 (2010).
- Mishra, B., et al. Using microfluidics chips for live imaging and study of injury responses in Drosophila larvae. J. Vis. Exp. , e50998 (2014).
- Chronis, N., Zimmer, M., Bargmann, C. I. Microfluidics for in vivo imaging of neuronal and behavioral activity in Caenorhabditis elegans. Nat. Methods. 4 (9), 727-731 (2007).
- Krajniak, J., Lu, H. Long-term high-resolution imaging and culture of C. elegans in chip-gel hybrid microfluidic device for developmental studies. Lab Chip. 10 (14), 1862-1868 (2010).
- Vasquez, V., Krieg, M., Lockhead, D., Goodman, M. B. Phospholipids that Contain Polyunsaturated Fatty Acids Enhance Neuronal Cell Mechanics and Touch Sensation. CellReports. 6 (1), 70-80 (2013).
- Krieg, M., et al. Genetic defects in β-spectrin and tau sensitize C. elegans axons to movement-induced damage via torque-tension coupling. Elife. 6 (2010), e20172 (2017).
- Arnadóttir, J., O'Hagan, R., Chen, Y., Goodman, M. B., Chalfie, M. The DEG/ENaC protein MEC-10 regulates the transduction channel complex in Caenorhabditis elegans touch receptor neurons. J. Neurosci. 31 (35), 12695-12704 (2011).
- Lockhead, D., et al. The tubulin repertoire of Caenorhabditis elegans sensory neurons and its context-dependent role in process outgrowth. Mol. Biol. Cell. 27 (23), 3717-3728 (2016).
- Goodman, M. B., Ernstrom, G. G., Chelur, D. S., O'hagan, R., Yao, C. A., Chalfie, M. MEC-2 regulates C. elegans DEG/ENaC channels needed for mechanosensation. Nature. 415 (6875), 1039-1042 (2002).
- Nekimken, A., Fehlauer, H., Kim, A., Goodman, M., Pruitt, B. L., Krieg, M. Pneumatic stimulation of C. elegans mechanoreceptor neurons in a microfluidic trap. Lab Chip. , (2017).
- Brower, K., White, A. K., Fordyce, P. M. Multi-step Variable Height Photolithography for Valved Multilayer Microfluidic Devices. J. Vis. Exp. (119), e55276 (2017).
- Jenkins, G. Rapid prototyping of PDMS devices using SU-8 lithography. Methods Mol. Biol. 949 (1), 153-168 (2013).
- Faustino, V., Catarino, S. O., Lima, R., Minas, G. Biomedical microfluidic devices by using low-cost fabrication techniques: A review. J. Biomech. 49 (11), 2280-2292 (2016).
- Xia, Y., Whitesides, G. M. SOFT LITHOGRAPHY. Annu. Rev. Mater. Sci. 28 (1), 153-184 (1998).
- Chen, T. -. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Cho, Y., Porto, D., Hwang, H., Grundy, L., Schafer, W. R., Lu, H. Automated and controlled mechanical stimulation and functional imaging in vivo in C. elegans. Lab Chip. , (2017).
- Edwards, S. L., et al. A novel molecular solution for ultraviolet light detection in Caenorhabditis elegans. PLoS Biol. 6 (8), 1715-1729 (2008).
- Porta-de-la-Riva, M., Fontrodona, L., Villanueva, A., Cerón, J. Basic Caenorhabditis elegans methods: synchronization and observation. J. Vis. Exp. (64), e4019 (2012).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat. Methods. 9 (7), 676-682 (2012).
- Cho, Y., Porto, D. A., Hwang, H., Grundy, L. J. High-Throughput Controlled Mechanical Stimulation and Functional Imaging In Vivo. BiorXiv. , (2017).
- Petzold, B. C., Park, S. -. J., Mazzochette, E. A., Goodman, M. B., Pruitt, B. L. MEMS-based force-clamp analysis of the role of body stiffness in C. elegans touch sensation. Integr. Biol. (Camb). 5 (6), 853-864 (2013).
- Nekimken, A. L., Mazzochette, E. A., Goodman, M. B., Pruitt, B. L. Forces applied during classical touch assays for Caenorhabditis elegans. PLoS One. 12 (5), e0178080 (2017).
- Chronis, N., Zimmer, M., Bargmann, C. I. Microfluidics for in vivo imaging of neuronal and behavioral activity in Caenorhabditis elegans. Nat. Methods. 4 (9), 727-731 (2007).
- Gilleland, C. L., Rohde, C. B., Zeng, F., Yanik, M. F. Microfluidic immobilization of physiologically active Caenorhabditis elegans. Nat. Protoc. 5 (12), 1888-1902 (2010).
- Chuang, H. -. S., Raizen, D. M., Lamb, A., Dabbish, N., Bau, H. H. Dielectrophoresis of Caenorhabditis elegans. Lab Chip. 11 (4), 599 (2011).
- Christensen, A. M., Chang-Yen, D. A., Gale, B. K. Characterization of interconnects used in PDMS microfluidic systems. J. Micromechanics Microengineering. 15 (5), 928-934 (2005).
- Gilpin, W., Uppaluri, S., Brangwynne, C. P. Worms under Pressure: Bulk Mechanical Properties of C. elegans Are Independent of the Cuticle. Biophys. J. 108 (8), 1887-1898 (2015).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。