このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
マイクロ流体デバイスを用いた機械的刺激と線虫の高解像度イメージング
* これらの著者は同等に貢献しました
要約
メカノバイオロジー研究のための新しいツールはどのように機械的ストレスを理解に必要な生化学的経路を活性化し、生体反応を引き出します。ここでは、細胞応答の高分解能イメージングをできるようにマイクロ トラップで固定化動物の選択的な機械的刺激のための新しい方法を紹介します。
要約
1 つの中央目標メカノバイオロジーの蛋白質および細胞のメカニカル ストレスの相互影響を理解することです。その重要性にもかかわらず機械的ストレスの細胞機能に及ぼす影響はまだよくわかっていません。いくつかのツールは、組織や細胞の同時変形、生きている動物の細胞の活動のイメージングと線虫など、それ以外の場合高度なモバイル モデル生物運動の効率的な制限を有効にするためにこの知識のギャップが存在する部分には、線虫。線虫 c. エレガンスのサイズが小さいマイクロ ベースの研究装置に優れた一致のため、マイクロ流体デバイスを用いた固定化のためのソリューションを提示されています。これらのデバイスは高分解能イメージングを使用、動物はポリジメチルシロキサン (PDMS)、ガラス、機械的な力や電気生理学的記録の配信のための物理的なアクセスを制限することに完全に包まれています。最近では、高解像度蛍光顕微鏡と互換性のあるトラップ デザインと空気圧アクチュエータを統合したデバイスを作成しました。作動チャネルは、薄い PDMS ダイヤフラムでワーム トラップ チャネルから区切られます。この振動板は、外部ソースからの圧力を適用することによってワームの側面にそらされます。デバイスは、個々 の機械受容ニューロンをターゲットできます。これらのニューロンの活性化でイメージはカルシウムの遺伝子にコードされた指標と高解像度。この記事は、接触受容体ニューロン (TRNs) でカルシウムに敏感なアクティビティ インジケーター (GCaMP6s) を表現する線虫の系統を用いた一般的な方法を示します。メソッドはしかし、プローブと TRNs にもカルシウム センサーに限定ではない、他の機械的に敏感な細胞またはセンサーに拡張できます。
概要
タッチの感覚は、彼らの環境に関する重要な情報を持つ動物を提供します。適用された力によって、無害な楽しい、または痛みを伴う、タッチは感知されます。タッチの中に組織の変形は、最もよくイオン チャンネル受容体蛋白質を表現する皮膚に埋め込まれた特殊な受容細胞によって検出されます。タッチと痛みの間にイオン チャネル活性化への力覚のリンク手順が完全に理解されていません。さらに少ないは、皮膚組織が機械的変形、メカノレセプターがひずみの変化を検出するかどうかをフィルターか1,2,3のストレスについて知られています。一部、このギャップの理解では、生きている動物の皮の表面に細胞レベルで反応を観察しながら正確な機械的刺激を適用する適切なツールの欠如から発生します。適用し、隔離されたセル4,5で力を測定してもリビングの Piezo1 受容体を有効にして、原子間力顕微鏡を広く使用されているに対し細胞6、特に生きている動物を使用して同様の実験は、 線虫、被写体の本質的なモビリティのために悪名高く挑戦されています。この挑戦は、伝統的寒天パッド1,7,8,9の個々 の動物を固定する獣医または手術用シアノアクリ レート系接着剤を使用して回避します。このアプローチは、生産されているが、接着剤と機械的コンプライアンスの軟寒天培地表面固定化に必要なスキルに関連する制限があります。マイクロ流体戦略は、接着にリンクされている合併症のいくつかを回避する無料の代替です。
線虫は動物のサイズのために、マイクロ流体技術のためのよい適合をある完全にマップされた神経系の遺伝モデル生物です。マイクロ ベースのデバイスは高分解能イメージングと関連する神経調節刺激の配信を行いながらそれ以外の場合非常にモバイルの動物を抑制できるという利点を提供しています。マイクロ流体の助けを借りて技術、動物の生活は害10,11, 生涯12,13上行動活動の監視と高解像度を実現することがなく固定化することができます。神経活動14,15,16,17のイメージング。さらに、タッチと痛みの感覚は、生理1,8、機械式4,18,19、特徴付けることができるために必要な多くの受容ニューロン分子レベル20,21,22。
線虫 c. エレガンス6 TRNs、動物の前部 (ALML/R と AVM) を支配する 3 つのうち、3 つは動物の後部 (PLML/R と PVM) を支配するを使用してその体壁に穏やかな機械的刺激を感覚します。生化学的信号に適用された力の伝達に必要なイオン チャネル分子は TRNs8で幅広く研究されています。本稿では正確な機械力を固定化c. の elegansの皮膚に適用する研究者を可能にするマイクロ流体プラットフォーム23回虫、光イメージングによるその内部組織の変形を読みながら。明確に定義された機械的刺激を提示に加えてカルシウム トランジェントを受容ニューロン細胞レベル下の解像度で記録し、形態学的および解剖学的機能と相関できます。デバイスは、単一の動物を保持し、その皮膚 (図 1および図 2) 六つの空気圧アクチュエータのチャンネルの横にあるを示す中央トラップ チャネルで構成されます。六つのチャンネルは、各ワームの 6 TRNs に機械的刺激を提供するトラップ チャネルに沿って配置されます。これらのチャネルは、薄い PDMS のダイヤフラムがあり、外部の空気圧力源 (図 1) によって駆動することができますでトラップ室から区切られます。圧力に対する変形を校正この記事で測定を提供しています。各アクチュエータは、個別に対処し、好みの受容を促進するために使用できます。ピエゾ駆動圧力ポンプを使用して圧力を配信、任意の代替デバイスを使用できます。TRNs体内をアクティブにし、大人の線虫に機械的刺激を提供する、デバイスに大人動物の読み込み、カルシウム イメージングを実行する適切な操作装置を示す圧力プロトコルを使用できることを示す実験と結果の分析します。デバイスの作製は、2 つの主な手順で構成されています: 1) SU-8; から金型を作るフォトリソグラフィー・ 2) デバイスにする PDMS を成形します。簡潔、明瞭のために以前に公開された記事およびプロトコル24,25金型とデバイスを生成する方法について読者が呼ばれます。
プロトコル
1. デバイスの作製
- (補足ファイル 1) 添付マスク ファイルをダウンロードし、商業サービスや社内施設使用クロム マスクを生成します。デバイスの最小寸法は、10 μ m (膜厚アクチュエータ) は、マスク機能を確実に生成するの十分に高い解像度、± 0.25 μ m 以内をいるを確認します。
-
標準の SU 8 写真平版方法に従って (例えば、24を参照,25,26) PDMS 装置のそれに続く生産のための金型を作製するには手順の概要は以下です。
注: SU 8 は、感光性材料、紫外線への露出にするクロスリンク (最大吸収 〜 365 nm)。出発点として製造元の指示を使用してソフト焼く、露出 (UV) の処理パラメーターを決定し、後焼きます。- シリコンウェーハやスピン コートに SU 8 2002年を預金して、おおよその厚さ 2 μ m、小構造物のよりよい付着のための。ソフト焼 95 ° C で 1 分のホット プレート上、若干過剰露出 (UV) 全体の表面 (~ 100 mJ/cm2)、95 ° C で 2 分間ホット プレート上後焼く
- デバイスの機能を定義するための SU 8 2050 47 μ m 厚い層のスピン-コート。15 s (130 rpm/s の加速度) と 90、2,000 rpm の 500 の rpm の回転速度を使用 s (260 rpm/s の加速度)。必要に応じて、繰り返し、フォトレジストの適切な厚さを得るためスピン速度を調整します。
- ソフト焼 65 ° C で 2 分してから 95 ° C で 7 分、ホット プレート上製造元の指示に従ってフォトレジストを公開 (~ 160 mJ/cm2) クロム マスクとロングパス ・ フィルターを使用して、ストレート側の壁を確保します。
- ウェハを外し、後 95 ° C で 7 分、65 ° C で 1 分でホット プレートで焼く
- 、開発者と未露光 SU 8 を溶かし、2-プロパノールできれい。
- 180 ° c 30 分 (ハード焼く) レジスト機能を安定させるためにホット プレート、ウエハーを焼きます。
-
成形方法27標準のレプリカを使用して SU 8 モデルから PDMS レプリカを作る。
- PDMS 接着 (シリル化) を減らすために trichloromethylsilane (TCM) 蒸気と SU 8 金型を扱います。
注意: TCM は有毒、水反応性です。- 発煙のフード無料水や水溶性試薬ガラスベル ジャー真空デシケータ内ウェハー ラックにパターン付きウェハを配置します。
- ボンネットの下には、ガラス皿に TCM の 1 滴を適用し、デシケータ内に配置するドロッパーを使用してください。
- デシケータの蓋を閉じて、少なくとも 20 分のウエハーをコートに TCM 蒸気を許可します。
- 発散し、デシケータを開きます。ベルの瓶のふたを開け、プラスチックのピンセットを使用してウェーハを取り外します。PDMS レプリカ成形用シャーレやアルミ箔のボートに配置します。TCM コーティング材料の適切な有害廃棄物の処分します。
- ミックス PDMS (10:1 の比率) は、ポリマーおよび 4 g PDMS 硬化剤 40 g を使用します。
- SU 8 型に混合物を注ぎ、ドガの真空チャンバーで、少なくとも 30 分のための混合物。
- 70 ° C のオーブンで、少なくとも 6 時間を治します。
- PDMS 接着 (シリル化) を減らすために trichloromethylsilane (TCM) 蒸気と SU 8 金型を扱います。
- ウェハからウェハを平らな面に水平設定、PDMS を慎重に剥離して PDMS を持ち上げます。曲げていないウェハ上向きこのステップの間に、それは金型を破ることができます。
注: ウェーハまたは不完全なシリル化 su-8 の不完全な接着はこの段階の SU 8 構造体の破壊につながります。 - 24 mm × 60 mm coverslip のデバイスに適合するように、PDMS を個々 のチップに装置のまわりカットします。
- 1 mm 生検パンチを使用すると、入口、2 つコンセント、および 6 アクチュエータで 1 mm 生検パンチで穴を作る。デバイスの周囲 2 mm 円を目指してください。
-
ガラス カバー スリップにボンド PDMS チップ。
- 80 W 酸素プラズマ両面を公開 (30 秒)。
- 等角のシールのカバー スリップの露出表面上に露出した PDMS 表面をそっと置きます。
- ホット プレート (100 ° C, 10 分間) 上のデバイスをアニールします。
注: 不十分な接合は漏出によるデバイスの失敗につながることができます。
2. 顕微鏡の準備
注: トランスジェニック動物: GCaMP6s28または興味 (例えばTRN); の neuron(s) で他の遺伝的コード化活動プローブなどのカルシウムのインジケーターを表現共同小横の機械的刺激が原因で起こるアウト フォーカス移動アーティファクトを修正する別の波長で発光活性に依存しない蛍光蛋白質を表現します。自動解析ソフトウェア追跡し、活動プローブの強度の運動による変化を補正します。ワーム系統 GN69223 (または AQ323629) GCaMP6s (または GCaMP6m) の表現とメック 7 プロモーターの制御下でカルシウムに依存しない tagRFP。さらに、GN692 には、GCaMP6s 蛍光23の励起の中に青い光センサーライト 130 のため TRNs の起動を抑止変異lite-1(ce314)が含まれています。
-
GCaMP と RFP の同時励振用顕微鏡システムを設定します。
- 連続光源とシアンと黄色だけの光を伝達するデュアル バンド励起フィルター使用や同時シアンなど定義された帯域幅での波長のみを放射する光源を使用 (0.77 mW) と黄色 (1.21 mW) の LED 励起ソースカルシウム依存性と独立した蛍光の同時励起それぞれ。
- 顕微鏡画像の記録を有効にするのにには、デジタル カメラを使用します。
注: ほとんどのカメラの画像取り込みソフトウェアが付属します。また、カメラと潜在的にも顕微鏡システムの他の部分を制御する使用することができます自由に利用できるソフトウェアがあります。 - カメラの飽和を避けるために蛍光強度に基づく励起強度を調整します。
-
励起ソースの選択によって励起フィルターを装備する必要があります蛍光キューブを使用します。
注: 488 nm GFP と 580 nm mCherry 励起フィルターをここで使用しました。- ビームスプリッターをシアンと黄色の光を反射し、緑と赤の光を送信するためのキューブに追加します。
- 客観的かつ高倍率対物 × 10 と顕微鏡を装備 (例えば63 X/1.32 NA オイル) 励起されたサンプル上に光を集中します。
- GCaMP とカルシウム依存しない信号の同時記録のためカメラの前でビームスプリッターをマウントします。ビームスプリッターにダイクロイック ミラーであることを確認 (ロングパス、570 でカットオフ nm) 緑 1 つ放出フィルターを使用して緑と赤の光を分離する (通過域 525 を中心とした 50 nm 幅の nm) と赤い光の 1 つ放出フィルター (632 を中心とした通過 60 nm nm 幅)。
- 上半分に緑と赤の蛍光をプロジェクト (緑) と下半分 (赤)、それぞれカメラのチップ (図 3を参照)。このオリエンテーションを提供分析ソフトウェアの前提条件です。
3. 動物の準備
- ポルタ デ-la Rivaらによって前述時代同期若いアダルトまたは成人向け 1 日目のc. の elegansを準備します。31
- マイクロ流体チップを準備します。
- 重力流れの貯蔵所を接続 (~ 60 cm チップ レベル上) チップの 1 つの出口 (0.2 μ m ポリエーテルサルホン シリンジ フィルター) M9 バッファーをフィルターを含みます。2 コンセント廃棄物コンテナー、すなわちフィルター フラスコ 1 つのコンセントに他のコンセントに接続します。蠕動性ポンプ廃棄容器の他のコンセントに接続します。
注: すべての接続用ポリエチレン (PE) 管しチップに PE チューブを接続する金属管継手を使用します。このように廃棄物のすべてのソリューションがチップからフラッシュ、廃棄容器で収集しました。コンセントを通じてフロー後トラッピング プロセス中にワームを居心地の良い維持が穏やかな吸引を作成します。 - 準備配線で構成される 50 mm 長い PE チューブ (外径 φ 0.9652 mm、0.5842 ミリメートル ID) 両端の金属管 (ゲージ サイズ 23TW、0.635 mm 外径) の。プレス フィットこれらの六つの作動指のそれぞれに、ワームの入口に相互接続 (図 1参照)。そのままこれらの反る・ チップ、繰り返し除去 PDMS 穴の摩耗に 。
- 重力流れの貯蔵所を接続 (~ 60 cm チップ レベル上) チップの 1 つの出口 (0.2 μ m ポリエーテルサルホン シリンジ フィルター) M9 バッファーをフィルターを含みます。2 コンセント廃棄物コンテナー、すなわちフィルター フラスコ 1 つのコンセントに他のコンセントに接続します。蠕動性ポンプ廃棄容器の他のコンセントに接続します。
- 顕微鏡にチップを置きます。ピックアップ 2-5 ワームのドロップにはフィルター処理 (0.2 μ m シリンジ フィルター) M9 バッファーしプランジャーを軽く引き、1 mL のシリンジに接続されている PE チューブ (外径 φ 0.9652 mm、0.5842 ミリメートル ID) にそれら描画する 1 mL 注射器を使用します。PE チューブと注射器でない動物を維持します。
注: あまりにも多くのワームやチップでフィルターされていないソリューションは、目詰まりする可能性があります。 - チップの相互接続 (図 1および図 2) は、ワームの入口にシリンジの PE 管を接続します。バルブを開くことによって重力流をアクティブにし、蠕動性ポンプを起動します。明視野観察モードで 10 倍レンズと顕微鏡の下でチャネルを観察しながらトラップ チャネルに動物を移動する注射器のシリンジのプランジャーを軽く押します。
注: 時折現われる気泡は問題を提起しない;彼らは通常、自動的にコンセントに移動されます。いくつかの動物は、'' 待機室に駐車し、順番で使用できます。- トラップ チャネルに動物をロードした後 (図 2参照してください)、優しく押し、チャネルの前部のテーパー形状の動物の頭の位置に注射器のプランジャーを引く位置を調整します。
- ワーム (1 日目大人) がチップに閉じ込められるため適切なサイズを確認します。
- ワームは (尾の先端を含まず) 本体の末尾の近くに鼻からチャネルの断面全体を記入しない場合はワームは注射器のピストンを移動することがなく、チャンネルの軸に沿って移動、トラップ チャネルから見えなくなるまで、シリンジのプランジャーを押すことによってワームを削除し、新しい 1 つの読み込み (手順 3.8 を参照してください)。
- 蛍光顕微鏡の高倍率レンズ (40 倍速以上) モードに切り替えるし、興味のニューロンの神経突起が横切り、アクチュエータの 1 つのダイヤフラムに来るかどうかを確認してください。ない場合は、プランジャーを引いたり押したりすることで、動物の位置を調整します。問題が解決しない場合は、ワームを削除し、新しいものを読み込みます。
- 興味のニューロンの細胞体に焦点を当てる、PE 管の使用圧力ポンプをニューロン細胞体の前方側に最も近いアクチュエータの配線を接続します。
- 実験は、アクチュエータとニューロンの間の距離を測定する必要がある場合は、ビューのフィールドの両方が、channelwall は画像の上部と下部のエッジに平行なのでフィールドのビューを移動します。
- プログラマブル圧力ポンプを使用して圧プロトコルを定義します。
注: このプロトコルは、目的の実験に調整できます。- イメージ シーケンス (正規化に必要) の少なくとも 50 の画像に対応する時間の 0 kPa の圧力を一定と開始します。10 Hz のイメージング速度この 5 s. 追加希望刺激波形と圧力に対応し、2 番目のステップとして刺激の長さを定義します。
注: TRNs を刺激するため (すなわち、75 kPa、10 Hz) の正弦波波形を (すなわち、275 kPa) ステップで重ねは大型ニューロンの応答を生成すると同時にお勧め。 - 実験では、その他の刺激を必要とする場合は、少なくとも 10 の期間を含む一定の刺激の間に 0 kPa の圧力で s。圧力ポンプを切り替え、前に実際の実験の前にワームの偶発的な刺激を避けるために定数 0 kPa、計器圧力を確認します。
- イメージ シーケンス (正規化に必要) の少なくとも 50 の画像に対応する時間の 0 kPa の圧力を一定と開始します。10 Hz のイメージング速度この 5 s. 追加希望刺激波形と圧力に対応し、2 番目のステップとして刺激の長さを定義します。
- イメージングおよび圧力のプロトコルを実行します。
- カメラの画像集録ソフトウェア、10 hz 圧力プロトコルの間 100 ms の露光時間を使用してイメージ シーケンスを設定します。励起強度を調整して、最大蛍光が増加しないカメラを飽和させない。正規化の最初の刺激の前に少なくとも 50 のイメージを持つ *.tif ファイルとしてイメージを保存します。
- 画像集録ソフトウェアとプログラマブル ポンプのソフトウェアで圧力プロトコルでイメージング プロトコルを起動します。録音中は、関心のニューロン 10 × 10 ピクセルの領域で最も明るいスポットだかどうか、連続画像で 10 ピクセルよりも遠くに移動しないかどうか、および記録中にビューのフィールドに留まるかどうかを観察します。
注: この処理を行わないと、解析ソフトウェアが失敗します。明るい (すなわち、蛍光) ニューロンの周りを作る困難なニューロンの録音をきれい。この問題を解決するには、罠からワームを削除し、新しいワームをチップに読み込みます。ワームの動きはあまりにも多く、同じワームの新しい記録をみて、ワームの動きを観察します。問題が解決しないワームがトラップするのには小さすぎる可能性があります。この場合このワームを駆除し、トラップに大きめのワームを読み込みます。 - 必要な場合、複数のニューロンからの信号ビューのフィールドで同時に記録ニューロンが記録全体で少なくとも 10 ピクセルで区切られている限り。
- 慣れを調べるために、動物に実験を繰り返し実行します。
- トラップ チャネルからワームを削除します。
- それがその後の研究のワームを保つために必要な場合は、重力流と廃棄容器へチップのコンセントを外します。流路にトラップ チャネルを介して全体のワームが押されるまで、シリンジのプランジャーを軽く押します。
- チップ外の液滴に動物が表示されるまで、シリンジのプランジャーを押し続けます。ワームの口から PE チューブなど注射器を切断、しぶきのワームを吸引し、寒天プレート上にそれを転送します。
- ワームを維持する必要がない場合は流路; にトラップ チャネルを介して全体のワームを押すまで注射器のピストンを押すことによってワームを削除します。重力流と蠕動運動型ポンプのサクション チップと廃棄物コンテナーに動物を運びます。
4. 分析
- ダウンロードして最新のフィジー バージョン32をインストールします。
- ダウンロードして最新の java SDK バージョンをインストールします。
注: 必要に応じて、削除または新しくインストールした java コンパイラを使用してフィジーのフィジー フォルダー内の java フォルダーの名前を変更します。 -
フィジー ソフトウェアを開きます。
- ソフトウェアが開く、新しくインストールした java コンパイラを実行しているかどうかを確認 ' プラグイン |ユーティリティ |ImageJ |プロパティ '。
- Pokinganalyzer*.java ファイルのダウンロード (https://github.com/HFehlauer/Poking-Analyzer、補足のファイル 2を参照してください)。
- ドラッグ アンド .java ファイルをプラグインとしてそれを開くにはソフトウェアのウィンドウにドロップします。
-
コンパイルし、フィジー; で Ctrl キーを押しながら R キーを押すことで pokinganalyzer*.java ファイルを実行グラフィカル ユーザー インターフェイス (突っついアナライザー) (図 3) が表示されます。
- 「ヘルプ」タブをクリックしてし解析を実行するソフトウェアの要件についてください。開始するには、"Open video"タブ アナライザーのビデオ ファイルの場所を指定するを選択:「を開く、ビデオ」ボタンをクリックして、ビデオの場所に移動し、開きます。
注: このタブを開くとソフトウェアを開始します。開始するとき、それが開いていない場合、新しい分析は"Open video"タブをクリックします。ビデオは a.tif 形式では、プログラムが内部でビデオを開くし、インターフェイスの下部に最初のイメージを表示します。、イメージ ビデオを分析する必要があるのである場合は、別のビデオを開くには「動画を開く」ボタンをクリックしてします。 - 引き続き、「定義・ ロワ」タブをクリックしてします。このタブで、TRN の位置を定義します。GCaMP 蛍光を表示する必要があります表示イメージの上部にニューロンをクリックしてこのタブを「TRN の定義」ボタンをクリックの下の部分で開かれたビデオの最初のイメージが表示されることに注意してください。
- オプション: アクチュエータが画像の上半分に表示されている場合、プログラム自動的に追跡できます距離ニューロンとアクチュエータの間必要な場合。これは、「定義アクチュエータ?」を確認してください。-ボックス、「アクチュエータの定義」ボタンをクリックして、画像上半分にアクチュエータをクリックしますします。
- 画像の集録レートを定義する「分析」タブをクリックしてします。フィールドに数値を入力またはクリックしてまたは上下の数を増減するボタン。前のタブ「定義アクチュエータ?」の場合-ボックスをチェックすると、プログラムは、距離を計算することができますので、カメラ携帯サイズ、倍率、ビニング要因を定義します。
- 「解析開始」ボタンをクリックします。
注: プログラムが今を追跡するニューロン上半分にイメージ シーケンスでその蛍光 (カルシウム依存) と下半分 (独立したカルシウム) イメージ シーケンスの。番組の録画の平面でニューロンの動きを考慮して次の図のニューロンの位置を検索する前のイメージでニューロンの位置のまわりの 10 × 10 ピクセルの領域を調査します。それは背景の蛍光性 (Fbg) の修正 (F0) の最初の 50 の画像で蛍光で割ることによって両方の半分で蛍光を計算します。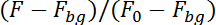
ニューロンによって引き起こされる緑、活動依存性チャネル (FCa2 +) の蛍光変化の記録は面外運動し、赤、活動非依存のチャネル (F で蛍光を使用して訂正コアー) とカルシウム依存の前刺激標準偏差 (sdCa2 +) によって独立した蛍光 (sdコアー)。
- プログラムは、インターフェイスの下部にあるステータス バーで、進行状況が表示されます。ステータス バーが 100% に達したら、「結果」タブをクリックしてします。ステータス バーは、100% の前に停止した場合、プログラムはプログラムは、ビデオを解析できなかった理由を示すエラー メッセージを与えます。
- プログラムが、ニューロンを識別できない信号対雑音比が低すぎる場合それ以降の録音で撮像パラメーターを調整します。
- ニューロンは、記録中にビューのフィールドを離れる場合、プログラムはもうそれを追跡できません、停止します。それに続く録音は、録音の冒頭にビューのフィールドの真ん中にニューロンを配置します。
- ビューのフィールドのいくつかの地域は、過飽和自動解析には無効な結果が生成されます。その後録音のため蛍光信号は、カメラのセンサーを飽和しない場合を確認します。
- '結果'] タブで、上部に結果が表示されます。「結果テーブルの保存」をクリックしてして結果テーブルのタブ区切りの *.txt ファイルを保存します。
注: このテーブルは秒と (カルシウム依存しない蛍光補正) 正規化されたカルシウム依存性蛍光の時間で構成されます。後、TRN と μ m の範囲のチャネルの壁に垂直のアクチュエータ間の距離の蛍光強度の代表の結果の増加や、TRN と μ m アクチュエータ間の合計距離を含まれています以前定義されている場合刺激と最も近いアクチュエータに細胞体の距離は、図 4にプロットされます。 - (以上 10 ピクセルで区切られた) 1 つの記録に複数のニューロンが含まれている場合「を定義・ ロワ」タブをもう一度クリック、2 番目のニューロンとステップ 4.6.2 に戻ります。
- 「ヘルプ」タブをクリックしてし解析を実行するソフトウェアの要件についてください。開始するには、"Open video"タブ アナライザーのビデオ ファイルの場所を指定するを選択:「を開く、ビデオ」ボタンをクリックして、ビデオの場所に移動し、開きます。
結果
SU 8 リソグラフィとチップ接合
リソグラフィ プロトコルと PDMS 成形標準的な手順に従います。詳細は23,24,25,26他の場所で見つけることができます。PDMS は硬化後問題なくウェーハをはがします必要があります。PDMS 剥離中に SU 8 機能をはぎ取る、SU 8 接着層?...
ディスカッション
このプロトコルは、マイクロ流体チップの中に閉じ込め回虫の皮膚に正確な機械的刺激を提供する方法を示します。それは生物的質問に答えるための物理的な刺激の統合を容易にするものです、メカノバイオロジー研究生物ラボでの効率化を目指します。このメソッドは、線虫の機械刺激受容ニューロンの機能を評価するために前の試金を拡張します。以前の定量的、半定量的な手法?...
開示事項
著者が明らかに何もありません。
謝辞
我々 はサンドラ N. Manosalvas-Kjono、プリム Ladpli に感謝、ファラー Memon、Divya Gopisetty、ヴェロニカ ・ サンチェスのサポート デバイス設計、変異動物の世代。この研究はサポートされている NIH 助成金 R01EB006745 (BLP)、(MBG) に R01NS092099、K99NS089942 (MK) に、(ALN) を F31NS100318、受信した欧州連合のホライゾン 2020年研究と技術革新の下で欧州研究会議 (ERC) からの資金調達のプログラム (付与契約号 715243 MK)。
資料
| Name | Company | Catalog Number | Comments |
| Chrome mask | Compugraphics (http://www.compugraphics-photomasks.com/) | 5'', designed in AutoCAD (Autodesk, Inc.) | |
| Chrome mask | Mitani-Micronics (http://www.mitani-micro.co.jp/en/) | 5'', designed in AutoCAD (Autodesk, Inc.) | |
| Chrome mask | Kuroda-Electric (http://www.kuroda-electric.eu/ | 5'', designed in AutoCAD (Autodesk, Inc.) | |
| 4'' Silicon wafer (B-test) | Stanford Nanofabrication Facility | ||
| SU-8 2002 | MicroChem | ||
| SU-8 2050 | MicroChem | ||
| Spin-coater | Laurell Technologies | WS-400BZ-6NPP/LITE | |
| Exposure timer | Optical Associates, Inc | OAI 150 | |
| Illumination controller | Optical Associates, Inc | 2105C2 | |
| SU-8 developer | MicroChem | ||
| 2-Propanol | Fisher Scientific | A426F-1GAL | |
| Acetone | Fisher Scientific | A18-4 | |
| Trichloromethylsilane (TCMS) | Sigma-Aldrich | 92361-500ML | Caution: TCMS is toxic and water-reactive |
| Sylgard 184 Elastomer Kit | Dow Corning | PDMS prepolymer | |
| Biopsy punch, 1 mm | VWR | 95039-090 | |
| Oxygen Plasma Asher | Branson/IPC | ||
| Small metal tubing (0.635 mm OD, 0.4318 mm ID, 12.7 mm long); gage size 23TW | New England Small Tube Corporation | NE-1300-01 | |
| Nalgene syringe filter, 0.22 μm | Thermo Scientific | 725-2520 | to filter all solution, small particles would clog the chip |
| Polyethylene tubing; 0.9652 mm OD, 0.5842 mm ID | Solomon Scientific | BPE-T50 | |
| Syringe, 1 ml | BD Scientific | 309628 | for worm trapping and release |
| Syringe, 20 ml | BD Scientific | 309661 | for gravity-based flow |
| Gilson Minipuls 3, Peristaltic pump | Gilson | to suck solutions and worms out of the chip | |
| Microfluidic flow controller, equipped with 0–800 kPa pressure channel | Elveflow | OB1 MK3 | pressure delivery |
| Water-Resistant Clear Poly- urethane Tubing, 4 mm ID and 6 mm OD | McMaster-Carr | 5195 T52 | connection from house air to pressure pump |
| Water-Resistant Clear Polyurethane Tubing, 2.6mm ID and 4mm OD | McMaster-Carr | 5195 T51 | connect pressure pump to small tubng |
| Push-to-Connect Tube Fitting for Air | McMaster-Carr | 5111K468 | metric - imperial converter |
| Straight Connector for 6 mm × 1/4″ Tube OD | McMaster-Carr | 5779 K258 | |
| Leica DMI 4000 B microscopy system | Leica | ||
| 63×/1.32 NA HCX PL APO oil objective | Leica | 506081 | |
| Hamamatsu Orca-Flash 4.0LT digital CMOS camera | Hamamatsu | C11440-42U | |
| Lumencor Spectra X light engine | Lumencor | With cyan and green/yellow light source | |
| Excitation beam splitter | Chroma | 59022bs | in the microscope |
| Hamamatsu W-view Gemini Image splitting optics | Hamamatsu | A12801-01 | to split green and red emission and project them on different areas on the camera chip |
| Emission beam splitter | Chroma | T570lpxr | in the image splitter |
| Emission filters GCamp6s | Chroma | ET525/50m | in the image splitter |
| Emission filters mCherry | Chroma | ET632/60m | in the image splitter |
参考文献
- Eastwood, A. L., et al. Tissue mechanics govern the rapidly adapting and symmetrical response to touch. Proc. Natl. Acad. Sci. 15 (50), E6955-E6963 (2015).
- Katta, S., Krieg, M., Goodman, M. B. Feeling Force: Physical and Physiological Principles Enabling Sensory Mechanotransduction. Annu. Rev. Cell Dev. Biol. 31, 347-371 (2015).
- Krieg, M., Dunn, A. R., Goodman, M. B. Mechanical systems biology of C. elegans touch sensation. BioEssays. 37 (3), 335-344 (2015).
- Krieg, M., Dunn, A. R., Goodman, M. B. Mechanical control of the sense of touch by β-spectrin. Nat. Cell Biol. 16 (3), 224-233 (2014).
- Krieg, M., et al. Tensile forces govern germ-layer organization in zebrafish. Nat Cell Biol. 10 (4), 429-436 (2008).
- Gaub, B. M., Müller, D. J. Mechanical stimulation of Piezo1 receptors depends on extracellular matrix proteins and directionality of force. Nano Lett. 17 (3), 2064-2072 (2017).
- Geffeney, S. L., et al. DEG/ENaC but not TRP channels are the major mechanoelectrical transduction channels in a c. Elegans nociceptor. Neuron. 71 (5), 845-857 (2011).
- O'Hagan, R., Chalfie, M., Goodman, M. B. The MEC-4 DEG/ENaC channel of Caenorhabditis elegans touch receptor neurons transduces mechanical signals. Nat. Neurosci. 8 (1), 43-50 (2005).
- Suzuki, H., et al. In Vivo Imaging of C. elegans Mechanosensory Neurons Demonstrates a Specific Role for the MEC-4 Channel in the Process of Gentle Touch Sensation. Neuron. 39 (6), 1005-1017 (2003).
- Kopito, R. B., Levine, E. Durable spatiotemporal surveillance of Caenorhabditis elegans response to environmental cues. Lab Chip. 14 (4), 764-770 (2014).
- Chokshi, T. V., Ben-Yakar, A., Chronis, N. CO2 and compressive immobilization of C. elegans on-chip. Lab Chip. 9 (1), 151 (2009).
- Hulme, S. E., Shevkoplyas, S. S., McGuigan, A. P., Apfeld, J., Fontana, W., Whitesides, G. M. Lifespan-on-a-chip: microfluidic chambers for performing lifelong observation of C. elegans. Lab Chip. 10 (5), 589-597 (2010).
- Li, S., Stone, H. a., Murphy, C. T. A microfluidic device and automatic counting system for the study of C. elegans reproductive aging. Lab Chip. 15 (2), 524-531 (2015).
- Chokshi, T. V., Bazopoulou, D., Chronis, N. An automated microfluidic platform for calcium imaging of chemosensory neurons in Caenorhabditis elegans. Lab Chip. 10 (20), 2758-2763 (2010).
- Mishra, B., et al. Using microfluidics chips for live imaging and study of injury responses in Drosophila larvae. J. Vis. Exp. , e50998 (2014).
- Chronis, N., Zimmer, M., Bargmann, C. I. Microfluidics for in vivo imaging of neuronal and behavioral activity in Caenorhabditis elegans. Nat. Methods. 4 (9), 727-731 (2007).
- Krajniak, J., Lu, H. Long-term high-resolution imaging and culture of C. elegans in chip-gel hybrid microfluidic device for developmental studies. Lab Chip. 10 (14), 1862-1868 (2010).
- Vasquez, V., Krieg, M., Lockhead, D., Goodman, M. B. Phospholipids that Contain Polyunsaturated Fatty Acids Enhance Neuronal Cell Mechanics and Touch Sensation. CellReports. 6 (1), 70-80 (2013).
- Krieg, M., et al. Genetic defects in β-spectrin and tau sensitize C. elegans axons to movement-induced damage via torque-tension coupling. Elife. 6 (2010), e20172 (2017).
- Arnadóttir, J., O'Hagan, R., Chen, Y., Goodman, M. B., Chalfie, M. The DEG/ENaC protein MEC-10 regulates the transduction channel complex in Caenorhabditis elegans touch receptor neurons. J. Neurosci. 31 (35), 12695-12704 (2011).
- Lockhead, D., et al. The tubulin repertoire of Caenorhabditis elegans sensory neurons and its context-dependent role in process outgrowth. Mol. Biol. Cell. 27 (23), 3717-3728 (2016).
- Goodman, M. B., Ernstrom, G. G., Chelur, D. S., O'hagan, R., Yao, C. A., Chalfie, M. MEC-2 regulates C. elegans DEG/ENaC channels needed for mechanosensation. Nature. 415 (6875), 1039-1042 (2002).
- Nekimken, A., Fehlauer, H., Kim, A., Goodman, M., Pruitt, B. L., Krieg, M. Pneumatic stimulation of C. elegans mechanoreceptor neurons in a microfluidic trap. Lab Chip. , (2017).
- Brower, K., White, A. K., Fordyce, P. M. Multi-step Variable Height Photolithography for Valved Multilayer Microfluidic Devices. J. Vis. Exp. (119), e55276 (2017).
- Jenkins, G. Rapid prototyping of PDMS devices using SU-8 lithography. Methods Mol. Biol. 949 (1), 153-168 (2013).
- Faustino, V., Catarino, S. O., Lima, R., Minas, G. Biomedical microfluidic devices by using low-cost fabrication techniques: A review. J. Biomech. 49 (11), 2280-2292 (2016).
- Xia, Y., Whitesides, G. M. SOFT LITHOGRAPHY. Annu. Rev. Mater. Sci. 28 (1), 153-184 (1998).
- Chen, T. -. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Cho, Y., Porto, D., Hwang, H., Grundy, L., Schafer, W. R., Lu, H. Automated and controlled mechanical stimulation and functional imaging in vivo in C. elegans. Lab Chip. , (2017).
- Edwards, S. L., et al. A novel molecular solution for ultraviolet light detection in Caenorhabditis elegans. PLoS Biol. 6 (8), 1715-1729 (2008).
- Porta-de-la-Riva, M., Fontrodona, L., Villanueva, A., Cerón, J. Basic Caenorhabditis elegans methods: synchronization and observation. J. Vis. Exp. (64), e4019 (2012).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat. Methods. 9 (7), 676-682 (2012).
- Cho, Y., Porto, D. A., Hwang, H., Grundy, L. J. High-Throughput Controlled Mechanical Stimulation and Functional Imaging In Vivo. BiorXiv. , (2017).
- Petzold, B. C., Park, S. -. J., Mazzochette, E. A., Goodman, M. B., Pruitt, B. L. MEMS-based force-clamp analysis of the role of body stiffness in C. elegans touch sensation. Integr. Biol. (Camb). 5 (6), 853-864 (2013).
- Nekimken, A. L., Mazzochette, E. A., Goodman, M. B., Pruitt, B. L. Forces applied during classical touch assays for Caenorhabditis elegans. PLoS One. 12 (5), e0178080 (2017).
- Chronis, N., Zimmer, M., Bargmann, C. I. Microfluidics for in vivo imaging of neuronal and behavioral activity in Caenorhabditis elegans. Nat. Methods. 4 (9), 727-731 (2007).
- Gilleland, C. L., Rohde, C. B., Zeng, F., Yanik, M. F. Microfluidic immobilization of physiologically active Caenorhabditis elegans. Nat. Protoc. 5 (12), 1888-1902 (2010).
- Chuang, H. -. S., Raizen, D. M., Lamb, A., Dabbish, N., Bau, H. H. Dielectrophoresis of Caenorhabditis elegans. Lab Chip. 11 (4), 599 (2011).
- Christensen, A. M., Chang-Yen, D. A., Gale, B. K. Characterization of interconnects used in PDMS microfluidic systems. J. Micromechanics Microengineering. 15 (5), 928-934 (2005).
- Gilpin, W., Uppaluri, S., Brangwynne, C. P. Worms under Pressure: Bulk Mechanical Properties of C. elegans Are Independent of the Cuticle. Biophys. J. 108 (8), 1887-1898 (2015).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved