A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
שימוש בהתקן מיקרופלואידיקה גירוי מכני, רזולוציה גבוהה הדמיה של C. elegans
* These authors contributed equally
In This Article
Summary
כלים חדשים למחקר mechanobiology יש צורך להבין כיצד מכאניים מפעילה מסלולים ביוכימיים, מעורר תגובות ביולוגיות. כאן, אנחנו ראווה שיטה חדשה עבור סלקטיבית גירוי מכני של חיות קיבוע עם מלכודת microfluidic ומאפשר הדמיה ברזולוציה גבוהה של תגובות הסלולר.
Abstract
מטרה מרכזית אחת של mechanobiology הוא להבין את השפעת הגומלין לחץ מכני על חלבונים ותאים. למרות חשיבותו, השפעת לחץ מכני על תפקוד התאים עדיין ממעטים להבין. בחלקו, הפער בידע קיים בגלל כמה כלים להפעיל בו זמנית דפורמציה של רקמות ותאים, הדמיה של פעילות תאית בבעלי חיים, הגבלת יעיל של תנועתיות אורגניזמים דגם אחרת מאד ניידים, כגון תולעים נימיות Caenorhabditis elegans. גודל קטן של C. elegans גורם להם קשר מצויין למכשירים מבוססי מיקרופלואידיקה מחקר, פתרונות עבור קיבעון הוצגו באמצעות מכשירי microfluidic. אף על פי התקנים אלה לאפשר הדמיה ברזולוציה גבוהה, החיה הוא מלא עטוף polydimethylsiloxane (PDMS) וזכוכית, הגבלת גישה פיזית למשלוח בכוח מכני או הקלטות אלקטרופיזיולוגיות. לאחרונה, יצרנו מכשיר המשלב גלילי עם עיצוב השמנה התואמת למיקרוסקופיה פלורסצנטיות ברזולוציה גבוהה. הערוץ הופעה מופרדת מן התעלה תולעת-השמנה באמצעות בדיאפרגמה PDMS דק. הסרעפת הוא הסיט לתוך הצד של תולעת על ידי הפעלת לחץ ממקור חיצוני. המכשיר ניתן לייעד נוירונים בודדים mechanosensitive. ההפעלה של הנוירונים הללו הוא עם תמונה ברזולוציה גבוהה עם מחוון בקידוד גנטית סידן. מאמר זה מציג את השיטה הכללית באמצעות C. elegans זנים לבטא מחוון הפעילות רגיש סידן (GCaMP6s) בנוירונים קולטן שלהם מגע (TRNs). השיטה, אולם אינה מוגבלת TRNs או חיישנים סידן כמו החללית, אלא ניתן להרחיב אחרים תאים רגישים מכנית או חיישנים.
Introduction
חוש המגע מספקת חיות עם מידע חיוני על הסביבה שלהם. בהתאם הכוח יישומית, מגע נתפשת גם לא מזיק, מענג או כואב. להרכב רקמות במהלך המגע הוא זוהה על ידי תאים מיוחדים mechanoreceptor מוטבע בתוך העור המבטאים קולטן חלבונים, לרוב תעלות יונים. השלבים קישור תפיסה כוח יון הפעלת הערוץ במהלך מגע וכאב אינם מובנים במלואם. אפילו פחות ידוע על מה רקמות העור מסננים דפורמציה מכאנית, אם mechanoreceptors לזהות שינויים זן או להדגיש1,2,3. פער זה בהבנה נובע, בין השאר, חוסר הכלים המתאימים כדי להחיל stimulations מכניים מדויקים על פני השטח של העור של חיים תוך התבוננות התגובות ברמה התאית. ואילו מיקרוסקופ כוח אטומי נעשה שימוש נרחב כדי להחיל ולמדוד את כוחות תאים מבודדים4,5 , גם כדי להפעיל את קולטני Piezo1 חי תאים6, ניסויים דומים באמצעות בעלי חיים, במיוחד C. elegans, היו לשמצה מאתגר עקב ניידות פנימית של הנושא. אתגר זה הוא מצויין באופן מסורתי באמצעות דבק cyanoacrylate וטרינרית או כירורגי-כיתה על מנת לשתק חיות בודדות על אגר רפידות1,7,8,9. גישה זו כבר פרודוקטיבי, אבל יש מגבלות הקשורות את המיומנות הדרושה הנייח על ידי הדבקת פני השטח אגר רך על ציות מכני. אסטרטגיה מיקרופלואידיקה הוא חלופה ללא תשלום זה מונע כמה סיבוכים הקשורים הדבקה.
תולעים נימיות C. elegans הוא אורגניזם מודל גנטי עם מערכת העצבים לחלוטין ממופה, בשל הגודל של החיה, היא מתאימה לטכנולוגיה מיקרופלואידיקה. מכשירים מבוססי מיקרופלואידיקה ההצעה יתרון כי החיות אחרת מאד ניידים יכול לרסנם בעת ביצוע הדמיה ברזולוציה גבוהה ואספקה של גירויים נוירו-modulatory רלוונטיים. עם העזרה של microfluidic טכנולוגיות, חיים בעלי חיים יכול להיות משותק ללא נזק10,11, המאפשר ניטור פעילות התנהגותית מעל12,שלמים13 ברזולוציה גבוהה הדמיה של פעילות. עצבית14,15,16,17. יתר על כן, נוירונים mechanoreceptor רבים הדרושים לצורך ניתן לאפיין את תחושת מגע וכאב שלהם פיזיולוגית1,8, מכני4,18,19, ומולקולרית ברמה20,21,22.
C. elegans החושים גירויים מכני עדין לקיר הגוף שלה באמצעות TRNs שש, שלוש מהן innervate של החיה הקדמי (ALML/R ו- AVM), מתוכם 3 innervate אחוריים של החיה (PLML/R ו PVM). מולקולות ערוץ יון הדרושים transducing כוח יישומית לתוך אות הביוכימי נחקרו בהרחבה ב- TRNs8. מאמר זה מציג על פלטפורמה microfluidic23 המאפשרת לחוקרים להחלת כוחות מכניים מדויקים על העור של קיבוע C. elegans העגולה, תוך כדי קריאת החוצה את דפורמציה של רקמות פנימיות שלה על ידי הדמיה אופטית. בנוסף מציג גירויים מכניים מוגדרים היטב, סידן שנחשולי יכול להיות מוקלט בנוירונים mechanoreceptor עם רזולוציה subcellular, בקורלציה עם תכונות מורפולוגיים האנטומי. המכשיר מורכב ערוץ השמנה מרכזית מחזיק חיה יחידה ומציג את עורה ליד שישה ערוצים הופעה פנאומטיים (איור 1 ואיור 2). שישה ערוצים ממוקמות לאורך הערוץ השמנה לספק גירויים מכניים לכל אחד TRNs 6 של התולעת. ערוצים אלה מופרדים מן החדר השמנה באמצעות דיאפרגמות PDMS דק, אשר יכול להיות מונע על ידי מקור לחץ אוויר חיצוני (איור 1). מכויל על סטיה ביחס ללחץ ואנו מספקים את המידות במאמר זה. כל מפעיל יכול להיות התייחס בנפרד, להשתמש בו כדי לעורר את mechanoreceptor של בחירה. הלחץ מועבר באמצעות משאבה ללחץ מונחה piezo אך ניתן להשתמש בכל מכשיר חלופי. אנחנו מראים כי פרוטוקול לחץ יכול לשמש כדי להפעיל TRNs ויוו ומדגימים התקני הפעלה מתאים אספקת גירויים מכניים למבוגרים C. elegans, טעינת למבוגרים בעלי חיים לתוך מכשירים, ביצוע הדמיית סידן ניסויים, וניתוח התוצאות. ייצור המכשיר מורכבת משני שלבים עיקריים: 1) פוטוליתוגרפיה לעשות תבנית מ סו-8; ו- 2) צורניים PDMS כדי להפוך התקן. למען תמציתיות ובהירות, הקוראים נקראים שפורסמו בעבר מאמרים ופרוטוקולים24,25 להוראות כיצד לייצר את תבניות וההתקנים.
Protocol
1. התקן פבריקציה נוספת
- הורד את הקובץ המצורף מסכת (1 קובץ משלים) וצור מסכה כרום באמצעות שירות מסחרי או מתקן ללא צורך במיקור חוץ. כמו בממד הקטן ביותר על המכשיר הוא 10 מיקרומטר (עובי ממברנה בוכנה), לוודא המסכה יש רזולוציה גבוהה מספיק, בתוך ± 0.25 מיקרומטר, לייצר בצורה אמינה את התכונות.
-
בצע בשיטות הרגילות של פוטוליתוגרפיה SU-8 (למשלהפניות24,25,26) ליצור את התבנית לייצור עוקבות של PDMS התקנים; סיכום של הפעולות המצוינות להלן.
הערה: SU-8 הוא חומר לאור, אשר crosslinks בעת חשיפה לאור אולטרה סגול (ספיגה מירבית ~ 365 ננומטר). השתמש בהוראות היצרן כנקודת התחלה לקבוע את הפרמטרים עיבוד עבור הרך-אופים, חשיפה (UV), ולאפות פוסט.- להפקיד 2002 SU-8 על גבי פרוסות סיליקון והמעיל ספין משוער עובי 2 מיקרומטר, הדבקה טובה יותר של מבנים קטנים. רך-אופים על פלטה חמה עבור 1 דקות ב 95 מעלות צלזיוס, מעט יתר על המידה לחשוף (UV) כל השטח (~ mJ/ס מ 1002), ואופים פוסט על פלטה חמה למשך 2 דקות ב 95 ° C.
- ספין-המעיל 47-מיקרומטר בשכבה עבה של סו-8 2050 להגדרת התכונות המכשיר. השתמש מהירות סיבוב של 500 סל ד 15 s (התאוצה סל"ד/s 130), אז 2,000 סל ד עבור 90 s (260 סל"ד/s התאוצה). במידת הצורך, חזור על ולהתאים את המהירות ספין כדי לקבל את העובי המתאים של photoresist.
- רך-אופים על פלטה חמה למשך 2 דקות ב 65 ° C, ולאחר מכן במשך 7 דקות-95 מעלות צלזיוס. לחשוף את photoresist בהתאם להוראות היצרן (~ mJ/cm 1602) באמצעות מסנן מסיכת ומעביר ארוך כרום כדי להבטיח והקירות הצדדיים ישר.
- להסיר את פרוסת סיליקון ואופים פוסט על פלטה חמה 1 דקות ב- 65 מעלות צלזיוס, ולכל 7 דקות-95 מעלות צלזיוס.
- להמיס סמויה SU-8 עם מפתח, ולנקות עם 2-פרופנול.
- אופים את לחם הקודש על גזייה ב 180 מעלות צלזיוס למשך 30 דקות (קשה לאפות) לייצב את תכונות photoresist.
-
להכין עותק משוכפל PDMS מהמודל SU-8 באמצעות עותק משוכפל רגיל שהמודעות שיטות27.
- פנקו את התבנית SU-8 עם אדי trichloromethylsilane (TCMS) כדי להפחית אדהזיה PDMS (silanization).
התראה: TCMS הוא רעיל, מים-ריאקטיבי.- מניחים את פרוסת סיליקון בדוגמת במעמד וופל בתוך desiccator ואקום בל-ג'אר בשכונה fume ללא מים או ריאגנטים מסיסים במים.
- מתחת למכסה המנוע, להשתמש טפטפת כדי להחיל טיפה 1 של TCMS על צלחת זכוכית ומניחים בפנים desiccator.
- סגור את המכסה desiccator ולאפשר TCMS אדי להרגיע את לחם הקודש לפחות 20 דקות.
- וונט ולאחר מכן פתח את desiccator. פתח את מכסה הצנצנת בל ולהסיר את לחם הקודש באמצעות פינצטה פלסטיק. להכניס בתוך סירה רדיד פטרי או אלומיניום עבור לכייר משוכפל PDMS. תשליך של חומרים מצופים TCMS פסולת מסוכנת נאותה.
- PDMS מיקס (היחס בין 10:1) באמצעות 40 g של בסיס פולימר ו- 4g PDMS ריפוי סוכן.
- שופכים את התערובת מעל כייר SU-8, דגה את התערובת במשך לפחות 30 דקות בתוך תא ואקום.
- התרופה לפחות 6-אייץ '-70 מעלות צלזיוס בתנור.
- פנקו את התבנית SU-8 עם אדי trichloromethylsilane (TCMS) כדי להפחית אדהזיה PDMS (silanization).
- הרם PDMS לחם הקודש על-ידי הגדרת כשהפחד אופקי על משטח שטוח בקפידה מתקלפת את PDMS. לא לכופף את לחם הקודש כלפי מעלה במהלך שלב זה, כמו זה יכול לשבור את התבנית.
הערה: אדהזיה לא שלם של סו-8 פרוסות או לא שלמים silanization יכול לגרום הרס המבנים SU-8 במהלך שלב זה. - חותכים PDMS סביב המכשירים שבבי בודדים כך יתאימו המכשירים coverslip 24 מ"מ x 60 מ"מ.
- באמצעות אגרוף ביופסיה 1 מ מ, לחורר לים, שני שקעים, שישה מפעילים בעזרת אגרוף ביופסיה 1 מ מ. המטרה עבור החוגים מ מ בקוטר 2 בקצוות של המכשיר.
-
PDMS בונד השבבים זכוכית שער גולשת.
- לחשוף את שני המשטחים כדי פלזמה חמצן W 80 (30 s).
- הנח בעדינות את השטח PDMS חשופות על גבי משטח החשוף של תגית כיסוי עבור גושפנקה קונפורמיים.
- Anneal את המכשיר על פלטה חמה (100 ° C, 10 דקות).
הערה: מליטה לא מספיקות יכול להוביל לכשל של המכשיר עקב דליפה.
2. הכנת המיקרוסקופ
הערה: חיות הטרנסגניים: אקספרס מחוון סידן כגון GCaMP6s28 או אחרים המכשיר פעילות גנטית מקודד neuron(s) של עניין (למשל, TRN); שיתוף מבטאים חלבון פלואורסצנטי פעילות עצמאית פולטות-אורך גל שונה לתיקון צדדי קטן וחפצים out-of-להתמקד תנועה המתעוררות עקב גירוי מכני. ניתוח אוטומטיות התוכנה עוקבת אחר, מפצה על תנועה-induced שינויים בעוצמת המכשיר פעילות. התולעת זנים GN69223 (או AQ323629) אקספרס GCaMP6s (או GCaMP6m), את tagRFP ללא תלות סידן תחת השליטה של promotor mec-7. בנוסף, GN692 מכיל את המוטציה lite-1(ce314), אשר מונעת הפעלה של TRNs עקב חיישן אור כחול לייט-130 במהלך עירור של זריחה GCaMP6s23.
-
הגדרת מערכת של מיקרוסקופ עירור סימולטני של GCaMP ו- RFP.
- השתמש מקור אור רציף או פס כפול עירור מסנן מעביר אור רק ציאן וצהוב או השתמש מקור אור הפולטת בלבד אורכי הגל פס מוגדרים כגון ציאן סימולטני (0.77 mW) וצהוב (1.21 mW) מקורות עירור LED עירור סימולטני של זריחה סידן תלוית ועצמאית, בהתאמה.
- השתמש במצלמה דיגיטלית כדי לאפשר הקלטה של תמונות מיקרוסקופ.
הערה: רוב המצלמות באים עם תוכנה עבור רכישת התמונה. לחלופין, יש תוכנה זמינה בחופשיות יכול לשמש כדי לשלוט המצלמה ואפשרות גם חלקים אחרים של המערכת מיקרוסקופ. - התאם עירור העוצמה בהתבסס על עוצמת קרינה פלואורסצנטית להימנע המצלמה רוויה.
-
השתמש קוביה פלורסצנטיות בהתאם הבחירה של המקור עירור צריך להיות מצויד במסנן עירור.
הערה: 488 ננומטר GFP, 580-nm mCherry מסנן עירור שימש כאן.- להוסיף במפצל קרן הקוביה על המשקף האור ציאן וצהוב והעברת אור ירוק ואדום.
- לצייד את המיקרוסקופ עם 10 X אובייקטיבית, מטרה גבוהה ההגדלה (למשל, 63 X / 1.32 נה שמן) למקד את עירור אור על המדגם.
- הר במפצל קרן לפני המצלמה, הקלטה בו זמנית של GCaMP ואת האות ללא תלות סידן. להבטיח כי המפצל קרן יש מראה ודיקרואיק זוהר (זמן יעבור, ניתוק-570 ננומטר) כדי להפריד בין אור ירוק ואדום באמצעות מסנן פליטה אחד עבור ירוק (passband מרוכז בכל 525 nm עם 50 ננומטר רוחב) ואת מסנן פליטה אחת עבור אור אדום (passband מרוכז בכל 632 nm עם 60 ננומטר רוחב).
- פרויקט ירוק ואדום זריחה על החצי העליון (ירוק), החלק התחתון (אדום), בהתאמה של המצלמה צ'יפ (ראה איור 3). נטייה זו היא תנאי הכרחי עבור תוכנת ניתוח שסופקו.
3. בעלי חיים הכנה
- להכין גיל-מסונכרנות צעירים למבוגרים למבוגרים יום אחד או C. elegans, כפי שתואר קודם לכן על ידי פורטה-de-la-Riva. et al. 31
- הכינו את השבב microfluidic.
- להתחבר למאגר זרימת הכבידה (~ 60 ס מ מעל פני צ'יפ) המכיל מסוננים (0.2-מיקרומטר polyethersulfone מזרק מסנן) מאגר M9 שקע אחד של השבב. להתחבר לשקע אחר שקע אחד של מיכל פסולת שני-outlet, קרי, בקבוקון מסנן. להתחבר לשקע אחרים של הגורם המכיל פסולת משאבה סחרור.
הערה: השתמש צינורות פוליאתילן (PE) עבור כל החיבורים והשתמש צינור מתכת אביזרי להתחבר לצנרת PE את השבב. בדרך זו כל הפתרונות פסולת לרוקן השבב, שליקט את פח אשפה. הזרם דרך הערוצים עודפים יוצר יניקה עדינה שישאיר את התולעת צמוד במהלך תהליך ההשמנה מאוחר יותר. - הכנת חיבורי בהיקף של 50-מ מ ארוך PE צינורות (OD 0.9652 מ מ, 0.5842 מ מ ID) עם צינורות מתכת (מד גודל 23TW, 0.635 מ מ OD) בשני הקצוות. הקש להתאמה אלה מהירים בכל אחת שש אצבעות הופעה, לתוך הים תולעת (ראה איור 1). השאירו את interconnectors האלה השבב, כמו הסרת חוזרות מוביל ללבוש על החורים PDMS.
- להתחבר למאגר זרימת הכבידה (~ 60 ס מ מעל פני צ'יפ) המכיל מסוננים (0.2-מיקרומטר polyethersulfone מזרק מסנן) מאגר M9 שקע אחד של השבב. להתחבר לשקע אחר שקע אחד של מיכל פסולת שני-outlet, קרי, בקבוקון מסנן. להתחבר לשקע אחרים של הגורם המכיל פסולת משאבה סחרור.
- מניחים את השבב על המיקרוסקופ. פיק תולעים 2 – 5 לתוך טיפת מסונן מאגר M9 (0.2-מיקרומטר מזרק מסנן) ולהשתמש מזרק 1-mL למשוך אותם לתוך PE צינורות (OD 0.9652 מ מ, 0.5842 מ מ ID) מחובר מזרק 1-mL על ידי משיכת הבוכנה בעדינות. לשמור את בעלי החיים בצינור PE לא במזרק.
הערה: מדי תולעים או פתרונות לא מסונן בשבב יכול להוביל סתימת. - לחבר את צינורות PE של המזרק interconnect-הים תולעת (איור 1 ו- 2 איור) של השבב. להפעיל את זרימת הכבידה על-ידי פתיחת המסתם ולהתחיל את משאבת סחרור. לאחר מכן לחץ בעדינות על הבוכנה מזרק של המזרק כדי להעביר את החיות לתוך הערוץ השמנה תוך התבוננות על הערוץ תחת מיקרוסקופ עם עדשה X 10 במצב brightfield.
הערה: לעתים להופיע בועות אוויר אינם מהווים בעיה; הם מועברים בדרך כלל באופן אוטומטי לשקע. מספר בעלי חיים יכול להיות 'חנית' בחדר ההמתנה ומשמשת ברצף.- לאחר טעינת החיה לתוך התעלה השמנה (ראה גם באיור 2), להתאים את מיקומו על-ידי בעדינות לדחוף או למשוך את הבוכנה של המזרק כדי למקם את הראש של החיה בצורת מחודדות בחזית התעלה.
- ודא התולעת (למבוגרים יום 1) בגודל הנכון להיות לכוד בתוך השבב.
- אם התולעת אינה ממלאת את כל חתך הרוחב של הערוץ של האף עד סמוך לסוף של הגוף (לא כולל את קצה הזנב) או התולעת נע על הציר של הערוץ מבלי להזיז את הבוכנה של המזרק , להסיר את התולעת על-ידי הקשה על הבוכנה של המזרק עד שהוא נעלם מן התעלה השמנה ולטעון אחד חדש (ראה שלב 3.8).
- לעבור למצב זריחה של המיקרוסקופ, עדשת הגדלה גבוהה יותר (40 X ומעלה) ולבדוק אם neurite של נוירון עניין מגיע לשקר מעבר הסרעפת של אחד מפעילים. אם לא, לכוונן את המיקום של החיה על ידי משיכה או דחיפה הבוכנה. אם זה לא עוזר, להסיר את התולעת, טען אחד חדש.
- מתמקדים בגוף התא של נוירון עניין וחבר את interconnect במפעיל הקרוב הנוירון על הצד הקדמי של הגוף תאים משאבה ללחץ לתכנות באמצעות צינורות PE.
- אם הניסוי מחייב מדידת המרחק בין במפעיל הנוירון, להעביר את שדה הראיה כך שניהם בתוך שדה הראייה, channelwall, הוא מקביל הקצה העליון והתחתון של התמונה.
- הגדרת פרוטוקול לחץ באמצעות המשאבה לחץ ניתן לתיכנות.
הערה: פרוטוקול זה ניתן לכוונן את הניסוי הרצוי.- להתחיל עם לחץ מתמיד של 0 kPa לזמן המתאים לפחות 50 תמונות של רצף תמונות (הכרחי עבור נרמול). עבור שיעור הדמיה של 10 הרץ זה מקביל 5 ס הוסף צורת גל הגירוי הרצוי ולחץ, להגדיר את האורך של הגירוי כמו שלב שני.
הערה: מעורר את TRNs, גל sinusoidal (קרי, 75 kPa, 10 הרץ) נקודות המגע המוצגים בצעד (קרי, 275 kPa) מומלץ כפי שהיא מייצרת לתגובה העצבית גדולים. - אם הניסוי דורש גירויים נוספים, לכלול תקופה של פחות 10 s, בלחץ מתמיד של kPa 0 בין גירויים. לפני החלפת את משאבת לחץ, ודא הלחץ בכלי ב kPa 0 קבוע כדי למנוע גירוי מקרית של התולעת לפני הניסוי בפועל.
- להתחיל עם לחץ מתמיד של 0 kPa לזמן המתאים לפחות 50 תמונות של רצף תמונות (הכרחי עבור נרמול). עבור שיעור הדמיה של 10 הרץ זה מקביל 5 ס הוסף צורת גל הגירוי הרצוי ולחץ, להגדיר את האורך של הגירוי כמו שלב שני.
- להפעיל את פרוטוקול הדמיה ובלחץ.
- בתוכנה רכישת התמונה של המצלמה, להגדיר את רצף תמונות ב-10 הרץ באמצעות מועד החשיפה של 100 ms עבור משך הזמן של פרוטוקול לחץ. התאם את עוצמת עירור כזה כי העלייה פלורסצנטיות מקסימלי לא להרוות את המצלמה. שמור את התמונות כקובץ *.tif עם תמונות לפחות 50 לפני הגירוי הראשון עבור נרמול.
- להתחיל פרוטוקול הדמיה התוכנה רכישת התמונה של פרוטוקול לחץ בתוכנה של המשאבה לתכנות. במהלך ההקלטה, לבחון אם הנוירון עניין הנקודה הבהירה ביותר באזור של 10 x 10 פיקסלים, לא זזה רחוק יותר מאשר 10 פיקסלים רציפים בתמונות, ונשאר בתוך שדה הראייה במהלך ההקלטה.
הערה: אם לא יעשה כן, התוכנה ניתוח ייכשל. כתמים בהירים (קרי: autofluorescence) סביב הנוירון לבצע הקלטות של הנוירונים קשה לנקות. כדי לתקן זאת, הסר את התולעת המלכודת וטען תולעת חדש לתוך השבב. אם התולעת זז יותר מדי, נסה הקלטה חדשה של התולעת זהה ולבחון את התנועה תולעת. אם הבעיה נמשכת התולעת עשויות להיות קטנות מדי להיות לכוד. במקרה זה להסיר את תולעת זו וטען תולעת מעט יותר גדול למלכודת. - אם רצונך בכך, הרשומה אותות מרובים נוירונים בתוך שדה הראייה בו-זמנית כל עוד הנוירונים מופרדות לפחות 10 פיקסלים במהלך כולו.
- לחקור habituation, לבצע את הניסוי שוב ושוב על חיים.
- הסר את התולעת בערוץ השמנה.
- אם זה רצוי לשמור את התולעת על מחקרים מאוחרים יותר, נתק את השקעים של השבב לכיוון זרימת הכבידה של פח אשפה. הקש על הבוכנה של המזרק בעדינות עד התולעת כולו נדחף דרך ערוץ השמנה לתוך ערוץ הזרימה.
- המשך להקיש על הבוכנה המזרק עד החיה מופיע droplet בחוץ השבב. נתק את המזרק כולל את צינורות PE מן הים תולעת, להשתמש בו כדי וארוקן את התולעים ה-droplet ולהעביר אותה אל צלחת אגר.
- אם זה אינו רצוי לשמור את התולעת, להסיר את התולעת על ידי לחיצה על הבוכנה של המזרק עד התולעת כולו נדחף דרך ערוץ השמנה לתוך תעלת זרימה; את זרימת הכבידה, היניקה של המשאבה ממברנות ויישא החיה מחוץ לשבב ולתוך המיכל פסולת.
4. ניתוח
- הורד והתקן את הגירסה החדשה פיג'י32.
- הורד והתקן את הגירסה החדשה ביותר של SDK java.
הערה: אם יש צורך, למחוק או לשנות שם התיקיה java בתוך תיקיית פיג'י פיג'י להשתמש המהדר java חדשה שהותקנה. -
פתח את תוכנת פיג'י.
- בדוק אם התוכנה פועלת המהדר java חדשה שהותקנה על-ידי פתיחת ' תוספים | עזרי | ImageJ | נכסים.
- הורד את הקובץ pokinganalyzer*.java (https://github.com/HFehlauer/Poking-Analyzer, לראות את 2 הקבצים המשלימים).
- גרור ושחרר את הקובץ .java לתוך חלון התוכנה כדי לפתוח אותו בתור תוסף.
-
בצע הידור והפעלת את הקובץ pokinganalyzer*.java על-ידי לחיצה על מקשי Ctrl + R בפיג'י; ממשק משתמש גרפי (מנתח מציץ) יפתח (איור 3).
- לחץ על הכרטיסייה "עזרה" ולקרוא על הדרישות של התוכנה, כיצד לבצע את הניתוח. כדי להתחיל, בחר את הכרטיסיה "וידאו פתוח" ציין מיקום קובץ וידאו במנתח: לחץ על לחצן "לפתוח וידאו", נווט אל המיקום של הווידאו ולפתוח אותה.
הערה: התוכנה מתחילה עם כרטיסיה זו נפתח. אם זה לא פתוח בעת הפעלת ניתוח חדש לחץ על הכרטיסייה "וידאו פתוח". אם הווידאו בפורמט a.tif, התוכנית פנימי לפתוח את הסרטון ולהציג את התמונה הראשונה בחלק התחתון של הממשק. אם התמונה אינה של וידאו צריך להיות מנותח, לחץ על לחצן "לפתוח את סרטון" כדי לפתוח עוד וידאו. - כדי להמשיך, לחץ על הכרטיסייה "ROIs להגדיר". בכרטיסיה זו, הגדר את המיקום של TRN. שימו לב כי התמונה הראשונה של הוידאו נפתח מוצגת בחלק התחתון של זה tab. לחץ על כפתור "TRN להגדיר" ולחץ על הנוירון בחלק העליון של התמונה המוצגת אשר אמורה להציג את זריחה GCaMP.
- אופציונלי: אם במפעיל מוצגת בחצי העליון של התמונה התוכנית באופן אוטומטי לאתר את המרחק בין הנוירון במפעיל במידת הצורך. עבור בדיקה זו, "קבע במפעיל?" -בתיבה, לחץ על כפתור "למפעיל להגדיר" ולחץ במפעיל בחצי העליון של התמונה.
- לחץ על הכרטיסיה "ניתוח" הגדר קצב רכישת התמונה. הזן מספר בשדה או לחץ על החץ למעלה או למטה כדי להגדיל או להקטין את המספר. אם הכרטיסיה הקודמת "קבע במפעיל?" -תיבה מסומנת, להגדיר גודל התא המצלמה ההגדלה, הגורם binning, אז התוכנית ניתן לחשב את המרחק.
- לחץ על לחצן "התחל ניתוח".
הערה: התוכנית עכשיו לאתר הנוירון מאת שלה פלורסצנטיות ברצף התמונה בחצי העליון (תלוי סידן), בחלק התחתון (סידן עצמאית) של רצף תמונות. לקחת בחשבון נוירון תנועה במישור של הקלטת התוכנית יחקרו על שטח של 10 x 10 פיקסלים מסביב המיקום של הנוירון בתמונה הקודמת כדי למצוא את המיקום של הנוירון בתמונה הבאה. זה יחשב את פלורסצנטיות בשני חצאים על ידי תיקון עבור קרינה פלואורסצנטית הרקע (Fbg) חלוקה זריחה של תמונות ראשון 50 (F0):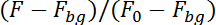
קרינה פלואורסצנטית לשינויים בערוץ ירוק, תלויי-פעילות (FCa2 +) הנגרמות על-ידי נוירון תנועה מהמטוס של הם recoding ולאחר מכן תוקנו באמצעות קרינה פלואורסצנטית בערוץ אדום, פעילות עצמאית (נ קור), גירוי מקדים סטיית התקן של הסידן תלוית (sdCa2 +), עצמאית קרינה פלואורסצנטית (sdקור) מאת:
- התוכנית תציג את התקדמותו בשורת המצב בחלק התחתון של הממשק; שורת המצב מגיע ל 100%, לחץ על הכרטיסייה "תוצאות". אם שורת המצב נפסק לפני 100%, התוכנית ייתן הודעת שגיאה המציינת את הסיבה שהתוכנית לא יכול לנתח את הוידאו.
- אם האות ליחס רעש נמוכה מדי, התוכנית לא יכולה לזהות הנוירון; כוונן את הפרמטרים הדמיה בהקלטות עוקבות.
- אם הנוירון עוזב את שדה הראיה במהלך ההקלטה, התוכנית לא יכולים לאתר אותם יותר, יעצור. להקלטות עוקבות, מקם הנוירון באמצע שדה הראייה בתחילת הקלטת.
- אם באזורים מסוימים של שדה הראייה הם רווי, ניתוח אוטומטיות יפיקו תוצאות לא חוקי. להקלטות הבאים, ודא שהאות פלורסצנטיות לא להרוות את חיישן המצלמה.
- בכרטיסיה 'תוצאות', התוצאה מוצגת בחלק העליון. שמירת קובץ המופרד *. txt של טבלת התוצאה על ידי לחיצה על "שמירת תוצאה שולחן".
הערה: בטבלה זו מורכבת הזמן שניות ו סידן תלוית מנורמל קרינה פלואורסצנטית (תורגם על-ידי קרינה פלואורסצנטית סידן ללא תלות). אם בעבר מוגדר, הוא מכיל גם את המרחק הכולל בין את TRN במפעיל ב מיקרומטר ולהגדיל את המרחק בין את TRN במפעיל בניצב לקיר ערוץ מיקרומטר התוצאות נציג של עוצמת קרינה פלואורסצנטית לאחר גירוי לעומת המרחק של גוף התא כדי במפעיל הקרוב מותוות באיור4. - אם ישנם נוירונים מרובים בהקלטה אחת (מופרדים על ידי יותר מ 10 פיקסלים), לחץ על הכרטיסייה "ROIs להגדיר" שוב ולחזור לשלב 4.6.2 עם הנוירון השני.
- לחץ על הכרטיסייה "עזרה" ולקרוא על הדרישות של התוכנה, כיצד לבצע את הניתוח. כדי להתחיל, בחר את הכרטיסיה "וידאו פתוח" ציין מיקום קובץ וידאו במנתח: לחץ על לחצן "לפתוח וידאו", נווט אל המיקום של הווידאו ולפתוח אותה.
תוצאות
SU-8 ליתוגרפיה, שבב מליטה
ליתוגרפיה הפרוטוקול לבין דפוס PDMS בצע הליכים סטנדרטיים. פרטים ניתן למצוא במקומות אחרים23,24,25,26. PDMS צריך לקלף את וופל ללא בעיות לאחר ריפוי. אם התכונות SU-8 תעתיקו במהלך PDMS ?...
Discussion
פרוטוקול זה מדגים שיטה להעברת גירוי מכני מדויק על העור של התולעת העגולה לכוד בתוך שבב microfluidic. הוא נועד להקל על קליטת גירויים הפיזי למענה על שאלות ביולוגיות, שמטרתו לייעל את mechanobiology מחקר במעבדות ביולוגיות. שיטה זו מרחיבה מבחני הקודם כדי להעריך את הפונקציה של נוירונים mechanosensory C. elegans. טכ?...
Disclosures
המחברים אין לחשוף.
Acknowledgements
אנו מודים סנדרה ש Manosalvas-Kjono, פורים Ladpli, פארה ממון, דיוויה Gopisetty וורוניקה סנצ'ז עבור תמיכה עיצוב המכשיר, דור של חיות. מחקר זה נתמך על ידי NIH מענקים R01EB006745 (קרית אתא), R01NS092099 (כדי מדיניות החזרה), K99NS089942 (כדי ח"כ), F31NS100318 (כדי ALN) ומימון שהתקבלה מ אירופה מחקר המועצה (ERC) תחת אופק 2020 מחקר וחדשנות של האיחוד האירופי התוכנית ( להעניק הסכם מס 715243 ח"כ).
Materials
| Name | Company | Catalog Number | Comments |
| Chrome mask | Compugraphics (http://www.compugraphics-photomasks.com/) | 5'', designed in AutoCAD (Autodesk, Inc.) | |
| Chrome mask | Mitani-Micronics (http://www.mitani-micro.co.jp/en/) | 5'', designed in AutoCAD (Autodesk, Inc.) | |
| Chrome mask | Kuroda-Electric (http://www.kuroda-electric.eu/ | 5'', designed in AutoCAD (Autodesk, Inc.) | |
| 4'' Silicon wafer (B-test) | Stanford Nanofabrication Facility | ||
| SU-8 2002 | MicroChem | ||
| SU-8 2050 | MicroChem | ||
| Spin-coater | Laurell Technologies | WS-400BZ-6NPP/LITE | |
| Exposure timer | Optical Associates, Inc | OAI 150 | |
| Illumination controller | Optical Associates, Inc | 2105C2 | |
| SU-8 developer | MicroChem | ||
| 2-Propanol | Fisher Scientific | A426F-1GAL | |
| Acetone | Fisher Scientific | A18-4 | |
| Trichloromethylsilane (TCMS) | Sigma-Aldrich | 92361-500ML | Caution: TCMS is toxic and water-reactive |
| Sylgard 184 Elastomer Kit | Dow Corning | PDMS prepolymer | |
| Biopsy punch, 1 mm | VWR | 95039-090 | |
| Oxygen Plasma Asher | Branson/IPC | ||
| Small metal tubing (0.635 mm OD, 0.4318 mm ID, 12.7 mm long); gage size 23TW | New England Small Tube Corporation | NE-1300-01 | |
| Nalgene syringe filter, 0.22 μm | Thermo Scientific | 725-2520 | to filter all solution, small particles would clog the chip |
| Polyethylene tubing; 0.9652 mm OD, 0.5842 mm ID | Solomon Scientific | BPE-T50 | |
| Syringe, 1 ml | BD Scientific | 309628 | for worm trapping and release |
| Syringe, 20 ml | BD Scientific | 309661 | for gravity-based flow |
| Gilson Minipuls 3, Peristaltic pump | Gilson | to suck solutions and worms out of the chip | |
| Microfluidic flow controller, equipped with 0–800 kPa pressure channel | Elveflow | OB1 MK3 | pressure delivery |
| Water-Resistant Clear Poly- urethane Tubing, 4 mm ID and 6 mm OD | McMaster-Carr | 5195 T52 | connection from house air to pressure pump |
| Water-Resistant Clear Polyurethane Tubing, 2.6mm ID and 4mm OD | McMaster-Carr | 5195 T51 | connect pressure pump to small tubng |
| Push-to-Connect Tube Fitting for Air | McMaster-Carr | 5111K468 | metric - imperial converter |
| Straight Connector for 6 mm × 1/4″ Tube OD | McMaster-Carr | 5779 K258 | |
| Leica DMI 4000 B microscopy system | Leica | ||
| 63×/1.32 NA HCX PL APO oil objective | Leica | 506081 | |
| Hamamatsu Orca-Flash 4.0LT digital CMOS camera | Hamamatsu | C11440-42U | |
| Lumencor Spectra X light engine | Lumencor | With cyan and green/yellow light source | |
| Excitation beam splitter | Chroma | 59022bs | in the microscope |
| Hamamatsu W-view Gemini Image splitting optics | Hamamatsu | A12801-01 | to split green and red emission and project them on different areas on the camera chip |
| Emission beam splitter | Chroma | T570lpxr | in the image splitter |
| Emission filters GCamp6s | Chroma | ET525/50m | in the image splitter |
| Emission filters mCherry | Chroma | ET632/60m | in the image splitter |
References
- Eastwood, A. L., et al. Tissue mechanics govern the rapidly adapting and symmetrical response to touch. Proc. Natl. Acad. Sci. 15 (50), E6955-E6963 (2015).
- Katta, S., Krieg, M., Goodman, M. B. Feeling Force: Physical and Physiological Principles Enabling Sensory Mechanotransduction. Annu. Rev. Cell Dev. Biol. 31, 347-371 (2015).
- Krieg, M., Dunn, A. R., Goodman, M. B. Mechanical systems biology of C. elegans touch sensation. BioEssays. 37 (3), 335-344 (2015).
- Krieg, M., Dunn, A. R., Goodman, M. B. Mechanical control of the sense of touch by β-spectrin. Nat. Cell Biol. 16 (3), 224-233 (2014).
- Krieg, M., et al. Tensile forces govern germ-layer organization in zebrafish. Nat Cell Biol. 10 (4), 429-436 (2008).
- Gaub, B. M., Müller, D. J. Mechanical stimulation of Piezo1 receptors depends on extracellular matrix proteins and directionality of force. Nano Lett. 17 (3), 2064-2072 (2017).
- Geffeney, S. L., et al. DEG/ENaC but not TRP channels are the major mechanoelectrical transduction channels in a c. Elegans nociceptor. Neuron. 71 (5), 845-857 (2011).
- O'Hagan, R., Chalfie, M., Goodman, M. B. The MEC-4 DEG/ENaC channel of Caenorhabditis elegans touch receptor neurons transduces mechanical signals. Nat. Neurosci. 8 (1), 43-50 (2005).
- Suzuki, H., et al. In Vivo Imaging of C. elegans Mechanosensory Neurons Demonstrates a Specific Role for the MEC-4 Channel in the Process of Gentle Touch Sensation. Neuron. 39 (6), 1005-1017 (2003).
- Kopito, R. B., Levine, E. Durable spatiotemporal surveillance of Caenorhabditis elegans response to environmental cues. Lab Chip. 14 (4), 764-770 (2014).
- Chokshi, T. V., Ben-Yakar, A., Chronis, N. CO2 and compressive immobilization of C. elegans on-chip. Lab Chip. 9 (1), 151 (2009).
- Hulme, S. E., Shevkoplyas, S. S., McGuigan, A. P., Apfeld, J., Fontana, W., Whitesides, G. M. Lifespan-on-a-chip: microfluidic chambers for performing lifelong observation of C. elegans. Lab Chip. 10 (5), 589-597 (2010).
- Li, S., Stone, H. a., Murphy, C. T. A microfluidic device and automatic counting system for the study of C. elegans reproductive aging. Lab Chip. 15 (2), 524-531 (2015).
- Chokshi, T. V., Bazopoulou, D., Chronis, N. An automated microfluidic platform for calcium imaging of chemosensory neurons in Caenorhabditis elegans. Lab Chip. 10 (20), 2758-2763 (2010).
- Mishra, B., et al. Using microfluidics chips for live imaging and study of injury responses in Drosophila larvae. J. Vis. Exp. , e50998 (2014).
- Chronis, N., Zimmer, M., Bargmann, C. I. Microfluidics for in vivo imaging of neuronal and behavioral activity in Caenorhabditis elegans. Nat. Methods. 4 (9), 727-731 (2007).
- Krajniak, J., Lu, H. Long-term high-resolution imaging and culture of C. elegans in chip-gel hybrid microfluidic device for developmental studies. Lab Chip. 10 (14), 1862-1868 (2010).
- Vasquez, V., Krieg, M., Lockhead, D., Goodman, M. B. Phospholipids that Contain Polyunsaturated Fatty Acids Enhance Neuronal Cell Mechanics and Touch Sensation. CellReports. 6 (1), 70-80 (2013).
- Krieg, M., et al. Genetic defects in β-spectrin and tau sensitize C. elegans axons to movement-induced damage via torque-tension coupling. Elife. 6 (2010), e20172 (2017).
- Arnadóttir, J., O'Hagan, R., Chen, Y., Goodman, M. B., Chalfie, M. The DEG/ENaC protein MEC-10 regulates the transduction channel complex in Caenorhabditis elegans touch receptor neurons. J. Neurosci. 31 (35), 12695-12704 (2011).
- Lockhead, D., et al. The tubulin repertoire of Caenorhabditis elegans sensory neurons and its context-dependent role in process outgrowth. Mol. Biol. Cell. 27 (23), 3717-3728 (2016).
- Goodman, M. B., Ernstrom, G. G., Chelur, D. S., O'hagan, R., Yao, C. A., Chalfie, M. MEC-2 regulates C. elegans DEG/ENaC channels needed for mechanosensation. Nature. 415 (6875), 1039-1042 (2002).
- Nekimken, A., Fehlauer, H., Kim, A., Goodman, M., Pruitt, B. L., Krieg, M. Pneumatic stimulation of C. elegans mechanoreceptor neurons in a microfluidic trap. Lab Chip. , (2017).
- Brower, K., White, A. K., Fordyce, P. M. Multi-step Variable Height Photolithography for Valved Multilayer Microfluidic Devices. J. Vis. Exp. (119), e55276 (2017).
- Jenkins, G. Rapid prototyping of PDMS devices using SU-8 lithography. Methods Mol. Biol. 949 (1), 153-168 (2013).
- Faustino, V., Catarino, S. O., Lima, R., Minas, G. Biomedical microfluidic devices by using low-cost fabrication techniques: A review. J. Biomech. 49 (11), 2280-2292 (2016).
- Xia, Y., Whitesides, G. M. SOFT LITHOGRAPHY. Annu. Rev. Mater. Sci. 28 (1), 153-184 (1998).
- Chen, T. -. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Cho, Y., Porto, D., Hwang, H., Grundy, L., Schafer, W. R., Lu, H. Automated and controlled mechanical stimulation and functional imaging in vivo in C. elegans. Lab Chip. , (2017).
- Edwards, S. L., et al. A novel molecular solution for ultraviolet light detection in Caenorhabditis elegans. PLoS Biol. 6 (8), 1715-1729 (2008).
- Porta-de-la-Riva, M., Fontrodona, L., Villanueva, A., Cerón, J. Basic Caenorhabditis elegans methods: synchronization and observation. J. Vis. Exp. (64), e4019 (2012).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat. Methods. 9 (7), 676-682 (2012).
- Cho, Y., Porto, D. A., Hwang, H., Grundy, L. J. High-Throughput Controlled Mechanical Stimulation and Functional Imaging In Vivo. BiorXiv. , (2017).
- Petzold, B. C., Park, S. -. J., Mazzochette, E. A., Goodman, M. B., Pruitt, B. L. MEMS-based force-clamp analysis of the role of body stiffness in C. elegans touch sensation. Integr. Biol. (Camb). 5 (6), 853-864 (2013).
- Nekimken, A. L., Mazzochette, E. A., Goodman, M. B., Pruitt, B. L. Forces applied during classical touch assays for Caenorhabditis elegans. PLoS One. 12 (5), e0178080 (2017).
- Chronis, N., Zimmer, M., Bargmann, C. I. Microfluidics for in vivo imaging of neuronal and behavioral activity in Caenorhabditis elegans. Nat. Methods. 4 (9), 727-731 (2007).
- Gilleland, C. L., Rohde, C. B., Zeng, F., Yanik, M. F. Microfluidic immobilization of physiologically active Caenorhabditis elegans. Nat. Protoc. 5 (12), 1888-1902 (2010).
- Chuang, H. -. S., Raizen, D. M., Lamb, A., Dabbish, N., Bau, H. H. Dielectrophoresis of Caenorhabditis elegans. Lab Chip. 11 (4), 599 (2011).
- Christensen, A. M., Chang-Yen, D. A., Gale, B. K. Characterization of interconnects used in PDMS microfluidic systems. J. Micromechanics Microengineering. 15 (5), 928-934 (2005).
- Gilpin, W., Uppaluri, S., Brangwynne, C. P. Worms under Pressure: Bulk Mechanical Properties of C. elegans Are Independent of the Cuticle. Biophys. J. 108 (8), 1887-1898 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved