Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Mekanik stimülasyon ve yüksek çözünürlük görüntüleme C. elegans bir havacilik aygıtı kullanma
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Mechanobiology araştırma için yeni araçlar nasıl mekanik stres anlamak için gerekli biyokimyasal yollar etkinleştirir ve biyolojik yanıt aydınlığa çıkartıyor. Burada, hücresel tepkilerin yüksek çözünürlüklü görüntüleme sağlayan bir mikrosıvısal tuzak ile immobilize hayvanların seçici mekanik uyarılması için yeni bir yöntem vitrin.
Özet
Mechanobiology bir merkezi amacı karşılıklı etkisi protein ve hücreleri mekanik stres anlamaktır. Önemini rağmen hücresel fonksiyonu mekanik stres etkisi hala kötü anlaşılmaktadır. Birkaç araçlarını etkinleştirme nedeniyle aynı anda deformasyon doku ve hücreleri, Canlı hayvanlarda hücresel hareketlilik görüntüleme ve verimli sınırlama-in hareketliliği Yuvarlak solucanlar gibi aksi takdirde son derece mobil model organizmalarda kısmen, bu bilgi boşluğu bulunmaktadır Caenorhabditis elegans. C. elegans küçük boyutunu onları havacilik dayalı araştırma aygıtlar için mükemmel bir maç yapar ve mikrosıvısal aygıtlarını kullanarak immobilizasyon için çözümler sunulmuştur. Bu aygıtlar yüksek çözünürlükte görüntüleme için izin rağmen hayvan tamamen polydimethylsiloxane (PDMS) ve cam, mekanik güç ya da Elektrofizyolojik kayıtlar teslim etmek için fiziksel erişimi sınırlama kaplı olduğu. Son zamanlarda, yüksek çözünürlüklü Floresans mikroskobu ile uyumlu bir bindirme tasarım ile pnömatik aktüatörler entegre bir cihaz geliştirdi. Çalıştırma kanal solucan-bindirme kanaldan ince PDMS diyafram tarafından ayrılır. Bu diyafram içine belgili tanımlık yan-in bir kurt bir dış kaynaktan basınç uygulayarak uğramaktadır. Cihazın bireysel mechanosensitive nöronlar hedefleyebilirsiniz. Bu nöronların harekete geçirmek, yansıma genetik olarak kodlanmış kalsiyum göstergeler ile yüksek çözünürlüklü. Bu makalede C. elegans suşları kalsiyum duyarlı etkinlik göstergesi (GCaMP6s) onların dokunmatik reseptör nöronlarda (TRNs) ifade kullanarak genel yöntem sunuyor. Yöntemi bir sonda TRNs ne de kalsiyum sensörler sınırlı değildir, ancak diğer mekanik olarak duyarlı hücreleri veya sensörler için genişletilebilir.
Giriş
Dokunma duygusu hayvanlar çevreleri hakkında çok önemli bilgiler sağlar. Bağlı olarak uygulanan kuvvet, dokunmatik zararsız, zevk veya acı olarak algılanmaktadır. Dokunmatik sırasında doku deformasyon reseptör proteinler, en sık iyon kanalları hızlı deride katıştırılmış özel mekanoreseptör hücreleri tarafından algılanır. Kuvvet algı iyon kanal etkinleştirme dokunma ve ağrı sırasında bağlanma adımları tam olarak anlaşılmış değildir. Daha az nasıl deri dokusu mekanik deformasyon ve gerginlik içinde mechanoreceptors değişiklikleri olup filtreler veya1,2,3stres bilinir. Bu boşluğu anlamada, kısmen, hassas mekanik elektrodlar kesilmediğini gözleyerek yanıt-e doğru hücresel düzeyde yaşayan hayvan cilt yüzeyine uygulamak için uygun araçlar eksikliği kaynaklanmaktadır. Atomik kuvvet mikroskobu kapsamlı uygulamak ve izole hücreler4,5 Kuvvetleri ölçmek için ve aynı zamanda yaşam Piezo1 reseptörleri etkinleştirmek için kullanılmıştır, ancak6, benzer deneyler yaşayan hayvanlar, özellikle kullanarak hücreler C. elegans, konu içsel hareketlilik nedeniyle Rootkitler zor olmuştur. Bu meydan okuma geleneksel olarak bireysel hayvanlar agar yastıkları1,7,8,9üzerinde hareketsiz için veteriner - veya cerrahi-sınıf cyanoacrylate tutkal kullanarak atlatılabilirdi. Bu yaklaşım üretken beri ama yapıştırma ve mekanik uygunluk yumuşak agar yüzeyinde immobilizasyon için gerekli beceri ile ilgili sınırlamalar vardır. Bazı yapıştırma için bağlı komplikasyonları önler bir ücretsiz alternatif havacilik stratejisidir.
Yuvarlak solucanlar C. elegans genetik model organizma bu hayvanın büyüklüğü nedeniyle, havacilik teknoloji için iyi bir seçimdir tamamen eşlenen bir sinir sistemi var. Havacilik tabanlı cihazlar teklif aksi takdirde son derece mobil hayvan yüksek çözünürlüklü görüntü ve ilgili nöro-düzenleyici uyaranların teslimat yaparken ölçülü avantaj. Mikrosıvısal yardımıyla teknolojileri, hayvanlar yaşayan bütün ömrünü12,13 üzerinde davranış faaliyet izleme ve yüksek çözünürlüklü etkinleştirme zararı10,11olmadan, etkisiz hale nöronal aktivite14,15,16,17ve görüntüleme. , Daha fazla dokunma ve ağrı hissi kendi fizyolojik1,8, mekanik4,18,19, karakterize edilebilir için gerekli birçok mekanoreseptör nöronlar ve moleküler seviye20,21,22.
C. elegans altı TRNs, üç olan hayvanın anterior (ALML/R ve AVM) innervate ve üç olan hayvanın arka (PLML/R ve PVM) innervate kullanarak kendi vücut duvar yumuşak mekanik uyaranlara hissediyor. Biyokimyasal bir sinyal uygulanan bir yürürlüğe transducing için gerekli iyon kanal molekülleri onun TRNs8' kapsamlı bir şekilde inceledik. Bu makalede araştırmacılar hassas mekanik kuvvetleri bir immobilize C. elegans kaplamasına uygulamak sağlayan bir mikrosıvısal platformu23 sunar kendi iç dokulara deformasyon tarafından optik görüntüleme okunurken yuvarlak kurt,. İyi tanımlanmış mekanik uyaranlara sunan ek olarak, kalsiyum geçişler mekanoreseptör nöron hücre altı çözünürlük ile kaydedilen ve morfolojik ve anatomik özellikleri ile ilişkili. Cihazın kendi cilt altı pnömatik çalıştırma kanalları (Resim 1 ve Şekil 2) yanındaki sunar ve tek bir hayvan tutan bir merkezi bindirme kanalı oluşur. Altı kanala mekanik uyaranlara her solucan'ın altı TRNs sunmak için bindirme kanalı boyunca konumlandırılır. Bu kanallar bir dış hava basınç kaynağı (şekil 1) tarafından yürütülen ince PDMS Diaframlar, bindirme odasından ayrılır. Saptırma basınç ile ilgili olarak kalibre edilmiş ve bu makaledeki ölçümler sağlamak. Her aktüatör ayrı ayrı ele alınması ve seçim mekanoreseptör uyarmak için kullanılır. Basınç bir piezo-driven basınç pompası kullanılarak teslim edilen ancak başka herhangi bir aygıtı kullanılabilir. Biz basınç Protokolü TRNs vivo içinde harekete geçirmek ve çalışma cihazları mekanik uyaranlara için yetişkin C. elegansteslim, Yetişkin hayvanların içine aygıt yükleme, kalsiyum görüntüleme gerçekleştirmek için uygun göstermek için kullanılabilir göstermek deneyleri ve sonuçlarını çözümleme. Cihaz imalat iki ana adımlardan oluşur: 1) SU-8; bir kalıp yapmak fotolitografi ve 2) bir cihaz yapmak için PDMS kalıp. Kısalık ve netlik uğruna, okuyucular için daha önce yayımlanmış makaleleri ve protokoller24,25 kalıpları ve cihazlar üretmek konusunda yönergeler için denir.
Protokol
1. cihaz imalat
- (Ek dosya 1) ekli maskesi dosyası indirmek ve bir ticari hizmet veya şirket içi tesis kullanarak bir krom maskesi oluşturmak. Cihazın üzerindeki en küçük boyutu 10 µm (aktüatör membran kalınlığı) olduğu için maske güvenilir özellikleri üretmek için yeterince yüksek çözünürlük, ± 0.25 µm içinde olduğundan emin olun.
-
Standart SU-8 fotolitografi yöntemleri uygulayın (örneğin, başvuran24,25,26) kalıp PDMS cihazların; sonraki üretim için imal etmek Aşağıda listelenen adımları bir özetini.
Not: Işığa duyarlı bir malzeme, hangi Glossar ultraviyole ışığa maruz kalma üzerine SU-8'dir (en fazla emme ~ 365 nm). Üreticinin yönergelerini sonrası pişirin ve yumuşak-fırında, pozlama (UV), işleme parametrelerini belirlemek için bir başlangıç noktası olarak kullanın.- SU-8 2002 bir silikon gofret spin-ceket yatırıp küçük yapıların daha iyi yapışma için 2 µm yaklaşık kalınlığı için. Yumuşak-pişir 95 ° C'de 1 dk sıcak tabakta, biraz aşırı (UV) tüm yüzey açığa (~ 100 mJ/cm2) ve 95 ° C'de 2 min için sıcak tabakta sonrası fırında
- Spin-ceket aygıt özellikleri tanımlamak için 47-µm kalın bir tabaka SU-8 2050. 15 s (130 d/d/s hızlanma) ve 90 için sonra 2000 rpm 500 RPM dönüş hızı kullanmak s (260 d/d/s hızlanma). Gerekirse yineleyin ve fotorezist uygun kalınlıkta olsun için dönüş hızı ayarlayın.
- Bir sıcak tabakta ve sonra 95 ° C'de 7 dk. 65 ° C'de 2 min için yumuşak oyuncak Üretici yönergelerine uygun fotorezist maruz (~ 160 mJ/cm2) düz yan duvarlar emin olmak için bir krom maskesi ve uzun-pass filtre kullanarak.
- Gofret kaldırmak ve sonrası bir sıcak tabakta ve 95 ° C'de 7 dk 1 dk 65 ° c için fırında
- Yıkamaya SU-8 geliştirici ile dağıtılması ve 2-propanol ile temiz.
- Gofret üzerinde bir aspiratör 30 dk (Sabit-pişir) fotorezist özellikleri stabilize etmek için 180 ° C'de pişirin.
-
Standart yineleme yöntemleri27kalıp kullanarak SU-8 modeli PDMS yinelemeden olun.
- SU-8 kalıp PDMS adezyon (silanization) azaltmak için trichloromethylsilane (TCMS) Buhar ile tedavi.
Uyarı: Toksik ve su-reaktif TCMS.- Desenli gofret su veya suda çözünen reaktifler arındırılmış bir duman başlıklı bir Sırça fanus vakum desiccator içinde bir gofret raf yerleştirin.
- Başlık altında bir damlalık cam yemek için TCMS 1 damla uygulamak ve desiccator içinde yerleştirmek için kullanın.
- Desiccator kapağını kapatın ve en az 20 dk için gofret kat TCMS buharı sağlar.
- Delik ve desiccator açın. Bell kavanoz kapağı açın ve plastik cımbız kullanarak gofret çıkarın. Bir Petri kabına veya alüminyum folyo tekne PDMS yineleme yoğurmak için yerleştirin. TCMS kaplı malzemelerin uygun tehlikeli atık bertaraf.
- Mix PDMS (10:1 oranı) 40 g temel polimer ve 4 g PDMS kür Aracısı kullanarak.
- SU-8 kalıp karışımı dökün ve en az 30 dk içinde bir vakum odası için karışım degas.
- En az 6 h 70 ° c fırında tedavisi.
- SU-8 kalıp PDMS adezyon (silanization) azaltmak için trichloromethylsilane (TCMS) Buhar ile tedavi.
- PDMS gofret yatay düz bir yüzeye ayarlayarak ve dikkatle PDMS soyulmuştu gofret kaldırın. Kalıp zarar verebilir gibi gofret bu adım sırasında viraj değil yukarı doğru.
Not: SU-8 eksik yapışma gofret veya eksik silanization için bu adımı sırasında SU-8 yapıların yıkım neden olabilir. - Öyle ki bir 24 mm x 60 mm coverslip cihazlar uyacaktır PDMS cihazları bireysel fiş içine kesti.
- 1-mm biyopsi yumruk kullanarak, delik giriş, iki çıkışları ve altı aktüatörler bir 1-mm biyopsi yumruk kullanarak yapmak. Cihazın kenarları etrafında 2 mm çapında daireler için amaç.
-
Cam kapak paket fişi Bond PDMS cips.
- Her iki yüzeyleri 80 W oksijen plazma için ortaya çıkarmak (30 s).
- Yavaşça maruz PDMS yüzey açıkorur bir mühür için kapak fişinin maruz yüzeyine yerleştirin.
- Sıcak bir tabak (100 ° C, 10 dk) üstünde belgili tanımlık aygıt tavlamak.
Not: Yetersiz bağ sızıntı nedeniyle cihazın yetersizliğine yol açabilir.
2. mikroskop hazırlanması
Not: Transjenik hayvanlar: kalsiyum göstergesi GCaMP6s28 veya faiz (örneğin, TRN); neuron(s) diğer genetik olarak kodlanmış etkinlik soruşturma gibi hızlı küçük lateral ve mekanik stimülasyon nedeniyle ortaya çıkan odak hareket eserler için düzeltmek için farklı bir dalga boyu, yayan bir etkinlik bağımsız floresan protein co hızlı. Otomatik analiz yazılımı izler ve hareket kaynaklı değişiklikleri için etkinlik sonda şiddeti dengeler. Solucan suşları GN69223 (ya da AQ323629) GCaMP6s (veya GCaMP6m) hızlı ve kalsiyum bağımsız tagRFP mec-7 promotor kontrol altında. Ayrıca, GN692 TRNs GCaMP6s Floresan23uyarma sırasında etkinleştirmesi nedeniyle mavi ışık sensörü lite-130 engeller mutasyon lite-1(ce314)içerir.
-
Bir mikroskop sistemi GCaMP ve RFP eşzamanlı uyarma için ayarlarsınız.
- Sürekli bir ışık kaynağı ve ikili şerit uyarma filtrenin sadece mavi ve sarı ışık iletir veya sadece dalgaboyu eşzamanlı mavi gibi tanımlanmış bir bant genişliği yayar bir ışık kaynağı kullanın (0.77 mW) ve sarı (1,21 mW) LED uyarma kaynakları için Kalsiyum-bağımlı ve bağımsız Floresans eşzamanlı uyarma anılan sıraya göre.
- Bir dijital fotoğraf makinesi mikroskobu görüntülerin kayıt etkinleştirmek için kullanın.
Not: Çoğu kamera resim alma için bir yazılım ile birlikte gelir. Alternatif olarak, kamera ve potansiyel olarak da mikroskobu sisteminin diğer bölümleri denetlemek için kullanılan serbestçe kullanılabilir yazılım vardır. - Kamera doygunluk kaçınmak için floresan yoğunluğu göre uyarma yoğunluğunu ayarlayın.
-
Bir floresan kübü uyarma kaynak seçimine bağlı olarak bir uyarma filtre ile donatılmış olması gerekiyor.
Not: 488-nm GFP ve 580 nm mCherry uyarma filtre burada kullanıldı.- Mavi ve sarı ışık yansıtan ve yeşil ve kırmızı ışık gönderme için küp bir ışın ayırıcı ekleyin.
- 10 X amaç ve yüksek büyütme objektif mikroskopla donatmak (örneğin, 63 X / 1.32 NA petrol) uyarma örnek ışık odaklanmak için.
- Bir ışın ayırıcı GCaMP ve kalsiyum bağımsız sinyal aynı anda kayıt için kamera önünde bağlayın. Işın bölücü bir dikroik ayna olduğundan emin olun (uzun geçmek, kesme, 570 nm) bir emisyon filtre kullanarak için yeşil yeşil ve kırmızı ışık ayırmak için (525 merkezli passband nm 50 nm genişliği ile) ve kırmızı ışık için bir emisyon filtre (632 merkezli passband 60 nm nm genişlik).
- Proje üst yarısı üzerine yeşil ve kırmızı Floresans (yeşil) ve alt yarısı (kırmızı), sırasıyla fotoğraf makinesinin chip (bkz. şekil 3). Bu yönlendirme sağlanan analiz yazılımı için bir önkoşuldur.
3. hayvan hazırlık
- Yaş senkronize genç yetişkin veya yetişkinlere yönelik ilk günden C. elegans, Porta-de-la-Riva vd tarafından daha önce açıklandığı şekilde hazırlayın 31
- Mikrosıvısal çip hazırlamak.
- Yerçekimi akışı rezervuar bağlanmak (~ çip seviyesinden 60 cm) içeren filtre (0.2 µm polyethersulfone şırınga filtre) M9 arabelleğe çipin bir çıkış. Diğer çıkış iki çıkış atık konteyner, Yani, bir filtre şişesi bir prize bağlayın. Diğer çıkış atık kapsayıcı Peristaltik pompa için bağlayın.
Not: tüm bağlantılar için polietilen (PE) boru kullanmak ve metal tüp bağlantı parçaları için çip PE boru bağlanın. Bu şekilde tüm atık çözümler çip dışarı fışkırma ve atık kapta toplanır. Çıkış kanalları aracılığıyla akış solucan daha sonra yakalama işlemi sırasında rahat tutacak bir nazik emiş oluşturur. - Hazırlamak oluşan arasında bağlantı yapan operatördür 50-mm uzun PE boru (0.9652-mm OD, 0.5842-mm ID) ile her iki ucundaki metal boru (ölçüm boyutu 23TW, 0.635-mm OD). Basın-fit Bunlar arasında bağlantı yapan operatördür her altı çalıştırma parmak ve solucan giriş içine (bkz. şekil 1). Tekrarlanan kaldırma PDMS delikleri giymek yol açar gibi bu interconnectors çipi içinde bırakın.
- Yerçekimi akışı rezervuar bağlanmak (~ çip seviyesinden 60 cm) içeren filtre (0.2 µm polyethersulfone şırınga filtre) M9 arabelleğe çipin bir çıkış. Diğer çıkış iki çıkış atık konteyner, Yani, bir filtre şişesi bir prize bağlayın. Diğer çıkış atık kapsayıcı Peristaltik pompa için bağlayın.
- Mikroskop çipte bir yer. Çekme 2 – 5 solucanlar içine bir damla (0.2 µm şırınga filtre) M9 arabellek filtre ve 1 mL şırınga onları pistonu hafifçe çekerek 1 mL şırınga bağlı bir PE boru (0.9652-mm OD, 0.5842-mm ID) içine çekmek için kullanın. Hayvanlara şırınga değil de PE tüp içinde tutun.
Not: Çok fazla solucan veya filtre uygulanmamış çip çözümlerinde tıkanma için yol açabilir. - PE boru şırınganın solucan giriş (Resim 1 ve Şekil 2), ara bağlantı için belgili tanımlık küçük parça bağlayın. Kapak açarak yerçekimi akışını etkinleştirmek ve Peristaltik pompa başlar. Sonra yavaşça hayvanlar kesilmediğini gözleyerek kanal aydınlık alan modunda 10 X lens ile mikroskop altında bindirme kanal taşımak için şırınga pistonu şırınganın tuşuna basın.
Not: Bazen görünen hava kabarcıkları bir sorun teşkil değil; Bunlar genellikle otomatik olarak çıkış taşınır. Çeşitli hayvanlar 'bekleme odasında Park' ve sırayla kullanılır.- Hayvan yakalama Kanal yükleme sonra (Ayrıca bkz: Şekil 2), hafifçe iterek veya hayvan başkanı kanal ön konik şeklinde konumlandırmak için dalgıç şırınganın çekerek konumunu ayarlayın.
- Solucan (yetişkin gün 1) yongasında mahsur kalmak için uygun büyüklükte olduğundan emin olun.
- Solucan (kuyruk ucu hariç) vücudun yakınındaki burun kanalından tüm kesit doldurmak değildir veya solucan şırınga pistonu hareket ettirmeden kanal ekseni boyunca giderse , bindirme kanaldan kaybolana kadar şırınga pistonu basarak solucanı silmek ve yeni bir yük (bkz. Adım 3.8).
- Floresan mikroskop ve daha yüksek büyütme objektif (40 X veya daha yüksek) moduna geçirin ve faiz nöron neurite birinin aktüatörler diyafram yalan konusunda kontrol edin. Eğer değilse, çekme veya itme pistonu hayvan konumunu ayarlamak. Bu yardımcı olmazsa, solucanı ve yeni bir yük.
- Faiz nöron hücre gövdesi üzerinde odaklanmak ve ara bağlantı nöron hücre gövdesi ön tarafındaki en yakın Aktüatörün PE boru kullanarak bir programlanabilir basınç pompası bağlayın.
- Deneme aktüatör ve nöron arasındaki uzaklık ölçme gerektiriyorsa, görüş alanı her iki görüş alanı ve channelwall görüntünün alt ve üst kenarına paralel değiştirin.
- Programlanabilir basınç pompa kullanarak bir basınç Protokolü tanımlar.
Not: Bu iletişim kuralı için istenen deney ayarlanabilir.- Bir süre resim silsilesi (normalleştirme için gerekli), en az 50 adet fotoğraf karşılık gelen 0 kPa sabit bir basınç ile başlayın. 10 Hz bir görüntüleme hızı için bu 5 s. Ekle istenen uyarıcı dalga biçimi ve basınç karşılık gelen ve uyarıcı bir ikinci adım olarak tanımlamak.
Not: bir büyük nöronal yanıt üretir gibi TRNs uyarıcı için bir adım (Yani, 275 kPa) üst üste bir sinüs dalga formu (Yani, 75 kPa, 10 Hz) tavsiye edilir. - Deneme ek uyaranlara gerektiriyorsa, bir dönem en az 10 dahil et 0 kPa uyaranlara arasında sürekli bir baskı s. Basınç pompası değiştirmeden önce enstrüman basınç solucan gerçek deneme önce yanlışlıkla uyarılması önlemek için sabit 0 kPa olduğundan emin olun.
- Bir süre resim silsilesi (normalleştirme için gerekli), en az 50 adet fotoğraf karşılık gelen 0 kPa sabit bir basınç ile başlayın. 10 Hz bir görüntüleme hızı için bu 5 s. Ekle istenen uyarıcı dalga biçimi ve basınç karşılık gelen ve uyarıcı bir ikinci adım olarak tanımlamak.
- Görüntüleme ve baskı iletişim kuralı çalıştırın.
- Görüntü alma yazılım kamera, görüntü sırası 10 Hz değerinde bir çekim hızı 100 MS basınç protokol süresince kullanarak ayarlayın. Öyle ki maksimal Floresans artış kamera emdirmek değil uyarma yoğunluğunu ayarlayın. Görüntüleri normalleştirme için ilk uyarıcı önce en az 50 adet fotoğraf ile *.tif dosyası olarak kaydedin.
- Görüntü alma yazılım ve yazılım programlanabilir pompa basınç protokolünde görüntüleme Protokolü başlatın. Kayıt sırasında faiz nöron 10 x 10 piksel bir alanda parlak bir noktadır, sıralı Albümdeki 10 piksel daha öteye taşımaz ve görüş alanı kayıt sırasında kalır gözlemlemek.
Not: Eğer bu yapılmazsa, analiz yazılımı başarısız olur. Parlak noktalar (yani autofluorescence) nöron çevresinde zor nöronların kayıtları temiz olun. Bu sorunu gidermek için tuzak solucanı ve yeni bir solucan çipin yükleyin. Solucan çok fazla hareket ederse, yeni bir kayıt aynı solucanın deneyin ve solucan hareket gözlemlemek. Sorun devam ederse solucan mahsur kalmak için çok küçük olabilir. Bu durumda bu solucanı ve biraz daha büyük bir solucan tuzağın içine yükleyin. - Nöronlar en az 10 piksel tüm kayıt sırasında ayrılır sürece birden fazla nöronlar gelen sinyalleri istenirse, görüş alanı aynı anda kayıt.
- Habituation araştırmak için deneme hkr bir hayvan üzerinde gerçekleştirin.
- Bindirme kanaldan solucanı.
- Sonraki çalışmaları için solucan tutmak isterseniz, yerçekimi akışı ve atık konteyner doğru çip çıkışları kesin. Tüm solucan bindirme kanalı ile akış kanalına itilir kadar şırınga pistonu hafifçe bastırın.
- Bir damlacık çip dışında hayvan görünene kadar şırınga pistonu tuşuna basmaya devam edin. PE boru solucan giriş üzerinden de dahil olmak üzere şırınga kesmek, damlacık de solucan Aspire edin ve agar tabağa aktarmak için kullanın.
- Bu solucan tutmak için istenmiyorsa, tüm solucan bindirme kanalı ile akış kanalına itilir kadar şırınga pistonu basarak solucanı; yerçekimi akışı ve Peristaltik pompa emme hayvan çip dışarı ve atık konteyner içine taşıyacak.
4. analiz
- Download ve install belgili tanımlık yeni Fiji sürüm32.
- Download ve install belgili tanımlık en yeni java SDK yorum.
Not: gerekirse, silmek veya yeni yüklenen java derleyicisi kullanmak Fiji için Fiji klasörünün içindeki java klasörü yeniden adlandırın. -
Fiji yazılımını açın.
- Belgili tanımlık bilgisayar yazılımı açarak yeni yüklenen java derleyicisi çalışır durumda olup olmadığını kontrol edin ' eklentileri | Yardımcı programlar | ImageJ | Özellikler.
- Download belgili tanımlık pokinganalyzer*.java eğe (https://github.com/HFehlauer/Poking-Analyzer, ek dosya 2' ye bakın).
- Sürükleyin ve bir eklenti olarak açmak için yazılım penceresinde .java dosya sürükleyip bırakamazsınız.
-
Derlemek ve koşmak belgili tanımlık pokinganalyzer*.java eğe Fiji'de Ctrl + R tuşlarına basarak; bir grafik kullanıcı arabirimi (alay Analyzer) (şekil 3) açılır.
- "Yardım" sekmesinde tıklatın ve yazılımı ve çözümlemeyi gerçekleştirmek nasıl gereksinimleri hakkında okuyun. Başlamak için belgili tanımlık çözümlemek için video dosyası konum belirleyin "Open video" sekmesini seçin: "Açık bir Video" düğmesini tıklatın, video konumuna gidin ve açın.
Not: Yazılımın açıldı bu sekme ile başlar. Başlatma sırasında açık değilse yeni bir analiz "Open video" sekmesinde tıklatın. Video a.tif biçiminde ise, programın dahili video açın ve ilk görüntü arabirimin alt kısmında görüntüleyin. Eğer görüntü çözümlenmesi gereken bir video değil, başka bir video açmak için "bir video açın" düğmesini tıklatın. - Devam etmek için "Define ROIs" sekmesini tıklatın. Bu sekmede, TRN konumunu tanımlayın. Not açılan video ilk görüntü bu sekmesini "Define TRN" düğmesini alt kısmında görüntülenir ve nöron GCaMP floresan-meli göstermek görüntülenen resmin üst kısmında tıklayın.
- İsteğe bağlı: aktüatör görüntünün üst yarısında görünür durumdaysa program otomatik olarak mesafe nöron ve eyleyici isterseniz izleyebilirsiniz. Bu, Denetim "Tanımla aktüatör?" -kutu, "Define aktüatör" butonuna tıklayın ve aktüatör görüntünün üst yarısında tıklayın.
- "Analiz" sekmesinde Tanımla resim alma hızı tıklatın. Alanına bir sayı girin veya yukarı veya aşağı düğmelerini sayısı azaltmak veya artırmak için. Eğer önceki sekmesinde "Tanımla aktüatör?" -kutusu seçiliyse, program mesafeyi hesaplayabilir bu yüzden kamera hücre boyutu, büyütme ve binning faktör tanımlayın.
- "Analiz Başlat" butonuna tıklayın.
Not: Program şimdi nöron tarafından üst yarısında görüntü sırayla onun Floresans izler (kalsiyum bağımlı) ve alt yarısında (kalsiyum bağımsız) görüntü sırası. Program kayıt düzlemde nöron hareket için hesap için 10 x 10 piksel nöron aşağıdaki resimdeki nöron konumunu bulmak için önceki görüntünün konumunu yüzölçümü araştıracağız. Floresan arka plan floresan (Fbg) düzeltme ve floresan ilk 50 görüntüleri (F0) tarafından bölen tarafından iki devrede hesaplar: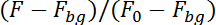
Nöron tarafından neden olduğu floresan yeşil, etkinlik bağlı kanal (FCa2 +) değişimler recoding vardır uçaktan hareket sonra floresan kırmızı, etkinlik bağımsız kanalını (F kullanarak düzeltildi corr) ve kalsiyum-bağımlı ön uyaran standart sapma (sdCa2 +) ve bağımsız floresan (sdcorr) tarafından:
- Program arabirimi alt bölümündeki durum çubuğunda ilerleme durumunu gösterir; durum çubuğu % 100 ulaştığında, "Sonuçlar" sekmesini tıklayın. Durum çubuğunun önce % 100 durursa, program program video çözümleyemedi nedenini belirten bir hata iletisi verecektir.
- Sinyal-gürültü oranı çok düşük ise, programı nöron belirleyemez; Sonraki kayıtları görüntüleme parametrelerini ayarlamak.
- Nöron görüş alanı kayıt sırasında terk ederse, program artık takip edemiyorum ve durur. Sonraki kayıtlar için kayıt başına görüş alanı ortasında nöron yerleştirmek.
- Bazı bölgelerde görüş alanı doygun otomatik analiz geçersiz sonuçlar üretecektir. Sonraki kayıtlar için Floresans sinyal fotoğraf makinesi sensörünün emdirmek değil emin olun.
- 'Sonuç' sekmesinde sonucu üst bölümünde görüntülenir. Bir sekmeyle ayrılmış *.txt sonuç tablosunun yanında tıkırtı "Kurtarmak sonuç tablo üzerinde" kaydedin.
Not: Bu tablo saniye ve normalleştirilmiş kalsiyum-bağımlı floresan (kalsiyum bağımsız Floresans tarafından düzeltildi) zamanında oluşur. Önceden tanımlanmış ise, aynı zamanda turnuvalar ve µm aktüatör arasındaki toplam mesafe içerir ve sonra floresan yoğunluğu temsilcisi sonuçlarını turnuvalar ve µm. kanal duvara dik eyleyici arasındaki uzaklığı artırın stimülasyon uzaklığı en yakın aktüatör için hücre vücudun karşı şekil 4' te çizilen. - Bir kayıt (10'dan fazla piksele ayrılmış) birden fazla nöronlar iseniz, "Define ROIs" sekmesinde yeniden tıklatın ve ikinci nöron 4.6.2 adımıyla geri dönün.
- "Yardım" sekmesinde tıklatın ve yazılımı ve çözümlemeyi gerçekleştirmek nasıl gereksinimleri hakkında okuyun. Başlamak için belgili tanımlık çözümlemek için video dosyası konum belirleyin "Open video" sekmesini seçin: "Açık bir Video" düğmesini tıklatın, video konumuna gidin ve açın.
Sonuçlar
SU-8 litografi ve çip bağlanma
Litografi Protokolü ve PDMS kalıplama standart yordamları izleyin. Bilgi23,24,25,26başka bir yerde bulunabilir. PDMS sorunsuz gofret kür sonra akasındaki. Eğer PDMS peeling sırasında SU-8 özellikleri rip off, SU-8 yapışma katman veya silanization yetersizdi. Plazma aktivasyonu cam coverslips ve PDM...
Tartışmalar
Bu iletişim kuralı bir mikrosıvısal çip sıkışmış bir yuvarlak kurt cilt için hassas mekanik stimülasyon teslim etmeye yönelik bir yöntem gösterir. Bu biyolojik sorulara cevap için fiziksel uyaranlara entegrasyonunu kolaylaştırmak için tasarlanmıştır ve mechanobiology araştırma biyolojik Labs'de düzene amaçlamaktadır. Bu yöntem mechanosensory nöronlarda C. elegansişlevini değerlendirmek için önceki deneyleri genişletir. Önceki nicel ve yarı kantitatif teknikleri Kuvvetleri
Açıklamalar
Yazarlar ifşa gerek yok.
Teşekkürler
Sandra N. Manosalvas-Kjono, Purim Ladpli teşekkür ediyoruz, Farah Memon, Divya Gopisetty ve Veronica Sanchez için aygıt tasarım ve mutant hayvanlar nesil destek. Bu araştırma desteklenmiştir NIH hibe tarafından R01EB006745 (BLP), R01NS092099 (için MBG), K99NS089942 (MK için) F31NS100318 (için ALN) ve Avrupa Birliği'nin ufuk 2020 araştırma ve yenilik altında Avrupa Araştırma Konseyi (ERC) üzerinden alınan finansman programı () Sözleşme No 715243 vermek MK için).
Malzemeler
| Name | Company | Catalog Number | Comments |
| Chrome mask | Compugraphics (http://www.compugraphics-photomasks.com/) | 5'', designed in AutoCAD (Autodesk, Inc.) | |
| Chrome mask | Mitani-Micronics (http://www.mitani-micro.co.jp/en/) | 5'', designed in AutoCAD (Autodesk, Inc.) | |
| Chrome mask | Kuroda-Electric (http://www.kuroda-electric.eu/ | 5'', designed in AutoCAD (Autodesk, Inc.) | |
| 4'' Silicon wafer (B-test) | Stanford Nanofabrication Facility | ||
| SU-8 2002 | MicroChem | ||
| SU-8 2050 | MicroChem | ||
| Spin-coater | Laurell Technologies | WS-400BZ-6NPP/LITE | |
| Exposure timer | Optical Associates, Inc | OAI 150 | |
| Illumination controller | Optical Associates, Inc | 2105C2 | |
| SU-8 developer | MicroChem | ||
| 2-Propanol | Fisher Scientific | A426F-1GAL | |
| Acetone | Fisher Scientific | A18-4 | |
| Trichloromethylsilane (TCMS) | Sigma-Aldrich | 92361-500ML | Caution: TCMS is toxic and water-reactive |
| Sylgard 184 Elastomer Kit | Dow Corning | PDMS prepolymer | |
| Biopsy punch, 1 mm | VWR | 95039-090 | |
| Oxygen Plasma Asher | Branson/IPC | ||
| Small metal tubing (0.635 mm OD, 0.4318 mm ID, 12.7 mm long); gage size 23TW | New England Small Tube Corporation | NE-1300-01 | |
| Nalgene syringe filter, 0.22 μm | Thermo Scientific | 725-2520 | to filter all solution, small particles would clog the chip |
| Polyethylene tubing; 0.9652 mm OD, 0.5842 mm ID | Solomon Scientific | BPE-T50 | |
| Syringe, 1 ml | BD Scientific | 309628 | for worm trapping and release |
| Syringe, 20 ml | BD Scientific | 309661 | for gravity-based flow |
| Gilson Minipuls 3, Peristaltic pump | Gilson | to suck solutions and worms out of the chip | |
| Microfluidic flow controller, equipped with 0–800 kPa pressure channel | Elveflow | OB1 MK3 | pressure delivery |
| Water-Resistant Clear Poly- urethane Tubing, 4 mm ID and 6 mm OD | McMaster-Carr | 5195 T52 | connection from house air to pressure pump |
| Water-Resistant Clear Polyurethane Tubing, 2.6mm ID and 4mm OD | McMaster-Carr | 5195 T51 | connect pressure pump to small tubng |
| Push-to-Connect Tube Fitting for Air | McMaster-Carr | 5111K468 | metric - imperial converter |
| Straight Connector for 6 mm × 1/4″ Tube OD | McMaster-Carr | 5779 K258 | |
| Leica DMI 4000 B microscopy system | Leica | ||
| 63×/1.32 NA HCX PL APO oil objective | Leica | 506081 | |
| Hamamatsu Orca-Flash 4.0LT digital CMOS camera | Hamamatsu | C11440-42U | |
| Lumencor Spectra X light engine | Lumencor | With cyan and green/yellow light source | |
| Excitation beam splitter | Chroma | 59022bs | in the microscope |
| Hamamatsu W-view Gemini Image splitting optics | Hamamatsu | A12801-01 | to split green and red emission and project them on different areas on the camera chip |
| Emission beam splitter | Chroma | T570lpxr | in the image splitter |
| Emission filters GCamp6s | Chroma | ET525/50m | in the image splitter |
| Emission filters mCherry | Chroma | ET632/60m | in the image splitter |
Referanslar
- Eastwood, A. L., et al. Tissue mechanics govern the rapidly adapting and symmetrical response to touch. Proc. Natl. Acad. Sci. 15 (50), E6955-E6963 (2015).
- Katta, S., Krieg, M., Goodman, M. B. Feeling Force: Physical and Physiological Principles Enabling Sensory Mechanotransduction. Annu. Rev. Cell Dev. Biol. 31, 347-371 (2015).
- Krieg, M., Dunn, A. R., Goodman, M. B. Mechanical systems biology of C. elegans touch sensation. BioEssays. 37 (3), 335-344 (2015).
- Krieg, M., Dunn, A. R., Goodman, M. B. Mechanical control of the sense of touch by β-spectrin. Nat. Cell Biol. 16 (3), 224-233 (2014).
- Krieg, M., et al. Tensile forces govern germ-layer organization in zebrafish. Nat Cell Biol. 10 (4), 429-436 (2008).
- Gaub, B. M., Müller, D. J. Mechanical stimulation of Piezo1 receptors depends on extracellular matrix proteins and directionality of force. Nano Lett. 17 (3), 2064-2072 (2017).
- Geffeney, S. L., et al. DEG/ENaC but not TRP channels are the major mechanoelectrical transduction channels in a c. Elegans nociceptor. Neuron. 71 (5), 845-857 (2011).
- O'Hagan, R., Chalfie, M., Goodman, M. B. The MEC-4 DEG/ENaC channel of Caenorhabditis elegans touch receptor neurons transduces mechanical signals. Nat. Neurosci. 8 (1), 43-50 (2005).
- Suzuki, H., et al. In Vivo Imaging of C. elegans Mechanosensory Neurons Demonstrates a Specific Role for the MEC-4 Channel in the Process of Gentle Touch Sensation. Neuron. 39 (6), 1005-1017 (2003).
- Kopito, R. B., Levine, E. Durable spatiotemporal surveillance of Caenorhabditis elegans response to environmental cues. Lab Chip. 14 (4), 764-770 (2014).
- Chokshi, T. V., Ben-Yakar, A., Chronis, N. CO2 and compressive immobilization of C. elegans on-chip. Lab Chip. 9 (1), 151 (2009).
- Hulme, S. E., Shevkoplyas, S. S., McGuigan, A. P., Apfeld, J., Fontana, W., Whitesides, G. M. Lifespan-on-a-chip: microfluidic chambers for performing lifelong observation of C. elegans. Lab Chip. 10 (5), 589-597 (2010).
- Li, S., Stone, H. a., Murphy, C. T. A microfluidic device and automatic counting system for the study of C. elegans reproductive aging. Lab Chip. 15 (2), 524-531 (2015).
- Chokshi, T. V., Bazopoulou, D., Chronis, N. An automated microfluidic platform for calcium imaging of chemosensory neurons in Caenorhabditis elegans. Lab Chip. 10 (20), 2758-2763 (2010).
- Mishra, B., et al. Using microfluidics chips for live imaging and study of injury responses in Drosophila larvae. J. Vis. Exp. , e50998 (2014).
- Chronis, N., Zimmer, M., Bargmann, C. I. Microfluidics for in vivo imaging of neuronal and behavioral activity in Caenorhabditis elegans. Nat. Methods. 4 (9), 727-731 (2007).
- Krajniak, J., Lu, H. Long-term high-resolution imaging and culture of C. elegans in chip-gel hybrid microfluidic device for developmental studies. Lab Chip. 10 (14), 1862-1868 (2010).
- Vasquez, V., Krieg, M., Lockhead, D., Goodman, M. B. Phospholipids that Contain Polyunsaturated Fatty Acids Enhance Neuronal Cell Mechanics and Touch Sensation. CellReports. 6 (1), 70-80 (2013).
- Krieg, M., et al. Genetic defects in β-spectrin and tau sensitize C. elegans axons to movement-induced damage via torque-tension coupling. Elife. 6 (2010), e20172 (2017).
- Arnadóttir, J., O'Hagan, R., Chen, Y., Goodman, M. B., Chalfie, M. The DEG/ENaC protein MEC-10 regulates the transduction channel complex in Caenorhabditis elegans touch receptor neurons. J. Neurosci. 31 (35), 12695-12704 (2011).
- Lockhead, D., et al. The tubulin repertoire of Caenorhabditis elegans sensory neurons and its context-dependent role in process outgrowth. Mol. Biol. Cell. 27 (23), 3717-3728 (2016).
- Goodman, M. B., Ernstrom, G. G., Chelur, D. S., O'hagan, R., Yao, C. A., Chalfie, M. MEC-2 regulates C. elegans DEG/ENaC channels needed for mechanosensation. Nature. 415 (6875), 1039-1042 (2002).
- Nekimken, A., Fehlauer, H., Kim, A., Goodman, M., Pruitt, B. L., Krieg, M. Pneumatic stimulation of C. elegans mechanoreceptor neurons in a microfluidic trap. Lab Chip. , (2017).
- Brower, K., White, A. K., Fordyce, P. M. Multi-step Variable Height Photolithography for Valved Multilayer Microfluidic Devices. J. Vis. Exp. (119), e55276 (2017).
- Jenkins, G. Rapid prototyping of PDMS devices using SU-8 lithography. Methods Mol. Biol. 949 (1), 153-168 (2013).
- Faustino, V., Catarino, S. O., Lima, R., Minas, G. Biomedical microfluidic devices by using low-cost fabrication techniques: A review. J. Biomech. 49 (11), 2280-2292 (2016).
- Xia, Y., Whitesides, G. M. SOFT LITHOGRAPHY. Annu. Rev. Mater. Sci. 28 (1), 153-184 (1998).
- Chen, T. -. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Cho, Y., Porto, D., Hwang, H., Grundy, L., Schafer, W. R., Lu, H. Automated and controlled mechanical stimulation and functional imaging in vivo in C. elegans. Lab Chip. , (2017).
- Edwards, S. L., et al. A novel molecular solution for ultraviolet light detection in Caenorhabditis elegans. PLoS Biol. 6 (8), 1715-1729 (2008).
- Porta-de-la-Riva, M., Fontrodona, L., Villanueva, A., Cerón, J. Basic Caenorhabditis elegans methods: synchronization and observation. J. Vis. Exp. (64), e4019 (2012).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat. Methods. 9 (7), 676-682 (2012).
- Cho, Y., Porto, D. A., Hwang, H., Grundy, L. J. High-Throughput Controlled Mechanical Stimulation and Functional Imaging In Vivo. BiorXiv. , (2017).
- Petzold, B. C., Park, S. -. J., Mazzochette, E. A., Goodman, M. B., Pruitt, B. L. MEMS-based force-clamp analysis of the role of body stiffness in C. elegans touch sensation. Integr. Biol. (Camb). 5 (6), 853-864 (2013).
- Nekimken, A. L., Mazzochette, E. A., Goodman, M. B., Pruitt, B. L. Forces applied during classical touch assays for Caenorhabditis elegans. PLoS One. 12 (5), e0178080 (2017).
- Chronis, N., Zimmer, M., Bargmann, C. I. Microfluidics for in vivo imaging of neuronal and behavioral activity in Caenorhabditis elegans. Nat. Methods. 4 (9), 727-731 (2007).
- Gilleland, C. L., Rohde, C. B., Zeng, F., Yanik, M. F. Microfluidic immobilization of physiologically active Caenorhabditis elegans. Nat. Protoc. 5 (12), 1888-1902 (2010).
- Chuang, H. -. S., Raizen, D. M., Lamb, A., Dabbish, N., Bau, H. H. Dielectrophoresis of Caenorhabditis elegans. Lab Chip. 11 (4), 599 (2011).
- Christensen, A. M., Chang-Yen, D. A., Gale, B. K. Characterization of interconnects used in PDMS microfluidic systems. J. Micromechanics Microengineering. 15 (5), 928-934 (2005).
- Gilpin, W., Uppaluri, S., Brangwynne, C. P. Worms under Pressure: Bulk Mechanical Properties of C. elegans Are Independent of the Cuticle. Biophys. J. 108 (8), 1887-1898 (2015).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır