Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
С помощью микрофлюидика устройства для механической стимуляции и высокой резолюции визуализация C. elegans
* Эти авторы внесли равный вклад
В этой статье
Резюме
Новые инструменты для исследований mechanobiology нужно, чтобы понять как механическому активизирует биохимические пути и вызывает биологических реакций. Здесь мы представляем новый метод для селективного механической стимуляции подвижности животных с microfluidic ловушку, позволяя с высоким разрешением изображений клеточных реакций.
Аннотация
Одна центральная цель mechanobiology — понять взаимное влияние механических напряжений на белки и клетки. Несмотря на свою важность влияние механических напряжений на клеточную функцию еще плохо поняты. В частности этот пробел в знаниях существует потому, что некоторые инструменты позволяют одновременное деформации ткани и клетки, визуализации клеточной активности в живых животных, а также эффективное ограничение подвижности в противном случае мобильных модель организмов, таких как нематода Caenorhabditis elegans. Небольшой размер C. elegans делает их отличный матч для устройств на базе микрофлюидика исследований, и были представлены решения для иммобилизации, используя microfluidic приборы. Хотя эти устройства позволяют для изображений с высоким разрешением, животное полностью помещены в полидиметилсилоксан (PDMS) и стекла, ограничение физического доступа для доставки механической силы или электрофизиологических записей. Недавно мы создали устройство, которое интегрирует пневматические приводы с треппинга дизайн, который совместим с высоким разрешением флуоресцентной микроскопии. Срабатывание канал отделяется от червя треппинга канала Тонкая диафрагма PDMS. Эта диафрагма отклоняются в сторону червя, применяя давление от внешнего источника. Устройство можно ориентировать отдельных mechanosensitive нейронов. Активация этих нейронов образы в с высоким разрешением с показателями генетически закодированный кальция. Эта статья содержит общий метод с использованием штаммов C. elegans , выражая индикатор активности кальция чувствительных (GCaMP6s) в их сенсорный рецепторных нейронов (TRNs). Метод, однако, не ограничено TRNs, ни кальция датчики для тестирования, но может быть расширена до других механически чувствительные клетки или датчиков.
Введение
Осязание обеспечивает животных с важной информации об окружающей их среде. В зависимости от силы touch воспринимается как безобидные, приятным или болезненным. Ткани деформации во время касания определяется специализированных механорецептора клетки, встроенные в коже, которые Экспресс рецептор белков, наиболее часто иона каналы. Шаги, связывание силы восприятие ионного канала активации во время касания и боль полностью не поняты. Еще меньше известно о как ткани кожи фильтры механической деформации и ли механорецепторов обнаруживать изменения напряжения или подчеркнуть1,2,3. Этот разрыв в понимании возникает, в частности, из-за отсутствия подходящих инструментов для применения точной механической стимуляции к поверхности кожи живых животных соблюдая ответы на клеточном уровне. В то время как широко используется атомно-силовой микроскопии применяются и измерения силы в изолированных клеток4,5 , а также для того чтобы активировать Piezo1 рецепторов в живых клетках6, подобные эксперименты с использованием живых животных, особенно C. elegans, были крайне сложной из-за внутренней мобильности субъекта. Эта проблема традиционно обойти с помощью ветеринарной или хирургические класса Цианакрилатный клей для иммобилизации отдельных животных агар прокладки1,,78,9. Этот подход был продуктивным, но имеет ограничения, связанные с навыки, необходимые для иммобилизации, склеивания и поверхности мягкой агар механического соблюдения. Микрофлюидика стратегия является бесплатная альтернатива, которая позволяет избежать некоторых осложнений, связанных с склеивания.
Нематоду C. elegans является генетическим модельный организм с полностью сопоставленных нервной системы, которая, из-за размера животного, является подходящим для микрофлюидика технологии. Устройства на базе микрофлюидика предлагают преимущество, что в противном случае чрезвычайно мобильный животных может удерживаться во время выполнения с высоким разрешением изображения и доставки соответствующих нейро модулирующее раздражителей. С помощью microfluidic технологий, живущих животных может быть иммобилизованным без вреда10,11, включение мониторинга поведенческой активности за весь срок12,13 и с высоким разрешением Визуализация активности нейронов14,,1516,17. Кроме того, многие механорецептора нейронов, необходимые для чувство касания и боль можно охарактеризовать их физиологических1,8, Механическая4,18,19и молекулярных уровень20,21,22.
C. elegans чувства нежный механических раздражителей для ее стенки тела с помощью шести TRNs, три из которых иннервируют переднюю животного (ALML/R и АВМ) и три из которых иннервируют животного кзади (PLML/R и PVM). Ионного канала молекулы, необходимые для преобразователя усилие в биохимических сигнал были широко изучены в своем TRNs8. Эта статья представляет microfluidic платформа23 , что позволяет исследователям для применения точных механических сил к коже иммобилизованных C. elegans аскариды, при чтении из деформации ее внутренних тканей, оптических изображений. Помимо представления четкой механических раздражителей, кальция переходные процессы можно записан в механорецептора нейронов с субцеллюлярные резолюции и коррелирует с морфологической и анатомические особенности. Устройство состоит из центрального треппинга канала, который держит одиночного животного и представляет ее кожи рядом с шести каналов пневматического привода (рис. 1 и рис. 2). Шесть каналов расположены вдоль канала треппинга для доставки механических раздражителей для каждого из шести TRNs червя. Эти каналы отделены от камеры треппинга тонкой PDMS мембраны, которые могут управляться источника давления наружного воздуха (рис. 1). Мы калиброванные прогиб относительно давления и проведения измерений в этой статье. Каждый привода могут быть рассмотрены индивидуально и используется для стимулирования механорецептора выбора. Давление доставляется с помощью пьезо driven давление насоса, но любое альтернативное устройство может быть использовано. Мы покажем, что протокол давления может использоваться для активации TRNs в естественных условиях и продемонстрировать эксплуатации устройства, пригодные для доставки механических раздражителей для взрослых C. elegans, Загрузка взрослых животных в устройств, выполняющих кальция изображений эксперименты и анализа результатов. Изготовление устройство состоит из двух основных этапов: 1) Фотолитография сделать плесень от Су-8; и 2) формования PDMS сделать устройство. Ради краткости и ясности читатели упоминаются ранее опубликованные статьи и протоколы24,25 для получения инструкций о том, как для создания плесени и устройств.
протокол
1. устройство изготовление
- Загрузите файл прилагаемый маски (дополнительный файл 1) и создания хром маски с помощью службы коммерческой или собственного объекта. Как наименьший размер на устройстве составляет 10 мкм (толщина мембраны привода), убедитесь, что маска имеет достаточно высоким разрешением, в пределах ± 0,25 мкм, надежно производить функции.
-
Выполните стандартные методы фотолитографии Су-8 (например, ссылается на24,25,26) для изготовления пресс-формы для последующего производства PDMS устройств; Ниже приводится краткое изложение шагов.
Примечание: Су-8 представляет собой светочувствительный материал, который сшивки при воздействии ультрафиолетового света (максимальное поглощение ~ 365 Нм). Инструкции производителя можно используйте в качестве отправной точки для определения параметров обработки для софт выпекать, воздействия (УФ) и после выпечки.- Депозит Су-8 2002 на кремниевой пластины и спин пальто его приблизительный толщина 2 мкм, для улучшения адгезии мелких структур. Софт Выпекать на горячей плите за 1 мин на 95 ° C, слегка чрезмерно разоблачить (УФ) всю поверхность (~ 100 МДж/см2) и после выпечки на горячей плите 2 мин на 95 ° C.
- Спин шерсть 47-мкм толстый слой Су-8 2050 для определения функций устройства. Использовать скорость вращения 500 об/мин для 15 s (130 ускорение об/мин/сек) и затем 2000 об/мин 90 s (260 об/мин/с ускорение). При необходимости, повторить и отрегулировать скорость отжима для получения надлежащей толщины фоторезиста.
- Софт Выпекать на горячей плите 2 мин при температуре 65 ° C, а затем 7 мин на 95 ° C. Разоблачить фоторезиста согласно инструкции производителя (~ 160 МДж/см2) с использованием Хром маски и Лонг pass фильтр для обеспечения прямой боковые стенки.
- Извлеките пластины и после выпечки на горячей плите для 1 мин при температуре 65 ° C и 7 минут при 95 ° C.
- Растворите неэкспонированные Су-8 с разработчиком и чистый с 2-пропанол.
- Выпекать пластин на конфорку на 180 ° C в течение 30 мин (жесткий испеките) для стабилизации фоторезиста функции.
-
Делать PDMS реплики из Су-8 модели, используя стандартный реплики, литье методы27.
- Лечения Су-8 формы с trichloromethylsilane (ВТК) паров для PDMS адгезию (silanization).
Предупреждение: ВТК токсичных и реагирующие с водой.- Место узорной пластин в стойку пластин в пределах колпаком вакуумного эксикатора в Зонта свободной воды или водорастворимый реагентов.
- Под капотом используйте капельницы применять 1 капля ВТК стеклянную посуду и поместите в эксикаторе.
- Закройте крышку эксикаторе и позволяют ВТК пара для смазывания пластин для по крайней мере 20 мин.
- Выход, а затем открыть эксикаторе. Открыть крышку колпаком и удалить пластин, с помощью пластиковых пинцета. Поместите в Петри или алюминиевая фольга лодку для PDMS реплики литья. Распоряжаться ВТК покрытием материалов в надлежащей опасных отходов.
- Mix PDMS (в соотношении 10:1) с использованием 40 g базового полимера и 4 g PDMS полимеризации агента.
- Смесь залить Су-8 плесени и Дега смесь для по крайней мере 30 минут в вакуумной камере.
- Cure для по крайней мере 6 ч при 70 ° C в духовке.
- Лечения Су-8 формы с trichloromethylsilane (ВТК) паров для PDMS адгезию (silanization).
- Поднимите PDMS вафля, установив горизонтальные пластины на плоской поверхности и тщательно отшелушивающим PDMS. Не сгибайте Вафля вверх во время этого шага, как он может разорвать плесень.
Примечание: Неполные адгезии Су-8 пластин или неполной silanization может привести к разрушению Су-8 структур во время этого шага. - Нарежьте PDMS вокруг устройства отдельных чипов таким образом, что устройства поместится на coverslip 24 x 60 мм.
- С помощью 1-мм биопсии удар, сделайте отверстия в входе, две розетки и шесть приводов с использованием 1-мм биопсии удар. Цель 2 мм Диаметр кругов по краям устройства.
-
Бонд PDMS чипов стекла Крышка скользит.
- Разоблачить обе поверхности до 80 W кислорода плазмы (30 s).
- Осторожно поместите подвергается поверхности PDMS на внешней поверхности скольжения обложки для конформных печати.
- Отжиг устройства на горячей плите (100 ° C, 10 мин).
Примечание: Недостаточная связь может привести к провалу устройства из-за утечки.
2. Подготовка микроскопа
Примечание: Трансгенных животных: Экспресс кальция индикатор, например GCaMP6s28 или других генетически закодированный деятельности зонд в neuron(s) интереса (например, РНН); Совместное Экспресс деятельность независимые флуоресцентный белок, излучающих в другой волны исправить для небольших боковых и вне фокуса движение артефакты, которые возникают из-за механической стимуляции. Программное обеспечение для автоматизированного анализа отслеживает и компенсирует движение индуцированные изменения в интенсивности деятельности зонда. Червь штаммов GN69223 (или AQ323629) Экспресс GCaMP6s (или GCaMP6m) и кальция независимые tagRFP под контролем promotor mec-7. Кроме того GN692 содержит мутации lite-1(ce314), который предотвращает активацию TRNs благодаря голубой световой датчик lite-130 во время возбуждения флуоресценции GCaMP6s23.
-
Создать систему микроскоп для одновременного возбуждения GCaMP и ППП.
- Использовать постоянный источник света и двухдиапазонный возбуждения фильтр, который пропускает только голубой и желтый свет, или источник света, который излучает только длин волн в определенной пропускной способности таких одновременных голубой (0,77 МВт) и желтого (1.21 МВт) светодиодные источники возбуждения для одновременного возбуждения флуоресценции кальций зависимых и независимых, соответственно.
- Использование цифровой камеры для включения записи микроскопии изображений.
Примечание: Большинство камер поставляются с программным обеспечением для захвата изображений. Кроме того есть свободно доступного программного обеспечения, который может использоваться для управления камерой и, возможно, другие части системы микроскопии. - Отрегулируйте интенсивность возбуждения, основанный на интенсивности флуоресценции чтобы избежать насыщения камеры.
-
Используете, в зависимости от выбора источника возбуждения должен быть оснащен фильтром возбуждения флуоресценции куб.
Примечание: 488 нм GFP и 580 Нм mCherry возбуждения фильтр был использован здесь.- Добавление splitter луча в куб для отражения голубой и желтый свет и препровождающее зеленый и красный свет.
- Оборудовать микроскоп с 10 X цель и цель высокого увеличения (например, 63 X / 1.32 NA нефти) сосредоточиться возбуждения света на образце.
- Смонтируйте splitter луча перед камерой для одновременной записи GCaMP и кальция независимые сигнала. Убедитесь, что splitter луча дихроичное зеркало (длинный пас, отсечение по 570 Нм) отделить красный и зеленый свет, с использованием одного фильтра выбросов для зеленого (пропускания центрированного 525 Нм с шириной 50 Нм) и один выбросов фильтр на красный свет (пропускания центрированного 632 нанометр с 60 Нм ширина).
- Проект зеленой и красной флуоресценцией на верхней половине (зеленый) и нижней половины (красный), соответственно из камеры чип (см. рис. 3). Эта ориентация является необходимым условием для предоставленного анализа программного обеспечения.
3. животных подготовка
- Подготовить синхронизированы возраст молодых взрослых или взрослый день один C. elegans, как описано ранее, порта де ла Рива и др. 31
- Подготовьте microfluidic чип.
- Подключение потока водохранилище гравитации (~ 60 см выше уровня чип) содержит отфильтрованные буфера M9 (0,2 мкм Полиэфирсульфон шприц фильтр) к одной розетке чипа. Подключите другой выход к одной розетке контейнер для отходов двух розетки, то есть, в колбу фильтра. Подключение на выходе из отходов контейнер к перистальтического насоса.
Примечание: Используйте полиэтилен (ПЭ) труб для всех подключений и металлические трубы для подключения труб PE на чип. Таким образом все отходы решения будет вспыхнул из чипа и собираются в контейнер для отходов. Поток, проходящий через каналы выход создает нежный всасывания, который будет держать червя плотно во время процесса более поздних треппинга. - Подготовить приближающую состоящий из 50-мм длиной ПЭ трубы (0.9652-мм OD, ID 0.5842-мм) с металлической трубки (манометрическое размер 23TW, 0.635-мм OD) на обоих концах. Пресс подходят эти соединения в каждой из шести пальцев срабатывания и входе червь (см. Рисунок 1). Оставьте эти Энергообъединение в чип, как неоднократные удаления приводит к носить на PDMS отверстия.
- Подключение потока водохранилище гравитации (~ 60 см выше уровня чип) содержит отфильтрованные буфера M9 (0,2 мкм Полиэфирсульфон шприц фильтр) к одной розетке чипа. Подключите другой выход к одной розетке контейнер для отходов двух розетки, то есть, в колбу фильтра. Подключение на выходе из отходов контейнер к перистальтического насоса.
- Установите фишку на микроскопе. Получить 2 – 5 червей в каплю отфильтрованных буфера M9 (0,2 мкм шприц фильтр) и использовать 1 мл шприц, чтобы втянуть их в ПЭ трубы (0.9652-мм OD, ID 0.5842-мм), подключен к 1 мл шприц, осторожно потянув поршень. Держите животных в PE трубки, а не в шприц.
Примечание: Слишком много червей или нефильтрованную решения в чип может привести к засорению. - ПЭ трубы шприца для соединения на входе червь (рис. 1 и рис. 2) Подключите чипа. Активировать самотечный поток, открыв клапан и начать Перистальтический насос. Затем осторожно нажмите шприце поршень шприца для перемещения животных в канал треппинга соблюдая канал под микроскопом с объективом 10 X в brightfield режиме.
Примечание: Иногда появляются пузырьки воздуха не представляют собой проблему; они обычно автоматически перемещаются в розетку. Некоторые животные могут быть «стоянке» в зале ожидания и используются последовательно.- После загрузки животное в канал треппинга (см. также рис. 2), отрегулируйте его положение, осторожно нажимать или вытягивать поршень шприца, чтобы положение головы животного в конической формы передней части канала.
- Убедитесь в том, что червь (взрослый день 1) имеет правильный размер, чтобы быть в ловушке в чипе.
- Если червь не заполняют весь сечение канала от носа до ближе к концу тела (не включая кончик хвоста) или червь движется вдоль оси канала без перемещения на поршень шприца , удаления червя, нажимая на поршень шприца, до тех пор, пока она исчезает из канала треппинга и загрузить новый (см. шаг 3,8).
- Переключиться в режим флуоресцентным микроскопом и выше увеличение объектива (40 X или выше) и проверить ли neurite нейрона интереса приходит лежать через диафрагму одного из приводов. Если нет, то отрегулировать положение животного, потянув или толкает поршень. Если это не помогает, удалите червь и загрузить новую.
- Сосредоточиться на клеток тело нейрона интерес и Подключите соединительный кабель привода ближе к нейрон на передней стороне тела клетки к программируемой давление насоса с помощью трубы PE.
- Если эксперимент требует, измерение расстояния между приводом и нейрон, переместить поле зрения, так как находятся в поле зрения и channelwall параллельно верхнего и нижнего края изображения.
- Определите давление протокол, с помощью программируемых давления насоса.
Примечание: Этот протокол можно подобрать нужный эксперимент.- Начните с постоянным давлением 0 кПа для времени, соответствующий по крайней мере 50 изображений последовательности изображений (необходимых для нормализации). Для изображений частота 10 Гц это соответствует 5 s. добавить требуемый стимул сигнала и давление и определить длину стимул в качестве второго шага.
Примечание: Для стимулирования TRNs, синусоидального сигнала (т.е., 75 кПа, 10 Гц) накладывается с шагом (т.е., 275 kPa) рекомендуется как он создает большой ответ нейронов. - Если эксперимент требует дополнительных стимулов, включают в течение по крайней мере 10 s при постоянном давлении 0 кПа между раздражителей. Перед включением давление насоса, убедитесь, что инструмент давления находится в постоянном 0 кПа во избежание случайного стимуляции червя до фактической эксперимент.
- Начните с постоянным давлением 0 кПа для времени, соответствующий по крайней мере 50 изображений последовательности изображений (необходимых для нормализации). Для изображений частота 10 Гц это соответствует 5 s. добавить требуемый стимул сигнала и давление и определить длину стимул в качестве второго шага.
- Запустите протокол изображений и давления.
- В программное обеспечение приобретения изображения камеры настроить последовательность изображений на 10 Гц, с использованием Выдержка 100 мс для продолжительности давление протокола. Отрегулируйте интенсивность возбуждения, таким образом, что увеличение максимальной флуоресценции не насыщают камеры. Сохранение изображений в формате *.tif с по крайней мере 50 изображений перед первым стимулом для нормализации.
- Начало изображений протокол в приобретение изображений программное обеспечение и давление протокол в программном обеспечении программируемый насоса. Во время записи, соблюдайте ли нейрон интерес яркое пятно в районе 10 x 10 точек, не двигаться дальше, чем 10 пикселей в последовательных изображений и остается в поле зрения во время записи.
Примечание: Если это не сделано, программное обеспечение для анализа завершится неудачей. Яркие пятна (то есть, Аутофлюоресценция) вокруг нейрон сделать чистой записи трудно нейронов. Чтобы это исправить, удалите червь из ловушки и загрузить новый червь в чипе. Если червь движется слишком много, попробуйте новую запись же червя и наблюдать движение червя. Если проблема не устранена червь может быть слишком мал, чтобы быть в ловушке. В этом случае удалить этот вирус и загрузки немного больше червя в ловушку. - При желании, запись сигналы от нескольких нейронов в поле зрения одновременно до тех пор, как нейроны разделены по крайней мере 10 пикселей во время всей записи.
- Расследовать привыкания, выполните эксперимент многократно на животных.
- Удаление червя из канала треппинга.
- Если желательно сохранить червь для последующего исследования, отсоедините точек чип к самотечный поток и контейнер для отходов. Аккуратно нажмите поршень шприца до тех пор, пока весь червь выталкивается через треппинга канал в канал потока.
- Нажимайте на поршень шприца до тех пор, пока животное появляется в капельку вне чип. Отсоедините шприц, включая ПЭ трубы на входе в систему червь, использовать его для аспирационная червей в капли и передаче его на тарелку агар.
- Если это нежелательно держать червя, удаления червя, нажимая на поршень шприца, до тех пор, пока весь червь выталкивается через треппинга канал в канал потока; Самотечный поток и всасывания Перистальтический насос будет нести животное из чипа и в контейнер для отходов.
4. анализ
- Скачать и установить новые версии Фиджи32.
- Загрузите и установите последнюю версию java SDK.
Примечание: В случае необходимости, удалить или переименовать папку java внутри папки Фиджи для Фиджи использовать недавно установленной java-компилятор. -
Программное обеспечение с открытым Фиджи.
- Проверить, работает ли программное обеспечение недавно установленной java-компилятор, открыв ' плагины | Утилиты | ImageJ | Свойства.
- Скачать файл pokinganalyzer*.java (https://github.com/HFehlauer/Poking-Analyzer, см. Дополнительные 2 файла).
- Перетащите и drop .java-файл в окне программного обеспечения, чтобы открыть его как плагин.
-
Скомпилируйте и запустите файл pokinganalyzer*.java, нажав клавиши Ctrl + R в Фиджи; графический интерфейс пользователя (тыкать анализатор) откроет (рис. 3).
- Нажмите на вкладку «Справка» и читать о требованиях программного обеспечения и как для выполнения анализа. Чтобы начать, выберите вкладку «Open video» укажите расположение видео файлов для анализатора: нажмите кнопку «Открыть видео», перейдите к местоположению видео и открыть его.
Примечание: Программное обеспечение начинается с этой вкладкой открыт. Если он не открыт, при запуске нового анализа перейдите на вкладку «Open video». Если видео имеет формат a.tif, программа будет внутренне открыть видео и отображать первое изображение в нижней части интерфейса. Если изображение не видео, которое необходимо проанализировать, нажмите на кнопку «Открыть видео», чтобы открыть еще один видео. - Чтобы продолжить, нажмите на вкладке «Определить ROIs». В этой вкладке определяют позицию TRN. Обратите внимание, что первое изображение открыл видео отображается в нижней части этой tab. Нажмите на кнопку «Определить TRN» и нажмите на нейрон в верхней части изображения, которая должна отображать GCaMP флуоресценции.
- Необязательно: Если привод виден в верхней половине изображения программа может автоматически отслеживать расстояние между нейрон и привода при желании. Для этого проверьте «Определить привода»? -коробки, нажмите на кнопку «Определить привода» и нажмите на привод в верхней части изображения.
- Нажмите на вкладку «Анализ» определить стоимость приобретения изображения. Введите число в поле или нажмите кнопку вверх или вниз для увеличения или уменьшения числа. Если в предыдущей вкладке «Определить привода»? -установлен флажок, определить размер ячейки камеры, масштаб и биннинга фактор, поэтому программа может рассчитать расстояние.
- Нажмите на кнопку «Начать анализ».
Примечание: Программа теперь будет отслеживать нейрон, его флуоресценции в последовательности изображений в верхней половине (кальций-зависимых) и в нижней половине (кальция независимых) из последовательности изображений. Для учета движения нейрон в плоскости запись программы будет расследовать площадью 10 x 10 точек вокруг расположение нейрон в предыдущем изображении найти положение нейрона на следующем рисунке. Он будет вычислить флуоресценции в обеих половинах, исправляя для флуоресценции фон (Fbg) и деления на флуоресценции в первых 50 изображений (0F):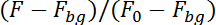
Флуоресценции изменения в зеленый, зависит от активности канала (FCa2 +), которые вызваны нейрон движения из плоскости по перекодирования являются затем корректируются с помощью флуоресценции в красный, деятельность независимый канал (F Корр) и предварительно стимул стандартное отклонение кальций зависимые (sdCa2 +) и независимых флуоресцирования (sdКорр):
- Программа покажет ход его выполнения в строке состояния в нижней части интерфейса; когда в строке состояния достигает 100%, нажмите на вкладке «Результаты». Если в строке состояния останавливается до 100%, программа даст сообщение об ошибке, указывающее причину, по которой программа не может анализировать видео.
- Если соотношение сигнал-шум является слишком низким, программа не может идентифицировать нейрона; Параметры обработки изображений в последующих записях.
- Если нейрон покидает поле зрения во время записи, программа не может отслеживать его больше и остановится. Для последующих записей место нейрон в середине поля зрения в начале записи.
- Если некоторые регионы в поле зрения перенасыщен, автоматизированный анализ будет производить неправильные результаты. Для последующих записей убедитесь, что флуоресценции сигнал не насыщают сенсора камеры.
- На вкладке «Результаты» результат отображается в верхней части. Сохраните файл *.txt, табуляцией таблицы результатов, нажав на «Сохранить таблицы результатов».
Примечание: Эта таблица состоит из времени в секундах и нормализованных кальций зависимых флюоресценция (исправлены флуоресценции кальция независимых). Если определен ранее, он также содержит общее расстояние между РНН и привода в мкм и расстояние между РНН и привода, перпендикулярно стене канала в мкм. Представитель результаты интенсивности флуоресценции увеличение после стимуляция против расстояние клетки тела к ближайшим привода строятся на рисунке 4. - Если есть несколько нейронов в одной записи (разделенных более чем 10 пикселей), снова нажмите на вкладке «Определить ROIs» и вернуться к шагу 4.6.2 с второй нейрон.
- Нажмите на вкладку «Справка» и читать о требованиях программного обеспечения и как для выполнения анализа. Чтобы начать, выберите вкладку «Open video» укажите расположение видео файлов для анализатора: нажмите кнопку «Открыть видео», перейдите к местоположению видео и открыть его.
Результаты
Су-8 литографии и склеивание стружки
Литография протокол и формования PDMS следуют стандартные процедуры. Подробности можно найти в других23,24,25,26. PDMS следует очистить от пластин без проблем ...
Обсуждение
Этот протокол демонстрирует метод для доставки точной механической стимуляции кожи аскариды, захваченных в microfluidic чип. Он предназначен для облегчения интеграции физических стимулов для ответов на вопросы биологического и стремится рационализировать mechanobiology исследований в области б...
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Мы благодарим Сандра н. Маносалвас-Kjono, Ladpli Пурим, Фарах Мемон, Дивья Gopisetty и Вероника Санчес для поддержки в конструкции устройства и поколение мутанта животных. Это исследование было поддержано NIH грантов R01EB006745 (БЛП), R01NS092099 (для MBG), K99NS089942 (для МК), F31NS100318 (для ALN) и получил финансирование от Европейского Совета исследований (ERC) под Европейского союза Horizon 2020 исследований и инноваций программы () Грантовое соглашение № 715243 в МК).
Материалы
| Name | Company | Catalog Number | Comments |
| Chrome mask | Compugraphics (http://www.compugraphics-photomasks.com/) | 5'', designed in AutoCAD (Autodesk, Inc.) | |
| Chrome mask | Mitani-Micronics (http://www.mitani-micro.co.jp/en/) | 5'', designed in AutoCAD (Autodesk, Inc.) | |
| Chrome mask | Kuroda-Electric (http://www.kuroda-electric.eu/ | 5'', designed in AutoCAD (Autodesk, Inc.) | |
| 4'' Silicon wafer (B-test) | Stanford Nanofabrication Facility | ||
| SU-8 2002 | MicroChem | ||
| SU-8 2050 | MicroChem | ||
| Spin-coater | Laurell Technologies | WS-400BZ-6NPP/LITE | |
| Exposure timer | Optical Associates, Inc | OAI 150 | |
| Illumination controller | Optical Associates, Inc | 2105C2 | |
| SU-8 developer | MicroChem | ||
| 2-Propanol | Fisher Scientific | A426F-1GAL | |
| Acetone | Fisher Scientific | A18-4 | |
| Trichloromethylsilane (TCMS) | Sigma-Aldrich | 92361-500ML | Caution: TCMS is toxic and water-reactive |
| Sylgard 184 Elastomer Kit | Dow Corning | PDMS prepolymer | |
| Biopsy punch, 1 mm | VWR | 95039-090 | |
| Oxygen Plasma Asher | Branson/IPC | ||
| Small metal tubing (0.635 mm OD, 0.4318 mm ID, 12.7 mm long); gage size 23TW | New England Small Tube Corporation | NE-1300-01 | |
| Nalgene syringe filter, 0.22 μm | Thermo Scientific | 725-2520 | to filter all solution, small particles would clog the chip |
| Polyethylene tubing; 0.9652 mm OD, 0.5842 mm ID | Solomon Scientific | BPE-T50 | |
| Syringe, 1 ml | BD Scientific | 309628 | for worm trapping and release |
| Syringe, 20 ml | BD Scientific | 309661 | for gravity-based flow |
| Gilson Minipuls 3, Peristaltic pump | Gilson | to suck solutions and worms out of the chip | |
| Microfluidic flow controller, equipped with 0–800 kPa pressure channel | Elveflow | OB1 MK3 | pressure delivery |
| Water-Resistant Clear Poly- urethane Tubing, 4 mm ID and 6 mm OD | McMaster-Carr | 5195 T52 | connection from house air to pressure pump |
| Water-Resistant Clear Polyurethane Tubing, 2.6mm ID and 4mm OD | McMaster-Carr | 5195 T51 | connect pressure pump to small tubng |
| Push-to-Connect Tube Fitting for Air | McMaster-Carr | 5111K468 | metric - imperial converter |
| Straight Connector for 6 mm × 1/4″ Tube OD | McMaster-Carr | 5779 K258 | |
| Leica DMI 4000 B microscopy system | Leica | ||
| 63×/1.32 NA HCX PL APO oil objective | Leica | 506081 | |
| Hamamatsu Orca-Flash 4.0LT digital CMOS camera | Hamamatsu | C11440-42U | |
| Lumencor Spectra X light engine | Lumencor | With cyan and green/yellow light source | |
| Excitation beam splitter | Chroma | 59022bs | in the microscope |
| Hamamatsu W-view Gemini Image splitting optics | Hamamatsu | A12801-01 | to split green and red emission and project them on different areas on the camera chip |
| Emission beam splitter | Chroma | T570lpxr | in the image splitter |
| Emission filters GCamp6s | Chroma | ET525/50m | in the image splitter |
| Emission filters mCherry | Chroma | ET632/60m | in the image splitter |
Ссылки
- Eastwood, A. L., et al. Tissue mechanics govern the rapidly adapting and symmetrical response to touch. Proc. Natl. Acad. Sci. 15 (50), E6955-E6963 (2015).
- Katta, S., Krieg, M., Goodman, M. B. Feeling Force: Physical and Physiological Principles Enabling Sensory Mechanotransduction. Annu. Rev. Cell Dev. Biol. 31, 347-371 (2015).
- Krieg, M., Dunn, A. R., Goodman, M. B. Mechanical systems biology of C. elegans touch sensation. BioEssays. 37 (3), 335-344 (2015).
- Krieg, M., Dunn, A. R., Goodman, M. B. Mechanical control of the sense of touch by β-spectrin. Nat. Cell Biol. 16 (3), 224-233 (2014).
- Krieg, M., et al. Tensile forces govern germ-layer organization in zebrafish. Nat Cell Biol. 10 (4), 429-436 (2008).
- Gaub, B. M., Müller, D. J. Mechanical stimulation of Piezo1 receptors depends on extracellular matrix proteins and directionality of force. Nano Lett. 17 (3), 2064-2072 (2017).
- Geffeney, S. L., et al. DEG/ENaC but not TRP channels are the major mechanoelectrical transduction channels in a c. Elegans nociceptor. Neuron. 71 (5), 845-857 (2011).
- O'Hagan, R., Chalfie, M., Goodman, M. B. The MEC-4 DEG/ENaC channel of Caenorhabditis elegans touch receptor neurons transduces mechanical signals. Nat. Neurosci. 8 (1), 43-50 (2005).
- Suzuki, H., et al. In Vivo Imaging of C. elegans Mechanosensory Neurons Demonstrates a Specific Role for the MEC-4 Channel in the Process of Gentle Touch Sensation. Neuron. 39 (6), 1005-1017 (2003).
- Kopito, R. B., Levine, E. Durable spatiotemporal surveillance of Caenorhabditis elegans response to environmental cues. Lab Chip. 14 (4), 764-770 (2014).
- Chokshi, T. V., Ben-Yakar, A., Chronis, N. CO2 and compressive immobilization of C. elegans on-chip. Lab Chip. 9 (1), 151 (2009).
- Hulme, S. E., Shevkoplyas, S. S., McGuigan, A. P., Apfeld, J., Fontana, W., Whitesides, G. M. Lifespan-on-a-chip: microfluidic chambers for performing lifelong observation of C. elegans. Lab Chip. 10 (5), 589-597 (2010).
- Li, S., Stone, H. a., Murphy, C. T. A microfluidic device and automatic counting system for the study of C. elegans reproductive aging. Lab Chip. 15 (2), 524-531 (2015).
- Chokshi, T. V., Bazopoulou, D., Chronis, N. An automated microfluidic platform for calcium imaging of chemosensory neurons in Caenorhabditis elegans. Lab Chip. 10 (20), 2758-2763 (2010).
- Mishra, B., et al. Using microfluidics chips for live imaging and study of injury responses in Drosophila larvae. J. Vis. Exp. , e50998 (2014).
- Chronis, N., Zimmer, M., Bargmann, C. I. Microfluidics for in vivo imaging of neuronal and behavioral activity in Caenorhabditis elegans. Nat. Methods. 4 (9), 727-731 (2007).
- Krajniak, J., Lu, H. Long-term high-resolution imaging and culture of C. elegans in chip-gel hybrid microfluidic device for developmental studies. Lab Chip. 10 (14), 1862-1868 (2010).
- Vasquez, V., Krieg, M., Lockhead, D., Goodman, M. B. Phospholipids that Contain Polyunsaturated Fatty Acids Enhance Neuronal Cell Mechanics and Touch Sensation. CellReports. 6 (1), 70-80 (2013).
- Krieg, M., et al. Genetic defects in β-spectrin and tau sensitize C. elegans axons to movement-induced damage via torque-tension coupling. Elife. 6 (2010), e20172 (2017).
- Arnadóttir, J., O'Hagan, R., Chen, Y., Goodman, M. B., Chalfie, M. The DEG/ENaC protein MEC-10 regulates the transduction channel complex in Caenorhabditis elegans touch receptor neurons. J. Neurosci. 31 (35), 12695-12704 (2011).
- Lockhead, D., et al. The tubulin repertoire of Caenorhabditis elegans sensory neurons and its context-dependent role in process outgrowth. Mol. Biol. Cell. 27 (23), 3717-3728 (2016).
- Goodman, M. B., Ernstrom, G. G., Chelur, D. S., O'hagan, R., Yao, C. A., Chalfie, M. MEC-2 regulates C. elegans DEG/ENaC channels needed for mechanosensation. Nature. 415 (6875), 1039-1042 (2002).
- Nekimken, A., Fehlauer, H., Kim, A., Goodman, M., Pruitt, B. L., Krieg, M. Pneumatic stimulation of C. elegans mechanoreceptor neurons in a microfluidic trap. Lab Chip. , (2017).
- Brower, K., White, A. K., Fordyce, P. M. Multi-step Variable Height Photolithography for Valved Multilayer Microfluidic Devices. J. Vis. Exp. (119), e55276 (2017).
- Jenkins, G. Rapid prototyping of PDMS devices using SU-8 lithography. Methods Mol. Biol. 949 (1), 153-168 (2013).
- Faustino, V., Catarino, S. O., Lima, R., Minas, G. Biomedical microfluidic devices by using low-cost fabrication techniques: A review. J. Biomech. 49 (11), 2280-2292 (2016).
- Xia, Y., Whitesides, G. M. SOFT LITHOGRAPHY. Annu. Rev. Mater. Sci. 28 (1), 153-184 (1998).
- Chen, T. -. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Cho, Y., Porto, D., Hwang, H., Grundy, L., Schafer, W. R., Lu, H. Automated and controlled mechanical stimulation and functional imaging in vivo in C. elegans. Lab Chip. , (2017).
- Edwards, S. L., et al. A novel molecular solution for ultraviolet light detection in Caenorhabditis elegans. PLoS Biol. 6 (8), 1715-1729 (2008).
- Porta-de-la-Riva, M., Fontrodona, L., Villanueva, A., Cerón, J. Basic Caenorhabditis elegans methods: synchronization and observation. J. Vis. Exp. (64), e4019 (2012).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat. Methods. 9 (7), 676-682 (2012).
- Cho, Y., Porto, D. A., Hwang, H., Grundy, L. J. High-Throughput Controlled Mechanical Stimulation and Functional Imaging In Vivo. BiorXiv. , (2017).
- Petzold, B. C., Park, S. -. J., Mazzochette, E. A., Goodman, M. B., Pruitt, B. L. MEMS-based force-clamp analysis of the role of body stiffness in C. elegans touch sensation. Integr. Biol. (Camb). 5 (6), 853-864 (2013).
- Nekimken, A. L., Mazzochette, E. A., Goodman, M. B., Pruitt, B. L. Forces applied during classical touch assays for Caenorhabditis elegans. PLoS One. 12 (5), e0178080 (2017).
- Chronis, N., Zimmer, M., Bargmann, C. I. Microfluidics for in vivo imaging of neuronal and behavioral activity in Caenorhabditis elegans. Nat. Methods. 4 (9), 727-731 (2007).
- Gilleland, C. L., Rohde, C. B., Zeng, F., Yanik, M. F. Microfluidic immobilization of physiologically active Caenorhabditis elegans. Nat. Protoc. 5 (12), 1888-1902 (2010).
- Chuang, H. -. S., Raizen, D. M., Lamb, A., Dabbish, N., Bau, H. H. Dielectrophoresis of Caenorhabditis elegans. Lab Chip. 11 (4), 599 (2011).
- Christensen, A. M., Chang-Yen, D. A., Gale, B. K. Characterization of interconnects used in PDMS microfluidic systems. J. Micromechanics Microengineering. 15 (5), 928-934 (2005).
- Gilpin, W., Uppaluri, S., Brangwynne, C. P. Worms under Pressure: Bulk Mechanical Properties of C. elegans Are Independent of the Cuticle. Biophys. J. 108 (8), 1887-1898 (2015).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены