JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
기계적 자극 및 높은 해상도 C. 선 충 의 이미징에 대 한 마이크로 장치를 사용 하 여
* 이 저자들은 동등하게 기여했습니다
요약
Mechanobiology 연구에 대 한 새로운 도구 어떻게 기계적 스트레스를 이해 하는 데 필요한 생화학 경로 활성화 하 고 elicits 생물학 응답. 여기, 우리 세포 응답의 고해상도 이미지를 수 있도록 미세 트랩으로 움직이지 동물의 선택적 기계적 자극에 대 한 새로운 방법을 전시.
초록
Mechanobiology의 한 중앙 목표 단백질 및 세포에 기계적 스트레스의 상호 효과 이해 하는 것입니다. 그 중요성에도 불구 하 고 세포질 기능에 기계적 스트레스의 영향이 아직도 제대로 이해 된다. 몇 가지 도구를 사용 하면 조직과 세포의 동시 변형, 생체, 세포 활동의 이미지와 달리 매우 모바일 모형 유기 체, 선 충 류 등 운동 성의 효율적 제한 때문에이 기술 격차 존재 하는 부분에서 꼬마 선 충. C. 선 충 의 작은 크기에 게 그들 훌륭한 일치 하는 마이크로-기반 연구 장치, 그리고 동원 정지에 대 한 솔루션 제시 된 미세 장치를 사용 하 여. 이 장치 고해상도 이미징에 대 한 허용, 동물 완전히입니다 (PDMS) 및 기계적 힘 또는 electrophysiological 녹음의 배달에 대 한 물리적 액세스를 제한 하는 유리에 쌌 다. 최근, 우리 고해상도 형광 현미경과 호환 되는 트래핑 디자인 공 압 액츄에이터를 통합 하는 장치를 만들었습니다. 작동 채널 벌레 트랩 채널에서 얇은 PDMS 격 막에 의해 구분 됩니다. 이 다이어 프이 램은 외부 소스에서 압력을 적용 하 여 벌레의 측으로 편향. 장치는 개별 mechanosensitive 신경을 대상 수 있습니다. 이러한 뉴런의 활성화에 몇 군데 유전자 인코딩 칼슘 지표와 고해상도. 이 문서는 그들의 터치 수용 체 신경 (TRNs)에 있는 칼슘-민감한 작동 표시등 (GCaMP6s)를 표현 하는 C. 선 충 종자를 사용 하 여 일반적인 메서드를 제공 합니다. 메서드를 조사로 TRNs도 칼슘 센서에 국한 되지 않습니다 하지만 다른 기계적으로 민감한 세포 또는 센서에 확장 될 수 있다.
서문
터치의 감각 동물을 그들의 환경에 대 한 중요 한 정보를 제공합니다. 적용 된 힘에 따라 터치 인식으로 무해 한, 즐거운, 또는 고통 스러운. 터치 하는 동안 조직 변형 전문된 mechanoreceptor 세포는 피부에 포함 된 가장 일반적으로 이온 채널, 수용 체 단백질을 표현 하 여 감지 됩니다. 터치와 고통 중에 이온 채널 활성화를 연결 하는 힘 인식 단계는 완전히 이해 되지 않는다. 심지어 어떻게 피부 조직을 기계적 변형 및 몸의 긴장에 있는 변화를 탐지 여부 필터 또는1,2,3스트레스에 대 한 알려져 있다. 이해에이 간격, 부분적으로, 세포 수준에서 응답을 관찰 하는 동안 정확한 기계적 stimulations 살아있는 동물의 피부 표면에 적용할 적당 한 도구의 부족에서 발생 합니다. 원자 힘 현미경 검사 법 사용 되었습니다 광범위 하 게 적용 하 고 격리 된 셀4,5 에 힘을 측정 하 고 또한 생활에 있는 Piezo1 수용 체를 활성화 하는 반면 세포6을 비슷한 실험 특히 살아있는 동물을 사용 하 여 C. 선 충, 악명 때문에 피사체의 본질적인 이동성 도전 되었습니다. 이 문제는 전통적으로 무력화 한 천 패드1,7,,89에 개별 동물을 동물 또는 외과-급 cyanoacrylate 접착제를 사용 하 여 피할. 이 접근은 생산성, 되었지만 접착 및 기계적 규격에 소프트 한 표면에 의해 동원 정지에 필요한 기술에 관련 된 제한 사항에는. 마이크로 전략 gluing에 연결 하는 합병증 중 일부를 피할 수 있는 무료 대안 이다.
선 충 류 선 충 C. 완전히 매핑된 신 경계를, 동물의 크기 때문에 적합 한 마이크로 기술 유전자 모델 생물 이다. 마이크로-기반 장치 그렇지 않으면 매우 모바일 동물 고해상도 이미징 및 관련 modulatory 신경 자극의 전달을 수행 하는 동안 제 지 될 수 있는 이점 제공 합니다. 미세의 도움으로 기술, 동물 생활 해10,11, 전체 수명12,13 이상 행동 활동의 모니터링 및 고해상도 없이 움직일 수 있습니다. 신경 활동14,15,,1617의 이미지입니다. 또한, 통증의 감각 그들의 생리1,8, 기계4,,1819, 특징 수에 필요한 많은 mechanoreceptor 신경 세포 및 분자 레벨20,,2122.
C. 선 충 6 TRNs, 동물의 앞쪽 (ALML/R 및 AVM) 중 3 개는 자극과 중 3 개는 동물의 후부 (PLML/R와 PVM) 자극을 사용 하 여 그것의 몸 벽에 부드러운 기계적 자극을 감지 합니다. 생 화 확 적인 신호에는 적용 된 힘을 시험에 필요한 이온 채널 분자는 그것의 TRNs8에 광범위 하 게 연구 되었습니다. 이 문서에서는 고정된 C. 선 충 의 피부에 정확한 기계적인 힘을 적용 하는 연구원을 가능 하 게 한 미세 플랫폼23 제공 광학 이미징에 의해 그것의 내부 조직 변형 밖으로 읽는 동안 거 위. 잘 정의 된 기계적 자극을 제시 하는 것 외에도 칼슘 과도 subcellular 해상도 mechanoreceptor 뉴런에 기록 된 고 형태학 및 해 부 기능 연관 될 수 있습니다. 하나의 동물을 보유 하 고 (그림 1 및 그림 2) 6 공 압 작동 채널 옆의 피부를 선물 하는 중앙 트래핑 채널 장치에 의하여 이루어져 있다. 6 채널 각 벌레의 6 TRNs의 기계적 자극을 제공 하는 트래핑 채널에 따라 배치 됩니다. 이러한 채널 트래핑 상공에서 외부 공기 압력 소스 (그림 1)에 의해 구동 될 수 있다 얇은 PDMS 격 막에 의해 구분 됩니다. 우리는 압력에 대해 편향 보정 하 고이 문서에 측정을 제공. 각 액추에이터 개별적으로 해결 하 고 선택의 mechanoreceptor 자극 하는 데 사용 될 수 있습니다. 압 전 구동 압력 펌프를 사용 하 여 압력을 전달 하지만 어떤 다른 장치를 사용할 수 있습니다. 우리 TRNs에서 vivo에서 활성화 하 고 운영 기기 성인 C. 선 충에 기계적 자극을 제공, 장치에 성인 동물을 로드, 칼슘 이미징 수행 입증 하 압력 프로토콜을 사용할 수 있음을 보여합니다 실험, 그리고 결과 분석입니다. 장치 제조 두 가지 주요 단계로 구성 됩니다: 1) 수-8;에서 금형을 만들기 위해 사진 평판 그리고 2) PDMS 장치를 만들기 위해 성형. 간결성, 명확성을 위해 독자 이전 게시 된 기사와 프로토콜24,25 금형 및 장치를 생산 하는 방법에 대 한 지침은 이라고 합니다.
프로토콜
1. 장치 제조
- 연결 된 마스크 파일 (추가 파일 1)를 다운로드 하 고는 상용 서비스 또는 사내 시설을 사용 하 여 크롬 마스크를 생성. 장치에 가장 작은 크기는 10 µ m (액추에이터 막 두께), 마스크는 ± 0.25 µ m 내에서 충분히 높은 해상도 사용 하 여 기능을 안정적으로 생산을 확인 해야 합니다.
-
표준 수-8 포토 리소 그래피 방법에 따라 (예를 들어,24참조,25,26) PDMS 장치;의 후속 생산을 위한 금형을 제작 하 단계 요약 아래에 나열 됩니다.
참고: 수-8은 감광 재료, 자외선에 노출 되 면 어떤 crosslinks (최대 흡수 ~ 365 nm). 시작 지점으로 제조업체 지침을 사용 하 여 소프트 빵, 노출 (UV)에 대 한 처리 매개 변수를 확인 하 여 후 구워.- 수-8 2002 스핀 코트를 실리콘 웨이퍼에 예금 그것의 작은 구조 더 나은 접착을 위해 2 µ m의 대략적인 두께. 소프트-95 ° C에 1 분 뜨거운 접시에 빵, 약간 지나치게 노출 (UV) 전체 표면 (~ 100 mJ/cm2), 95 ° c.에 2 분 동안 뜨거운 접시에 후 구워
- 스핀-코트는 47 µ m의 두꺼운 층 수-8 2050 장치 기능을 정의 하기 위한. 500 rpm의 회전 속도 사용 하 여 15 s (130 rpm/s 가속)와 90에 대 한 다음 2000 rpm에 대 한 s (260 rpm/s 가속). 필요한 경우 반복 하 고 적절 한 두께의 감광 제를 회전 속도 조정.
- 소프트-65 ° C에서 2 분 그리고 7 분 95 ° c.에 대 한 뜨거운 접시에 빵 제조업체 지침에 따라 감광 노출 (~ 160 mJ/cm2) 똑 바른 옆 벽에 되도록 크롬 마스크 및 긴 패스 필터를 사용 하 여.
- 웨이퍼를 제거 하 고 후 핫 플레이트 65 ° C에서 1 분 그리고 95 ° c.에 7 분에 구워
- 노출 되지 않은 수-8 개발자, 녹이 고 2-프로 판 올을 청소.
- 30 분 (하드 빵) 안정 감광 기능을 위한 180 ° C에서 열판에 웨이퍼를 구워.
-
성형 방법27표준 복제를 사용 하 여 수-8 모델에서 PDMS 복제를 확인 합니다.
- PDMS 접착 (silanization)을 줄이기 위해 trichloromethylsilane (TCMS) 수증기를 가진 수 8 금형 취급.
주의: TCMS 이며 독성 물 반응.- 물 또는 수용 성 시 약의 무료 증기 두건에서 벨 항아리 진공 desiccator 내 웨이퍼 랙에서 패턴된 웨이퍼를 놓습니다.
- 후드, 유리 접시에 TCMS 1 방울을 적용 하는 desiccator 내부 dropper를 사용 합니다.
- Desiccator 뚜껑 닫고 20 분 이상 웨이퍼 코트 TCMS 증기를 허용 합니다.
- 환기 한 다음은 desiccator 엽니다. 벨 항아리 뚜껑 열고 플라스틱 핀셋을 사용 하 여 웨이퍼를 제거 합니다. PDMS 복제 성형의 페 트리 접시 또는 알루미늄 호 일 보트를 넣으십시오. TCMS-코팅 재료 적절 한 유해 폐기물의 처분.
- 믹스 PDMS (10: 1의 비율) 40 g 베이스 폴리머와 4 g PDMS 경화제의 사용.
- SU-8 형 위에 혼합물을 부 어 하 고 진공 챔버에 적어도 30 분 동안 혼합물을 드.
- 70 ° c 오븐에서 적어도 6 h에 대 한 치료.
- PDMS 접착 (silanization)을 줄이기 위해 trichloromethylsilane (TCMS) 수증기를 가진 수 8 금형 취급.
- 평평한 표면에는 웨이퍼를 가로 설정 하 고 신중 하 게 벗 겨 내는 PDMS 웨이퍼에서 PDMS를 들어올립니다. 할 하지 혼합할 웨이퍼 위쪽이 단계, 그것은 금형을 깰 수 없습니다.
참고: 웨이퍼 또는 불완전 한 silanization 수 8의 불완전 한 접착이 단계 수 8 구조 파괴 될 수 있습니다. - 잘라 PDMS 장치 주위 개별 칩으로는 장치 24 m m x 60 m m coverslip에 맞습니다.
- 1 mm 생 검 펀치를 사용 하 여, 입구, 두 개의 콘센트에 6 개의 액추에이터는 1 mm 생 검 펀치를 사용 하 여 구멍을 확인 합니다. 소자의 가장자리 주위 2 mm 직경 원을 목표로 합니다.
-
유리 커버 전표를 본드 PDMS 칩입니다.
- 모두 80 W 산소 플라즈마 표면 노출 (30 s).
- 부드럽게 등각 인감 커버 슬립의 노출된 표면에 노출 된 PDMS 표면을 놓습니다.
- 핫 플레이트 (100 ° C, 10 분)에 장치 anneal
참고: 부족 한 결합의 누설 때문에 장치 오류가 발생할 수 있습니다.
2입니다. 현미경의 준비
참고: 유전자 변형 동물: GCaMP6s28 등 (예를 들어, TRN); 관심의 neuron(s)에 다른 유전자 인코딩된 활동 조사 칼슘 표시기를 표현 공동 작은 측면 및 기계적 자극으로 인해 발생 하는 밖으로의 초점 운동 아티팩트에 대 한 해결 하기 위해 다른 파장에서 방출 하는 활동-독립 형광 단백질을 표현 한다. 자동된 분석 소프트웨어 트랙과 활동 조사의 강도에서 운동 유도 된 변화에 대 한 보상. 웜 변종 GN69223 (또는 AQ323629) GCaMP6s (또는 GCaMP6m) 익스프레스와 멕 7 promotor 통제 칼슘 독립적인 tagRFP. 또한, GN692는 돌연변이 lite-1(ce314), GCaMP6s 형광23의 구동 중 블루 광 센서 라이트-130 인 TRNs의 활성화를 방지 포함 되어 있습니다.
-
GCaMP 및 RFP의 동시 자극에 대 한 현미경 시스템을 설정 합니다.
- 연속 광원 및만 하늘색과 노란색 빛을 전송 하는 듀얼 밴드 여기 필터를 사용 하 여 또는 동시 녹청 같은 정의 된 대역폭에 파장만을 방출 하는 광원을 사용 하 여 (0.77 mW)과 노란색 (1.21 mW)에 대 한 LED 구동 소스 칼슘 의존 하 고 독립적인 형광의 동시 자극 각각.
- 디지털 카메라를 사용 하 여 현미경 이미지의 녹음 수 있도록.
참고: 대부분의 카메라 이미지 수집에 대 한 소프트웨어를 갖추고 있습니다. 또는, 자유롭게 사용할 수 있는 소프트웨어는 카메라와 잠재적으로 또한 현미경 시스템의 다른 부분을 제어 하는 데 사용할 수 있습니다. - 카메라 채도 피하기 위해 형광 강도에 따라 흥분 강도 조정 합니다.
-
여기 필터를 장착할 필요가 여기 소스의 선택에 따라 형광 큐브를 사용 합니다.
참고: 488 nm GFP와 580 nm mCherry 여기 필터는 여기 사용 되었다.- 청록색과 노란색 빛을 반영 하 고 녹색과 붉은 빛을 전송에 대 한 큐브를 빔 스플리터를 추가 합니다.
- 10 배 목표와 높은 확대 목표 현미경 장비 (예를 들어, 63 X / 1.32 나 오일) 여기 샘플에 빛을 초점을.
- GCaMP와 칼슘 독립적인 신호 동시 녹음 카메라 앞에서 빔 스플리터를 탑재 합니다. 빔 스플리터가 dichroic 거울 (긴 패스, 570에서 컷오프 nm) 녹색과 붉은 빛 그린에 대 한 하나의 방출 필터를 사용 하 여 분리 하 (통과 대역 가운데 525에 50 nm 폭 nm)과 붉은 빛에 대 한 1 개의 방출 필터 (통과 대역 가운데 632에 60 nm nm 너비)입니다.
- 상반신에 녹색과 적색 형광 프로젝트 (녹색)와 반 (적색), 각각의 카메라 칩 ( 그림 3참조). 이 방향은 제공된 분석 소프트웨어에 대 한 전제 조건입니다.
3. 동물 준비
- 앞에서 설명한 간-드-라-리 외. 여 나이 동기화 젊은 성인 또는 성인 첫날 C. 선 충, 준비 31
- 미세 칩을 준비 합니다.
- 중력 흐름 저수지를 연결 (~ 칩 수준 이상의 60 cm) 포함 하는 칩의 한 콘센트 (0.2 µ m polyethersulfone 주사기 필터) M9 버퍼 필터링. 2 콘센트 폐기물 컨테이너, 즉, 필터 플라스 크의 한 콘센트에 다른 콘센트를 연결 합니다. 연동 펌프에 폐기물 컨테이너의 다른 콘센트를 연결 합니다.
참고: 모든 연결에 대 한 폴 리 에틸렌 (PE) 관을 사용 하는 칩에 PE 튜브를 연결 하 금속 튜브 피팅. 이 이렇게 모든 폐기물 솔루션 칩에서 플러시 고 폐기물 컨테이너에 수집 될 것입니다. 콘센트 채널을 통해 흐름 계속 됩니다 웜 아늑한 나중 트래핑 과정에서 부드러운 흡입을 만듭니다. - 준비로 구성 된 인터커넥트 50 m m 긴 PE 튜브 (0.9652 m m OD, 0.5842 m m ID) 양쪽에 금속 튜브 (게이지 크기 23TW, 0.635 m m OD). 프레스-맞게 이러한 인터커넥트 6 개폐 손가락의 각 및 벌레에 ( 그림 1참조). PDMS 구멍에 착용 반복된 제거 리드 칩, 이러한 interconnectors를 둡니다.
- 중력 흐름 저수지를 연결 (~ 칩 수준 이상의 60 cm) 포함 하는 칩의 한 콘센트 (0.2 µ m polyethersulfone 주사기 필터) M9 버퍼 필터링. 2 콘센트 폐기물 컨테이너, 즉, 필터 플라스 크의 한 콘센트에 다른 콘센트를 연결 합니다. 연동 펌프에 폐기물 컨테이너의 다른 콘센트를 연결 합니다.
- 현미경에 칩을 놓습니다. 선택 2-5 벌레에 한 방울 (0.2 µ m 주사기 필터) M9 버퍼 필터링 하 고 1 mL 주사기를 사용 하 여 1 mL 주사기 플런저를 부드럽게 당겨서 연결 PE 튜브 (0.9652 m m OD, 0.5842 m m ID)으로 그려. PE 튜브에 주사기 안에 동물을 유지.
참고: 너무 많은 벌레 또는 필터링된 솔루션 칩에 막힘을 발생할 수 있습니다. - 칩의 (그림 1 및 그림 2) 웜 입구 인터커넥트에 주사기의 PE 튜브를 연결 합니다. 밸브를 개방 하 여 중력 흐름을 활성화 하 고 연동 펌프를 시작 합니다. 채널 명시 모드에서 10 배 렌즈와 현미경 관찰 하면서 트랩 채널에 동물을 이동 하는 주사기의 주사기 플런저를 살짝 누릅니다.
참고: 가끔 나타나는 기포 포즈를 하지 않습니다 문제가; 그들은 콘센트에 일반적으로 자동으로 이동 됩니다. 여러 동물 대기 상공에 ' 주차'를 순차적으로 사용 됩니다.- 트래핑 채널에 동물을 로드 한 후 (참고 그림 2)를 가볍게 밀거나 당기는 채널의 앞의 테이퍼 모양에 동물의 머리를 주사기의 플런저의 위치를 조정.
- 웜 (성인 하루 1)는 칩에 갇혀 있을 수 있는 적당 한 크기 다는 것을 확인 하십시오.
- 벌레 (꼬리의 끝을 포함 하지 않음) 본문의 끝에 코에서 채널의 전체 횡단면을 기입 하지 않는다 또는 벌레는 주사기의 플런저를 이동 하지 않고 채널의 축을 따라 이동 하는 경우 트래핑 채널에서 사라질 때까지 주사기의 플런저를 눌러 제거 하 고 새로운 한 로드 (단계 3.8 참조).
- 형광 현미경 및 더 높은 확대 렌즈 (40 X 이상)의 모드를 전환 하 고 관심의 신경의 neurite 하나는 액추에이터의 격 막에 걸쳐 거짓말을 제공 여부를 확인 합니다. 그렇지 않은 경우에 당기 거 나 밀어 플런저에 의해 동물의 위치를 조정. 도움이 되지 않습니다, 제거 하 고 새 것을 로드 하십시오.
- 관심의 뉴런의 세포 체에 집중 하 고 PE 튜브를 사용 하 여 프로그래밍 가능한 압력 펌프에 가까운 신경 세포 체의 앞쪽에 액추에이터의 상호 연결.
- 실험에서 액추에이터와 신경 사이의 거리를 측정 하는 경우 그래서 모두 보기의 필드에는 channelwall 이미지의 위쪽과 아래쪽 가장자리에 평행 하 게 보기의 필드를 이동 합니다.
- 프로그래밍 가능한 압력 펌프를 사용 하 여 압력 프로토콜을 정의 합니다.
참고:이 프로토콜 원하는 실험에 조정할 수 있습니다.- 적어도 50 이미지 (정상화에 필요한) 이미지 시퀀스의 해당 시간에 대 한 0 kPa의 압력을 일정 시작. 10 Hz의 이미징 속도 대 한이 5 미 추가 원하는 자극 파형 및 압력에 해당 하 고 두 번째 단계는 자극의 길이 정의 합니다.
참고:는 TRNs, 자극에 대 한 (즉, 275 kPa) 단계와 겹쳐 (즉, 75 kPa, 10 Hz)의 정현파 파형이 좋습니다 큰 신경 응답 생성. - 실험이 필요한 경우 추가 자극, 포함 적어도 10의 기간 자극 사이 0 kPa의 압력을 일정에 s. 에 압력 펌프를 전환 하기 전에 확인 계기 압력 상수 0 kPa에서 실제 실험 하기 전에 벌레의 실수로 자극을 피하기 위해.
- 적어도 50 이미지 (정상화에 필요한) 이미지 시퀀스의 해당 시간에 대 한 0 kPa의 압력을 일정 시작. 10 Hz의 이미징 속도 대 한이 5 미 추가 원하는 자극 파형 및 압력에 해당 하 고 두 번째 단계는 자극의 길이 정의 합니다.
- 이미징 및 압력 프로토콜을 실행 합니다.
- 카메라의 이미지 수집 소프트웨어, 압력 프로토콜 동안 100 ms의 노출 시간을 사용 하 여 10 Hz에서 이미지 시퀀스를 설정 합니다. 최대 형광 증가 카메라를 포화 하지 않습니다 같은 자극 강도 조정 합니다. 정규화에 대 한 첫 번째 자극 하기 전에 50 이미지 *.tif 파일로 이미지를 저장 합니다.
- 이미지 수집 소프트웨어 및 소프트웨어 프로그래밍 가능한 펌프의 압력 프로토콜에서 이미징 프로토콜을 시작 합니다. 녹음 중 관심의 신경 10 x 10 픽셀의 영역에서 가장 밝은 장소 하, 순차적 이미지에서 10 픽셀 보다 더 멀리 이동 하지 않습니다 및 녹음 하는 동안 시야에 유지를 준수 합니다.
참고: 이렇게 하지 않으면 분석 소프트웨어 실패 합니다. 밝은 반점 (즉, autofluorescence)는 신경 주위 어려운 뉴런의 청소 확인 합니다. 이 해결 하기 위해 함정에서 벌레를 제거 하 고 칩에 새로운 벌레를 로드 합니다. 벌레는 너무 많이 이동, 새로운 동일한 벌레 기록 노력과 웜 모션 관찰. 문제가 계속 되 면 벌레 너무 작아서 갇혀 있을 수 있습니다. 이 경우이 웜을 제거 하 고 함정에 약간 더 큰 벌레를 로드 합니다. - 원하는 경우, 여러 신경 세포에서 신호에에서 기록 보기의 필드 동시에으로 뉴런 전체 녹음 하는 동안 적어도 10 픽셀을 구분 됩니다.
- 요법이 니 조사, 동물에 실험을 반복적으로 수행 합니다.
- 트래핑 채널에서 벌레를 제거 합니다.
- 후속 연구에 대 한 웜 유지를 원하는 경우 중력 흐름 및 폐기물 컨테이너 쪽으로 칩의 콘센트를 분리 합니다. 전체 웜 흐름 채널에 트래핑 채널 통해 푸시됩니다 때까지 주사기의 플런저를 살짝 누릅니다.
- 동물 방울 칩 외부에 표시 될 때까지 주사기 플런저를 누르고 계속 합니다. 벌레 입구에서 PE 튜브를 포함 하 여 주사기를 분리, 그것을 사용 하 여 발음에 방울 벌레를 한 천 배지 위에 그것을 전송.
- 그것은 벌레를 계속 적절 하지, 전체 웜 흐름 채널;으로 트래핑 채널 통해 푸시됩니다 때까지 주사기의 플런저를 눌러 웜을 제거합니다 중력 흐름과 연동 펌프의 흡입 칩과 폐기물 콘테이너로 동물을 수행 한다.
4입니다. 분석
- 다운로드 및 설치 최신 피지 버전32.
- 다운로드 및 설치 최신 java SDK 버전.
참고: 필요한 경우, 삭제 또는 새로 설치 된 자바 컴파일러를 사용 하 여 피지에 대 한 피지 폴더 안에 java 폴더의 이름을 바꿉니다. -
피지 소프트웨어를 엽니다.
- 소프트웨어를 열어 새로 설치 된 자바 컴파일러 실행 여부 확인 ' 플러그인 | 유틸리티 | ImageJ | 속성 '입니다.
- Pokinganalyzer*.java 파일을 다운로드 (https://github.com/HFehlauer/Poking-Analyzer, 보충 파일 2참조).
- 플러그인으로 그것을 열고 소프트웨어 창에.java 파일을 끌어서 설정 합니다 됩니다.
-
컴파일 및 피지;에서 Ctrl + R 키를 눌러 pokinganalyzer*.java 파일을 실행 그래픽 사용자 인터페이스 (파고 분석기) (그림 3)을 열 것 이다.
- "도움말" 탭에서 클릭 하 고 소프트웨어 및 분석을 수행 하는 방법의 요구 사항에 대 한 읽기. 시작 하려면, 분석기에 대 한 비디오 파일 위치 지정 "열려 있는 비디오" 탭을 선택 합니다: "열려 있는 비디오" 버튼을 클릭 하 고, 비디오의 위치를 탐색 한 열.
참고: 소프트웨어 열이 탭으로 시작 합니다. 시작할 때 열려 있지 않은 경우 새 분석 "열려 있는 비디오" 탭을 클릭 하십시오. 비디오 a.tif 형식에는, 프로그램은 내부적으로 비디오 열고 인터페이스의 아래 부분에 첫 번째 이미지를 표시 합니다. 이미지 분석 되어야 하는 비디오의 경우 다른 동영상 여 "동영상 열기" 버튼을 클릭 합니다. - 계속 하려면, "정의 ROIs" 탭을 클릭 합니다. 이 탭에는 TRN의 위치를 정의 합니다. 열린된 비디오의 첫 번째 이미지 "정의 TRN" 버튼 클릭이이 탭의 아래쪽에 표시 됩니다 하 고 GCaMP 형광 표시 해야 하는 표시 된 이미지의 위쪽 부분에 신경에 클릭 합니다.
- 선택 사항: 액추에이터는 이미지의 위쪽 절반에 표시 하는 경우 프로그램 자동으로 추적할 수 거리 신경 및 액추에이터 사이의 원하는 경우. 이 위해 "정의 액추에이터?" 확인 -상자 "정의 액추에이터" 버튼을 클릭 하 고 이미지의 위쪽 절반에 액추에이터를 클릭 합니다.
- "분석" 탭 정의 이미지 수집 속도 클릭 하십시오. 중 필드에 숫자를 입력 하거나 위쪽 클릭 하거나 아래쪽 단추 수를 늘리거나를. "정의 액추에이터?" 이전 탭에 경우 -선택, 카메라 셀 크기, 배율, 및 범주화 인자를 정의 하므로 프로그램 거리를 계산할 수 있습니다.
- "분석 시작" 버튼 클릭 합니다.
참고: 프로그램은 지금 추적 신경 윗부분에 이미지 시퀀스에서의 형광에 의해 (칼슘 의존)와 아래쪽에 (독립 칼슘) 이미지 시퀀스의. 신경 모션 녹화 프로그램의 평면에 대 한 계정에 다음 그림에는 신경의 위치를 찾을 수 이전 이미지에 신경의 위치 주변 10 x 10 픽셀의 영역을 조사 하겠습니다. 그것은 배경 형광 (Fbg)에 대 한 수정 및 처음 50 이미지 (F0)에 형광으로 나누는 두 반에 있는 형광을 계산: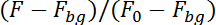
신경에 의해 발생 하는 녹색, 활동-종속 채널 (F캘리포니아2 +)에 형광 변화 레코딩의 평면에서 모션 다음 빨간색, 활동-독립 채널 (F에에서 형광을 사용 하 여 수정 corr)와 칼슘-의존의 사전 자극 표준 편차 (sd캘리포니아2 +)와 의해 독립적인 형광 (sdcorr):
- 프로그램은 인터페이스;의 하단 부분에 있는 상태 표시줄에 진행률을 표시 됩니다. 상태 표시줄에는 100%에 도달 하면, "결과" 탭을 클릭 합니다. 상태 표시줄은 100% 중지, 프로그램 프로그램 비디오를 분석 하지 수 하는 이유를 나타내는 오류 메시지를 줄 것 이다.
- 신호 대 잡음 비 너무 낮은 경우에, 프로그램 신경;을 식별할 수 없는 이후의 녹음에 이미징 매개 변수를 조정 합니다.
- 신경 녹음 하는 동안 보기 필드의 경우, 프로그램은 더 이상 추적할 수 없습니다 하 고 중지 합니다. 이후의 녹음에 대 한 보기의 필드 중간 신경 녹음의 시작 부분에 놓습니다.
- 보기의 필드에 일부 지역 oversaturated는 자동된 분석 잘못 된 결과 생성 합니다. 이후의 녹음에 대 한 형광 신호 카메라 센서를 포화 하지 않습니다 있는지 확인 합니다.
- '결과' 탭 결과 상단 부분에 표시 됩니다. "저장 결과 표"를 클릭 하 여 결과 테이블의 *.txt 탭으로 구분 된 파일을 저장 합니다.
참고:이 테이블에 초 (칼슘 독립적인 형광에 의해 수정) 정규화 된 칼슘-의존 형광 시간으로 구성 됩니다. 이전 정의 그것은 또한는 TRN µ m에 액추에이터 사이 총 거리 포함 하 고는 TRN µ m. 채널 벽에 수직인 액추에이터 사이의 거리 형광 강도의 대표적인 결과 후 증가 가장 가까운 액추에이터를 세포 체의 거리 대 자극 그림 4에 그려집니다. - 한 기록 (10 개 이상의 픽셀로 구분)에 여러 신경 경우 "정의 ROIs" 탭을 다시 클릭 하 고 두 번째 신경으로 4.6.2 단계로 돌아올.
- "도움말" 탭에서 클릭 하 고 소프트웨어 및 분석을 수행 하는 방법의 요구 사항에 대 한 읽기. 시작 하려면, 분석기에 대 한 비디오 파일 위치 지정 "열려 있는 비디오" 탭을 선택 합니다: "열려 있는 비디오" 버튼을 클릭 하 고, 비디오의 위치를 탐색 한 열.
결과
수-8 리소 그래피와 칩 본딩
리소 그래피 프로토콜 및 PDMS 성형 표준 절차를 따릅니다. 자세한 내용은 다른23,,2425,26찾을 수 있습니다. PDMS는 경화 후 문제 없이 웨이퍼를 벗기다 한다. 수-8 기능 PDMS 필 링 하는 동안 벗어 버리고, 경우 SU-8 접착 레이어 또는 silanizati...
토론
이 프로토콜에서는 미세 칩에 갇혀 거 위 피부에 정확한 기계적 자극을 제공 하는 방법을 보여 줍니다. 그것은 생물학 질문에 응답 하기 위한 물리적 자극의 통합을 촉진 하기 위한 것입니다 그리고 생물학 실험실에서 mechanobiology 연구를 합리화 하는 것을 목표로. 이 메서드는 C. 선 충에 mechanosensory 신경의 기능을 평가 하기 위해 이전 분석을 확장 합니다. 이전 양적 및 반 정량적 기법 힘
공개
저자는 공개 없다.
감사의 말
우리 산드라 북 아 일 Manosalvas-Kjono, 푸 림 Ladpli 감사, 장치 설계 및 돌연변이 동물의 세대에서 파라 Memon, Divya Gopisetty, 및 베로니카 산체스에 대 한 지원. 이 연구는 지원 했다 NIH 교부 금 R01EB006745 (BLP)에, (에 MBG) R01NS092099, K99NS089942 (MK)를, (ALN)에 F31NS100318 및 받은 자금 유럽 연합의 지평선 2020 연구 및 혁신 유럽 연구 회의 (ERC)에서 프로그램 ( 부여 계약 번호 715243 MK).
자료
| Name | Company | Catalog Number | Comments |
| Chrome mask | Compugraphics (http://www.compugraphics-photomasks.com/) | 5'', designed in AutoCAD (Autodesk, Inc.) | |
| Chrome mask | Mitani-Micronics (http://www.mitani-micro.co.jp/en/) | 5'', designed in AutoCAD (Autodesk, Inc.) | |
| Chrome mask | Kuroda-Electric (http://www.kuroda-electric.eu/ | 5'', designed in AutoCAD (Autodesk, Inc.) | |
| 4'' Silicon wafer (B-test) | Stanford Nanofabrication Facility | ||
| SU-8 2002 | MicroChem | ||
| SU-8 2050 | MicroChem | ||
| Spin-coater | Laurell Technologies | WS-400BZ-6NPP/LITE | |
| Exposure timer | Optical Associates, Inc | OAI 150 | |
| Illumination controller | Optical Associates, Inc | 2105C2 | |
| SU-8 developer | MicroChem | ||
| 2-Propanol | Fisher Scientific | A426F-1GAL | |
| Acetone | Fisher Scientific | A18-4 | |
| Trichloromethylsilane (TCMS) | Sigma-Aldrich | 92361-500ML | Caution: TCMS is toxic and water-reactive |
| Sylgard 184 Elastomer Kit | Dow Corning | PDMS prepolymer | |
| Biopsy punch, 1 mm | VWR | 95039-090 | |
| Oxygen Plasma Asher | Branson/IPC | ||
| Small metal tubing (0.635 mm OD, 0.4318 mm ID, 12.7 mm long); gage size 23TW | New England Small Tube Corporation | NE-1300-01 | |
| Nalgene syringe filter, 0.22 μm | Thermo Scientific | 725-2520 | to filter all solution, small particles would clog the chip |
| Polyethylene tubing; 0.9652 mm OD, 0.5842 mm ID | Solomon Scientific | BPE-T50 | |
| Syringe, 1 ml | BD Scientific | 309628 | for worm trapping and release |
| Syringe, 20 ml | BD Scientific | 309661 | for gravity-based flow |
| Gilson Minipuls 3, Peristaltic pump | Gilson | to suck solutions and worms out of the chip | |
| Microfluidic flow controller, equipped with 0–800 kPa pressure channel | Elveflow | OB1 MK3 | pressure delivery |
| Water-Resistant Clear Poly- urethane Tubing, 4 mm ID and 6 mm OD | McMaster-Carr | 5195 T52 | connection from house air to pressure pump |
| Water-Resistant Clear Polyurethane Tubing, 2.6mm ID and 4mm OD | McMaster-Carr | 5195 T51 | connect pressure pump to small tubng |
| Push-to-Connect Tube Fitting for Air | McMaster-Carr | 5111K468 | metric - imperial converter |
| Straight Connector for 6 mm × 1/4″ Tube OD | McMaster-Carr | 5779 K258 | |
| Leica DMI 4000 B microscopy system | Leica | ||
| 63×/1.32 NA HCX PL APO oil objective | Leica | 506081 | |
| Hamamatsu Orca-Flash 4.0LT digital CMOS camera | Hamamatsu | C11440-42U | |
| Lumencor Spectra X light engine | Lumencor | With cyan and green/yellow light source | |
| Excitation beam splitter | Chroma | 59022bs | in the microscope |
| Hamamatsu W-view Gemini Image splitting optics | Hamamatsu | A12801-01 | to split green and red emission and project them on different areas on the camera chip |
| Emission beam splitter | Chroma | T570lpxr | in the image splitter |
| Emission filters GCamp6s | Chroma | ET525/50m | in the image splitter |
| Emission filters mCherry | Chroma | ET632/60m | in the image splitter |
참고문헌
- Eastwood, A. L., et al. Tissue mechanics govern the rapidly adapting and symmetrical response to touch. Proc. Natl. Acad. Sci. 15 (50), E6955-E6963 (2015).
- Katta, S., Krieg, M., Goodman, M. B. Feeling Force: Physical and Physiological Principles Enabling Sensory Mechanotransduction. Annu. Rev. Cell Dev. Biol. 31, 347-371 (2015).
- Krieg, M., Dunn, A. R., Goodman, M. B. Mechanical systems biology of C. elegans touch sensation. BioEssays. 37 (3), 335-344 (2015).
- Krieg, M., Dunn, A. R., Goodman, M. B. Mechanical control of the sense of touch by β-spectrin. Nat. Cell Biol. 16 (3), 224-233 (2014).
- Krieg, M., et al. Tensile forces govern germ-layer organization in zebrafish. Nat Cell Biol. 10 (4), 429-436 (2008).
- Gaub, B. M., Müller, D. J. Mechanical stimulation of Piezo1 receptors depends on extracellular matrix proteins and directionality of force. Nano Lett. 17 (3), 2064-2072 (2017).
- Geffeney, S. L., et al. DEG/ENaC but not TRP channels are the major mechanoelectrical transduction channels in a c. Elegans nociceptor. Neuron. 71 (5), 845-857 (2011).
- O'Hagan, R., Chalfie, M., Goodman, M. B. The MEC-4 DEG/ENaC channel of Caenorhabditis elegans touch receptor neurons transduces mechanical signals. Nat. Neurosci. 8 (1), 43-50 (2005).
- Suzuki, H., et al. In Vivo Imaging of C. elegans Mechanosensory Neurons Demonstrates a Specific Role for the MEC-4 Channel in the Process of Gentle Touch Sensation. Neuron. 39 (6), 1005-1017 (2003).
- Kopito, R. B., Levine, E. Durable spatiotemporal surveillance of Caenorhabditis elegans response to environmental cues. Lab Chip. 14 (4), 764-770 (2014).
- Chokshi, T. V., Ben-Yakar, A., Chronis, N. CO2 and compressive immobilization of C. elegans on-chip. Lab Chip. 9 (1), 151 (2009).
- Hulme, S. E., Shevkoplyas, S. S., McGuigan, A. P., Apfeld, J., Fontana, W., Whitesides, G. M. Lifespan-on-a-chip: microfluidic chambers for performing lifelong observation of C. elegans. Lab Chip. 10 (5), 589-597 (2010).
- Li, S., Stone, H. a., Murphy, C. T. A microfluidic device and automatic counting system for the study of C. elegans reproductive aging. Lab Chip. 15 (2), 524-531 (2015).
- Chokshi, T. V., Bazopoulou, D., Chronis, N. An automated microfluidic platform for calcium imaging of chemosensory neurons in Caenorhabditis elegans. Lab Chip. 10 (20), 2758-2763 (2010).
- Mishra, B., et al. Using microfluidics chips for live imaging and study of injury responses in Drosophila larvae. J. Vis. Exp. , e50998 (2014).
- Chronis, N., Zimmer, M., Bargmann, C. I. Microfluidics for in vivo imaging of neuronal and behavioral activity in Caenorhabditis elegans. Nat. Methods. 4 (9), 727-731 (2007).
- Krajniak, J., Lu, H. Long-term high-resolution imaging and culture of C. elegans in chip-gel hybrid microfluidic device for developmental studies. Lab Chip. 10 (14), 1862-1868 (2010).
- Vasquez, V., Krieg, M., Lockhead, D., Goodman, M. B. Phospholipids that Contain Polyunsaturated Fatty Acids Enhance Neuronal Cell Mechanics and Touch Sensation. CellReports. 6 (1), 70-80 (2013).
- Krieg, M., et al. Genetic defects in β-spectrin and tau sensitize C. elegans axons to movement-induced damage via torque-tension coupling. Elife. 6 (2010), e20172 (2017).
- Arnadóttir, J., O'Hagan, R., Chen, Y., Goodman, M. B., Chalfie, M. The DEG/ENaC protein MEC-10 regulates the transduction channel complex in Caenorhabditis elegans touch receptor neurons. J. Neurosci. 31 (35), 12695-12704 (2011).
- Lockhead, D., et al. The tubulin repertoire of Caenorhabditis elegans sensory neurons and its context-dependent role in process outgrowth. Mol. Biol. Cell. 27 (23), 3717-3728 (2016).
- Goodman, M. B., Ernstrom, G. G., Chelur, D. S., O'hagan, R., Yao, C. A., Chalfie, M. MEC-2 regulates C. elegans DEG/ENaC channels needed for mechanosensation. Nature. 415 (6875), 1039-1042 (2002).
- Nekimken, A., Fehlauer, H., Kim, A., Goodman, M., Pruitt, B. L., Krieg, M. Pneumatic stimulation of C. elegans mechanoreceptor neurons in a microfluidic trap. Lab Chip. , (2017).
- Brower, K., White, A. K., Fordyce, P. M. Multi-step Variable Height Photolithography for Valved Multilayer Microfluidic Devices. J. Vis. Exp. (119), e55276 (2017).
- Jenkins, G. Rapid prototyping of PDMS devices using SU-8 lithography. Methods Mol. Biol. 949 (1), 153-168 (2013).
- Faustino, V., Catarino, S. O., Lima, R., Minas, G. Biomedical microfluidic devices by using low-cost fabrication techniques: A review. J. Biomech. 49 (11), 2280-2292 (2016).
- Xia, Y., Whitesides, G. M. SOFT LITHOGRAPHY. Annu. Rev. Mater. Sci. 28 (1), 153-184 (1998).
- Chen, T. -. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Cho, Y., Porto, D., Hwang, H., Grundy, L., Schafer, W. R., Lu, H. Automated and controlled mechanical stimulation and functional imaging in vivo in C. elegans. Lab Chip. , (2017).
- Edwards, S. L., et al. A novel molecular solution for ultraviolet light detection in Caenorhabditis elegans. PLoS Biol. 6 (8), 1715-1729 (2008).
- Porta-de-la-Riva, M., Fontrodona, L., Villanueva, A., Cerón, J. Basic Caenorhabditis elegans methods: synchronization and observation. J. Vis. Exp. (64), e4019 (2012).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat. Methods. 9 (7), 676-682 (2012).
- Cho, Y., Porto, D. A., Hwang, H., Grundy, L. J. High-Throughput Controlled Mechanical Stimulation and Functional Imaging In Vivo. BiorXiv. , (2017).
- Petzold, B. C., Park, S. -. J., Mazzochette, E. A., Goodman, M. B., Pruitt, B. L. MEMS-based force-clamp analysis of the role of body stiffness in C. elegans touch sensation. Integr. Biol. (Camb). 5 (6), 853-864 (2013).
- Nekimken, A. L., Mazzochette, E. A., Goodman, M. B., Pruitt, B. L. Forces applied during classical touch assays for Caenorhabditis elegans. PLoS One. 12 (5), e0178080 (2017).
- Chronis, N., Zimmer, M., Bargmann, C. I. Microfluidics for in vivo imaging of neuronal and behavioral activity in Caenorhabditis elegans. Nat. Methods. 4 (9), 727-731 (2007).
- Gilleland, C. L., Rohde, C. B., Zeng, F., Yanik, M. F. Microfluidic immobilization of physiologically active Caenorhabditis elegans. Nat. Protoc. 5 (12), 1888-1902 (2010).
- Chuang, H. -. S., Raizen, D. M., Lamb, A., Dabbish, N., Bau, H. H. Dielectrophoresis of Caenorhabditis elegans. Lab Chip. 11 (4), 599 (2011).
- Christensen, A. M., Chang-Yen, D. A., Gale, B. K. Characterization of interconnects used in PDMS microfluidic systems. J. Micromechanics Microengineering. 15 (5), 928-934 (2005).
- Gilpin, W., Uppaluri, S., Brangwynne, C. P. Worms under Pressure: Bulk Mechanical Properties of C. elegans Are Independent of the Cuticle. Biophys. J. 108 (8), 1887-1898 (2015).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유