A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
مقايسة المستندة إلى الخلوي تدفق التعرف على المركبات التي تعطل ملزمة للامتحانات المسمى فلوريسسينتلي تشيموكيني يجند 12 لمستقبلات تشيموكيني الامتحانات 4
In This Article
Summary
تدفق ويرد التحليل القائم على الخلوي الخلوي ملزم يستخدم أساسا كأداة لفحص لتحديد المركبات التي تحول دون ربط يجند chemokine للامتحانات المسمى فلوريسسينتلي 12 (CXCL12) لمستقبلات تشيموكيني الامتحانات 4 (CXCR4).
Abstract
استهداف الدوائي ز إلى جانب البروتين مستقبلات (جبكرس) من أهمية كبيرة على صحة الإنسان واختلال هذه العملية بوساطة الإشارات يسهم في تطور العديد من الأمراض. زوج يجند/مستقبلات للامتحانات chemokine يجند 12 (CXCL12)/للامتحانات chemokine مستقبلات 4 (CXCR4) أثارت الاهتمام السريرية الهامة، على سبيل المثال كهدف محتمل لعلاج السرطان وأمراض التهابات. ولذلك تعتبر الجزيئات الصغيرة فضلا عن الأجسام المضادة العلاجية التي تستهدف CXCR4 على وجه التحديد وتمنع الدالة المستقبلات لتكون أدوات قيمة دوائية. ويرد هنا، تدفق مقايسة خلوية التي تتيح تحديد هوية المركبات (مثل الجزيئات الصغيرة) التي تلغي ملزمة CXCL12 إلى CXCR4، القائم على الخلوي. أساسا، التحليل يعتمد على التنافس على مستقبلات ملزم بين مقدار ثابت من المسمى فلوريسسينتلي CXCL12، مؤثر تشيموكيني الطبيعية ل CXCR4، والمركبات غير مسمى. ومن ثم فهو تجنب استخدام المسابير المسمى إشعاعيا غير مرغوب فيه في هذا التحليل. وبالإضافة إلى ذلك، يتم استخدام الخلايا الحية كمصدر لمستقبلات (CXCR4) بدلاً من الأعمال التحضيرية في غشاء الخلية. وهذا ما يسمح سهلة التكيف للفحص على شكل لوحة، مما يزيد من الإنتاجية. هذا التحليل قد ثبت مقايسة اكتشاف قيمة الأدوية التعرف على المركبات استهداف CXCR4. البروتوكول المحتمل يمكن تكييفها للأخرى جبكرس، على الأقل إذا كان المسمى فلوريسسينتلي يغاندس متوفرة أو يمكن أن تتولد. معرفة مسبقة بشأن مسارات الإشارات داخل الخلايا التي هي فعل عند تفعيل هذه جبكرس، غير مطلوب.
Introduction
ز إلى جانب البروتين مستقبلات (جبكرس) هي الخلية البروتينات السطحية التي يمكن تنشيطه بواسطة يغاندس خارج الخلية (مثلاً، الببتيدات، هرمونات البروتين، والامينات)، وبالتالي تنظيم العديد من الفسيولوجية والتنموية العمليات1. عندما تحتل مؤثر في جيب ملزم GPCR، التغيير conformational المستحث في مستقبلات البروتين يعزز ربط البروتينات داخل الخلايا المرتبطة بمستقبلات هيتيروتريميريك ز، وتتألف من مجموعةα-الناتج المحلي الإجمالي ومفارزβγ ز. الإشارات اللاحقة تبادل أنشئ للناتج المحلي الإجمالي على نتائج فرعيةα G في الانفصال مفارز البروتين ز (α-أنشئ ز وزβγ) التي، بدورها، كما ستبدأ المصب مسارات2،3. عندما يصبح تحلل Gα-أنشئ، رابطة إعادة من Gα-الناتج المحلي الإجمالي ومفارزβγ ز سيتم تحويل البروتين ز العودة إلى الدولة يستريح3،4. أنواع متميزة من البروتينات ز موجودة (زق، زالإدخال/الإخراج، ز، ز12/13)، التي تصنف استناداً إلى تسلسل تشابه مع وحدة فرعيةα ز5. كل من هذه البروتينات ز الحث على مسارات الإشارات داخل الخلايا المحددة التي تكمن وراء الاستجابة البيولوجية لتنشيط مستقبلات. بعد تنشيط مستقبلات، فوسفوريلاتي هذه العملية مؤنزم (جركس) ذيل داخل الخلايا جبكرس، مما يعزز التفاعل مع β-أريستينس. تؤدي هذه العملية إلى إنهاء البروتين ز إشارات، مستقبلات الحساسية واستيعاب6. Β-أرريستينس أيضا جزء من المجمعات الجزيئية متعددة أن إشارات الزناد تتالي مستقلة من البروتين G يشير إلى7.
جبكرس من بين الأهداف الجزيئية الأكثر المصادق عليها للتدخل العلاجي، كما حررت هذه العملية بوساطة إشارات، وعلى سبيل المثال سبب مكسب للدالة الطفرات في مستقبلات الجينات أو مستقبلات overexpression، يسهم في مسببات كثيرة 8من الأمراض التي تصيب الإنسان. ولذلك، جبكرس تمثل واحدة من أهم أصناف المخدرات أهداف التحقيق في صناعة المستحضرات الصيدلانية8،،من910. من الأمثلة بارزة لهذه العملية ذات الصلة سريرياً مستقبلات تشيموكيني الامتحانات 4 (CXCR4)، الذي يمكن تنشيطه بواسطة يجند طبيعي وحيد، للامتحانات chemokine يجند 12 (CXCL12)11. بسبب دورها الثابت كمستقبل المشارك رئيسي لفيروس نقص المناعة البشرية 1 (فيروس نقص المناعة البشرية-1) الدخول والإصابة في المجموعة من التمايز 4 (CD4) حقق إيجابية الخلايا اللمفية تي12، CXCR4 أولاً كهدف العقاقير المضادة للفيروسات. تفاعل CXCL12-CXCR4 في نخاع العظام كذلك ينظم الاحتفاظ واستضافة أكثر من السلف وتنبع الخلايا13. أيضا، نظراً للمشاركة في جوانب كثيرة من سرطان علم الأحياء (مثلاً، ورم الخلايا البقاء، وورم خبيث، تولد الأوعية المتصلة بالورم)14 والعديد غيرها الأمراض البشرية (مثل أمراض التهابات)15، CXCR4 وأثارت اهتماما كبيرا كهدف واعدة لاكتشاف المخدرات. واكتشفت في البداية كمرشح العقاقير المضادة فيروس نقص المناعة البشرية16 AMD3100، جزيء صغيرة التي تستهدف على وجه التحديد CXCR4، ولا تزال واحدة من أقوى الخصوم CXCR4 الموصوفة بتاريخ17. تطويره كما كان العقاقير المضادة للفيروسات، ومع ذلك، توقف18. حاليا يستخدم كعامل تعبئة خلايا الجذعية هذا الجزيء أثناء علاج مرضى الورم النخاعي المتعدد، والأورام اللمفاوية18. وكانت العديد من الجزيئات الصغيرة لا علاقة لها كيميائيا والبيولوجي التي تمنع الدالة CXCR4 بفاعلية متفاوتة وصفت19.
أساليب ربط مستقبلات هي أدوات قيمة في علم الأدوية التي تسمح بتحديد المركبات (مثل الجزيئات الصغيرة) التي تتفاعل مباشرة مع هذه العملية للفائدة. من أجل إجراء الدراسات ملزمة، ليست هناك حاجة لمعرفة مسبقة بشأن خصائص الإشارات داخل الخلايا أو الأداء الوظيفي ل GPCR معين. على الرغم من أن هذا يمكن أن يعتبر ميزة، فإنه يعني ضرورة المركبات يمكن البرهنة ملزمة لمستقبلات التي تتسم كذلك بتقييم نشاطهم ناهضة أو معادية محتملة. ويمكن تقييم هذا النشاط باستخدام فحوصات الدوائية أو البيولوجية المتصلة هذه العملية قيد الدراسة. تعتمد على التشكيل الجانبي النشاط، مستقبلات ملزم الجزيئات قد ثم يحتمل أن تتطور لتصبح مركبات الرصاص رواية للتحقيق في الدراسات ما قبل السريرية والسريرية. أيضا يمكن أن تكون الجزيئات التي تربط على وجه التحديد إلى مستقبل مع انجذاب عال السقالات لإنشاء أدوات تشخيصية أو علاجية، على سبيل المثال بواسطة راديولابيلينج منهم لتصوير موسع في فيفو ورم الخلايا20، أو كاحتمال مركبات للتنفيذ الهادف للمداواة21. في حالة CXCR4، في فيفو تصوير الخلايا السرطانية وقد ثبت بالفعل باستخدام نماذج الماوس حيث يسمح الجزيئات المسماة CXCR4--استهداف التصور من السرطان البشري تكثيفها20،22،23 .
في هذا التقرير، يصف لنا بروتوكول مفصل مقايسة ربط منافسة التي تمكن من تحديد الجزيئات الصغيرة والبيولوجي التي تتعارض مباشرة مع مؤثر (CXCL12) الملزم ل CXCR4. هو المبدأ الأساسي المتعلق التحليل المنافسة بين مقدار ثابت من يجند المسمى فلوريسسينتلي (CXCL12AF647، انظر الجدول للمواد والمواد الكاشفة) وغير مسمى المركبات لملزمة لمستقبلات البروتين17، 24-ثم يتم تحليل إشارة الفلورسنت محددة من يجند المسمى منضمة إلى الخلايا المفردة، وإذ تعرب عن CXCR4 بالتدفق الخلوي. سيتم تخفيض هذا إشارة الفلورسنت عند تعطيل الجزيئات الصغيرة غير مسمى التفاعل بين CXCL12AF647 و CXCR4. المقايسة تستخدم الخلايا الحية غير التلاعب اندوجينوسلي تعبر عن CXCR4 (أي الخلايا جوركات). ومن ثم، مطلوب لا إعداد غشاء الخلية، الأمر الذي يجعل المقايسة مريحة وسريعة ومتوافقة مع زيادة الإنتاجية. حيث يتم استخدام يجند مسمى فلوريسسينتلي، هو تجنب النشاط الإشعاعي.
لأن CXCL12 هو مؤثر الطبيعية ل CXCR4، المركبات جزيء الصغيرة التي تتداخل مع CXCL12AF647 ملزمة المقايسة من المحتمل أن تتفاعل مع الموقع ملزم مستقبلات أورثوستيريك (أي الموقع الملزمة التي تحتلها الطبيعية مؤثر). الجزيئات التي ستتفاعل مع مستقبلات ملزم مواقع طبوغرافيا مميزة من موقع الربط أورثوستيريك تبقى غير مكتشفة، إذا فإنها لا تؤثر على ملزمة CXCL12. على سبيل المثال، المغيرون allosteric الإيجابية والسلبية، على فئة الهامة والناشئة من هذه العملية تستهدف جزيئات يعملون في مواقع الربط اللوستيريك25، سوف يحتمل أن لا يتم انتقاؤها بهذا الفحص. وبالإضافة إلى ذلك، ما إذا كانت المركبات المحددة مع هذه الدالة المقايسة ملزمة مستقبلات الخصوم أو يضع لا يمكن اشتقاق. وبالتالي سيلزم التحقيق المركبات التي تم تحديدها في إضافية فحوصات تتعلق بمستقبلات دوائية أو الوظيفية. وقد تتضمن هذه الاختبارات (مجموعة من) الخلوية fluorescence التﻷلؤ القائم أو فحوصات للكشف عن رسل الثانية (مثلاً، Ca2 +، دوري الادينوسين الأدينوزين (مخيم))، المظهرية أو فحوصات بيولوجية و β-أريستين فحوصات التوظيف، اختيار الذي يعتمد على خصائص إشارات محددة هذه العملية قيد الدراسة. ومن ثم، مقايسة ملزمة تنافسية ووصف هذه الوثيقة أساسا بمثابة مقايسة فرز أولية التي تحتاج إلى أن تستكمل مع فحوصات أخرى يستند إلى الخلية لتمكين وصف متعمق للمركبات مع مستقبلات قوتها الملزمة.
Protocol
1-الحفاظ على ثقافة الخلية
ملاحظة: تنفذ جميع الخطوات المذكورة في 1 و 2 تحت ظروف معقمة في تدفق الصفحي مجلس الوزراء.
- تنمو الخلايا في قوارير الثقافة T75 في 37 درجة مئوية و 5% CO2 في حاضنة هوميديفيد.
ملاحظة: في هذا التحليل، تستخدم الخلايا جوركات (أي الخلايا البشرية اللمفاويات T ليوكيميك اندوجينوسلي تعبر عن CXCR417). وينبغي تقييم التعبير عن CXCR4 على سطح الخلية في جميع أنحاء استزراع خلية عن طريق التدفق الخلوي. ووصف وصفاً للتدفق الخلوي الداخلي والمواد الكاشفة لتحديد مستويات التعبير مستقبلات على سطح الخلية هو، مع ذلك، ليس في نطاق هذا البروتوكول، ولكن قد تم سابقا17. - السماح للخلايا جوركات تنمو في تعليق حتى تصل إلى 80-85% كونفلوينسي. قبل باساجينج الخلايا لقارورة رواية، السماح لجميع المواد الكاشفة تصل إلى درجة حرارة الغرفة (RT).
- إضافة 20 مل من النمو الكامل الطازجة المتوسطة (RPMI 1640 المتوسطة، 10% الجنيني البقري المصل (FBS)، الجلوتامين 2 مم) قارورة ثقافة T75 رواية.
- إضافة 5 مل تعليق خلية جوركات من قارورة T75 الأصلي (الذي يتضمن 25 مل تعليق خلية) لرواية قارورة الثقافة T75. احتضان في 37 درجة مئوية و 5% CO2 في حاضنة هوميديفيد.
2-إعداد CXCL12، المخزن المؤقت للمقايسة، والخلايا جوركات للمنافسة ملزم المقايسة.
- تحضير حلاً أسهم من CXCL12AF647 (20 ميكروغرام/مل؛ انظر الجدول للمواد والمواد الكاشفة) بتذويب الكاشف المجففة بالتبريد (المخزنة في-80 درجة مئوية، في الظلام) في الماء عالي النقاوة وتستكمل مع 0.01% (حجم/حجم) بوليسوربيت 20. استخدام مخزن واحد مختبرين من هذا الحل الأسهم في-80 درجة مئوية، ومحمية من الضوء.
- إعداد المقايسة المخزن المؤقت عن طريق إضافة 40 مل حبيس (تركيز 1 م 20 مم، النهائي) 200 مل هانك متوازن الملح حل (حبس، 10 x، دون الأحمر الفينول ودون بيكربونات الصوديوم، 1 × التركيز النهائي). إضافة الماء عالي النقاوة للحصول على وحدة تخزين نهائي من 2 4 إضافة ل. ز (0.2% وزن/حجم) البقري ألبومين المصل (BSA)، وحل جيش صرب البوسنة عن طريق المغناطيسية إثارة. وأخيراً ضبط ال pH إلى 7.4 (استخدام هيدروكسيد الصوديوم لهذا الغرض) وتصفية الحل من خلال 0.2 ميكرون المسام (انظر الجدول للمواد والمواد الكاشفة) استخدام متعددة من فراغ.
ملاحظة: سيتم استخدام المخزن المؤقت هذا الفحص في جميع خطوات أخرى من البروتوكول. - عد العدد وقدرة على البقاء الخلايا. لهذا، أخذ عينة من تعليق خلية وتمييع في الفوسفات مخزنة المالحة (PBS).
ملاحظة: نحن تستخدم بشكل روتيني محلل بقاء خلية الآلي (انظر الجدول للمواد والمواد الكاشفة) قادر على عد معلقات الخلايا بتركيزات مختلفة. لعد الخلايا، تمييع 0.5 مل تعليق خلية في 1.5 مل برنامج تلفزيوني (تخفيف الأخرى، مثلاً، 0.1 مل في 1.9 مل برنامج تلفزيوني، أيضا ممكنة). وقد تم استخدام هذا الأسلوب، الذي يستند إلى أسلوب الاستبعاد صبغة زرقاء تريبان، الموصوفة سابقا26. عدة أجهزة أخرى متاحة تجارياً لعد عدد الخلايا والسلامة التي ينبغي أن تعمل بشكل جيد على قدم المساواة. - جمع العدد المطلوب من الخلايا (أي ~ 24 × 106 خلايا لتشغيل المقايسة مع لوح 96-جيدا كاملة واحد) في أنبوب عقيم 50 مل بالطرد المركزي (انظر الجدول للمواد والمواد الكاشفة للنوع من أجهزة الطرد المركزي المستخدمة) في 400 غرام x لمدة 5 دقائق في الرايت
- بلطف من أجل إيقاف المادة طافية دون إزعاج بيليه الخلية. إضافة المخزن المؤقت مقايسة جديدة (مثلاً 20 مل) وريسوسبيند الخلايا بلطف بيبيتينج صعودا وهبوطاً.
- الطرد المركزي الخلايا مرة أخرى في 400 غرام x لمدة 5 دقائق في الرايت
- من أجل إيقاف المادة طافية مرة أخرى وريسوسبيند بيليه الخلية في المخزن المؤقت مقايسة جديدة للحصول على كثافة 5 × 106 خلايا/مل.
3-المنافسة ملزم بالانزيم
ملاحظة: تتم في الرايت مقايسة الربط المنافسة الفعلية ويمكن أن تتم في ظروف غير معقمة.
- تمييع المركبات قيد التحقيق في المخزن المؤقت للتحليل (انظر 2.2) للحصول على التركيز المطلوب. أما إعداد تركيز ثابت للمجمع للفحص الأولى (مثلاً، 10 ميكرون تركيز النهائي)، أو بدلاً من ذلك، سلسلة تمييع مسلسل من تركيزات لمزيد من التفصيل توصيف المركبات (مثلاً من 1/3، 1/4 أو 1/ 5 إضعاف سلسلة بدءاً من 1 ميكرومتر، التركيز النهائي). ضع في اعتبارك أن الحل المركب سوف تصبح في نهاية المطاف x 2 المخفف في التحليل؛ ولذلك، تعد 2 × الحل مركزة.
- الاستغناء عن 100 ميليلتر من حل مركب (2 x تتركز) في بئر 96 واضحة جولة أسفل لوحة (انظر الجدول للمواد والمواد الكاشفة) وفقا لوضع تجريبية محددة مسبقاً بها (مثلاً، الشكل 1).
ملاحظة: في هذه المرحلة، يتم تضمين عينات المراقبة السلبية والإيجابية في المقايسة. في عينة مراقبة سلبية، يتم إضافة 100 ميليلتر من المخزن المؤقت للمقايسة بدلاً من المجمع إلى الآبار التي بليت 96-جيدا. مراقبة إيجابية العينة، يتم أيضا إضافة الإنزيم المخزن المؤقت أثناء هذه الخطوة. انظر أيضا الرقم 1 لتخطيط تجريبية نموذجية التي يتم اختبار سلسلة تخفيف من عدة مركبات. - إضافة 50 ميليلتر من تعليق خلية (انظر 2.7؛ 0.25 × 106 خلايا) من خزان كاشف في لوحة 96-كذلك استخدام ماصة متعددة القنوات. احتضان اللوحة لمدة 15 دقيقة في RT في الظلام.
- إضافة 50 ميليلتر من CXCL12 المسمى فلوريسسينتلي (أي 100 نانوغرام/مل من CXCL12AF647 في المخزن المؤقت للمقايسة، 4 x تتركز 25 نانوغرام/مليلتر تركيز النهائي) من خزان كاشف مماثلة للآبار التي بليت 96-جيدا. احتضان لمدة 30 دقيقة في RT في الظلام.
ملاحظة: عينات المراقبة السلبية، إضافة الإنزيم المخزن المؤقت بدلاً من ذلك. ومن ثم سوف تتوافق مع إشارة الفلورسنت اكتشف في عينات مراقبة سلبية إلى إشارة خلفية أوتوفلوريسسينت (الشكل 1A). عينات مراقبة إيجابية، إضافة 50 ميليلتر/بئر CXCL12AF647. سوف تسفر عن عينات مراقبة إيجابية الأسفار القصوى تم الكشف عن إشارة، حيث أدرج لا تثبيط المحتملة بالحضانة قبل مع المركبات (الشكل 1A). - الطرد المركزي لوحة 96-جيدا في 400 غرام x لمدة 5 دقائق في الرايت إزالة المادة طافية من الخلايا الأعلاف التي تنقلب اللوحة. الجاف للوحة على أنسجة.
- إضافة 200 ميليلتر من المخزن المؤقت مقايسة جديدة من خزان كاشف للآبار استخدام ماصة الأقنية. ينتقل فورا.
- الطرد المركزي في اللوحة مرة أخرى لمدة 5 دقائق في 400 غرام x في الرايت إزالة المادة طافية بالتقليب على اللوحة وجاف مرة أخرى أنه في الأنسجة.
- بلطف ريسوسبيند بيليه الخلية في 200 ميليلتر من 1% بارافورمالدهيد حله في برنامج تلفزيوني. هذه الخطوة سوف إصلاح الخلايا.
- مواصلة البروتوكول فورا مع التحديد الكمي للأسفار بالتدفق الخلوي.
4-تحليل العينات بالتدفق الخلوي
CXCL12AF647 الملون والخلايا تركز اهتمامها على استعداد الآن ليتم تحليلها باستخدام التدفق الخلوي. يمكن استخدام عدة أنواع من تدفق سيتوميتيرس، بل أنها تحتاج إلى أن تكون مجهزة بالليزر الصحيح (أي، ليزر أحمر والإثارة مجموعة ~ 630 نيوتن متر) للإثارة ومرشحات مناسبة للكشف عن فلوروفوري (الانبعاثات مرشحات ~ 660 nm). أنهم بحاجة إلى أن تكون قادرة على التعامل مع عينات في شكل لوحة 96-جيدا. أمثلة من أجهزة قياس التدفق مناسبة في الجدول للمواد والمواد الكاشفة.
- بدء تشغيل الجهاز وفتح برنامج المقابلة (انظر الجدول للمواد والمواد الكاشفة).
- حدد المحددات الخلوية التالية تصور في شكل اسطوانة دوت: الأمام مبعثر (FSC) والجانب مبعثر (SSC) وقناة كشف فلوروفوري (CXCL12AF647).
ملاحظة: مع المعلمة منتدى التعاون الأمني، خلايا يتعرضون للتمييز استناداً إلى حجمها، نظراً لامتصاص الضوء تم الكشف عنها غير متناسب إلى القطر للخلية. المعلمة SSC، قياس تشتت الضوء بزاوية 90 درجة، يوفر معلومات حول مستوى الخلايا. - اختر عينة واحدة (مثلاً، عينة مراقبة سلبية) لأداء النابضة للسكان خلية متجانسة محددة استناداً إلى المعلمات منتدى التعاون الأمني، والتعاون بين بلدان الجنوب.
- حدد التلقائية حقن ~ 100 ميليلتر من الخلايا تركز اهتمامها من هذه العينة المراقبة السلبية إلى سيتوميتير التدفق. حدد الخيار "خلط" قبل الحقن واستخدام نموذج معدل تدفق 1.5 ميليلتر/s.
- تشغيل هذا النموذج عن طريق تحديد "الحصول على البيانات." الآن سوف تظهر المعلمات منتدى التعاون الأمني، والتعاون بين بلدان الجنوب من أجل هذه العينة على الشاشة.
- حدد أداة النابضة للبرنامج. يستند التصور وصمة عار دوت منتدى التعاون الأمني، والتعاون بين بلدان الجنوب، تحدد مسبقاً عدد سكان خلية متجانسة وقابلة للتطبيق قبل النابضة. للقيام بذلك، قم بإنشاء مضلع (باستخدام أداة النابضة للبرنامج) الذي يتضمن الخلايا المفردة الموزعة المتجانسة ("الأحداث") استناداً إلى هذين البعدين.
ملاحظة: هذا الإجراء النابضة يهدف إلى تحديد عدد سكان خلية متجانسة وقابلة للتطبيق الذي سيتم استخدامه لإجراء مزيد من التحليل. النابضة تعتمد على افتراض أن غالبية خلايا قابلة للحياة وسوف تشكل خلية متجانسة سكان استناداً إلى المعلمات منتدى التعاون الأمني، والتعاون بين بلدان الجنوب. قبل تنفيذ هذه الخطوة، يمكن إلى حد كبير استبعاد الحطام الخلوية والخلايا الميتة والخلية المجاميع من مزيد من التحليل. مثال على عملية النابضة يرد في الشكل 1 باء.
- حدد لتحليل 20,000 "الأحداث" (أي الخلايا المفردة) كل عينة.
ملاحظة: وهذا يعني أن لكل نموذج، سيتم في نهاية المطاف تحليل 20,000 الخلايا التي تقع داخل بوابة المعرفة مسبقاً. الحصول على البيانات لكل عينة سوف تستمر حتى يتم تحليل هذا العدد من الأحداث. - بدء التشغيل (حدد "بيانات التسجيل"). جهاز قياس التدفق الآن تحليل جميع العينات واحداً تلو الآخر عن طريق تسجيل الأسفار متوسط الكثافة (MFI) لكل عينة. مؤسسة مونتانيار هذا يناظر إشارة الفلورسنت يعني تناظر 20,000 الخلايا التي تقع داخل بوابة المعرفة مسبقاً.
5-بيانات التحليل
استخدام مؤسسة مونتانيار الحصول عليها لكل عينة لإجراء جميع عمليات حسابية أخرى. تحليل بيانات التدفق الخلوي يمكن أن يؤديها العديد من حزم البرمجيات المتاحة تجارياً (انظر الجدول للمواد والمواد الكاشفة).
- لتحديد النسبة المئوية تثبيط الإشارات الملزمة الفلورسنت، نتيجة للحضانة قبل مجمع، تطبيق الصيغة التالية:
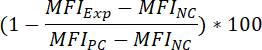
حيث:
مؤسسة مونتانيارأكسب = مؤسسة مونتانيار التجريبي (= يعامل المجمع) عينة
مؤسسة مونتانيارPC = مؤسسة مونتانيار لمراقبة إيجابية
مؤسسة مونتانيارNC = مؤسسة مونتانيار لمراقبة سلبية - لتحديد القيمة50 IC لمركب (أي تركيز مجمع التي يمكن أن تقلل من إشارة الفلورسنت ملزمة بنسبة 50%)، يتم تطبيق الصيغة التالية:
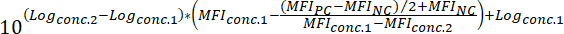
حيث:
سجلconc.2 = سجل تركيز مركب أن النتائج في أقل من 50% في تثبيط للفرق بين قيمة مؤسسة مونتانيار للكمبيوتر ونورث كارولاينا
سجلconc.1 = سجل تركيز مركب أن النتائج في أكثر من 50% في تثبيط للفرق بين قيمة مؤسسة مونتانيار للكمبيوتر ونورث كارولاينا
ملاحظة: بدلاً من ذلك، في حالة مركبات نشطة للغاية، منحنى استجابة لجرعة تغطي عدة سجلات من حجم يمكن إنشاؤها استناداً إلى مؤسسة مونتانيار المقابلة لكل اختبار تركيز المجمع. عن طريق تطبيق ملائمة منحنى الانحدار غير الخطي باستخدام البرمجيات المناسبة (انظر الجدول للمواد والمواد الكاشفة)، قيم50 IC ثم يمكن أن يستنتج من المنحنيات التي تم إنشاؤها. ويرد مثال على هذا النهج من التحليل في الشكل 3.
النتائج
ويرد في الشكل 1Aسير العمل العام للتحليل ملزمة. مثال على نوع بيانات التدفق الخلوي الحصول على عينة مختلفة الأنواع في تجربة قياسية (أي سلبية التحكم ومراقبة إيجابية العينة التجريبية) هو مبين في الشكل 1 باء، وتخطيط لوحة ممكنة لأداء ويرد الت...
Discussion
مقارنة بالأنواع الأخرى من فحوصات ملزمة (أي، تشبع ملزم والتجارب الحركية ملزم)، فحوصات ملزمة المنافسة الأنسب لأغراض الفرز. وفي الواقع، أنها تسمح تقييم مجموعات كبيرة من مركبات غير مسمى، والجزيئات الصغيرة على سبيل المثال، بقدرتها على التدخل مع الربط من مقدار ثابت من يجند مستقبلات المسم?...
Disclosures
الكتاب ليس لها علاقة بالكشف عن.
Acknowledgements
المؤلف يود أن يشكر إريك أفضل للمساعدة التقنية الممتازة. تم دعم هذا العمل من خلال "وفين كو" (منحة لا. PF/10/018)، صندوق voor أونديرزوك ويتينشابيليجك (فو، منح لا. G.485.08) وفي فادوز دورميور مؤسسة.
Materials
| Name | Company | Catalog Number | Comments |
| BD FACSCanto II | Becton Dickinson | Not applicable | Flow cytometry device |
| BD FACSDIVA Software | |||
| BD FACSArray | Becton Dickinson | Not applicable | Flow cytometry device |
| BD FACSArray System Software | |||
| Graphpad Prism | Graphpad | software package used for nonlinear regression analysis in Figure 2 and Figure 3 | |
| FlowJo | FlowJo is now a wholly owned subsidiary of BD. | ||
| Vi-CELL | Beckman Coulter | Not applicable | cell viability analyzer |
| Sigma 3-18 KS | Sigma | Not applicable | centrifuge |
| AMD3100 | Sigma | A5602-5mg | specific CXCR4 antagonist |
| Maraviroc | Pfizer | antiretroviral drug, CCR5 antagonist, available for research at Selleckchem (cat#S2003), Sigma (cat#PZ0002) | |
| h-SDF1a (AF647) | ALMAC | CAF-11-B-01 | fluorescently labeled CXCL12, CXCL12AF647 |
| Fetal Bovine Serum (FBS) | Gibco (Life Technologies) | 10270-106 | |
| Bovine Serum Albumin (BSA) | Sigma | A1933-25G | |
| HBSS (10x), calcium, magnesium, no phenol red | Gibco (Life Technologies) | 14065-049 | |
| HEPES (1M) | Gibco (Life Technologies) | 15630-056 | |
| Dulbecco's Phosphate Buffered Saline (DPBS) | Gibco (Life Technologies) | 14190-094 | |
| Jurkat cells | ATCC | ||
| Reagent reservoir PP | Sigma | BR703411 | |
| Rapid flow filter: 0.2 µm aPES | Thermo Scientific | 566-0020 | |
| Sterilin microtiter plate, 96-well, U bottom, clear | Thermo Scientific | 611U96 | |
| Falcon tubes, 50ml | Greiner Bio-One | 227 261 | |
| Tissue culture flask (T75) | Corning | 353024 |
References
- Fredriksson, R., Lagerstrom, M. C., Lundin, L. G., Schioth, H. B. The G-protein-coupled receptors in the human genome form five main families. Phylogenetic analysis, paralogon groups, and fingerprints. Mol Pharmacol. 63, 1256-1272 (2003).
- Milligan, G., Kostenis, E. Heterotrimeric G-proteins: A short history. Br J Pharmacol. 147 Suppl 1, S46-S55 (2006).
- Oldham, W. M., Hamm, H. E. Heterotrimeric G protein activation by G-protein-coupled receptors. Nat Rev Mol Cell Biol. 9, 60-71 (2008).
- Tuteja, N. Signaling through G protein coupled receptors. Plant Signal Behav. 4, 942-947 (2009).
- Neves, S. R., Ram, P. T., Iyengar, R. G protein pathways. Science. 296, 1636-1639 (2002).
- Gurevich, E. V., Tesmer, J. J., Mushegian, A., Gurevich, V. V. G protein-coupled receptor kinases: more than just kinases and not only for GPCRs. Pharmacol Ther. 133, 40-69 (2012).
- Smith, J. S., Rajagopal, S. The beta-arrestins: Multifunctional regulators of G protein-coupled receptors. J Biol Chem. 291, 8969-8977 (2016).
- Pierce, K. L., Premont, R. T., Lefkowitz, R. J. Seven-transmembrane receptors. Nat Rev Mol Cell Biol. 3, 639-650 (2002).
- Hopkins, A. L., Groom, C. R. The druggable genome. Nat Rev Drug Discov. 1, 727-730 (2002).
- Lappano, R., Maggiolini, M. G protein-coupled receptors: Novel targets for drug discovery in cancer. Nat Rev Drug Discov. 10, 47-60 (2011).
- Chatterjee, S., Behnam Azad, ., Nimmagadda, B., S, The intricate role of CXCR4 in cancer. Adv Cancer Res. 124, 31-82 (2014).
- Bleul, C. C., Farzan, M., Choe, H., Parolin, C., Clark-Lewis, I., Sodroski, J., Springer, T. A. The lymphocyte chemoattractant SDF-1 is a ligand for LESTR/fusin and blocks HIV-1 entry. Nature. 382, 829-833 (1996).
- Flomenberg, N., DiPersio, J., Calandra, G. Role of CXCR4 chemokine receptor blockade using AMD3100 for mobilization of autologous hematopoietic progenitor cells. Acta Haematol. 114, 198-205 (2005).
- Domanska, U. M., Kruizinga, R. C., Nagengast, W. B., Timmer-Bosscha, H., Huls, G., de Vries, E. G., Walenkamp, A. M. A review on CXCR4/CXCL12 axis in oncology: No place to hide. Eur J Cancer. 49, 219-230 (2013).
- Tsou, L. K., Huang, Y. H., Song, J. S., Ke, Y. Y., Huang, J. K., Shia, K. S. Harnessing CXCR4 antagonists in stem cell mobilization, HIV infection, ischemic diseases, and oncology. Med Res Rev. , (2017).
- Schols, D., Struyf, S., Van Damme, J., Este, J. A., Henson, G., De Clercq, E. Inhibition of T-tropic HIV strains by selective antagonization of the chemokine receptor CXCR4. J Exp Med. 186, 1383-1388 (1997).
- Van Hout, A., D'Huys, T., Oeyen, M., Schols, D., Van Loy, T. Comparison of cell-based assays for the identification and evaluation of competitive CXCR4 inhibitors. PLoS One. 12, e0176057 (2017).
- De Clercq, E. The AMD3100 story: the path to the discovery of a stem cell mobilizer (Mozobil). Biochem Pharmacol. 77, 1655-1664 (2009).
- Debnath, B., Xu, S., Grande, F., Garofalo, A., Neamati, N. Small molecule inhibitors of CXCR4. Theranostics. 3, 47-75 (2013).
- Woodard, L. E., Nimmagadda, S. CXCR4-based imaging agents. J Nucl Med. 52, 1665-1669 (2011).
- Wang, Y., Xie, Y., Oupicky, D. Potential of CXCR4/CXCL12 Chemokine Axis in Cancer Drug Delivery. Curr Pharmacol Rep. 2, 1-10 (2016).
- Nimmagadda, S., Pullambhatla, M., Stone, K., Green, G., Bhujwalla, Z. M., Pomper, M. G. Molecular imaging of CXCR4 receptor expression in human cancer xenografts with [64Cu]AMD3100 positron emission tomography. Cancer Res. 70, 3935-3944 (2010).
- De Silva, R. A., Peyre, K., Pullambhatla, M., Fox, J. J., Pomper, M. G., Nimmagadda, S. Imaging CXCR4 expression in human cancer xenografts: evaluation of monocyclam 64Cu-AMD3465. J Nucl Med. 52, 986-993 (2011).
- Hatse, S., Princen, K., Liekens, S., Vermeire, K., De Clercq, E., Schols, D. Fluorescent CXCL12AF647 as a novel probe for nonradioactive CXCL12/CXCR4 cellular interaction studies. Cytometry A. 61, 178-188 (2004).
- Wootten, D., Christopoulos, A., Sexton, P. M. Emerging paradigms in GPCR allostery: implications for drug discovery. Nat Rev Drug Discov. 12, 630-644 (2013).
- Louis, K. S., Siegel, A. C. Cell viability analysis using trypan blue: manual and automated methods. Methods Mol Biol. 740, 7-12 (2011).
- Perry, C. M. Maraviroc: a review of its use in the management of CCR5-tropic HIV-1 infection. Drugs. 70, 1189-1213 (2010).
- Moyle, G., DeJesus, E., Boffito, M., Wong, R. S., Gibney, C., Badel, K., MacFarland, R., Calandra, G., Bridger, G., Becker, S. Proof of activity with AMD11070, an orally bioavailable inhibitor of CXCR4-tropic HIV type 1. Clin Infect Dis. 48, 798-805 (2009).
- Balabanian, K., Lagane, B., Infantino, S., Chow, K. Y., Harriague, J., Moepps, B., Arenzana-Seisdedos, F., Thelen, M., Bachelerie, F. The chemokine SDF-1/CXCL12 binds to and signals through the orphan receptor RDC1 in T lymphocytes. J Biol Chem. 280, 35760-35766 (2005).
- Burns, J. M., Summers, B. C., Wang, Y., Melikian, A., Berahovich, R., Miao, Z., Penfold, M. E., Sunshine, M. J., Littman, D. R., Kuo, C. J., Wei, K., McMaster, B. E., Wright, K., Howard, M. C., Schall, T. J. A novel chemokine receptor for SDF-1 and I-TAC involved in cell survival, cell adhesion, and tumor development. J Exp Med. 203, 2201-2213 (2006).
- Stoddart, L. A., Kilpatrick, L. E., Briddon, S. J., Hill, S. J. Probing the pharmacology of G protein-coupled receptors with fluorescent ligands. Neuropharmacology. 98, 48-57 (2015).
- Vernall, A. J., Hill, S. J., Kellam, B. The evolving small-molecule fluorescent-conjugate toolbox for Class A GPCRs. Br J Pharmacol. 171, 1073-1084 (2014).
- Stoddart, L. A., White, C. W., Nguyen, K., Hill, S. J., Pfleger, K. D. Fluorescence- and bioluminescence-based approaches to study GPCR ligand binding. Br J Pharmacol. 173, 3028-3037 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved