È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Un'analisi di citometria-basata di flusso per identificare i composti che interrompono il grippaggio del Ligand di Chemokine CXC fluorescente etichettati 12 al recettore di chemochine CXC 4
In questo articolo
Riepilogo
Un flusso di analisi basate su cytometry cellulare obbligatoria è descritto che è utilizzato principalmente come uno strumento di screening per identificare i composti che inibiscono il legame di un ligando di chemochine CXC fluorescente contrassegnato 12 (CXCL12) al recettore di chemochine CXC 4 (CXCR4).
Abstract
Targeting farmacologica dei recettori accoppiati a proteine G (GPCR) è di grande importanza per la salute umana, come segnalazione disfunzionale GPCR-mediated contribuisce alla progressione di molte malattie. La coppia di ligando/recettore ligando di chemochine CXC 12 (CXCL12) / recettore delle chemochine CXC 4 (CXCR4) ha sollevato interesse clinico significativo, per esempio come un potenziale bersaglio per il trattamento di cancro e di malattie infiammatorie. Piccole molecole come pure gli anticorpi terapeutici specificamente destinate a CXCR4 e inibiscono la funzione del recettore sono pertanto considerati da preziosi strumenti farmacologici. Qui, un flusso cytometry cellulare test che permette l'identificazione di composti (ad esempio, piccole molecole) che abrogare CXCL12 associazione di CXCR4, è descritto. Essenzialmente, il dosaggio si basa sulla competizione per il recettore vincolante tra un importo fisso di CXCL12 fluorescente identificati, l'agonista di chemokine naturale per CXCR4 e composti senza etichetta. Quindi, in questo dosaggio è evitato l'uso indesiderabile di sonda marcata radioattivamente. Inoltre, le cellule viventi sono utilizzate come fonte di ricevitore (CXCR4) invece di preparazioni della membrana delle cellule. Questo consente il facile adattamento del dosaggio per un formato del piatto, che aumenta la velocità effettiva. Questo test ha dimostrato di essere un'analisi di scoperta del prezioso farmaco generico per identificare composti CXCR4-targeting. Il protocollo probabilmente può essere adattato ad altri GPCR, almeno se fluorescente contrassegnati ligandi sono disponibili o possono essere generati. Conoscenza preventiva riguardante le vie di segnalazione intracellulare che sono indotte all'attivazione di questi GPCR, non è necessario.
Introduzione
I recettori accoppiati a proteine G (GPCR) sono proteine di superficie delle cellule che possono essere attivati da ligandi extracellulari (ad es., peptidi, ormoni proteici, ammine), quindi molti fisiologici e di sviluppo che regolano i processi1. Quando un agonista occupa la tasca di associazione GPCR, il cambiamento conformazionale indotto nella proteina recettore promuove il legame di proteine intracellulari associata al recettore G eterotrimeriche, composto da Gα- PIL e subunitàβγ G. Il successivo scambio di GTP per PIL sui risultati di subunitàα G nella dissociazione delle subunità G proteine (Gα-GTP e Gβγ) che, a sua volta, ulteriormente avvierà a valle di segnalazione vie2,3. Quando il Gα-GTP diventa idrolizzato, ri-associazione il Gα- PIL e subunitàβγ G convertirà la proteina di G nel suo riposo di3,di stato4. Diversi tipi di proteine G esistano (Gs, G/ o, Gq, G12/13), che sono classificati basato su somiglianza di sequenza con la subunitàα di G5. Tutte queste proteine G indurre definite vie di segnalazione intracellulare che sottendono la risposta biologica per l'attivazione del recettore. A seguito di attivazione del recettore, chinasi GPCR (GRK) fosforilano la coda intracellulare dei GPCR, promuovendo in tal modo l'interazione con β-arrestins. Questo processo conduce alla cessazione di segnalazione, di desensibilizzazione e internalizzazione del recettore6G di proteine. Β-arrestins sono anche parte di complessi multi-molecolari che trigger segnalazione cascades indipendente di segnalazione7G di proteine.
GPCR sono tra i bersagli molecolari più convalidati per un intervento terapeutico, come deregolamentato GPCR-mediata di segnalazione, per esempio a causa di mutazioni con guadagno di funzione nel gene del ricevitore o sovraespressione del recettore, contribuisce all'eziologia di molti malattie umane8. Di conseguenza, GPCR rappresentano una delle più importanti classi di bersagli farmacologici studiati dall'industria farmaceutica8,9,10. Un esempio notevole di un GPCR clinicamente rilevante è il recettore di chemochine CXC 4 (CXCR4), che può essere attivato da un ligando naturale unico, le chemochine CXC (CXCL12) ligando 1211. A causa del suo ruolo stabilito come un importante co-recettore per il virus dell'immunodeficienza umana 1 (HIV-1) voce e infezione in cluster di differenziazione 4 (CD4) positivo T-linfociti12, CXCR4 in primo luogo è stato studiato come un bersaglio di farmaci antivirali. Interazione di CXCL12-CXCR4 nel midollo osseo inoltre regola la ritenzione e homing delle staminali e progenitrici delle cellule13. Inoltre, dato il suo coinvolgimento in molti aspetti del cancro biologia (ad esempio, la sopravvivenza delle cellule del tumore, metastasi, tumore-relativa angiogenesi)14 e diverse altre malattie umane (ad es., malattie infiammatorie)15, CXCR4 sollevato l'interesse significativo come un bersaglio promettente per la scoperta di nuovi farmaci. AMD3100, una piccola molecola che si rivolge specificamente CXCR4, inizialmente è stato scoperto come un anti-HIV farmaco candidato16 ed è ancora uno dei più potenti antagonisti CXCR4 descritti a data17. Suo sviluppo come un farmaco antivirale è stato, tuttavia, interrotto18. Attualmente questa molecola è usata come agente di mobilizzazione di cellule staminali durante il trattamento del mieloma multiplo e linfoma pazienti18. Diverse altre piccole molecole chimicamente indipendenti e biologics che inibiscono la funzione di CXCR4 con potenza variabile sono stati descritti19.
Metodi di associazione del ricevitore sono strumenti preziosi in farmacologia che permettono l'identificazione di composti (ad esempio, piccole molecole) che interagiscono direttamente con i GPCR di interesse. Al fine di eseguire studi di binding, non c'è nessuna necessità di conoscenza preliminare riguardante la proprietà di segnalazione intracellulare o la funzionalità di un determinato GPCR. Anche se questo può essere considerato un vantaggio, essa implica che composti per quale recettore può essere dimostrata associazione devono essere ulteriormente caratterizzata da valutare il loro potenziale attività agonista o antagonista. Questa attività può essere valutata utilizzando dosaggi farmacologici o biologiche legate alla GPCR sotto studio. Dipendente sul loro profilo di attività, molecole leganti del ricevitore potrebbero quindi potenzialmente evolvere per diventare composti di piombo romanzo per indagine negli studi pre-clinici e clinici. Molecole che si legano specificamente a un recettore ad alta affinità possono anche servire come scaffold per generare strumenti terapeutici o diagnostici, per esempio da radiolabeling li per l'imaging non invasivo in vivo del tumore le cellule20, o come potenziale veicoli per la somministrazione mirata di therapeutics21. In caso di CXCR4, è già stata dimostrata in vivo imaging delle cellule del tumore usando modelli murini in cui molecole di CXCR4-targeting con etichettate ha permesso la visualizzazione di cancro umano xenotrapianti20,22,23 .
In questo rapporto, descriviamo un protocollo dettagliato per un test di associazione di competizione che consente l'identificazione di piccole molecole e farmaci biologici che interferiscono direttamente con l'agonista (CXCL12) vincolante di CXCR4. Il principio di base del test è la competizione tra un importo fisso di ligando fluorescente contrassegnato (CXCL12AF647, Vedi tabella materiali e reagenti) e senza etichetta composti per il legame al recettore proteina17, 24. il segnale fluorescente specifico dal ligando con etichetta associato alle singole cellule che esprimono CXCR4 è quindi analizzato mediante citometria a flusso. Questo segnale fluorescente diminuisce quando adenoide piccole molecole disturbare l'interazione tra CXCL12AF647 e CXCR4. L'analisi utilizza le cellule viventi non manipolato che esprimono in modo endogeno CXCR4 (cioè, cellule Jurkat). Quindi, nessuna preparazione della membrana delle cellule è richiesta, che rende il dosaggio conveniente, veloce e compatibile con aumento della velocità. Poiché viene utilizzato un ligando fluorescente contrassegnato, radioattività è evitato.
Perché CXCL12 è l'agonista naturale per CXCR4, composti di piccola molecola che interferiscano con l'associazione di CXCL12AF647 nell'analisi sono probabilità di interagire con il sito di legame del recettore ortosterici (cioè, il sito di legame occupato dalla naturale agonista). Molecole che potrebbe interagire con siti di legame del recettore topograficamente distinti dal sito di legame ortosterici rimangano inosservati, se non influenzano il legame di CXCL12. Per esempio, modulatori allosterici positivi e negativi, una categoria importante ed emergente di GPCR targeting molecole che agiscono su allosterico associazione siti25, potenzialmente non verremo con questo test. Inoltre, se i composti identificati con questa funzione di analisi di associazione come antagonisti o agonisti non può essere derivato. Indagine dei composti identificati in ulteriori saggi relativi recettori farmacologici o funzionale così sarà richiesto. Queste analisi potrebbero includere (una combinazione di) analisi cellulare fluorescenza - o luminescenza-based per la rilevazione di secondi messaggeri (ad es., Ca2 +, monofosfato di adenosina ciclico (cAMP)), fenotipiche o saggi biologici e β-arrestina saggi di reclutamento, la cui scelta dipende dalle specifiche proprietà segnalazione dei GPCR sotto studio. Quindi, il saggio di legame competitivo descritto nel presente documento principalmente serve come un test di screening iniziale che deve essere integrata con altre analisi cell-based per consentire un'approfondita caratterizzazione di composti con potenza di legame del recettore.
Protocollo
1. manutenzione della coltura delle cellule
Nota: Tutti i passaggi descritti in 1 e 2 sono effettuati in condizioni di sterilità in un flusso laminare.
- Crescere le cellule in matracci di cultura T75 a 37 ° C e 5% di CO2 in un incubatore.
Nota: In questo test, vengono utilizzate cellule Jurkat (cioè, cellule leucemiche umane del linfocita di T che esprimono in modo endogeno CXCR417). Espressione di CXCR4 alla superficie delle cellule dovrebbe essere valutata in tutto cellula coltura mediante citometria a flusso. Una descrizione della procedura di citometria a flusso e reagenti per determinare i livelli di espressione del recettore sulla superficie cellulare, tuttavia, non è nell'ambito del presente protocollo, ma è stato descritto in precedenza17. - Ha lasciato le cellule Jurkat crescere in sospensione fino a quando raggiungono l'80-85% confluenza. Prima passaggio le cellule in un matraccio da romanzo, lasciare che tutti i reagenti raggiungano la temperatura ambiente (TA).
- Aggiungere 20 mL di fresca completa crescita medio (medium RPMI-1640, 10% siero bovino fetale (FBS), glutamina 2mm) in un matraccio di cultura T75 romanzo.
- Aggiungere 5 mL di sospensione cellulare Jurkat dal pallone originale T75 (contenente 25 mL di sospensione cellulare) al romanzo T75 matraccio di cultura. Incubare a 37 ° C e 5% di CO2 in un incubatore.
2. preparazione di CXCL12, tampone e cellule Jurkat per il concorso associazione Assay.
- Preparare una soluzione stock di CXCL12AF647 (20 µ g/mL; Vedi tabella materiali e reagenti) sciogliendo il reagente liofilizzato (conservato a-80 ° C, al buio) in acqua ultrapura completato con 0.01% (volume/volume) di polisorbato 20. Conservare le aliquote monouso da questa soluzione madre a-80 ° C, al riparo dalla luce.
- Preparare il tampone del saggio aggiungendo 40 mL HEPES (concentrazione di 1 M, 20 mM finale) di soluzione salina bilanciata di Hank 200ml (HBSS, 10x, senza rosso fenolo e senza bicarbonato di sodio, 1 x concentrazione finale). Aggiungete dell'acqua ultrapura per ottenere un volume finale di 2 L. aggiungere 4 g (0,2% peso/volume) albumina di siero bovino (BSA) e sciogliere la BSA via magnetica mescolando. Infine, regolare il pH a 7,4 (utilizzare NaOH per questo) e filtrare la soluzione attraverso 0,2 µm pori (Vedi tabella materiali e reagenti) utilizzando un collettore ad aspirazione.
Nota: Questo tampone verrà essere utilizzato in tutte le fasi ulteriori del protocollo. - Contare il numero e la vitalità delle cellule. Per questo, prendere un campione della sospensione cellulare e diluirla in tampone fosfato salino (PBS).
Nota: Usiamo ordinariamente un analizzatore di attuabilità delle cellule automatizzato (Vedi tabella materiali e reagenti) in grado di contare le sospensioni delle cellule alle concentrazioni variabili. Per il conteggio delle cellule, diluire 0,5 mL di sospensione cellulare in 1,5 mL di PBS (sono possibili anche altre diluizioni, per esempio, 0,1 mL in 1,9 mL di PBS,). L'uso di questo metodo, che si basa il metodo di esclusione del colorante blu di trypan, è stato descritto in precedenza26. Molti altri dispositivi sono disponibili in commercio per contare il numero di cell e vitalità che dovrebbe funzionare altrettanto bene. - Raccogliere il numero desiderato di cellule (cioè, ~ 24 x 106 cellule per eseguire il test con una piastra a 96 pozzetti completa) in una provetta sterile 50 mL mediante centrifugazione (Vedi tabella dei materiali e i reagenti per il tipo di centrifuga utilizzata) a 400 x g per 5 min a RT.
- Versare delicatamente il sovranatante senza disturbare il pellet cellulare. Aggiungere tampone fresco (ad es., da 20 mL) e risospendere le cellule pipettando delicatamente su e giù.
- Centrifugare le cellule ancora a 400 x g per 5 minuti a TA.
- Versare nuovamente il surnatante e risospendere il pellet cellulare nel tampone fresco per ottenere una densità di 5 x 106 cellule/mL.
3. concorrenza Binding Assay
Nota: Il test di associazione effettiva competizione viene eseguito a RT e possono essere eseguite in condizioni non sterili.
- Diluire i composti sotto inchiesta nel tampone (Vedi 2.2) per ottenere la concentrazione desiderata. O preparare una concentrazione fissa di composto per lo screening iniziale (ad esempio, 10 concentrazione finale di µM) o, in alternativa, una serie di diluizioni seriali di concentrazioni per più dettagliate caratterizzazione dei composti (ad esempio, un 1/3, 1/4 o 1 / 5 serie di diluizioni a partire a 1 µM, concentrazione finale). Tenete a mente che la soluzione composta alla fine diventerà 2x diluito nel dosaggio; quindi, preparare una soluzione concentrata di 2x.
- Pipettare 100 µ l di soluzione composto (2x concentrato) in un chiaro 96 pozzetti fondo piatto rotondo (Vedi tabella materiali e reagenti) secondo un pre-definito laico sperimentale fuori (per esempio, Figura 1).
Nota: In questa fase, i campioni di controllo positivi e negativi sono inclusi nell'analisi. Nel campione di controllo negativo, 100 µ l di tampone di dosaggio viene aggiunto invece composto dei pozzetti della piastra 96 pozzetti. Per il campione di controllo positivo, il tampone viene aggiunto anche durante questo passaggio. Vedi anche Figura 1 per un tipico layout sperimentale in cui viene testata una serie di diluizioni di diversi composti. - Aggiungere 50 µ l di sospensione cellulare (Vedi 2.7; 0.25 x 106 cellule) da un serbatoio di reagente nella piastra 96 pozzetti usando una pipetta multicanale. Incubare la piastra per 15 min a RT nel buio.
- Aggiungere 50 µ l di CXCL12 fluorescente contrassegnati (cioè, 100 ng/mL di CXCL12AF647 in tampone, 4x concentrato, concentrazione finale di 25 ng/mL) da un serbatoio di reagente simile ai pozzetti della piastra 96 pozzetti. Incubare per 30 min a temperatura ambiente al buio.
Nota: Per i campioni di controllo negativo, aggiungere tampone del saggio. Quindi, il segnale fluorescente rilevato nei campioni di controllo negativo corrisponderà il segnale di fondo di autofluorescent (Figura 1A). Per i campioni di controllo positivi, aggiungere 50 µ l/pozzetto di CXCL12AF647. I campioni di controllo positivo darà il segnale di fluorescenza massima rilevato, poiché nessun potenziale inibizione di pre-incubazione con composti era inclusa (Figura 1A). - Centrifugare la piastra a 96 pozzetti a 400 x g per 5 min a RT. rimuovere il surnatante dalle cellule pellettate di lanciare sopra la piastra. Asciugare la piastra su un tessuto.
- Aggiungere 200 µ l di tampone fresco da un serbatoio di reagente nei pozzetti usando una pipetta multicanale. Procedere immediatamente.
- Centrifugare la piastra ancora per 5 min a 400 x g a RT. rimuovere il surnatante da lanciare sopra la piastra e asciugare nuovamente sul tessuto.
- Delicatamente e risospendere il pellet cellulare in 200 µ l di 1% paraformaldeide disciolto in PBS. Questo passaggio consentirà di correggere le cellule.
- Continuare il protocollo immediatamente con la quantificazione della fluorescenza da citometria a flusso.
4. analisi dei campioni mediante citometria a flusso
CXCL12AF647 macchiato e fissate cellule ora sono pronte essere analizzati mediante citometria a flusso. Diversi tipi di citometri a flusso possono essere utilizzati, ma hanno bisogno di essere equipaggiata con il laser corretto (cioè, un laser rosso, eccitazione gamma ~ 630 nm) per eccitazione e filtri adatti per il rilevamento di fluoroforo (emissione filtri ~ 660 nm). Hanno bisogno di essere in grado di gestire campioni in un formato di piastra a 96 pozzetti. Esempi di dispositivi di citometria a flusso adatto sono forniti nella tabella materiali e reagenti.
- Avviare il dispositivo e aprire il software corrispondente (Vedi tabella materiali e reagenti).
- Selezionare i seguenti parametri cellulari possano essere visualizzati in un formato di punto della macchia: forward scatter (FSC), side scatter (SSC) e il canale di rilevamento fluoroforo (CXCL12AF647).
Nota: Con il parametro FSC, le cellule sono discriminate base alle loro dimensioni, poiché l'assorbimento della luce rilevata è proporzionale al diametro della cella. Il parametro SSC, misura la dispersione della luce ad un angolo di 90°, fornisce informazioni circa la granularità delle cellule. - Scegliere un campione (ad esempio, un campione di controllo negativo) di eseguire gating di una popolazione di cella definita omogeneo basata sui parametri FSC e SSC.
- Selezionare automatico iniezione di ~ 100 µ l di cellule fissate da questo campione di controllo negativo nel citometro a flusso. Selezionare l'opzione "miscelazione" prima dell'iniezione e utilizzare una portata del campione di 1,5 µ l/s.
- Esegui questo esempio selezionando "Acquisizione dati". I parametri FSC e SSC per questo esempio verranno visualizzato sullo schermo.
- Selezionare strumento di controllo del software. Basato sul FSC e SSC la visualizzazione dot blot, pre-definire una popolazione cellulare omogenea e praticabile di gating. A tale scopo, creare un poligono (utilizzando tool gating del software) che include le celle singole omogeneamente distribuite ("eventi") basate su queste due dimensioni.
Nota: La procedura di gating mira a definire una popolazione cellulare omogenea e praticabile che verrà utilizzata per un'ulteriore analisi. Gating si basa sul presupposto che la maggior parte delle cellule vitali si forma una popolazione omogenea delle cellule basata sui parametri FSC e SSC. Eseguendo questo passaggio, detriti cellulari, cellule morte e aggregati cellulari in gran parte possono essere esclusi da ulteriori analisi. Un'illustrazione del processo di colata è dato in Figura 1B.
- Selezionare questa opzione per analizzare 20.000 "eventi" (cioè, cellule singole) per campione.
Nota: Questo significa che per ogni campione, 20.000 celle che rientrano il cancello pre-definito saranno infine analizzate. Acquisizione di dati per ciascun campione continuerà fino a quando questo numero di eventi è analizzato. - Avviare l'esecuzione (selezionare "Record dati"). Il dispositivo di citometria a flusso ora analizzerà tutti i campioni one-by-one registrando l'intensità media di fluorescenza (MFI) per ogni campione. Questo MFI corrisponde al segnale fluorescente medio corrispondente alle 20.000 celle che rientrano il cancello pre-definito.
5. analisi dei dati
Utilizzare l'IFM ottenuto per ciascun campione per eseguire tutti i calcoli successivi. Analisi dei dati di citometria a flusso può essere eseguita da diversi pacchetti software disponibili in commercio (vedere tabella materiali e reagenti).
- Per determinare la percentuale di inibizione del segnale fluorescente associazione, a seguito di composto pre-incubazione, applicare la seguente formula:
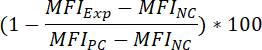
Dove:
MFIExp = l'IFM di sperimentale (= composto-trattati) campione
MFIPC = l'IFM del controllo positivo
MFINC = l'IFM del controllo negativo - Per determinare il valore di50 IC di un composto (cioè, la concentrazione del composto che può ridurre il segnale fluorescente associazione 50%), applicare la seguente formula:
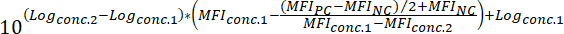
Dove:
Logconc.2 = registro di una concentrazione del composto che si traduce in meno del 50% di inibizione della differenza tra il valore MFI di PC e NC
Logconc.1 = il log di una concentrazione del composto che si traduce in più del 50% l'inibizione della differenza tra il valore MFI di PC e NC
Nota: In alternativa, in caso di composti altamente attivi, una curva dose-risposta che coprono diversi registri di grandezza può essere generata basato sull'IFM corrispondente a ciascuna concentrazione testata del composto. Mediante l'applicazione di montaggio di curva di regressione non lineare usando il software adatto (Vedi tabella materiali e reagenti), valori di IC50 quindi possono essere dedotto dalle curve generate. Nella Figura 3è riportato un esempio di questo approccio di analisi.
Risultati
Il flusso di lavoro generale del dosaggio associazione è presentato in Figura 1A. Un'illustrazione del tipo di dati di citometria a flusso ottenuti per tipi di campioni diversi in un esperimento standard (cioè, controllo negativo, controllo positivo e campione sperimentale) è raffigurata in Figura 1Be un layout possibili piastra per eseguire il dosaggio in un formato di piastra a 96 pozzetti è dato in
Discussione
Rispetto ad altri tipi di analisi obbligatorie (i.e., associazione di saturazione ed esperimenti di binding cinetico), concorrenza analisi obbligatorie sono più adatte ai fini dello screening. Infatti, essi consentono la valutazione di grandi lotti di composti senza etichetta, per esempio piccole molecole, segnando la loro capacità di interferire con il legame di un importo fisso di un ligando del recettore con etichetta. Composti che si legano ad altri siti del ricevitore rispetto il ligando con etichettato p...
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Gli autori vorrei ringraziare Eric Fonteyn per l'eccellente assistenza tecnica. Questo lavoro è stato supportato da KU Leuven (grant no. PF/10/018), Fonds voor Wetenschappelijk Onderzoek (FWO, concedere no. G.485.08) e la Fondation Dormeur Vaduz.
Materiali
| Name | Company | Catalog Number | Comments |
| BD FACSCanto II | Becton Dickinson | Not applicable | Flow cytometry device |
| BD FACSDIVA Software | |||
| BD FACSArray | Becton Dickinson | Not applicable | Flow cytometry device |
| BD FACSArray System Software | |||
| Graphpad Prism | Graphpad | software package used for nonlinear regression analysis in Figure 2 and Figure 3 | |
| FlowJo | FlowJo is now a wholly owned subsidiary of BD. | ||
| Vi-CELL | Beckman Coulter | Not applicable | cell viability analyzer |
| Sigma 3-18 KS | Sigma | Not applicable | centrifuge |
| AMD3100 | Sigma | A5602-5mg | specific CXCR4 antagonist |
| Maraviroc | Pfizer | antiretroviral drug, CCR5 antagonist, available for research at Selleckchem (cat#S2003), Sigma (cat#PZ0002) | |
| h-SDF1a (AF647) | ALMAC | CAF-11-B-01 | fluorescently labeled CXCL12, CXCL12AF647 |
| Fetal Bovine Serum (FBS) | Gibco (Life Technologies) | 10270-106 | |
| Bovine Serum Albumin (BSA) | Sigma | A1933-25G | |
| HBSS (10x), calcium, magnesium, no phenol red | Gibco (Life Technologies) | 14065-049 | |
| HEPES (1M) | Gibco (Life Technologies) | 15630-056 | |
| Dulbecco's Phosphate Buffered Saline (DPBS) | Gibco (Life Technologies) | 14190-094 | |
| Jurkat cells | ATCC | ||
| Reagent reservoir PP | Sigma | BR703411 | |
| Rapid flow filter: 0.2 µm aPES | Thermo Scientific | 566-0020 | |
| Sterilin microtiter plate, 96-well, U bottom, clear | Thermo Scientific | 611U96 | |
| Falcon tubes, 50ml | Greiner Bio-One | 227 261 | |
| Tissue culture flask (T75) | Corning | 353024 |
Riferimenti
- Fredriksson, R., Lagerstrom, M. C., Lundin, L. G., Schioth, H. B. The G-protein-coupled receptors in the human genome form five main families. Phylogenetic analysis, paralogon groups, and fingerprints. Mol Pharmacol. 63, 1256-1272 (2003).
- Milligan, G., Kostenis, E. Heterotrimeric G-proteins: A short history. Br J Pharmacol. 147 Suppl 1, S46-S55 (2006).
- Oldham, W. M., Hamm, H. E. Heterotrimeric G protein activation by G-protein-coupled receptors. Nat Rev Mol Cell Biol. 9, 60-71 (2008).
- Tuteja, N. Signaling through G protein coupled receptors. Plant Signal Behav. 4, 942-947 (2009).
- Neves, S. R., Ram, P. T., Iyengar, R. G protein pathways. Science. 296, 1636-1639 (2002).
- Gurevich, E. V., Tesmer, J. J., Mushegian, A., Gurevich, V. V. G protein-coupled receptor kinases: more than just kinases and not only for GPCRs. Pharmacol Ther. 133, 40-69 (2012).
- Smith, J. S., Rajagopal, S. The beta-arrestins: Multifunctional regulators of G protein-coupled receptors. J Biol Chem. 291, 8969-8977 (2016).
- Pierce, K. L., Premont, R. T., Lefkowitz, R. J. Seven-transmembrane receptors. Nat Rev Mol Cell Biol. 3, 639-650 (2002).
- Hopkins, A. L., Groom, C. R. The druggable genome. Nat Rev Drug Discov. 1, 727-730 (2002).
- Lappano, R., Maggiolini, M. G protein-coupled receptors: Novel targets for drug discovery in cancer. Nat Rev Drug Discov. 10, 47-60 (2011).
- Chatterjee, S., Behnam Azad, ., Nimmagadda, B., S, The intricate role of CXCR4 in cancer. Adv Cancer Res. 124, 31-82 (2014).
- Bleul, C. C., Farzan, M., Choe, H., Parolin, C., Clark-Lewis, I., Sodroski, J., Springer, T. A. The lymphocyte chemoattractant SDF-1 is a ligand for LESTR/fusin and blocks HIV-1 entry. Nature. 382, 829-833 (1996).
- Flomenberg, N., DiPersio, J., Calandra, G. Role of CXCR4 chemokine receptor blockade using AMD3100 for mobilization of autologous hematopoietic progenitor cells. Acta Haematol. 114, 198-205 (2005).
- Domanska, U. M., Kruizinga, R. C., Nagengast, W. B., Timmer-Bosscha, H., Huls, G., de Vries, E. G., Walenkamp, A. M. A review on CXCR4/CXCL12 axis in oncology: No place to hide. Eur J Cancer. 49, 219-230 (2013).
- Tsou, L. K., Huang, Y. H., Song, J. S., Ke, Y. Y., Huang, J. K., Shia, K. S. Harnessing CXCR4 antagonists in stem cell mobilization, HIV infection, ischemic diseases, and oncology. Med Res Rev. , (2017).
- Schols, D., Struyf, S., Van Damme, J., Este, J. A., Henson, G., De Clercq, E. Inhibition of T-tropic HIV strains by selective antagonization of the chemokine receptor CXCR4. J Exp Med. 186, 1383-1388 (1997).
- Van Hout, A., D'Huys, T., Oeyen, M., Schols, D., Van Loy, T. Comparison of cell-based assays for the identification and evaluation of competitive CXCR4 inhibitors. PLoS One. 12, e0176057 (2017).
- De Clercq, E. The AMD3100 story: the path to the discovery of a stem cell mobilizer (Mozobil). Biochem Pharmacol. 77, 1655-1664 (2009).
- Debnath, B., Xu, S., Grande, F., Garofalo, A., Neamati, N. Small molecule inhibitors of CXCR4. Theranostics. 3, 47-75 (2013).
- Woodard, L. E., Nimmagadda, S. CXCR4-based imaging agents. J Nucl Med. 52, 1665-1669 (2011).
- Wang, Y., Xie, Y., Oupicky, D. Potential of CXCR4/CXCL12 Chemokine Axis in Cancer Drug Delivery. Curr Pharmacol Rep. 2, 1-10 (2016).
- Nimmagadda, S., Pullambhatla, M., Stone, K., Green, G., Bhujwalla, Z. M., Pomper, M. G. Molecular imaging of CXCR4 receptor expression in human cancer xenografts with [64Cu]AMD3100 positron emission tomography. Cancer Res. 70, 3935-3944 (2010).
- De Silva, R. A., Peyre, K., Pullambhatla, M., Fox, J. J., Pomper, M. G., Nimmagadda, S. Imaging CXCR4 expression in human cancer xenografts: evaluation of monocyclam 64Cu-AMD3465. J Nucl Med. 52, 986-993 (2011).
- Hatse, S., Princen, K., Liekens, S., Vermeire, K., De Clercq, E., Schols, D. Fluorescent CXCL12AF647 as a novel probe for nonradioactive CXCL12/CXCR4 cellular interaction studies. Cytometry A. 61, 178-188 (2004).
- Wootten, D., Christopoulos, A., Sexton, P. M. Emerging paradigms in GPCR allostery: implications for drug discovery. Nat Rev Drug Discov. 12, 630-644 (2013).
- Louis, K. S., Siegel, A. C. Cell viability analysis using trypan blue: manual and automated methods. Methods Mol Biol. 740, 7-12 (2011).
- Perry, C. M. Maraviroc: a review of its use in the management of CCR5-tropic HIV-1 infection. Drugs. 70, 1189-1213 (2010).
- Moyle, G., DeJesus, E., Boffito, M., Wong, R. S., Gibney, C., Badel, K., MacFarland, R., Calandra, G., Bridger, G., Becker, S. Proof of activity with AMD11070, an orally bioavailable inhibitor of CXCR4-tropic HIV type 1. Clin Infect Dis. 48, 798-805 (2009).
- Balabanian, K., Lagane, B., Infantino, S., Chow, K. Y., Harriague, J., Moepps, B., Arenzana-Seisdedos, F., Thelen, M., Bachelerie, F. The chemokine SDF-1/CXCL12 binds to and signals through the orphan receptor RDC1 in T lymphocytes. J Biol Chem. 280, 35760-35766 (2005).
- Burns, J. M., Summers, B. C., Wang, Y., Melikian, A., Berahovich, R., Miao, Z., Penfold, M. E., Sunshine, M. J., Littman, D. R., Kuo, C. J., Wei, K., McMaster, B. E., Wright, K., Howard, M. C., Schall, T. J. A novel chemokine receptor for SDF-1 and I-TAC involved in cell survival, cell adhesion, and tumor development. J Exp Med. 203, 2201-2213 (2006).
- Stoddart, L. A., Kilpatrick, L. E., Briddon, S. J., Hill, S. J. Probing the pharmacology of G protein-coupled receptors with fluorescent ligands. Neuropharmacology. 98, 48-57 (2015).
- Vernall, A. J., Hill, S. J., Kellam, B. The evolving small-molecule fluorescent-conjugate toolbox for Class A GPCRs. Br J Pharmacol. 171, 1073-1084 (2014).
- Stoddart, L. A., White, C. W., Nguyen, K., Hill, S. J., Pfleger, K. D. Fluorescence- and bioluminescence-based approaches to study GPCR ligand binding. Br J Pharmacol. 173, 3028-3037 (2016).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon