Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Fluorescently etiketli CXC Kemokin Ligand 12 CXC Kemokin reseptör 4 için bağlama bozabilir bileşikler tanımlamak için Akış Sitometresi tabanlı tahlil
Bu Makalede
Özet
Sitometresi tabanlı hücresel bağlama tahlil anlatılan ve öncelikle bir tarama aracı olarak bir fluorescently etiketli CXC Kemokin ligand 12 (CXCL12) bağlama CXC Kemokin reseptör 4 (CXCR4) inhibe bileşikler tanımlamak için kullanılan bir akış.
Özet
Disfonksiyonel GPCR aracılı sinyalleşme birçok hastalığın ilerleme katkıda gibi farmakolojik G protein birleştiğinde reseptörleri (GPCRs) insan sağlığı için büyük önem hedefliyor. Ligand/reseptör çifti CXC Kemokin ligand 12 (CXCL12) / CXC Kemokin reseptör 4 (CXCR4) yükseltti önemli klinik faiz, örneğin kanser ve inflamatuar hastalıkları tedavisi için potansiyel bir hedef olarak. Küçük moleküller yanı sıra özellikle CXCR4 hedef ve reseptör'ın işlevi inhibe terapötik antikorlar bu nedenle değerli farmakolojik araçlar olarak kabul edilir. Burada, CXCL12 bağlama CXCR4, iptal etmek bileşikler (Örneğin, küçük moleküller) tanımlaması sağlayan bir Akış Sitometresi tabanlı hücresel tahlil açıklanmıştır. Esasen, tahlil yarışma fluorescently etiketli CXCL12, doğal Kemokin agonist CXCR4 için sabit bir miktarda ve etiketsiz bileşikler arasında bağlama reseptör için kullanır. Bu nedenle, radioactively etiketli probları istenmeyen kullanımı bu tahlil önlenmiş olur. Ayrıca, canlı hücreler reseptör (CXCR4) hücre zarının ürünleri yerine kaynağı olarak kullanılır. Bu tahlil daha fazla işlem hacmi artar bir plaka biçimine kolay uyum sağlar. Bu Tahlil CXCR4 hedefleme bileşenleri tanımlamak için değerli jenerik ilaç keşif tahlil için gösterilmiştir. Protokol büyük olasılıkla en az fluorescently etiketli ligandlar kullanılabilir veya oluşturulabilir diğer GPCRs için adapte edilebilir. Bu GPCRs aktivasyonu indüklenen hücre içi sinyal yolları ile ilgili ön bilgi gerekli değildir.
Giriş
G protein birleştiğinde reseptörleri (GPCRs) hücre yüzey proteinler hücre dışı ligandlar (Örneğin, peptidler, protein hormonlar, aminler) tarafından etkinleştirilebilir, böylece birçok fizyolojik ve gelişimsel düzenleyen1işler. Ne zaman bir agonist onun GPCR bağlama cep kaplar, indüklenen konformasyonal değişim reseptör protein Gαoluşan bağlama hücre içi heterotrimeric G reseptör ilişkili proteinlerin teşvik - GSYİH ve Gβγ alt birimleri. GTP ki, buna karşılık, daha da aşağı başlatacaktır G protein alt (Gα-GTP ve Gβγ) ayrılma Gα alt birim sonuçlarında üzerinde sonraki exchange GSYİH için yolları2,3işaret. Gα-GTP hidrolize olur zaman yeniden Derneği Gα- GSYİH ve Gβγ alt birimleri gr protein geri onun istirahat devlet3,4dönüştürür. G proteinlerin farklı türleri (Gs, Gg/ç, Gq, G12/13) mevcut, hangi ile Gα alt birim5sıra benzerlik göre kategorize edilir. Tüm bu G protein reseptörü harekete geçirmek için biyolojik yanıt altında yatan tanımlı hücre içi sinyal yolları teşvik. Reseptör etkinleştirme sonraki GPCR kinaz (GRKs) GPCRs, böylece β-arrestins ile etkileşimi teşvik hücre içi kuyruğunun fazdan. Bu işlem sinyal, reseptör duyarsızlaştırma ve içselleştirilmesi6gr protein sona erdirilmesi için yol açar. Β-arrestins de çok moleküler komplekslerin tetikleyici sinyal7sinyal G protein bağımsız basamaklandırır parçasıdır.
Kuralsız GPCR aracılı, örneğin reseptör gen veya reseptör overexpression, işlev kazanç mutasyonların nedeniyle sinyal birçok nedenleri katkıda terapötik müdahale için en doğrulanmış moleküler hedefler arasında GPCRs şunlardır insan hastalıkları8. Bu nedenle, GPCRs ilaç endüstrisi8,9,10tarafından araştırıldı uyuşturucu hedeflerinden en önemli sınıflarından birini temsil eder. Bir kayda değer bir klinik GPCR CXC Kemokin reseptör 4 (CXCR4), bir tek doğal ligand, CXC Kemokin ligand 12 (CXCL12)11tarafından etkinleştirilen örnektir. Kurulan olarak rolünü büyük bir co reseptör için insan immün yetmezlik virüsü 1 (HIV-1) nedeniyle giriş ve enfeksiyon kümedeki olumlu T-lenfositleri12, CXCR4 ilk bir antiviral ilaç hedef olarak araştırıldı farklılaşma 4 (CD4). CXCL12-CXCR4 etkileşim daha fazla kemik iliğinde tutma düzenleyen ve posta kök ve Dede13hücreleri. Ayrıca, birçok açıdan kanser biyoloji (Örneğin, tümör hücre survival, metastaz, tümör ile ilgili angiogenez)14 ve birkaç diğer insan hastalıkları (Örneğin, inflamatuar hastalıkları)15, CXCR4 onun tutulumu verilen faiz önemli ilaç keşfi için umut verici bir hedef olarak ortaya çıkar. AMD3100, özellikle CXCR4, hedefleyen bağlanabilecek küçük bir moleküldür başlangıçta bir Anti-HIV ilaç aday16 keşfedilmiştir ve hala tarihi17için açıklanan en güçlü CXCR4 antagonistleri biridir. Bir antiviral ilaç olduğu, ancak, onun gelişme18üretilmiyor. Şu anda bu molekül Multipl Miyelom ve lenfoma hastaları18tedavi sırasında bir kök hücre seferberlik ajan olarak kullanılır. Diğer çeşitli kimyasal olarak ilgisiz küçük moleküller ve CXCR4 işlevi ile değişen etki gücüne inhibe destekte açıklanan19olmuştur.
Reseptör bağlama yöntemleri, doğrudan etkileşim bileşikler (Örneğin, küçük moleküller) tanımlaması GPCR ilgi ile izin Farmakoloji değerli araçlardır. Bağlama çalışmaları gerçekleştirmek için hücre içi sinyal özellikleri veya belirli bir GPCR işlevselliğini hakkında ön bilgi için gerek yoktur. Her ne kadar bu bir avantaj olarak kabul, bu bileşikler hangi reseptör için bağlama göstermiş olabilir daha fazla potansiyel agonistik veya antagonistik faaliyetlerini değerlendirerek karakterize edilebilir gerekir anlamına gelir. Bu etkinliği GPCR altında eğitim ile ilgili farmakolojik veya biyolojik deneyleri kullanılarak değerlendirilebilir. Onların etkinlik profili üzerinde bağımlı, reseptör bağlama molekülleri sonra potansiyel olarak roman kurşun bileşikleri önceden klinik ve klinik çalışmalarda soruşturma için olmak için gelişecek. Özellikle yüksek benzeşimli bir reseptör bağlamak moleküller de tedavi veya tanı araçları, örneğin tümör hücreleri20, noninvaziv vivo içinde görüntüleme için radiolabeling tarafından oluşturmak için iskele veya potansiyel olarak hizmet verebilir Araçlar'therapeutics21hedeflenen dır. CXCR4 durumunda, in vivo görüntüleme tümör hücrelerinin zaten neyin Etiketli CXCR4 hedefleme molekülleri insan kanser xenografts20,22,23 görselleştirme izin fare modelleri kullanarak kanıtlanmıştır .
Bu raporda, biz küçük moleküller ve doğrudan agonist (CXCL12) ile CXCR4 bağlayıcı müdahale destekte sağlar bir rekabet bağlama tahlil için detaylı bir protokol tanımlamak. Sabit bir miktar olan fluorescently etiketli ligand arasındaki rekabet testin temel ilkedir (CXCL12AF647, bkz: malzemeler tablo ve reaktifler) ve etiketsiz bileşikler bağlama reseptör protein17, için 24. etiketli ligand CXCR4 ifade tek hücrelere bağlı belirli floresan sinyalden sonra Akış Sitometresi tarafından analiz edilir. Etiketlenmemiş küçük moleküller arasındaki etkileşim CXCL12AF647 ve CXCR4 bozabilir zaman bu floresan sinyal azalacaktır. Tahlil endogenously CXCR4 hızlı sigara manipüle canlı hücreler kullanır (Yani, Jurkat hücreleri). Bu nedenle, hiçbir hücre zarı hazırlık gereklidir uygun, hızlı ve artan işlem hacmi ile uyumlu tahlil yapar. Fluorescently etiketli bir ligand kullanıldığından, radyoaktivite önlenmiş olur.
CXCL12 doğal agonist CXCR4 için olduğundan, tahlil bağlamasında CXCL12AF647 müdahale küçük molekül bileşikler (bağlama sitesi doğal tarafından işgalYani, orthosteric reseptör bağlama site ile etkileşimde muhtemeldir agonist). CXCL12 bağlantısını etkilemez arazi orthosteric bağlama sitesinden farklı reseptör bağlama siteleriyle etkileşim molekülleri undetected, kalır. Örneğin, pozitif ve negatif allosteric modülatörler, allosteric bağlama siteleri25, oyunculuk molekülleri hedefleme GPCR önemli ve gelişmekte olan bir Kategorideki bu tahlil ile seçilmiş olacak potansiyel olarak değil. Buna ek olarak, bileşikleri bu bağlama tahlil işleviyle reseptör antagonistleri veya agonistler olarak tanımlanan olup olmadığını türetilemez. Soruşturma ek farmakolojik veya fonksiyonel reseptör ilgili deneyleri içinde tanımlanan bileşiklerin böylece gerekli olacaktır. Bu deneyleri (birleşimi) içerebilir hücresel floresan veya ışıldama tabanlı deneyleri ikinci haberci (örneğin, Ca2 +, siklik adenozin monofosfattır (kampı)), fenotipik tespiti için veya biyolojik deneyleri ve β-arrestin İşe Alım deneyleri, belirli sinyal özelliklerinde GPCR altında eğitim, hangi seçim bağlıdır. Bu nedenle, burada esas olarak açıklanan rekabetçi bağlama tahlil bileşikler derinlemesine bir karakterizasyonu reseptör bağlama kudret ile etkinleştirmek için diğer hücre tabanlı deneyleri ile tamamlanabilir gerekir bir başlangıç tarama yöntemi olarak hizmet vermektedir.
Protokol
1. hücre kültürü bakımından
Not: 1 ve 2 altında açıklanan tüm adımları laminar akışı kabine steril koşullarda yapılmaktadır.
- T75 kültür şişeler 37 ° C ve % 5 CO2 oksijen kuluçka hücrelerinde büyür.
Not: Bu tahlil Jurkat hücreler (Yani, endogenously CXCR417hızlı insan lösemik T lenfosit hücreleri) kullanılır. CXCR4 ifade hücre yüzeyinde Akış Sitometresi aracılığıyla hücre kültürü çalışmalarının boyunca değerlendirilmelidir. Akış Sitometresi yordam ve reaktifler reseptör ifade seviyeleri hücre yüzeyinde, ancak, bu protokol kapsamında değildir ancak olmuştur belirlemek için bir açıklama daha önce17açıklanan. - Jurkat hücreleri % 80-85 ulaşana kadar süspansiyon confluency büyümesine izin. Roman bir şişesi hücrelere passaging önce oda sıcaklığında (RT) ulaşmak tüm reaktifler izin.
- 20 mL taze tam büyüme orta (RPMI-1640 orta, % 10 fetal sığır serum (FBS), 2 mM glutamin) bir roman T75 kültür şişesi için ekleyin.
- Jurkat hücre süspansiyon 5 mL (hücre süspansiyon 25 mL içeren) özgün T75 balonun roman T75 kültür şişesi ekleyin. 37 ° C ve % 5 CO2 oksijen kuluçka kuluçkaya.
2. CXCL12, tahlil arabellek ve Jurkat hücreleri için hazırlanması tahlil bağlama rekabet.
- CXCL12AF647 (20 µg/mL; bkz: malzemeler tablo ve Kimyasalları) stok çözeltisi (-80 ° C'de, karanlıkta saklanan) lyophilized reaktif % 0,01 ile (birim/birim) Polysorbate 20 takıma ultrasaf su çözülerek hazırlayın. Tek Kişilik Kullanım aliquots ışıktan korunan-80 ° C'de hisse senedi bu çözümden saklayın.
- Tahlil arabellek 40 mL HEPES (1 M, 20 mM son konsantrasyonu) ekleyerek 200 mL Hank'in dengeli tuz solüsyonu (HBSS, 10 x, fenol red ve sodyum bikarbonat, 1 x son toplama olmadan) için hazır olun. 2 L. eklemek 4 g (%0,2 ağırlık/hacim) sığır serum albumin (BSA) son bir hacim elde edilir ve BSA manyetik yoluyla dağıtılması ultrasaf su Ekle karıştırma. Son olarak, pH 7,4 (kullanmak NaOH bunun için) için ayarlamak ve solution'ı (bakınız tablo malzemeleri ve Kimyasalları) 0.2 µm gözenekleri filtre manifold vakum kullanarak.
Not: Bu tahlil arabellek tüm adımlarını daha fazla iletişim kuralı kullanılır. - Sayısı sayısı ve hücrelerin canlılık. Bunun için hücre süspansiyon örneğini alın ve fosfat tamponlu tuz (PBS) oranında seyreltin.
Not: Rutin bir otomatik hücre canlılığı analizörü kullanın (bkz. tablo malzemeleri ve Kimyasalları) hücre süspansiyonlar değişik konsantrasyonlarda sayma yeteneğine sahip. Hücre sayımı için hücre süspansiyon 1,5 ml ( Örneğin, 0.1 mL 1,9 ml PBS, diğer dilutions da mümkündür) PBS 0.5 mL seyreltik. Trypan mavi boya dışlama yöntemi üzerinde dayanır, bu yöntemin kullanılması oldu daha önce açıklanan26. Birkaç diğer cihazlar cep telefonu numarasını ve eşit derecede iyi çalışması gerekir canlılığı sayım için ticari olarak kullanılabilir. - (Yani, ~ 24 x 106 hücre tahlil bir tam 96-şey plaka ile çalıştırmak için) hücreleri için istediğiniz sayıyı bir steril 50 mL tüp içinde 400 x g 5 min için de Santrifüjü tarafından (bkz. tablo malzeme ve reaktifler santrifüj türü için kullanılan) toplamak RT.
- Yavaşça süpernatant hücre Pelet bozmadan dökün. Taze tahlil arabellek ekleyin (Örneğin, 20 mL) ve hücrelerin yavaşça yukarı ve aşağı pipetting tarafından resuspend.
- Hücreleri yeniden vasıl 400 x g RT., 5 min için santrifüj kapasitesi
- Süpernatant tekrar dökün ve hücre Pelet 5 x 106 hücre/mL yoğunluğu elde etmek için taze tahlil arabellekte resuspend.
3. yarışma bağlama tahlil
Not: Gerçek rekabet bağlama tahlil RT gerçekleştirilir ve non-steril koşullarda yapılabilir.
- Soruşturma tahlil tampon altında bileşikler seyreltik (istenen konsantrasyonu elde etmek için 2.2 bkz:). Daha fazla bileşikleri karakterizasyonu için ya bileşik başlangıç tarama (Örneğin, 10 µM son konsantrasyonu) için sabit bir konsantrasyon veya alternatif olarak, konsantrasyonları bir seri seyreltme dizi hazırlamak (Örneğin, 1/3, 1/4 veya 1 / 5 seyreltme serisi) 1 µM, nihai toplama başlangıç. Bileşik çözüm sonuçta 2 x assay olarak seyreltilmiş olacak unutmayın; Bu nedenle, bir 2 x konsantre çözüm hazır olun.
- Bir kuyuya temiz 96-yuvarlak alt plaka bileşik çözüm (2 x konsantre) 100 µL dağıtmak (bkz: malzemeler tablo ve reaktifler) göre bir önceden tanımlanmış deneysel paralamak (Örneğin, şekil 1 c).
Not: Bu aşamada, negatif ve pozitif kontrol örnekleri assay olarak eklenmiştir. Negatif kontrol örnektahlil arabelleği 100 µL 96-şey plaka wells için bileşik yerine eklenir. Pozitif kontrol örnekiçin tahlil arabellek de bu adımı sırasında eklenir. Ayrıca şekil 1 c çeşitli bileşenler seyreltme dizi test tipik bir deneysel düzen için bkz. - Hücre süspansiyon 50 µL ekleyin (2,7; bkz: 0,25 x 106 hücreler) bir çok kanallı pipet kullanarak 96-şey plaka içine bir reaktif rezervuar. RT, 15 dk karanlıkta plaka kuluçkaya.
- Fluorescently etiketli CXCL12 50 µL ekleyin (Yani, 100 ng/mL CXCL12AF647 tahlil arabellek, 4 x konsantre, 25 ng/mL nihai toplama) benzer bir reaktif rezervuar 96-şey plaka kuyu. RT, 30 dk içinde belgili tanımlık karanlık için kuluçkaya.
Not: negatif kontrol örnekleriiçin bunun yerine tahlil arabellek ekleyin. Bu nedenle, floresan sinyali algılandı negatif kontrol örnekleri autofluorescent arka plan sinyal (şekil 1A) karşılık gelir. Pozitif kontrol örnekleriiçin 50 µL/iyi CXCL12AF647ekleyin. Pozitif kontrol örnekleri yok olası inhibisyon bileşikler ile ön kuluçka tarafından dahil bu yana algılanan maksimal Floresans sinyal (şekil 1A) ortaya çıkarır. - 400 x g RT. Kaldır süpernatant pelleted hücrelerden, 5 min için de 96-şey plaka plaka üzerinde saygısız santrifüj kapasitesi. Bir doku tabakta kuru.
- Taze tahlil arabelleği 200 µL reaktif su deposu bir çok kanallı pipet kullanarak wells ekleyin. Derhal gidin.
- Yine de RT. Kaldır süpernatant 400 x g, 5 min için plaka plaka üzerinde saygısız santrifüj kapasitesi ve tekrar doku üzerinde kuru.
- Yavaşça hücre Pelet 200 µL % 1 paraformaldehyde PBS içinde çözünmüş olarak resuspend. Bu adımı hücreleri ortadan kaldırır.
- Floresans miktar hemen protokolüyle Akış Sitometresi tarafından devam.
4. analiz örnekleri tarafından Akış Sitometresi
CXCL12AF647 lekeli ve saplantısı hücreleri artık Akış Sitometresi kullanarak çözümlenmesi hazırız. Akış cytometers çeşitli kullanılabilir ancak uyarma ve fluorophore algılama için uygun filtreler için doğru lazer (Yani, kırmızı bir lazer, uyarma aralığı ~ 630 nm) ile donatılmış olması gerekir (emisyon filtreleri ~ 660 nm). 96-şey plaka kartvizitlere örnekleri taşıma kapasitesine sahip olmak istiyorlar. Uygun Akış Sitometresi aygıtlara örnek olarak tablo malzemeleri ve Kimyasallarıverilir.
- Cihaz başlatın ve karşılık gelen yazılım açın (bkz. tablo malzemeleri ve Kimyasalları).
- Bir nokta leke biçiminde görüntülenmeyecektir için hücresel aşağıdaki parametreleri seçin: ileri dağılım (FSC), yan dağılım (SSC) ve fluorophore (CXCL12AF647) algılama kanal.
Not: algılanan ışık emilimi hücrenin çapı için orantılı olduğundan FSC parametresiyle hücreleri onların boyutu temelinde ayrımcılık. 90 ° açıyla ışık saçılma ölçüm SSC parametre taneciklik hücrelerin Kılavuzu. - FSC ve SSC parametrelere göre tanımlanmış homojen hücre nüfusunun geçişi gerçekleştirmek için bir örnek (Örneğin, bir negatif kontrol örnek) seçin.
- Otomatik enjeksiyon ~ 100 µL saplantısı hücre Akış Sitometresi bu negatif kontrol örnek seçin. Seçenek "enjeksiyon önce karıştırma" seçin ve bir örnek Debi 1.5 µL/s kullanın.
- Bu örnek "Edinme verileri." seçerek çalıştırın Bu örnek için FSC ve SSC parametreleri şimdi ekranda görünür.
- Yazılım'ın gating aracını seçin. FSC ve SSC nokta leke görselleştirme üzerinde bağlı olarak, homojen ve uygulanabilir hücre nüfus çoğunluğuna tarafından önceden tanımlayın. Bunu yapmak için homojen dağıtılmış tek hücreleri ("olaylar") bu iki boyut üzerinde alarak içerir (yazılımın gating aracını kullanarak) bir çokgen oluşturun.
Not: Daha fazla çözümleme için kullanılacak bir homojen ve uygulanabilir hücre nüfusu tanımlamak için gating yordamı amaçlamaktadır. Perdeleme hücrelerin çoğunluğu FSC ve SSC parametreleri temel alınarak bir homojen hücre nüfus oluşturacak varsayımına dayanır. Bu adımı uygulayarak, hücresel enkaz, ölü hücreleri ve hücre toplamları büyük ölçüde daha fazla analiz dışı bırakılabilir. Perdeleme süreci bir çizimi şekil 1Badımında verilir.
- 20.000 "olaylar" (Yani, tek hücreleri) örnek başına analiz etmek için seçin.
Not: Bu her örnek için önceden tanımlanmış kapıyı içinde kalan 20.000 hücre sonunda incelenecek anlamına gelir. Bu olay sayısı analiz edilir kadar veri toplama her örnek için devam edecektir. - Çalıştır (select "kayıt verileri") başlatın. Akış Sitometresi aygıt şimdi her örnek için ortalama Floresans yoğunluğu (MFI) kaydederek tüm örneklerini tek tek analiz eder. Bu MFI içinde önceden tanımlanmış geçit düşmek 20.000 hücreleri karşılık gelen kötü floresan sinyal karşılık gelir.
5. veri analizi
Her örnek için elde edilen MFI tüm diğer hesaplamaları gerçekleştirmek için kullanın. Akış Sitometresi veri analizi (bkz: malzemeler tablo ve reaktifler) çeşitli ticari yazılım paketleri tarafından gerçekleştirilebilir.
- Floresan bağlama sinyal, bileşik ön kuluçka, bir sonucu olarak yüzde inhibisyonu belirlemek için aşağıdaki formül uygulanır:
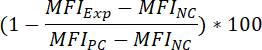
Nerede:
MFIExp MFI, deneysel (= bileşik tedavi) = örnek
MFIPC olumlu denetim MFI =
MFINC negatif kontrol MFI = - Bir bileşik (Yani, floresan bağlama sinyal % 50 oranında azaltabilir bileşik konsantrasyonu) ŞA50 değeri belirlemek için aşağıdaki formül uygulanır:
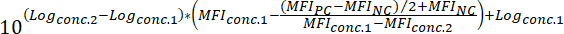
Nerede:
Günlükconc.2 içinde % 50'den az sonuçları bileşik bir konsantrasyon günlük = PC ve NC MFI değer arasındaki fark inhibisyonu
Günlükconc.1 içinde % 50'den fazla sonuç bileşik bir konsantrasyon günlük = PC ve NC MFI değer arasındaki fark inhibisyonu
Not: Alternatif olarak, son derece aktif bileşikler halinde büyüklükte birkaç günlükleri kapsayan bir doz-yanıt eğrisi bileşik her test konsantrasyon için karşılık gelen MFI göre oluşturulabilir. Doğrusal olmayan regresyon eğrisi uygun uygun yazılımı kullanarak uygulayarak (bkz. tablo malzemeleri ve reaktifler), ŞA50 değerleri sonra sonucuna ki oluşturulan eğrileri. Bu analiz yaklaşım örneği şekil 3' te gösterilmiştir.
Sonuçlar
Genel iş akışını bağlama tahlil ve şekil 1Aile sunulur. Farklı örnek türleri (Örneğin, negatif kontrol, pozitif kontrol ve deneysel örnek) standart bir deneyde elde edilen Akış Sitometresi veri türüne bir örnek şekil 1Bve olası plaka düzen içinde gerçekleştirmek için tasvir tahlil bir 96-şey plaka biçiminde şekil 1 ciçinde verilir. Kuluçka endogenously Kemokin r...
Tartışmalar
Bağlama deneyleri (Yani, doygunluk bağlama ve Kinetik bağlama deneyler), diğer türleri için karşılaştırıldığında, rekabet bağlama deneyleri amacıyla filtreleme için en uygundur. Gerçekten de, onların yeteneklilik-e doğru sabit tutar etiketli Reseptör ligand olan bağlama ile müdahale puanlama tarafından etiketlenmemiş bileşikleri, örneğin küçük moleküller, büyük toplu işlemleri değerlendirilmesi sağlarlar. Etiketli ligand daha diğer reseptör sitelere bağlamak bileşikler ta...
Açıklamalar
Yazarlar ifşa gerek yok.
Teşekkürler
Yazarlar Eric Fonteyn mükemmel teknik destek için teşekkür etmek istiyorum. Bu eser KU Leuven tarafından desteklenmiştir (Hayır verin. PF/10/018), Fonds voor Wetenschappelijk Onderzoek (iki, hayır vermek. G.485.08) ve Fondation Dormeur Vaduz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| BD FACSCanto II | Becton Dickinson | Not applicable | Flow cytometry device |
| BD FACSDIVA Software | |||
| BD FACSArray | Becton Dickinson | Not applicable | Flow cytometry device |
| BD FACSArray System Software | |||
| Graphpad Prism | Graphpad | software package used for nonlinear regression analysis in Figure 2 and Figure 3 | |
| FlowJo | FlowJo is now a wholly owned subsidiary of BD. | ||
| Vi-CELL | Beckman Coulter | Not applicable | cell viability analyzer |
| Sigma 3-18 KS | Sigma | Not applicable | centrifuge |
| AMD3100 | Sigma | A5602-5mg | specific CXCR4 antagonist |
| Maraviroc | Pfizer | antiretroviral drug, CCR5 antagonist, available for research at Selleckchem (cat#S2003), Sigma (cat#PZ0002) | |
| h-SDF1a (AF647) | ALMAC | CAF-11-B-01 | fluorescently labeled CXCL12, CXCL12AF647 |
| Fetal Bovine Serum (FBS) | Gibco (Life Technologies) | 10270-106 | |
| Bovine Serum Albumin (BSA) | Sigma | A1933-25G | |
| HBSS (10x), calcium, magnesium, no phenol red | Gibco (Life Technologies) | 14065-049 | |
| HEPES (1M) | Gibco (Life Technologies) | 15630-056 | |
| Dulbecco's Phosphate Buffered Saline (DPBS) | Gibco (Life Technologies) | 14190-094 | |
| Jurkat cells | ATCC | ||
| Reagent reservoir PP | Sigma | BR703411 | |
| Rapid flow filter: 0.2 µm aPES | Thermo Scientific | 566-0020 | |
| Sterilin microtiter plate, 96-well, U bottom, clear | Thermo Scientific | 611U96 | |
| Falcon tubes, 50ml | Greiner Bio-One | 227 261 | |
| Tissue culture flask (T75) | Corning | 353024 |
Referanslar
- Fredriksson, R., Lagerstrom, M. C., Lundin, L. G., Schioth, H. B. The G-protein-coupled receptors in the human genome form five main families. Phylogenetic analysis, paralogon groups, and fingerprints. Mol Pharmacol. 63, 1256-1272 (2003).
- Milligan, G., Kostenis, E. Heterotrimeric G-proteins: A short history. Br J Pharmacol. 147 Suppl 1, S46-S55 (2006).
- Oldham, W. M., Hamm, H. E. Heterotrimeric G protein activation by G-protein-coupled receptors. Nat Rev Mol Cell Biol. 9, 60-71 (2008).
- Tuteja, N. Signaling through G protein coupled receptors. Plant Signal Behav. 4, 942-947 (2009).
- Neves, S. R., Ram, P. T., Iyengar, R. G protein pathways. Science. 296, 1636-1639 (2002).
- Gurevich, E. V., Tesmer, J. J., Mushegian, A., Gurevich, V. V. G protein-coupled receptor kinases: more than just kinases and not only for GPCRs. Pharmacol Ther. 133, 40-69 (2012).
- Smith, J. S., Rajagopal, S. The beta-arrestins: Multifunctional regulators of G protein-coupled receptors. J Biol Chem. 291, 8969-8977 (2016).
- Pierce, K. L., Premont, R. T., Lefkowitz, R. J. Seven-transmembrane receptors. Nat Rev Mol Cell Biol. 3, 639-650 (2002).
- Hopkins, A. L., Groom, C. R. The druggable genome. Nat Rev Drug Discov. 1, 727-730 (2002).
- Lappano, R., Maggiolini, M. G protein-coupled receptors: Novel targets for drug discovery in cancer. Nat Rev Drug Discov. 10, 47-60 (2011).
- Chatterjee, S., Behnam Azad, ., Nimmagadda, B., S, The intricate role of CXCR4 in cancer. Adv Cancer Res. 124, 31-82 (2014).
- Bleul, C. C., Farzan, M., Choe, H., Parolin, C., Clark-Lewis, I., Sodroski, J., Springer, T. A. The lymphocyte chemoattractant SDF-1 is a ligand for LESTR/fusin and blocks HIV-1 entry. Nature. 382, 829-833 (1996).
- Flomenberg, N., DiPersio, J., Calandra, G. Role of CXCR4 chemokine receptor blockade using AMD3100 for mobilization of autologous hematopoietic progenitor cells. Acta Haematol. 114, 198-205 (2005).
- Domanska, U. M., Kruizinga, R. C., Nagengast, W. B., Timmer-Bosscha, H., Huls, G., de Vries, E. G., Walenkamp, A. M. A review on CXCR4/CXCL12 axis in oncology: No place to hide. Eur J Cancer. 49, 219-230 (2013).
- Tsou, L. K., Huang, Y. H., Song, J. S., Ke, Y. Y., Huang, J. K., Shia, K. S. Harnessing CXCR4 antagonists in stem cell mobilization, HIV infection, ischemic diseases, and oncology. Med Res Rev. , (2017).
- Schols, D., Struyf, S., Van Damme, J., Este, J. A., Henson, G., De Clercq, E. Inhibition of T-tropic HIV strains by selective antagonization of the chemokine receptor CXCR4. J Exp Med. 186, 1383-1388 (1997).
- Van Hout, A., D'Huys, T., Oeyen, M., Schols, D., Van Loy, T. Comparison of cell-based assays for the identification and evaluation of competitive CXCR4 inhibitors. PLoS One. 12, e0176057 (2017).
- De Clercq, E. The AMD3100 story: the path to the discovery of a stem cell mobilizer (Mozobil). Biochem Pharmacol. 77, 1655-1664 (2009).
- Debnath, B., Xu, S., Grande, F., Garofalo, A., Neamati, N. Small molecule inhibitors of CXCR4. Theranostics. 3, 47-75 (2013).
- Woodard, L. E., Nimmagadda, S. CXCR4-based imaging agents. J Nucl Med. 52, 1665-1669 (2011).
- Wang, Y., Xie, Y., Oupicky, D. Potential of CXCR4/CXCL12 Chemokine Axis in Cancer Drug Delivery. Curr Pharmacol Rep. 2, 1-10 (2016).
- Nimmagadda, S., Pullambhatla, M., Stone, K., Green, G., Bhujwalla, Z. M., Pomper, M. G. Molecular imaging of CXCR4 receptor expression in human cancer xenografts with [64Cu]AMD3100 positron emission tomography. Cancer Res. 70, 3935-3944 (2010).
- De Silva, R. A., Peyre, K., Pullambhatla, M., Fox, J. J., Pomper, M. G., Nimmagadda, S. Imaging CXCR4 expression in human cancer xenografts: evaluation of monocyclam 64Cu-AMD3465. J Nucl Med. 52, 986-993 (2011).
- Hatse, S., Princen, K., Liekens, S., Vermeire, K., De Clercq, E., Schols, D. Fluorescent CXCL12AF647 as a novel probe for nonradioactive CXCL12/CXCR4 cellular interaction studies. Cytometry A. 61, 178-188 (2004).
- Wootten, D., Christopoulos, A., Sexton, P. M. Emerging paradigms in GPCR allostery: implications for drug discovery. Nat Rev Drug Discov. 12, 630-644 (2013).
- Louis, K. S., Siegel, A. C. Cell viability analysis using trypan blue: manual and automated methods. Methods Mol Biol. 740, 7-12 (2011).
- Perry, C. M. Maraviroc: a review of its use in the management of CCR5-tropic HIV-1 infection. Drugs. 70, 1189-1213 (2010).
- Moyle, G., DeJesus, E., Boffito, M., Wong, R. S., Gibney, C., Badel, K., MacFarland, R., Calandra, G., Bridger, G., Becker, S. Proof of activity with AMD11070, an orally bioavailable inhibitor of CXCR4-tropic HIV type 1. Clin Infect Dis. 48, 798-805 (2009).
- Balabanian, K., Lagane, B., Infantino, S., Chow, K. Y., Harriague, J., Moepps, B., Arenzana-Seisdedos, F., Thelen, M., Bachelerie, F. The chemokine SDF-1/CXCL12 binds to and signals through the orphan receptor RDC1 in T lymphocytes. J Biol Chem. 280, 35760-35766 (2005).
- Burns, J. M., Summers, B. C., Wang, Y., Melikian, A., Berahovich, R., Miao, Z., Penfold, M. E., Sunshine, M. J., Littman, D. R., Kuo, C. J., Wei, K., McMaster, B. E., Wright, K., Howard, M. C., Schall, T. J. A novel chemokine receptor for SDF-1 and I-TAC involved in cell survival, cell adhesion, and tumor development. J Exp Med. 203, 2201-2213 (2006).
- Stoddart, L. A., Kilpatrick, L. E., Briddon, S. J., Hill, S. J. Probing the pharmacology of G protein-coupled receptors with fluorescent ligands. Neuropharmacology. 98, 48-57 (2015).
- Vernall, A. J., Hill, S. J., Kellam, B. The evolving small-molecule fluorescent-conjugate toolbox for Class A GPCRs. Br J Pharmacol. 171, 1073-1084 (2014).
- Stoddart, L. A., White, C. W., Nguyen, K., Hill, S. J., Pfleger, K. D. Fluorescence- and bioluminescence-based approaches to study GPCR ligand binding. Br J Pharmacol. 173, 3028-3037 (2016).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır