Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Потока на основе цитометрии проба для выявления соединений, которые нарушают Связывание лиганда дневно меченых КЭС хемокиновых 12 КЭС хемокиновых рецепторов 4
В этой статье
Резюме
Поток, описал сотовой привязку на основе цитометрии пробирного, который используется главным образом как инструмент скрининга для выявления соединений, которые тормозят привязки дневно обозначенные КЭС хемокиновых лигандом 12 (CXCL12) КЭС хемокиновых рецепторов 4 (CXCR4).
Аннотация
Фармакологических ориентации G белок рецепторы (GPCR) имеет большое значение для здоровья человека, как дисфункциональные GPCR-опосредованной сигнализации способствует прогрессированию многих заболеваний. Лиганд/рецептор пара КЭС хемокиновых лигандом 12 (CXCL12) / КЭС хемокиновых рецепторов 4 (CXCR4) вызвало значительный клинический интерес, например, как потенциальной мишенью для лечения рака и воспалительных заболеваний. Малые молекулы, а также терапевтических антител, которые конкретно нацелены CXCR4 и препятствовать рецепторов функция поэтому считается ценным фармакологическим инструменты. Здесь описан поток на основе цитометрии сотовой assay который позволяет идентификации соединений (например, малых молекул), которые отменить привязку CXCR4, CXCL12. По существу assay полагается на конкурс на рецептор, привязки между фиксированное количество дневно обозначенные CXCL12, естественный хемокиновых агониста для CXCR4 и немеченого соединения. Следовательно в этот assay избегать нежелательных использования радиоактивно помечены зондов. Кроме того живые клетки используются в качестве источника рецептор (CXCR4) вместо препаратов для клеточной мембраны. Это позволяет легко адаптация assay пластины формат, который увеличивает пропускную способность. Этот assay было показано, быть ценным дженериков пробирного обнаружения для определения ориентации CXCR4 соединений. Этот протокол может вероятно быть адаптированы для других GPCR, по крайней мере если дневно обозначенные ligands доступны или могут быть созданы. Не требуется предварительного знания, касающиеся внутриклеточных сигнальных путей, которые индуцированных после активации этих GPCR.
Введение
Белок-рецепторы G (GPCR) белков на поверхности клеток, которые могут быть активированы внеклеточных лигандов (например, пептиды, белки гормонов, амины), тем самым регулирующих многие физиологические и развития процессов1. Когда агонист занимает его карман привязки GPCR, индуцированная конформационные изменения в рецептор белков способствует привязки внутриклеточных гетеротримерные рецептор связанные G белков, состоящий из Gα- ВВП и Gβγ подразделений. Последующего обмена GTP ВВП по итогам Субблокα G в диссоциации субблоков протеина G (α-GTP, G и Gβγ) которые, в свою очередь, далее будет инициировать вниз по течению сигнальные пути2,3. Когда становится гидролизованный Gα-GTP, повторное объединение Gα- ВВП и Gβγ подразделений будет конвертировать G-белок обратно в его упокоения государства3,4. Различных типов G белков существует (Gs, Gввода-вывода, Gq, G12/13), которые классифицируются на основе последовательности сходство с Gα Субблок5. Все из этих белков G вызывают определенные внутриклеточных сигнальных путей, которые лежат в основе биологической реакции активации рецептора. После активации рецептора GPCR киназ (GRK) фосфорилировать хвост внутриклеточный GPCR, способствуя тем самым взаимодействие с β-arrestins. Этот процесс приводит к прекращению сигнализации, рецептор десенсибилизация и интернализации6G-белка. Β-arrestins, также являются частью мульти молекулярных комплексов, что триггер сигнализации каскады независимо от сигнализации7G-белка.
GPCR находятся среди самых проверенных молекулярным мишеням для терапевтического вмешательства, как дерегулирование GPCR-опосредованной сигнализации, например из-за усиления функции мутации гена рецептора или Избыточная экспрессия рецепторов, способствует этиологию многих 8заболеваний человека. Таким образом GPCR представляют собой один из наиболее важных классов лекарственных препаратов, расследованных в фармацевтической промышленности8,9,10. Ярким примером клинически значимых GPCR является КЭС хемокиновых рецепторов 4 (CXCR4), который может быть активирован единственным естественным лиганд, КЭС хемокиновых лигандом 12 (CXCL12)11. Из-за своей установившейся роль как основных ко-рецептор для вируса иммунодефицита человека 1 (HIV-1) вход и инфекции в кластер дифференцировки 4 (CD4) позитивные Т-лимфоциты12, CXCR4 впервые исследованы как цель противовирусным препаратам. CXCL12-CXCR4 взаимодействия в костном мозге далее регулирует сохранение и самонаведения стволовых и прогениторных клеток13. Кроме того учитывая его участие во многих аспектах рака биологии (например, выживание клетки опухоли, метастазы, ангиогенез опухоли связанных)14 и несколько других заболеваний человека (например, воспалительные заболевания)15, CXCR4 поднял значительный интерес как перспективные цели для обнаружения наркотиков. AMD3100, малые молекулы, специально предназначенном CXCR4, был первоначально обнаружен как препарат против ВИЧ кандидат16 и по-прежнему является одним из самых мощных антагонистов CXCR4, описал Дата17. Его развития как противовирусных препаратов, однако, было прекращено18. В настоящее время эта молекула используется как средство мобилизации стволовых клеток при лечении лимфомы и множественной миеломы пациентов18. Несколько других химически связанных малых молекул и биопрепаратов, которые препятствуют CXCR4 функция с различной потенции были описаны19.
Методы связывания рецептора являются ценными инструментами в области фармакологии, которые позволяют идентифицировать соединений (например, малых молекул), которые непосредственно взаимодействуют с GPCR интерес. Чтобы выполнить связывание исследования, нет необходимости для предварительных знаний о внутриклеточной сигнализации свойства или функциональность данного GPCR. Хотя это может рассматриваться как преимущество, это означает, что соединений, для которых рецептор может быть продемонстрирована привязки должны характеризоваться дальнейшей оценки их потенциального агонистических или антагонистических деятельности. Эта деятельность может оцениваться с использованием фармакологических или биологических анализов, связанных с GPCR изучается. В зависимости от профиля их деятельности, связывания молекулы рецептор может затем потенциально развиваться, чтобы стать соединений Роман свинца для расследования в доклинических и клинических исследований. Молекулы, которые конкретно связать рецептора с высоким сродством может также служить в качестве подмости для создания терапевтических или диагностических инструментов, например, radiolabeling их для неинвазивной в vivo изображений опухолевых клеток20, или потенциал транспортные средства для доставки целевых терапии21. В случае CXCR4 в естественных условиях изображений опухолевых клеток уже была продемонстрирована с помощью мыши модели которой помечены CXCR4 ориентации молекул позволило визуализация человека рак ксенотрасплантатов20,22,23 .
В настоящем докладе мы описываем подробный протокол assay конкуренции привязки, который позволяет идентифицировать малых молекул и биопрепаратов, которая непосредственно вмешиваться агонистов (CXCL12) обязательный CXCR4. Основной принцип анализа является конкуренция между фиксированное количество дневно обозначенные лиганда (CXCL12AF647, см. таблицу материалов и реагентов) и без маркировки соединений для связывания с белком рецептор17, 24. конкретные флуоресцентные сигнал от помечены лиганд, привязаны к одной клетки, выражая CXCR4 затем анализируются проточной цитометрии. Этот флуоресцентного сигнала будет снижена когда немеченого малых молекул нарушить взаимодействие между CXCL12AF647 и CXCR4. Assay использует не манипулировать живых клеток, которые эндогенно Экспресс CXCR4 (то есть, Jurkat клетки). Следовательно, требуется подготовка не клеточной мембраны, что делает assay, удобный, быстрый и совместимы с повышенной пропускной способностью. Поскольку используется дневно обозначенные лиганд, избегать радиоактивности.
Поскольку CXCL12 является естественным агониста для CXCR4, малые молекулы соединений, которые мешают CXCL12AF647 привязки в assay скорее всего взаимодействовать с сайт связывания рецептора orthosteric (т.е. сайт связывания оккупирована природных агонист). Молекулы, которые будут взаимодействовать с сайтов связывания рецептора топографически отличается от orthosteric привязки сайта остаются незамеченными, если они не влияют на привязки CXCL12. Например положительные и отрицательные аллостерический модуляторы, важных и возникающих Категория GPCR ориентации молекулы, действующие на аллостерический привязки сайтов25, будет потенциально не забрать с этот assay. Кроме того не может быть получены ли соединений, выявленных с этой функцией привязки пробирного как антагонисты рецепторов или как агонисты. Будет таким образом расследование выявленных соединений в дополнительных фармакологических или функциональных анализов, связанных с рецептором. Эти анализы могут включать (комбинация) сотовых флуоресценции или люминесценция-на основе анализов для выявления второй посыльных (например, Ca2 +, циклический аденозинмонофосфат (лагерь)), фенотипические или биологических анализов и β-arrestin набор анализов, выбор которых зависит от конкретных сигналов свойств GPCR изучается. Таким образом конкурентные привязки assay описанные здесь главным образом служит первоначальный отбор assay который необходимо дополнить другими на основе ячеек анализов для включения углубленная характеристика соединений с потенцией связывания рецептора.
протокол
1. поддержание культуры клеток
Примечание: Все шаги, описанные в разделе 1 и 2 проводятся в стерильных условиях в поток Ламинарный шкаф.
- Рост клеток в колбах T75 культуры при 37 ° C и 5% CO2 в увлажненные инкубатора.
Примечание: В этот assay, используются Jurkat клетки (т.е. человеческой лейкозных лимфоцитов T которые эндогенно Экспресс CXCR417). Выражение CXCR4 на клеточной поверхности должны оцениваться на протяжении культивирования клеток с помощью проточной цитометрии. Описание потока цитометрии процедуры и реагентов для определения уровни выражения рецептором на поверхности клетки, однако, не входит в сферу действия этого протокола, но было описано ранее17. - Пусть Jurkat клетки растут в суспензии, пока они не достигают 80-85% confluency. Прежде чем пассированый клетки Роман колбу, разрешить все реагенты до комнатной температуры (RT).
- Добавьте 20 мл свежего полный рост средних (RPMI 1640 средний, 10% плода бычьим сывороточным (ФБС), глютамин 2 мм) роман T75 культуры колбу.
- Добавьте 5 мл суспензии клеток Jurkat от оригинального T75 колбу (содержащие 25 мл суспензии клеток) роман T75 культуры колбу. Инкубируйте на 37 ° C и 5% CO2 в увлажненные инкубатора.
2. Подготовка CXCL12, Assay Buffer, и Jurkat клетки для участия в конкурсе привязки Assay.
- Подготовьте Стоковый раствор CXCL12AF647 (20 мкг/мл; см. таблицу материалы и реагенты), растворяя лиофилизированные реагента (температуре-80 ° C, в темноте) в ультрачистая вода, дополнена 0,01% (объем/объем) Полисорбат 20. Храните одноразовые аликвоты от этого Стоковый раствор на-80 ° C, защищать от света.
- Подготовьте аналитический буфер путем добавления 40 мл HEPES (1 М, 20 мм окончательный концентрация) 200 мл Хэнк сбалансированного солевого раствора (HBSS, 10 x, без фенола красного и бикарбонат натрия, 1 x конечная концентрация). Добавить ультрачистая вода получить окончательный объем 2 л добавить 4 g (0,2% вес/объем) бычьим сывороточным альбумином (БСА), и распустить BSA через магнитные помешивая. Наконец, скорректировать рН 7,4 (для этого используйте NaOH) и фильтрации раствор через 0,2 мкм поры (см. таблицу материалов и реагентов) с помощью вакуумного коллектора.
Примечание: Этот assay буфер будет использоваться во всех дальнейших шагах протокола. - Подсчет числа и жизнеспособность клеток. Для этого взять образец клеток подвеска и развести его в-фосфатный буфер (PBS).
Примечание: Мы регулярно использовать анализатор жизнеспособности автоматизированных клеток (см. таблицу материалов и реагентов) способны подсчета клеточных суспензий в различных концентрациях. Для подсчета клеток, разбавляют 0,5 мл суспензии клеток в 1,5 мл PBS (возможны также другие разведений, например, 0.1 мл в 1.9 мл PBS,). Использование этого метода, который основан на методе исключения Трипановый синий краситель, было описано ранее,26. Для подсчета количества клеток и жизнеспособности, которое должно работать одинаково хорошо коммерчески доступны несколько других устройств. - Собрать нужное количество клеток (т.е. ~ 24 x 106 клеток для запуска анализа с одной полной тарелкой 96-луночных) в стерильных 50 мл трубки центрифугированием (см. таблицу материалов и реагентов для типа центрифуги) на 400 g x 5 мин на RT.
- Осторожно слить супернатант не нарушая Пелле ячейки. Добавить свежие аналитического буфера (например, 20 мл) и Ресуспензируйте клетки, нежно закупорить вверх и вниз.
- Центрифуга клетки снова на 400 g x 5 мин на RT.
- Слить супернатант снова и Ресуспензируйте Пелле клеток в свежих пробирного буфер для получения плотности тарелок 5 x 106 клеток/мл.
3. конкурс привязки Assay
Примечание: Фактической конкуренции привязки выполняется на RT и могут быть выполнены в нестерильных условиях.
- Ослабить соединения под следствием в assay buffer (см. 2.2), для получения желаемой концентрации. Либо подготовить фиксированной концентрации комплекса для первоначальной проверки (например, 10 мкм конечная концентрация) или, альтернативно, серию последовательных разрежения концентрации более подробная характеристика соединений (например, 1/3, 1/4 или 1 / 5 Разведение серии начиная 1 мкм, конечная концентрация). Имейте в виду, что составные решения в конечном счете станет 2 x, разбавленным в пробы; Таким образом подготовьте 2 x концентрированный раствор.
- Лунки 100 мкл составные решения (в основном 2 x) в четкой 96-луночных вокруг нижней плиты (см. таблицу материалов и реагентов) согласно предварительно определенных экспериментальным лежали вне (например, Рисунок 1 c).
Примечание: На данном этапе, отрицательных и положительных контрольных образцов включены в assay. В Пример отрицательного контроля100 мкл аналитического буфера вместо соединения добавляется скважин 96-луночных пластины. Для позитивного управления образцапробирного буфера также добавляется во время этого шага. Смотрите также фигура 1 c для типичной экспериментальной макета, в котором проверяется ряд разбавление несколько соединений. - Добавьте 50 мкл суспензии клеток (см. 2.7; 0,25 х 106 клеток) от водохранилища реагента в 96-луночных пластину с помощью многоканальных дозаторов. Инкубируйте пластину для 15 мин на RT в темноте.
- Добавьте 50 мкл дневно обозначенные CXCL12 (т.е., 100 нг/мл CXCL12AF647 в Пробирной буфера, 4 x, в основном, 25 нг/мл конечная концентрация) от аналогичных водохранилище реагента к добрам плиты 96-луночных. Инкубируйте 30 мин на RT в темноте.
Примечание: Для отрицательных контрольных образцов, вместо этого добавьте аналитического буфера. Следовательно флуоресцентный сигнал обнаружен в образцах отрицательный контроль будет соответствовать autofluorescent фонового сигнала (рис. 1A). Для положительных контрольных образцовдобавьте 50 мкл/ну CXCL12AF647. Положительный контроль образцов даст максимальную флуоресценции сигнал обнаружен, так как не потенциальных ингибирования предварительной инкубации с соединениями был включен (рис. 1A). - Центрифуга 96-луночных пластины на 400 g x 5 мин на RT. удалить супернатант из гранулированного клеток, перевернув пластину. Сухие пластины на ткани.
- Добавьте 200 мкл свежие аналитического буфера из водохранилища реагент для скважин с помощью многоканальных дозаторов. Немедленно.
- Центрифуга пластину снова за 5 мин на 400 x g на RT. удалить супернатант, перевернув пластину и снова сушить на ткани.
- Нежно ресуспензируйте Пелле клеток в 200 мкл параформальдегида 1% растворенных в PBS. Этот шаг будет исправить клетки.
- Продолжать протокола сразу с количественной оценке флуоресцентным проточной цитометрии.
4. Анализ образцов подачей cytometry
CXCL12AF647 окрашенных и зацикленная клетки теперь готовы быть проанализированы с помощью проточной цитометрии. Можно использовать несколько типов потока цитофлуориметрами, но они должны быть оборудованы с правильным лазер (т.е., красный лазер, возбуждения диапазон ~ 630 Нм) для возбуждения и соответствующих фильтров для обнаружения Флюорофор (выбросов фильтры ~ 660 нм). Они должны быть способны обработки образцов в формате 96-луночных пластины. В таблице материалы и реагентыприводятся примеры подходящий поток цитометрии устройств.
- Запустите устройство и откройте соответствующее программное обеспечение (см. таблицу материалы и реагенты).
- Выберите следующие параметры сотовой для отображения в формате блот точка: вперед точечной (FSC), стороны точечной (SSC) и каналом обнаружения Флюорофор (CXCL12AF647).
Примечание: С параметром FSC, клетки подвергаются дискриминации на основании их размера, так как обнаруженные поглощения света пропорциональна диаметр ячеек. Параметр SSC, измерения рассеяния света под углом в 90°, предоставляет сведения о гранулярность клеток. - Выберите один из образцов (например, образец отрицательный контроль) для выполнения стробирования определенных однородных клеток населения на основе параметров FSC и SSC.
- Выберите Автоматический впрыск ~ 100 мкл зацикленная клеток из примера отрицательный контроль в проточный цитометр. Выберите параметр «смешение» перед инъекцией и использовать скорость потока образца 1,5 мкл/сек.
- Запустить этот образец, выбрав «Приобретение данных». FSC и SSC параметров для данного образца теперь появится на экране.
- Выберите стробирования инструмент программного обеспечения. Основываясь на FSC и SSC точка блот визуализации, предварительно определите однородных и жизнеспособных клеток населения стробирования. Чтобы сделать это, создайте многоугольник (с помощью программного обеспечения стробирования инструмента), включающий содержанием однородно распределенных единичных клеток («события»), на основании этих двух аспектов.
Примечание: Стробирования процедура призвана определить однородных и жизнеспособных клеток населения, который будет использоваться для дальнейшего анализа. Стробирования основывается на предположении о том, что большинство жизнеспособных клеток образуют однородные клетки населения на основе параметров FSC и SSC. Выполняя этот шаг, сотовой мусора, мертвые клетки и клетки агрегатов во многом могут быть исключены из дальнейшего анализа. Иллюстрация стробирования процесса приводится на рисунке 1B.
- Выберите, чтобы анализировать 20 000 «события» (то есть, отдельные ячейки) на сэмпл.
Примечание: Это означает, что для каждого образца, 20000 клетки, которые входят в заранее определенных ворот в конечном итоге быть проанализированы. Получение данных для каждого образца будет продолжаться, пока это количество событий анализируется. - Начало выполнения (выберите «запись данных»). Устройства цитометрии потока теперь будет анализировать все образцы один в 1 запись означает флуоресценции интенсивности (МФО) для каждого образца. Этот МФО соответствует средней флуоресцентные сигнал, соответствующий 20000 клетки, которые входят в заранее определенных ворот.
5. анализ данных
Для выполнения все дальнейшие вычисления используйте МФО, полученные для каждого образца. Анализ потока данных цитометрии могут выполняться несколькими пакетами коммерчески доступного программного обеспечения (см. таблицу материалы и реагенты).
- Чтобы определить процент ингибирование флуоресцентные привязки сигнал, в результате соединения предварительной инкубации, примените следующую формулу:
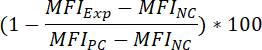
Где:
МФОExp = МФО экспериментальных (= соединение лечение) образец
МФОPC = МФО положительный контроль
МФОNC = МФО отрицательный контроль - Чтобы определить значение50 соединения (т.е., концентрация соединения, которые могут уменьшить сигнал флуоресцентные привязки на 50%), примените следующую формулу:
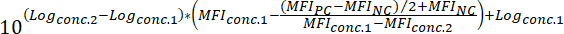
Где:
Журналconc.2 = журнал концентрации смеси, что приводит к менее чем 50% ингибирования разницы между МФО значение PC и NC
Журналconc.1 = журнал концентрации смеси, что приводит к более чем 50% ингибирования разницы между МФО значение PC и NC
Примечание: в качестве альтернативы, в случае весьма активных соединений, кривая доза реакция, охватывающих несколько журналов величины могут быть созданы на основании МФО, соответствующий каждой опытах концентрации комплекса. Путем применения нелинейной регрессии кривой с использованием соответствующего программного обеспечения (см. таблицу материалы и реагенты), IC50 значения затем может вытекать из созданного кривых. На рисунке 3приведен пример этого анализа подхода.
Результаты
Общий рабочий процесс привязки анализа представлена на рисунке 1A. Иллюстрации типа потока цитометрии данных, полученных для различных образцов типов в стандартный эксперимент (т.е. отрицательный контроль, положительный контроль и эксперименталь...
Обсуждение
По сравнению с другими типами привязки анализов (то есть, насыщенность привязки и кинетические привязки экспериментов), конкурс привязки анализов лучше всего подходит для целей проверки. Действительно они позволяют производить оценку больших партий немеченого соединения, наприм...
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Авторы хотели бы поблагодарить Эрик Фонтейн за отличную техническую помощь. Эта работа была поддержана ку Лёвен (Грант нет. PF/10/018), Фонд воор Wetenschappelijk институте (FWO, Грант нет. G.485.08) и Фонд Dormeur Вадуц.
Материалы
| Name | Company | Catalog Number | Comments |
| BD FACSCanto II | Becton Dickinson | Not applicable | Flow cytometry device |
| BD FACSDIVA Software | |||
| BD FACSArray | Becton Dickinson | Not applicable | Flow cytometry device |
| BD FACSArray System Software | |||
| Graphpad Prism | Graphpad | software package used for nonlinear regression analysis in Figure 2 and Figure 3 | |
| FlowJo | FlowJo is now a wholly owned subsidiary of BD. | ||
| Vi-CELL | Beckman Coulter | Not applicable | cell viability analyzer |
| Sigma 3-18 KS | Sigma | Not applicable | centrifuge |
| AMD3100 | Sigma | A5602-5mg | specific CXCR4 antagonist |
| Maraviroc | Pfizer | antiretroviral drug, CCR5 antagonist, available for research at Selleckchem (cat#S2003), Sigma (cat#PZ0002) | |
| h-SDF1a (AF647) | ALMAC | CAF-11-B-01 | fluorescently labeled CXCL12, CXCL12AF647 |
| Fetal Bovine Serum (FBS) | Gibco (Life Technologies) | 10270-106 | |
| Bovine Serum Albumin (BSA) | Sigma | A1933-25G | |
| HBSS (10x), calcium, magnesium, no phenol red | Gibco (Life Technologies) | 14065-049 | |
| HEPES (1M) | Gibco (Life Technologies) | 15630-056 | |
| Dulbecco's Phosphate Buffered Saline (DPBS) | Gibco (Life Technologies) | 14190-094 | |
| Jurkat cells | ATCC | ||
| Reagent reservoir PP | Sigma | BR703411 | |
| Rapid flow filter: 0.2 µm aPES | Thermo Scientific | 566-0020 | |
| Sterilin microtiter plate, 96-well, U bottom, clear | Thermo Scientific | 611U96 | |
| Falcon tubes, 50ml | Greiner Bio-One | 227 261 | |
| Tissue culture flask (T75) | Corning | 353024 |
Ссылки
- Fredriksson, R., Lagerstrom, M. C., Lundin, L. G., Schioth, H. B. The G-protein-coupled receptors in the human genome form five main families. Phylogenetic analysis, paralogon groups, and fingerprints. Mol Pharmacol. 63, 1256-1272 (2003).
- Milligan, G., Kostenis, E. Heterotrimeric G-proteins: A short history. Br J Pharmacol. 147 Suppl 1, S46-S55 (2006).
- Oldham, W. M., Hamm, H. E. Heterotrimeric G protein activation by G-protein-coupled receptors. Nat Rev Mol Cell Biol. 9, 60-71 (2008).
- Tuteja, N. Signaling through G protein coupled receptors. Plant Signal Behav. 4, 942-947 (2009).
- Neves, S. R., Ram, P. T., Iyengar, R. G protein pathways. Science. 296, 1636-1639 (2002).
- Gurevich, E. V., Tesmer, J. J., Mushegian, A., Gurevich, V. V. G protein-coupled receptor kinases: more than just kinases and not only for GPCRs. Pharmacol Ther. 133, 40-69 (2012).
- Smith, J. S., Rajagopal, S. The beta-arrestins: Multifunctional regulators of G protein-coupled receptors. J Biol Chem. 291, 8969-8977 (2016).
- Pierce, K. L., Premont, R. T., Lefkowitz, R. J. Seven-transmembrane receptors. Nat Rev Mol Cell Biol. 3, 639-650 (2002).
- Hopkins, A. L., Groom, C. R. The druggable genome. Nat Rev Drug Discov. 1, 727-730 (2002).
- Lappano, R., Maggiolini, M. G protein-coupled receptors: Novel targets for drug discovery in cancer. Nat Rev Drug Discov. 10, 47-60 (2011).
- Chatterjee, S., Behnam Azad, ., Nimmagadda, B., S, The intricate role of CXCR4 in cancer. Adv Cancer Res. 124, 31-82 (2014).
- Bleul, C. C., Farzan, M., Choe, H., Parolin, C., Clark-Lewis, I., Sodroski, J., Springer, T. A. The lymphocyte chemoattractant SDF-1 is a ligand for LESTR/fusin and blocks HIV-1 entry. Nature. 382, 829-833 (1996).
- Flomenberg, N., DiPersio, J., Calandra, G. Role of CXCR4 chemokine receptor blockade using AMD3100 for mobilization of autologous hematopoietic progenitor cells. Acta Haematol. 114, 198-205 (2005).
- Domanska, U. M., Kruizinga, R. C., Nagengast, W. B., Timmer-Bosscha, H., Huls, G., de Vries, E. G., Walenkamp, A. M. A review on CXCR4/CXCL12 axis in oncology: No place to hide. Eur J Cancer. 49, 219-230 (2013).
- Tsou, L. K., Huang, Y. H., Song, J. S., Ke, Y. Y., Huang, J. K., Shia, K. S. Harnessing CXCR4 antagonists in stem cell mobilization, HIV infection, ischemic diseases, and oncology. Med Res Rev. , (2017).
- Schols, D., Struyf, S., Van Damme, J., Este, J. A., Henson, G., De Clercq, E. Inhibition of T-tropic HIV strains by selective antagonization of the chemokine receptor CXCR4. J Exp Med. 186, 1383-1388 (1997).
- Van Hout, A., D'Huys, T., Oeyen, M., Schols, D., Van Loy, T. Comparison of cell-based assays for the identification and evaluation of competitive CXCR4 inhibitors. PLoS One. 12, e0176057 (2017).
- De Clercq, E. The AMD3100 story: the path to the discovery of a stem cell mobilizer (Mozobil). Biochem Pharmacol. 77, 1655-1664 (2009).
- Debnath, B., Xu, S., Grande, F., Garofalo, A., Neamati, N. Small molecule inhibitors of CXCR4. Theranostics. 3, 47-75 (2013).
- Woodard, L. E., Nimmagadda, S. CXCR4-based imaging agents. J Nucl Med. 52, 1665-1669 (2011).
- Wang, Y., Xie, Y., Oupicky, D. Potential of CXCR4/CXCL12 Chemokine Axis in Cancer Drug Delivery. Curr Pharmacol Rep. 2, 1-10 (2016).
- Nimmagadda, S., Pullambhatla, M., Stone, K., Green, G., Bhujwalla, Z. M., Pomper, M. G. Molecular imaging of CXCR4 receptor expression in human cancer xenografts with [64Cu]AMD3100 positron emission tomography. Cancer Res. 70, 3935-3944 (2010).
- De Silva, R. A., Peyre, K., Pullambhatla, M., Fox, J. J., Pomper, M. G., Nimmagadda, S. Imaging CXCR4 expression in human cancer xenografts: evaluation of monocyclam 64Cu-AMD3465. J Nucl Med. 52, 986-993 (2011).
- Hatse, S., Princen, K., Liekens, S., Vermeire, K., De Clercq, E., Schols, D. Fluorescent CXCL12AF647 as a novel probe for nonradioactive CXCL12/CXCR4 cellular interaction studies. Cytometry A. 61, 178-188 (2004).
- Wootten, D., Christopoulos, A., Sexton, P. M. Emerging paradigms in GPCR allostery: implications for drug discovery. Nat Rev Drug Discov. 12, 630-644 (2013).
- Louis, K. S., Siegel, A. C. Cell viability analysis using trypan blue: manual and automated methods. Methods Mol Biol. 740, 7-12 (2011).
- Perry, C. M. Maraviroc: a review of its use in the management of CCR5-tropic HIV-1 infection. Drugs. 70, 1189-1213 (2010).
- Moyle, G., DeJesus, E., Boffito, M., Wong, R. S., Gibney, C., Badel, K., MacFarland, R., Calandra, G., Bridger, G., Becker, S. Proof of activity with AMD11070, an orally bioavailable inhibitor of CXCR4-tropic HIV type 1. Clin Infect Dis. 48, 798-805 (2009).
- Balabanian, K., Lagane, B., Infantino, S., Chow, K. Y., Harriague, J., Moepps, B., Arenzana-Seisdedos, F., Thelen, M., Bachelerie, F. The chemokine SDF-1/CXCL12 binds to and signals through the orphan receptor RDC1 in T lymphocytes. J Biol Chem. 280, 35760-35766 (2005).
- Burns, J. M., Summers, B. C., Wang, Y., Melikian, A., Berahovich, R., Miao, Z., Penfold, M. E., Sunshine, M. J., Littman, D. R., Kuo, C. J., Wei, K., McMaster, B. E., Wright, K., Howard, M. C., Schall, T. J. A novel chemokine receptor for SDF-1 and I-TAC involved in cell survival, cell adhesion, and tumor development. J Exp Med. 203, 2201-2213 (2006).
- Stoddart, L. A., Kilpatrick, L. E., Briddon, S. J., Hill, S. J. Probing the pharmacology of G protein-coupled receptors with fluorescent ligands. Neuropharmacology. 98, 48-57 (2015).
- Vernall, A. J., Hill, S. J., Kellam, B. The evolving small-molecule fluorescent-conjugate toolbox for Class A GPCRs. Br J Pharmacol. 171, 1073-1084 (2014).
- Stoddart, L. A., White, C. W., Nguyen, K., Hill, S. J., Pfleger, K. D. Fluorescence- and bioluminescence-based approaches to study GPCR ligand binding. Br J Pharmacol. 173, 3028-3037 (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены