A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
וזמינותו מבוססי Cytometry זרימה כדי לזהות תרכובות לשבש קשירה של ליגנד כימוקין שכותרתו Fluorescently CXC 12 לקולטן כימוקין CXC 4
In This Article
Summary
זרם איגוד הסלולר מבוססי cytometry assay מתואר זה משמש בעיקר ככלי מיון כדי לזהות תרכובות המעכבות את הכריכה של ליגנד כימוקין CXC fluorescently שכותרתו 12 (CXCL12) לקולטן כימוקין CXC 4 (CXCR4).
Abstract
פילוח תרופתי של G-חלבון בשילוב קולטנים (GPCRs) הוא בעל חשיבות רבה לבריאות האדם, כמו איתות בתיווך GPCR לקוי תורמת ההתקדמות של מחלות רבות. הזוג ליגנד/קולטן CXC כימוקין ליגנד 12 (CXCL12) / CXC כימוקין קולטן 4 (CXCR4) העלה הריבית קלינית משמעותית, למשל כמו יעד פוטנציאליים לטיפול בסרטן ומחלות דלקתיות. מולקולות קטנות, כמו גם נוגדנים טיפולית במיוחד למטרה CXCR4 ומעכבות הפונקציה של הקולטן, ולכן נחשבת כלי תרופתי יקר. כאן, זרימה מבוססי cytometry הסלולר assay המאפשרת זיהוי של תרכובות (למשל, מולקולות קטנות) ביטל CXCL12 מחייב CXCR4, מתואר. בעיקרו של דבר, וזמינותו מסתמך על התחרות על קולטן איגוד בין כמות קבועה של CXCL12 fluorescently שכותרתו, אגוניסט טבעי כימוקין עבור CXCR4, תרכובות ללא תווית. לפיכך, השימוש לא רצויים של הגששים שכותרתו radioactively הוא נמנע בדרך זה וזמינותו. בנוסף, מתאים חיים משמשים כמקור של קולטן (CXCR4) במקום ההכנות קרום התא. דבר זה מאפשר עיבוד קל של וזמינותו לתבנית צלחת, אשר מגדילה את התפוקה. זה וזמינותו הוכח להיות assay גילוי תרופה גנרית יקר כדי לזהות תרכובות CXCR4 פילוח. הפרוטוקול סביר ניתן להתאים GPCRs אחרים, לפחות אם ליגנדים fluorescently עם תוויות זמינות או יכול להיווצר. ידע מוקדם לגבי המסלולים איתות תאיים כי הם המושרה על ההפעלה של אלה GPCRs, אינה נדרשת.
Introduction
G-חלבון בשילוב קולטנים (GPCRs) הם חלבונים פני שטח התא כי יכול להיות מופעל על ידי ליגנדים חוץ-תאית (למשל, פפטידים, הורמונים חלבון, אמינים), ובכך ויסות רבים פיזיולוגיים התפתחותיים מעבד1. כאשר אגוניסט מתפרסת שלה כיס כריכה GPCR, בשינוי הסתגלותי המושרה חלבון קולטן מקדמת את הכריכה של חלבונים תאיים הקשורים קולטן heterotrimeric G, המורכב Gα- תוצר ו- Gβγ subunits. ההחלפה עוקבות של GTP על התוצר המקומי הגולמי על התוצאות יחידה משניתα G ב- הדיסוציאציה של G החלבוניות (αG -GTP Gβγ) אשר, בתורו, יהיה עוד יותר ליזום במורד הזרם איתות המסלולים2,3. כאשר Gα-GTP הופך הידרוליזה, שיוך מחדש של Gα- תוצר ו- Gβγ subunits יהיה להמיר את חלבון G בחזרה לתוך שלו3,המנוחה המדינה4. סוגים שונים של חלבונים G קיים (Gs, Gi/o, ג'יקיו, G12/13), אשר מסווגים המבוססת על רצף דמיון עם יחידת משנהα G5. כל החלבונים האלה G לגרום מוגדר תאיים איתות המסלולים העומדים בבסיס התגובה הביולוגית הפעלת קולטן. לאחר הפעלת קולטן, kinases GPCR (GRKs) phosphorylate את הזנב תאיים של GPCRs, ובכך לקדם אינטראקציה עם β-arrestins. תהליך זה מוביל הסיום של חלבון G איתות, קולטן הקהיה, הפנמה6. Β-arrestins הם גם חלק של מתחמי רב המולקולרי הגורם המפעיל איתות מפלי עצמאית של חלבון G איתות7.
GPCRs הם בין מטרות מולקולריות ביותר המאומת התערבות טיפולית, כפי ושוחררו בתיווך GPCR איתות, למשל בשל רווח-של-פונקציה מוטציות הגן לקולטן או ביטוי הקולטן, תורמת האטיולוגיה של רבים מחלות אנושיות8. לכן, GPCRs לייצג את אחד השיעורים החשובים ביותר של סמים מטרות נחקרים על ידי תעשיית התרופות8,9,10. דוגמה הבולטים GPCR הרלוונטית קלינית היא הקולטן כימוקין CXC 4 (CXCR4), אשר יכול להיות מופעל על ידי ליגנד טבעי הבלעדית, CXC כימוקין ליגנד 12 (CXCL12)11. בשל תפקידו הוקמה קולטן שותף מרכזי עבור וירוס הכשל החיסוני האנושי 1 (HIV-1) כניסה ולדלקת באשכול של בידול 4 (CD4) חיובי T-לימפוציטים12, CXCR4 נחקר לראשונה בתור מטרה תרופה קוטלת נגיפים. CXCL12-CXCR4 אינטראקציה במח העצם יותר מווסת את השמירה, יונת ושל גזע קדמון תאים13. כמו כן, לנוכח מעורבותו היבטים רבים של סרטן ביולוגיה (למשל, גידול התא הישרדות, גרורות, הקשורות הגידול אנגיוגנזה)14 ו מספר אחר מחלות האדם (למשל, מחלות דלקתיות)15CXCR4 העלה הריבית משמעותי כמטרה מבטיח לגילוי סמים. AMD3100, מולקולה קטנה שממוקד במיוחד CXCR4, התגלה לראשונה מטוס המועמד סמים האיידס16 , הוא עדיין אחד היריבים CXCR4 הקטלניים ביותר תיאר תאריך17. פיתוחה תרופה קוטלת נגיפים היה, עם זאת, הופסק18. כעת מולקולה זו משמשת כסוכן גיוס תאי גזע במהלך הטיפול של חולי מיאלומה נפוצה, לימפומה18. מספר מולקולות קטנות קשורות כימית אחרים, תכשירים המעכבות CXCR4 פונקציה עם עוצמה משתנה כבר מתואר19.
קולטן איגוד שיטות הם כלי רב ערך בפרמקולוגיה, המאפשרות הזיהוי של תרכובות (למשל, מולקולות קטנות) המקיימים אינטראקציה ישירות עם GPCR עניין. על מנת לבצע מחקרים מחייב, יש צורך ידע מוקדם לגבי את מאפייני איתות תאיים או את הפונקציונליות של GPCR נתון. אמנם זה יכול להיחשב להיות יתרון, זה מרמז כי תרכובות עבור איזה קולטן איגוד ניתן להדגים צריכים להיות עוד יותר מאופיין על ידי הערכת פעילותן היתה ללא-חת או אויבת פוטנציאלית. פעילות זו ניתן להעריך באמצעות מבחני תרופתי או ביולוגיים הקשורים את GPCR שנבחנה. תלוי בפרופיל שלהם פעילות, איגוד קולטן מולקולות אולי ואז פוטנציאל להתפתח להיות תרכובות הרומן להוביל לחקירה מחקרים פרה-קליניים ומחקרים קליניים. מולקולות במיוחד לאגד קולטן עם זיקה גבוהה יכול לשמש גם פיגומים ליצירת כלים טיפוליים או אבחון, למשל על-ידי radiolabeling אותם עבור הדמיה לא פולשנית ויוו של תאי הגידול20, או כמו הפוטנציאל כלי רכב עבור משלוח ממוקד של הרפוי21. במקרה של CXCR4, ויוו הדמיה של תאים סרטניים שכבר הוכח באמצעות העכבר מודלים שבה מולקולות פילוח CXCR4 שכותרתו מותר הפריט החזותי של סרטן אנושי xenografts20,22,23 .
בדו ח זה, אנו מתארים עבור assay איגוד תחרות המאפשרת זיהוי מולקולות קטנות, תכשירים ישירות להפריע אגוניסט (CXCL12) מחייב כדי CXCR4 פרוטוקול מפורט. העיקרון הבסיסי של וזמינותו היא התחרות בין כמות קבועה של ליגנד שכותרתו fluorescently (CXCL12AF647, ראה טבלה של חומרים, ריאגנטים), ללא תווית תרכובות עבור איגוד חלבון קולטן17, 24. האות פלורסנט ספציפי של ליגנד שכותרתו מאוגד לתאים אחת CXCR4 לבטא מכן נותחו על ידי cytometry זרימה. את האות פלורסנט יופחת כאשר מולקולות קטנות ללא תווית לשבש את האינטראקציה בין CXCL12AF647 CXCR4. וזמינותו משתמשת בתאים חיים ללא מניפולציה endogenously אקספרס CXCR4 (קרי, תאים Jurkat). לפיכך, ללא הכנה קרום התא נדרשת, מה שהופך את הבדיקה נוח, מהיר, תואם עם תפוקה מוגברת. מאז משמש של ליגנד fluorescently שכותרתו, הוא נמנע רדיואקטיביות.
מכיוון CXCL12 הוא אגוניסט טבעי עבור CXCR4, תרכובות מולקולה קטנה להפריע CXCL12AF647 מחייב ב וזמינותו צפויים לקיים אינטראקציה עם orthosteric מחייב האתר קולטן (קרי, באתר איגוד שנכבשו על ידי הטבעי אגוניסט). מולקולות יקיים אינטראקציה עם אתרי קישור לקולטן ברורים טופוגרפית מאתר איגוד orthosteric נשארים בלי שירגישו, אם הם לא להשפיע על הכריכה של CXCL12. למשל, מאפננים allosteric חיוביים ושליליים, קטגוריית חשוב ועתידיים של GPCR מיקוד מולקולות פועלים על אתרי קשירה allosteric25, שעשוי להיות לא יאסף עם זה וזמינותו. בנוסף, אם תרכובות מזוהה עם פונקציה זו וזמינותו מחייבת היריבים קולטן או אגוניסטים לא ניתן לגזור. החקירה של תרכובות שזוהו ב נוספים תרופתי או פונקציונליים הקשורות קולטן מבחני ולכן יידרש. מבחני אלה עשויים לכלול (שילוב של) הסלולר זריחה או הפריה חוץ גופית-המבוסס על מבחני איתור שני שליחים (למשל, Ca2 +, אדנוזין מחזורית monophosphate (מחנה)), פנוטיפי או מבחני ביולוגי ו β-arrestin מבחני הגיוס, הבחירה אשר תלוי במאפיינים איתות ספציפיים של GPCR שנבחנה. לפיכך, תחרותי איגוד וזמינותו המתוארים במסמך זה בעיקר משמש וזמינותו ההקרנה הראשונית שצריך השלמה עם שאר מבחני מבוססת תא כדי לאפשר של אפיון מעמיק של תרכובות עם קולטן איגוד האון.
Protocol
1. תחזוקה של תרבית תאים
הערה: כל השלבים המתוארים תחת 1 ו- 2 מתבצעת בתנאים סטריליים ב- cabinet זרימה שכבתית.
- לגדל תאים T75 מבחנות תרבות-37 מעלות צלזיוס ו-5% CO2 ב חממה humidified.
הערה: זו assay, Jurkat תאים (קרי, האדם לימפוציט T לוקמיה תאים המבטאים endogenously CXCR417) משמשים. ביטוי CXCR4 על פני התא צריך להעריך לאורך תא culturing באמצעות cytometry זרימה. תיאור של הליך cytometry זרימה, ריאגנטים כדי לקבוע רמות הביטוי קולטן על פני התא, אולם הוא לא בתוך הטווח של פרוטוקול זה, אבל היה שתואר לעיל17. - תן Jurkat תאים לגדול ההשעיה עד שיגיעו 80-85% confluency. לפני passaging את התאים אל בקבוק הרומן, לאפשר כל ריאגנטים לטמפרטורת החדר (RT).
- הוסף 20 מ של מדיום הגידול שלם טרי (RPMI-1640 בינוני, 10% עוברית שור סרום (FBS), גלוטמין 2 מ מ) בקבוקון תרבות T75 הרומן.
- הוסף 5 מ של השעיה תא Jurkat הבקבוקון T75 המקורי (מכיל 25 מ של התא השעיה) לרומן T75 תרבות הבקבוק. דגירה-37 מעלות צלזיוס ו-5% CO2 ב חממה humidified.
2. הכנת CXCL12, מאגר Assay ותאים Jurkat לתחרות איגוד וזמינותו.
- להכין פתרון מניות של CXCL12AF647 (20 µg/mL; ראה טבלה של חומרים, ריאגנטים) על ידי המסת הכימית lyophilized (מאוחסן ב- 80 ° C, בחושך) במים הנדסה גנטית בתוספת 0.01% (נפח/נפח) של Polysorbate 20. חנות אחת להשתמש aliquots של פתרון זה מניות ב-80 מעלות צלזיוס, מוגן מפני אור.
- היכונו assay מאגר על-ידי הוספת 40 מ"ל HEPES (ריכוז סופי 1 מ', 20 מ"מ) של 200 מ ל האנק מאוזנת תמיסת מלח (HBSS, x 10, פנול אדום ובלי סודיום ביקרבונט, 1 x ריכוז סופי). הוסף מים הנדסה גנטית כדי לקבל נפח סופי של 2 ל להוסיף 4 g (0.2% משקל/נפח) שור אלבומין (BSA), לפזר את BSA ויה מגנטי זע. לבסוף, להתאים את רמת ה-pH ל 7.4 (השתמש NaOH בשביל זה) ולסנן את הפתרון דרך הנקבוביות מיקרומטר 0.2 (ראה טבלה של חומרים, ריאגנטים) באמצעות של יריעה ואקום.
הערה: מאגר assay ישמש כל צעדים נוספים של הפרוטוקול. - לספור את המספר ואת הכדאיות של התאים. בשביל זה, לקחת דגימה של התליה תא, למהול אותו בתוך תמיסת מלח פוספט buffered (PBS).
הערה: אנו משתמשים באופן שגרתי מנתח הכדאיות של התא אוטומטית (ראה טבלה של חומרים, ריאגנטים) מסוגל לספור תאים המתלים בריכוזים שונים. לספירת תאים, לדלל 0.5 מ"ל של השעיה תא ב- 1.5 mL PBS (דילולים אחרים, למשל, מ 0.1 ל mL 1.9 PBS, הם גם אפשרי). השימוש בשיטה זו, אשר מבוססת על שיטת מניעה trypan צבע כחול, היה כפי שתוארה לעיל26. מספר התקנים אחרים זמינים מסחרית לספירת מספר הטלפון הנייד ואת הכדאיות זה אמור לעבוד באותה מידה. - לאסוף מספר תאים (קרי, ~ 24 x 106 תאים להפעיל וזמינותו עם לוח אחד 96-ובכן מלאה) הרצוי בשפופרת סטרילי 50 מ על ידי צנטריפוגה (ראה טבלת חומרים, ריאגנטים עבור סוג צנטריפוגה בשימוש)-400 g x עבור 5 דקות- RT.
- יוצקים בעדינות את תגובת שיקוע מבלי להפריע בגדר התא. להוסיף מאגר assay טריים (למשל, 20 מ ל), resuspend את התאים על ידי בעדינות pipetting למעלה ולמטה.
- Centrifuge התאים שוב ב 400 g x עבור 5 דקות ב- RT.
- יוצקים את תגובת שיקוע שוב, resuspend בגדר תא במאגר assay טריים כדי להשיג צפיפות של 5 x 106 תאים/מ ל....
3. תחרות איגוד וזמינותו
הערה: תחרות בפועל מחייב וזמינותו מתבצע ב- RT, יכול להתבצע בתנאים שאינו סטרילי.
- לדלל את תרכובות תחת חקירה במאגר assay (ראה 2.2) כדי להשיג את הריכוז הרצויה. גם הכנת ריכוז קבוע של המתחם להקרנה הראשונית (למשל, 10 מיקרומטר הסופי ריכוז) או, לחילופין, סדרת טורי דילול ריכוזים לקבלת מפורט יותר אפיון של תרכובות (למשל, 1/3, 1/4 או 1 / 5 דילול סדרת החל מ- 1 מיקרומטר, הריכוז הסופי). יש לזכור כי הפתרון מורכב שבסופו של דבר יהפוך 2 x מעורבבת עם וזמינותו; לכן, להכין 2 x תמיסה מרוכזת.
- לוותר על 100 µL של פתרון תרכובת (2 x מרוכז) לבאר ברור 96-סביב הצלחת התחתונה (ראה טבלה של חומרים, ריאגנטים) לפי זיון ניסיוני מוגדרים מראש החוצה (למשל, איור 1C).
הערה: בשלב זה, בקרה חיובית ושלילית דוגמאות כלולים וזמינותו. דגימת בקרה שלילית, 100 µL assay מאגר נוסף במקום מתחם הבארות של צלחת 96-ובכן. מדגם בקרה חיובית, מאגר assay מתווסף גם במהלך שלב זה. ראה גם איור 1C פריסה ניסויית טיפוסית שבה נבדק סדרת דילול מספר תרכובות. - להוסיף 50 µL תא השעיה (ראה 2.7; 0.25 x 106 תאים) מתוך מאגר מגיב המשקולת 96-ובכן, בעזרת פיפטה רב-ערוצי. דגירה את הצלחת. בשביל 15 דקות ב RT בחושך.
- להוסיף 50 µL של CXCL12 fluorescently שכותרתו (קרי, 100 ננוגרם למ"ל של CXCL12AF647 assay מאגר, 4 x מרוכז, 25 הריכוז הסופי של ng/mL) מתוך מאגר ריאגנט דומה לבארות של צלחת 96-ובכן. תקופת דגירה של 30 דקות ב- RT בחושך.
הערה: עבור שליטה שלילי דגימות, להוסיף מאגר assay במקום. לפיכך, האות פלורסנט שאותרו בדגימות שליטה שלילי יתאים לאות רקע autofluorescent (איור 1 א'). לקבלת דוגמאות בקרה חיובית, להוסיף µL 50/טוב של CXCL12AF647. הדגימות בקרה חיובית תניב האות פלורסצנטיות מקסימלי שאותרו, מאז אין עיכוב פוטנציאליים על ידי דגירה מראש עם תרכובות נכללה (איור 1 א'). - Centrifuge את הצלחת 96-ובכן-400 g x עבור 5 דקות ב RT. להסיר תגובת שיקוע מתאי pelleted על ידי flipping מעל הצלחת. יבש על הלוחית טישו.
- להוסיף 200 µL assay טריים מאגר מתוך מאגר ריאגנט הבארות באמצעות פיפטה רב-ערוצי. ומיד להמשיך.
- Centrifuge את הצלחת שוב למשך 5 דקות ב 400 g x-RT. להסיר תגובת שיקוע על ידי flipping יניף וזה שוב יבש על רקמות.
- בעדינות resuspend בגדר תא ב 200 µL של paraformaldehyde 1% מומס ב- PBS. שלב זה יהיה לתקן את התאים.
- המשך הפרוטוקול באופן מיידי באמצעות כימות של זריחה על-ידי cytometry זרימה.
4. ניתוח של הדגימות מאת cytometry זרימה
CXCL12AF647 צבעונית, תאים מקובעים מוכנים כעת להיות מנותח באמצעות cytometry זרימה. ניתן להשתמש בכמה סוגי זרימה cytometers, אבל הם צריכים להיות מצויד הלייזר הנכון (קרי, לייזר אדום, עירור טווח ~ 630 ננומטר) עבור עירור ומסננים מתאימים לצורך זיהוי fluorophore (פליטת מסננים ~ 660 ננומטר). הם צריכים להיות מסוגל. להתמודד עם דגימות בתבנית 96-ובכן צלחת. דוגמאות של התקנים cytometry זרימה מתאימים ניתנת טבלה של חומרים, ריאגנטים.
- הפעל את ההתקן ופתח את התוכנה המתאימה (ראה טבלה של חומרים, ריאגנטים).
- בחר את הפרמטרים הבאים הסלולר כדי ניתן לאבחן בתבנית חשופה נקודה: קדימה פיזור (FSC), לצד פיזור (האס) וערוץ זיהוי fluorophore (CXCL12AF647).
הערה: עם הפרמטר FSC, התאים הם היפלו בהתאם לגודל שלהם, מאז קליטת האור שזוהו הוא יחסי בקוטר של התא. הפרמטר האס, למדידת פיזור אור בזווית של 90°, מספק מידע אודות צפיפות הרשת של התאים. - לבחור דוגמא אחת (למשל, דגימת בקרה שלילית) כדי לבצע gating של אוכלוסיה מוגדרת תא הומוגנית על סמך הפרמטרים FSC והאס.
- בחר הזרקה אוטומטית של ~ 100 µL של תאים מקובעים דגימת הבקרה השלילית הזו לתוך cytometer זרימה. בחר את האפשרות "ערבוב" לפני הזרקת ולהשתמש קצב זרימה מדגם של µL 1.5/s.
- תריצי את הדוגמא על-ידי בחירה "ידרשו נתוני." הפרמטרים FSC והאס עבור דוגמה זו תופיע כעת על המסך.
- בחרו בכלי חסימה של התוכנה. בהתבסס על ויזואליזציה חשופה נקודה FSC של האס, מראש להגדיר אוכלוסיה הומוגנית בר -קיימא תא על-ידי gating. לשם כך, צור מצולע (באמצעות הכלי חסימה של התוכנה) הכוללת את למשל מבוזרת תאים בודדים ("אירועים") מבוסס על שני ממדים אלה.
הערה: ההליך המגביל שואפת להגדיר אוכלוסיה הומוגנית בר -קיימא תא שישמש לניתוח נוסף. Gating מסתמך על ההנחה כי הרוב המכריע של התאים קיימא יהוו אוכלוסייה הומוגנית תא בהתבסס על הפרמטרים FSC והאס. על ידי ביצוע שלב זה, פסולת הסלולר, תאים מתים, אגרגטים התא יכול במידה רבה לא ייכללו ניתוח נוסף. איור של תהליך המגביל הוא נתון איור 1B.
- בחר באפשרות זו כדי לנתח 20,000 "אירועים" (קרי, תאים בודדים) עבור דגימה.
הערה: פירוש הדבר כי עבור כל דגימה, 20,000 תאים הנמצאים בתוך השער מוגדר מראש בסופו של דבר ינותחו. חדרי קירור והקפאה עבור כל דגימה תימשך עד ניתוח מספר זה של אירועים. - התחל ההפעלה (בחר "רשומת נתונים"). המכשיר cytometry זרימה ננתח עכשיו כל דוגמאות אחד--אחד על-ידי רישום עצמת קרינה פלואורסצנטית רשע (MFI) עבור כל דגימה. MFI הזה מקביל האות פלורסנט רשע התואם התאים 20,000 הנמצאות בין השער מוגדר מראש.
5. ניתוח נתונים
השתמש את MFI השיג עבור כל דגימה לבצע את כל החישובים נוספות. ניתוח של הנתונים cytometry זרימה יכולה להתבצע על ידי מספר חבילות תוכנה זמינים מסחרית (ראו טבלה של חומרים, ריאגנטים).
- כדי לקבוע את האחוז עיכוב של האות איגוד פלורסנט, כתוצאה מתחם הדגירה קדם, להחיל את הנוסחה הבאה:
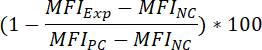
איפה:
MFIExp = את MFI של הניסוי (= שטופלו מתחם) מדגם
MFIPC = MFI את הפקד חיובי
MFINC = MFI את הפקד שלילי - כדי לקבוע את הערך50 IC של תרכובת (קרי, הריכוז של מתחם זה יכול להפחית את האות איגוד פלורסנט ב-50%), להחיל את הנוסחה הבאה:
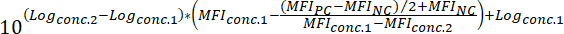
איפה:
יומןconc.2 = את יומן הרישום של ריכוז של המתחם כי התוצאות פחות מ 50% עיכוב של ההבדל בין הערך MFI של PC, NC
יומןconc.1 = את יומן הרישום של ריכוז של מתחם זה מתבטא יותר מ 50% עיכוב של ההבדל בין הערך MFI של PC, NC
הערה: לחלופין, במקרה של חומרים פעילים מאוד, עקומת מנה-תגובה כיסוי ממספר יומני רישום של גודל ניתן להפיק על סמך את MFI המתאים לכל נבדק ריכוז המתחם. על-ידי החלת רגרסיה ליניארי פריסטלטיות באמצעות תוכנה מתאימה (ראה טבלה של חומרים, ריאגנטים), IC50 ערכים יכול אז ניתן להסיק את עקומות שנוצרו. דוגמה מובהקת לכך ניתוח מוצג באיור3.
תוצאות
תהליך העבודה הכללי של איגוד וזמינותו מוצג איור 1A. המחשה של סוג הנתונים cytometry זרימה השיג עבור סוגי דגימה שונים בניסוי סטנדרטי (קרי, שליטה שלילי, חיובי, ובקרה מדגם ניסיוני) מתואר ב איור 1B, ופריסת לוח אפשרי לביצוע וזמינותו בתבנית צלחת 96-וב?...
Discussion
לעומת סוגים אחרים של מבחני הכריכה (קרי, רוויה איגוד, איגוד קינטי ניסויים), מבחני הכריכה תחרות הם המתאימים ביותר לסינון למטרות. אכן, הם מאפשרים הערכה של קבוצות גדולות של תרכובות ללא תווית, מולקולות קטנות למשל, כשקלע שלהם יכולת להתערב עם הכריכה של כמות קבועה של ליגנד לקולטן שכותרתו. תרכוב...
Disclosures
המחברים אין לחשוף.
Acknowledgements
המחברים רוצה להודות אריק Fonteyn לסיוע טכני מעולה. עבודה זו בתמיכתם של לופן KU (מענק. לא. PF/10/018), Fonds voor Wetenschappelijk Onderzoek (FWO, להעניק. לא. G.485.08) וואדוז Dormeur את Fondation.
Materials
| Name | Company | Catalog Number | Comments |
| BD FACSCanto II | Becton Dickinson | Not applicable | Flow cytometry device |
| BD FACSDIVA Software | |||
| BD FACSArray | Becton Dickinson | Not applicable | Flow cytometry device |
| BD FACSArray System Software | |||
| Graphpad Prism | Graphpad | software package used for nonlinear regression analysis in Figure 2 and Figure 3 | |
| FlowJo | FlowJo is now a wholly owned subsidiary of BD. | ||
| Vi-CELL | Beckman Coulter | Not applicable | cell viability analyzer |
| Sigma 3-18 KS | Sigma | Not applicable | centrifuge |
| AMD3100 | Sigma | A5602-5mg | specific CXCR4 antagonist |
| Maraviroc | Pfizer | antiretroviral drug, CCR5 antagonist, available for research at Selleckchem (cat#S2003), Sigma (cat#PZ0002) | |
| h-SDF1a (AF647) | ALMAC | CAF-11-B-01 | fluorescently labeled CXCL12, CXCL12AF647 |
| Fetal Bovine Serum (FBS) | Gibco (Life Technologies) | 10270-106 | |
| Bovine Serum Albumin (BSA) | Sigma | A1933-25G | |
| HBSS (10x), calcium, magnesium, no phenol red | Gibco (Life Technologies) | 14065-049 | |
| HEPES (1M) | Gibco (Life Technologies) | 15630-056 | |
| Dulbecco's Phosphate Buffered Saline (DPBS) | Gibco (Life Technologies) | 14190-094 | |
| Jurkat cells | ATCC | ||
| Reagent reservoir PP | Sigma | BR703411 | |
| Rapid flow filter: 0.2 µm aPES | Thermo Scientific | 566-0020 | |
| Sterilin microtiter plate, 96-well, U bottom, clear | Thermo Scientific | 611U96 | |
| Falcon tubes, 50ml | Greiner Bio-One | 227 261 | |
| Tissue culture flask (T75) | Corning | 353024 |
References
- Fredriksson, R., Lagerstrom, M. C., Lundin, L. G., Schioth, H. B. The G-protein-coupled receptors in the human genome form five main families. Phylogenetic analysis, paralogon groups, and fingerprints. Mol Pharmacol. 63, 1256-1272 (2003).
- Milligan, G., Kostenis, E. Heterotrimeric G-proteins: A short history. Br J Pharmacol. 147 Suppl 1, S46-S55 (2006).
- Oldham, W. M., Hamm, H. E. Heterotrimeric G protein activation by G-protein-coupled receptors. Nat Rev Mol Cell Biol. 9, 60-71 (2008).
- Tuteja, N. Signaling through G protein coupled receptors. Plant Signal Behav. 4, 942-947 (2009).
- Neves, S. R., Ram, P. T., Iyengar, R. G protein pathways. Science. 296, 1636-1639 (2002).
- Gurevich, E. V., Tesmer, J. J., Mushegian, A., Gurevich, V. V. G protein-coupled receptor kinases: more than just kinases and not only for GPCRs. Pharmacol Ther. 133, 40-69 (2012).
- Smith, J. S., Rajagopal, S. The beta-arrestins: Multifunctional regulators of G protein-coupled receptors. J Biol Chem. 291, 8969-8977 (2016).
- Pierce, K. L., Premont, R. T., Lefkowitz, R. J. Seven-transmembrane receptors. Nat Rev Mol Cell Biol. 3, 639-650 (2002).
- Hopkins, A. L., Groom, C. R. The druggable genome. Nat Rev Drug Discov. 1, 727-730 (2002).
- Lappano, R., Maggiolini, M. G protein-coupled receptors: Novel targets for drug discovery in cancer. Nat Rev Drug Discov. 10, 47-60 (2011).
- Chatterjee, S., Behnam Azad, ., Nimmagadda, B., S, The intricate role of CXCR4 in cancer. Adv Cancer Res. 124, 31-82 (2014).
- Bleul, C. C., Farzan, M., Choe, H., Parolin, C., Clark-Lewis, I., Sodroski, J., Springer, T. A. The lymphocyte chemoattractant SDF-1 is a ligand for LESTR/fusin and blocks HIV-1 entry. Nature. 382, 829-833 (1996).
- Flomenberg, N., DiPersio, J., Calandra, G. Role of CXCR4 chemokine receptor blockade using AMD3100 for mobilization of autologous hematopoietic progenitor cells. Acta Haematol. 114, 198-205 (2005).
- Domanska, U. M., Kruizinga, R. C., Nagengast, W. B., Timmer-Bosscha, H., Huls, G., de Vries, E. G., Walenkamp, A. M. A review on CXCR4/CXCL12 axis in oncology: No place to hide. Eur J Cancer. 49, 219-230 (2013).
- Tsou, L. K., Huang, Y. H., Song, J. S., Ke, Y. Y., Huang, J. K., Shia, K. S. Harnessing CXCR4 antagonists in stem cell mobilization, HIV infection, ischemic diseases, and oncology. Med Res Rev. , (2017).
- Schols, D., Struyf, S., Van Damme, J., Este, J. A., Henson, G., De Clercq, E. Inhibition of T-tropic HIV strains by selective antagonization of the chemokine receptor CXCR4. J Exp Med. 186, 1383-1388 (1997).
- Van Hout, A., D'Huys, T., Oeyen, M., Schols, D., Van Loy, T. Comparison of cell-based assays for the identification and evaluation of competitive CXCR4 inhibitors. PLoS One. 12, e0176057 (2017).
- De Clercq, E. The AMD3100 story: the path to the discovery of a stem cell mobilizer (Mozobil). Biochem Pharmacol. 77, 1655-1664 (2009).
- Debnath, B., Xu, S., Grande, F., Garofalo, A., Neamati, N. Small molecule inhibitors of CXCR4. Theranostics. 3, 47-75 (2013).
- Woodard, L. E., Nimmagadda, S. CXCR4-based imaging agents. J Nucl Med. 52, 1665-1669 (2011).
- Wang, Y., Xie, Y., Oupicky, D. Potential of CXCR4/CXCL12 Chemokine Axis in Cancer Drug Delivery. Curr Pharmacol Rep. 2, 1-10 (2016).
- Nimmagadda, S., Pullambhatla, M., Stone, K., Green, G., Bhujwalla, Z. M., Pomper, M. G. Molecular imaging of CXCR4 receptor expression in human cancer xenografts with [64Cu]AMD3100 positron emission tomography. Cancer Res. 70, 3935-3944 (2010).
- De Silva, R. A., Peyre, K., Pullambhatla, M., Fox, J. J., Pomper, M. G., Nimmagadda, S. Imaging CXCR4 expression in human cancer xenografts: evaluation of monocyclam 64Cu-AMD3465. J Nucl Med. 52, 986-993 (2011).
- Hatse, S., Princen, K., Liekens, S., Vermeire, K., De Clercq, E., Schols, D. Fluorescent CXCL12AF647 as a novel probe for nonradioactive CXCL12/CXCR4 cellular interaction studies. Cytometry A. 61, 178-188 (2004).
- Wootten, D., Christopoulos, A., Sexton, P. M. Emerging paradigms in GPCR allostery: implications for drug discovery. Nat Rev Drug Discov. 12, 630-644 (2013).
- Louis, K. S., Siegel, A. C. Cell viability analysis using trypan blue: manual and automated methods. Methods Mol Biol. 740, 7-12 (2011).
- Perry, C. M. Maraviroc: a review of its use in the management of CCR5-tropic HIV-1 infection. Drugs. 70, 1189-1213 (2010).
- Moyle, G., DeJesus, E., Boffito, M., Wong, R. S., Gibney, C., Badel, K., MacFarland, R., Calandra, G., Bridger, G., Becker, S. Proof of activity with AMD11070, an orally bioavailable inhibitor of CXCR4-tropic HIV type 1. Clin Infect Dis. 48, 798-805 (2009).
- Balabanian, K., Lagane, B., Infantino, S., Chow, K. Y., Harriague, J., Moepps, B., Arenzana-Seisdedos, F., Thelen, M., Bachelerie, F. The chemokine SDF-1/CXCL12 binds to and signals through the orphan receptor RDC1 in T lymphocytes. J Biol Chem. 280, 35760-35766 (2005).
- Burns, J. M., Summers, B. C., Wang, Y., Melikian, A., Berahovich, R., Miao, Z., Penfold, M. E., Sunshine, M. J., Littman, D. R., Kuo, C. J., Wei, K., McMaster, B. E., Wright, K., Howard, M. C., Schall, T. J. A novel chemokine receptor for SDF-1 and I-TAC involved in cell survival, cell adhesion, and tumor development. J Exp Med. 203, 2201-2213 (2006).
- Stoddart, L. A., Kilpatrick, L. E., Briddon, S. J., Hill, S. J. Probing the pharmacology of G protein-coupled receptors with fluorescent ligands. Neuropharmacology. 98, 48-57 (2015).
- Vernall, A. J., Hill, S. J., Kellam, B. The evolving small-molecule fluorescent-conjugate toolbox for Class A GPCRs. Br J Pharmacol. 171, 1073-1084 (2014).
- Stoddart, L. A., White, C. W., Nguyen, K., Hill, S. J., Pfleger, K. D. Fluorescence- and bioluminescence-based approaches to study GPCR ligand binding. Br J Pharmacol. 173, 3028-3037 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved