JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
CXC Chemokine 수용 체 4에 붙일 레이블 CXC Chemokine Ligand 12의 바인딩 중단 하는 화합물을 식별 하는 흐름 Cytometry 기반 시험
요약
한 흐름 cytometry 기반 셀룰러 바인딩 분석 결과 설명 CXC chemokine 수용 체 4 (CXCR4)에 붙일 레이블된 CXC chemokine ligand 12 (CXCL12)의 바인딩을 억제 하는 화합물을 식별 하는 검사 도구로 주로 사용 되는.
초록
G 단백질 결합 된 수용 체 (GPCRs)의 약리 타겟팅으로 많은 질병의 진행에 기여 장애 GPCR 중재 신호 인간의 건강에 매우 중요입니다. 수용 체의 ligand 쌍 CXC chemokine ligand 12 (CXCL12) / CXC chemokine 수용 체 4 (CXCR4) 암 및 염증 성 질환의 치료에 대 한 잠재적인 대상으로 예를 들어 중요 한 임상 관심을 제기 하고있다. 특히 CXCR4 대상 및 수용 체의 기능을 억제 하는 치료 항 체로 서 작은 분자 약리학 유용한 도구 간주 됩니다 따라서. 여기, 흐름 cytometry 기반 셀룰러 분석 결과 CXCL12 바인딩을 CXCR4, 파기 화합물 (예를 들어, 작은 분자) 수 있도록 설명 되어 있습니다. 기본적으로, 분석 결과 붙일 레이블된 CXCL12, CXCR4, 자연 chemokine 주 작동 근의 고정 된 금액 및 레이블이 없는 화합물 사이의 바인딩 수용 체에 대 한 경쟁에 의존 합니다. 따라서, 방사성 레이블이 프로브를 사용 하 여 바람직하지이 분석 결과에 피 한다. 또한, 살아있는 세포 수용 체 (CXCR4) 세포 막 준비 대신의 원본으로 사용 됩니다. 처리량을 증가 플레이트 형식으로 분석 결과의 쉬운 적응 수 있습니다. 이 분석 결과 CXCR4 대상 화합물을 식별 하 귀중 한 제네릭 약물 발견 분석 결과 되도록 표시 되었습니다. 프로토콜 가능성이 적용할 수 있습니다 다른 GPCRs에 적어도 붙일 레이블된 ligands 사용할 수 있습니다 또는 생성 될 수 있습니다. 이러한 GPCRs의 활성화 유도 된 세포내 신호 통로 관한 사전 지식이 필요 하지 않습니다.
서문
G 단백질 결합 된 수용 체 (GPCRs)는 세포 표면 단백질 (예를 들면, 펩 티 드, 단백질 호르몬, 아민) extracellular ligands에 의해 활성화 될 수 있는, 많은 생리 적 그리고 발달을 조절 함으로써 처리1. 한 길 항 제는 GPCR 바인딩 주머니 차지 하 고, 수용 체 단백질에 유도 구조적 변화 Gα의 구성 된 세포내 수용 체 관련 된 heterotrimeric G 단백질의 바인딩을 촉진-GDP와 Gβγ 소 단위. Gα 소 단위 결과 G 단백질 소 단위 (Gα-GTP와 Gβγ)를 차례로 추가 시작 하류의 분리에 GDP에 대 한 GTP의 후속 교환 신호 경로2,3. Gα-GTP 분해 된다 때 다시 협회 Gα의 GDP와 Gβγ 소 단위 변환 G 단백질 다시는 휴식 상태3,4. G 단백질의 다른 종류 (Gs, Gi/o, Gq, G12/13), 존재는 Gα 소 단위5시퀀스 유사성에 따라 분류 한다. 모두 이러한 G 단백질 수용 체 활성화에 생물학 응답 기초 정의 된 세포내 신호 통로 유도. 수용 체 활성화 후 GPCR kinases (GRKs) 함으로써 β-arrestins와의 상호 작용을 촉진 하는 GPCRs의 세포내 꼬리 phosphorylate. 이 프로세스는 G 단백질 신호, 수용 체 탈 감 작과 국제화6의 종료에 리드. Β-arrestins는7을 신호 하는 G 단백질의 독립적인 폭포 트리거 신호 다 분자 복합물의 부분 있습니다.
GPCRs는 치료 적 개입에 대 한 가장 유효한 분자 표적 사이 많은의 병 인에 기여 하 고 규제 완화 GPCR 중재 신호, 예를 들면 수용 체 유전자 또는 수용 체 overexpression에 이득의 기능 돌연변이 때문으로 인간의 질병8. 따라서, GPCRs 제약 산업8,,910조사 약물 목표의 가장 중요 한 클래스 중 하나를 나타냅니다. 임상 관련 GPCR의 주목할 만한 보기는 CXC chemokine 수용 체 4 (CXCR4) CXC chemokine ligand 12 (CXCL12)11유일한 자연 리간드에 의해 활성화 될 수 있는 이다. 때문에 인간 면역 결핍 바이러스 1에 대 한 주요 공동 수용 체로 서의 설립된 역할 (HIV-1) 항목 및 클러스터 차별화 4의 (CD4) 긍정적인 T 세포12, CXCR4 항 바이러스 약물 대상으로 조사에 처음에 감염. 더 골에서 CXCL12 CXCR4 상호 작용 조절 유지 그리고 줄기와 뿌리의 유도 세포13. 또한, 암 생물학 (예: 종양 세포 생존, 전이, 종양 관련 신생)14 의 여러 측면에 몇 가지 다른 인간의 질병 (예를 들어, 염증 성 질환)15, CXCR4의 개입을 주어진 약물 발견에 대 한 유망 대상으로 상당한 관심을 발생합니다. AMD3100, 특히 표적으로 CXCR4, 작은 분자 항 HIV 약물 후보16 처음 밝혀졌다 이며 여전히 가장 강력한 CXCR4 길 항 근 날짜17에 설명 중 하나. 그러나 개발으로는 항 바이러스 약물은,,18를 중단. 현재이 분자 다 발성 림프 종 환자18의 치료 중 줄기 세포 동원 에이전트로 사용 됩니다. 다른 여러 가지 화학적으로 관련이 없는 작은 분자와 다양 한 효능 가진 CXCR4 기능을 억제 하는 생물 의약품 설명된19되었습니다.
수용 체 바인딩 메서드는 관심의 GPCR와 직접 상호 작용 하는 화합물 (예를 들어, 작은 분자)의 id를 허용 하는 약리학에 귀중 한 도구입니다. 바인딩 연구를 수행 하기 위해서는 세포내 신호 속성 또는 특정된 GPCR의 기능에 관한 사전 지식에 대 한 필요가 있다. 이 이점을로 간주 될 수 있습니다, 하지만 그것은 화합물 바인딩 설명 될 수 있는 수용 체에 대 한 그들의 잠재적인 agonistic 또는 대립 활동을 평가 하 여 특징 추가 될 필요가 의미. 이 활동은 GPCR 연구에 관련 된 약리학 또는 생물학 분석 실험을 사용 하 여 평가할 수 있습니다. 그들의 작업 프로필에 의존, 수용 체 바인딩 분자 수 있습니다 다음 잠재적으로 진화 될 전 임상 및 임상 연구에 조사에 대 한 소설 리드 화합물. 예를 들어 종양 세포20, 비 침 투 적인 vivo에서 이미징 radiolabeling 여 치료 또는 진단 도구를 생성 하는 건설 기계 또는 잠재력으로 특히 높은 선호도와 수용 체에 묶는 분자도 사용할 수 있습니다. 치료제21의 대상 배달 차량. CXCR4, 경우 종양 세포의 이미징 vivo에서 이미 입증 되었습니다 레이블이 CXCR4 타겟팅 분자 인간 암 xenografts20,22,23의 시각화를 허용 하는 어떤 점에서 마우스 모델을 사용 하 여 .
이 보고서에서 우리는 작은 분자와 방해 하는 직접 길 항 제 (CXCL12) 바인딩 CXCR4 biologics의 식별을 가능 하 게 경쟁 바인딩 분석 결과 대 한 상세한 프로토콜을 설명 합니다. 분석 결과의 기본 원리는 붙일 레이블된 ligand의 고정 된 금액 간의 경쟁 (CXCL12AF647, 참조 테이블의 재료 및 시 약)과 화합물 바인딩 수용 체 단백질17, 에 대 한 레이블 없음 24. 레이블이 ligand CXCR4 표현 하는 단일 셀에 바인딩된에서 특정 형광 신호 다음 cytometry에 의해 분석 됩니다. 이 형광 신호 레이블 없는 작은 분자 CXCL12AF647 와 CXCR4 간의 상호 작용을 방해 하는 경우에 줄어들 것입니다. 분석 결과 endogenously 익스프레스 CXCR4 조작 아닌 살아있는 세포를 사용 하 여 (즉, Jurkat 세포). 따라서, 아무 세포 막 준비는 필요 하 게 분석 결과 편리, 신속 하 고 늘어난된 처리량과 호환. 붙일 레이블된 ligand 사용 되므로 방사능은 피 한다.
분석 결과에서 CXCL12AF647 바인딩을 방해 하는 작은 분자 화합물 (즉, 바인딩 사이트는 자연에 의해 점령 orthosteric 수용 체 바인딩 사이트와 상호 작용을 확률이 CXCL12 CXCR4 위한 자연 길 항 제 이므로 주 작동 근)입니다. 그들은 CXCL12의 바인딩을 좌우 하지 않는다 것 세 orthosteric 바인딩 사이트에서 고유 수용 체 바인딩 사이트와 상호 작용 하는 분자 들 키 지 않고, 남아 있습니다. 예를 들어, 긍정적이 고 부정적인 allosteric 변조기, 분자 allosteric 바인딩 사이트25에 행동을 타겟팅 하는 GPCR의 중요 하 고 신흥 카테고리 것입니다 잠재적으로 하지 주워이 분석 결과 함께. 또한, 수용 체 길 항 제 또는 촉진제로는 화합물이 바인딩 분석 기능으로 식별 여부를 파생 수 없습니다. 추가적인 약리 또는 기능 수용 체 관련 분석 실험에서 확인 된 화합물의 조사 따라서 하셔야 합니다. 이 분석 실험의 (조합) 포함 될 수 있습니다 두 번째 메신저 (예를 들어, 캘리포니아2 +, 순환 아데노신 monophosphate (캠프)), phenotypic의 검출에 대 한 분석 실험 세포 형광 또는 발광 기반 또는 생물학 분석 실험 및 β-arrestin GPCR 연구의 특정 신호 속성에 따라 어떤 선택 채용 분석 실험 따라서, 주로 여기에 설명 된 경쟁 바인딩 분석 결과 초기 심사 분석 결과 수용 체 바인딩 힘으로 화합물의 깊이 특성을 사용 하도록 다른 세포 기반 분석으로 보완 하는 역할을 합니다.
프로토콜
1입니다. 세포 배양의 유지 보수
참고: 1과 2에 설명 된 모든 단계는 층 류 캐비닛에 무 균 조건 하에서 수행 됩니다.
- 37 ° C, 5% CO2 습도 인큐베이터 T75 문화 플라스 크에 세포 성장.
참고:이 분석 결과에서 Jurkat 세포 (즉, 인간의 leukemic T 림프 구 세포 endogenously CXCR417익스프레스)는 사용 됩니다. 세포 표면에 CXCR4 표현의 cytometry에 의하여 세포 배양을 통해 평가 되어야 한다. 그러나 교류 cytometry 절차 및 셀 표면에 수용 체 식 수준 아니다,,이 프로토콜의 범위 내에서 하지만 되었습니다 확인 시 약의 설명 설명 이전17. - 하자 Jurkat 세포 성장에 80-85%에 도달할 때까지 confluency. 소설 플라스 크에 세포를 뿌리고, 하기 전에 실내 온도 (RT)를 도달 하는 모든 시 약을 하실 수 있습니다.
- 소설 T75 문화 플라스 크를 신선한 완전 한 성장 매체 (RPMI-1640 매체, 10% 태아 둔감 한 혈 청 (FBS), 2mm 글루타민) 20 mL를 추가 합니다.
- 소설 T75 문화 플라스 크를 (세포 현 탁 액 25 mL를 포함 하는) 원래 T75 플라스 크에서 Jurkat 세포 현 탁 액 5 mL를 추가 합니다. 습도 인큐베이터에서 37 ° C, 5% CO2 에서 품 어.
2. 경쟁 분석 결과 바인딩 CXCL12, 분석 결과 버퍼 및 Jurkat 세포의 준비.
- 동결 건조 된 시 약 (어둠 속에서-80 ° C에 저장) 초순 0.01% (볼륨/볼륨) 폴 20의 보충에 용 해 하 여 CXCL12AF647 (20 µ g/mL, 참조 테이블의 재료 및 시 약)의 재고 솔루션을 준비 합니다. 단일 저장소-80 ° c, 빛 으로부터 보호이 재고 솔루션에서 aliquots를 사용 합니다.
- 200 mL 행 크의 균형 소금물 (HBSS, 10 배, 페 놀 레드과 나트륨 중 탄산염, 최종 농도 x 1 없이) 40 mL HEPES (1 M, 20mm 최종 농도)를 추가 하 여 분석 결과 버퍼를 준비 합니다. 추가 초순 2 L. 추가 4 g (0.2% 무게/볼륨) 소 혈 청 알 부 민 (BSA)의 최종 볼륨을 가져오고 자기 통해 BSA를 분해 하는 감동. 마지막으로, pH 7.4 (NaOH을 사용 하 여이 대 한)를 조정 하 고 참조 테이블의 재료 및 시 약0.2 µ m 숨 구멍을 통해 솔루션 필터 진공 매니폴드를 사용 하 여.
참고:이 분석 결과 버퍼 프로토콜의 모든 추가 단계에 사용 됩니다. - 수와 세포의 생존 능력을 계산 합니다. 이 위해, 세포 현 탁 액의 샘플 고 버퍼링 하는 인산 염 (PBS)에 희석.
참고: 우리 정기적으로 사용 하 여 자동된 세포 생존 능력 분석 ( 테이블의 재료 및 시 약참조) 다양 한 농도에서 세포 정지 계산의 능력. 셀 계산에 대 한 세포 현 탁 액 1.5 ml PBS (다른 희석, 예를 들어, 1.9 ml PBS, 0.1 mL 있습니다 가능) 0.5 mL를 희석. Trypan blue 염료 제외 방법에 근거 하는이 메서드의 사용 되었습니다26위에서 설명한. 다른 여러 장치 계산 셀 번호와 동일 하 게 작동 하는 생존에 대 한 상업적으로 사용할 수 있습니다. - 5 분에 대 한 400 x g에서 원심 (사용 하는 원심 분리기의 종류에 대 한 재료 및 시 약의 표 참조)에 의해 살 균 50 mL 튜브에 셀 (즉, ~ 24 x 106 셀 하나의 완전 한 96 잘 접시와 분석 결과 실행)의 원하는 번호를 수집 실시간
- 부드럽게 셀 펠 렛을 방해 하지 않고는 상쾌한을 붓는 다. 신선한 분석 결과 버퍼를 추가 (예: 20 mL)와 부드럽게 위아래로 pipetting으로 셀 resuspend.
- 실시간에서 5 분에 대 한 400 x g에서 다시 셀을 원심
- 상쾌한 떨어져 다시와 5 x 106 셀/mL의 조밀도를 신선한 분석 결과 버퍼에서 셀 펠 릿 resuspend.
3. 경쟁 의무적인 분석 실험
참고: 실제 경쟁 바인딩 분석 결과 RT에서 수행 되 고 비 살 균 조건 하에서 수행할 수 있습니다.
- 조사 분석 결과 버퍼에서 화합물을 희석 (2.2 참조) 원하는 농도를. 자세한 화합물의 특성에 대 한 초기 심사 (예를 들어, 10 µ M 최종 농도)에 대 한 화합물의 농도 고정된 하거나, 또는 농도의 직렬 희석 시리즈 준비 중 (예를 들어, 1/3, 1/4 또는 1 / 5 희석 시리즈 1 µ M, 최종 농도에서 시작). 복합 솔루션 궁극적으로 2 x 분석 결과;에 희석 될 다는 것을 명심합니다 따라서, 집중된 솔루션 x 2를 준비 합니다.
- 바닥판 라운드 분명 96-잘으로 복합 솔루션 (2 배 농축) 100 µ L를 분배 ( 테이블의 재료 및 시 약참조) 밖으로 (예를 들어, 그림 1C) 미리 정의 된 실험 배치에 따르면.
참고:이 단계에서 부정과 긍정적인 제어 샘플 분석 결과에 포함 됩니다. 부정적인 컨트롤 샘플분석 결과 버퍼의 100 µ L 96 잘 접시의 우물에 화합물 대신 추가 됩니다. 긍정적인 컨트롤 샘플에 대 한 분석 결과 버퍼는이 단계에 추가 됩니다. 또한 여러 가지 화합물의 희석 시리즈 테스트는 일반적인 실험 레이아웃에 대 한 그림 1C 참조. - 세포 현 탁 액의 50 µ L 추가 (2.7; 참조 106 셀 x 0.25) 다중 채널 피 펫을 사용 하 여 96 잘 접시에 시 약 저수지에서. 어둠 속에서 RT에서 15 분 동안 접시를 품 어.
- 붙일 레이블된 CXCL12의 50 µ L 추가 (CXCL12AF647 분석 결과 버퍼, 집중 하는 4 x 25 ng/mL의 최종 농도에즉, 100 ng/mL) 96 잘 접시의 우물에 비슷한 시 저수지에서. 어둠 속에서 RT에서 30 분 동안 품 어.
주: 부정적인 컨트롤 샘플에 대 한 추가 분석 결과 버퍼 대신 합니다. 따라서, 부정적인 컨트롤 샘플에서 검출 하는 형광 신호 autofluorescent 배경 신호 (그림 1A)에 대응 됩니다. 긍정적인 통제 견본CXCL12AF647의 50 µ L/잘 추가 합니다. 긍정적인 통제 견본 최대한 형광 신호 감지, 이후 아무 잠재적인 억제 화합물과 사전 외피에 의해 포함 되었다 (그림 1A)를 얻을 것입니다. - 접시를 뒤집어 여 실시간 제거 수송과 세포에서 상쾌한에 5 분에 대 한 400 x g에서 96 잘 접시를 원심. 조직에 접시를 건조.
- 멀티 채널 피 펫을 사용 하 여 우물을 시 저수지에서 신선한 분석 결과 버퍼의 200 µ L를 추가 합니다. 바로 진행 합니다.
- 접시를 뒤집어 여 실시간 제거는 상쾌한에 x 400g에 5 분 동안 다시 접시를 원심 하 고 조직에 다시 그것을 건조.
- 부드럽게 1% paraformaldehyde PBS에 용 해의 200 µ L에서 셀 펠 릿 resuspend. 이 단계는 셀 해결 됩니다.
- Cytometry 여 형광의 정량화와 즉시 프로토콜을 계속 합니다.
4. cytometry에 의해 샘플의 분석
CXCL12AF647 얼룩이 고 집착된 셀 cytometry 사용 하 여 분석할 준비가 됩니다. 교류 cytometers의 여러 종류를 사용할 수 있습니다, 하지만 그들은 정확한 레이저 (즉, 빨간색 레이저, 여기 범위 ~ 630 nm) 여기와 fluorophore 탐지에 대 한 적합 한 필터 장착 해야 (방출 필터 ~ 660 nm). 그들은 96 잘 접시 형태로 샘플을 처리할 수 있이 필요가 있다. 적당 한 흐름 cytometry 장치의 예는 테이블의 재료 및 시 약에부여 됩니다.
- 장치를 시작 하 고 해당 소프트웨어를 열고 ( 테이블의 재료 및 시 약참조).
- 점 오 점 형식으로 시각을 다음 세포 매개 변수 선택: 산포 (FSC), 측면 살포 (SSC) 및 fluorophore (CXCL12AF647) 검색 채널 전달.
참고: FSC 매개 변수를 사용 하는 세포는 차별 그들의 크기에 따라 감지 된 빛 흡수 셀의 직경에 비례 이기 때문. SSC 매개 변수를 90 ° 각도로 산란 측정 셀의 세분성에 대 한 정보를 제공 합니다. - FSC 그리고 SSC 매개 변수를 기반으로 정의 된 동질적인 셀 인구의 게이팅을 수행 하려면 하나의 샘플 (예를 들어, 부정적인 컨트롤 샘플)을 선택 합니다.
- 교류 cytometer에 집착 셀 ~ 100 µ L의 자동 주입이 부정적인 컨트롤 샘플에서 선택 합니다. 옵션 "혼합" 주입 하기 전에 선택한 1.5 µ L/s의 샘플 유량을 사용 합니다.
- "취득 데이터."를 선택 하 여이 샘플을 실행 이 샘플에 대 한 FSC 그리고 SSC 매개 변수는 화면에 표시 됩니다.
- 소프트웨어의 제어 도구를 선택 합니다. 미리 FSC 그리고 SSC 점 오 점 시각에 따라 달라 집니다, 게이팅 하 여 균일 하 고 가능한 세포 인구를 정의 합니다. 이렇게 하려면 homogenously 분산된 단일 셀 (이 하 "행사")이 두 차원에 따라 포함 (를 사용 하 여 소프트웨어의 제어 도구) 다각형을 만듭니다.
참고: 제어 절차는 추가 분석을 위해 사용 될 것 이다 균질이 고 실행 가능한 세포 인구를 정의 하는 것을 목표로. 게이팅 가능한 세포의 대다수 FSC 그리고 SSC 매개 변수에 따라 동종 세포 인구를 형성할 것 이다 가정에 의존 합니다. 이 단계를 수행 하 여 세포질 파편, 죽은 세포, 및 셀 집계 수 주로에서 제외 추가 분석. 제어 프로세스의 그림은 그림 1B에서 제공 됩니다.
- 20000 "" (즉, 단일 셀) 당 이벤트 샘플 분석을 선택 합니다.
참고:이 각 샘플에 대 한 미리 정의 된 게이트 내에 있는 20000 셀 결국 분석 될 것 이다 의미 합니다. 각 샘플에 대 한 데이터 수집 이벤트의이 수 분석 될 때까지 계속 됩니다. - 실행 (선택 "레코드 데이터")를 시작 합니다. 교류 cytometry 장치 각 샘플에 대 한 평균 형광 강도 (MFI)을 기록 하 여 지금 모든 샘플 하나 하나를 분석 합니다. 이 MFI 의미 형광 신호에 해당 하는 미리 정의 된 게이트 내에 있는 20000 셀에 해당 합니다.
5. 데이터 분석
각 샘플에 대 한 얻은 MFI를 사용 하 여 모든 추가 계산을 수행 하. 교류 cytometry 데이터의 분석 ( 테이블의 재료 및 시 약참조) 여러 상용 소프트웨어 패키지에서 수행할 수 있습니다.
- 복합 사전 인큐베이션 결과로 형광 바인딩 신호의 비율 억제를 결정 하려면 다음 수식을 적용.
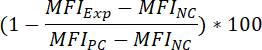
장소:
MFI특급 (= 화합물 취급) 실험의 MFI = 샘플
MFIPC 긍정적인 통제의 MFI를 =
MFINC 부정적인 컨트롤의 MFI를 = - (즉, 50%에 의해 형광 바인딩 신호를 줄일 수 있는 화합물의 농도) 화합물의 IC50 값을 확인 하려면 다음 수식을 적용:
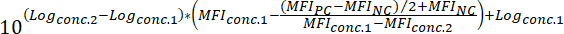
장소:
로그conc.2 = 50% 미만에서 발생 하는 화합물의 농도의 로그 PC와 NC의 MFI 값의 차이의 저해
로그conc.1 = 50% 이상에서 발생 하는 화합물의 농도의 로그 PC와 NC의 MFI 값의 차이의 저해
참고: 또는, 높은 활성 화합물의 경우 규모의 여러 로그를 다루는 복용량 응답 곡선 생성할 수 있습니다 화합물의 각 시험된 농도에 해당 MFI에 기반. 적절 한 소프트웨어를 사용 하 여 비선형 회귀 곡선 맞춤을 적용 하 여 (참조 테이블의 재료 및 시 약), IC50 값 다음 생성 된 커브에서 연 역 될 수 있습니다. 이 분석 방법의 예는 그림 3에 표시 됩니다.
결과
바인딩 분석 결과의 일반적인 워크플로 그림 1A에 제공 됩니다. 다른 샘플 형식 (즉, 부정적인 컨트롤, 긍정적인 제어 및 실험 샘플) 표준 실험에 대 한 얻은 흐름 cytometry 데이터 유형의 그림은 묘사 그림 1B을 가능한 접시 레이아웃을 수행 하 96 잘 접시 형태로 분석 결과 그림 1C에서 주어진 다. Endogeno...
토론
바인딩 분석 (즉, 채도 바인딩 및 바인딩 운동 실험)의 다른 유형에 비해, 경쟁 의무적인 분석 실험은 심사 목적에 가장 적합. 실제로, 그들은 레이블이 지정 된 수용 체 ligand의 고정 된 금액의 바인딩을 방해 하는 그들의 기능을 채 점 하 여 레이블이 없는 화합물, 예를 들어 작은 분자의 큰 배치의 평가 허용. 레이블이 리간드 보다 다른 수용 체 사이트에 바인딩되는 화합물 분석 결과에 들 ?...
공개
저자는 공개 없다.
감사의 말
저자 에릭 Fonteyn 우수한 기술 지원에 대해 감사 하 고 싶습니다. 이 일 구 루벤에 의해 지원 되었습니다 (no를 부여 합니다. PF/10/018), Fonds voor Wetenschappelijk Onderzoek (FWO, no를 부여. G.485.08)와 Fondation Dormeur 파두츠.
자료
| Name | Company | Catalog Number | Comments |
| BD FACSCanto II | Becton Dickinson | Not applicable | Flow cytometry device |
| BD FACSDIVA Software | |||
| BD FACSArray | Becton Dickinson | Not applicable | Flow cytometry device |
| BD FACSArray System Software | |||
| Graphpad Prism | Graphpad | software package used for nonlinear regression analysis in Figure 2 and Figure 3 | |
| FlowJo | FlowJo is now a wholly owned subsidiary of BD. | ||
| Vi-CELL | Beckman Coulter | Not applicable | cell viability analyzer |
| Sigma 3-18 KS | Sigma | Not applicable | centrifuge |
| AMD3100 | Sigma | A5602-5mg | specific CXCR4 antagonist |
| Maraviroc | Pfizer | antiretroviral drug, CCR5 antagonist, available for research at Selleckchem (cat#S2003), Sigma (cat#PZ0002) | |
| h-SDF1a (AF647) | ALMAC | CAF-11-B-01 | fluorescently labeled CXCL12, CXCL12AF647 |
| Fetal Bovine Serum (FBS) | Gibco (Life Technologies) | 10270-106 | |
| Bovine Serum Albumin (BSA) | Sigma | A1933-25G | |
| HBSS (10x), calcium, magnesium, no phenol red | Gibco (Life Technologies) | 14065-049 | |
| HEPES (1M) | Gibco (Life Technologies) | 15630-056 | |
| Dulbecco's Phosphate Buffered Saline (DPBS) | Gibco (Life Technologies) | 14190-094 | |
| Jurkat cells | ATCC | ||
| Reagent reservoir PP | Sigma | BR703411 | |
| Rapid flow filter: 0.2 µm aPES | Thermo Scientific | 566-0020 | |
| Sterilin microtiter plate, 96-well, U bottom, clear | Thermo Scientific | 611U96 | |
| Falcon tubes, 50ml | Greiner Bio-One | 227 261 | |
| Tissue culture flask (T75) | Corning | 353024 |
참고문헌
- Fredriksson, R., Lagerstrom, M. C., Lundin, L. G., Schioth, H. B. The G-protein-coupled receptors in the human genome form five main families. Phylogenetic analysis, paralogon groups, and fingerprints. Mol Pharmacol. 63, 1256-1272 (2003).
- Milligan, G., Kostenis, E. Heterotrimeric G-proteins: A short history. Br J Pharmacol. 147 Suppl 1, S46-S55 (2006).
- Oldham, W. M., Hamm, H. E. Heterotrimeric G protein activation by G-protein-coupled receptors. Nat Rev Mol Cell Biol. 9, 60-71 (2008).
- Tuteja, N. Signaling through G protein coupled receptors. Plant Signal Behav. 4, 942-947 (2009).
- Neves, S. R., Ram, P. T., Iyengar, R. G protein pathways. Science. 296, 1636-1639 (2002).
- Gurevich, E. V., Tesmer, J. J., Mushegian, A., Gurevich, V. V. G protein-coupled receptor kinases: more than just kinases and not only for GPCRs. Pharmacol Ther. 133, 40-69 (2012).
- Smith, J. S., Rajagopal, S. The beta-arrestins: Multifunctional regulators of G protein-coupled receptors. J Biol Chem. 291, 8969-8977 (2016).
- Pierce, K. L., Premont, R. T., Lefkowitz, R. J. Seven-transmembrane receptors. Nat Rev Mol Cell Biol. 3, 639-650 (2002).
- Hopkins, A. L., Groom, C. R. The druggable genome. Nat Rev Drug Discov. 1, 727-730 (2002).
- Lappano, R., Maggiolini, M. G protein-coupled receptors: Novel targets for drug discovery in cancer. Nat Rev Drug Discov. 10, 47-60 (2011).
- Chatterjee, S., Behnam Azad, ., Nimmagadda, B., S, The intricate role of CXCR4 in cancer. Adv Cancer Res. 124, 31-82 (2014).
- Bleul, C. C., Farzan, M., Choe, H., Parolin, C., Clark-Lewis, I., Sodroski, J., Springer, T. A. The lymphocyte chemoattractant SDF-1 is a ligand for LESTR/fusin and blocks HIV-1 entry. Nature. 382, 829-833 (1996).
- Flomenberg, N., DiPersio, J., Calandra, G. Role of CXCR4 chemokine receptor blockade using AMD3100 for mobilization of autologous hematopoietic progenitor cells. Acta Haematol. 114, 198-205 (2005).
- Domanska, U. M., Kruizinga, R. C., Nagengast, W. B., Timmer-Bosscha, H., Huls, G., de Vries, E. G., Walenkamp, A. M. A review on CXCR4/CXCL12 axis in oncology: No place to hide. Eur J Cancer. 49, 219-230 (2013).
- Tsou, L. K., Huang, Y. H., Song, J. S., Ke, Y. Y., Huang, J. K., Shia, K. S. Harnessing CXCR4 antagonists in stem cell mobilization, HIV infection, ischemic diseases, and oncology. Med Res Rev. , (2017).
- Schols, D., Struyf, S., Van Damme, J., Este, J. A., Henson, G., De Clercq, E. Inhibition of T-tropic HIV strains by selective antagonization of the chemokine receptor CXCR4. J Exp Med. 186, 1383-1388 (1997).
- Van Hout, A., D'Huys, T., Oeyen, M., Schols, D., Van Loy, T. Comparison of cell-based assays for the identification and evaluation of competitive CXCR4 inhibitors. PLoS One. 12, e0176057 (2017).
- De Clercq, E. The AMD3100 story: the path to the discovery of a stem cell mobilizer (Mozobil). Biochem Pharmacol. 77, 1655-1664 (2009).
- Debnath, B., Xu, S., Grande, F., Garofalo, A., Neamati, N. Small molecule inhibitors of CXCR4. Theranostics. 3, 47-75 (2013).
- Woodard, L. E., Nimmagadda, S. CXCR4-based imaging agents. J Nucl Med. 52, 1665-1669 (2011).
- Wang, Y., Xie, Y., Oupicky, D. Potential of CXCR4/CXCL12 Chemokine Axis in Cancer Drug Delivery. Curr Pharmacol Rep. 2, 1-10 (2016).
- Nimmagadda, S., Pullambhatla, M., Stone, K., Green, G., Bhujwalla, Z. M., Pomper, M. G. Molecular imaging of CXCR4 receptor expression in human cancer xenografts with [64Cu]AMD3100 positron emission tomography. Cancer Res. 70, 3935-3944 (2010).
- De Silva, R. A., Peyre, K., Pullambhatla, M., Fox, J. J., Pomper, M. G., Nimmagadda, S. Imaging CXCR4 expression in human cancer xenografts: evaluation of monocyclam 64Cu-AMD3465. J Nucl Med. 52, 986-993 (2011).
- Hatse, S., Princen, K., Liekens, S., Vermeire, K., De Clercq, E., Schols, D. Fluorescent CXCL12AF647 as a novel probe for nonradioactive CXCL12/CXCR4 cellular interaction studies. Cytometry A. 61, 178-188 (2004).
- Wootten, D., Christopoulos, A., Sexton, P. M. Emerging paradigms in GPCR allostery: implications for drug discovery. Nat Rev Drug Discov. 12, 630-644 (2013).
- Louis, K. S., Siegel, A. C. Cell viability analysis using trypan blue: manual and automated methods. Methods Mol Biol. 740, 7-12 (2011).
- Perry, C. M. Maraviroc: a review of its use in the management of CCR5-tropic HIV-1 infection. Drugs. 70, 1189-1213 (2010).
- Moyle, G., DeJesus, E., Boffito, M., Wong, R. S., Gibney, C., Badel, K., MacFarland, R., Calandra, G., Bridger, G., Becker, S. Proof of activity with AMD11070, an orally bioavailable inhibitor of CXCR4-tropic HIV type 1. Clin Infect Dis. 48, 798-805 (2009).
- Balabanian, K., Lagane, B., Infantino, S., Chow, K. Y., Harriague, J., Moepps, B., Arenzana-Seisdedos, F., Thelen, M., Bachelerie, F. The chemokine SDF-1/CXCL12 binds to and signals through the orphan receptor RDC1 in T lymphocytes. J Biol Chem. 280, 35760-35766 (2005).
- Burns, J. M., Summers, B. C., Wang, Y., Melikian, A., Berahovich, R., Miao, Z., Penfold, M. E., Sunshine, M. J., Littman, D. R., Kuo, C. J., Wei, K., McMaster, B. E., Wright, K., Howard, M. C., Schall, T. J. A novel chemokine receptor for SDF-1 and I-TAC involved in cell survival, cell adhesion, and tumor development. J Exp Med. 203, 2201-2213 (2006).
- Stoddart, L. A., Kilpatrick, L. E., Briddon, S. J., Hill, S. J. Probing the pharmacology of G protein-coupled receptors with fluorescent ligands. Neuropharmacology. 98, 48-57 (2015).
- Vernall, A. J., Hill, S. J., Kellam, B. The evolving small-molecule fluorescent-conjugate toolbox for Class A GPCRs. Br J Pharmacol. 171, 1073-1084 (2014).
- Stoddart, L. A., White, C. W., Nguyen, K., Hill, S. J., Pfleger, K. D. Fluorescence- and bioluminescence-based approaches to study GPCR ligand binding. Br J Pharmacol. 173, 3028-3037 (2016).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유