A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تحليل في الحجم والشكل واتجاهية شبكات من أستروسيتيس إلى جانب
In This Article
Summary
نقدم هنا بروتوكولا لتقييم المنظمة لشبكات أستروسيتيك. الأسلوب وصف يقلل من التحيز لتوفير تدابير وصفية لهذه الشبكات مثل عدد الخلايا، وحجم ومجال والموقف داخل نواة. ويتم تقييم تباين مع تحليل اتجاهي.
Abstract
أصبح من الواضح بشكل متزايد أن astrocytes تعدل وظيفة الخلايا العصبية ليس فقط على الصعيدين متشابك وخلية واحدة، ولكن أيضا على مستوى الشبكة. أستروسيتيس ترتبط بشدة ببعضها البعض من خلال تقاطعات الفجوة واقتران من خلال هذه الوصلات الديناميكية وعالية التنظيم. مفهوم الناشئ هو أن أستروسيتيك وظائف متخصصة وتتكيف مع مهام الدوائر العصبية التي ترتبط. ولذلك، تلزم أساليب لقياس بارامترات مختلفة من الشبكات أستروسيتيك لوصف أفضل القواعد الناظمة للاتصال بهم واقتران وكذلك فهم وظائفها.
هنا، باستخدام برمجيات تحليل الصورة (مثلاً.، إيماجيجفيجي)، يصف لنا طريقة لتحليل الصور [كنفوكل] شبكات أستروسيتيك كشفت عنها صبغة-اقتران. تسمح هذه الأساليب 1) الاكتشاف الآلي وغير متحيزة للخلايا المسماة، 2) حساب حجم الشبكة، 3) حساب التوجه تفضيلية لصبغ تنتشر داخل الشبكة، و 4) إعادة تنظيم شبكة الاتصال ضمن مجال الاهتمام .
يمكن استخدام هذا التحليل لتميز الشبكات أستروسيتيك لمنطقة معينة، وقارن الشبكات في مختلف المجالات المرتبطة بوظائف مختلفة، أو مقارنة الشبكات التي تم الحصول عليها تحت ظروف مختلفة التي لها تأثيرات مختلفة على اقتران. قد تؤدي هذه الملاحظات إلى أهمية الاعتبارات الفنية. على سبيل المثال، نحن نحلل شبكات نواة تريجمينل، حيث أننا أظهرنا سابقا أن اقتران أستروسيتيك ضروري للخلايا العصبية قادرة على تحويل أنماطها إطلاق النار من منشط ل انفجار إيقاعي1أستروسيتيك. عن طريق قياس حجم والحبس، والميول تفضيلية لشبكات أستروسيتيك في هذه النواة، يمكننا أن نبني فرضيات حول المجالات الوظيفية التي كانت تقيد. العديد من الدراسات تشير إلى أن عدة مناطق الدماغ الأخرى، منها اللحاء البرميل والزيتون متفوقة الأفقي، glomeruli حاسة الشم، والنوى الحسية في المهاد والقشرة البصرية، على سبيل المثال، قد تستفيد من تحليل مماثل.
Introduction
وقد وصف العديد من الدراسات كيف يمكن أن يكون الحوار أستروسيتي العصبية على مستوى الخلوي الفرعي أو متشابك الآثار في وظائف الخلايا العصبية وانتقال متشابك. ومن الثابت أن astrocytes حساسة إلى المحيطة بنشاط الخلايا العصبية؛ وفي الواقع، لديهم مستقبلات للعديد من أجهزة الإرسال العصبية بما في ذلك غلوتامات غابا، أستيل و ATP (انظر ملاحظات نشرت سابقا2،،من34). وفي المقابل، أستروسيتيك عمليات انشياث متشابك العناصر وتأثير نشاط الخلايا العصبية هناك وفي مواقع اكستراسينابتيك بتنظيم التوازن الأيونية خارج الخلية والإفراج عن عدة عوامل أو أجهزة الإرسال مثل الجلوتامات ود-سيرين ATP 5 , 6 , 7.
برزت فكرة أن أستروسيتيس يمكن أن تعدل أيضا وظيفة الخلايا العصبية على مستوى الشبكة، بدليل أن اقتران أستروسيتيك مكانياً وينظم ويناظر تقسيم الخلايا العصبية في المناطق التي تتسم تشريحي واضح تجزئة (مثل المناطق مع تمثيلات حسية)، مما يشير إلى أن أستروسيتيس سوف زوجين إلى astrocytes أخرى تخدم نفس الوظيفة وليس فقط تلك التي قريبة من. في الزيتون متفوقة الأفقي، على سبيل المثال، شبكات الأكثر أستروسيتيك تتجه أورثوجونالي إلى محور تونوتوبيك8، بينما في البرميل اللحاء أو أولفاكتوتي جلوميرولي، الاتصال بين astrocytes أقوى بكثير داخل براميل أو جلوميرولي والأضعف بين المجاورة منها9،10. وفي كلتا الحالتين، الشبكات أستروسيتيك تتجه نحو مركز9،جلوميرولي أو البرميل10.
ونحن مؤخرا أظهرت أن ينظم نشاط أستروسيتيك إطلاق الخلايا العصبية بتقليل تركيز Ca خارج الخلية2 + ([Ca2 +]ﻫ)، يفترض من خلال الإفراج عن S100β، Ca2 +-ملزمة البروتين11. في هذا الصدد، الذي تجلى في عدد من الخلايا العصبية رهيثموجينيك تريجمينل في الجزء الظهرية الحسية الرئيسية تريجمينل نواة (نفسنبر، ويعتقد أن تلعب دوراً هاما في توليد حركات ماستيكاتوري)، ناتج عن كون أن إطلاق الإيقاعي في هذه الخلايا العصبية يعتمد على استمرار نا+ الحالي الذي يتعزز بنقصان [Ca2 +]ه11،12. يمكن آثار إطلاق الإيقاعي في هذه الخلايا العصبية "فسيولوجيا" بالحث على مدخلاتها أو نقصان اصطناعية من [Ca2 +]ه. ونحن كذلك أظهرت أن اقتران أستروسيتيك المطلوبة لإطلاق الإيقاعي العصبية1. وهذا يثير إمكانية أن شبكات أستروسيتيك يمكن أن تشكل مجالات وظيفية محددة حيث يمكن مزامنة نشاط الخلايا العصبية وتنسيقها. لتقييم هذه الفرضية، نحن بحاجة أولاً وضع طريقة لتوثيق دقيق تنظيم هذه الشبكات داخل نفسنبر.
وقد وصف الدراسات السابقة على شبكات أستروسيتيك معظمهم مدى اقتران من حيث عدد الخلايا والكثافة والمنطقة التي تغطيها. أجريت محاولات لتقييم شكل شبكات أستروسيتيك والاتجاه لصبغ-اقتران معظمها بمقارنة حجم الشبكات على محورين (س وص) في البرميل اللحاء9،، الحصين13،14 15، حقول باريلويد المهاد16و الزيتون متفوقة الجانبي8، glomeruli حاسة الشم10، واللحاء14. الأساليب الموصوفة هنا تمكين التهم غير منحازة للخلايا المسماة في شبكة وتقدير من المنطقة التي تغطيها. كما قمنا بتطوير أدوات لتحديد اتجاه المفضل لاقتران ضمن شبكة، وتقييم ما إذا كان المفضل والتوجه نحو مركز نواة أو في اتجاه مختلف. بالمقارنة مع الأساليب المستخدمة سابقا، يوفر هذا البروتوكول وسيلة لوصف المنظمة والتوجه لشبكات أستروسيتيك في هياكل مثل نواة الحسية الرئيسية تريجمينل الظهرية التي ليس لديها معروف تشريحية واضحة التقسيم. في الدراسات المذكورة أعلاه، توجه شبكة توصف بأنها على علاقة بشكل البنية نفسها التي تم توثيقها بالفعل (على سبيل المثال-، باريلويد في المهاد، برميل في القشرة، والطبقات في قرن آمون وقشرة، وجلوميرولي في لمبة شمي، إلخ.). وبالإضافة إلى ذلك، يسمح تحليل اتجاهي لإجراء مقارنات لاقتران التوجهات كشفت تحت ظروف مختلفة. لتحليل ما إذا كان تغيير هذه المعلمات وفقا لموضع شبكة الاتصال داخل النواة، وضعنا أيضا طريقة لاستبدال الشبكة كل إشارة إلى حدود النواة. هذه الأدوات يمكن تكييفها بسهولة إلى مناطق أخرى لشبكات الخلايا إلى جانب التحقيق.
Protocol
أقرت جامعة مونتريال رعاية الحيوان واستخدام اللجنة جميع الإجراءات والإقامة بقواعد "المعاهد الكندية للبحوث الصحية".
1-إعداد شرائح المخ الفئران
- تحضير 1 لتر للحل القائم على السكروز (الجدول 1) و 1 لتر من السائل الدماغي الشوكي قياسي الاصطناعي (قام) (الجدول 2).
- فقاعة الحل القائم على السكروز مع مزيج من 95% O2 و 5% أول أكسيد الكربون2 (كاربوجين) لمدة 30 دقيقة قبل وضعه في-80 درجة مئوية لمدة حوالي 30 دقيقة، حتى يصبح الحل الباردة ولكن ليست مجمدة تماما. استخدم هذا السكروز المثلج كقطع المخزن المؤقت لتشريح الدماغ. يبقيه على الجليد بمجرد إزالته من الثلاجة.
- فقاعة قام مع كاربوجين من خلال التجربة أكملها. استخدام هذا الحل لتخزين شريحة بيرفوسينج المخزن المؤقت الذي سيتم إجراء لقط التصحيح وملء بيوسيتين من أستروسيتيس. إعداد انتعاش شريحة عقد الدائرة بإيداع شرائح المخ بمجرد أن يتم قطع.
ملاحظة: يمكن أن تكون مصنوعة خصيصا الدائرة إجراء الاسترداد شريحة ويتكون أساسا من بئر واحدة صغيرة مع شبكة أسفل علقت في بئر أكبر مليء قام، الذي يتم إدراج أنبوب لجلب كاربوجين من الأسفل. - استخدام الفئران سبراغ داولي 15 إلى 21 يوما-عمرها دون أي تحيز لجنس أو سلالة معينة. تخدير الحيوان مع إيسوفلوراني (1 مل إيسوفلوراني في دائرة التعريفي لتخدير). تحقق من عمق التخدير بلطف معسر هند مخلب أو ذيل الحيوان.
- قطع رأس الفئران باستخدام مقصلة وقطع في الجمجمة مع مقص بسرعة إزالة الدماغ من الجمجمة بملعقة مسطحة.
- تراجع الدماغ في الحل القائم على السكروز المثلج عن 30 ثانية ونقل أنه (مع الحل) إلى بيتري طبق. مع شفرة الحلاقة، وإزالة الأجزاء التي الأمامي والخلفي للمنطقة لتكون مقطوع، إذا قطع شرائح في الطائرة عرضية.
- الصق الكتلة المتبقية من أنسجة المخ على جانبها روسترال والشروع في قطع شرائح المخ (350 ميكرون سميكة) في الأجل المتوسط على أساس السكروز استخدام فيبرتوم. ثم قم بنقل الشرائح التي تم جمعها في انتعاش عقد غرفة مليئة قام كاربوجيناتيد في درجة حرارة الغرفة (RT) حتى أنهم على استعداد لاستخدام (السماح على الأقل 1 ساعة للاسترداد).
ملاحظة: تسمح التطورات الأخيرة في المجال حضانة طويلة تصل إلى 24 ساعة شرائح المخ في المختبر الشروط17.
2-سولفورهوداميني 101 (SR-101) وسم من أستروسيتيس
- قبل الحرارة حمام مائي إلى 34 درجة مئوية ووضع دائرتين احتضان شريحة فيه. ملء إحدى الدوائر احتضان شريحة مع حل الذي يحتوي على 1 ميكرومتر قام ريال-101، وملء أخرى فقط مع قام.
- احتضان الشرائح في قاعة الحضانة التي تتضمن ميكرومتر 1 ريال-101 20 دقيقة وثم نقل لهم في الحضانة الثانية الدائرة لغسل 101 ريال الزائد من الأنسجة. وليكن على احتضانها لمدة 20 دقيقة أو أكثر في 34 درجة مئوية، ثم تبقى الدائرة الحضانة التي تحتوي على الشرائح في الرايت حتى أنهم بحاجة18.
3-أستروسيتي الترقيع وسد بيوسيتين
- حدد شريحة ووضعه في دائرة تسجيل المجهر. لتصحيح أستروسيتيس، واستخدام الأقطاب الكهربائية مع مقاومة من 4-6MΩ عندما مملوءة بالتوصل إلى حل على أساس غلوكونات البوتاسيوم (انظر الجدول 3).
- تحت التوجيه البصرية واستخدام ميكرومانيبولاتور، مباشرة مسرى تسجيل نحو أستروسيتي ريال-101-المسمى كما هو مبين في الشكل 1. تجنب الخلايا الموجودة في سطح الشريحة نظراً لأنها من المرجح أن يكون معطوباً أو قد فقدت الاتصال بالخلايا المجاورة.
- لمنع تسرب بيوسيتين في الأنسجة، تقليل الضغط الإيجابي إضافة إلى ماصة التصحيح وتطبيقه إلا عندما تكون قريبة من أستروسيتي التي سوف تكون مصححة (0.1-0.4 مل في حقنه 1 مل).
- قبل الترقيع، ضبط الإزاحة الماصة وفي السعة. تصحيح لإمكانات تقاطع السائل، كأوامر الجهد صحيحة ودقيقة ذات الأهمية الحاسمة ل تجارب19.
- نقل ماصة إغلاق ما يكفي أستروسيتي لمراقبة الاكتئاب الناجم عن الضغط الإيجابي. ثم إزالة الضغط الإيجابي وبطء تطبيق بعض الضغوط السلبية. المشبك أستروسيتي إلى-70 mV عندما الختم يصل إلى 100 MΩ. انتظر حتى يصل إلى الختم GΩ 1-3. يستمر تطبيق الضغط السلبي حتى يكسر داخل الخلية. كن حذراً أثناء تطبيق الضغط السلبي، حيث astrocytes هشة جداً.
- تقييم الخصائص الكهربية للخلية مصححة. في وضع المشبك الجهد، تنفيذ بروتوكول كامل الخلية الحالية الفولت مع قيادة جهد منحدر لمدة 600 مللي ثانية تمتد من-120 إلى +110 أم. في الوضع الحالي-المشبك، تنفيذ بروتوكول خطوة الرابعة التي يتم حقن 1000 مللي ثانية الخطوات الحالية للسلطة الفلسطينية 100 من-1 إلى 1 غ، معدل أخذ العينات من تسجيلات كامل الخلية 10 كيلوهرتز.
ملاحظة: تظهر Astrocytes ملف تعريف الجهد الحالي خطي دون أي نوع من التصحيح (كما هو موضح في الشكل 1B) وإمكانات العمل لا يطلقون النار على غشاء ديبولاريزيشن (الشكل 1). ينبغي أن تكون إمكانات غشاء يستريح (خطة إدارة المبردات) مستقرة وإيجابية لا إلى-60mV. في بعض مناطق الدماغ، خطة إدارة المبردات أستروسيتيس هايبربولاريزيد أكثر مما في نفسنبر. - السماح بيوسيتين لنزع فتيل داخل أستروسيتي لمدة 30 دقيقة أثناء القيام بخطوة البروتوكول الرابع كل 5 دقائق.
- تتراجع وفصل ماصة التصحيح بدقة دون إلحاق الضرر astrocyte مصححة وفورا الإحاطة علما بإزاحة الماصة قبل إخراجها من دائرة التسجيل. طرح هذه القيمة من التسجيلات غشاء المحتملة.
- ترك شريحة الدماغ للراحة في غرفة تسجيل لحد أدنى من 15 دقيقة (بالإضافة إلى 30 دقيقة لحقن) للسماح بنشر للتتبع من astrocyte مصححة إلى شبكة الاتصال بأكملها من الخلايا المتباعدة.
ملاحظة: للكشف عن شبكة خلايا المتباعدة، ينبغي مصححة خلية واحدة فقط في نواة للفائدة. إذا كان عدة محاولات مطلوبة من أجل تحقيق تصحيحًا ناجحة، تجاهل القضية ومحاولة التصحيح على الجانب كونترالاتيرال أو في شريحة أخرى من الدماغ. - جعل علامة أو شق في الأنسجة لتحديد أي جانب من الشريحة تواجه صعودا، ونقل الشريحة الأولى إلى طبق بتري يحتوي على قام العادي، ثم في حل من 4% بارافورمالدهيد (منهاج عمل بيجين). احتضان الشريحة في 4 درجات مئوية بين عشية وضحاها.
تنبيه: منهاج عمل بيجين مضر جداً. استخدام المعدات الواقية في غطاء التهوية. التأكد من عدم الاتصال جميع المواد (فرش، والأنابيب، إلخ) التي كانت على اتصال مع منهاج عمل بيجين استرداد عقد الدائرة أو غرفة الحضانة أو غيرها من المواد المستخدمة لتسجيل الأنسجة الطازجة.
4-بيوسيتين الوحي
- الوحي مع ستريبتافيديني نيون
- غسل الدماغ شرائح 2 x 10 دقيقة في 0.1 متر العازلة الفوسفات سالين (PBS) في الرايت ثم، تكشف عن بيوسيتين بحضانة شرائح المخ مع ستريبتافيديني مترافق فلوروفوري في تمييع 1/200 في برنامج تلفزيوني مع المنظفات غير الأيونية 4% ح 4 في الرايت
- تغسل شرائح المخ 3 × 10 دقيقة في برنامج تلفزيوني م 0.1 في الرايت وتحميل المقاطع على الشرائح الزجاجية باستخدام وسيط مائي متصاعدة. وضع الجانبين التي تم ضخها صعودا، ساترة الشرائح، وختم لهم بمسمار الورنيش.
- الوحي مع الدأب
ملاحظة: يمكن استخدام الوحي الدأب (3,3-ديامينوبينزيديني) عندما يتعذر استخدام الفلورية. وفي هذه الحالة، يجب أن تستخدم الأسلوب الوحي واحد فقط لإجراء مقارنات.- أغسل شرائح المخ 3 × 10 دقيقة في برنامج تلفزيوني في الرايت احتضان الشرائح في برنامج تلفزيوني + ح2س2 0.5% لمدة ساعة واحدة في الرايت
- شطف شرائح 3 × 10 دقيقة في برنامج تلفزيوني في الرايت ثم احتضان الشرائح في حل عبدين-بيوتين المصبوغة معقدة تتألف من برنامج تلفزيوني والمنظفات غير الأيونية 0.1% + البيوتين عبدين البيروكسيديز معقدة القياسية المصبوغة طقم الكواشف في 1/100 لمدة 24 ساعة في الرايت
- شطف شرائح 3 × 10 دقيقة في برنامج تلفزيوني في الرايت، احتضان لهم في إيجاد حل لبرنامج تلفزيوني + الدأب 0.05% لمدة 20 دقيقة في RT، وتحويلها إلى إيجاد حل لبرنامج تلفزيوني + الدأب 0.05% + ح2س2 0.5%.
تنبيه: الدأب مضر جداً. استخدام المعدات الواقية في غطاء التهوية. أن رد الفعل اللون توقفت عندما يتم نقل الشرائح في برنامج تلفزيوني. - شطف شرائح 5 × 10 دقيقة في برنامج تلفزيوني في الرايت، تحميل المقاطع على الشرائح الزجاجية (تواجه الجانبين التي تم ضخها صعودا) والسماح لهم الجافة على شريحة تجفيف مقاعد البدلاء بين عشية وضحاها في 34 درجة مئوية.
- غمر الشرائح الزجاجية لمدة 1 دقيقة في عدة حمامات الكحول في 70%، 95%، و 100 في المائة، ونهاية بحمام من زيلين نفط لمدة 1 دقيقة.
- تحميل الشرائح الزجاجية باستخدام راتنج اصطناعية على أساس التولوين تصاعد المتوسطة. ضع كوفيرسليبس على الشرائح وختم لهم بمسمار الورنيش.
5-شبكة التصوير
- تصور الشبكات أستروسيتيك باستخدام مجهر [كنفوكل] مسح مجهزة 20 X و 4 X أهداف (أو هدفا مناسباً لتصور نواة كاملة حيث يقع الشبكة) وليزر للكشف عن فلوروفوري (في هذه الحالة، أليكسا-594 من المستخدمة).
- استخدم التكبير X 20 جعل z-كومة من شبكة الخلايا المسماة. استخدام دقة 800 × 800 بكسل وتفحص سرعة ميكروثانية 12.5/بكسل.
ملاحظة: مكدسات متعددة مطلوبة عادة للصور الشبكة بأكملها، وعدد المكدسات يحتاج إلى تعديل لكل شبكة. يمكن أن تتغير بسرعة القرار والمسح الضوئي، ولكن تأكد من استخدام نفس الإعدادات لكافة بيانات الصورة. - استخدم التكبير X 4 لالتقاط صور للشبكة والمنطقة من الفائدة.
ملاحظة: يتم استخدام 4 × التصوير لتحديد موضع شبكة الاتصال داخل النواة للفائدة. دائماً الصورة نفس الحقل في ضوء المنقولة. هذه الصورة ستكون مفيدة إذا كان لا يمكن تحديد حدود النواة في الصورة الفلورية [كنفوكل].
6. تحليل الصور
- إعداد البيانات
- استخدام برنامج إيماجيجفيجي (تحميل في https://fiji.sc/). فتح الملف وانقر فوق موافق في نافذة "خيارات استيراد تنسيقات الحيوية".
- لإعادة تعريف z-كومة التي سوف تحتوي على فقط الشرائح الضوئية اللازمة للنهائي z-المكدس (الشكل 2A)، انقر فوق مفتاح "المكدس" في شريط الأدوات (للبحث عن، حدد أولاً stk | المشروع Z). حدد "ماكس كثافة" في إعداد نوع الإسقاط (الشكل 2A). قم بحفظ الملف وتسميته "المكدس الملف".
- إذا كان الملف التصوير يحتوي على عدة قنوات، تقسيم للمحافظة فقط القناة بتصوير شبكة أستروسيتيك (الصورة | لون | تقسيم القنوات).
- تحقق من إعدادات بكسل من الصورة [صورة | خصائص | بكسل (مع "1" لإبعاد البيكسل)].
- استخدم أداة خلفية استقطاع (عملية | طرح الخلفية) لإزالة الخلفية لوضع العلامات بيوسيتين. استخدم الدالة المعاينة لتعيين نصف قطر الكرة المتداول، الذي يقع عادة في 50 بكسل (الشكل 2).
- استخدام أداة إزالة القيم المتطرفة (عملية | ضجيج | إزالة القيم المتطرفة) إذا كان ذلك مطلوباً بعد خطوة خلفية استقطاع. حدد "برايت" الإعداد "المتطرفة التي" (الشكل 2). استخدم الدالة المعاينة لتعيين نصف قطر والعتبة. كن حذراً مع هذه الأداة، حيث أنه قد طمس البيانات، كما هو موضح في الشكل 2D.
ملاحظة: هذه الأداة إزالة البقع الصغيرة الناجمة عن الودائع لأجل غير محدد من ستريبتافيديني (كما هو موضح بالأسهم البيضاء الموجودة في الشكل 2 (ب) و 2 (ج) قبل وبعد العلاج، على التوالي). - ضبط العتبة (صورة | ضبط | العتبة). حدد وضع "الافتراضي" و "B & W" (الشكل 2E). انقر فوق "تطبيق".
ملاحظة: ضبط تلقائي يمكن استخدامها، ولكن ضبط يدوي مع أشرطة التمرير اثنين المفضل. والهدف من هذه الخطوة للحد من الضوضاء إلى الحد الأقصى دون أن تفقد أي الخلايا المسماة. - تحويل الصورة إلى صورة ثنائية مع أداة عملية ثنائية (عملية | ثنائي | جعل ثنائي) كما هو مبين في الشكل 2 واو. قم بحفظ الملف كملف TIFF وتسميته "ملف ثنائي".
- عد الخلايا
- تحقق من إعداد وظيفة التدبير (تحليل | تعيين القياس). حدد الخيار "Centroid".
- استخدم أداة "تحليل الجزيئات" على "ملف ثنائي" (الشكل 3 أ) أنتجت في الخطوة السابقة (تحليل | تحليل الجسيمات) (الشكل 3 على اليسار). قم بتحديد "الخطوط العريضة" في الإعداد "إظهار" (الشكل 3). يقوم هذا بإنشاء ملف جديد التي تظهر نتيجة للكشف عن (الشكل 3B).
- اللعب مع المعلمات: حجم (للكشف عن الخلايا فقط، استخدم القيم بين 30 و 6000) والتدوير (لتحديد الفاصل زمني بين 0 إلى 1، أي "1" يحدد دائرة كاملة و "0" شكل عشوائي) لتحسين الكشف عن (الشكل 3، ترك جزء). تشغيل الكشف عن بواسطة النقر فوق "موافق".
ملاحظة: سوف تظهر جدولين في أعقاب الكشف عن: 1) جدول تحت عنوان "الملخص" الذي يوفر العدد الخلايا تم الكشف عنها، وجدول 2) عنوان "النتائج" (الشكل 3، الجزء الأيمن) يوفر إحداثيي س وص لكل خلية. - نسخ القيم ولصقها في تطبيق جدول بيانات. حفظ هذا الجدول تحت اسم "الجدول الكشف". سوف يظهر ملف بمؤامرة للكشف عن الخلايا أيضا (الشكل 3B). حفظ هذا الملف كملف TIFF تحت اسم "الكشف عن الملف".
- إذا تم الكشف عن مجموعة من الخلايا 2 أو أكثر من المسمى في الشبكة كخلية واحدة باستخدام أداة تحليل الجزيئات لأنها قريبة جداً من بعضها البعض، استخدم أداة مستجمعات المياه (عملية | ثنائي | مستجمعات المياه) على الصورة الثنائية قبل تطبيق تحليل الجزيئات أداة، وإعادة تحليل الجزيئات الخطوات.
ملاحظة: الأداة مستجمعات المياه بإنشاء تعيين حدود 1 بكسل واسعة بين الخلايا وثيقة للغاية. خلية عداد المكون إضافي يمكن أن تستخدم عند وضع العلامات لا لبس فيه، ويمكن أن تجري يدوياً.
- قياس المنطقة شبكة أستروسيتيك
- لقياس المساحة السطحية للشبكات، استخدم الملف الكشف باستخدام "صورة ج."
- استخدم أداة التحديد المضلع (اليسار انقر على الزر في شريط الأدوات لتحديده) لتتبع مضلع الذي يربط كافة الخلايا الموجودة في المحيط الخارجي للشبكة (الشكل 4 أ). غادر انقر لبدء تعقب المضلع، وفوق الحق في إغلاقه.
ملاحظة: سيتم تحديد هذا المضلع كمنطقة للفائدة (ROI) وسوف يقاس سطحه لتحديد المساحة السطحية للشبكة. - فتح نافذة تعيين القياس (تحليل | تعيين القياس) وحدد الخيار "المنطقة". فتح إدارة العائد على الاستثمار (تحليل | أدوات | مدير ROI) (الشكل 4 باء). ثم إضافة مضلع تتبع في إدارة العائد على الاستثمار بواسطة النقر فوق '' إضافة '' (الشكل 4 باء) وتشغيل القياس بواسطة النقر فوق '' تدبير '' في إدارة العائد على الاستثمار.
ملاحظة: سوف تظهر في جدول قياس المساحة ويعبر عنها بكسل. لا تنسى أن تحويل هذه القيمة مع معامل التحويل للمجهر المستخدمة للحصول على قيمة في ميكرو2.
- تصميم ناقلات التوجه الرئيسي
- تحديد الخلية مصححة
- افتح الملف المكدس في إيماجيجفيجي وتحديد الخلية مصححة في الملف مكدس استناداً إلى كثافة أقوى وضع العلامات (الشكل 4). ثم افتح الملف المسمى "الكشف عن الجدول" في تطبيق جدول بيانات والعثور على عدد المرتبطة بالخلية مصححة وإحداثياته المقابلة.
- إذا كان غير قادر على تحديد دقة الخلية مصححة، تحيط المنطقة حيث يتم إيداع بيوسيتين أكثر كثافة في شبكة المصورة من الخلايا المتباعدة، باستخدام أداة المضلع في إيماجيجفيجي، والإشارة إلى هذا الموقف للخلية مصححة (الشكل 4).
- استخدم إدارة العائد على الاستثمار (تحليل | أدوات | إدارة العائد على الاستثمار). ثم رسم عائد الاستثمار في موقع الخلية مصححة وإضافته إلى إدارة العائد على الاستثمار (انظر الشكل 4 باء).
- تعيين قياس (تحليل | تعيين القياس) وحدد الخيار "Centroid".
- في إدارة العائد على الاستثمار، انقر فوق "إجراء" للحصول على إحداثيات centroid لمنطقة تتبع. استخدام هذه الإحداثيات كنقطة مرجعية لهذه الشبكة المحددة.
- الترجمة المرجعي
- حساب إحداثيات كل خلية إشارة إلى astrocyte مصححة باستخدام الصيغة التالية:

مع: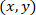 إحداثيات لخلية معينة؛
إحداثيات لخلية معينة؛ 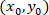 إحداثيات الخلية مصححة (أو نقطة مرجعية للشبكة)؛ و
إحداثيات الخلية مصححة (أو نقطة مرجعية للشبكة)؛ و 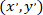 إحداثيات لخلية معينة في الجديد مرجعي.
إحداثيات لخلية معينة في الجديد مرجعي.
ملاحظة: الإعراب عن إحداثيات كل خلية إشارة إلى astrocyte مصححة خطوة هامة في حساب ناقلات من astrocyte مصححة. كن حذراً عند استخدام إيماجيجفيجي المرجعي لأي صورة الموجود في الزاوية العليا اليسرى من الصورة.
- حساب إحداثيات كل خلية إشارة إلى astrocyte مصححة باستخدام الصيغة التالية:
- تصميم الناقل الرئيسي للاتجاه التفضيلي
- حساب إحداثيات الموجه الرئيسي للميول تفضيلية مع الصيغة التالية:
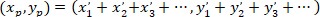
مع: (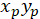 ) إحداثيات الموجه الرئيسي للميول تفضيلية؛ و
) إحداثيات الموجه الرئيسي للميول تفضيلية؛ و 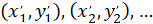 إحداثيات كل خلية من الشبكة التي تم الحصول عليها مع يرقع الخلية مرجعية.
إحداثيات كل خلية من الشبكة التي تم الحصول عليها مع يرقع الخلية مرجعية.
ملاحظة: لكل خلية في شبكة الاتصال، يتم تحديد ناقل بالنسبة إلى إحداثيات astrocyte مصححة. ناقلات الأمراض الرئيسية الميول تفضيلية للشبكة هو مجموع كافة هذه العوامل الناقلة للمرض. - تقسيم طول الموجه الرئيسي (المقدمة من الإحداثيات التي تم الحصول عليها من استخدام الصيغة أعلاه) بعدد الخلايا في الشبكة ناقص واحد (حيث لا يتم تضمين إحداثيات الخلية مصححة)، لتطبيع القيم وتمكين إجراء مقارنات بين الشبكات. ويرد في الشكل 5رؤية تخطيطية لهذا التحليل.
- حساب إحداثيات الموجه الرئيسي للميول تفضيلية مع الصيغة التالية:
- تحديد الخلية مصححة
- موضع تحليل الشبكات في نواة للفائدة
- المحاذاة من 20 X و 4 X الصور
- لتحديد موقف كل شبكة في نواة للفائدة (نفسنبر)، استخدم الصورة X 4. فتح الصورة X 4 باستخدام محرر صور متجهة.
- قم بتحديد الصورة X 4 وتعديل حجمها عن طريق ضرب من قبل 5. إطار البعد الموجود في الجزء الأيمن من شريط الأدوات الأفقي العلوي. على سبيل المثال، لصورة X 4 التي تم أخذ عينات في 800 × 800 بكسل، تغيير دقة أخذ العينات إلى 4000 x 4000 بكسل (لتعيين وحدة العامل في بكسل، انتقل إلى "إعداد الوثيقة" ضمن علامة التبويب ملف: ملف | إعداد الوثيقة). تصدير الملف في تنسيق TIFF واسم "حجمها 4 X".
- قم بمحاذاة الزاوية العلوية اليمنى من الصورة بالزاوية اليسرى السفلي من وثيقة Adobe Illustrator.
ملاحظة: البرنامج يوفر الإحداثيات من نقطة مرجعية في زاوية اليسرى السفلي. - فتح الصورة X 20 من الشبكة. استخدام '' ملف ثنائي '' أو '' الكشف عن ملف '' لأنها أسهل في محاذاة. ثم اللعب باستخدام أداة التعتيم على '' الملف الثنائي '' من الصورة X 20 لمواءمته مع إعادة الحجم 4 X الصورة.
ملاحظة: أداة التعتيم في شريط الأدوات الأفقي العلوي. - عندما يتم المحاذاة، حدد وابق ضاغطا على أداة الماصة حيث تظهر أداة القياس، وحدد ذلك في شريط الأدوات الأيسر.
- استخدام أداة القياس انقر فوق في الزاوية العلوية اليسرى من الصورة X 20 للحصول على إحداثيات 20 X المرجعي أشر إلى 4 حجمها X الصورة.
ملاحظة: هذه الإحداثيات التي يشار 20 X المرجعي (20XR في الشكل 5)، ستكون مفيدة للإعراب عن موقف كل شبكة تخطيطي الرسم من النواة.
- تطبيع نواة للفائدة
ملاحظة: لتلخيص البيانات، يتم استخدام تطبيع النواة (نفسنبر) كمستطيل. يتم وصف الخطوات أدناه.- فتح 4 X حجم الملف في إيماجيجفيجي، واستخدم أداة المضلع لتحيط النواة (نفسنبر). استخدام الصورة مع الضوء المنقولة إذا كانت حدود النواة غير قادرة على أن ينظر إليه؛ في هذه الحالة، تذكر أن تقوم بتغيير حجمه أولاً.
- فتح إدارة العائد على الاستثمار وإضافة دوروا عليه. في "تعيين القياس"، حدد الخيار '' "مستطيل إحاطة" ''.
ملاحظة: الخيار "مستطيل إحاطة" حساب أصغر مستطيل حول نواة مرسومة. - انقر فوق "إجراء".
ملاحظة: يظهر جدول مع BX و BY، إحداثيات الزاوية اليسرى العليا للمستطيل: '''' "المستطيل الموقف" ''، ويقدم العرض والارتفاع. BX و BY هي إحداثيات مستطيل إحاطة المرجعي هي يشار إليها باسم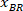 و
و 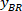 .
.
- التعبير عن كل موضع شبكة الاتصال في نواة طبيعية
- التعبير عن إحداثيات كل خلية مع 4 X المرجعي (مربع أسود في الشكل 5) باستخدام الصيغة التالية:

المكان: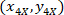 إحداثيات الخلية مع 4 X المرجعي؛
إحداثيات الخلية مع 4 X المرجعي؛ 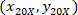 هي إحداثيات الخلية مع 20 X المرجعي (مربع برتقالي في الشكل 5)؛ و
هي إحداثيات الخلية مع 20 X المرجعي (مربع برتقالي في الشكل 5)؛ و 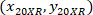 هي إحداثيات 20 × نقطة مرجعية في الصورة X 4 (20XR).
هي إحداثيات 20 × نقطة مرجعية في الصورة X 4 (20XR). - التعبير عن إحداثيات الخلية في مستطيل إحاطة المرجعي (الأزرق في الشكل 5) باستخدام الصيغة التالية:
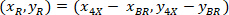
المكان: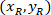 يتم تنسيق الخلية في مستطيل إحاطة المرجعي؛
يتم تنسيق الخلية في مستطيل إحاطة المرجعي؛ 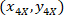 إحداثيات الخلية في 4 X المرجعي؛ و
إحداثيات الخلية في 4 X المرجعي؛ و  هي إحداثيات مستطيل إحاطة المرجعي في الصورة X 4.
هي إحداثيات مستطيل إحاطة المرجعي في الصورة X 4. - تحويل إحداثيات الخلية في مستطيل إحاطة المرجعي بالنسبة المئوية للعرض والارتفاع للمستطيل المحيط باستخدام الصيغة التالية:
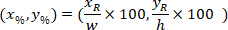
المكان: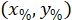 يتم تنسيق الخلية في النسبة المئوية للعرض والارتفاع للمستطيل المحيط؛
يتم تنسيق الخلية في النسبة المئوية للعرض والارتفاع للمستطيل المحيط؛ 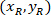 هي بتنسيق الخلية في مستطيل إحاطة المرجعي؛
هي بتنسيق الخلية في مستطيل إحاطة المرجعي؛  هو عرض مستطيل إحاطة تقاس أعلاه في البروتوكول؛ و
هو عرض مستطيل إحاطة تقاس أعلاه في البروتوكول؛ و 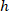 يتم قياس ارتفاع المستطيل إحاطة أعلاه في البروتوكول.
يتم قياس ارتفاع المستطيل إحاطة أعلاه في البروتوكول. - لتمثيل جميع الشبكات على نفس الرقم، تأخذ في الاعتبار اتجاه الشريحة (يسار أو يمين). لتوحيد البيانات، يتم تطبيق التكامل المرجعي على الجانب الأيسر من الشريحة. نقل إحداثيات الشبكة من الجانب الأيمن إلى الجانب الأيسر بتطبيق الصيغة التالية فقط لإحداثيات س:
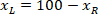
المكان: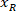 هو اﻻحداثي س على الجانب الأيسر من الشريحة؛ و
هو اﻻحداثي س على الجانب الأيسر من الشريحة؛ و 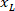 من جديد اﻻحداثي س المعرب عنها في التكامل المرجعي على الجانب الأيسر من الشريحة.
من جديد اﻻحداثي س المعرب عنها في التكامل المرجعي على الجانب الأيسر من الشريحة.
ملاحظة: بدلاً من ذلك، تعكس الصورة في إيماجيجفيجي قبل التحليل (صورة | تحويل | انعكاس أفقي). - للتعبير عن إحداثيات الموجه الرئيسي للاتجاه التفضيلي، اتبع نفس الخطوات مع إحداثيات الخلية (الخطوات 6.5.3.1 إلى 6.5.3.4).
ملاحظة: يتيح التعبير عن الإحداثيات في النسب المئوية تجميعاً للبيانات كقطعة واحدة فيها النواة (نفسنبر) تم تصميمه كمستطيل.
- التعبير عن إحداثيات كل خلية مع 4 X المرجعي (مربع أسود في الشكل 5) باستخدام الصيغة التالية:
- المحاذاة من 20 X و 4 X الصور
- دراسة عن الفرق الزاوي للموجة الرئيسي للاتجاه التفضيلي
ملاحظة: يتم استخدام الفرق الزاوي لشبكة أستروسيتيك لتحديد ما إذا كان توجهها التفضيلية نحو مركز نواة للفائدة. لحساب الفرق الزاوي (α في الشكل 5)، الذي هو الزاوية بين الموجه الرئيسي للاتجاه التفضيلي للشبكة (PD، أحمر الخط في الشكل 5) وخط الاتصال ف ج، تطبيق نظرية Al-كاشي في منطقة المثلث PDC (انظر اقحم الرقم 5 و الأساليب التكميلية).- أولاً، حساب أطوال مختلفة باستخدام تطبيق نظرية فيثاغورس في ديكارت التكامل المرجعي باستخدام المعادلة التالية:
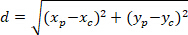
المكان: الإحداثيات ف وج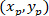 و
و  ، على التوالي، في مستطيل إحاطة المرجعي (المحسوبة أعلاه).
، على التوالي، في مستطيل إحاطة المرجعي (المحسوبة أعلاه). - تحديد الفرق الزاوي بالراديان استخدام الصيغة التالية:
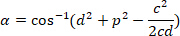
- تحويل الفرق الزاوي في درجات (مثلاً، مع دالة DEGREES في برنامج Excel).
- ترجمة جميع الخلافات الزاوي بالتآمر عليها في المخططات الشريطية الرأسية (الشكل 7 و 7 د) وتحديد ما إذا كان هناك اتجاه تفضيلي لشبكات أستروسيتيك.
- أولاً، حساب أطوال مختلفة باستخدام تطبيق نظرية فيثاغورس في ديكارت التكامل المرجعي باستخدام المعادلة التالية:
النتائج
اقتران بين الخلايا في الدماغ ليست ثابتة ولكن بدلاً من ذلك التنظيم بشكل حيوي بالعديد من العوامل. الأساليب المذكورة ووضعت لتحليل الشبكات أستروسيتيك كشف تحت ظروف مختلفة وفهم منظمتهم في نفسنبر. وكانت هذه النتائج الفعل المنشورة1. أجرينا بملء بيوسيتين أستروسيتيس...
Discussion
يوجد عدد من الطرق الكهربية لتقييم وظيفي اقتران بين أستروسيتيس،من2324. ومع ذلك، هذه الأساليب لا توفر معلومات حول ترتيب التشريحية لشبكات أستروسيتيك. عدد من الدراسات قد أثبتت أن "صبغ-أو الراسم-اقتران"، كما فعل هنا، لا يحدث إلا في جزء صغير من إلى جانب الخلايا التي...
Disclosures
الكتاب ليس لها علاقة بالكشف عن.
Acknowledgements
ويمول هذا العمل من "المعاهد الكندية للبحوث الصحية"، عدد المنح/جائزة: 14392.
Materials
| Name | Company | Catalog Number | Comments |
| NaCl | Fisher Chemicals | S671-3 | |
| KCl | Fisher Chemicals | P217-500 | |
| KH2PO4 | Fisher Chemicals | P285-500 | |
| MgSO4 | Fisher Chemicals | M65-500 | |
| NaHCO3 | Fisher Chemicals | S233-500 | |
| C6H12O6 Dextrose anhydrous | Fisher Chemicals | D16-500 | |
| CaCl2 dihydrated | Sigma | C70-500 | |
| Sucrose | Sigma | S9378 | |
| D-gluconic acid potassium salt | Sigma | G45001 | |
| MgCl2 anhydrous | Sigma | M8266 | |
| HEPES | Sigma | H3375 | |
| EGTA | Sigma | E4378 | |
| ATPTris Salt | Sigma | A9062 | |
| GTPTris Salt | Sigma | G9002 | |
| Biocytin | Sigma | B4261 | |
| Carbenoxolone disodium salt | Sigma | C4790 | |
| avidin-biotin complex : ABC kit | Vestor laboratories | PK-4000 | |
| Streptavidine-alexa 594 | Molecular Probes | S11227 | |
| Triton | Fisher Chemicals | BP151-500 | |
| Xylene | Fisher Chemicals | X5-1 | |
| Aqueous mounting medium 1 : Fluoromount-G | SouthernBiotech | 0100-01 | |
| Toluen-based synthetic resin mounting medium : Permount | Fisher Chemicals | SP15-100 | |
| Slide Drying Bench | Fisherbrand | 11-474-470 | |
| Vibratome | Leica | VT 1000S | |
| Microscope cover glass | Fisherbrand | 12-544A | |
| Microscope slide ColorFrost | Fisherbrand | 12-550-413 | |
| PFA | Fisherchemicals | 04042-500 | |
| Olympus FluoView FV 1000 Confocal microscope | Olympus | ||
| 40X water-immersion lens | Olympus | LUMPLFLN40XW | |
| 20X water-immersion lens | Olympus | XLUMPLFL20XW | |
| 4X water-immersion lens | Olympus | XLFLUOR4X/340 | |
| Micropipette puller | Sutter Instrument | P97 | |
| Micromanipulator | Sutter Instrument | MP 225 | |
| Camera CCD | Sony | CX-ST50 | |
| Black and white monitor | Sony | SSM-125 | |
| Digidata | Molecular devices | 1322A | |
| Patch Clamp amplifier | Axon instrument | Mulitclamp 700A | |
| Electrophysiology acquisition software | Molecular devices | pClamp 8 | |
| Electrophysiology analysis software | Molecular devices | Clampfit 8 | |
| Imaging analysis software | ImageJFIJI | Open source software. FIJI version including plug in package. | |
| Vector image editor | Adobe | Illustrator CS4 | |
| Spreadsheet application | Microsoft Office | Excel 2010 |
References
- Condamine, S., Lavoie, R., Verdier, D., Kolta, A. Functional rhythmogenic domains defined by astrocytic networks in the trigeminal main sensory nucleus. Glia. 66 (2), 311-326 (2018).
- Verkhratsky, A., Orkand, R. K., Kettenmann, H. Glial calcium: homeostasis and signaling function. Physiological Review. 78 (1), 99-141 (1998).
- Christensen, R. K., Petersen, A. V., Perrier, J. F. How do glial cells contribute to motor control?. Current Pharmaceutical Design. 19 (24), 4385-4399 (2013).
- Verkhratsky, A., Steinhauser, C. Ion channels in glial cells. Brain Research Review. 32 (2-3), 380-412 (2000).
- Harada, K., Kamiya, T., Tsuboi, T. Gliotransmitter Release from Astrocytes: Functional, Developmental, and Pathological Implications in the Brain. Frontiers Neuroscience. 9, 499 (2015).
- Montero, T. D., Orellana, J. A. Hemichannels: new pathways for gliotransmitter release. Neuroscience. 286, 45-59 (2015).
- Araque, A., et al. Gliotransmitters travel in time and space. Neuron. 81 (4), 728-739 (2014).
- Augustin, V., et al. Functional anisotropic panglial networks in the lateral superior olive. Glia. 64 (11), 1892-1911 (2016).
- Houades, V., Koulakoff, A., Ezan, P., Seif, I., Giaume, C. Gap junction-mediated astrocytic networks in the mouse barrel cortex. Journal of Neuroscience. 28 (20), 5207-5217 (2008).
- Roux, L., Benchenane, K., Rothstein, J. D., Bonvento, G., Giaume, C. Plasticity of astroglial networks in olfactory glomeruli. Proceedings of the National Academy of Science of the United State of America. 108 (45), 18442-18446 (2011).
- Morquette, P., et al. An astrocyte-dependent mechanism for neuronal rhythmogenesis. Nature Neuroscience. 18 (6), 844-854 (2015).
- Brocard, F., Verdier, D., Arsenault, I., Lund, J. P., Kolta, A. Emergence of intrinsic bursting in trigeminal sensory neurons parallels the acquisition of mastication in weanling rats. Journal of Neurophysiology. 96 (5), 2410-2424 (2006).
- Anders, S., et al. Spatial properties of astrocyte gap junction coupling in the rat hippocampus. Philosophical Transactions of the Royal Society of London. Series B, Biological Science. 369 (1654), (2014).
- Houades, V., et al. Shapes of astrocyte networks in the juvenile brain. Neuron Glia Biology. 2 (1), 3-14 (2006).
- Rouach, N., Koulakoff, A., Abudara, V., Willecke, K., Giaume, C. Astroglial metabolic networks sustain hippocampal synaptic transmission. Science. 322 (5907), 1551-1555 (2008).
- Claus, L., et al. Barreloid Borders and Neuronal Activity Shape Panglial Gap Junction-Coupled Networks in the Mouse Thalamus. Cerebral Cortex. 28 (1), 213-222 (2018).
- Cameron, M. A., et al. Prolonged Incubation of Acute Neuronal Tissue for Electrophysiology and Calcium-imaging. Journal of Visualized Experiments. (120), (2017).
- Kafitz, K. W., Meier, S. D., Stephan, J., Rose, C. R. Developmental profile and properties of sulforhodamine 101--Labeled glial cells in acute brain slices of rat hippocampus. Journal of Neuroscience Methods. 169 (1), 84-92 (2008).
- Neher, E. Correction for liquid junction potentials in patch clamp experiments. Methods in Enzymology. , 123-131 (1992).
- Giaume, C., Leybaert, L., Naus, C. C., Saez, J. C. Connexin and pannexin hemichannels in brain glial cells: properties, pharmacology, and roles. Frontiers in Pharmacology. 4, 88 (2013).
- Torres, A., et al. Extracellular Ca(2)(+) acts as a mediator of communication from neurons to glia. Science Signaling. 5 (208), ra8 (2012).
- Ye, Z. C., Wyeth, M. S., Baltan-Tekkok, S., Ransom, B. R. Functional hemichannels in astrocytes: a novel mechanism of glutamate release. Journal of Neuroscience. 23 (9), 3588-3596 (2003).
- Ma, B., et al. Gap junction coupling confers isopotentiality on astrocyte syncytium. Glia. 64 (2), 214-226 (2016).
- Meme, W., Vandecasteele, M., Giaume, C., Venance, L. Electrical coupling between hippocampal astrocytes in rat brain slices. Neuroscience Research. 63 (4), 236-243 (2009).
- Ransom, B. R., Kettenmann, H. Electrical coupling, without dye coupling, between mammalian astrocytes and oligodendrocytes in cell culture. Glia. 3 (4), 258-266 (1990).
- Audesirk, G., Audesirk, T., Bowsher, P. Variability and frequent failure of lucifer yellow to pass between two electrically coupled neurons in Lymnaea stagnalis. Journal of Neurobiology. 13 (4), 369-375 (1982).
- Ewadinger, N., Syed, N., Lukowiak, K., Bulloch, A. Differential Tracer Coupling between Pairs of Identified Neurones of the Mollusc Lymnaea Stagnalis. Journal of Experimental Biology. 192 (1), 291-297 (1994).
- Griemsmann, S., et al. Characterization of Panglial Gap Junction Networks in the Thalamus, Neocortex, and Hippocampus Reveals a Unique Population of Glial Cells. Cerebral Cortex. 25 (10), 3420-3433 (2015).
- Kuwajima, T., et al. ClearT: a detergent- and solvent-free clearing method for neuronal and non-neuronal tissue. Development. 140 (6), 1364-1368 (2013).
- Gourine, A. V., et al. Astrocytes control breathing through pH-dependent release of ATP. Science. 329 (5991), 571-575 (2010).
- Forsberg, D., Ringstedt, T., Herlenius, E. Astrocytes release prostaglandin E2 to modify respiratory network activity. eLife. 6, (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved