Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Анализируя размер, форму и направленность сетей спаренных астроциты
В этой статье
Резюме
Здесь мы представляем протокол для оценки Организации Астроцитарная сетей. Описан метод минимизирует смещения для предоставления описательного мер этих сетей таких клеток, размер, площадь и позиция в ядра. Анизотропия оценивается с векторного анализа.
Аннотация
Она становится все более очевидным, что астроциты модулировать нейрональных функции не только на уровне синаптических и одной ячейки, но и на сетевом уровне. Астроциты тесно связаны друг с другом через разрыв соединения, и соединение через эти соединения является динамичной и жестко регулируемых. Формирующейся концепции, что Астроцитарная функции являются специализированными и адаптированы к функции нейронов цепи, с которой они связаны. Таким образом методы измерения различных параметров Астроцитарная сетей необходимо лучше описать правила, регулирующие их связи и соединения и для более глубокого понимания их функций.
Здесь, используя программное обеспечение для анализа изображения (например., ImageJFIJI), мы описываем метод для анализа конфокальный изображения Астроцитарная сетей, обнаруженных краситель муфта. Эти методы позволяют 1) автоматизированных и беспристрастной выявления помеченных клеток, 2) расчет размера сети, 3) вычисления преференциальных ориентации красителя распространяется в сети и 4) репозиционирования сети в области интересов .
Этот анализ может использоваться для характеризуют Астроцитарная сетей в конкретной области, сравнить сетей разных областей, связанных с различными функциями или сравнить сетей, полученные при различных условиях, которые имеют различные эффекты на муфты. Эти наблюдения могут привести к важным функциональными соображениями. Например мы анализируем Астроцитарная сетей ядра тройничного нерва, где мы ранее показали, что Астроцитарная муфта имеет важное значение для способности нейронов для переключения схем их стрельбы от тоник художественной разрывной1. Путем измерять размер, родов и преференциальных ориентации Астроцитарная сетей в этом ядре, мы можем построить гипотезы о функциональных домены, которые они ограничивают. Некоторые исследования предполагают, что несколько других областях мозга, включая ствол мозга, боковые превосходное оливковое, обонятельные клубочков и сенсорные ядра таламуса и зрительной коры, чтобы назвать несколько, могут извлечь выгоду из аналогичный анализ.
Введение
Многие исследования были описаны как нейрон экзоцитоз диалог на уровне субклеточном или синаптических может иметь последствия в нейрональных функций и синаптической передачи. Хорошо известно, что астроциты чувствительны к окружающим нейронной активности; в самом деле они имеют рецепторы для многих нейромедиаторов, включая глутамата, ГАМК, ацетилхолин и СПС (см. ранее опубликованных отзывов2,,34). В свою очередь Астроцитарная процессы синаптической элементы ensheath и влияние нейронной активности там и на внесинаптического участках регулирующих внеклеточного ионного гомеостаза и освобождение нескольких факторов или приемник например глутамата, D-серина и СПС 5 , 6 , 7.
Возникла идея, что Астроциты также может модулировать нейрональных функции на уровне сети, с доказательства того, что Астроцитарная муфта пространственно регулируется и соответствует нейрональных сегментации в областях характеризуется ясно анатомические фрагментарность (как районы с сенсорными представлений), указывая, что астроциты будет пару других астроциты, обслуживающих те же функции, а не только те, которые находятся рядом с отелем. В боковых превосходное оливковое например, наиболее Астроцитарная сети ориентированы ортогонально к оси tonotopic8, тогда как в ствол мозга или olfactoty клубочков, связь между астроциты гораздо сильнее в бочках или клубочков и слабее между соседними те9,10. В обоих случаях Астроцитарная сети ориентированы на центр glomerule или ствол9,10.
Недавно мы показали, что Астроцитарная деятельность модулирует нейронов стрельбы путем снижения концентрации внеклеточного Ca2 + ([Ca2 +]e), предположительно путем выпуска S100β, Ca2 +-привязка белка11. Этот эффект, который был продемонстрирован в популяции нейронов тройничного нерва rhythmogenic в спинной части тройничного нерва основные сенсорные ядра (NVsnpr, думал играть важную роль в генерации жевательных движений), приводит к от факта что ритмичный огонь в этих нейронов, зависит от стойких Na+ текущий, способствует уменьшается [Ca2 +]e11,12. Ритмичный огонь в этих нейронов может вызвали «физиологически» путем стимуляции их вклада или искусственное снижение [Ca2 +]e. Мы показали также, что требуется для нейронов ритмичный огонь1Астроцитарная муфты. Это возникает возможность, что Астроцитарная сетей могут образовывать очерченную функциональные домены где нейронной активности могут быть синхронизированы и координации. Для оценки этой гипотезе, мы сначала необходимо разработать метод строго документ Организации этих сетей в пределах NVsnpr.
Предыдущие исследования в Астроцитарная сетях главным образом описал степень сцепления с точки зрения количества клеток и плотности и площадь. Попытки оценить форму Астроцитарная сетей и направление краситель муфта главным образом выполнялись путем сравнения размера сетей по двум осям (x и y) в ствол мозга9, гиппокамп13,14, 15, barreloid области таламуса16, боковые превосходное оливковое8, обонятельные клубочков10и коры14. Описанные здесь методы позволяют беспристрастной количество помеченных клеток в сети и оценки площади, которую они охватывают. Мы также разработали инструменты для определения предпочтительного ориентации сцепного устройства в сети и оценить, является ли предпочтительным ориентации к центру ядра или в другом направлении. По сравнению с ранее используемых методов этот протокол предоставляет средства для описания организации и ориентации Астроцитарная сетей в структурах как спинной тройничного нерва основные сенсорные ядра, которые не имеют известный ясно анатомические фрагментарность. В выше исследований, ориентации сети описан как отношения к форме сама структура, которая уже документально (например., barreloid в таламус, бочки в коре головного мозга, слои в гиппокампе и коры, клубочков в обонятельные луковицы и т.д.). Кроме того Векторный анализ позволяет для сравнения сцепления ориентаций показал в различных условиях. Чтобы проанализировать ли эти параметры изменены согласно позиции сети внутри ядро, мы также разработал метод для замены каждой сети, со ссылкой на границах ядра. Эти инструменты могут быть легко адаптирована в другие районы для расследования сетей спаренных клеток.
протокол
Все процедуры обитель правилами Канады институтов здравоохранения исследования и были утверждены Комитетом использования и ухода за животными Монреальского университета.
1. подготовка мозга крысы ломтиками
- Подготовка 1 решения на основе сахарозы (Таблица 1) и 1 Л стандартной искусственной мозговой спинномозговой жидкости (ФАГО) (Таблица 2).
- Пузырь решение на основе сахарозы с сочетанием 95% O2 и 5% CO2 (Карбоген) за 30 мин перед его размещением в-80 ° C около 30 мин, до тех пор, пока решение является холодная, но не полностью замороженные. Используйте этот ледяной сахарозы как передний буфер для нарезки мозга. Держите его на льду, как только он удаляется из морозильной камеры.
- Пузырь фаго с Карбоген через всего эксперимента. Используйте это решение для хранения фрагментов и как perfusing буфера, в котором будет выполняться патч зажима и biocytin заполнение астроциты. Подготовка восстановления срез, держа камеру на хранение срезы мозга, как только они вырезаны.
Примечание: Ломтик восстановления холдинг камеры может быть на заказ и по существу состоит из одной небольшой хорошо с сеткой внизу приостановлено в крупных хорошо, которая заполняется с фаго, в котором вводится трубка довести Карбоген снизу. - Используйте 15 - 21-дневного Sprague-Dawley крыс без какой-либо предвзятости конкретного пола или деформации. Анестезировать животное с изофлюрановая (1 мл изофлюрановая в камере индукции анестезии). Проверка глубины анестезии, осторожно сжимая задние лапы или хвост животного.
- Обезглавить крыс с помощью гильотины, сократить ее череп с ножницами и быстро удалить мозг из черепной коробки с плоской шпателем.
- Окуните мозга в ледяной решения на основе сахарозы для о 30 s и передачи его (раствором) Петри блюдо. С лезвием бритвы, удалить части, которые передней и задней в этот район для секционного, если резки ломтиками в поперечной плоскости.
- Приклейте оставшийся блок ткани мозга на его стороне Ростральных и приступить к вырезать мозг срезы (толщиной 350 мкм) в среде на основе сахарозы с помощью vibratome. Затем, передачи собранных фрагментов в холдинг камеры заполнены с carbogenated фаго при комнатной температуре (RT), пока они не готовы использовать восстановления (позволяют по крайней мере 1 час для восстановления).
Примечание: Последние события в области позволяют длительное инкубации до 24 h срезов мозга в vitro условия17.
2. Sulforhodamine 101 (SR-101) маркировки астроциты
- Нагреть на водяной бане до 34 ° C и место два фрагмента инкубации камер в нем. Заполните одну из палат инкубации срез с раствором фаго, содержащие 1 мкм SR-101 и заполнить другие только с фаго.
- Инкубации срезов в зале инкубации, содержащие 1 мкм SR-101 20 мин и затем передачи их в инкубации второй камеры промыть избыток SR-101 из ткани. Пусть это Проинкубируйте втечение 20 мин или более при температуре 34 ° C, затем держать зале инкубации, содержащие фрагменты в РТ, до тех пор, пока они необходимы18.
3. экзоцитоз исправлений и наполнения Biocytin
- Выберите фрагмент и поместить его в записи камеры микроскопа. Патч астроциты, использовать электроды с сопротивлением 4-6MΩ когда заполнены раствором на основе калия глюконат (см. таблицу 3).
- Под руководством визуальные и с помощью микроманипулятор прямой записи электрода к SR-101-меченых экзоцитоз, как показано на рисунке 1. Избегайте клетки, расположенные на поверхности среза, так как они более правоподобны для того быть повреждены или потеряли соединения соседних клеток.
- Для предотвращения утечки biocytin в ткани, свести к минимуму положительным давлением, добавлен патч пипетки и применять его только тогда, когда это близко к экзоцитоз, которая будет исправлена (0,1-0,4 мл в шприцах по 1 мл).
- До исправления, отрегулируйте смещение пипетки и его емкости. Исправление для жидких Джанкшен потенциалов, как и точное напряжение команды имеют решающее значение для экспериментов19.
- Переместите пипетку достаточно близко к экзоцитоз наблюдать депрессии, вызванной положительным давлением. Затем удалите положительным давлением и медленно применить некоторые отрицательное давление. Зажим экзоцитоз до -70 mV при печати достигает 100 MΩ. Подождите, пока печать не достигнет 1-3 GΩ. Продолжать применять отрицательное давление до ломать в клетку. Будьте осторожны при применении отрицательное давление, поскольку астроциты являются очень хрупкими.
- Оцените электрофизиологических свойств пропатчен ячейки. В режиме напряжение зажим, выполняют с команды рамп напряжения продолжительностью 600 мс до 110 -120 вольт амперных протокол поклеточного МВ. В режиме ток зажим выполните шаг IV протокол, в котором инъекции 1000 мс текущий шаги 100 Па от -1 до 1 nA, частота выборки записей поклеточного – 10 кГц.
Примечание: Астроциты Показать профиль линейный ток напряжение без какой-либо ректификации (как показано на рисунке 1B) и без действий потенциал стрельбы при деполяризации мембраны (рис. 1 c). Мембранного потенциала покоя (РМП) должно быть стабильным и не положительный, к - 60mV. В некоторых областях мозга РМП астроциты более hyperpolarized, чем в NVsnpr. - Разрешить biocytin для распространения в пределах экзоцитоз 30 мин при выполнении шага IV протокола каждые 5 мин.
- Убрать и отсоединить патч пипеткой тщательно не повредив пропатчен экзоцитоз и немедленно принять к сведению смещение пипеткой прежде чем принимать его из записи камеры. Вычитание этого значения из потенциальных записей мембраны.
- Оставьте срез мозга отдохнуть в зале записи как минимум 15 мин (в дополнение к 30 мин для инъекций) разрешить распространение трассировщик от пропатчен экзоцитоз для всей сети спаренных клеток.
Примечание: Выявить сеть спаренных клеток, только одну ячейку следует заплата в ядре интерес. Несколько попыток, если они необходимы для того, чтобы достичь успешного патч отбросить дело и пытаться патч на контралатеральную сторону или в другой срез мозга. - Сделать Марк или разрез в ткани, чтобы определить, какая сторона фрагмента вверх и сначала передать срез чашку Петри, содержащие нормальные фаго, затем в раствор 4% параформальдегида (PFA). Инкубируйте срез на 4 ° C на ночь.
Предупреждение: PFA чрезвычайно вредно. Используйте защитное снаряжение в вентилированные капюшон. Убедитесь, что все материалы (щетки, трубки и т.д.), которые были в контакте с PFA не контакт восстановления, держа камеру, инкубации камеры или другие материалы, используемые для записи свежие ткани.
4. Biocytin откровения
- Откровение с флуоресцентной streptavidine
- Мыть мозга кусочки 2 x 10 мин в 0,1 М буфера фосфатный (PBS) на RT. Затем выявить biocytin, инкубации срезов мозга с streptavidine, конъюгированных с Флюорофор на 1/200 разрежения в PBS с 4% неионные моющее средство для 4 h на RT.
- Вымойте ломтики мозга 3 x 10 мин в 0,1 М PBS на RT и смонтировать разделы на стеклянных вставках, с использованием средних водный монтажа. Поместите стороны, которые вводили вверх, coverslip слайды и запечатать их лаком для ногтей.
- Откровение с DAB
Примечание: DAB (3,3-Диаминобензидин) Откровение может использоваться когда флуоресценции нельзя использовать. В этом случае только один откровение метод следует использовать для сравнения.- Вымойте, срезы мозга 3 x 10 мин в PBS на RT. инкубации срезов в PBS + H2O2 0,5% за 1 час на RT.
- Промыть ломтики 3 x 10 мин в PBS на RT. Затем инкубации срезов в авидин Биотин комплекс окрашивание раствора состоит из PBS и 0.1% неионные моющего средства + авидин Биотин комплекс пероксидазы стандартных окрашивание комплект реагентов в 1/100 за 24 часа на RT.
- Промыть ломтики 3 x 10 мин в PBS на RT, инкубировать их в растворе PBS DAB 0,05% на 20 мин в РТ и передавать их в раствор PBS + DAB 0,05% + H2O2 0,5%.
Предупреждение: DAB очень вредно. Используйте защитное снаряжение в вентилированные капюшон. Цвет реакция останавливается при ломтики передаются в PBS. - Промыть ломтики 5 x 10 мин в PBS на RT, смонтировать разделы на стеклянных вставках (сталкиваются стороны, которые вводили вверх) и дайте им высохнуть на слайде сушки скамейке ночь в 34 ° C.
- Опускайте стеклянных скольжениях за 1 мин в нескольких ванн алкоголя в 70%, 95% и 100% и в конце с ванной ксилол за 1 мин.
- Смонтируйте стекла слайды с помощью на основе толуола Синтетическая смолаа монтаж среднего. Место coverslips на слайдах и запечатать их лаком для ногтей.
5. сети обработки изображений
- Визуализация Астроцитарная сети, используя Сканирующий конфокальный микроскоп оснащен 20 X и 4 X цели (или соответствующие цели для визуализации всего ядра, где находится сеть) и лазер для обнаружения Флюорофор (в данном случае, Alexa-594- используется).
- Используйте 20 кратным увеличением для z стека сети помеченных клеток. Использование разрешения 800 x 800 пикселов и проверять скорость 12,5 μs/пиксель.
Примечание: Для того, чтобы изображение всей сети, обычно требуются несколько стеки, и количество ярусов должна быть скорректирована для каждой сети. Резолюции и сканирования скорость может меняться, но не забудьте использовать одинаковые параметры для всех данных изображения. - Использование 4-кратном принять изображения региона интерес и сети.
Примечание: 4 X изображений используется для определения сети позиция в ядра интерес. Всегда же поле в переданном свете изображения. Это изображение будет полезным, если вам не удается определить границы ядра в конфокальных флуоресцентного изображения.
6. анализ
- Подготовка данных
- Использовать программное обеспечение ImageJFIJI (скачать на https://fiji.sc/). Откройте файл и нажмите кнопку ОК в окне «Параметры импорта био-форматов».
- Чтобы переопределить z стека, который будет содержать только оптический фрагменты, необходимые для окончательного z стека (рисунок 2A), нажмите на ручку «Стек» в панели инструментов (для поиска, сначала выберите stk | Проект Z). Выберите «Макс интенсивности» в параметр типа проекции (рис. 2A). Сохраните файл и назовите его «стека файлов».
- Если изображения файл содержит несколько каналов, разделить его для сохранения только канал с Астроцитарная сети обработки изображений (Image | Цвет | Разделение каналов).
- Проверьте параметры пикселя изображения [изображение | Свойства | Пиксел (с «1» для измерения пиксель)].
- Используйте инструмент вычитание фона (процесс | Вычитание фона) чтобы удалить фон biocytin маркировки. Используйте функцию предварительного просмотра для задания радиусу качения шарика, который обычно устанавливается в 50 пикселей (рис. 2B).
- Используйте средство удаления нетипичные (процесс | Шум | Удаление останцы) если это требуется после шаг вычитание фона. Выберите «Яркий» в параметре «Который нетипичные» (рис. 2 c). Используйте функцию предварительного просмотра, чтобы задать радиус и порог. Будьте осторожны с этим инструментом, так как это может размыть данных, как показано на рисунке 2D.
Примечание: Этот инструмент удаляет небольшие пятна, вызванные неспецифических месторождения streptavidine (как показано на белые стрелки в Рисунок 2B и 2 C до и после лечения, соответственно). - Отрегулировать порог (изображение | Отрегулируйте | Порог). Выберите режим «По умолчанию» и «B & W» (Рисунок 2E). Нажмите «Применить».
Примечание: Auto регулировка может использоваться, но ручной регулировки с двух ползунков является предпочтительным. Этот шаг призван снизить уровень шума до максимального без потери каких-либо помечены клетки. - Преобразовать изображение в двоичный образ с помощью средства двоичного процесс (процесс | Двоичные | Сделать двоичные) как показано на рисунке 2F. Сохраните файл как TIFF-файл и назовите его «двоичный файл».
- Подсчет клеток
- Проверьте настройку функции мера (анализ | Задать измерение). Выберите параметр «Центр тяжести».
- Используйте средство «Анализ частиц» на «двоичный файл» (рис. 3A) производится на предыдущем шаге (анализ | Анализ частиц) (рис. 3 c слева). Выберите «Контуры» в параметре «Шоу» (рис. 3 c). Это создает новый файл, показывающий результат обнаружения (рис. 3B).
- Играть с параметрами: размер (для обнаружения только клетки, использовать значения между 30 и 6000) и округлость (чтобы определить интервал между 0 до 1, в котором «1» определяет идеальный круг и «0» случайный фигуру) для уточнения обнаружения (рис. 3 c, оставил часть). Запуск обнаружения, нажав «ОК».
Примечание: Две таблицы будут отображаться после обнаружения: 1) таблицу под названием «Резюме», предоставляющий количество обнаруженных клеток и 2) таблицу под названием «Результаты» (рис. 3 c, правая часть), обеспечивает x - и y координаты каждой ячейки. - Скопируйте значения и вставьте их в приложении электронной таблицы. Сохраните эту таблицу под именем «обнаружение столом». Файл с участком обнаруженных клетки также появятся (рис. 3B). Сохраните этот файл как TIFF-файл под именем «файл обнаружения».
- Если группы 2 или более Приклеенные этикетку клеток в сети определяются как одну ячейку с инструментом анализа частиц, потому что они слишком близко друг к другу, используйте средство водораздел (процесс | Двоичные | Водораздел) на двоичное изображение до применения анализ частиц инструмент и повторить шаги анализ частиц.
Примечание: Средство водораздел создает делимитации 1 пиксель между чрезвычайно тесные клетки. Клетки счетчик плагин может использоваться при маркировке однозначен и может проводиться вручную.
- Измерение Астроцитарная сети
- Чтобы измерить площадь поверхности сетей, используйте файл обнаружения с помощью изображения Дж.
- Используйте средство выбора полигона (щелкните левой кнопкой мыши на кнопку на панели инструментов, чтобы выбрать его) для трассировки, многоугольник, который соединяет все клетки расположен на внешней периферии сети (рис. 4A). Щелкните левой кнопкой мыши, чтобы начать отслеживание полигона и щелкните правой кнопкой мыши, чтобы закрыть его.
Примечание: Этот полигон будет определяться как региона интерес (ROI) и его поверхность будет оцениваться для определения площади поверхности сети. - Открыть окно набора измерений (анализ | Задать измерения) и выберите параметр «Область». Откройте диспетчер ROI (анализ | Инструменты | Диспетчер ROI) (рис. 4В). Затем добавьте проследить полигона в менеджере ROI, нажав кнопку '' Добавить '' (рис. 4B) и запустите измерения, нажав кнопку '' мера '' в менеджере ROI.
Примечание: Измерение площади появятся в таблице и выражается в пикселях. Не забывайте преобразовать это значение с помощью коэффициента конверсии для микроскопа, используется для получения значения в мкм2.
- Определение основных направление вектора
- Определение пропатчен ячейки
- Откройте файл стека в ImageJFIJI и определения исправленной ячейки в файле стек, основанный на его сильнее маркировки интенсивности (рис. 4 c). Затем откройте файл с именем «таблица обнаружения» в приложении электронной таблицы и найти номер исправленной ячейки и ее соответствующих координат.
- Если удалось точно определить пропатчен ячейки, окружить в районе, где депозит biocytin плотнее образа сети спаренных клеток, используя инструмент «Многоугольник» в ImageJFIJI, и относятся к этой позиции, что и пропатчен клеток (рис. 4 d).
- Используйте менеджер ROI (анализ | Инструменты | Менеджер по ROI). Затем, нарисуйте ROI на пропатчен сотой и добавить его к диспетчеру ROI (см. рис. 4B).
- Задать измерения (анализ | Задать измерения) и выберите параметр «Центр тяжести».
- В менеджере ROI, нажмите на «Мера» для получения координаты центра тяжести области трассировки. Эти координаты можно используйте в качестве точки отсчета для этой конкретной сети.
- Ссылочная перевод
- Вычислите координаты каждой ячейки со ссылкой на пропатчен экзоцитоз, используя следующую формулу:

С: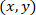 как координаты для заданной ячейки;
как координаты для заданной ячейки; 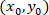 как координаты пропатчен ячейки (или ссылочной точка сети); и
как координаты пропатчен ячейки (или ссылочной точка сети); и 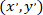 как координаты для заданной ячейки в новой ссылочной.
как координаты для заданной ячейки в новой ссылочной.
Примечание: Выражая координаты каждой ячейки со ссылкой на пропатчен экзоцитоз является важным шагом в расчете векторов с исправленными экзоцитоз. Будьте осторожны при использовании ImageJFIJI что ссылочной для любого изображения расположен в верхнем левом углу изображения.
- Вычислите координаты каждой ячейки со ссылкой на пропатчен экзоцитоз, используя следующую формулу:
- Определение основных вектора преференциальных ориентации
- Вычислите координаты вектора главных преференциальных ориентации с использованием следующей формулы:
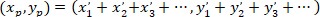
С: (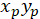 ) как координаты вектора главных преференциальных ориентации; и
) как координаты вектора главных преференциальных ориентации; и 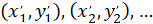 как координаты каждой ячейки сети, полученные с исправленной ячейки как ссылочная.
как координаты каждой ячейки сети, полученные с исправленной ячейки как ссылочная.
Примечание: Для каждой ячейки в сети, вектор определяется относительно координат пропатчен экзоцитоз. Главный вектор преференциальных ориентации сети является суммой всех этих векторов. - Разделите длину основных вектора (предоставляемые координаты, полученные от использования указанной выше формулы) на количество клеток в сети минус один (поскольку координаты пропатчен ячейки не включены в стоимость номера), чтобы нормализовать значения и позволяют сравнивать сетей. Схематическое представление этого анализа представлена на рисунке 5.
- Вычислите координаты вектора главных преференциальных ориентации с использованием следующей формулы:
- Определение пропатчен ячейки
- Размещение анализируемого сетей в ядре интерес
- Выравнивание 20 X и 4 X изображений
- Чтобы определить положение каждой сети в ядре интерес (NVsnpr), используйте 4 X изображения. Откройте 4 X изображение с векторный редактор изображений.
- Выберите 4 X изображение и изменить ее размер, умножив его на 5. Окно измерения расположен в правой части верхней горизонтальной панели инструментов. Например, 4 изображения X, были пробы на 800 x 800 пикселов, изменить разрешение проб до 4000 x 4000 пикселей (чтобы задать рабочую единицу в пикселях, перейдите к «Параметры документа» на вкладке файл: файл | Параметры документа). Экспортируйте файл в формате TIFF и имя его «размер 4 X».
- Совместите левый верхний угол изображения с нижнем левом углу документа Adobe Illustrator.
Примечание: Программное обеспечение предоставляет координаты из ссылочной точки левого нижнего угла. - Откройте 20 X изображение сети. Используйте '' двоичный файл '' или '' обнаружения файла '', потому что они легче согласовать. Затем, играть с помощью непрозрачности инструмента на '' двоичного файла '' 20 X изображение, чтобы привести его в соответствие с повторно размером 4 X изображения.
Примечание: Непрозрачность инструмент находится в верхней горизонтальной панели инструментов. - Когда выравнивание, выберите и удерживайте инструмент «Пипетка», так появится инструмент «Линейка» и выберите его в левой панели.
- Используйте инструмент «Линейка» щелкните в левом верхнем углу 20 X изображения для получения координат 20 X ссылочной указывают на изменения размеров 4 X изображения.
Примечание: Эти координаты, которые называются 20 X ссылочной (20XR на рис. 5), будет полезным для выражения позиции каждой сети на схема, чертеж ядра.
- Нормализация ядро интерес
Примечание: Для суммирования данных, используется нормализации ядра (NVsnpr) как прямоугольник. Шаги описаны ниже.- Откройте 4 X изменения размера файла в ImageJFIJI и используйте инструмент «Многоугольник» вокруг ядра (NVsnpr). Используйте изображения с пропускаемого света, если границы ядра не способны увидеть; в этом случае не забудьте сначала изменить его размер.
- Откройте диспетчер ROI и добавить Рисованные ROI. В «Задать измерение» выберите параметр '' ограничивающего прямоугольника ''.
Примечание: Параметр «Ограничивающий прямоугольник» вычисляет наименьший прямоугольник вокруг Рисованные ядра. - Нажмите кнопку «Мера».
Примечание: Таблица появляется с BX и BY, координаты верхнего левого угла прямоугольника: '' прямоугольник позиции '' и предоставляет высоту и ширину. BX и BY являются координаты ограничивающего прямоугольника ссылочной, которые называются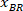 и
и 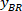 .
.
- Выражение позиции каждой сети в ядре нормализованных
- Экспресс координаты каждой ячейки с 4 X ссылочной (черный квадрат на рис. 5) с помощью следующей формулы:

Где: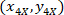 являются координаты ячейки с 4 X ссылочной;
являются координаты ячейки с 4 X ссылочной; 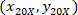 являются координаты ячейки с 20 X ссылочной (оранжевый квадрат на рис. 5); и
являются координаты ячейки с 20 X ссылочной (оранжевый квадрат на рис. 5); и 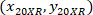 координаты 20 X ссылочной точка в изображении 4 X (20XR).
координаты 20 X ссылочной точка в изображении 4 X (20XR). - Экспресс координат ячейки в ограничивающий прямоугольник ссылочной (синий на рис. 5) с помощью следующей формулы:
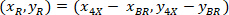
Где: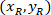 являются координаты ячейки в ограничивающий прямоугольник ссылочной;
являются координаты ячейки в ограничивающий прямоугольник ссылочной; 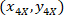 являются координаты ячейки в 4 X ссылочной; и
являются координаты ячейки в 4 X ссылочной; и  являются координаты ограничивающего прямоугольника ссылочной в 4 X изображения.
являются координаты ограничивающего прямоугольника ссылочной в 4 X изображения. - Преобразование координат ячейки в ограничивающий прямоугольник ссылочной процент ширина и высота ограничивающего прямоугольника, с использованием следующей формулы:
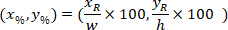
Где: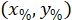 являются клетки координирует в процентах от ширины и высоты прямоугольника, ограничивающего;
являются клетки координирует в процентах от ширины и высоты прямоугольника, ограничивающего; 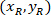 являются координаты ячейки в ограничивающий прямоугольник ссылочной;
являются координаты ячейки в ограничивающий прямоугольник ссылочной;  ширина ограничивающего прямоугольника, измеряется выше в протоколе; и
ширина ограничивающего прямоугольника, измеряется выше в протоколе; и 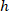 измеряется высота ограничивающего прямоугольника выше в протоколе.
измеряется высота ограничивающего прямоугольника выше в протоколе. - Для представления всех сетей на ту же цифру, учитывать ориентацию фрагмента (слева или справа). Для стандартизации данных, ссылочной применяется на левой стороне фрагмента. Передачи сетевых координат с правой стороны на левую сторону, применив следующую формулу только к x координаты:
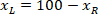
Где: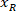 — это x координата на правой стороне фрагмента; и
— это x координата на правой стороне фрагмента; и 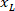 это новый x координата выражена в ссылочной на левой стороне фрагмента.
это новый x координата выражена в ссылочной на левой стороне фрагмента.
Примечание: в качестве альтернативы, зеркало изображение в ImageJFIJI до анализа (изображение | Трансформировать | Отразите горизонтально). - Чтобы выразить координаты вектора главных преференциальных ориентации, выполните те же действия с координатами ячейки (шаги 6.5.3.1 для 6.5.3.4).
Примечание: Выражение координат в процентах позволяет компиляцию данных как один сюжет, в котором ядро (NVsnpr) разработан как прямоугольник.
- Экспресс координаты каждой ячейки с 4 X ссылочной (черный квадрат на рис. 5) с помощью следующей формулы:
- Выравнивание 20 X и 4 X изображений
- Исследование угловых разности главный вектор преференциальных направления
Примечание: Угловой разница Астроцитарная сети используется для определения, является ли преференциальных ориентации к центру ядра интерес. Чтобы вычислить угловое разница (α на рис. 5), который является угол между основным вектором преференциальных направления сети (PD, красная линия на рис. 5) и линия, соединяющая P C, примените теорему ал-Каши в треугольник PDC (см. Вставка Дополнительных методови Рисунок 5 ).- Во-первых Вычислите разной длины, используя применение теоремы Пифагора в декартовой ссылочной, используя следующее уравнение:
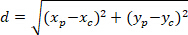
Где: координаты P и C являются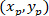 и
и  , соответственно, в ограничивающий прямоугольник ссылочной (рассчитанных выше).
, соответственно, в ограничивающий прямоугольник ссылочной (рассчитанных выше). - Определите угловое разницу в радианах, с использованием следующей формулы:
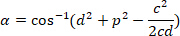
- Преобразование угловой разница в градусах (например, с функцией градусов в Excel программного обеспечения).
- Скомпилируйте все угловые различия путем построения их в вертикальной гистограммы (рис. 7 c и 7 D) и определить, если есть льготные ориентация Астроцитарная сетей.
- Во-первых Вычислите разной длины, используя применение теоремы Пифагора в декартовой ссылочной, используя следующее уравнение:
Результаты
Связь между клеток в головном мозге не статические, но скорее динамически регулируется многих факторов. Описанные методы были разработаны для анализа Астроцитарная сетей, показали в различных условиях и понять их организации в NVsnpr. Эти результаты были уже опубликова?...
Обсуждение
Существует целый ряд электрофизиологических методов для оценки функциональных сцепления между астроциты23,24. Однако эти методы не предоставляют информацию о механизме анатомические Астроцитарная сетей. В ряде исследований уже показали, что «краситель ...
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Эта работа финансируется Канадским институтов медицинских исследований, номер гранта /: 14392.
Материалы
| Name | Company | Catalog Number | Comments |
| NaCl | Fisher Chemicals | S671-3 | |
| KCl | Fisher Chemicals | P217-500 | |
| KH2PO4 | Fisher Chemicals | P285-500 | |
| MgSO4 | Fisher Chemicals | M65-500 | |
| NaHCO3 | Fisher Chemicals | S233-500 | |
| C6H12O6 Dextrose anhydrous | Fisher Chemicals | D16-500 | |
| CaCl2 dihydrated | Sigma | C70-500 | |
| Sucrose | Sigma | S9378 | |
| D-gluconic acid potassium salt | Sigma | G45001 | |
| MgCl2 anhydrous | Sigma | M8266 | |
| HEPES | Sigma | H3375 | |
| EGTA | Sigma | E4378 | |
| ATPTris Salt | Sigma | A9062 | |
| GTPTris Salt | Sigma | G9002 | |
| Biocytin | Sigma | B4261 | |
| Carbenoxolone disodium salt | Sigma | C4790 | |
| avidin-biotin complex : ABC kit | Vestor laboratories | PK-4000 | |
| Streptavidine-alexa 594 | Molecular Probes | S11227 | |
| Triton | Fisher Chemicals | BP151-500 | |
| Xylene | Fisher Chemicals | X5-1 | |
| Aqueous mounting medium 1 : Fluoromount-G | SouthernBiotech | 0100-01 | |
| Toluen-based synthetic resin mounting medium : Permount | Fisher Chemicals | SP15-100 | |
| Slide Drying Bench | Fisherbrand | 11-474-470 | |
| Vibratome | Leica | VT 1000S | |
| Microscope cover glass | Fisherbrand | 12-544A | |
| Microscope slide ColorFrost | Fisherbrand | 12-550-413 | |
| PFA | Fisherchemicals | 04042-500 | |
| Olympus FluoView FV 1000 Confocal microscope | Olympus | ||
| 40X water-immersion lens | Olympus | LUMPLFLN40XW | |
| 20X water-immersion lens | Olympus | XLUMPLFL20XW | |
| 4X water-immersion lens | Olympus | XLFLUOR4X/340 | |
| Micropipette puller | Sutter Instrument | P97 | |
| Micromanipulator | Sutter Instrument | MP 225 | |
| Camera CCD | Sony | CX-ST50 | |
| Black and white monitor | Sony | SSM-125 | |
| Digidata | Molecular devices | 1322A | |
| Patch Clamp amplifier | Axon instrument | Mulitclamp 700A | |
| Electrophysiology acquisition software | Molecular devices | pClamp 8 | |
| Electrophysiology analysis software | Molecular devices | Clampfit 8 | |
| Imaging analysis software | ImageJFIJI | Open source software. FIJI version including plug in package. | |
| Vector image editor | Adobe | Illustrator CS4 | |
| Spreadsheet application | Microsoft Office | Excel 2010 |
Ссылки
- Condamine, S., Lavoie, R., Verdier, D., Kolta, A. Functional rhythmogenic domains defined by astrocytic networks in the trigeminal main sensory nucleus. Glia. 66 (2), 311-326 (2018).
- Verkhratsky, A., Orkand, R. K., Kettenmann, H. Glial calcium: homeostasis and signaling function. Physiological Review. 78 (1), 99-141 (1998).
- Christensen, R. K., Petersen, A. V., Perrier, J. F. How do glial cells contribute to motor control?. Current Pharmaceutical Design. 19 (24), 4385-4399 (2013).
- Verkhratsky, A., Steinhauser, C. Ion channels in glial cells. Brain Research Review. 32 (2-3), 380-412 (2000).
- Harada, K., Kamiya, T., Tsuboi, T. Gliotransmitter Release from Astrocytes: Functional, Developmental, and Pathological Implications in the Brain. Frontiers Neuroscience. 9, 499 (2015).
- Montero, T. D., Orellana, J. A. Hemichannels: new pathways for gliotransmitter release. Neuroscience. 286, 45-59 (2015).
- Araque, A., et al. Gliotransmitters travel in time and space. Neuron. 81 (4), 728-739 (2014).
- Augustin, V., et al. Functional anisotropic panglial networks in the lateral superior olive. Glia. 64 (11), 1892-1911 (2016).
- Houades, V., Koulakoff, A., Ezan, P., Seif, I., Giaume, C. Gap junction-mediated astrocytic networks in the mouse barrel cortex. Journal of Neuroscience. 28 (20), 5207-5217 (2008).
- Roux, L., Benchenane, K., Rothstein, J. D., Bonvento, G., Giaume, C. Plasticity of astroglial networks in olfactory glomeruli. Proceedings of the National Academy of Science of the United State of America. 108 (45), 18442-18446 (2011).
- Morquette, P., et al. An astrocyte-dependent mechanism for neuronal rhythmogenesis. Nature Neuroscience. 18 (6), 844-854 (2015).
- Brocard, F., Verdier, D., Arsenault, I., Lund, J. P., Kolta, A. Emergence of intrinsic bursting in trigeminal sensory neurons parallels the acquisition of mastication in weanling rats. Journal of Neurophysiology. 96 (5), 2410-2424 (2006).
- Anders, S., et al. Spatial properties of astrocyte gap junction coupling in the rat hippocampus. Philosophical Transactions of the Royal Society of London. Series B, Biological Science. 369 (1654), (2014).
- Houades, V., et al. Shapes of astrocyte networks in the juvenile brain. Neuron Glia Biology. 2 (1), 3-14 (2006).
- Rouach, N., Koulakoff, A., Abudara, V., Willecke, K., Giaume, C. Astroglial metabolic networks sustain hippocampal synaptic transmission. Science. 322 (5907), 1551-1555 (2008).
- Claus, L., et al. Barreloid Borders and Neuronal Activity Shape Panglial Gap Junction-Coupled Networks in the Mouse Thalamus. Cerebral Cortex. 28 (1), 213-222 (2018).
- Cameron, M. A., et al. Prolonged Incubation of Acute Neuronal Tissue for Electrophysiology and Calcium-imaging. Journal of Visualized Experiments. (120), (2017).
- Kafitz, K. W., Meier, S. D., Stephan, J., Rose, C. R. Developmental profile and properties of sulforhodamine 101--Labeled glial cells in acute brain slices of rat hippocampus. Journal of Neuroscience Methods. 169 (1), 84-92 (2008).
- Neher, E. Correction for liquid junction potentials in patch clamp experiments. Methods in Enzymology. , 123-131 (1992).
- Giaume, C., Leybaert, L., Naus, C. C., Saez, J. C. Connexin and pannexin hemichannels in brain glial cells: properties, pharmacology, and roles. Frontiers in Pharmacology. 4, 88 (2013).
- Torres, A., et al. Extracellular Ca(2)(+) acts as a mediator of communication from neurons to glia. Science Signaling. 5 (208), ra8 (2012).
- Ye, Z. C., Wyeth, M. S., Baltan-Tekkok, S., Ransom, B. R. Functional hemichannels in astrocytes: a novel mechanism of glutamate release. Journal of Neuroscience. 23 (9), 3588-3596 (2003).
- Ma, B., et al. Gap junction coupling confers isopotentiality on astrocyte syncytium. Glia. 64 (2), 214-226 (2016).
- Meme, W., Vandecasteele, M., Giaume, C., Venance, L. Electrical coupling between hippocampal astrocytes in rat brain slices. Neuroscience Research. 63 (4), 236-243 (2009).
- Ransom, B. R., Kettenmann, H. Electrical coupling, without dye coupling, between mammalian astrocytes and oligodendrocytes in cell culture. Glia. 3 (4), 258-266 (1990).
- Audesirk, G., Audesirk, T., Bowsher, P. Variability and frequent failure of lucifer yellow to pass between two electrically coupled neurons in Lymnaea stagnalis. Journal of Neurobiology. 13 (4), 369-375 (1982).
- Ewadinger, N., Syed, N., Lukowiak, K., Bulloch, A. Differential Tracer Coupling between Pairs of Identified Neurones of the Mollusc Lymnaea Stagnalis. Journal of Experimental Biology. 192 (1), 291-297 (1994).
- Griemsmann, S., et al. Characterization of Panglial Gap Junction Networks in the Thalamus, Neocortex, and Hippocampus Reveals a Unique Population of Glial Cells. Cerebral Cortex. 25 (10), 3420-3433 (2015).
- Kuwajima, T., et al. ClearT: a detergent- and solvent-free clearing method for neuronal and non-neuronal tissue. Development. 140 (6), 1364-1368 (2013).
- Gourine, A. V., et al. Astrocytes control breathing through pH-dependent release of ATP. Science. 329 (5991), 571-575 (2010).
- Forsberg, D., Ringstedt, T., Herlenius, E. Astrocytes release prostaglandin E2 to modify respiratory network activity. eLife. 6, (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены