このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
サイズ、形状、および結合のアストロ サイトのネットワークの方向性を分析
要約
ここでアストロ サイトのネットワークの組織を評価するためのプロトコルを提案する.この方法では、細胞数、サイズ、領域、および核内の位置などのこれらのネットワークの記述対策を提供するためにバイアスを最小限に抑えます。異方性は、ベクトル解析と評価されます。
要約
アストロ サイトがシナプスおよび単一セルのレベルでだけでなく、ネットワーク レベルでも神経機能を調節することがますます明らかになった。アストロ サイトは、強く、ギャップ結合を介して互いに接続しているし、これらの接合点を介して結合はダイナミックで、厳しく規制されています。新興コンセプトはアストロ サイト機能を特化し、彼らが関連付けられている神経回路の機能に適応です。したがってより良いコミュニケーションを支配して、結合ルールを記述してその機能を理解するため、アストロ サイトのネットワークの様々 なパラメーターを測定する方法が必要です。
ここでは、画像解析ソフトを使用して (例えば.、ImageJFIJI)、色素結合によるアストロ サイトのネットワークの共焦点画像を分析する手法について述べる。これらのメソッドにより 1) 自動および公平な細胞の検出ラベル、2) 3) 色素ネットワーク内で拡散し、4) 対象地域内ネットワークの再配置の優先配向の計算ネットワークのサイズの計算.
この分析は、特定の領域のアストロ サイトのネットワークを特徴づける、さまざまな機能に関連するさまざまな分野のネットワークを比較または結合に対して異なる効果をさまざまな条件下で得られたネットワークを比較に使用できます。これらの観察は、重要な機能を考慮する可能性があります。例えば、どこ我々 は以前アストロ サイトのカップリングはニューロンのリズミカルな破裂1に強壮剤からの発火パターンを切り替える機能のために不可欠に、三叉神経核のアストロ サイトのネットワークを分析します。サイズ、閉じ込め、この核におけるアストロ サイトのネットワークの優先配向を測定することによってそれらを囲む機能ドメインについての仮説を構築できます。いくつかの研究は、いくつかの名前の視覚野と視床のバレル皮質、側方の優れたオリーブ、嗅糸球体、感覚核を含むいくつかの他の頭脳区域同様の分析から寄与するかもしれないことを提案します。
概要
多くの研究は、亜細胞やシナプス レベルでニューロン ・ グリア対話がシナプス伝達と神経機能への影響を持つことができますどのように説明しています。アストロ サイトが周囲の神経細胞の活動に敏感であることは周知します。実際には、グルタミン酸、GABA、アセチルコリン、ATP (以前公開されたレビュー2,3,4参照) を含む多くの神経伝達物質の受容体があります。その見返りに、アストロ サイト処理 ensheath シナプス要素と影響神経活動の両方あると櫛谷サイトで細胞外のイオンの恒常性を調節し、いくつかの要因やグルタミン酸、D-セリン、ATP などの送信機を解放して5,6,7。
アストロ サイトのカップリングは空間的に調整され、エリアが明確な解剖学的特徴の神経細胞の分割に対応する証拠と、アストロ サイトのネットワーク レベルで神経機能を調節することがまた考えが出現しました。(感覚的表現と地域) のような区画は、アストロ サイトが他のアストロ サイトの近くにあるものだけではなく、同じ機能を提供するカップルのことを示します。横の優れたオリーブの例えば、最もアストロ サイト ネットワークは、8, 純音に反応軸を直交指向バレル皮質または olfactoty の糸球体におけるアストロ サイトの間の通信はバレルまたは糸球体内で非常に強いに対し隣接するもの9,10間弱い。両方のケースでアストロ サイトのネットワーク、glomerule またはバレルの9,10の中心に向かって指向です。
我々 は最近、アストロ サイトの活性が細胞外 Ca2 +の濃度を減少させることによってニューロンの興奮を調節することを示した ([Ca2 +]e)、S100β、Ca2 +のリリースでおそらく-結合蛋白質11。という事実に起因する核 (NVsnpr、咀嚼運動の生成に重要な役割を果たすと考えられて)、三叉神経主感覚の背の部分で三叉神経プレベッツィンガー ニューロンの人口で示したこの効果をこれらのニューロンのリズミカルな発射は、永続的な Na+現在 [Ca2 +]e11,12の低下によって促進されてによって異なります。これらのニューロンにリズミカルな発射は、その入力の刺激または [Ca2 +]eの人工の減少によって「生理」誘発されることができます。アストロ サイトの結合するリズミカルなニューロン1必要がある示した。これはアストロ サイトのネットワークが神経活動を同期および調整できる限局性の機能ドメインを形成する可能性が発生します。この仮説を評価するために、我々 はまず厳格な NVsnpr 内のこれらのネットワークの組織を文書化する方法を開発する必要です。
アストロ サイトのネットワークに関する先行研究は主細胞数と密度と範囲の面で結合の程度を説明しています。バレル皮質9、海馬13,14,の 2 つの軸 (x と y) に沿ってネットワークのサイズを比較することでアストロ サイトのネットワークの形状と色素結合の方向を評価する試みを行った主15、視床16、外側優れたオリーブ8、嗅糸球体の10、および皮質14の barreloid フィールド。ここで説明する方法は、ネットワーク内のラベル付きセルの公平な数と覆っている面積の推定に有効にします。また、ネットワーク内の結合の結晶配向を定義し、配向は中心核のまたは別の方向に向かっているかどうかを評価するツールを開発しています。以前使用していた方法と比較すると、このプロトコルは組織と知られている明確な解剖学的を持たない背側三叉神経主知覚核のような構造でアストロ サイトのネットワークの向きを記述する手段を提供します。区画。上記の研究でネットワーク指向はすでに記載されて構造自体の形状に関係として記述されます (e.g、海馬と皮質の糸球体でレイヤーの視床、大脳皮質での樽で barreloid。嗅球など)。また、ベクトル解析は、異なる条件下で明らかに向きを結合の比較できます。核内ネットワークの位置によるとこれらのパラメーターが変更されたかどうかを分析するため、核の境界に関して各ネットワークを交換する方法を開発しました。これらのツールは、結合セルの調査ネットワークの他の領域に簡単に適応できます。
プロトコル
すべてのプロシージャは健康の研究のカナダの協会の規則によってすみかし、モントリオール大学のアニマル ・ ケアおよび使用委員会によって承認されました。
1. ラット脳スライスの準備
- ショ糖ベースのソリューション (表 1) の 1 L と 1 L 標準人工脳脊髄液 (アプライド) (表 2) を準備します。
- バブル 95% O2と 5% CO2 (カーボゲン ・) 30 分間のミックスとショ糖・ ベースのソリューションのソリューションが寒いが、ない完全冷凍するまで約 30 分間-80 ° C でそれを配置する前に。脳のスライスに切断バッファーとしてこの冷たいショ糖を使用します。アイス冷凍庫から取除かれればそれを続けます。
- カーボゲン ・全体の実験を通して、アプライドをバブルします。スライス ストレージとパッチ クランプとアストロ サイトの biocytin 充填が実行されます perfusing のバッファーとしては、このソリューションを使用します。保持室カットされますすぐと脳スライスの預金をスライス回復を準備します。
メモ: スライス回復保持チャンバー カスタムメイドできるし、底からカーボゲン ・を引き出すにチューブが挿入されるアプライドで満ちている大きいよく中断下部にメッシュの 1 つの小さな井戸から本質的に成っています。 - セックスやひずみに固有の任意のバイアスなし 15-21 日齢ラットを使用します。イソフルラン (イソフルラン麻酔の部屋に誘導の 1 mL) を持つ動物を麻酔します。後肢や動物の尾を軽くつまんで麻酔の深さを確認します。
- ギロチンを使用してラットの首をはねる、その頭蓋骨をはさみでカット、すばやく平らなヘラで頭蓋から脳を削除します。
- ペトリネット (ソリューション) とそれが皿 30 s と転送のために冷たいショ糖・ ベースのソリューションでは、脳を浸しなさい。かみそりの刃で切断する領域に前部と後部にある部分を削除切断スライス横断面内のかどうか。
- 吻側側脳組織の残りのブロックを接着し、vibratome を使用してショ糖ベースの中型の脳のスライス (350 μ m 厚) をカットに進みます。その後、使用する準備ができるまで、常温 (RT) carbogenated アプライドで満ちていた区域を保持している回復で収集したスライスを転送 (回復のために少なくとも 1 時間できるように)。
注: 分野の最近の進歩により長期培養まで体外で脳スライスの 24 h 条件17。
2. Sulforhodamine 101 (SR 101) アストロ サイトのラベル
- 予熱して 34 ° c の水浴し、2 つのスライス培養室を配置します。アプライド 1 μ M を含む溶液でスライス培養室の 1 つを埋める SR-101、アプライドでのみ、その他を記入しています。
- 1 μ M を含む培養室でスライスをインキュベート 20 分、転送します 2 番目の潜伏には組織から余分な SR 101 洗浄する商工会議所の SR 101。20 分間インキュベートせてまたは 34 ° C 以上までは RT でスライスを含む培養室を見続ける必要18。
3. アストロ サイトのパッチと Biocytin 充填
- スライスを選択し、顕微鏡の記録室に配置します。4 6MΩ カリウム グルコン酸ベースの溶液で満たされたときの抵抗で電極を使用して、アストロ サイトにパッチを適用する (表 3参照)。
- [視覚的なガイダンスとマニュピュレーターを使用して、図 1に示すように、SR 101 ラベルのアストロに向かって記録電極を直接します。破損したり、隣接セルへの接続を失っている可能性が高いので、スライスの表面にある細胞を避けてください。
- 組織における biocytin の漏れを防止する追加パッチ ピペットに肯定的な圧力を最小限に抑えるため、パッチがアストロ サイトの近くにある場合にのみ適用 (0.1 0.4 mL を 1 mL の注射器で)。
- パッチ前にピペットとその容量のオフセットを調整します。正確かつ正確な電圧コマンドいる実験19に重要な液体の接合電位の修正します。
- ピペット近くに十分な肯定的な圧力によって引き起こされる不況を観察するアストロ サイトに移動します。肯定的な圧力を削除し、ゆっくりといくつかの否定的な圧力を適用します。-70 にアストロ サイトをクランプ シール 100 MΩ に達するとの mV。シール 1 3 GΩ に達するまで待機します。引き続きセル分割まで否定的な圧力を適用します。アストロ サイトが非常に壊れやすいので否定的な圧力を適用するときに、注意をします。
- パッチを適用したセルの電気生理学的特性を評価します。電圧クランプ モードで実行 110-120 に至る持続時間 600 ms のランプ電圧コマンドで全細胞の電流-電圧プロトコル mV。電流クランプ モードで 1000 ms 現在 100 pa-1 からにステップ 1 nA、全体セルの録音サンプリング レートの注入、10 kHz ステップ IV プロトコルを実行します。
注: アストロ サイトは整流 (図 1 bに示すように) の任意の種類と膜脱分極 (図 1) の時に発火しない活動電位なし線形電流-電圧プロファイルを表示します。静止膜電位 (RMP) は、安定しており、60mV にポジティブではないにする必要があります。いくつかの脳領域でアストロ サイトの RMP は、NVsnpr でよりもより偏です。 - ステップ IV プロトコル 5 分ごとを実行しながら 30 分のアストロ サイトに拡散する biocytin を許可します。
- 撤回しパッチのアストロ サイトを損なうことがなく慎重にパッチ ピペットを外し、すぐに録音室から取る前にピペットのオフセットを注意します。膜の潜在的な録音からその値を減算します。
- 結合セルの全体のネットワークにパッチを適用したアストロ サイトからトレーサーの拡散を許可する (注射用 30 分) に加えて 15 分の最小値に記録室の中に脳のスライスを残してください。
注: 結合セルのネットワークを明らかにするには、単一セルについてのみは興味の核でパッチする必要があります。複数回の試行が成功したパッチを達成するために必要な場合ケースを破棄、側または別の脳スライス内にパッチを適用しようとします。 - マークや切開にスライスのどちら側が上向きを識別するために組織し 4% パラホルムアルデヒド (PFA) の溶液に、通常アプライドを含むシャーレにまずスライスを転送します。4 ° C でスライスを一晩インキュベートします。
注意: PFA は極めて有害であります。換気フードで保護具を使用します。PFA に接触されているすべての素材 (ブラシ、チューブ等) 連絡、回復室、培養室、または他の材料を新鮮な組織を記録するために使用を保持しているを確認します。
4. Biocytin 黙示録
- 蛍光 streptavidine と啓示
- 脳の洗浄が 0.1 M リン酸バッファー生理食塩水 (PBS) 室温で 2 x 10 分をスライスします。その後、室温 4 時間 4% 非イオン性洗剤で PBS で 1/200 希釈 fluorophore に活用される streptavidine と脳スライスをインキュベートし、biocytin を明らかにします。
- RT で 0.1 M PBS で脳スライス 3 x 10 分を洗って水土台媒体を使用してスライド ガラスのセクションをマウントします。スライド、上向き、coverslip で注入された側面を置き、爪ニスとそれらを封印します。
- 軽打と啓示
注: 蛍光を使用できない場合は、軽打 (3, 3-ジアミノベンジジン) 啓示を使用できます。この場合、比較を行うためのみ 1 つの啓示方法を採用する必要があります。- 脳スライスした PBS の 3 × 10 分間インキュベート PBS + H でスライス2O2 0.5% 室温 1 時間洗浄
- 室温 PBS の 3 × 10 分のスライスをすすいでください。その後、室温 24 時間 PBS と 0.1% 非イオン性洗剤 + アビジン-ビオチン複合ペルオキシダーゼ標準染色キット試薬の 1/100 から成るアビジン-ビオチン複合染色ソリューションでスライスをインキュベートします。
- RT で PBS でスライスの 3 × 10 分をすすぎ、PBS のソリューションにそれらをインキュベート + 常温では、20 分の 0.05% を軽くたたくと PBS のソリューションにそれらを転送 + 0.05% + H2O2 0.5% を軽くたたきます。
注意: DAB は極めて有害であります。換気フードで保護具を使用します。スライスが PBS で転送されるとき、呈色反応は停止します。 - RT で PBS でスライス 5 x 10 分を洗い流し、(上向きに注入された側面の顔) スライド ガラスのセクションをマウント スライド 34 ° C で一晩ベンチを乾燥乾燥させますと
- 1 分のキシレンの風呂で 70%、95%、100% と最後にいくつかのアルコール風呂に 1 分のスライド ガラスが水没します。
- 媒体をマウント トルエン系の合成樹脂を使用してガラス スライドをマウントします。スライドに coverslips を置き、爪ニスとそれらを封印します。
5. ネットワーク イメージング
- 20 X と 4 X 目標 (またはネットワークがある全体の核を視覚化するための適切な目的) を装備走査型共焦点顕微鏡によるアストロ サイトのネットワークを可視化し、蛍光を検出するレーザー (この場合、Alexa 594 は使用)。
- 20 倍の倍率を使用して、z の標識細胞のネットワークを行います。800 x 800 ピクセルの解像度を使用し、12.5 μ s/ピクセルの速度をスキャンします。
注: は、ネットワーク全体をイメージするために複数のスタックは、通常、必要とスタックの数は、ネットワークごとに調整が必要があります。確認するすべてのデータをイメージに同じ設定を使用することが、解像度とスキャン速度を変更できます。 - 4 倍の倍率を使用して、ネットワークおよび関心領域の画像を撮影します。
メモ: イメージング X 4 は興味の核内ネットワークの位置を決定する使用されます。常に透過光で同じフィールドをイメージします。このイメージは、共焦点蛍光画像で核の境界線を決定できない場合に便利になります。
6. 画像解析
- データの準備
- ソフトウェア ImageJFIJI を使用 (https://fiji.sc/ でダウンロード)。ファイルを開き、"バイオ形式インポート オプション] ウィンドウで [ok] をクリックします。
- 最後の z スタック (図 2 a) に必要な光学的スライスのみを含む z スタックを再定義には、ツールバーの「スタック」ノブをクリックして (検索、最初に stk を選択する |Z プロジェクト)。投影の種類を設定 (図 2 a) で「最大輝度」を選択します。ファイルを保存し、名前を「ファイルをスタック」。
- 画像ファイルには、いくつかのチャンネルが含まれています、アストロ サイト ネットワーク イメージングによるチャネルだけを節約するためにそれを分割 (画像 |カラー |チャンネルに分割)。
- イメージのピクセル設定をチェック [画像 |プロパティ |(「1」ピクセル寸法のため) からピクセル] です。
- 減算背景ツールを使用 (プロセス |背景を引く) biocytin ラベルの背景を削除します。プレビュー機能を使用して、設定のローリングの球の半径は、一般的に 50 ピクセル (図 2 b) に設定されます。
- 外れ値除去ツールを使用して、(プロセス |ノイズ |外れ値を削除) 減算背景のステップに続く必要がある場合。「ある外れ値」設定 (図 2) で「明るい」を選択します。半径としきい値を設定するのには、プレビュー機能を使用します。それは2 D 図で示すように、データをぼかしがありますので、このツールに注意します。
注: このツールは (示すよう図 2 bおよび2 Cの白い矢印で、治療の前後にそれぞれ) streptavidine 不特定の沈殿物によって引き起こされる小さな斑点を削除します。 - しきい値を調整 (画像 |調整 |しきい値)。"Default"と"B & W"モード (図 2 e) を選択します。「適用」をクリックします。
注意: 自動調整を使用することができます、しかし、2 つのスライダバーで手動調整することをお勧めします。この手順の目的は、任意の標識細胞を失うことがなく最大限にノイズを低減することです。 - 二進プロセス ツールでバイナリ イメージにイメージを変換 (プロセス |バイナリ |バイナリを作る)図 2 fに示すように。TIFF ファイルとしてファイルを保存し、名前を「バイナリ ファイル」。
- セルを数える
- 測定機能の設定を確認 (分析 |測定の設定)。「重心」オプションを選択します。
- 「バイナリ ファイル」「分析粒子」ツールを使用して前の手順で生成された (図 3 a) (分析 |粒子の分析) (左の図 3を参照)。「ショー」の設定 (図 3) の「アウトライン」を選択します。これは、検出 (図 3 b) の結果を表示する新しいファイルを生成します。
- パラメーターと遊ぶ: サイズ (セルのみを検出値は 30 ~ 6000 を使用する)、(の間の間隔を決定するための「1」の 1 0 にシェイプを定義する完全な円と「0」ランダム) 真円度検出 (図 3、左の部分) を調整します。検出を実行するには、「OK」をクリックします。
注: 2 つのテーブルが表示されます次の検出: 各セルの x 座標と y 座標を提供する検出された細胞の数は、「概要」というタイトル 1) のテーブルと 2)「結果」(図 3、右の部分) のタイトル テーブル。 - 値をコピーし、スプレッドシート アプリケーションに貼り付けます。「検出テーブル」という名の下でこのテーブルを保存します。検出セルのプロットを持つファイルは、(図 3 b) も表示されます。「検出ファイル」という名の下で TIFF ファイルとしてこのファイルを保存します。
- ネットワーク上の 2 つよりラベル付きセルのグループが分析粒子を使って単一のセルとなっても近くに互いに検出された流域ツールを使用 (プロセス |バイナリ |流域)バイナリ イメージに分析粒子を適用する前にツールし、分析粒子の手順を再度実行します。
注: 流域ツールは 1 ピクセルの幅にきわめて近いセル間の限界を作成します。細胞カウンター プラグインことができますラベルは明確ですが、手動で行うことができる場合に使用します。
- アストロ サイトのネットワーク領域を測定
- ネットワークの表面積を測定するには、画像 j. を使用して検出ファイルを使用します。
- トレース ネットワーク (図 4 a) の外周にあるすべてのセルを接続する多角形に多角形選択ツール (選択するツール ・ バーにあるボタンを左クリックします) を使用します。多角形をトレースを開始する左クリックし、右クリックで閉じます。
注: このポリゴンは利益 (率 ROI) の領域として定義されます、その表面がネットワークの表面積を決定する測定されます。 - 設定測定ウィンドウを開く (分析 |測定を設定)、「エリア」オプションを選択します。ROI マネージャーを開く (分析 |ツール |ROI マネージャー) (図 4 b)。'追加' (図 4 b) をクリックして ROI マネージャーでトレースされた多角形を追加し、' メジャー ' ROI マネージャーで] をクリックして、測定を実行します。
注: 面積測定テーブルに表示されます、ピクセル単位で表現されます。この値は μ m2で値を取得するために使用する顕微鏡に換算係数要素を変換することを忘れないでください。
- メインの方向ベクトルの決定
- パッチを適用したセルの定量
- ImageJFIJI のスタック ファイルを開き、その強いラベル強度 (図 4) に基づいてスタック ファイルにパッチを適用したセルを識別します。スプレッドシート アプリケーションで「検出テーブル」という名前のファイルを開くし、パッチを適用したセルとその対応する座標に関連付けられている番号を確認します。
- パッチを適用したセルを正確に判断できない場合は、biocytin の沈殿物は ImageJFIJI で多角形ツールを使用して、結合セルのイメージのネットワークの高密度領域を囲むし、パッチを適用したセル (図 4) のようにこの位置を参照してください。
- ROI マネージャーを使用して (分析 |ツール |ROI マネージャー)。次に、パッチを適用したセルの位置に投資収益率を描画し、ROI マネージャーに追加 (図 4 bを参照してください)。
- 測定値を設定 (分析 |計測を設定)、「重心」オプションを選択します。
- ROI マネージャーでは、「測定」トレース エリアの重心の座標を取得するをクリックします。この特定のネットワークの参照点としてこれらの座標を使用します。
- 参照変換
- 次の数式を使用して、パッチを適用したアストロ サイトへの参照の各セルの座標を計算します。

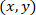 ; 特定のセルの座標として
; 特定のセルの座標として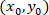 パッチを適用したセル (またはネットワークの参照点) の座標として
パッチを適用したセル (またはネットワークの参照点) の座標として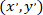 参照新しい内の指定されたセルの座標として。
参照新しい内の指定されたセルの座標として。
注: パッチのアストロ サイトへの参照の各セルの座標を表現するパッチを適用したアストロ サイトからのベクトルを計算する際に重要なステップであります。慎重に ImageJFIJI を使用して画像の参照イメージの左上隅に配置されています。
- 次の数式を使用して、パッチを適用したアストロ サイトへの参照の各セルの座標を計算します。
- 配向の主なベクトルの決定
- 次の数式の優先配向の主なベクトルの座標を計算します。
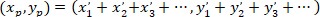
(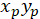 ) 配向; の主なベクトルの座標として
) 配向; の主なベクトルの座標として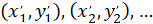 、パッチで得られたネットワークの各セルの座標としてセルに参照します。
、パッチで得られたネットワークの各セルの座標としてセルに参照します。
注: ネットワークの各セルにおいて、ベクトルはパッチを適用したアストロ サイトの座標を基準にして決定されます。ネットワークの優先配向の主なベクトルは、すべてのこれらのベクトルの合計です。 - (上記の数式を使用してから取得された座標によって提供される) 主なベクトルの長さマイナス 1 (ので、パッチを適用したセルの座標は含まれておりません)、ネットワークのセルの数で割る値を正規化し、間の比較を有効にします。ネットワーク。この分析の概略図を図 5に示します。
- 次の数式の優先配向の主なベクトルの座標を計算します。
- パッチを適用したセルの定量
- 興味の核の分析ネットワークの配置
- 20 X と 4 X 画像の配置
- 興味 (NVsnpr) の核内の各ネットワークの位置を決定するには、4 X イメージを使用します。ベクトル画像エディターで 4 倍の画像を開きます。
- 4 倍の画像を選択し、5 を掛け合わせることによってそのサイズを変更します。ディメンション ウィンドウ上部の水平ツールバーの右側の部分にあります。例えば、800 x 800 ピクセルでサンプリングされている 4 X イメージ、4,000 x 4,000 ピクセルをサンプリング解像度を変更 (作業単位をピクセル単位で設定、する [ファイル] タブの下で「ドキュメント設定」に移動: ファイル |ドキュメント設定)。TIFF 形式とそれは「リサイズ 4 X」の名前でファイルをエクスポートします。
- Adobe Illustrator のドキュメントの左下隅にイメージの左上隅に合わせます。
注: ソフトウェアは、左下隅の参照点から座標を提供します。 - ネットワークの 20 倍の画像を開きます。簡単に配置しているので、' バイナリ ファイル 'または' 検出ファイル ' を使用します。再サイズ 4 X と合わせて 20 倍の画像の「バイナリ ファイル」の不透明度を使って、プレイ画像。
注: 不透明度ツールは上部の水平のツールバーでは。 - 整列したら行って、選択しピペット ツールを保持するものさしツールが表示されますので、左側のツールバーで選択。
- サイズ 4 X にポイント参照 20 X の座標を取得する 20 X イメージの左上隅をクリックする測定ツールの使用イメージ。
注: 20 X 参照 (20XR図5) と呼ばれます、これらの座標は核の図に各ネットワークの位置を表現するのに便利になります。
- 関心の核の正規化
メモ: データを合計するには、四角形として核 (NVsnpr) の正規化が使用されます。手順は次のとおりです。- ImageJFIJI で 4 X のサイズが変更されたファイルを開くし、[ポリゴン] ツールを使用して核 (NVsnpr) を囲みます。核の境界は; 見ることができない場合、透過光のイメージを使用します。その場合、最初にサイズを変更してください。
- ROI マネージャーを開き、描画の ROI を追加します。「測定の設定」で「境界長方形」オプションをを選択します。
注:「外接矩形」オプションは、描かれた原子核の周りの最小の四角形を計算します。 - 「測定」をクリックします。
メモ: BX とで、四角形の左上隅の座標が表示されますテーブル:「長方形の位置 '' し、幅と高さを提供します。BX と BY と呼ばれる参照の外接する四角形の座標は、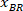 、
、 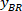 。
。
- 正規化された核内の各ネットワーク位置の式
- (図 5の黒四角形) 4 X 参照の各セルの座標を次の数式を使用して。

場所: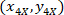 、4 X のセルの座標を参照。
、4 X のセルの座標を参照。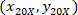 20 X 参照セル座標 (図 5のオレンジ色の四角);
20 X 参照セル座標 (図 5のオレンジ色の四角);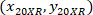 20 X 4 X イメージ (20XR) の参照ポイントの座標です。
20 X 4 X イメージ (20XR) の参照ポイントの座標です。 - (図 5の青)、外接する四角形の参照のセルの座標を表す次の式を使用します。
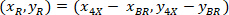
場所: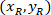 、セルの参照に外接する四角形の座標は
、セルの参照に外接する四角形の座標は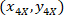 は、4 X のセルの座標を参考。
は、4 X のセルの座標を参考。 外接する四角形の座標を 4 倍の画像に記載されています。
外接する四角形の座標を 4 倍の画像に記載されています。 - 次の数式を使って外接する四角形の高さと幅の割合を参照の外接する四角形のセルの座標を変換します。
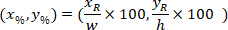
場所: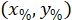 は、外接する四角形の高さと幅の割合でセルの座標
は、外接する四角形の高さと幅の割合でセルの座標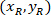 、セルの参照に外接する四角形の座標は
、セルの参照に外接する四角形の座標は 上記プロトコルで測定される外接する四角形の幅は、
上記プロトコルで測定される外接する四角形の幅は、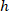 は外接する四角形の高さをプロトコルで上記測定します。
は外接する四角形の高さをプロトコルで上記測定します。 - 同じ図にすべてのネットワークを表すスライス (左または右) の向きを考慮して取る。データを標準化するために、参照が、スライスの左側に適用されます。X 座標のみに次の数式を適用することによって、左側に右側のネットワーク座標を転送します。
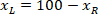
場所: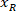 スライスの右側の x 座標
スライスの右側の x 座標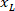 スライスの左側にある、参照で表される新しい x 座標です。
スライスの左側にある、参照で表される新しい x 座標です。
注: また、分析の前に ImageJFIJI の画像をミラー (画像 |変換 |水平方向に反転)。 - 配向の主なベクトルの座標を表現するには、セルの座標 (ステップ 6.5.3.1 に 6.5.3.4) と同じ手順に従います。
注: 割合で座標の式は、核 (NVsnpr) は、四角形として設計されている 1 つのプロットとしてデータのコンパイルを使用できます。
- (図 5の黒四角形) 4 X 参照の各セルの座標を次の数式を使用して。
- 20 X と 4 X 画像の配置
- 優遇の方向の主なベクトルの角度の違いの研究
注: アストロ サイトのネットワークの角度の差は、その配向関心の核の中心に向かってかどうかを確認する使用されます。ネットワーク (図 5の PD、赤い線) の優遇の方向の主要なベクトルと C を P を結ぶ線の間の角度は、角度差 (図5 α) を計算するには、三角形 PDC (を参照してくださいにアル樫定理を適用します。図 5および補助的な手段のはめ込み式)。- まず、デカルト参照使用次の方程式にピタゴラスの定理のアプリケーションを使用して別の長さを計算します。
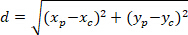
場所: P と C の座標は、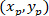 と
と 、それぞれ、外接する四角形参照 (計算上)。
、それぞれ、外接する四角形参照 (計算上)。 - 次の数式を使用してラジアン単位の角度の差を決定します。
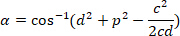
- 度 (例えば、 DEGREES 関数 Excel のソフトウェアと) の角度の違いを変換します。
- 垂直のバー グラフ (図 7および7 D) でそれらをプロットすることによってすべての角度の違いをコンパイルし、アストロ サイトのネットワークの優先配向がないか確認します。
- まず、デカルト参照使用次の方程式にピタゴラスの定理のアプリケーションを使用して別の長さを計算します。
結果
脳の細胞間の結合はなく静的ではなく動的に多くの要因によって規制です。説明する方法は、異なる条件の下で明らかにアストロ サイトのネットワークを分析して NVsnpr の組織を理解するために開発されました。これらの結果は、既に公開された1されています。3 つの異なる条件で NVsnpr の背の部分の単一のアストロ サイトの biocytin 充填を行った: C...
ディスカッション
電気生理学的方法があり、アストロ サイト23,24間結合機能を評価することができます。ただし、これらのメソッドは、アストロ サイト ネットワークの解剖学的配置に関する情報を提供できません。研究の数はすでに「色素- またはトレーサー カップリング」、ようここで発生することのみの一部電気生理学的方法25,
開示事項
著者が明らかに何もありません。
謝辞
この作品はカナダ協会の健康研究、助成/賞数によって資金を供給: 14392。
資料
| Name | Company | Catalog Number | Comments |
| NaCl | Fisher Chemicals | S671-3 | |
| KCl | Fisher Chemicals | P217-500 | |
| KH2PO4 | Fisher Chemicals | P285-500 | |
| MgSO4 | Fisher Chemicals | M65-500 | |
| NaHCO3 | Fisher Chemicals | S233-500 | |
| C6H12O6 Dextrose anhydrous | Fisher Chemicals | D16-500 | |
| CaCl2 dihydrated | Sigma | C70-500 | |
| Sucrose | Sigma | S9378 | |
| D-gluconic acid potassium salt | Sigma | G45001 | |
| MgCl2 anhydrous | Sigma | M8266 | |
| HEPES | Sigma | H3375 | |
| EGTA | Sigma | E4378 | |
| ATPTris Salt | Sigma | A9062 | |
| GTPTris Salt | Sigma | G9002 | |
| Biocytin | Sigma | B4261 | |
| Carbenoxolone disodium salt | Sigma | C4790 | |
| avidin-biotin complex : ABC kit | Vestor laboratories | PK-4000 | |
| Streptavidine-alexa 594 | Molecular Probes | S11227 | |
| Triton | Fisher Chemicals | BP151-500 | |
| Xylene | Fisher Chemicals | X5-1 | |
| Aqueous mounting medium 1 : Fluoromount-G | SouthernBiotech | 0100-01 | |
| Toluen-based synthetic resin mounting medium : Permount | Fisher Chemicals | SP15-100 | |
| Slide Drying Bench | Fisherbrand | 11-474-470 | |
| Vibratome | Leica | VT 1000S | |
| Microscope cover glass | Fisherbrand | 12-544A | |
| Microscope slide ColorFrost | Fisherbrand | 12-550-413 | |
| PFA | Fisherchemicals | 04042-500 | |
| Olympus FluoView FV 1000 Confocal microscope | Olympus | ||
| 40X water-immersion lens | Olympus | LUMPLFLN40XW | |
| 20X water-immersion lens | Olympus | XLUMPLFL20XW | |
| 4X water-immersion lens | Olympus | XLFLUOR4X/340 | |
| Micropipette puller | Sutter Instrument | P97 | |
| Micromanipulator | Sutter Instrument | MP 225 | |
| Camera CCD | Sony | CX-ST50 | |
| Black and white monitor | Sony | SSM-125 | |
| Digidata | Molecular devices | 1322A | |
| Patch Clamp amplifier | Axon instrument | Mulitclamp 700A | |
| Electrophysiology acquisition software | Molecular devices | pClamp 8 | |
| Electrophysiology analysis software | Molecular devices | Clampfit 8 | |
| Imaging analysis software | ImageJFIJI | Open source software. FIJI version including plug in package. | |
| Vector image editor | Adobe | Illustrator CS4 | |
| Spreadsheet application | Microsoft Office | Excel 2010 |
参考文献
- Condamine, S., Lavoie, R., Verdier, D., Kolta, A. Functional rhythmogenic domains defined by astrocytic networks in the trigeminal main sensory nucleus. Glia. 66 (2), 311-326 (2018).
- Verkhratsky, A., Orkand, R. K., Kettenmann, H. Glial calcium: homeostasis and signaling function. Physiological Review. 78 (1), 99-141 (1998).
- Christensen, R. K., Petersen, A. V., Perrier, J. F. How do glial cells contribute to motor control?. Current Pharmaceutical Design. 19 (24), 4385-4399 (2013).
- Verkhratsky, A., Steinhauser, C. Ion channels in glial cells. Brain Research Review. 32 (2-3), 380-412 (2000).
- Harada, K., Kamiya, T., Tsuboi, T. Gliotransmitter Release from Astrocytes: Functional, Developmental, and Pathological Implications in the Brain. Frontiers Neuroscience. 9, 499 (2015).
- Montero, T. D., Orellana, J. A. Hemichannels: new pathways for gliotransmitter release. Neuroscience. 286, 45-59 (2015).
- Araque, A., et al. Gliotransmitters travel in time and space. Neuron. 81 (4), 728-739 (2014).
- Augustin, V., et al. Functional anisotropic panglial networks in the lateral superior olive. Glia. 64 (11), 1892-1911 (2016).
- Houades, V., Koulakoff, A., Ezan, P., Seif, I., Giaume, C. Gap junction-mediated astrocytic networks in the mouse barrel cortex. Journal of Neuroscience. 28 (20), 5207-5217 (2008).
- Roux, L., Benchenane, K., Rothstein, J. D., Bonvento, G., Giaume, C. Plasticity of astroglial networks in olfactory glomeruli. Proceedings of the National Academy of Science of the United State of America. 108 (45), 18442-18446 (2011).
- Morquette, P., et al. An astrocyte-dependent mechanism for neuronal rhythmogenesis. Nature Neuroscience. 18 (6), 844-854 (2015).
- Brocard, F., Verdier, D., Arsenault, I., Lund, J. P., Kolta, A. Emergence of intrinsic bursting in trigeminal sensory neurons parallels the acquisition of mastication in weanling rats. Journal of Neurophysiology. 96 (5), 2410-2424 (2006).
- Anders, S., et al. Spatial properties of astrocyte gap junction coupling in the rat hippocampus. Philosophical Transactions of the Royal Society of London. Series B, Biological Science. 369 (1654), (2014).
- Houades, V., et al. Shapes of astrocyte networks in the juvenile brain. Neuron Glia Biology. 2 (1), 3-14 (2006).
- Rouach, N., Koulakoff, A., Abudara, V., Willecke, K., Giaume, C. Astroglial metabolic networks sustain hippocampal synaptic transmission. Science. 322 (5907), 1551-1555 (2008).
- Claus, L., et al. Barreloid Borders and Neuronal Activity Shape Panglial Gap Junction-Coupled Networks in the Mouse Thalamus. Cerebral Cortex. 28 (1), 213-222 (2018).
- Cameron, M. A., et al. Prolonged Incubation of Acute Neuronal Tissue for Electrophysiology and Calcium-imaging. Journal of Visualized Experiments. (120), (2017).
- Kafitz, K. W., Meier, S. D., Stephan, J., Rose, C. R. Developmental profile and properties of sulforhodamine 101--Labeled glial cells in acute brain slices of rat hippocampus. Journal of Neuroscience Methods. 169 (1), 84-92 (2008).
- Neher, E. Correction for liquid junction potentials in patch clamp experiments. Methods in Enzymology. , 123-131 (1992).
- Giaume, C., Leybaert, L., Naus, C. C., Saez, J. C. Connexin and pannexin hemichannels in brain glial cells: properties, pharmacology, and roles. Frontiers in Pharmacology. 4, 88 (2013).
- Torres, A., et al. Extracellular Ca(2)(+) acts as a mediator of communication from neurons to glia. Science Signaling. 5 (208), ra8 (2012).
- Ye, Z. C., Wyeth, M. S., Baltan-Tekkok, S., Ransom, B. R. Functional hemichannels in astrocytes: a novel mechanism of glutamate release. Journal of Neuroscience. 23 (9), 3588-3596 (2003).
- Ma, B., et al. Gap junction coupling confers isopotentiality on astrocyte syncytium. Glia. 64 (2), 214-226 (2016).
- Meme, W., Vandecasteele, M., Giaume, C., Venance, L. Electrical coupling between hippocampal astrocytes in rat brain slices. Neuroscience Research. 63 (4), 236-243 (2009).
- Ransom, B. R., Kettenmann, H. Electrical coupling, without dye coupling, between mammalian astrocytes and oligodendrocytes in cell culture. Glia. 3 (4), 258-266 (1990).
- Audesirk, G., Audesirk, T., Bowsher, P. Variability and frequent failure of lucifer yellow to pass between two electrically coupled neurons in Lymnaea stagnalis. Journal of Neurobiology. 13 (4), 369-375 (1982).
- Ewadinger, N., Syed, N., Lukowiak, K., Bulloch, A. Differential Tracer Coupling between Pairs of Identified Neurones of the Mollusc Lymnaea Stagnalis. Journal of Experimental Biology. 192 (1), 291-297 (1994).
- Griemsmann, S., et al. Characterization of Panglial Gap Junction Networks in the Thalamus, Neocortex, and Hippocampus Reveals a Unique Population of Glial Cells. Cerebral Cortex. 25 (10), 3420-3433 (2015).
- Kuwajima, T., et al. ClearT: a detergent- and solvent-free clearing method for neuronal and non-neuronal tissue. Development. 140 (6), 1364-1368 (2013).
- Gourine, A. V., et al. Astrocytes control breathing through pH-dependent release of ATP. Science. 329 (5991), 571-575 (2010).
- Forsberg, D., Ringstedt, T., Herlenius, E. Astrocytes release prostaglandin E2 to modify respiratory network activity. eLife. 6, (2017).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved