A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
ניתוח של גודל, צורה, כיוון של רשתות של האסטרוציטים בשילוב
In This Article
Summary
כאן אנו מציגים פרוטוקול כדי להעריך את הארגון של רשתות astrocytic. השיטה המתוארת ממזער הטיה לספק מדדים תיאוריים של רשתות אלה כגון ספירת תאים, גודל, שטח, מיקום בתוך גרעין. . בנוגע למקורו שקובעת עם ניתוח וקטורי.
Abstract
זה הפך ליותר ויותר ברורה האסטרוציטים לווסת את תפקוד לא רק ברמות סינפטית, תא בודד, אלא גם ברמת הרשת. האסטרוציטים חריפה מחוברים אחד לשני דרך צמתי הפער והוא צימוד דרך יפלו דינמי ומוסדרת מאוד. קונספט המתעוררים הוא פונקציות astrocytic מיוחדים ומותאמים לפונקציות של מעגל עצביים שאליו הן משויכות. לכן, שיטות למדידת פרמטרים שונים של רשתות astrocytic נחוצים יותר לתאר את הכללים המסדירים את התקשורת שלהם, מצמד, להבין עוד יותר את הפונקציות שלהם.
כאן, שימוש בתוכנת ניתוח התמונה (למשל., ImageJFIJI), אנו מתארים שיטה לניתוח תמונות קונאפוקלית של רשתות astrocytic חשף זיווגו-צבע. שיטות אלה מאפשרים 1) האוטומטי לא משוחד זיהוי, של תאים עם תוויות, 2) חישוב של הגודל של הרשת, 3) חישוב כיוון מועדף של צבע להתפשט בתוך הרשת, ההגדלה והמיקום 4) של הרשת בתוך האזור בעל עניין .
ניתוח זה יכול לשמש כדי לאפיין את רשתות astrocytic של אזור מסויים, להשוות רשתות של אזורים שונים הקשורים לפונקציות שונות או להשוות רשתות שהושגו בתנאים שונים כי יש השפעות שונות על צימוד. תצפיות אלה עלולה להוביל חשוב בשיקולים פונקציונליים. למשל, אנחנו מנתחים את הרשתות astrocytic של גרעין טריגמינל, איפה אנחנו בעבר הראו כי צימוד astrocytic הוא חיוני עבור היכולת של נוירונים לעבור על דפוסי הירי של טוניק המתפרצת קצבית1. על ידי מדידת את גודל, כליאה, וכיוון מועדף של רשתות astrocytic בגרעין הזה, נוכל לבנות השערות לגבי התחומים הפונקציונליים הם circumscribe. מספר מחקרים מראים כי מספר המוח בתחומים אחרים, כולל חבית, זית מעולה לרוחב, חוש הריח glomeruli ולשגר את הגרעינים חושית תלמוס, קליפת הראייה, שם כמה, עשויה להועיל ניתוח דומה.
Introduction
מחקרים רבים תיארו איך הדיאלוג נוירון-אסטרוציט ברמה התאית תת או סינפטית יכול להיות השלכות פונקציות עצביים, העברה סינפטית. היא מבוססת היטב כי האסטרוציטים רגישים סביב פעילות. עצבית; למעשה, יש להם רצפטורים של נוירוטרנסמיטורים רבים כולל גלוטמט, גאבא, אצטילכולין ו- ATP (ראה הדעת שפורסמו בעבר-2,-3,-4). בתמורה, astrocytic תהליכים אלמנטים סינפטית ensheath וגם פעילות. עצבית השפעה, באתרים extrasynaptic על ידי ויסות הומאוסטזיס יוניים חוץ-תאית ושחרור מספר גורמים או משדרי כגון גלוטמט, D-סרין ו- ATP 5 , 6 , 7.
הרעיון כי האסטרוציטים יכול גם לווסת תפקוד ברמת הרשת התפתחה, עם ראיות כי צימוד astrocytic במרחב מוסדר, מקביל פילוח העצבית באזורים מאופיין אנטומי ברור מידור (כמו אזורים עם ייצוגים חושית), המציין כי האסטרוציטים נשלים כדי אחרים האסטרוציטים המשרתים את אותה הפונקציה ולא רק על אלה נמצאים בקרבת מקום. בזית מעולה לרוחב, למשל, רשתות astrocytic ביותר הם שכיוונו orthogonally על ציר ' tonotopic '8, ואילו glomeruli קליפת או olfactoty חבית, תקשורת בין האסטרוציטים הוא הרבה יותר חזק בתוך חביות או glomeruli חלש יותר בין סמוכים אלה9,10. בשני המקרים, הרשתות astrocytic הם שכיוונו לכיוון מרכז ה glomerule או חבית9,10.
לאחרונה הראינו כי פעילות astrocytic ממיקרו עצביים ירי על ידי הפחתת הריכוז של Ca חוץ-תאית2 + ([Ca2 +]e), ככל הנראה דרך שחרורו של S100β, Ca2 +-איגוד חלבון11. את האפקט הזה, שבו הודגם על אוכלוסיה של rhythmogenic טריגמינל נוירונים בחלק הגבי של חושי הראשי טריגמינל גרעין (NVsnpr, חשב לשחק תפקיד חשוב דור של תנועות masticatory), נובעת מהעובדה כי ירי קצבית בנוירונים אלו תלוי עקשן Na+ הנוכחי זה מקודם על ידי ירידות של [Ca2 +]e11,12. ירי קצבית בנוירונים אלו יכולים להיות שהפיק ". פיזיולוגית" גירוי של תשומות שלהם או ירידה מלאכותית של [Ca2 +]e. בהמשך הראינו כי צימוד astrocytic היה נדרש עבור ירי קצבית עצביים1. זה העלה את האפשרות כי רשתות astrocytic עלולה להיווצר חוסם תחומים פונקציונליים בו פעילות. עצבית יכול להיות מסונכרנת ומתואמת. כדי להעריך את השערה זו, נזקקנו קודם לפתח שיטה לתעד בקפדנות את הארגון של רשתות אלה בתוך NVsnpr.
מחקרים קודמים ברשתות astrocytic תיארו בעיקר את מידת צימוד מבחינת מספר הטלפון הנייד ואת צפיפות אזור מכוסה. ניסיונות כדי להעריך את הצורה של רשתות astrocytic ואת הכיוון של צבע-מצמד בוצעו בעיקר על-ידי השוואת גודל רשתות לאורך שני צירים (x ו- y) ב חבית קליפת9, ההיפוקמפוס13,14, 15, barreloid שדות של התלמוס16, לרוחב זית מעולה8, חוש הריח glomeruli10, קליפת14. בשיטות המתוארות כאן מאפשרים עבירות לא משוחדת של תאים עם תוויות ברשת הערכה של האזור שהם מכסים. פיתחנו גם כלים כדי להגדיר את הכיוון המועדף של צימוד בתוך רשת וכדי להעריך אם הכיוון המועדף הוא לכיוון המרכז של הגרעין או בכיוון אחר. לעומת שיטות השתמשו בעבר, פרוטוקול זה מספק אמצעים כדי לתאר את הארגון ואת כיוון ההדפסה של רשתות astrocytic במבנים כמו הגבי טריגמינל גרעין החישה העיקריים שאין ידוע אנטומי ברור מידור. במחקרים לעיל, כיוון רשת מתואר יחסים לפי צורת המבנה עצמו אשר מתועדת כבר (למשל., barreloid של התלמוס, חביות בקליפת, שכבות ההיפוקמפוס, קליפת המוח, glomeruli ב הריח הנורה, וכו '). בנוסף, מאפשרת ניתוח וקטורי להשוואות מצמד אוריינטציות חשף בתנאים שונים. כדי לנתח אם פרמטרים אלה משתנה בהתאם למיקום של הרשת בתוך הגרעין, גם פיתחנו שיטה כדי להחליף את כל רשת ביחס לגבולות של הגרעין. כלים אלה ניתן להתאים בקלות לאזורים אחרים לרשתות החקירה של תאים בשילוב.
Protocol
כל ההליכים abode לפי הכללים הקנדי מכוני הבריאות מחקר ואושרו על ידי טיפול בבעלי חיים מאוניברסיטת מונטריאול ועל שימוש הוועדה.
1. הכנת פרוסות המוח של עכברוש
- להכין 1 ליטר של פתרון מבוסס-סוכרוז (טבלה 1) 1 ליטר של נוזל מוחי-שדרתית מלאכותי רגיל (כלנית חדד) (טבלה 2).
- בועה הפתרון מבוסס-סוכרוז עם שילוב של 95% O2 ו 5% CO2 (carbogen) במשך 30 דקות לפני הנחת ב-80 מעלות צלזיוס למשך כ- 30 דקות, עד הפתרון הוא קר אבל לא קפוא לחלוטין. להשתמש סוכרוז הקר הזה המאגר חיתוך שמגיע של המוח. לשמור זה על הקרח לאחר שהוסר מהמקפיא.
- בועה של כלנית חדד עם carbogen דרך הניסוי כולו. השתמש פתרון זה לאחסון פרוסה כמו המאגר perfusing בו מחבר תיקון-חובק למעקה ואת biocytin-מילוי האסטרוציטים יבוצעו. להכין החלמה פרוסה מחזיק קאמרית להפקיד את פרוסות המוח ברגע שהם נחתכים.
הערה: תא המעצר פרוסה שחזור יכול להיות בהזמנה אישית, מורכב בעיקרו של דבר אחד טוב קטן עם רשת שינוי בחלק התחתון הושעו בבאר גדול זה מתמלא כלנית חדד, שבה מוכנס צינור להביא carbogen מלמטה. - השתמש כדי 21 יום-בת 15 חולדות ספראג-Dawley ללא כל הטיה ספציפיים מין או זן. עזים ומתנגד החיה עם איזופלוריין (1 מ"ל של איזופלוריין בתא אינדוקציה הרדמה). בדוק את עומק הרדמה על ידי בעדינות צובט את כפה האחוריות או הזנב של החיה.
- לערוף את החולדה באמצעות גיליוטינה, לחתוך את הגולגולת שלו עם מספריים, ולהסיר במהירות במוח הגולגולת עם מרית שטוחה.
- טובלים את המוח בפתרון מבוסס-סוכרוז קר כקרח עבור 30 s ועל העברת זה (עם הפתרון) פטרי צלחת. עם סכין גילוח, להסיר את החלקים שאינם anterior ואת אחורי לאזור כדי להיות למחלקה, אם חיתוך פרוסות ב מישור רוחבי.
- הדבק את הבלוק הנותרים של רקמת המוח על צידה rostral והמשך חותכים פרוסות המוח (בעובי 350 מיקרומטר) במדיום מבוססי סוכרוז באמצעות vibratome. לאחר מכן, להעביר את הפרוסות שנאספו בבית החלמה מחזיק חדר מלא עם חנה המבר carbogenated בטמפרטורת החדר (RT) עד שהם יהיו מוכנים לשמש (אפשר לפחות שעה עבור שחזור).
הערה: ההתפתחויות האחרונות בתחום לאפשר דגירה ממושך עד 24 שעות של פרוסות המוח in vitro תנאים17.
2. Sulforhodamine 101 (SR-101) תיוג של האסטרוציטים
- מראש בחום באמבט מים עד 34 מעלות צלזיוס, מקום שני תאי הדגירה פרוסה בו. מילוי באחד התאים הדגירה פרוסה עם פתרון של חנה המבר המכיל 1 μM SR-101, ולמלא אחר רק עם חנה המבר.
- דגירה הפרוסות בחדר דגירה המכיל את 1 מיקרומטר SR-101 20 דקות, ואז להעביר אותם לתוך הדגירה השני קאמרית שוטפת עודף SR-101 מתוך הרקמה. תן לזה תקופת דגירה של 20 דקות או יותר ב 34 מעלות, ואז לשמור תא הדגירה המכיל את הפרוסות ב RT עד שהם זקוקים18.
3. תיקון אסטרוציט ו Biocytin מילוי
- בחרו פרוסה ולמקם אותו בחדרו הקלטה של המיקרוסקופ. תיקון האסטרוציטים, השתמש אלקטרודות עם התנגדות של 4-6MΩ כאשר מלא עם פתרון מבוסס-אשלגן-gluconate (ראו טבלה 3).
- תחת הנחיה חזותית ושימוש של micromanipulator, לכוון האלקטרודה הקלטה לכיוון אסטרוציט SR-101-מתויג כמוצג באיור1. הימנע תאים נמצא על פני השטח של הפרוסה, שכן הם נוטים יותר פגום או איבדו חיבורים לתאים שכנים.
- כדי למנוע דליפה של biocytin ברקמה, להקטין את הלחץ חיובי נוסף על פיפטה תיקון ולהחיל אותו רק כאשר הוא קרוב אסטרוציט זה להיות מטולא (0.1-0.4 מ ל מזרק של 1 מ"ל).
- לפני תיקון, כוונון ההיסט של פיפטה, קיבוליות שלה. תקן עבור פוטנציאל צומת נוזלי, כמו פקודות מתח ומדויקים הם קריטיים ניסויים19.
- הזז פיפטה קרוב מספיק אסטרוציט להתבונן דיכאון גורם לחץ חיובי. לאחר מכן, להסיר את הלחץ, לאט לאט החל לחץ שלילי. מהדק את אסטרוציט ל-70 mV החותם מגיע ל 100 MΩ. המתן עד החותם מגיע ל 1-3 GΩ. להמשיך להפעיל לחץ שלילי עד לפרוץ לתוך התא. להיזהר בעת הפעלת לחץ שלילי, מאחר האסטרוציטים הם מאוד שבירים.
- להעריך את המאפיינים אלקטרופיזיולוגיות של התא תוקנו. במצב מתח-קלאמפ, לבצע פרוטוקול זרם-מתח התא כולו עם פקודה מתח סוללה של משך 600 ms ועד-120 +110 mV. במצב הנוכחי-קלאמפ, לבצע נוהל שלב IV בהן ההזרקה של 1000 ms הנוכחי צעדים של הרשות הפלסטינית 100 מ-1 ל נה 1, קצב הדגימה של ההקלטות כל תא הוא 10 קילו-הרץ.
הערה: האסטרוציטים הצג פרופיל זרם-מתח לינארית ללא כל סוג של תיקון (כפי שמוצג באיור 1B), אין פוטנציאל פעולה ירי על קרום דפולריזציה (איור 1C). פוטנציאל הממברנה בזמן מנוחה (RMP) צריך להיות יציב וטוב לא ל- 60mV. באזורים מסוימים במוח, RMP של האסטרוציטים היא יותר hyperpolarized מאשר ב- NVsnpr. - אפשר את biocytin לנטרל בתוך אסטרוציט למשך 30 דקות בעת ביצוע שלב IV פרוטוקול בכל 5 דקות.
- . משכי לנתק את פיפטה תיקון בזהירות מבלי להזיק את אסטרוציט תוקנו, מיד שימו לב ההיסט של פיפטה לפני שלקחתי אותה מחוץ לחדר ההקלטה. לחסר ערך זה מ ההקלטות פוטנציאל הממברנה.
- להשאיר את הפרוסה למוח לנוח בבית הבליעה הקלטה למשך לפחות 15 דקות (בנוסף 30 דקות להזרקה) כדי לאפשר הפצת רכיב המעקב מ אסטרוציט תוקנו רשת שלמה של תאים בשילוב.
הערה: כדי לחשוף את רשת של תאים בשילוב, רק תא אחד צריך להיות מטולא בגרעין של ריבית. אם נסיונות מרובים נדרשות כדי להשיג תקופה מוצלחת, למחוק את המקרה ולנסות תיקון בצד contralateral או בפרוסה נוספת של המוח. - הפיכת מארק או חתך ברקמת לזהות באיזה צד של הפרוסה פונה כלפי מעלה, להעביר את הפרוסה הראשונה צלחת פטרי המכילות חנה המבר נורמלי, ואז לתוך פתרון של 4% paraformaldehyde (PFA). דגירה הפרוסה ב 4 מעלות צלזיוס למשך הלילה.
התראה: PFA מזיק מאוד. השימוש בציוד המגן בשכונה מאוורר. ודא כי כל החומרים (מברשות, צינורות, וכו ') שהיו בקשר עם מחברים אל תצור קשר עם התאוששות מחזיק קאמרית, דגירה קאמרית או חומרים אחרים המשמש להקלטת הרקמה טריים.
4. Biocytin ההתגלות
- התגלות עם פלורסנט streptavidine
- שטיפת המוח פרוסות 2 x 10 min ב- 0.1 M פוספט מאגר תמיסת מלח (PBS) ב RT. לאחר מכן, לחשוף את biocytin על ידי המקננת את פרוסות המוח עם streptavidine מצומדת fluorophore-דילול 1/200 ב- PBS עם 4% דטרגנט ללא יונית במשך 4 שעות ב- RT.
- לשטוף את פרוסות המוח 3 x 10 min ב- 0.1 M PBS ב RT והר הסעיפים בשקופיות זכוכית באמצעות בינוני של הרכבה מימית. מקם הצדדים הוזרקו כלפי מעלה, coverslip השקופיות ולאחר לאטום אותם-הלק.
- התגלות עם DAB
הערה: התגלות DAB (3,3-diaminobenzidine) ניתן להשתמש כאשר אין אפשרות להשתמש קרינה פלואורסצנטית. במקרה זה, שיטה ההתגלות היחיד צריך להיות מועסק עבור ביצוע השוואות.- תשטוף פרוסות המוח 3 x 10 min ב- PBS ב RT. דגירה הפרוסות ב- PBS + H2O2 0.5% למשך שעה-RT.
- לשטוף את פרוסות 3 x 10 min ב- PBS ב RT. לאחר מכן, דגירה הפרוסות ב אבידין-ביוטין מורכבים מכתימים פתרון מורכב PBS ו דטרגנט ללא יונית 0.1% + אבידין-ביוטין peroxidase מורכבים סטנדרטי מכתימים ערכת ריאגנטים ב- 1/100 למשך 24 שעות-RT.
- לשטוף את פרוסות 3 x 10 min ב- PBS ב RT, דגירה אותם בפתרון של PBS + כי אמחה קלות 0.05% במשך 20 דקות ב- RT, ולא להעביר אותם לתוך פתרון של PBS + כי אמחה קלות 0.05% + H2O2 0.5%.
התראה: DAB מזיק מאוד. השימוש בציוד המגן בשכונה מאוורר. התגובה צבע מופסק כאשר הפרוסות מועברים ב- PBS. - לשטוף את הפרוסות 5 x 10 min ב- PBS ב RT, הר הסעיפים בשקופיות זכוכית (פנים את הצדדים הוזרקו כלפי מעלה) ולתת להן להתייבש בשקופית ייבוש ספסל בן לילה ב 34 מעלות צלזיוס.
- להטביע את השקופיות זכוכית עבור 1 דקות בכמה אמבטיות אלכוהול 70%, 95%, ו- 100%, ובסוף עם אמבט של קסילן עבור 1 דקות.
- הר בשקופיות זכוכית באמצעות מבוססי טולואן שרף סינתטי הרכבה בינונית. מקום coverslips בשקופיות, לסמנם עם הלק.
5. רשת הדמיה
- דמיינו את הרשתות astrocytic באמצעות מיקרוסקופ קונפוקלי סריקה מצויד 20 X 4 X מטרות (או אובייקטיבית המתאים כדי להמחיש את הגרעין כולו שבו ממוקם ברשת) ו לייזר כדי לזהות את fluorophore (במקרה זה, אלקסה-594 הוא בשימוש).
- להשתמש ההגדלה 20 X z-בערימה של הרשת של תאים עם תוויות. השתמש ברזולוציה של 800 x 800 פיקסלים, לסרוק במהירות של 12.5 μs לפיקסל.
הערה: על מנת דמות כל הרשת, ערימות מרובות נדרשים בדרך כלל ולאחר מספר ערימות צריך להיות מותאם עבור כל רשת. מהירות סריקה של רזולוציה ניתן לשינוי, אך הקפד להשתמש באותן ההגדרות של כל נתוני תמונה. - השתמש ההגדלה X 4 תמונות של הרשת, אזור בעל עניין.
הערה: 4 X הדמיה משמש כדי לקבוע את מיקום הרשת בתוך הגרעין של עניין. תמיד תמונה באותו השדה באור המשודרת. הדימוי הזה יהיה שימושי אם אתה לא יכול לקבוע את הגבול של הגרעין בתמונה פלורסנט קונפוקלי.
6. ניתוח תמונות
- הכנת הנתונים
- להשתמש בתוכנה ImageJFIJI (להוריד אותו ב- https://fiji.sc/). פתח את הקובץ ולחץ על OK בחלון "ביו-תבניות ייבוא אפשרויות".
- להגדיר מחדש את z-מחסנית שיכיל רק את הפרוסות אופטי עבור סופי z-המחסנית (איור 2 א), לחץ על הידית "מחסנית" בסרגל הכלים (כדי למצוא, בחר תחילה stk | פרויקט Z). בחר "מקס אינטנסיביות" הסוג הקרנה הגדרת (איור 2 א). שמור את הקובץ, שם "מחסנית קובץ".
- אם קובץ הדמיה מכיל מספר ערוצים, נתחלק לשמר רק את הערוץ עם ההדמיה רשת astrocytic (תמונה | צבע | פצל ערוצים).
- בדוק את הגדרות הפיקסל של התמונה [תמונה | מאפייני | פיקסל (עם "1" עבור ממד פיקסל)].
- השתמש בכלי רקע הפחת (תהליך | להחסיר רקע) כדי להסיר את הרקע של biocytin תוויות. השתמש בפונקציה תצוגה מקדימה כדי להגדיר את רדיוס הכדור מתגלגל, אשר מוגדר בדרך כלל 50 פיקסלים (איור 2B).
- השתמש בכלי ליניאריים הסרה (תהליך | רעש | להסיר ליניאריים) אם נדרש בעקבות הצעד רקע הפחת. בחר "ברייט" בהגדרת "אשר ליניאריים" (איור 2C). השתמש בפונקציה תצוגה מקדימה כדי לקבוע את רדיוס הסף. להיזהר עם הכלי הזה, מאז זה עשוי לטשטש את הנתונים, כפי שמוצג באיור 2D.
הערה: כלי זה מסיר את הנקודות קטנים הנגרמת על ידי פיקדונות לא ספציפי של streptavidine (כפי שמוצג על ידי החצים הלבנים להבין 2B ו 2 C לפני ואחרי טיפול, בהתאמה). - התאם את הסף (תמונה | התאם | מפתן). בחר במצב "ברירת מחדל" ו- "B & W" (2E איור). לחץ על "החל".
הערה: כוונון אוטומטי יכול לשמש, אך התאמה ידנית עם מייצגי המחוון שני הוא מועדף. מטרת שלב זה היא כדי להפחית את הרעש למקסימום מבלי לאבד תאים עם תוויות. - המירו את התמונה לתוך תמונה בינארית באמצעות הכלי תהליך בינארי (תהליך | בינארית | להפוך בינארי) כפי שמוצג באיור 2F. שמור את הקובץ כקובץ TIFF ולכנותו "קובץ בינארי".
- סופר תא
- בדוק את ההגדרה של הפונקציה מידה (נתח | הגדר מדידה). בחר באפשרות "Centroid".
- השתמש בכלי "חלקיקים לנתח" על "קובץ בינארי" (איור 3 א) המיוצר בשלב הקודם (נתח | לנתח את החלקיקים) (3C איור משמאל). בחר "מתאר" בהגדרת "להראות" (איור 3C). יוצר קובץ חדש המציג את תוצאת הזיהוי (איור 3B).
- לשחק עם הפרמטרים: גודל (כדי לזהות רק תאים, השתמש בערכים בין 30 ל 6000) ואת מעגליות (כדי לקבוע פרק זמן בין 0 ל- 1, אשר "1" מגדיר את מעגל מושלם ו- "0" צורה אקראית) כדי לחדד את הזיהוי (איור 3C, נשאר חלק). הפעל הזיהוי על-ידי לחיצה על "אישור".
הערה: שתי הטבלאות יופיעו בעקבות הזיהוי: 1) תחת הכותרת "Summary" המספק את מספר התאים שאותרו, וטבלת 2) תחת הכותרת "תוצאות" (איור 3C, החלק הנכון) המספק את הקואורדינטות x ו- y של כל תא. - להעתיק את הערכים ולהדביק אותם לתוך יישום גליונות אלקטרוניים. שמור את השולחן הזה תחת השם "זיהוי השולחן". קובץ עם מגרש של תאים שזוהו יופיעו גם (איור 3B). שמור את הקובץ כקובץ TIFF תחת השם "איתור הקובץ".
- אם קבוצת תאים 2 או יותר שכותרתו ברשת מזוהים כפי תא בודד באמצעות הכלי חלקיקים נתח כי הם קרוב מדי אחד לשני, השתמש בכלי קו פרשת המים (תהליך | בינארית | קו פרשת המים) על התמונה בינארי לפני החלת החלקיקים נתח כלי, ובצע את השלבים חלקיקים נתח.
הערה: הכלי קו פרשת המים יוצר של תיחום רחב בין תאים מאוד קרוב 1 פיקסל. פחית plug-in של מונה תא לשמש כאשר תיוג הוא חד משמעי, יכול להתבצע באופן ידני.
- מדידת שטח רשת astrocytic
- כדי למדוד את פני השטח של הרשתות, להשתמש בקובץ ה-זיהוי באמצעות תמונה ג'
- השתמש בכלי בחירה מצולע (שמאל לחץ על הלחצן בסרגל כלי כדי לבחור בו) לאתר מצולע שמחבר את כל התאים הממוקמים בפריפריה חיצוני של הרשת (איור 4A). שמאל לחץ כדי להתחיל מעקב את המצולע, לחץ לחיצה ימנית כדי לסגור אותו.
הערה: מצולע זו תוגדר כאזור עניין (ROI), פני השטח שלו נמדד כדי לקבוע את פני השטח של הרשת. - פתח את החלון מדידה set (נתח | לקבוע מדידה) ובחר באפשרות "אזור". פתח את מנהל רועי (לנתח | כלים | רועי מנהל) (איור 4B). לאחר מכן, להוסיף את המצולע עקיבה במנהל רועי על-ידי לחיצה על "הוסף" (איור 4B) ולהפעיל את המדידה על ידי לחיצה על ' מידה ' במנהל רועי.
הערה: מדידת השטח יופיע בטבלה ולא להתבטא פיקסלים. אל תשכחו להמיר את הערך הזה עם הגורם ההמרה עבור המיקרוסקופ משמש כדי לקבל ערך μm2.
- הנחישות של וקטור הכיוון העיקרי
- הנחישות של התא מתוקנת
- פתח את הקובץ מחסנית ב ImageJFIJI ולזהות את התא תוקנו בקובץ מחסנית בהתבסס על בעוצמתה תיוג חזק (איור 4C). לאחר מכן, פתח את הקובץ בשם "זיהוי שולחן" ביישום גיליונות אלקטרוניים, למצוא את מספר התא תוקנו והקואורדינטות המתאימים שלו.
- אם אין אפשרות לקבוע באופן מדויק את התא תוקנו, המקיפים את האזור שבו ההפקדה של biocytin היא צפופה ברשת תמונה של תאים בשילוב, שימוש בכלי מצולע ב ImageJFIJI, והפנה לתנוחה הזאת כמו זה של התא תוקנו (איור 4D).
- השתמש במנהל ROI (לנתח | כלים | רועי מנהל). לאחר מכן, לצייר רועי במיקום התא תוקנו ולהוסיף אותו למנהל ROI (ראה איור 4B).
- הגדר מדידה (נתח | לקבוע מדידה) ובחר באפשרות "Centroid".
- במנהל רועי, לחץ על "מדד" כדי להשיג את הקואורדינטות של centroid האזור לעקוב אחריו. השתמש הקואורדינטות כנקודת התייחסות ברשת ספציפית זו.
- תרגום הקשרים
- לחשב את הקואורדינטות של כל תא בהקשר אסטרוציט תוקנו באמצעות הנוסחה הבאה:

עם: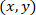 כמו קואורדינטות תא נתון;
כמו קואורדינטות תא נתון; 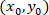 כמו הקואורדינטות של התא תוקנו (או נקודת הקשרים של הרשת);
כמו הקואורדינטות של התא תוקנו (או נקודת הקשרים של הרשת); 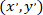 כמו קואורדינטות תא נתון החדשה הקשרים.
כמו קואורדינטות תא נתון החדשה הקשרים.
הערה: לבטא את נקודות הציון של כל תא בהקשר אסטרוציט תוקנו היא צעד חשוב לחישוב וקטורים מ אסטרוציט תוקנו. להיזהר בעת שימוש ImageJFIJI הקשרים עבור כל תמונה הממוקם בפינה השמאלית העליונה של התמונה.
- לחשב את הקואורדינטות של כל תא בהקשר אסטרוציט תוקנו באמצעות הנוסחה הבאה:
- הנחישות של וקטור הראשי כיוון מועדף
- לחשב את הקואורדינטות של וקטור הראשי של כיוון מועדף עם הנוסחה הבאה:
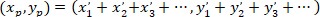
עם: (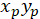 ) כמו הקואורדינטות של וקטור הראשי של כיוון מועדף;
) כמו הקואורדינטות של וקטור הראשי של כיוון מועדף; 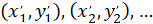 כמו נקודות הציון של כל תא של הרשת שהושג עם תוקנו תא כמו הקשרים.
כמו נקודות הציון של כל תא של הרשת שהושג עם תוקנו תא כמו הקשרים.
הערה: עבור כל תא ברשת, וקטור נקבע באופן יחסי הקואורדינטות של אסטרוציט תוקנו. וקטור הראשי של כיוון מועדף של הרשת הוא הסכום של כל וקטורים אלה. - לחלק את אורך הווקטור הראשי (שמספק את נקודות הציון המתקבל באמצעות הנוסחה לעיל) על ידי מספר התאים ברשת מינוס אחד (מאז הקואורדינטות של התא תוקנו אינם כלולים), לנרמל את הערכים ולאפשר השוואות בין רשתות. מבט סכמטי של ניתוח זה מוצג באיור5.
- לחשב את הקואורדינטות של וקטור הראשי של כיוון מועדף עם הנוסחה הבאה:
- הנחישות של התא מתוקנת
- השמה של רשתות שנותחה בגרעין של ריבית
- היישור של 20 X ותמונות X 4
- כדי לקבוע את המיקום של כל רשת בגרעין של הריבית (NVsnpr), להשתמש בתמונה X 4. פתחו את התמונה X 4 באמצעות עורך תמונות וקטור.
- בחר בתמונה X 4 ושנה את גודלה על-ידי הכפלת זה 5. חלון ממד ממוקם בחלק הנכון של הכלים האופקי העליון. למשל, עבור תמונת X 4 יש כבר לטעום-800 x 800 פיקסלים, לשנות את הרזולוציה הדגימה 4000 x 4000 פיקסלים (כדי להגדיר את יחידת עבודה בפיקסלים, עבור אל 'הגדרות מסמך' תחת הכרטיסיה קובץ: קובץ | הגדרות מסמך). לייצא את הקובץ בתבנית TIFF והשם "הגודל שלה 4 X".
- יישר את הפינה השמאלית העליונה של התמונה עם הפינה הימנית התחתונה של המסמך Adobe Illustrator.
הערה: התוכנה מספקת קואורדינטות נקודה הקשרים בפינה השמאלית התחתונה. - פתחו את התמונה X 20 של הרשת. השתמש ' קובץ בינארי ' או 'איתור הקובץ ' כי הם יותר קל ליישר. לאחר מכן, לשחק בעזרת הכלי ' אטימות ' על 'הקובץ הבינארי ' של התמונה X 20 כדי ליישר אותו עם 4 מחדש בגודל X התמונה.
הערה: הכלי אטימות נמצא סרגל הכלים האופקי העליון. - כאשר היישור, בחר, להחזיק את הכלי פיפטה כך מופיע בכלי מדידה ולאחר בחירתו בסרגל הכלים השמאלי.
- שימוש בכלי מדידה כדי ללחוץ על הפינה השמאלית העליונה של התמונה X 20 כדי לקבל את נקודות הציון של ה-20 X הקשרים הצבע על גבי 4 שגודלה השתנה X התמונה.
הערה: הקואורדינטות, אשר מכונים את 20 X הקשרים (20XR באיור5), יהיה שימושי עבור לבטא את המיקום של כל רשת על שרטוט ציור של הגרעין.
- נורמליזציה של גרעין עניין
הערה: כדי לסכם את הנתונים, נורמליזציה של הגרעין (NVsnpr) כמלבן משמש. השלבים שיפורטו להלן.- לפתוח את 4 X קובץ שגודלה השתנה ב- ImageJFIJI, והשתמש בכלי מצולע כדי להקיף את הגרעין (NVsnpr). להשתמש בתמונה עם אור המשודרת אם הגבולות של הגרעין אינם מסוגלים לראות; בכל מקרה, זכור את גודלה קודם.
- פתח את מנהל רועי ולהוסיף את רועי מצוירות. במדידה"להגדיר", בחר באפשרות ' מלבן תוחמת '.
הערה: האפשרות "תיבה תוחמת מלבן" מחשבת את המלבן הקטן ביותר מסביב לגרעין מצוירות. - לחץ על "מידה".
הערה: מופיעה טבלה עם BX ו ב, הקואורדינטות של הפינה השמאלית העליונה של המלבן: ' מלבן עמדה ' מספקת את הרוחב והגובה. BX ו ב הם הקואורדינטות של המלבן התוחם הקשרים אשר מכונים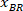 ,
, 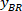 .
.
- ביטוי לכל תפקיד הרשת בגרעין מנורמל
- לבטא את נקודות הציון של כל תא עם 4 X הקשרים (ריבוע שחור באיור5) באמצעות הנוסחה הבאה:

איפה: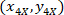 הן הקואורדינטות תא עם 4 X הקשרים;
הן הקואורדינטות תא עם 4 X הקשרים; 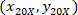 הציון תא עם 20 X הקשרים (ריבוע כתום באיור5); ו
הציון תא עם 20 X הקשרים (ריבוע כתום באיור5); ו 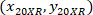 הציון מתוך 20 X נקודת הקשרים בתמונה X 4 (20XR).
הציון מתוך 20 X נקודת הקשרים בתמונה X 4 (20XR). - לבטא את הקואורדינטות תא בתוך המלבן התוחם הקשרים (כחול באיור5) באמצעות הנוסחה הבאה:
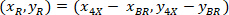
איפה: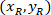 הם התא מרכזת בתוך המלבן התוחם הקשרים;
הם התא מרכזת בתוך המלבן התוחם הקשרים; 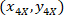 הן נקודות הציון של התא ב- 4 X הקשרים;
הן נקודות הציון של התא ב- 4 X הקשרים;  הם הקואורדינטות של המלבן התוחם הקשרים בתמונה X 4.
הם הקואורדינטות של המלבן התוחם הקשרים בתמונה X 4. - להפוך את הקואורדינטות תא בתוך המלבן התוחם הקשרים על האחוז של הרוחב והגובה של המלבן התוחם באמצעות הנוסחה הבאה:
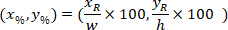
איפה: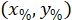 הם התא מרכזת את אחוז רוחב וגובה של המלבן התוחם;
הם התא מרכזת את אחוז רוחב וגובה של המלבן התוחם; 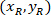 הם התא מרכזת בתוך המלבן התוחם הקשרים;
הם התא מרכזת בתוך המלבן התוחם הקשרים;  הרוחב של המלבן התוחם נמדד מעל הפרוטוקול; ו
הרוחב של המלבן התוחם נמדד מעל הפרוטוקול; ו 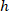 הגובה של המלבן התוחם נמדד לעיל בפרוטוקול.
הגובה של המלבן התוחם נמדד לעיל בפרוטוקול. - כדי לייצג כל הרשתות על אותה דמות, לקחת בחשבון את הכיוון של הפרוסה (בצד שמאל או ימין). כדי לתקנן את הנתונים, הקשרים מוחל על הצד השמאלי של הפרוסה. להעביר את רשת הקואורדינטות של הצד הימני בצד שמאל על-ידי החלת את הנוסחה הבאה רק קואורדינטות ה-x:
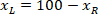
איפה: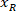 הוא קואורדינטת ה-x בצד ימין של הפרוסה; ו
הוא קואורדינטת ה-x בצד ימין של הפרוסה; ו 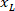 חדשה שבאה לידי ביטוי שלמות הקשרים על הצד השמאלי של הפרוסה קואורדינטת x.
חדשה שבאה לידי ביטוי שלמות הקשרים על הצד השמאלי של הפרוסה קואורדינטת x.
הערה: לחלופין, ראי את התמונה ImageJFIJI לפני הניתוח (תמונה | שינוי צורה | להפוך אופקית). - כדי לבטא את הקואורדינטות של וקטור הראשי של כיוון מועדף, בצע את השלבים באותו תא הציון (שלבים 6.5.3.1 כדי 6.5.3.4).
הערה: הביטוי של נקודות הציון באחוזים מאפשר אוסף של הנתונים כמו מגרש יחיד שבו הגרעין (NVsnpr) תוכנן כמלבן.
- לבטא את נקודות הציון של כל תא עם 4 X הקשרים (ריבוע שחור באיור5) באמצעות הנוסחה הבאה:
- היישור של 20 X ותמונות X 4
- חקר ההבדל זוויתי של וקטור הראשי של כיוון מועדף
הערה: ההבדל זוויתי של רשת astrocytic משמש כדי לקבוע אם ומגמתו מועדף לכיוון המרכז של הגרעין של עניין. כדי לחשב את ההפרש זוויתי (α באיור5), אשר היא הזווית בין הווקטור הראשי של כיוון מועדף של הרשת (PD, אדום קו באיור5) לבין הקו מתחבר P C, להחיל את משפט באל-קאשי לתוך המשולש PDC (ראה שיבוץ של איור 5 ושיטות משלים).- ראשית, לחשב באורכים שונים באמצעות היישום של פיתגורס לתוך קרטזית הקשרים באמצעות המשוואה הבאה:
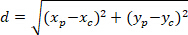
: איפה הקואורדינטות של P ו- C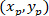 ,
,  , בהתאמה, בתוך המלבן התוחם הקשרים (החישוב לעיל).
, בהתאמה, בתוך המלבן התוחם הקשרים (החישוב לעיל). - לקבוע את ההבדל זוויתי ברדיאנים באמצעות הנוסחה הבאה:
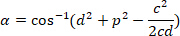
- להמיר את ההבדל זוויתי במעלות (למשל, באמצעות הפונקציה מעלות בתוכנת Excel).
- לקמפל את כל ההבדלים זוויתי ידי אותם בתרשימי עמודות אנכיות (איור 7C ו 7 D) ולקבוע אם יש כיוון מועדף של רשתות astrocytic.
- ראשית, לחשב באורכים שונים באמצעות היישום של פיתגורס לתוך קרטזית הקשרים באמצעות המשוואה הבאה:
תוצאות
צימוד בין תאים במוח אינו סטטי אלא מעדיף באופן דינמי מוסדר על ידי גורמים רבים. בשיטות המתוארות פותחו כדי לנתח רשתות astrocytic חשף בתנאים שונים, כדי להבין את הארגון שלהם ב- NVsnpr. תוצאות אלו היו כבר פורסם1. ביצענו biocytin מילוי האסטרוציטים יחיד בחלק הגבי של NVsnpr של שלושה מ?...
Discussion
קיימות מספר שיטות אלקטרופיזיולוגיות להערכת תפקודי צימוד בין האסטרוציטים23,24. עם זאת, שיטות אלה אינם מספקים מידע אודות הסידור האנטומי של רשתות astrocytic. מספר מחקרים הראו כבר כי "צבע - או מעקב-מצמד", כפי שנעשה כאן, מתרחשת רק בשבריר של מצמידים תאים שזוהו על-ידי שיטות...
Disclosures
המחברים אין לחשוף.
Acknowledgements
עבודה זו ממומנת על ידי קנדי מוסדות של בריאות המחקר, גרנט/פרס המספר: 14392.
Materials
| Name | Company | Catalog Number | Comments |
| NaCl | Fisher Chemicals | S671-3 | |
| KCl | Fisher Chemicals | P217-500 | |
| KH2PO4 | Fisher Chemicals | P285-500 | |
| MgSO4 | Fisher Chemicals | M65-500 | |
| NaHCO3 | Fisher Chemicals | S233-500 | |
| C6H12O6 Dextrose anhydrous | Fisher Chemicals | D16-500 | |
| CaCl2 dihydrated | Sigma | C70-500 | |
| Sucrose | Sigma | S9378 | |
| D-gluconic acid potassium salt | Sigma | G45001 | |
| MgCl2 anhydrous | Sigma | M8266 | |
| HEPES | Sigma | H3375 | |
| EGTA | Sigma | E4378 | |
| ATPTris Salt | Sigma | A9062 | |
| GTPTris Salt | Sigma | G9002 | |
| Biocytin | Sigma | B4261 | |
| Carbenoxolone disodium salt | Sigma | C4790 | |
| avidin-biotin complex : ABC kit | Vestor laboratories | PK-4000 | |
| Streptavidine-alexa 594 | Molecular Probes | S11227 | |
| Triton | Fisher Chemicals | BP151-500 | |
| Xylene | Fisher Chemicals | X5-1 | |
| Aqueous mounting medium 1 : Fluoromount-G | SouthernBiotech | 0100-01 | |
| Toluen-based synthetic resin mounting medium : Permount | Fisher Chemicals | SP15-100 | |
| Slide Drying Bench | Fisherbrand | 11-474-470 | |
| Vibratome | Leica | VT 1000S | |
| Microscope cover glass | Fisherbrand | 12-544A | |
| Microscope slide ColorFrost | Fisherbrand | 12-550-413 | |
| PFA | Fisherchemicals | 04042-500 | |
| Olympus FluoView FV 1000 Confocal microscope | Olympus | ||
| 40X water-immersion lens | Olympus | LUMPLFLN40XW | |
| 20X water-immersion lens | Olympus | XLUMPLFL20XW | |
| 4X water-immersion lens | Olympus | XLFLUOR4X/340 | |
| Micropipette puller | Sutter Instrument | P97 | |
| Micromanipulator | Sutter Instrument | MP 225 | |
| Camera CCD | Sony | CX-ST50 | |
| Black and white monitor | Sony | SSM-125 | |
| Digidata | Molecular devices | 1322A | |
| Patch Clamp amplifier | Axon instrument | Mulitclamp 700A | |
| Electrophysiology acquisition software | Molecular devices | pClamp 8 | |
| Electrophysiology analysis software | Molecular devices | Clampfit 8 | |
| Imaging analysis software | ImageJFIJI | Open source software. FIJI version including plug in package. | |
| Vector image editor | Adobe | Illustrator CS4 | |
| Spreadsheet application | Microsoft Office | Excel 2010 |
References
- Condamine, S., Lavoie, R., Verdier, D., Kolta, A. Functional rhythmogenic domains defined by astrocytic networks in the trigeminal main sensory nucleus. Glia. 66 (2), 311-326 (2018).
- Verkhratsky, A., Orkand, R. K., Kettenmann, H. Glial calcium: homeostasis and signaling function. Physiological Review. 78 (1), 99-141 (1998).
- Christensen, R. K., Petersen, A. V., Perrier, J. F. How do glial cells contribute to motor control?. Current Pharmaceutical Design. 19 (24), 4385-4399 (2013).
- Verkhratsky, A., Steinhauser, C. Ion channels in glial cells. Brain Research Review. 32 (2-3), 380-412 (2000).
- Harada, K., Kamiya, T., Tsuboi, T. Gliotransmitter Release from Astrocytes: Functional, Developmental, and Pathological Implications in the Brain. Frontiers Neuroscience. 9, 499 (2015).
- Montero, T. D., Orellana, J. A. Hemichannels: new pathways for gliotransmitter release. Neuroscience. 286, 45-59 (2015).
- Araque, A., et al. Gliotransmitters travel in time and space. Neuron. 81 (4), 728-739 (2014).
- Augustin, V., et al. Functional anisotropic panglial networks in the lateral superior olive. Glia. 64 (11), 1892-1911 (2016).
- Houades, V., Koulakoff, A., Ezan, P., Seif, I., Giaume, C. Gap junction-mediated astrocytic networks in the mouse barrel cortex. Journal of Neuroscience. 28 (20), 5207-5217 (2008).
- Roux, L., Benchenane, K., Rothstein, J. D., Bonvento, G., Giaume, C. Plasticity of astroglial networks in olfactory glomeruli. Proceedings of the National Academy of Science of the United State of America. 108 (45), 18442-18446 (2011).
- Morquette, P., et al. An astrocyte-dependent mechanism for neuronal rhythmogenesis. Nature Neuroscience. 18 (6), 844-854 (2015).
- Brocard, F., Verdier, D., Arsenault, I., Lund, J. P., Kolta, A. Emergence of intrinsic bursting in trigeminal sensory neurons parallels the acquisition of mastication in weanling rats. Journal of Neurophysiology. 96 (5), 2410-2424 (2006).
- Anders, S., et al. Spatial properties of astrocyte gap junction coupling in the rat hippocampus. Philosophical Transactions of the Royal Society of London. Series B, Biological Science. 369 (1654), (2014).
- Houades, V., et al. Shapes of astrocyte networks in the juvenile brain. Neuron Glia Biology. 2 (1), 3-14 (2006).
- Rouach, N., Koulakoff, A., Abudara, V., Willecke, K., Giaume, C. Astroglial metabolic networks sustain hippocampal synaptic transmission. Science. 322 (5907), 1551-1555 (2008).
- Claus, L., et al. Barreloid Borders and Neuronal Activity Shape Panglial Gap Junction-Coupled Networks in the Mouse Thalamus. Cerebral Cortex. 28 (1), 213-222 (2018).
- Cameron, M. A., et al. Prolonged Incubation of Acute Neuronal Tissue for Electrophysiology and Calcium-imaging. Journal of Visualized Experiments. (120), (2017).
- Kafitz, K. W., Meier, S. D., Stephan, J., Rose, C. R. Developmental profile and properties of sulforhodamine 101--Labeled glial cells in acute brain slices of rat hippocampus. Journal of Neuroscience Methods. 169 (1), 84-92 (2008).
- Neher, E. Correction for liquid junction potentials in patch clamp experiments. Methods in Enzymology. , 123-131 (1992).
- Giaume, C., Leybaert, L., Naus, C. C., Saez, J. C. Connexin and pannexin hemichannels in brain glial cells: properties, pharmacology, and roles. Frontiers in Pharmacology. 4, 88 (2013).
- Torres, A., et al. Extracellular Ca(2)(+) acts as a mediator of communication from neurons to glia. Science Signaling. 5 (208), ra8 (2012).
- Ye, Z. C., Wyeth, M. S., Baltan-Tekkok, S., Ransom, B. R. Functional hemichannels in astrocytes: a novel mechanism of glutamate release. Journal of Neuroscience. 23 (9), 3588-3596 (2003).
- Ma, B., et al. Gap junction coupling confers isopotentiality on astrocyte syncytium. Glia. 64 (2), 214-226 (2016).
- Meme, W., Vandecasteele, M., Giaume, C., Venance, L. Electrical coupling between hippocampal astrocytes in rat brain slices. Neuroscience Research. 63 (4), 236-243 (2009).
- Ransom, B. R., Kettenmann, H. Electrical coupling, without dye coupling, between mammalian astrocytes and oligodendrocytes in cell culture. Glia. 3 (4), 258-266 (1990).
- Audesirk, G., Audesirk, T., Bowsher, P. Variability and frequent failure of lucifer yellow to pass between two electrically coupled neurons in Lymnaea stagnalis. Journal of Neurobiology. 13 (4), 369-375 (1982).
- Ewadinger, N., Syed, N., Lukowiak, K., Bulloch, A. Differential Tracer Coupling between Pairs of Identified Neurones of the Mollusc Lymnaea Stagnalis. Journal of Experimental Biology. 192 (1), 291-297 (1994).
- Griemsmann, S., et al. Characterization of Panglial Gap Junction Networks in the Thalamus, Neocortex, and Hippocampus Reveals a Unique Population of Glial Cells. Cerebral Cortex. 25 (10), 3420-3433 (2015).
- Kuwajima, T., et al. ClearT: a detergent- and solvent-free clearing method for neuronal and non-neuronal tissue. Development. 140 (6), 1364-1368 (2013).
- Gourine, A. V., et al. Astrocytes control breathing through pH-dependent release of ATP. Science. 329 (5991), 571-575 (2010).
- Forsberg, D., Ringstedt, T., Herlenius, E. Astrocytes release prostaglandin E2 to modify respiratory network activity. eLife. 6, (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved