Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Boyut, şekil ve yön ağlar yönetim eşleşmiş Astrocytes analiz
Bu Makalede
Özet
Burada astrositik ağlar organizasyonu değerlendirmek için bir protokol mevcut. Açıklanan yöntemi hücre sayısı, boyutu, alan ve bir çekirdek içinde pozisyon gibi bu ağların açıklayıcı ölçüleri sağlamak için önyargı en aza indirir. Anizotropi vektörel bir analizi ile değerlendirilir.
Özet
Astrocytes nöronal fonksiyon sadece sinaptik ve tek hücre düzeylerinde, aynı zamanda ağ düzeyinde modüle giderek netlik kazanmıştır. Astrocytes güçlü boşluğu kavşak birbirine bağlı ve kaplin yoluyla bu kavşaklar dinamik ve son derece düzenlenir. Astrositik işlevleri uzmanlaşmış ve bunların ilişkili olduğu nöronal devre fonksiyonları için uyarlanmış bir ortaya çıkan kavramdır. Bu nedenle, astrositik ağların çeşitli parametreleri ölçmek için yöntemler daha iyi iletişim yöneten ve kaplin kuralları tanımlamak için ve daha işlevlerini anlamak için ihtiyaç vardır.
Burada, görüntü analiz yazılımı kullanarak (Örn., ImageJFIJI), astrositik ağlar boya-kaplin tarafından ortaya confocal görüntülerini analiz etmek için bir yöntem açıklanmaktadır. Bu yöntemler 1) bir otomatik ve tarafsız algılanması için etiketli hücreleri, ağlar, 3) 4) ilgi alanı içinde ağının yeniden konumlandırma ve ağ içindeki yaymak boya Tercihli yönünü hesaplama hesaplama 2) olanak sağlar .
Bu analiz belirli bir alanda astrositik ağları karakterize, ağları farklı alanlar için farklı işlevler ilişkili karşılaştırmak veya bağlantı üzerinde farklı etkiler farklı koşullar altında elde edilen ağlar karşılaştırmak için kullanılabilir. Bu gözlemler için önemli işlevsel konuları açabilir. Örneğin, biz nereye biz daha önce astrositik kaplin nöronlar tonik onların ateş desenlerini ritmik patlama1' e geçiş yapma yeteneği için gerekli olduğunu göstermiştir trigeminal çekirdeği, astrositik ağlar analiz. Boyutunu, lohusalık ve bu çekirdek astrositik ağlarda Tercihli yönünü ölçerek, onlar çemberlemek işlevsel etki alanları hakkında hipotezler inşa edebilirsiniz. Çeşitli çalışmalarda varil korteks, yanal üstün zeytin, koku glomeruli ve duyusal çekirdeği talamus ve bir kaç isim için görsel korteksin'de dahil olmak üzere çeşitli beyin bölgeleri benzer bir analizinden yararlanabilir öneririz.
Giriş
Birçok çalışma alt hücresel veya sinaptik düzeyinde nöron-astrocyte diyalog nöronal işlevleri ve sinaptik iletimi nasıl olabilir anlatmıştık. De astrocytes nöronal aktivite çevreleyen duyarlıdır kurulur; Aslında, onlar için glutamat, GABA, asetilkolin ve ATP (daha önce yayımlanmış değerlendirmeleri2,3,4bakınız) de dahil olmak üzere birçok nörotransmitter reseptörlerinin var. Buna karşılık, astrositik ensheath sinaptik öğeleri ve etkisi nöronal aktivite var ve extrasynaptic sitelerdeki ekstraselüler iyonik homeostazı düzenleyen ve çeşitli faktörler veya vericileri glutamat, D-serin ve ATP gibi serbest işler 5 , 6 , 7.
Astrocytes Ayrıca ağ düzeyinde nöronal fonksiyon modüle fikir, astrositik kaplin dağınık şekilde düzenlenmiştir ve karşılık gelen nöronal segmentasyon alanlarda açık anatomik tarafından karakterize kanıtlarla ortaya çıkmıştır Bölünebilme (gibi alanlarda duyusal temsilcilikleri ile), astrocytes diğer astrocytes aynı işlevi yerine sadece o kadar da yakın hizmet veren çift gösteren. İçinde varil korteks veya olfactoty glomeruli, astrocytes arasındaki iletişimi varil ya da glomeruli içinde çok daha güçlü ise yanal üstün olive, mesela en astrositik ağları uygun tonotopic eksen8' e, odaklı ve zayıf bitişik olanlar9,arası10. Her iki durumda da, astrositik ağlar glomerule veya varil9,10merkezine doğru odaklı vardır.
Biz son zamanlarda astrositik faaliyet nöronal ateş konsantrasyonu hücre dışı Ca2 + azaltarak gelen gösterdi ([Ca2 +]e), S100β, bir Ca2 +sürümü ile muhtemelen-protein11bağlama. Çekirdek (NVsnpr, masticatory hareketleri üretiminde önemli bir rol oynamaktadır düşünülen), sonuçları aslında trigeminal rhythmogenic nöronların trigeminal ana duyusal sırt kısmında bir popülasyondaki sunuldu bu etki bu Bu nöronlar ritmik ateş etmeye [Ca2 +]e11,12azalır tarafından teşvik bir kalıcı Na+ geçerli bağlıdır. Bu nöronlar ritmik ateş etmeye "fizyolojik" girişleri uyarılması veya yapay [Ca2 +]eazalma elicited. Biz daha fazla astrositik kaplin nöronal ritmik ateş1için gerekli olduğunu gösterdi. Bu olasılığını astrositik ağlar nöronal aktivite nerede senkronize ve koordine sinirlari belirli işlevsel etki alanları oluşturmak kaldırdı. Bu hipotezi değerlendirmek için ilk ciddi bir şekilde NVsnpr içinde bu ağların kuruluş belgelemek için bir yöntem geliştirmeye ihtiyacımız vardı.
Astrositik ağlarda önceki çalışmalar çoğunlukla kaplin cep telefonu numarasını ve yoğunluğu ve bölgeyi açısından ölçüde anlatmıştık. Astrositik ağlar şekli ve boya-kaplin yönünü değerlendirmek için girişimleri çoğunlukla iki eksen (x ve y) varil cortex9, hipokampus13,14, boyunca ağların boyutu karşılaştırarak gerçekleştirilmiştir 15, talamus16, yanal üstün zeytin8, koku glomeruli10ve korteks14barreloid alanlarında. Yöntem tanımlamak burada bir ağ etiketli hücrelerinin tarafsız sayıları ve çevrenin onlar kapağı bir tahmin sağlar. Ayrıca bir ağ içinde bağlantı tercih edilen yönünü belirtin ve tercih edilen yönlendirme merkezi çekirdeği veya farklı bir yöne doğru olup olmadığını değerlendirmek için araçlar geliştirdi. Önceden kullanılan yöntemleri ile karşılaştırıldığında, bu iletişim kuralı organizasyon ve dorsal trigeminal ana duyusal çekirdeği gibi bilinen bir açık anatomik var mı yapılarda astrositik ağlar yönünü açıklamak için bir yol sağlar. Bölünebilme. Yukarıdaki çalışmalarda, ağ yönlendirmesini şekil zaten belgelenen yapının kendisi bir ilişki olarak açıklanan (Örn., varil korteks, talamus barreloid katmanlar hipokampus ve korteks, glomeruli içinde olfaktör ampul, vb). Buna ek olarak, farklı koşullar altında ortaya yönelimleri kaplin karşılaştırmalar için vektörel analiz sağlar. Bu parametreler ağ çekirdek içindeki konumuna göre değişiklik olup olmadığını çözümlemek için Ayrıca her ağ referans olarak çekirdek sınırları değiştirmek için bir yöntem geliştirdi. Bu araçların kolayca diğer alanlar eşleşmiş hücre soruşturma ağlar için adapte edilebilir.
Protokol
Tüm yordamlar tarafından Kanada Sağlık araştırma enstitüleri kuralları abode ve Montreal Üniversitesi hayvan bakımı ve kullanımı Komitesi tarafından kabul edildi.
1. sıçan Beyin dilimleri hazırlanması
- 1 litre sükroz tabanlı bir çözümü (Tablo 1) ve standart yapay beyin-omurilik sıvısı (aCSF) (Tablo 2) 1 litre hazırlamak.
- % 95'i O2 ve %5 CO2 (carbogen) için 30 dk karışımı ile sükroz tabanlı çözüm çözüm soğuk ama tamamen donmuş olana bu yaklaşık 30 dk,-80 ° C'de yerleştirmeden önce kabarcık. Bu buz gibi sükroz beyni Dilimleme Kesim tampon olarak kullanın. Dondurucudan kaldırıldıktan sonra buz üzerinde tutun.
- ACSF carbogen tüm deneyi ile kabarcık. Bu çözüm için dilim depolama ve yama sıkma ve biocytin-dolgu astrocytes yapıldığı perfusing tampon olarak kullanın. En kısa zamanda onlar kesilir Beyin dilimleri yatırmak odası tutan bir dilim kurtarma hazırlayın.
Not: Dilim kurtarma holding odası özel yapım olabilir ve aslında bir küçük iyi bir kafes içinde alttan carbogen getirmek için bir tüp takılı olduğundan aCSF ile dolu büyük bir kuyu içinde alt ile oluşur. - 15 - için 21-bayat Sprague-Dawley rat herhangi bir seks ya da zorlanma özel önyargı olmadan kullanın. Hayvan isoflurane (isoflurane bir anestezi indüksiyon odasında 1 mL) ile anestezi. Anestezi derinliği hafifçe arka pençe veya kuyruk hayvan pinching tarafından kontrol edin.
- Fareyi kullanarak bir giyotine başını kesmek, onun kafatası makasla kesme ve beyin kafatası düz bir spatula ile hızlı bir şekilde kaldırmak.
- 30 s ve transfer hakkında kendisine (Çözümle) bir petri çanağı için buz gibi sükroz tabanlı çözüm beyinde daldırma. Bir jilet ile anterior ve posteiror kesitli için alana kısımları kaldırmak kesme transvers düzlemde dilimler.
- Beyin dokusu rostral kendi tarafında kalan bloğunu tutkal ve beyin dilimleri (350 µm kalınlığında) bir vibratome kullanarak sükroz tabanlı ortamda kesmek için devam edin. O zaman, carbogenated aCSF, oda sıcaklığında (RT) kadar kullanılmak üzere hazır dolu odası tutan bir kurtarma toplanan dilimleri transferi (en az 1 saat kurtarma için izin).
Not: Alanındaki son gelişmeleri uzun süreli kuluçka kadar izin 24 h vitro beyin dilim koşulları17.
2. Sulforhodamine 101 Astrocytes (SR-101) etiketleme
- Önceden bir su banyosu ile 34 ° C ısı ve iki dilim kuluçka odaları yerleştirin. Bir dilim kuluçka chambers 1 mikron içeren aCSF bir çözüm ile doldurmak SR-101 ve diğer sadece aCSF ile doldurun.
- 1 µM içeren kuluçka odasında dilimleri kuluçkaya SR-101 20 min ve o zaman transferi onlara ikinci kuluçka odası aşırı SR-101 kimden doku dışarı durulama için. 20 dk için kuluçkaya izin veya daha 34 ° C'de, o zaman tutmak onlar kadar RT, dilimler içeren kuluçka odası18gerekli.
3. astrocyte yama ve Biocytin dolum
- Bir dilim seçin ve mikroskop kayıt odasında yerleştirin. Astrocytes patch, elektrotlar 4-6MΩ potasyum glukonat dayalı bir çözüm ile dolu bir direnç ile kullanmak için (bkz. Tablo 3).
- Görsel rehberlik ve bir micromanipulator kullanarak altında kayıt elektrot bir SR-101-etiketli astrocyte Şekil 1' de gösterildiği gibi doğru yönlendirin. Onlar daha fazla zarar görmüş veya bağlantıları komşu hücrelere kaybetmiş olasılığı olduğundan dilim yüzeyde bulunan hücreleri kaçının.
- Biocytin doku kaçağı önlemek için yama pipet eklendi pozitif basınç en aza indirmek ve yalnızca yamalı olabilir astrocyte yakın olduğunda uygulanacak (0,1-0.4 mL şırınga 1 ml).
- Yama önce pipet ve onun kapasitans uzaklığı ayarlayın. Doğru ve hassas voltaj komutları için deneyler19kritik olduğundan sıvı kavşak potansiyeller için düzeltin.
- Pipet yeterince pozitif basınç nedeniyle depresyon gözlemlemek için astrocyte yakın hareket. O zaman, pozitif basınç kaldırmak ve yavaş yavaş bazı negatif basınç uygulayın. -70 için astrocyte kelepçe mühür 100 MΩ ulaştığında mV. 1-3 GΩ mühür ulaşıncaya kadar bekleyin. Hücre içine breaking kadar negatif basınç uygulamaya devam. Astrocytes çok hassas olduğundan negatif basınç uygularken dikkatli olun.
- Yamalı hücresinin elektrofizyolojik özelliklerini değerlendirmek. Gerilim tipi kelepçe modunda, tüm hücreli akım-gerilim protokolü için 110 -120 değişen 600 ms süresinin bir rampa gerilim komutla gerçekleştirmek mV. Geçerli-kelepçe modunda 1000 ms geçerli adımları 100 PA -1 den 1 nA, tüm hücreli kayıtları örnekleme oranı için enjeksiyon 10 kHz olduğu bir adım IV protokol gerçekleştirin.
Not: Astrocytes her türlü ( Şekil 1Badımında gösterildiği gibi) düzeltme ve membran depolarizasyon (Şekil 1 c) ateş yok Aksiyon potansiyeli olmayan bir doğrusal akım-gerilim profilini göster. İstirahat membran potansiyeli (RMP)-meli var olmak istikrarlı ve için - 60mV olumlu değil. Bazı beyin bölgelerde astrocytes RMP içinde NVsnpr daha hyperpolarized. - Astrocyte 30 dk içinde bir adım IV protokolü her 5 dk gerçekleştirirken diffüz biocytin izin verir.
- Geri çekmek ve yama pipet dikkatle yamalı astrocyte zarar vermeden bağlantısını kesin ve hemen pipet uzaklığı kayıt odadan çekmeden önce dikkat edin. Bu değeri membran potansiyeli kayıtlarından çıkarma.
- Beyin dilim yamalı astrocyte üzerinden izleyici tüm ağa eşleşmiş hücrelerinin Yayilim izin vermek için en az 15 dk (ek 30 dk enjeksiyon için) kayıt odasında dinlenmeye bırakın.
Not: bir ağ eşleşmiş hücre ortaya çıkarmak için sadece tek bir hücre faiz çekirdeğinde uygulanması. Başarılı bir yama elde etmek için birden çok deneme gerekiyorsa, davayı iptal et ve kontralateral tarafında veya başka bir beyin dilim yama çalışın. - Dilimin hangi tarafı yukarı bakacak şekilde tanımlamak için dokusunda bir işareti veya kesi yapmak ve dilimi ilk normal aCSF, o zaman %4 paraformaldehyde (PFA) bir çözümde içeren petri kabına aktarın. 4 ° C'de dilim gecede kuluçkaya.
Dikkat: İngiltere'de yılın son derece zararlıdır. Koruyucu ekipman havalandırılmış bir mahallede kullanın. PFA ile temas halinde olan tüm malzemeler (fırçalar, tüpler, vb) odası, kuluçka odası veya taze doku kaydetmek için kullanılan diğer malzemeler tutan kurtarma ile değil emin olun.
4. Biocytin Vahiy
- Vahiy ile floresan streptavidine
- Beyin yıkama RT., 0.1 M fosfat tampon serum (PBS) içinde 2 x 10 dk dilimler O zaman, biocytin bir fluorophore ile % 4 non-iyonik deterjan RT. 4 h için PBS içinde 1/200 seyreltme, Birleşik streptavidine ile beyin dilimleri kuluçka tarafından ortaya
- RT, 0.1 M PBS beyin dilimler 3 x 10 dk yıkayın ve bölümleri cam slaytlara bir sulu montaj orta kullanarak bağlayabilirsiniz. Yukarı doğru coverslip enjekte edildi taraf slaytları yerleştirin ve onları tırnak-cila ile mühür.
- Vahiy ile DAB
Not: DAB (3,3-diaminobenzidine) vahiy floresans kullanıldığında kullanılabilir. Bu durumda, yalnızca bir vahiy yöntemi karşılaştırmaları yapmak için istihdam edilmelidir.- 3 x 10 dk içinde RT. adlı PBS Beyin dilimleri RT. 1 saat2O%2 0.5 PBS + H dilimleri kuluçkaya yıkama
- PBS, RT. dilimler 3 x 10 dk durulama O zaman, kuluçkaya dilimleri PBS ve %0,1 non-iyonik deterjan + avidin-biotin karmaşık peroksidaz standart boyama seti reaktifler 1/100 RT. 24 saat oluşan bir çözümde avidin-biotin karmaşık boyama
- PBS RT, dilimler 3 x 10 dk durulama, onları PBS bir çözümde kuluçkaya + RT %0.05 20 dk için DAB ve onları PBS bir çözümde transfer + %0,05 + H2O%2 0.5 DAB.
Dikkat: DAB son derece zararlıdır. Koruyucu ekipman havalandırılmış bir mahallede kullanın. Zaman dilimleri içinde PBS aktarılır renk reaksiyonu durdurulur. - PBS RT, dilimleri 5 x 10 dk durulama, bölümleri (yüz yukarı doğru enjekte edildi taraf) cam slaytlarda takma ve onlara bir slaytta tezgah gecede 34 ° C'de kurutma makinası
- Ksilen 1 dk 1 dk içinde banyo ile % 70, % 95'i ve % 100 ve sonunda birkaç alkol hamam cam slaytlarını daldırın.
- Orta montaj bir Toluen-sentetik reçine bazlı kullanarak cam slaytlar bağlayın. Coverslips slaytlar üzerine yerleştirin ve onları tırnak vernik ile mühür.
5. ağ görüntüleme
- Astrositik ağları tarama confocal mikroskop 20 X ve 4 X hedefleri (veya ağ nerede tüm çekirdeği görselleştirmek için uygun bir amaç ile) donatılmış kullanarak görselleştirmek ve fluorophore tespit etmek için bir lazer (Bu durumda, Alexa-594 olduğunu kullanılan).
- 20 X büyütme etiketli hücre ağ yığınını z olun 12.5 μs/piksel hızı tarama ve 800 x 800 piksel çözünürlük kullanın.
Not: tüm ağ görüntü için birden çok yığınları genellikle gereklidir ve yığın sayısından her ağ için ayarlanması gerekiyor. Çözünürlük ve inceden inceye gözden geçirmek hız, tüm veri görüntü için aynı ayarları kullandığınızdan emin olun değiştirilebilir. - 4 X büyütme ağ ve faiz bölgesinin görüntülerini almak için kullanın.
Not: 4 X görüntüleme ilgi içinde çekirdek ağ konumunu belirlemek için kullanılır. Her zaman alanındaki iletilen ışık görüntü. Bu görüntü confocal floresan görüntü çekirdeğinde kenarlığını belirleyemiyorsa faydalı olacaktır.
6. görüntü analizi
- Veri hazırlama
- Kullanma bilgisayar yazılımı ImageJFIJI (https://fiji.sc/ indirebilirsiniz). Dosyayı açıp "Biyo-formatları içe aktarma seçenekleri" penceresinde Tamam'ı tıklatın.
- Sadece son z-yığın için (Şekil 2A) gerekli optik dilimler içeren bir z yığın yeniden tanımlamak için "Yığın" düğmesi araç çubuğunda tıklayın (bulmak için önce stk seçin | Z Projesi). "Max yoğunluğu" projeksiyon yazın (Şekil 2A) ayarını seçin. Dosyayı kaydedin ve "dosya yığını" adını verin.
- Görüntü dosyası birkaç kanalları içeriyorsa, yalnızca Kanal astrositik ağ görüntüleme ile tasarruf etmek için split (görüntü | Renk | «««Split) kanalları.
- Görüntü piksel ayarlarını kontrol edin [resim | Özellikleri | Piksel ("1" piksel boyutu için ile)].
- Çıkarma arka plan aracını kullanın (işlem | Arka plan çıkarmak) biocytin etiketleme arka plan çıkarmak. Genellikle 50 piksel (Şekil 2B) ayarlanır haddeleme topu yarıçapı ayarlamak için Önizleme işlevini kullanın.
- Kaldır outliers aracını kullanın (işlem | Gürültü | Outliers kaldırmak) çıkarma arka plan adım takip gerekli ise. "Parlak" "Hangi Outliers" ayarında (Şekil 2C) seçin. RADIUS ve eşik ayarlamak için Önizleme işlevini kullanın. Verileri, Şekil 2Bolarak gösterildiği gibi bulanıklık bu yana bu araç ile dikkatli ol.
Not: Bu araç streptavidine belirsiz mevduat tarafından ( 2B şekil ve 2 C beyaz ok işlemden, önce ve sonra sırasıyla görüldüğü gibi) neden olduğu küçük noktalar kaldırır. - Eşik ayarlayın (görüntü | Ayarlamak | Eşik). "Varsayılan" ve "siyah-beyaz" modu (Şekil 2E) seçin. Tıkırtı üstünde "uygulamak".
Not: Otomatik ayarlama kullanılabilir, ancak el ile ayarlama iki kaydırma çubuklarıyla tercih edilir. Bu adım, etiketli hücreleri kaybetmeden maksimum gürültüyü azaltmak için amaçtır. - İkili işlem aracı ile ikili bir resim görüntü dönüştürmek (işlem | İkili | İkili olun) Şekil 2Fiçinde gösterildiği gibi. Dosyayı TIFF dosyası olarak kaydedin ve "ikili dosya" adını koy.
- Hücre sayımı
- Kontrol belgili tanımlık koyma ölçü işlevinin (Analyze | Set ölçüm). "Centroid" seçeneğini seçin.
- "İkili dosyada" "Parçacıklar analiz" aracını kullanın (Şekil 3A) üretilen önceki adımda (Analyze | Parçacık analiz) (Şekil 3 c solda). "Ana hatlarıyla" "Show" ayarında (Şekil 3 c) seçin. Bu algılama (Şekil 3B) sonucunu gösterir yeni bir dosya oluşturur.
- Parametreleri ile oynamak: boyutu (yalnızca hücreleri bulmak için 30 ila 6000 arasında değerleri kullanın) ve (bir aralığını belirlemek için 0-1, hangi "1" tam bir daire ve tanımlar "0" rasgele bir şekil) döngü algılama (Şekil 3 c,) bölümü yaptı iyileştirmek için. Algılama yanında tıkırtı "OK" çalıştırın.
Not: Algılama aşağıdaki iki tablo görünür: algılanan hücreleri sağlayan "Özet" başlıklı 1) bir tablosunun ve "Sonuçlar" (Şekil 3 c, doğru bölümü) başlıklı 2) bir tablo x - ve y-koordinatlarının her hücrenin sağlar. - Değerleri kopyalamak ve bir elektronik tablo uygulaması yapıştırabilirsiniz. Bu tablo "algılama tablo" adı altında kaydedin. Bir komplo algılanan hücre içeren bir dosyayı da (Şekil 3B) görünür. Bu dosyayı "algılama dosya" adı altında bir TIFF dosyası olarak kaydedin.
- Analiz parçacıklar aracı ile tek bir hücre oldukları için çok yakın olarak birbirlerine bir grup 2 veya daha fazla etiketli hücre ağ algılanmazsa, havza aracını kullanın (işlem | İkili | Analiz parçacıklar uygulamadan önce dönüm noktası) ikili görüntü aracı ve analiz parçacıklar adımları yeniden.
Not: Havza Aracı 1 piksel arasında son derece yakın hücreleri geniş bir ayırma oluşturur. Bir hücre sayaç eklentisi can var olmak kullanılmış ne zaman etiketleme kesin ve el ile yapılabilir.
- Astrositik ağ alan ölçme
- Ağlar yüzey alanı ölçmek için görüntü J. kullanarak algılama dosyasını kullanın
- Çokgen seçim aracını (sol tıkırtı üstünde seçmek için araç çubuğunda düğme) tüm hücreleri bağlayan bir çokgen ağ (Şekil 4A) dış çevre içinde bulunan izlemek için kullanın. Çokgen izleme başlatmak için sol tıklayın ve kapatmak için sağ tıklatın.
Not: Bu Çokgen faiz (ROI) bir bölge olarak tanımlanır ve yüzeyi ağ yüzey alanını belirlemek üzere ölçülecek. - Küme ölçüm penceresini açın (Analyze | Ölçüm ayarla) ve "Alan" seçeneğini belirleyin. ROI Yöneticisi'ni açın (analiz | Araçlar | ROI Yöneticisi) (Şekil 4B). Ardından, '' ekle '' (Şekil 4B) tıklatarak ROI Yöneticisi'nde izlenen Çokgen ekleyin ve ölçüm ROI Yöneticisi'nde '' ölçü '' tıklayarak çalıştırın.
Not: Alan ölçüm bir tabloda görüntülenir ve piksel cinsinden ifade edilebilir. Bu değeri bir değer μm kalınlığında2elde etmek için kullanılan mikroskop için dönüştürme faktörü ile dönüştürmek unutmayın.
- Ana yön vektör belirlenmesi
- Yamalı hücre belirlenmesi
- ImageJFIJI içinde yığın dosyasını açın ve daha güçlü etiketleme şiddeti üzerinde (Şekil 4 c) bağlı olarak yığın dosyasını yamalı hücrede tanımlamak. Sonra bir elektronik tablo uygulamasında "algılama tablo" adlı dosyayı açın ve yamalı hücre ve karşılık gelen koordinatları ile ilişkilendirilen numarasını bulun.
- İse doğru yamalı hücre belirlemek, biocytin para yatırma eşleşmiş hücre, ImageJFIJI, Çokgen aracını kullanarak görüntülü ağındaki daha yoğun nerede etrafı sarın ve yamalı hücre (Şekil 4 d) olarak bu duruma bakın.
- ROI Yöneticisi'ni kullanın (analiz | Araçlar | ROI Yöneticisi). Sonra bir yatırım getirisi yamalı hücre konumu çizmek ve yatırım getirisi yöneticisine Ekle (bkz. Şekil 4B).
- Bir ölçüm ayarla (Analyze | Ölçüm ayarla) ve "Centroid" seçeneğini belirleyin.
- ROI Yöneticisi'nde izlenen çevrenin centroid koordinatlarını elde etmek için "ölçü"'ı tıklatın. Bu koordinatlar, bu belirli ağ için referans noktası olarak kullanın.
- Bilgi tutarlılığına çeviri
- Yamalı astrocyte referans olarak her hücre koordinatlarını aşağıdaki formülü kullanarak hesaplar:

İle: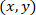 olarak koordinatları için belirli bir hücrenin;
olarak koordinatları için belirli bir hücrenin; 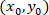 olarak koordinatları yamalı hücrenin (veya ağ başvuru noktası); ve
olarak koordinatları yamalı hücrenin (veya ağ başvuru noktası); ve 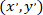 yeni başvuru belirli bir hücre için koordinatları olarak.
yeni başvuru belirli bir hücre için koordinatları olarak.
Not: yamalı astrocyte vektörlerinden hesaplanmasında önemli bir adım olduğunu yamalı astrocyte referans olarak her hücre koordinatlarını dile getirdi. ImageJFIJI kullanırken dikkatli olun herhangi bir görüntü için bilgi tutarlılığına görüntünün sol üst köşesinde bulunur.
- Yamalı astrocyte referans olarak her hücre koordinatlarını aşağıdaki formülü kullanarak hesaplar:
- Ana vektör Tercihli yönünün belirlenmesi
- Aşağıdaki formül ile Tercihli yönlendirme ana vektörünü koordinatları hesaplayın:
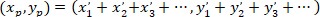
İle: (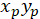 ) Tercihli yönelim; ana vektörünü koordinatları olarak ve
) Tercihli yönelim; ana vektörünü koordinatları olarak ve 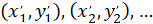 yamalı ile elde edilen ağ her hücresini koordinatları olarak hücre olarak başvuru.
yamalı ile elde edilen ağ her hücresini koordinatları olarak hücre olarak başvuru.
Not: ağ her hücre için bir vektör yamalı astrocyte koordinatları göreli olarak belirlenir. Ağ Tercihli yönünü ana vektör bu vektörel çizimler toplamıdır. - (Yukarıdaki formül kullanılarak elde koordinatları tarafından sağlanan) ana Yöneyin uzunluğu eksi bir yana (yamalı hücre koordinatlarını dahil değildir), ağ hücre sayısı bölün değerleri normalize ve arasındaki karşılaştırmaları etkinleştirmek için ağlar. Bu analiz şematik Şekil 5' te gösterilmektedir.
- Aşağıdaki formül ile Tercihli yönlendirme ana vektörünü koordinatları hesaplayın:
- Yamalı hücre belirlenmesi
- Faiz çekirdeği analiz ağlarda yerleşimini
- 20 X ve 4 X resim hizalama
- 4 X resim faiz (NVsnpr) çekirdeği her ağ konumunu belirlemek için kullanabilirsiniz. 4 X görüntüyü bir vektör resim editörü ile açın.
- 4 X görüntü seçin ve 5 tarafından çarparak boyutunu değiştirebilirsiniz. Boyutu penceresi üst yatay araç sağ kısmında yer alır. Örneğin, 4 X görüntü için örnek 800 x 800 piksel, örnekleme çözünürlüğü 4000 x 4000 piksel olarak değiştirmek (numune piksel olarak ayarlamak için "Belge ayarları" altında Dosya sekmesine gidin: dosya | Belge Ayarları). Dosyayı TIFF formatında ve bu "4 X yeniden boyutlandırılabilir" adı verin.
- Görüntü sol üst köşesi ile Adobe Illustrator belgesini sol alt köşesine hizalayın.
Not: Yazılımın koordinatlarından bir sol alt köşesindeki başvuru noktası sağlar. - Ağ 20 X görüntü açın. Çünkü onlar hizalamak daha kolay '' ikili dosya '' veya '' algılama dosyasını '' kullanın. O zaman, opaklık aracıyla yeniden boyutlandırılmış 4 X ile hizalamak için 20 X görüntü '' ikili dosya '' oynamak görüntü.
Not: Üst yatay araç çubuğunda Opaklık araçtır. - Hizalama olduğunda, seçin ve ölçü aracı görünecek şekilde pipet araç tutun ve sol araç çubuğunda seçin.
- 20 X koordinatları başvuru almak 20 X görüntünün sol üst köşesini tıklatın için ölçü aracını yeniden boyutlandırılmış 4 X gelin kullanım görüntü.
Not: 20 X bilgi tutarlılığına (20XR Şekil5) olarak adlandırılır, bu koordinatlar çekirdeği çizim bir şematik her ağ konumunu ifade etmek için faydalı olacaktır.
- Normalleştirme ilgi çekirdeği
Not: çekirdek (NVsnpr) bir normalleştirme bir dikdörtgen olarak verileri özetlemek için kullanılır. Adımları aşağıda açıklanmıştır.- Açık 4 X ImageJFIJI dosyasında yeniden boyutlandırılabilir ve Çokgen aracı çekirdek (NVsnpr) için kullanılır. Çekirdek sınırları görülmesi mümkün değilse görüntü ile iletilen ışık kullanımı; Bu durumda, ilk yeniden boyutlandırmak hatırlıyorum.
- ROI Yöneticisi'ni açın ve çizilmiş yatırım getirisi ekleyin. "Ayarla ölçümü", '' sınırlayıcı dikdörtgen '' seçeneğini belirleyin.
Not: "Sınırlayıcı dikdörtgen" seçeneği en küçük dikdörtgenin etrafında çizilmiş çekirdeği hesaplar. - "Ölçü"'ı tıklatın.
Not: BX ve BY, dikdörtgenin sol üst köşesine koordinatlarını içeren bir tablo görünür: '' dikdörtgen pozisyon '' ve genişlik ve yükseklik sağlar. BX ve BY vardır olarak adlandırılır sınırlayıcı dikdörtgen başvurusal koordinatlarını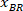 ve
ve 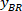 .
.
- Normalleştirilmiş çekirdek her ağ konumu ifade
- 4 X bilgi tutarlılığına ( Şekil5 siyah kare) her hücre koordinatlarını hızlı aşağıdaki formülü kullanarak:

Nerede: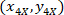 4 X ile hücre koordinatları başvurusal; vardır
4 X ile hücre koordinatları başvurusal; vardır 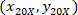 hücre koordinatları 20 X bilgi tutarlılığına (turuncu kare Şekil 5'); ve
hücre koordinatları 20 X bilgi tutarlılığına (turuncu kare Şekil 5'); ve 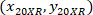 20 X 4 X görüntü (20XR) başvuru noktası koordinatlarını vardır.
20 X 4 X görüntü (20XR) başvuru noktası koordinatlarını vardır. - (Mavi olarak Şekil 5) hücre koordinatları sınırlayıcı dikdörtgen başvuru içinde hızlı aşağıdaki formülü kullanarak:
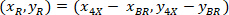
Nerede: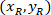 olan hücre koordinatları sınırlayıcı dikdörtgen başvuru;
olan hücre koordinatları sınırlayıcı dikdörtgen başvuru; 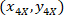 4 X hücre koordinatları başvurusal; vardır ve
4 X hücre koordinatları başvurusal; vardır ve  sınırlayıcı dikdörtgenin koordinatlar 4 X görüntü başvuru.
sınırlayıcı dikdörtgenin koordinatlar 4 X görüntü başvuru. - Hücre koordinatları sınırlayıcı dikdörtgen genişliğinin yüzdesi ve aşağıdaki formülü kullanarak sınırlayıcı dikdörtgenin yüksekliği için başvuru dönüşümü:
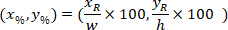
Nerede: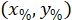 olan hücre koordinatları genişliğinin yüzdesi ve yükseklik sınırlayıcı dikdörtgenin;
olan hücre koordinatları genişliğinin yüzdesi ve yükseklik sınırlayıcı dikdörtgenin; 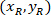 olan hücre koordinatları sınırlayıcı dikdörtgen başvuru;
olan hücre koordinatları sınırlayıcı dikdörtgen başvuru;  sınırlayıcı dikdörtgen yukarıda iletişim kuralında; ölçülen genişliği ve
sınırlayıcı dikdörtgen yukarıda iletişim kuralında; ölçülen genişliği ve 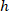 sınırlayıcı dikdörtgenin yüksekliği yukarıda iletişim kuralında ölçülür.
sınırlayıcı dikdörtgenin yüksekliği yukarıda iletişim kuralında ölçülür. - Aynı şekilde tüm ağlarda temsil etmek için dilim (sol veya sağ tarafına) yönünü dikkate alın. Verileri standart hale getirmek için bilgi tutarlılığına dilimin sol tarafında uygulanır. Sağ tarafındaki ağ koordinatlarını sadece x-koordinatları için aşağıdaki formülü uygulayarak sol tarafına aktarın:
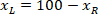
Nerede: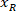 x-koordinatı dilim; sağ tarafında olduğunu ve
x-koordinatı dilim; sağ tarafında olduğunu ve 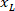 olan yeni x-koordinat başvuru içinde dilimi sol tarafındaki ifade.
olan yeni x-koordinat başvuru içinde dilimi sol tarafındaki ifade.
Not: Alternatif olarak, ImageJFIJI resimde analiz önce ayna (görüntü | Dönüştürme | Yatayda ters çevir). - Tercihli yönlendirme ana vektörünü koordinatları ifade etmek için hücre koordinatları (adım 6.5.3.1-6.5.3.4) ile aynı adımları izleyin.
Not: Veri derleme olarak çekirdek (NVsnpr) bir dikdörtgen olarak tasarlanmış tek bir arsa koordinat yüzdelerle ifade sağlar.
- 4 X bilgi tutarlılığına ( Şekil5 siyah kare) her hücre koordinatlarını hızlı aşağıdaki formülü kullanarak:
- 20 X ve 4 X resim hizalama
- Çalışmanın ana vektör Tercihli yön açısal fark
Not: Bir astrositik ağının açısal fark Tercihli yönünü faiz çekirdeği merkezine doğru olup olmadığını belirlemek için kullanılır. Tercihli Yön ( Şekil 5polisi, kırmızı hat) ağının ana vektör ile P yı C'ye bağlayan çizgi arasındaki açıdır açısal farkı ( Şekil 5' te α), hesaplama için PDC (bkz: üçgen Al-Kashi teoremi uygulanır iç metin Ek yöntemlerve Şekil 5 ).- İlk olarak, aşağıdaki denklemi kullanarak bir Kartezyen başvurusal içine Pisagor teoremi uygulanması kullanarak farklı uzunlukta Hesapla:
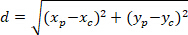
: Nerede P ve C koordinatlarını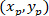 ve
ve  , sırasıyla, sınırlayıcı dikdörtgen başvuru (yukarıda hesaplanan) içinde.
, sırasıyla, sınırlayıcı dikdörtgen başvuru (yukarıda hesaplanan) içinde. - Aşağıdaki formülü kullanarak radyan açısal farkı belirlemek:
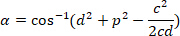
- Açısal fark derece (Örneğin, derece fonksiyonu Excel yazılımı ile) dönüştürün.
- Dikey çubuk grafiklerde (Şekil 7C ve 7 D) komplo tarafından açısal farklılıklar derlemek ve Tercihli yönünü astrositik ağlar olup olmadığını belirlemek.
- İlk olarak, aşağıdaki denklemi kullanarak bir Kartezyen başvurusal içine Pisagor teoremi uygulanması kullanarak farklı uzunlukta Hesapla:
Sonuçlar
Beyin hücreleri arasında bağlantı statik ama oldukça dinamik olarak birçok faktör tarafından düzenlenmiş değildir. Açıklanan yöntemleri astrositik ağları farklı koşullar altında ortaya çözümlemek ve NVsnpr kuruluşlarındaki anlamak için geliştirilmiştir. Bu sonuçlar zaten yayımlanmış1olmuştur. Biz üç farklı koşullarda NVsnpr dorsal parçası tek astrocytes biocytin dolum yapılan: Ca2 +(koşullarında denetim yokluğund...
Tartışmalar
Astrocytes23,24arasında kaplin fonksiyonel değerlendirmek için elektrofizyolojik yöntemlerle bir dizi vardır. Ancak, bu yöntemlerin astrositik ağlar anatomik yerleşimi hakkında bilgi sağlar. Çalışmalar bir dizi zaten "boya - veya izleyici-olarak kancası", burada, yalnızca bir kısmını içinde birleştiğinde düşündüren elektrofizyolojik yöntemleri25,26,27...
Açıklamalar
Yazarlar ifşa gerek yok.
Teşekkürler
Bu eser Kanada Enstitüleri Sağlık Araştırma tarafından Grant/ödül numarası finanse edilmektedir: 14392.
Malzemeler
| Name | Company | Catalog Number | Comments |
| NaCl | Fisher Chemicals | S671-3 | |
| KCl | Fisher Chemicals | P217-500 | |
| KH2PO4 | Fisher Chemicals | P285-500 | |
| MgSO4 | Fisher Chemicals | M65-500 | |
| NaHCO3 | Fisher Chemicals | S233-500 | |
| C6H12O6 Dextrose anhydrous | Fisher Chemicals | D16-500 | |
| CaCl2 dihydrated | Sigma | C70-500 | |
| Sucrose | Sigma | S9378 | |
| D-gluconic acid potassium salt | Sigma | G45001 | |
| MgCl2 anhydrous | Sigma | M8266 | |
| HEPES | Sigma | H3375 | |
| EGTA | Sigma | E4378 | |
| ATPTris Salt | Sigma | A9062 | |
| GTPTris Salt | Sigma | G9002 | |
| Biocytin | Sigma | B4261 | |
| Carbenoxolone disodium salt | Sigma | C4790 | |
| avidin-biotin complex : ABC kit | Vestor laboratories | PK-4000 | |
| Streptavidine-alexa 594 | Molecular Probes | S11227 | |
| Triton | Fisher Chemicals | BP151-500 | |
| Xylene | Fisher Chemicals | X5-1 | |
| Aqueous mounting medium 1 : Fluoromount-G | SouthernBiotech | 0100-01 | |
| Toluen-based synthetic resin mounting medium : Permount | Fisher Chemicals | SP15-100 | |
| Slide Drying Bench | Fisherbrand | 11-474-470 | |
| Vibratome | Leica | VT 1000S | |
| Microscope cover glass | Fisherbrand | 12-544A | |
| Microscope slide ColorFrost | Fisherbrand | 12-550-413 | |
| PFA | Fisherchemicals | 04042-500 | |
| Olympus FluoView FV 1000 Confocal microscope | Olympus | ||
| 40X water-immersion lens | Olympus | LUMPLFLN40XW | |
| 20X water-immersion lens | Olympus | XLUMPLFL20XW | |
| 4X water-immersion lens | Olympus | XLFLUOR4X/340 | |
| Micropipette puller | Sutter Instrument | P97 | |
| Micromanipulator | Sutter Instrument | MP 225 | |
| Camera CCD | Sony | CX-ST50 | |
| Black and white monitor | Sony | SSM-125 | |
| Digidata | Molecular devices | 1322A | |
| Patch Clamp amplifier | Axon instrument | Mulitclamp 700A | |
| Electrophysiology acquisition software | Molecular devices | pClamp 8 | |
| Electrophysiology analysis software | Molecular devices | Clampfit 8 | |
| Imaging analysis software | ImageJFIJI | Open source software. FIJI version including plug in package. | |
| Vector image editor | Adobe | Illustrator CS4 | |
| Spreadsheet application | Microsoft Office | Excel 2010 |
Referanslar
- Condamine, S., Lavoie, R., Verdier, D., Kolta, A. Functional rhythmogenic domains defined by astrocytic networks in the trigeminal main sensory nucleus. Glia. 66 (2), 311-326 (2018).
- Verkhratsky, A., Orkand, R. K., Kettenmann, H. Glial calcium: homeostasis and signaling function. Physiological Review. 78 (1), 99-141 (1998).
- Christensen, R. K., Petersen, A. V., Perrier, J. F. How do glial cells contribute to motor control?. Current Pharmaceutical Design. 19 (24), 4385-4399 (2013).
- Verkhratsky, A., Steinhauser, C. Ion channels in glial cells. Brain Research Review. 32 (2-3), 380-412 (2000).
- Harada, K., Kamiya, T., Tsuboi, T. Gliotransmitter Release from Astrocytes: Functional, Developmental, and Pathological Implications in the Brain. Frontiers Neuroscience. 9, 499 (2015).
- Montero, T. D., Orellana, J. A. Hemichannels: new pathways for gliotransmitter release. Neuroscience. 286, 45-59 (2015).
- Araque, A., et al. Gliotransmitters travel in time and space. Neuron. 81 (4), 728-739 (2014).
- Augustin, V., et al. Functional anisotropic panglial networks in the lateral superior olive. Glia. 64 (11), 1892-1911 (2016).
- Houades, V., Koulakoff, A., Ezan, P., Seif, I., Giaume, C. Gap junction-mediated astrocytic networks in the mouse barrel cortex. Journal of Neuroscience. 28 (20), 5207-5217 (2008).
- Roux, L., Benchenane, K., Rothstein, J. D., Bonvento, G., Giaume, C. Plasticity of astroglial networks in olfactory glomeruli. Proceedings of the National Academy of Science of the United State of America. 108 (45), 18442-18446 (2011).
- Morquette, P., et al. An astrocyte-dependent mechanism for neuronal rhythmogenesis. Nature Neuroscience. 18 (6), 844-854 (2015).
- Brocard, F., Verdier, D., Arsenault, I., Lund, J. P., Kolta, A. Emergence of intrinsic bursting in trigeminal sensory neurons parallels the acquisition of mastication in weanling rats. Journal of Neurophysiology. 96 (5), 2410-2424 (2006).
- Anders, S., et al. Spatial properties of astrocyte gap junction coupling in the rat hippocampus. Philosophical Transactions of the Royal Society of London. Series B, Biological Science. 369 (1654), (2014).
- Houades, V., et al. Shapes of astrocyte networks in the juvenile brain. Neuron Glia Biology. 2 (1), 3-14 (2006).
- Rouach, N., Koulakoff, A., Abudara, V., Willecke, K., Giaume, C. Astroglial metabolic networks sustain hippocampal synaptic transmission. Science. 322 (5907), 1551-1555 (2008).
- Claus, L., et al. Barreloid Borders and Neuronal Activity Shape Panglial Gap Junction-Coupled Networks in the Mouse Thalamus. Cerebral Cortex. 28 (1), 213-222 (2018).
- Cameron, M. A., et al. Prolonged Incubation of Acute Neuronal Tissue for Electrophysiology and Calcium-imaging. Journal of Visualized Experiments. (120), (2017).
- Kafitz, K. W., Meier, S. D., Stephan, J., Rose, C. R. Developmental profile and properties of sulforhodamine 101--Labeled glial cells in acute brain slices of rat hippocampus. Journal of Neuroscience Methods. 169 (1), 84-92 (2008).
- Neher, E. Correction for liquid junction potentials in patch clamp experiments. Methods in Enzymology. , 123-131 (1992).
- Giaume, C., Leybaert, L., Naus, C. C., Saez, J. C. Connexin and pannexin hemichannels in brain glial cells: properties, pharmacology, and roles. Frontiers in Pharmacology. 4, 88 (2013).
- Torres, A., et al. Extracellular Ca(2)(+) acts as a mediator of communication from neurons to glia. Science Signaling. 5 (208), ra8 (2012).
- Ye, Z. C., Wyeth, M. S., Baltan-Tekkok, S., Ransom, B. R. Functional hemichannels in astrocytes: a novel mechanism of glutamate release. Journal of Neuroscience. 23 (9), 3588-3596 (2003).
- Ma, B., et al. Gap junction coupling confers isopotentiality on astrocyte syncytium. Glia. 64 (2), 214-226 (2016).
- Meme, W., Vandecasteele, M., Giaume, C., Venance, L. Electrical coupling between hippocampal astrocytes in rat brain slices. Neuroscience Research. 63 (4), 236-243 (2009).
- Ransom, B. R., Kettenmann, H. Electrical coupling, without dye coupling, between mammalian astrocytes and oligodendrocytes in cell culture. Glia. 3 (4), 258-266 (1990).
- Audesirk, G., Audesirk, T., Bowsher, P. Variability and frequent failure of lucifer yellow to pass between two electrically coupled neurons in Lymnaea stagnalis. Journal of Neurobiology. 13 (4), 369-375 (1982).
- Ewadinger, N., Syed, N., Lukowiak, K., Bulloch, A. Differential Tracer Coupling between Pairs of Identified Neurones of the Mollusc Lymnaea Stagnalis. Journal of Experimental Biology. 192 (1), 291-297 (1994).
- Griemsmann, S., et al. Characterization of Panglial Gap Junction Networks in the Thalamus, Neocortex, and Hippocampus Reveals a Unique Population of Glial Cells. Cerebral Cortex. 25 (10), 3420-3433 (2015).
- Kuwajima, T., et al. ClearT: a detergent- and solvent-free clearing method for neuronal and non-neuronal tissue. Development. 140 (6), 1364-1368 (2013).
- Gourine, A. V., et al. Astrocytes control breathing through pH-dependent release of ATP. Science. 329 (5991), 571-575 (2010).
- Forsberg, D., Ringstedt, T., Herlenius, E. Astrocytes release prostaglandin E2 to modify respiratory network activity. eLife. 6, (2017).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır