需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
耦合星形胶质细胞网络的大小、形状和方向性分析
摘要
在这里, 我们提出了一个评估胶质网络组织的协议。所述方法最大限度地减少偏倚, 以提供这些网络的描述性度量, 如细胞计数、大小、面积和原子核内的位置。各向异性的评估与矢量分析。
摘要
越来越清楚的是, 星形胶质细胞调节神经元功能不仅在突触和单细胞水平, 而且在网络水平。星形胶质细胞通过缝隙连接紧密相连, 通过这些结点的耦合是动态和高度调节的。一个新的概念是, 胶质功能是专门的和适应的功能, 神经元电路与他们的联系。因此, 需要测量胶质网络各种参数的方法, 以便更好地描述其通信和耦合的规则, 进一步了解它们的功能。
在这里, 利用图像分析软件 (ImageJFIJI), 描述了一种分析染料耦合胶质网络共焦图像的方法。这些方法允许 1) 自动和无偏检标记的细胞, 2) 计算网络的大小, 3) 计算染料在网络内传播的优先方向, 4) 在感兴趣的区域内重新定位网络.
该分析可用于描述某一特定区域的胶质网络, 比较与不同功能相关的不同区域的网络, 或比较在不同条件下获得的网络对耦合有不同的影响。这些观察可能会导致重要的功能考虑。例如, 我们分析了三叉核的胶质网络, 我们以前曾表明, 胶质耦合对于神经元将其射击模式从补品转变为有节奏的1的能力至关重要。通过测量这个原子核中胶质网络的大小、约束和优先方向, 我们可以建立它们所限制的功能域的假说。一些研究表明, 一些其他的大脑区域, 包括桶皮质, 侧高橄榄, 嗅觉肾小球, 以及丘脑和视觉皮层的感觉细胞核, 可以从类似的分析中获益。
引言
许多研究已经描述了神经元-星形胶质细胞在子蜂窝或突触水平上的对话如何对神经元功能和突触传递产生影响。研究表明, 星形胶质细胞对周围神经元活动敏感;事实上, 他们有许多神经递质的受体, 包括谷氨酸, GABA, 乙酰胆碱和 ATP (见以前发表的评论2,3,4)。作为回报, 胶质处理 ensheath 突触元素, 并通过调节细胞外离子动态平衡和释放几个因素或发射机, 如谷氨酸、d-丝氨酸和 ATP, 影响到 extrasynaptic 的神经活动。5,6,7。
星形胶质细胞也可以在网络水平上调节神经元功能的想法已经出现, 证据表明胶质耦合是空间调控的, 对应于具有清晰解剖特征的区域的神经元分割。划分 (如与感官表示的区域), 表明星形胶质细胞将对其他功能相同的星形胶质细胞, 而不仅仅是那些附近的。例如, 在外侧高级橄榄, 大多数胶质网络是定向正交到 tonotopic 轴8, 而在桶皮层或 olfactoty 肾小球, 星形胶质细胞之间的通信更强在桶或肾小球并且较弱在相邻部分之间9,10。在这两种情况下, 胶质网络都面向团伞花序或桶9,10的中心。
我们最近表明, 胶质活动通过减少细胞外钙的浓度2 + ([Ca2 +]e) 来调节神经元的发射, 大概是通过释放 S100β, 一个 Ca2 +结合蛋白11。这一效应在三叉神经主要感觉细胞核 (NVsnpr) 背部的三叉神经 rhythmogenic 神经元中表现出来, 认为在咀嚼运动的产生中起着重要作用, 这是由于这些神经元的节律性射击依赖于持续的 Na+电流, 这是由 [Ca2 +]e11,12的减少所促进的。这些神经元的节律性射击可以通过刺激他们的输入或人工减少 [Ca2 +]e来诱发 "生理上的"。我们进一步表明, 胶质耦合是需要的神经元节律性射击1。这就提高了胶质网络可能形成可同步和协调神经元活动的界限功能域的可能性。为了评估这个假说, 我们首先需要开发一种方法来严格记录这些网络在 NVsnpr 中的组织。
以前对胶质网络的研究大多描述了细胞数和密度和覆盖范围的耦合程度。试图评估胶质网络的形状和染料耦合的方向主要是通过比较两个轴 (x 和 y) 在桶皮层9, 海马13,14的网络大小,15, barreloid 的丘脑16, 外侧高级橄榄8, 嗅肾小球10, 皮质14。此处描述的方法使网络中标记的单元格具有无偏数的计数, 并对所覆盖的区域进行估计。我们还开发了工具来定义网络中耦合的首选方向, 并评估首选方向是朝向原子核的中心还是朝着不同的方向。与以前使用的方法相比, 本协议提供了一种方法来描述胶质网络在结构上的组织和定位, 如背三叉神经主要感觉细胞核没有已知清楚的解剖划分。在上面的研究中, 网络定向被描述为与结构本身的形状的关系, 这已经被记录下来 (例如, 丘脑的 barreloid, 皮层中的桶, 海马和皮质层, 肾小球在嗅球等)。此外, 矢量分析允许比较在不同条件下揭示的耦合方向。为了分析这些参数是否根据网络在原子核中的位置而变化, 我们还开发了一个方法来代替每个网络, 并参照原子核的边界。这些工具可以很容易地适应其他领域, 以调查耦合细胞网络。
研究方案
加拿大卫生研究所规定的所有程序, 并经蒙特利尔大学动物保育和使用委员会批准。
1. 大鼠脑切片的制备
- 制备 1 l 的蔗糖基溶液 (表 1) 和 1 l 的标准人工脑脊髓液 (aCSF) (表 2)。
- 气泡的蔗糖为基础的解决方案, 混合 95% O2和 5% CO2 (卡波金) 为30分钟之前, 将其放置在-80 °c 约30分钟, 直到解决方案是冷的, 但不是完全冻结。用这种冰冷的蔗糖作为切片的切削缓冲。把它放在冰上, 一旦它从冰箱里取出。
- 通过整个实验, aCSF 与卡波金的气泡。将此解决方案用于切片存储, 并将其作为灌注缓冲器, 在该缓冲区中对星形胶质细胞进行补丁夹紧和 biocytin 填充。准备一个切片恢复保持室, 以存放脑切片, 一旦他们被削减。
注: 切片回收保持室可以是定制的, 主要包括一个小井与网在底部悬浮在一个较大的井, 填补了 aCSF, 其中一管插入, 以使卡波金从底部。 - 使用15到21天大的大大鼠, 没有任何性别或应变特异性的偏见。麻醉动物与异氟醚 (1 毫升异氟醚在麻醉诱导室)。通过轻轻捏紧动物的后爪或尾部, 检查麻醉深度。
- 斩首老鼠使用断头台, 用剪刀剪下头骨, 用平铲快速地从颅骨上取出大脑。
- 将大脑浸泡在冰冷的蔗糖基溶液中, 大约三十年代, 将它 (与溶液) 转移到培养皿中。用剃刀刀片, 删除的部分, 是前和后的区域被切片, 如果切割切片在横向平面。
- 将其余的脑组织块粘附在其延髓侧, 然后使用 vibratome 在蔗糖基培养基上切割脑切片 (350 µm 厚)。然后, 将收集到的切片在室温 (RT) 填充 carbogenated aCSF 的回收保持室中, 直到它们准备好使用 (至少允许1小时恢复)。
注: 该领域的最近发展允许长时间孵化多达24小时的脑切片的体外条件17。
2. 磺基罗丹明 101 (SR-101) 标记星形胶质细胞
- 预先加热水浴到34°c 和安置二个切片孵化室在它。用含有1微米 SR-101 的 aCSF 溶液填充切片孵化室之一, 再用 aCSF 填充另一条。
- 在孵化室中孵化出含有1µM SR-101 20 分钟的切片, 然后将其转移到第二个孵化室中, 以冲洗组织中多余的 SR-101。让它孵育20分钟或更多在34摄氏度, 然后保持孵化室包含切片在 RT, 直到他们需要18。
3. 星形胶质细胞修补和 Biocytin 充填
- 选择切片并将其放置在显微镜的记录室中。要修补星形胶质细胞, 在充满葡萄糖酸钾的溶液中使用4-6MΩ电阻的电极 (见表 3)。
- 在视觉指导下, 使用机器人, 将记录电极直接指向 SR-101-labeled 星形胶质细胞, 如图 1所示。避免位于切片表面的单元格, 因为它们更容易被损坏或与相邻单元格的连接丢失。
- 为了防止组织中 biocytin 的渗漏, 尽量减少添加到贴片吸管的正压, 并仅当它靠近将被修补的星形胶质细胞 (0.1-0.4 毫升的注射器1毫升) 时才应用。
- 在修补之前, 调整吸管及其电容的偏移量。正确的液体连接电位, 因为准确和精确的电压命令是关键的实验19。
- 移动吸管足够接近的星形胶质细胞观察抑郁症引起的正压。然后, 去掉正压, 慢慢地施加一些负压。当密封达到 100 MΩ时, 将星形胶质细胞夹紧至-70 mV。等到封印达到 1-3 GΩ。继续施加负压直到闯入细胞。使用负压时要小心, 因为星形胶质细胞非常脆弱。
- 评估已修补细胞的电生理特性。在电压钳模式下, 执行具有600毫秒的坡道电压命令的全电池电流电压协议, 范围从-120 到 +110 mV 不等。在电流钳模式下, 执行步骤 IV 协议, 其中注入 1000年 ms 当前步骤 100 pA 从-1 到 1 nA, 整个细胞记录的采样率为10赫。
注: 星形胶质细胞显示一个线性电流-电压剖面没有任何类型的整流 (如图 1B所示), 并没有动作电位射击后, 膜退极化 (图 1C)。静止膜电位 (RMP) 应稳定, 不能阳性至60mV。在某些脑区, 星形胶质细胞的 RMP 比 NVsnpr 超极化搏。 - 允许 biocytin 在星形胶质细胞内扩散30分钟, 同时执行步骤 IV 协议每5分钟。
- 仔细收回和分离的补丁吸管, 不损害修补的星形胶质细胞, 并立即注意到的偏移量的吸管, 然后把它从录音室。从膜电位记录中减去该值。
- 让脑切片在录音室中休息至少15分钟 (除了注射30分钟), 允许将追踪器从已修补的星形胶质细胞传播到整个耦合单元网络。
注: 为了揭示一个耦合细胞的网络, 只有一个细胞应该被修补在一个核心的利益。如果需要多次尝试才能获得成功的修补程序, 请丢弃该案例并尝试在对侧或另一脑切片上进行修补。 - 在组织中做一个标记或切口, 以确定切片的哪一侧朝上, 并首先将切片转移到含有正常 aCSF 的培养皿中, 然后再转化为4% 多聚甲醛 (粉煤灰) 的溶液。一夜之间孵化4摄氏度的切片。
注意: 粉煤灰是极其有害的。在通风罩中使用防护设备。确保与粉煤灰接触的所有材料 (刷子、管子等) 不与回收保持室、孵化室或用于记录新鲜组织的其他材料联系。
4. Biocytin 启示
- 荧光简便而的启示
- 在0.1 米磷酸缓冲盐水 (PBS) 的 RT 中冲洗脑切片 2 x 10 分钟。然后, 通过孵化与简便而共轭荧光1/200 稀释在 PBS 与4% 非离子洗涤剂 4 h 在 RT 的脑切片, 揭示 biocytin。
- 将 3 x 10 分钟的脑切片清洗到 RT 中的0.1 米 PBS 中, 然后使用水上安装介质在玻璃滑梯上安装切片。放置向上注入的两侧, 盖玻片幻灯片, 并用指甲油封住它们。
- 与民建联的启示
注: 在不能使用荧光时, 可以使用 diaminobenzidine (33-) 的启示。在这种情况下, 只应使用一种启示方法进行比较。- 在 pbs 中洗脑切片 3 x 10 分钟. 在 rt 中, 在 pbs + H2O2 0.5% 中孵化切片。
- 在 PBS 中冲洗 3 x 10 分钟的切片。然后, 在亲和-生物素复合染色溶液中孵化切片, 由 PBS 和0.1% 非离子洗涤剂 + 亲和-生物素复合过氧化物酶标准染色试剂在 1/100 24 小时在 RT。
- 冲洗切片 3 x 10 分钟在 pbs 的 rt, 孵化他们在 pbs + 民建联0.05% 在 rt 的解决方案, 并将其转移到 pbs + 民建联 0.05% + H2O2 0.5%。
注意: 民建联是极其有害的。在通风罩中使用防护设备。在 PBS 中传输切片时, 颜色反应停止。 - 在 PBS 中冲洗 5 x 10 分钟的切片, 在玻璃滑梯上安装切片 (面对向上注入的两侧), 让他们在一夜之间在34摄氏度的滑动干燥台上晾干。
- 在70%、95% 和100% 的几个酒精浴中浸泡1分钟的玻璃滑梯, 最后用二甲苯浴为1分钟。
- 使用甲苯基合成树脂安装介质安装玻璃滑梯。将盖玻片放在幻灯片上, 用指甲油封住它们。
5. 网络成像
- 使用具有20X 和4X 目标的扫描共焦显微镜可视化胶质网络 (或适当的目标来可视化网络所在的整个原子核) 和激光检测荧光 (在这种情况下, Alexa-594 是使用)。
- 使用20X 放大倍数制作标记单元格网络的 z 堆栈。使用分辨率为 800 x 800 像素, 扫描速度为12.5 微秒/像素。
注意: 为了对整个网络进行映像, 通常需要多个堆栈, 并且需要为每个网络调整堆栈数。分辨率和扫描速度可以更改, 但请确保使用相同的设置来映像所有数据。 - 使用4X 放大倍数来拍摄网络和感兴趣区域的图像。
注: 4X 成像用于确定感兴趣的核心中的网络位置。在透射光中总是图像相同的字段。如果不能确定共焦荧光图像中原子核的边界, 此图像将非常有用。
6. 图像分析
- 数据准备
- 使用软件 ImageJFIJI (下载它在 https://fiji.sc/)。打开该文件, 然后在 "生物格式导入选项" 窗口中单击 "确定"。
- 要重新定义将只包含最终 z 堆栈所需的光学切片的 z 堆栈 (图 2A), 请单击工具栏中的 "堆栈" 旋钮 (查找, 首先选择 stk |Z 项目)。在投影类型设置中选择 "最大强度" (图 2A)。保存文件并命名为 "堆栈文件"。
- 如果图像文件包含多个通道, 则将其拆分以仅保存带有胶质网络映像的通道 (图像 |颜色 |分割通道)。
- 检查图像的像素设置 [图像 |属性 |像素 (像素尺寸为 "1")]。
- 使用减法背景工具 (过程 |减去背景), 以消除 biocytin 标签的背景。使用预览功能设置滚动球半径, 通常设置为50像素 (图 2B)。
- 使用 "删除异常值" 工具 (进程 |噪声 |删除异常值) (如果在减法背景步骤之后需要)。在 "哪个异常值" 设置中选择 "亮" (图 2C)。使用预览函数设置半径和阈值。请小心此工具, 因为它可能会模糊数据, 如图 2D所示。
注: 此工具去除由不确定的简便而引起的小斑点 (如图 2B和处理前后的白色箭头分别显示)。 - 调整阈值 (图像 |调整 |阈值)。选择 "默认" 和 "B & W" 模式 (图 2E)。点击 "应用"。
注: 可使用自动调整, 但手动调整与两个滑杆是首选。此步骤的目的是在不丢失任何标记的单元格的情况下将噪音降低到最大值。 - 使用二进制过程工具将图像转换为二进制图像 (进程 |二进制 |使二进制文件) 如图 2F所示。将文件另存为 TIFF 文件, 并将其命名为 "二进制文件"。
- 单元计数
- 检查测量函数的设置 (分析 |设置测量)。选择 "质心" 选项。
- 使用前面步骤中生成的 "二进制文件" (图 3A) 中的 "分析粒子" 工具 (分析 |分析粒子) (左图 3C )。在 "显示" 设置中选择 "大纲" (图 3C)。这将生成一个显示检测结果的新文件 (图 3B)。
- 使用参数: 大小 (仅检测单元格, 使用介于30和6000之间的值) 和循环 (确定介于0到1之间的间隔, 其中 "1" 定义了一个完美的圆圈和 "0" 随机形状) 以细化检测 (图 3C, 左侧部分)。通过单击 "确定" 运行检测。
注意: 在检测后会出现两个表: 1) 一个标题为 "摘要" 的表, 提供检测到的单元格数和 2) 一个标题为 "结果" (图 3C, 右部分) 的表, 提供每个单元格的 x 和 y 坐标。 - 复制这些值并将它们粘贴到电子表格应用程序中。在 "检测表" 的名称下保存此表。还会出现一个带有检测到单元格图的文件 (图 3B)。将此文件保存为 TIFF 文件, 名称为 "检测文件"。
- 如果网络中的2个或多个标记的单元格被检测为单个单元格, 其中有 "分析粒子" 工具, 因为它们彼此太接近, 请使用分水岭工具 (进程 |二进制 |分水岭)在对二进制图像应用分析粒子工具之前, 重做分析粒子的步骤。
注: 分水岭工具在极接近的细胞之间创建1像素宽的定界。当标记明确且可以手动进行时, 可以使用单元格计数器插件。
- 测量胶质网络区域
- 要测量网络的表面积, 请使用图像 J 的检测文件。
- 使用多边形选择工具 (左键单击工具栏中的按钮以选择它) 以跟踪连接网络外部外围的所有单元格的多边形 (图 4A)。左键单击可开始跟踪多边形, 右键单击可将其关闭。
注意: 这个多边形将被定义为一个感兴趣的区域 (ROI), 它的表面将被测量以确定网络的表面积。 - 打开 "设置测量" 窗口 (分析 |设置度量值) 并选择 "区域" 选项。打开 ROI 管理器 (分析 |工具 |ROI 管理器) (图 4B)。然后, 在 roi 管理器中添加跟踪的多边形, 方法是单击 "添加" (图 4B), 然后通过单击 roi 管理器中的 "度量" 来运行度量。
注意: 区域测量将显示在表格中, 以像素表示。不要忘记将此值转换为用于在微米2中获取值的显微镜的换算系数。
- 主方向向量的确定
- 修补细胞的测定
- 在 ImageJFIJI 中打开堆栈文件, 并根据其更强的标记强度识别堆栈文件中的修补单元格 (图 4C)。然后, 在电子表格应用程序中打开名为 "检测表" 的文件, 并查找与修补的单元格及其相应坐标相关联的数字。
- 如果无法准确确定已修补的单元格, 请使用 ImageJFIJI 中的多边形工具, 将 biocytin 沉积在耦合单元的成像网络中密度较大的区域包围, 并将此位置与已修补的单元格 (图 4D) 相参照。
- 使用 ROI 管理器 (分析 |工具 |ROI 管理器)。然后, 在修补的单元格位置绘制一个 roi, 并将其添加到 roi 管理器 (请参见图 4B)。
- 设置测量 (分析 |设置测量), 并选择 "质心" 选项。
- 在 ROI 管理器中, 单击 "度量" 以获取跟踪区域质心的坐标。使用这些坐标作为此特定网络的参考点。
- 参考翻译
- 使用以下公式计算每个单元格在参照已修补的星形胶质细胞时的坐标:

用: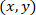 作为给定单元格的坐标;
作为给定单元格的坐标;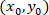 作为修补单元的坐标 (或网络的参照点);
作为修补单元的坐标 (或网络的参照点);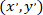 作为新参照中给定单元格的坐标。
作为新参照中给定单元格的坐标。
注: 在对已修补的星形胶质细胞进行参考时, 表达每个单元格的坐标是计算被修补的星形胶质的重要步骤。使用 ImageJFIJI 时要小心, 因为任何图像的引用都位于图像的左上角。
- 使用以下公式计算每个单元格在参照已修补的星形胶质细胞时的坐标:
- 优先取向主向量的确定
- 用以下公式计算优先方向的主向量的坐标:
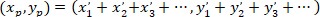
以: (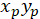 ) 作为优先方向的主向量的坐标;并
) 作为优先方向的主向量的坐标;并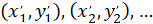 作为网络中每个单元格的坐标, 以被修补的单元格作为参照。
作为网络中每个单元格的坐标, 以被修补的单元格作为参照。
注: 对于网络中的每个单元格, 相对于已修补的星形胶质细胞的坐标确定向量。网络优先方向的主向量是所有这些向量的总和。 - 将主向量的长度 (由使用上述公式获得的坐标提供) 除以网络中的单元格数减去一 (因为未包括已修补单元格的坐标), 以使值正常化, 并允许比较网络。图 5给出了这种分析的示意图。
- 用以下公式计算优先方向的主向量的坐标:
- 修补细胞的测定
- 分析网络在利益核心中的位置
- 20X 和4X 图像的对齐方式
- 要确定每个网络在感兴趣的核心 (NVsnpr) 中的位置, 请使用4X 图像。使用矢量图像编辑器打开4X 图像。
- 选择4X 图像并通过将其乘以5来修改其大小。"维度" 窗口位于顶部水平工具栏的右侧部分。例如, 对于以 800 x 800 像素取样的4X 图像, 将采样分辨率更改为 4000 x 4000 像素 (以像素为单位设置工作单元, 转到 "文件" 选项卡下的 "文档设置": "文件" | "文档设置)。以 TIFF 格式导出文件, 并将其命名为 "调整4X 大小"。
- 将图像的左上角与 Adobe 插画文档的左下角对齐。
注意: 软件提供从左下角参照点的坐标。 - 打开网络的20X 图像。使用 "二进制文件" 或 "检测文件", 因为它们更容易对齐。然后, 在20X 图像的 "二进制文件" 上播放不透明度工具, 使其与重新大小的4X 图像对齐。
注意: 不透明度工具位于顶部水平工具栏中。 - 完成对齐后, 选择并按住吸管工具, 以便显示 "度量" 工具, 并在左侧工具栏中选择它。
- 使用 "度量" 工具单击20X 图像的左上角可将20X 参照点的坐标获取到调整大小的4X 图像上。
注意: 这些坐标被称为20X 参照 (图 5中的 20XR), 将有助于在原子核的示意图上表达每个网络的位置。
- 利益核心的正常化
注: 要总结数据, 使用原子核 (NVsnpr) 作为矩形的正常化。步骤如下所述。- 在 ImageJFIJI 中打开4X 调整大小的文件, 并使用多边形工具环绕原子核 (NVsnpr)。如果无法看到原子核的边界, 则使用透射光的图像;在这种情况下, 请记住先调整它的大小。
- 打开 roi 管理器并添加所绘制的 roi。在 "设置测量" 中, 选择 "边框矩形" 选项。
注意: "边框" 选项计算绘制原子核周围的最小矩形。 - 单击 "度量"。
注意: 表格中显示的是一个表, 上面是矩形左上角的坐标: "矩形位置", 并提供宽度和高度。和由是被称为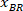 和
和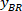 的边界矩形参照的坐标。
的边界矩形参照的坐标。
- 归一化核中各网络位置的表达式
- 使用以下公式, 用4X 参照 (图 5中的黑色正方形) 来表示每个单元格的坐标:

位置: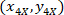 单元格坐标与4X 参照;
单元格坐标与4X 参照;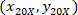 单元格坐标与20X 参照 (图 5中的橙色正方形);
单元格坐标与20X 参照 (图 5中的橙色正方形);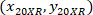 是4X 图像 (20XR) 中20X 参照点的坐标。
是4X 图像 (20XR) 中20X 参照点的坐标。 - 使用以下公式在边框参照 (图 5中的蓝色) 中表达单元格坐标:
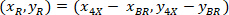
位置: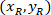 是边框参照中的单元坐标;
是边框参照中的单元坐标;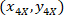 是4X 参照中的单元坐标;并且
是4X 参照中的单元坐标;并且 是4X 图像中边框参照的坐标。
是4X 图像中边框参照的坐标。 - 使用以下公式将边框参照中的单元坐标转换为边框宽度和高度的百分比:
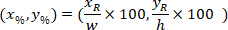
位置: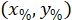 单元格坐标在边框宽度和高度的百分比;
单元格坐标在边框宽度和高度的百分比;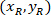 是边界矩形引用中的单元格坐标;
是边界矩形引用中的单元格坐标; 是在协议中测量到的边界矩形的宽度;并且
是在协议中测量到的边界矩形的宽度;并且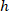 是在协议中测量到的边界矩形的高度。
是在协议中测量到的边界矩形的高度。 - 要表示同一图形上的所有网络, 请考虑切片的方向 (左侧或右侧)。若要对数据进行标准化, 参照将应用于切片的左侧。将以下公式仅应用于 x 坐标, 将右侧的网络坐标传输到左侧:
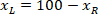
位置: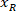 在切片右侧的 x 坐标;并且
在切片右侧的 x 坐标;并且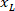 是在切片左侧的参照中表示的新 x 坐标。
是在切片左侧的参照中表示的新 x 坐标。
注: 或者, 在分析之前在 ImageJFIJI 中镜像图片 (图像 |转换 |水平翻转)。 - 要表示优先方向的主向量的坐标, 请遵循与单元坐标相同的步骤 (步骤6.5.3.1 到 6.5.3.4)。
注意: 坐标的表达式允许将数据编译为单个图块, 其中原子核 (NVsnpr) 被设计为矩形。
- 使用以下公式, 用4X 参照 (图 5中的黑色正方形) 来表示每个单元格的坐标:
- 20X 和4X 图像的对齐方式
- 优先方向主向量角差的研究
注: 胶质网络的角差用于确定其优先方向是否朝向感兴趣的核心中心。计算角差 (图 5中的α), 这是网络优先方向的主向量 (PD、图 5中的红线) 和连接 P 到 C 的线之间的夹角, 将 "喀什" 定理应用到三角形 PDC 中 (见图 5和辅助方法的插图)。- 首先, 计算不同长度使用毕达哥拉斯定理的应用到笛卡尔引用使用以下等式:
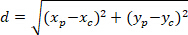
在哪里: P 和 C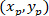
 的坐标分别在边界矩形参照 (上面计算) 中。
的坐标分别在边界矩形参照 (上面计算) 中。 - 使用以下公式确定弧度的角差:
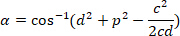
- 将角度差转换为度数 (例如, Excel 软件中的度数函数)。
- 通过在垂直条形图 (图 7C和7D) 中绘制所有的角度差异, 确定是否有胶质网络的优先方向。
- 首先, 计算不同长度使用毕达哥拉斯定理的应用到笛卡尔引用使用以下等式:
结果
大脑细胞之间的耦合不是静止的, 而是由许多因素动态调节的。介绍了在不同条件下胶质网络的分析方法, 并对其在 NVsnpr 中的组织进行了了解。这些结果已经发表在1。在三种不同的条件下, 我们在 NVsnpr 的背部进行了 biocytin 填充单星形胶质细胞的充填: 休息 (在没有任何刺激的情况下控制条件下), 在 Ca2 +自由条件, 并继电刺激投射到细胞核的感官?...
讨论
有许多电生理方法来评估星形胶质细胞23,24之间的功能耦合。然而, 这些方法并没有提供有关胶质网络解剖安排的信息。一些研究已经表明, "染料-或示踪-耦合", 在这里做, 只发生在一小部分的耦合细胞检测的电生理方法25,26,27, 表明,使用此方法检测到的单元格数被低估。然而, 这仍然?...
披露声明
作者没有什么可透露的。
致谢
这项工作由加拿大卫生研究所资助, 赠款/奖励编号: 14392。
材料
| Name | Company | Catalog Number | Comments |
| NaCl | Fisher Chemicals | S671-3 | |
| KCl | Fisher Chemicals | P217-500 | |
| KH2PO4 | Fisher Chemicals | P285-500 | |
| MgSO4 | Fisher Chemicals | M65-500 | |
| NaHCO3 | Fisher Chemicals | S233-500 | |
| C6H12O6 Dextrose anhydrous | Fisher Chemicals | D16-500 | |
| CaCl2 dihydrated | Sigma | C70-500 | |
| Sucrose | Sigma | S9378 | |
| D-gluconic acid potassium salt | Sigma | G45001 | |
| MgCl2 anhydrous | Sigma | M8266 | |
| HEPES | Sigma | H3375 | |
| EGTA | Sigma | E4378 | |
| ATPTris Salt | Sigma | A9062 | |
| GTPTris Salt | Sigma | G9002 | |
| Biocytin | Sigma | B4261 | |
| Carbenoxolone disodium salt | Sigma | C4790 | |
| avidin-biotin complex : ABC kit | Vestor laboratories | PK-4000 | |
| Streptavidine-alexa 594 | Molecular Probes | S11227 | |
| Triton | Fisher Chemicals | BP151-500 | |
| Xylene | Fisher Chemicals | X5-1 | |
| Aqueous mounting medium 1 : Fluoromount-G | SouthernBiotech | 0100-01 | |
| Toluen-based synthetic resin mounting medium : Permount | Fisher Chemicals | SP15-100 | |
| Slide Drying Bench | Fisherbrand | 11-474-470 | |
| Vibratome | Leica | VT 1000S | |
| Microscope cover glass | Fisherbrand | 12-544A | |
| Microscope slide ColorFrost | Fisherbrand | 12-550-413 | |
| PFA | Fisherchemicals | 04042-500 | |
| Olympus FluoView FV 1000 Confocal microscope | Olympus | ||
| 40X water-immersion lens | Olympus | LUMPLFLN40XW | |
| 20X water-immersion lens | Olympus | XLUMPLFL20XW | |
| 4X water-immersion lens | Olympus | XLFLUOR4X/340 | |
| Micropipette puller | Sutter Instrument | P97 | |
| Micromanipulator | Sutter Instrument | MP 225 | |
| Camera CCD | Sony | CX-ST50 | |
| Black and white monitor | Sony | SSM-125 | |
| Digidata | Molecular devices | 1322A | |
| Patch Clamp amplifier | Axon instrument | Mulitclamp 700A | |
| Electrophysiology acquisition software | Molecular devices | pClamp 8 | |
| Electrophysiology analysis software | Molecular devices | Clampfit 8 | |
| Imaging analysis software | ImageJFIJI | Open source software. FIJI version including plug in package. | |
| Vector image editor | Adobe | Illustrator CS4 | |
| Spreadsheet application | Microsoft Office | Excel 2010 |
参考文献
- Condamine, S., Lavoie, R., Verdier, D., Kolta, A. Functional rhythmogenic domains defined by astrocytic networks in the trigeminal main sensory nucleus. Glia. 66 (2), 311-326 (2018).
- Verkhratsky, A., Orkand, R. K., Kettenmann, H. Glial calcium: homeostasis and signaling function. Physiological Review. 78 (1), 99-141 (1998).
- Christensen, R. K., Petersen, A. V., Perrier, J. F. How do glial cells contribute to motor control?. Current Pharmaceutical Design. 19 (24), 4385-4399 (2013).
- Verkhratsky, A., Steinhauser, C. Ion channels in glial cells. Brain Research Review. 32 (2-3), 380-412 (2000).
- Harada, K., Kamiya, T., Tsuboi, T. Gliotransmitter Release from Astrocytes: Functional, Developmental, and Pathological Implications in the Brain. Frontiers Neuroscience. 9, 499 (2015).
- Montero, T. D., Orellana, J. A. Hemichannels: new pathways for gliotransmitter release. Neuroscience. 286, 45-59 (2015).
- Araque, A., et al. Gliotransmitters travel in time and space. Neuron. 81 (4), 728-739 (2014).
- Augustin, V., et al. Functional anisotropic panglial networks in the lateral superior olive. Glia. 64 (11), 1892-1911 (2016).
- Houades, V., Koulakoff, A., Ezan, P., Seif, I., Giaume, C. Gap junction-mediated astrocytic networks in the mouse barrel cortex. Journal of Neuroscience. 28 (20), 5207-5217 (2008).
- Roux, L., Benchenane, K., Rothstein, J. D., Bonvento, G., Giaume, C. Plasticity of astroglial networks in olfactory glomeruli. Proceedings of the National Academy of Science of the United State of America. 108 (45), 18442-18446 (2011).
- Morquette, P., et al. An astrocyte-dependent mechanism for neuronal rhythmogenesis. Nature Neuroscience. 18 (6), 844-854 (2015).
- Brocard, F., Verdier, D., Arsenault, I., Lund, J. P., Kolta, A. Emergence of intrinsic bursting in trigeminal sensory neurons parallels the acquisition of mastication in weanling rats. Journal of Neurophysiology. 96 (5), 2410-2424 (2006).
- Anders, S., et al. Spatial properties of astrocyte gap junction coupling in the rat hippocampus. Philosophical Transactions of the Royal Society of London. Series B, Biological Science. 369 (1654), (2014).
- Houades, V., et al. Shapes of astrocyte networks in the juvenile brain. Neuron Glia Biology. 2 (1), 3-14 (2006).
- Rouach, N., Koulakoff, A., Abudara, V., Willecke, K., Giaume, C. Astroglial metabolic networks sustain hippocampal synaptic transmission. Science. 322 (5907), 1551-1555 (2008).
- Claus, L., et al. Barreloid Borders and Neuronal Activity Shape Panglial Gap Junction-Coupled Networks in the Mouse Thalamus. Cerebral Cortex. 28 (1), 213-222 (2018).
- Cameron, M. A., et al. Prolonged Incubation of Acute Neuronal Tissue for Electrophysiology and Calcium-imaging. Journal of Visualized Experiments. (120), (2017).
- Kafitz, K. W., Meier, S. D., Stephan, J., Rose, C. R. Developmental profile and properties of sulforhodamine 101--Labeled glial cells in acute brain slices of rat hippocampus. Journal of Neuroscience Methods. 169 (1), 84-92 (2008).
- Neher, E. Correction for liquid junction potentials in patch clamp experiments. Methods in Enzymology. , 123-131 (1992).
- Giaume, C., Leybaert, L., Naus, C. C., Saez, J. C. Connexin and pannexin hemichannels in brain glial cells: properties, pharmacology, and roles. Frontiers in Pharmacology. 4, 88 (2013).
- Torres, A., et al. Extracellular Ca(2)(+) acts as a mediator of communication from neurons to glia. Science Signaling. 5 (208), ra8 (2012).
- Ye, Z. C., Wyeth, M. S., Baltan-Tekkok, S., Ransom, B. R. Functional hemichannels in astrocytes: a novel mechanism of glutamate release. Journal of Neuroscience. 23 (9), 3588-3596 (2003).
- Ma, B., et al. Gap junction coupling confers isopotentiality on astrocyte syncytium. Glia. 64 (2), 214-226 (2016).
- Meme, W., Vandecasteele, M., Giaume, C., Venance, L. Electrical coupling between hippocampal astrocytes in rat brain slices. Neuroscience Research. 63 (4), 236-243 (2009).
- Ransom, B. R., Kettenmann, H. Electrical coupling, without dye coupling, between mammalian astrocytes and oligodendrocytes in cell culture. Glia. 3 (4), 258-266 (1990).
- Audesirk, G., Audesirk, T., Bowsher, P. Variability and frequent failure of lucifer yellow to pass between two electrically coupled neurons in Lymnaea stagnalis. Journal of Neurobiology. 13 (4), 369-375 (1982).
- Ewadinger, N., Syed, N., Lukowiak, K., Bulloch, A. Differential Tracer Coupling between Pairs of Identified Neurones of the Mollusc Lymnaea Stagnalis. Journal of Experimental Biology. 192 (1), 291-297 (1994).
- Griemsmann, S., et al. Characterization of Panglial Gap Junction Networks in the Thalamus, Neocortex, and Hippocampus Reveals a Unique Population of Glial Cells. Cerebral Cortex. 25 (10), 3420-3433 (2015).
- Kuwajima, T., et al. ClearT: a detergent- and solvent-free clearing method for neuronal and non-neuronal tissue. Development. 140 (6), 1364-1368 (2013).
- Gourine, A. V., et al. Astrocytes control breathing through pH-dependent release of ATP. Science. 329 (5991), 571-575 (2010).
- Forsberg, D., Ringstedt, T., Herlenius, E. Astrocytes release prostaglandin E2 to modify respiratory network activity. eLife. 6, (2017).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。