JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
크기, 모양, 및 결합 된 이다의 네트워크의 방향 분석
요약
여기 astrocytic 네트워크의 조직 평가 프로토콜 선물이. 설명된 방법 셀 수, 크기, 지역, 및 핵 내의 위치 등이 네트워크의 기술적인 조치를 제공 하는 바이어스를 최소화 합니다. 이방성 vectorial 분석 평가 이다.
초록
그것은 이다 네트워크 수준에서 뿐만 아니라 시 냅 스 및 단일 세포 수준에서 뿐만 아니라 신경 기능 조절 점점 더 분명 되었다. 이다는 강력 하 게 서로 연결 간격 접속 점을 통해 이며 커플링이이 접합을 통해 역동적이 고 높은 규제. 새로운 개념은 astrocytic 함수는 전문화 하 고 그들은 연결 하는 신경 회로의 기능에 맞게. 따라서, 더 나은 그들의 통신을 제어 하 고 커플링 규칙을 설명 하 고 그들의 기능을 더욱 이해 하 astrocytic 네트워크의 다양 한 매개 변수를 측정 하는 방법이 필요 합니다.
여기, 이미지 분석 소프트웨어를 사용 하 여 (예., ImageJFIJI), 염료 커플링 공개 astrocytic 네트워크의 공초점 이미지를 분석 하는 방법을 설명. 이러한 방법은 허용 1)는 자동화 되 고 편견 검색 레이블이 지정 된 셀의 2) 3) 염료는 네트워크 내에서 확산과 4) 관심의 영역 내에서 네트워크의 위치에의 우선 방향 계산 네트워크의 크기의 계산 .
이 분석은 특정 영역의 astrocytic 네트워크 특성, 비교 다른 기능에 관련 된 다른 분야의 네트워크 또는 네트워크 연결에 서로 다른 영향을 서로 다른 조건 하에서 얻은 비교를 사용할 수 있습니다. 이러한 관측 기능 중요 한 고려 사항이 될 수 있습니다. 예를 들어, 우리가 어디 우리가 이전 나타났습니다 astrocytic 커플링 리듬 붕괴1토 닉에서 그들의 발사 패턴을 전환 하는 뉴런의 기능을 위해 필수적 이다 trigeminal 핵의 astrocytic 네트워크 분석. 크기, 감 금, 그리고이 핵에서 astrocytic 네트워크의 우선 방향을 측정, 우리 그들은 등 기능 도메인에 대 한 가설을 구축할 수 있습니다. 여러 연구 결과 시상 및 몇 가지 이름으로, 시각 피 질에 신 피 질, 측면 우수한 올리브, 후 각 glomeruli, 및 감각 핵을 포함 하 여 다른 몇몇 두뇌 지역 유사한 분석 으로부터 혜택을 받을 수는 것이 좋습니다.
서문
많은 연구는 어떻게 하위 셀룰러 또는 시 냅 스 수준에서 신경-사이토 대화 신경 기능 및 시 냅 스 전송에 영향을 가질 수 있습니다 설명 했습니다. 그것은 잘 이다 주변 신경 활동에 민감합니다 설립 사실, 그들은 많은 신경 전달 물질 등 조미료, GABA, 아 세 틸 콜린, ATP (이전에 게시 리뷰2,,34참조)에 대 한 수용 체가 있다. 반환에서는, astrocytic 처리 ensheath 시 냅 스 요소와 영향 신경 활동 거기와 extrasynaptic 사이트에 extracellular 이온 항상성 조절 하 고 여러 요인 또는 송신기 조미료, D-떠들고, ATP 등을 발표 하 여 5 , 6 , 7.
Astrocytic 커플링은 공간적으로 통제 되 고 취소 해 부 특징 영역에서 신경 세그먼트에 해당 하는 증거 이다 네트워크 수준에서 신경 기능 조절 또한 수 아이디어가 나왔다 (같은 감각 표현 영역), 구획 이다 보다는 그냥 그 근처는 같은 기능을 제공 하는 다른 이다에 커플 것입니다 나타냅니다. 측면 우수한 올리브에서 예를 들어, 가장 astrocytic 네트워크는8tonotopic 축 직교 방향 신 피 질 또는 olfactoty glomeruli 이다 간의 통신 배럴 또는 glomeruli 훨씬 더 강한 반면 그리고 인접 한 것 들9,10사이 약한. 두 경우 모두, astrocytic 네트워크는 glomerule 또는 배럴9,10의 중심을 향해 지향.
우리는 최근 astrocytic 활동의 extracellular 캘리포니아2 + 농도 감소 시켜 신경 발포 변조 보였다 ([캘리포니아2 +]e), S100β, 캘리포니아2 +의 출시를 통해 아마도-바인딩 단백질11. 감각 trigeminal 메인의 등 쪽 부분에 trigeminal rhythmogenic 뉴런의 인구에서 시연 되었다는 사실에서 유래한 다 핵 (NVsnpr, masticatory의 생성에 중요 한 역할을 생각),이 효과 이러한 뉴런에 리듬 발사는 영구 나+ 현재 [캘리포니아2 +]e11,12의 감소에 의해 추진에 따라 달라 집니다. 이러한 뉴런에 리듬 발사 그들의 입력의 자극 또는 인공 감소 [캘리포니아2 +]e의 "순수" elicited 수 있습니다. 우리는 더 astrocytic 커플링 신경 리듬 발사1필요 이었다는 것을 보여주었다. 이 astrocytic 네트워크 신경 활동을 동기화 할 수 및 조정 circumscribed 기능 도메인을 형성 수 있습니다 가능성 제기. 이 가설을 평가 하기 위해 우리가 먼저를 엄격 하 게 NVsnpr 내에서 이러한 네트워크의 조직 방법을 개발 필요 합니다.
Astrocytic 네트워크에 대 한 이전 연구 대부분 휴대폰 번호와 밀도 및 영역 결합의 정도 설명 했습니다. Astrocytic 네트워크의 형태와 염료-커플링의 방향 평가 하려고 했다 주로 배럴 피9, 마13,14, 두 개의 축 (x와 y)에 따라 네트워크의 크기를 비교 하 여 수행 15, barreloid 분야 시상16, 측면 우수한 올리브8, 후 각 glomeruli10, 피 질14의. 여기에 설명 된 메서드는 네트워크에 있는 레이블된 셀의 편견된 수와 그들이 커버 영역의 추정 가능 우리는 또한 네트워크 내에서 연결의 기본 설정된 방향을 정의 하 고 핵의 또는 다른 방향에서 중심으로 원하는 방향 인지 평가 도구를 개발 했다. 이전에 사용한 방법에 비해이 프로토콜 조직 및 알려진 취소 해 부가 없는 지 trigeminal 주 감각 핵 같은 구조에 astrocytic 네트워크의 방향을 설명 하는 수단 제공 서입니다. 위의 연구에서 네트워크 방향으로 이미 문서화 구조 자체의 모양에 관계 설명 (예., 시상, 피 질, 배럴에에서 barreloid 해 마와 피 질,에서 glomeruli 레이어 후 각 전구, 등입니다.)입니다. 또한, vectorial 분석 방향 밝혀 다른 조건 하에서 커플링의 비교에 대 한 수 있습니다. 이러한 매개 변수는 핵 내에서 네트워크의 위치에 따라 변경 여부 분석, 우리는 또한 핵의 경계에 관하여 각 네트워크를 대체 하는 방법을 개발. 이러한 도구는 연결 된 셀의 조사 네트워크에 대 한 다른 지역에 쉽게 적응 될 수 있다.
프로토콜
모든 절차는 건강 연구의 캐나다 학회 규칙에 의해 거주 하 고 몬트리올의 대학 동물 보호와 사용 위원회에 의해 승인 했다.
1입니다. 쥐 뇌 조각의 준비
- 자당 기반 솔루션 (표 1)의 1 리터와 표준 인공 뇌 척추 액체 (실제) (표 2) 1 리터를 준비 합니다.
- 95% O2 , 5% CO2 (carbogen) 30 분의 혼합으로 자당 기반 솔루션 솔루션 감기 하지만 하지 완전히 고정 될 때까지 약 30 분,-80 ° C에 그것을 배치 하기 전에 거품. 두뇌의 조각화에 대 한이 얼음 처럼 차가운 자당 절단 버퍼 사용 합니다. 냉동 고에서 제거 되 면 얼음에 그것을 유지.
- 전체 실험을 통해 carbogen와 실제 거품. 이 솔루션을 사용 하 여 슬라이스 저장용 perfusing 버퍼는 패치 클램핑 및 이다의 biocytin 채우기 수행 됩니다. 최대한 빨리 그들은 잘라 두뇌 분할 입금 챔버를 들고 조각을 복구를 준비 합니다.
참고: 슬라이스 복구 지주 챔버 주문 품 일 수 있고 실제, 튜브 아래쪽에서 carbogen 려 삽입으로 가득 큰 우물에 하단에 메쉬를 하나의 작은의 본질적으로 구성 되어. - 어떤 섹스 또는 스트레인 특정 편견 없이 15에 21-하루-오래 된 Sprague-Dawley 쥐를 사용 합니다. Isoflurane (1 mL의 마 취 유도 실에서 isoflurane)와 동물 anesthetize 부드럽게 뒷 발 또는 동물의 꼬리를 곤란 하 여 마 취의 깊이 확인 합니다.
- 목을 벨 쥐를 단두대를 사용 하 여가 위, 그것의 두개골을 잘라 고 신속 하 게 편평한 주걱으로는 두개골에서 뇌를 제거.
- 30 s 및 전송에 대 한 그것 (솔루션)에 페 트리 접시에 얼음 처럼 차가운 자당 기반 솔루션에서 뇌를 찍어. 면도기 칼 날 앞쪽 및 후부 영역으로 구분 되는 부분을 제거 절단 조각 가로 평면에서 경우.
- 접착제의 rostral 측면에 뇌 조직의 나머지 블록 고 자당 기반 매체는 vibratome를 사용 하 여 뇌 조각 (350 µ m 두께)을 잘라 계속 합니다. 그런 다음 전송 챔버를 사용할 수 있을 때까지 실 온 (RT)에서 carbogenated 실제 가득 들고 복구에서 수집 된 조각 (복구에 최소 1 시간을 허용).
참고: 필드에 최근 개발 허용 연장된 보육까지 체 외에서 뇌 조각의 24 h 조건17.
2. Sulforhodamine 101 (SR-101) 이다의 라벨
- 34 ° C에 물 목욕 전 열 및 그것 두 슬라이스 보육 실 장소. 분할 영역 보육 실 1 μ M를 포함 하는 실제의 솔루션 작성 SR-101, 채울 다른만 실제.
- 1 µ M를 포함 하는 인큐베이션 챔버에 슬라이스를 품 어 20 분 및 다음 전송 두 번째 외피에 그들 조직에서 초과 SR 101 개 린스 챔버 SR-101. 그것은 20 분 동안 품 어 또는 34 ° C에서 더 많은 다음 유지 때까지 RT에서 분할 영역을 포함 하는 인큐베이션 챔버 필요한18.
3. 사이토 패치 및 Biocytin 작성
- 슬라이스를 선택 하 고 현미경의 녹음 실에서 그것을 배치. 패치 이다, 4-6MΩ 칼륨 구 루 콘-기반 솔루션으로 채워질 때의 저항 전극 사용 ( 표 3참조).
- 시각적 지침과는 micromanipulator를 사용 하 여, 아래 그림 1에서 보듯이 한 SR 101 표시 된 사이토를 향해 기록 전극 직접. 이후 그들은 더 많은 가능성이 손상 되거나 인접 셀에 연결을 잃 었 조각의 표면에 있는 세포를 하지 마십시오.
- Biocytin 조직에서의 누설을 방지 하기 위해 패치 피 펫에 추가 긍정적인 압력을 최소화 하 고 고칠 것 이다 사이토 가까이 하는 경우에 적용 (0.1-0.4 mL 1 mL 주사기에).
- 패치 전에 피 펫의 커패시턴스의 간격 조정. 정확 하 고 정밀한 전압 명령을 중요 한 실험19액체 접합 잠재력에 대 한 수정.
- 피펫으로 긍정적인 압력에 의해 발생 하는 우울증을 관찰 하는 사이토를 충분히 가까이 이동 합니다. 그런 다음, 긍정적인 압력을 제거 하 고 천천히 일부 부정적인 압력을 적용. 클램프-70에 사이토 mV 인감 100 m ω에 도달 하면. 인감에 1-3 GΩ를 도달할 때까지 기다립니다. 계속 셀에 침입까지 부정적인 압력을 적용. 때문에 이다 매우 연약한 부정적인 압력을 적용 하는 동안 주의 해야 합니다.
- 기 워 진된 셀의 electrophysiological 속성을 평가 합니다. 전압 클램프 모드에서-120에서 110에 이르기까지 600 ms의 램프 전압 명령으로 전체 셀 전류-전압 프로토콜 수행 mV. 전류 클램프 모드에 있는 1000 밀리초 현재 단계 100 pA의-1에서 1 nA, 전체 셀 녹음의 샘플링 레이트의 주입은 10 kHz 단계 IV 프로토콜을 수행 합니다.
참고: 이다 정류 ( 그림 1B에서 같이)의 어떤 종류 없이 막 도발은 (그림 1C)에 따라 발사 작업 잠재력 선형 전류-전압 프로필 표시. 휴식 막 잠재력 (RMP) 안정적이 고을-60mV 긍정 하지 해야 합니다. 어떤 뇌 영역에 이다의 RMP는 NVsnpr에서 보다 더 hyperpolarized입니다. - 단계 IV 프로토콜 마다 5 분을 수행 하는 동안 30 분 동안 사이토 내 확산 biocytin 허용.
- 철회 및 패치 사이토를 손상 없이 패치 피 펫을 신중 하 게 분리 하 고 즉시 주의 피 펫의 오프셋의 녹음 실에서 그것을 복용 하기 전에. 막 잠재력 기록에서 해당 값을 뺍니다.
- 뇌 조각을 결합 된 셀의 전체 네트워크에 패치 사이토에서 추적 프로그램의 확산을 허용 (이외에 주입을 위한 30 분) 15 분의 최소 녹음 실에서 나머지를 남겨 주세요.
참고: 결합 된 세포의 네트워크를 공개, 단일 셀만 해야 패치 관심의 핵에서. 여러 시도가 성공적인 패치를 달성 하기 위해 필요한 경우, 경우 삭제 하 고 패치 contralateral 쪽 이나 다른 뇌 조각에 하려고 합니다. - 슬라이스 면을 위쪽으로 직면 하 고 식별 하는 조직에 마크 또는 절 개를 확인 하 고 4 %paraformaldehyde (PFA)의 솔루션으로 정상적인 실제를 포함 하는 배양 접시에 슬라이스를 먼저 전송. 4 ° C에서 슬라이스를 밤새 품 어.
주의: PFA 매우 유해한입니다. 보호 장비를 사용 하 여 통풍 후드. PFA 접촉 된 모든 자료 (브러쉬, 튜브, 등) 복구 챔버, 보육 실, 또는 신선한 조직의 기록에 사용 하는 기타 자료를 들고 게 연락 하지 마십시오 확인 하십시오.
4. Biocytin 계시
- 형광 streptavidine와 계시
- 워시 뇌 조각 2 x 10 분 0.1 M 인산 염 버퍼 식 염 수 (PBS)에 실시간에 그런 다음 실시간에 4 h 4% 비 이온 세제로 PBS에서 1/200 희석에 fluorophore를 활용 하는 streptavidine와 함께 뇌 조각 잠복기는 biocytin 공개
- RT에서 0.1 M PBS에 뇌 조각 3 x 10 분을 세척 하 고 수성 설치 매체를 사용 하 여 유리 슬라이드에 섹션을 탑재. 위쪽으로 coverslip 주입 했다 측면 슬라이드에 놓고 손톱 광택 그들을 봉인.
- DAB와 계시
참고: 소량 (3, 3-diaminobenzidine) 계시는 형광을 사용할 수 없는 경우 사용할 수 있습니다. 이 경우에, 하나의 계시 방법 비교에 대 한 고용 해야 합니다.- 뇌 조각 실시간에 PBS에 3 x 10 분 알을 품고 조각 PBS + H2O2 0.5% 실시간에서 1 시간 동안 세척
- 실시간에 PBS에 조각 3 x 10 분을 씻어 그런 다음, 실시간 24 시간 PBS와 0.1% 비 이온 세제 + avidin 비타민 b 복합체 복잡 한 과산화 효소 표준 얼룩 키트 시 약 1/100의 구성 avidin 비타민 b 복합체 복잡 한 얼룩 솔루션에서 분할 영역을 품 어
- RT에 PBS에 3 x 10 분 슬라이스를 헹 구 십시오, PBS의 솔루션에 그들을 품 어 + RT에서 20 분에 대 한 0.05%를 소량 PBS의 솔루션으로 그들을 전송 + DAB 0.05% + H2O2 0.5%.
주의: 소량은 매우 해로운. 보호 장비를 사용 하 여 통풍 후드. 슬라이스는 PBS에 전송 될 때 색상 반응 중지 됩니다. - RT에 PBS에 조각 5 x 10 분을 씻어, 유리 슬라이드 (얼굴 위쪽으로 주입 했다 측면)에 섹션을 마운트 슬라이드 벤치 34 ° c.에 하룻밤 건조에 말리 고
- 1 분 동안 크 실 렌의 목욕, 70%, 100%, 95%, 및 끝에 몇 가지 알코올 목욕에 1 분 동안 유리 슬라이드 잠수함
- 유리 슬라이드는 톨루엔 기반 합성 수 지 매체를 설치를 사용 하 여 탑재 합니다. Coverslips를 슬라이드에 놓고 손톱 광택 그들을 봉인.
5. 네트워크 영상
- 스캐닝 confocal 현미경 20 X 4 X 목표 (또는 네트워크는 전체 핵을 시각화 하는 적절 한 목표)를 사용 하 여 astrocytic 네트워크 시각화는 fluorophore를 감지 하는 레이저 (이 경우에, 알 렉 사-594는 사용).
- 20 배 확대를 사용 하 여 레이블이 지정 된 셀의 네트워크의 z 스택 수 있도록. 800 x 800 픽셀의 해상도 사용 하 고 스캔 속도 12.5 μ/픽셀의.
참고: 전체 네트워크 이미지를 위해 여러 기반은 일반적으로 필요 하 고, 그리고 스택 수 각 네트워크에 대 한 조정 될 필요가 있다. 모든 데이터의 이미지를 동일한 설정을 사용 해야 하지만 볼 수 있듯이 해상도 및 스캔 속도 변경할 수 있습니다. - 4 배 확대를 사용 하 여 네트워크 및 관심 영역에의 이미지를 데리고.
참고: 이미징 X 4는 관심의 핵 내 네트워크 위치를 결정 하는 데 사용 됩니다. 항상 이미지 전송된 빛에 동일한 필드. 공초점 형광 이미지에서 핵의 테두리를 확인할 수 없는 경우이 이미지는 유용할 것 이다.
6. 이미지 분석
- 데이터 준비
- ImageJFIJI 소프트웨어를 사용 하 여 (https://fiji.sc/에서 다운로드). 파일을 "바이오 형식 가져오기 옵션" 창에서 확인을 클릭 합니다.
- Z-스택만 최종 z-스택 (그림 2A)에 필요한 광학 분할 영역을 포함 하는 재정의 하려면 도구 모음에서 "스택" 손잡이에 (찾을, 먼저 stk 선택 | Z 프로젝트)입니다. 프로젝션 유형 설정 (그림 2A)에서 "최대 강도"를 선택 합니다. 파일을 저장 하 고 이름을 "스택 파일".
- 이미지 파일에 여러 채널 있으면 astrocytic 네트워크 영상으로 채널만을 보존 하기 위해 그것을 분할 (이미지 | 컬러 | 채널 분할).
- 이미지의 픽셀 설정을 확인 [이미지 | 속성 | 픽셀 (픽셀 차원에 대 한 "1")와 함께].
- Subtract 배경 도구를 사용 하 여 (프로세스 | 배경 빼기) biocytin 라벨의 배경을 제거 하. 미리 보기 기능을 사용 하 여 일반적으로 50 픽셀 (그림 2B)에 설정 된 롤링 볼 반지름 설정.
- 제거 outliers 도구를 사용 하 여 (프로세스 | 소음 | Outliers를 제거) 빼기 배경 단계에 따라 필요한 경우. "어떤 Outliers" 설정 (그림 2C)에 "밝은"를 선택 합니다. 미리 보기 기능을 사용 하 여 반경 및 임계값 설정. 이후 그림 2D와 같이 그것은 데이터를 흐리게 수 있습니다이 도구와 함께 주의 해야 합니다.
참고:이 도구는 (같이 그림 2B와 2c 에 흰색 화살표로 처리, 전후 각각) streptavidine의 불특정 예금으로 인 한 작은 반점 제거 됩니다. - 임계값을 조정 (이미지 | 조정 | 임계값)입니다. "기본" 및 "B & W" 모드 (그림 2E)을 선택 합니다. "적용" 클릭 합니다.
참고: 자동 조정 사용할 수 있습니다, 하지만 두 개의 슬라이더 막대를 사용 하 여 수동 조정 하는 것이 좋습니다. 이 단계의 목표는 소음을 줄이기 위해 최대 레이블이 지정 된 셀에 그대로입니다. - 이진 프로세스 도구 바이너리 이미지 이미지 변환 (프로세스 | 이진 | 이진 하 게) 그림 2 층에 같이. TIFF 파일로 파일을 저장 하 고 이름을 "이진 파일".
- 셀 계산
- 측정 기능 설정을 확인 (분석 | 설정 측정). "중심" 옵션을 선택 합니다.
- "이진 파일"에서 "입자 분석" 도구를 사용 하 여 이전 단계에서 (그림 3A) 생산 (분석 | 입자 분석) (왼쪽그림 3C ). "표시" 설정 (그림 3C)에서 "설명"을 선택 합니다. 이 탐지 (그림 3B)의 결과 표시 하는 새 파일을 생성 합니다.
- 매개 변수와 함께 재생: (만 셀을 검출 하려면 30과 6000 사이의 값을 사용 하 여) 크기와 순환 (사이의 간격을 결정 하 0 ~ 1는 "1"에서 완벽 한 원형 및 정의 "0" 임의의 모양) 탐지 (그림 3C, 왼쪽 부분)을 수정. "확인"을 클릭 하 여 검색을 실행 합니다.
참고: 두 테이블 검색 다음 표시 됩니다: 각 셀 x 및 y 좌표를 제공 하는 1) 테이블 "요약" 제목 검색 된 셀의 수를 제공 하 고 2) "결과" (그림 3C, 오른쪽 부분) 라는 테이블. - 값을 복사 하는 스프레드시트 응용 프로그램에 붙여넣을 합니다. 이름 "감지 테이블"에서이 테이블을 저장 합니다. 검색 된 셀의 음모와 파일 (그림 3B) 나타납니다. 이름 "검색 파일" TIFF 파일로이 파일을 저장 합니다.
- 분수령 도구를 사용 하 여 네트워크에서 2 또는 더 레이블 셀 그룹 분석 입자 도구 단일 셀 때문에 너무 가깝게 서로 게 감지 되 면 (프로세스 | 이진 | 분수령) 바이너리 이미지 분석 입자를 적용 하기 전에 도구를, 그리고 분석 입자 단계를 다시 실행.
참고: 분수령 도구는 매우 가까운 셀 사이의 폭 1 픽셀의 한계를 만듭니다. 셀 카운터 플러그인 수 있는 라벨은 모호 하 고 수동으로 수행할 수 있습니다 때 사용.
- Astrocytic 네트워크 영역 측정
- 네트워크의 표면적을 측정 하려면 제이 이미지를 사용 하 여 검색 파일
- 다각형 선택 도구를 선택 하려면 도구 모음에서 단추 (왼쪽된 클릭)를 사용 하 여 (그림 4A) 네트워크의 외부 주변에 있는 모든 셀을 연결 하는 다각형을. 왼쪽 다각형, 추적을 시작 하 고 그것을 마우스 오른쪽 단추로.
참고:이 다각형 (ROI)의 지역으로 정의 됩니다 하 고 그것의 표면 네트워크의 표면 영역을 결정 하기 위해 측정 됩니다. - 설정된 측정 창을 엽니다 (분석 | 측정 설정) 및 "영역" 옵션을 선택. 투자 수익 관리자 (분석 | 도구 | 투자 수익 관리자) (그림 4B). 다음, '추가 ' (그림 4B)를 클릭 하 여 추적된 다각형 투자 수익 관리자에서 추가 하 고 ROI 관리자에서 '측정'을 클릭 하 여 측정을 실행.
참고: 영역 측정 테이블에 표시 됩니다 및 픽셀 단위로 표시 됩니다. Μ m2에서 값을 가져오는 데 사용 하는 현미경에 대 한 변환 인수를이 값으로 변환 하는 것을 잊지 마십시오.
- 주요 방향 벡터의 결정
- 기 워 진된 셀의 결정
- ImageJFIJI에서 스택 파일을 열고 그것의 강한 라벨 강도 (그림 4C)에 따라 스택 파일에 패치 셀을 식별 합니다. 그런 다음 스프레드시트 응용 프로그램에서 "검색 표" 라는 파일 열고 패치 된 셀 및 해당 좌표에 관련 된 수 있습니다.
- 정확 하 게 패치 된 셀을 확인할 수 없습니다, 경우에 biocytin 예금 ImageJFIJI에서 다각형 도구를 사용 하 여 결합 된 셀의 이미지 네트워크에서 밀도가 지역 포위 하 고 패치 셀 (그림 4D)의이 위치 합니다.
- 투자 수익 관리자를 사용 하 여 (분석 | 도구 | 투자 수익 관리자)입니다. 그런 다음 패치 셀 위치에는 투자 수익을 그릴 하 고 ROI 관리자에 추가 ( 그림 4B참조).
- 설정 측정 (분석 | 설정 측정) 하 고 "중심" 옵션을 선택 합니다.
- 투자 수익 관리자에서 "측정" 추적된 지역의 중심의 좌표를 클릭. 이 좌표를 사용 하 여이 특정 네트워크에 대 한 참조 지점으로.
- 참조 번역
- 다음 수식을 사용 하 여 패치 사이토에 관하여 각 셀의 좌표를 계산.

함께: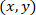 좌표로 주어진 셀;
좌표로 주어진 셀; 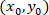 패치 셀 (또는 네트워크의 참조 포인트);의 좌표로 그리고
패치 셀 (또는 네트워크의 참조 포인트);의 좌표로 그리고 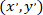 으로 지정 된 셀에 새 참조에 대 한 좌표.
으로 지정 된 셀에 새 참조에 대 한 좌표.
참고: 패치 사이토에서 벡터 계산에 중요 한 단계는 패치 사이토에 관하여 각 셀의 좌표를 표현. 조심 하면 ImageJFIJI를 사용 하 여 모든 이미지에 대 한 참조는 이미지의 왼쪽 위 모서리에 있는.
- 다음 수식을 사용 하 여 패치 사이토에 관하여 각 셀의 좌표를 계산.
- 우선 방향의 주요 벡터의 결정
- 다음 수식 사용 하 여 우선 방향의 기본 벡터의 좌표를 계산.
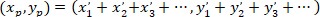
함께: (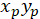 )으로 우선 방향;의 기본 벡터의 좌표 그리고
)으로 우선 방향;의 기본 벡터의 좌표 그리고 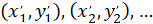 는 패치 취득 네트워크의 각 셀의 좌표로 셀로 참조.
는 패치 취득 네트워크의 각 셀의 좌표로 셀로 참조.
참고: 네트워크에 있는 각 셀에 대 한 벡터 패치 사이토의 좌표를 기준으로 결정 됩니다. 우선 방향 네트워크의 주요 벡터는이 벡터의 합. - 하나 (이후 패치 셀의 좌표 포함 되지 않습니다), 마이너스 네트워크에서 셀의 수에 나누어 (위의 수식을 사용 하 여에서 얻은 좌표에서 제공) 주요 벡터의 길이 값을 정규화 하 고 사이 비교를 사용 하 네트워크입니다. 이 분석의 회로도 보기는 그림 5에 표시 됩니다.
- 다음 수식 사용 하 여 우선 방향의 기본 벡터의 좌표를 계산.
- 기 워 진된 셀의 결정
- 관심의 핵에서 분석 된 네트워크의 배치
- 20 X 4 X 이미지의 맞춤
- (NVsnpr)의 핵에 있는 각 네트워크의 위치를 확인 하려면 4 X 이미지를 사용 합니다. 벡터 이미지 편집기로 4 X 이미지를 엽니다.
- 4 X 이미지를 선택 하 고 5로 그것을 곱하여 그 크기를 수정 합니다. 차원 창의 위쪽 가로 도구 모음의 오른쪽 부분에 위치 해 있습니다. 예를 들어, 800 x 800 픽셀 샘플링 되는 4 X 이미지, 4000 x 4000 픽셀 샘플링 해상도 변경 (픽셀 단위로 작업 단위를 설정로 이동 "문서 설정" 파일 탭: 파일 | 문서 설정)입니다. TIFF 형식 및 이름 그것 "크기 4 X" 파일을 내보냅니다.
- 어도비 일러스트 레이 터 문서의 왼쪽 아래 모서리와 이미지의 왼쪽 위 모서리를 맞춥니다.
참고: 소프트웨어 왼쪽 하단 참조 지점에서 좌표를 제공합니다. - 네트워크의 20 X 이미지를 엽니다. '바이너리 파일 ' 또는 '검색 파일 '을 사용 하 여 그들은 정렬 하기 쉽기 때문에. 다음, 다시 크기 4 X 정렬 20 X 이미지의 '이진 파일'에 불투명도 도구 함께 플레이 이미지.
참고: 투명도 도구 최고 가로 도구 모음에는. - 때 정렬이 완료 및 측정 도구가 나타납니다, 그래서 피 펫 도구를 잡고 선택한 왼쪽된 도구 모음에서 선택.
- 20 X의 좌표를 참조 20 X 이미지의 왼쪽 위 모서리에 클릭 하 여 측정 도구 크기 4 X에 포인트를 사용 하 여 이미지.
참고: 라고 하는 20 X 참조 (20XR 그림5에서),이 좌표는 핵의 그리기 회로도에 각 네트워크의 위치를 표현 하는 데 유용 있을 것입니다.
- 관심의 핵의 정규화
참고: 데이터를 요약, 사각형으로 핵 (NVsnpr)의 정규화가 사용 됩니다. 아래 단계를 설명 합니다.- 오픈 4 X ImageJFIJI에서 파일 크기를 조정 하 고 다각형 도구를 사용 하 여 핵 (NVsnpr)를 둘러싸고. 사용 하 여 이미지 전송된 빛으로 핵의 테두리; 볼 수 수 없는 경우 어떤 경우에, 먼저 그것을 조정 기억 해요.
- 투자 수익 관리자 열고 그려진된 ROI를 추가 합니다. "설정 측정"에서 ' 경계 사각형 ' 옵션을 선택 합니다.
참고: "경계 사각형" 옵션 그려진된 핵 주위에 작은 사각형을 계산합니다. - "측정"을 클릭 합니다.
참고: BX와 BY, 사각형의 왼쪽된 위 모퉁이의 좌표는 테이블이 나타납니다: ' 사각형 위치 ' 하 고 너비와 높이 제공 합니다. BX, BY 이라고 참조 하는 경계 사각형의 좌표는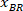 및
및 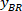 .
.
- 정규화 된 핵에서 각 네트워크 위치 표현
- 각 셀 참조 X 4 (검은 사각형 그림5에서)의 좌표 표현 다음 수식을 사용 하 여:

장소: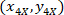 는 4 X 셀 좌표 참조;
는 4 X 셀 좌표 참조; 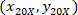 는 20 X 참조 셀 좌표 (오렌지 광장 그림 5에서); 그리고
는 20 X 참조 셀 좌표 (오렌지 광장 그림 5에서); 그리고 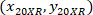 X 4 X 이미지 (20XR)에서 참조 포인트 20의 좌표.
X 4 X 이미지 (20XR)에서 참조 포인트 20의 좌표. - ( 그림 5의 파란색) 참조 하는 경계 사각형에 셀 좌표 표현 다음 수식을 사용 하 여:
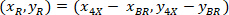
장소: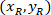 셀 참조; 하는 경계 사각형의 좌표는
셀 참조; 하는 경계 사각형의 좌표는 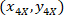 는 X 4에서 셀 좌표 참조; 그리고
는 X 4에서 셀 좌표 참조; 그리고  는 경계 사각형의 좌표 4 X 이미지에서 참조.
는 경계 사각형의 좌표 4 X 이미지에서 참조. - 다음 수식을 사용 하 여 경계 사각형의 높이 폭의 비율을 참조 하는 경계 사각형의 셀 좌표 변환:
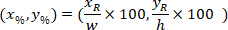
장소: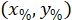 셀 폭의 비율 및 높이 경계 사각형;의 좌표는
셀 폭의 비율 및 높이 경계 사각형;의 좌표는 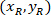 셀 참조; 하는 경계 사각형의 좌표는
셀 참조; 하는 경계 사각형의 좌표는  프로토콜; 위에서 측정 하는 경계 사각형의 너비입니다 그리고
프로토콜; 위에서 측정 하는 경계 사각형의 너비입니다 그리고 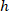 는 경계 사각형의 높이 측정 위의 프로토콜에.
는 경계 사각형의 높이 측정 위의 프로토콜에. - 같은 그림에 모든 네트워크를 표현 하기 위해 계정에 걸릴 슬라이스 (왼쪽 또는 오른쪽)의 방향. 데이터를 표준화 하는 참조에 적용 됩니다 슬라이스의 왼쪽. X 좌표에만 다음 수식을 적용 하 여 왼쪽 오른쪽의 네트워크 좌표를 전송:
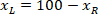
장소: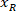 은 슬라이스; 오른쪽에 x 좌표 그리고
은 슬라이스; 오른쪽에 x 좌표 그리고 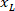 은 새로운 x 좌표 슬라이스의 왼쪽에는 참조에 표현.
은 새로운 x 좌표 슬라이스의 왼쪽에는 참조에 표현.
참고: 또는, 거울 분석 하기 전에 ImageJFIJI에 그림 (이미지 | 변환 | 뒤집기 수평으로). - 우선 방향의 기본 벡터의 좌표 표현 하 셀 좌표 (단계 6.5.3.1 6.5.3.4)와 같은 단계를 수행 합니다.
참고: 백분율로 좌표 식 있는 핵 (NVsnpr)은 사각형으로 설계 된 단일 플롯으로 데이터의 편집을 허용 한다.
- 각 셀 참조 X 4 (검은 사각형 그림5에서)의 좌표 표현 다음 수식을 사용 하 여:
- 20 X 4 X 이미지의 맞춤
- 우선 방향 주요 벡터의 각도 차이의 연구
참고: astrocytic 네트워크의 각도 차이 관심의 핵의 중심을 향해 우선 방향을 인지 확인 하는 데 사용 됩니다. ( 그림 5의 PD, 빨간 라인) 네트워크의 우선 방향의 주요 벡터와 c P를 연결 하는 선 사이의 각도 각도 차이 ( 그림 5의 α)를 계산 하려면 삼각형 PDC (참조로 알-카스 정리 적용 삽입 된 그림 5 의 보충 방법).- 첫째, 직교 참조 사용 하 여 다음과 같은 방정식으로 피타고라스의 정리의 응용 프로그램을 사용 하 여 서로 다른 길이 계산:
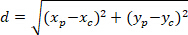
장소: P와 C의 좌표는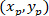 ,
,  , 각각, (위의 계산) 경계 사각형 참조에서.
, 각각, (위의 계산) 경계 사각형 참조에서. - 다음 수식을 사용 하 여 라디안에서 각도 차이 확인 합니다.
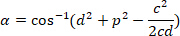
- 도 (예를 들어, Excel 소프트웨어에서도 함수) 각도 차이 변환 합니다.
- 세로 막대형 차트 (그림 ℃ 및 7 D)에 그들을 그려서 모든 각도 차이 컴파일하고 astrocytic 네트워크의 우선 방향을 인지 확인 합니다.
- 첫째, 직교 참조 사용 하 여 다음과 같은 방정식으로 피타고라스의 정리의 응용 프로그램을 사용 하 여 서로 다른 길이 계산:
결과
뇌에서 세포 간의 결합 정적 하지만 오히려 동적으로 많은 요인에 의해 규제 되지 않습니다. 다른 조건 하에서 공개 astrocytic 네트워크를 분석 하 고 NVsnpr에 그들의 조직을 이해 하기 설명 하는 방법 개발 되었다. 이러한 결과 출판된1에 이미 있다. 우리는 세 가지 다른 조건에서 NVsnpr의 등 쪽 부분에 단일 이다 biocytin 작성 수행: 캘리포니아2 +(제어 ...
토론
Electrophysiological 방법의 수 이다23,24사이 결합 기능을 평가 하기 위해 존재 한다. 그러나,이 메서드는 astrocytic 네트워크의 해부학 적 배열에 대 한 정보를 제공 하지 않습니다. 많은 연구를 이미 그 "염료 또는 추적 프로그램-커플링", 다 여기, 발생의 일부분에만 electrophysiological 방법25,26,27<...
공개
저자는 공개 없다.
감사의 말
이 작품은 건강 연구의 캐나다 학회, 부여/보너스 번호에 의해 투자: 14392.
자료
| Name | Company | Catalog Number | Comments |
| NaCl | Fisher Chemicals | S671-3 | |
| KCl | Fisher Chemicals | P217-500 | |
| KH2PO4 | Fisher Chemicals | P285-500 | |
| MgSO4 | Fisher Chemicals | M65-500 | |
| NaHCO3 | Fisher Chemicals | S233-500 | |
| C6H12O6 Dextrose anhydrous | Fisher Chemicals | D16-500 | |
| CaCl2 dihydrated | Sigma | C70-500 | |
| Sucrose | Sigma | S9378 | |
| D-gluconic acid potassium salt | Sigma | G45001 | |
| MgCl2 anhydrous | Sigma | M8266 | |
| HEPES | Sigma | H3375 | |
| EGTA | Sigma | E4378 | |
| ATPTris Salt | Sigma | A9062 | |
| GTPTris Salt | Sigma | G9002 | |
| Biocytin | Sigma | B4261 | |
| Carbenoxolone disodium salt | Sigma | C4790 | |
| avidin-biotin complex : ABC kit | Vestor laboratories | PK-4000 | |
| Streptavidine-alexa 594 | Molecular Probes | S11227 | |
| Triton | Fisher Chemicals | BP151-500 | |
| Xylene | Fisher Chemicals | X5-1 | |
| Aqueous mounting medium 1 : Fluoromount-G | SouthernBiotech | 0100-01 | |
| Toluen-based synthetic resin mounting medium : Permount | Fisher Chemicals | SP15-100 | |
| Slide Drying Bench | Fisherbrand | 11-474-470 | |
| Vibratome | Leica | VT 1000S | |
| Microscope cover glass | Fisherbrand | 12-544A | |
| Microscope slide ColorFrost | Fisherbrand | 12-550-413 | |
| PFA | Fisherchemicals | 04042-500 | |
| Olympus FluoView FV 1000 Confocal microscope | Olympus | ||
| 40X water-immersion lens | Olympus | LUMPLFLN40XW | |
| 20X water-immersion lens | Olympus | XLUMPLFL20XW | |
| 4X water-immersion lens | Olympus | XLFLUOR4X/340 | |
| Micropipette puller | Sutter Instrument | P97 | |
| Micromanipulator | Sutter Instrument | MP 225 | |
| Camera CCD | Sony | CX-ST50 | |
| Black and white monitor | Sony | SSM-125 | |
| Digidata | Molecular devices | 1322A | |
| Patch Clamp amplifier | Axon instrument | Mulitclamp 700A | |
| Electrophysiology acquisition software | Molecular devices | pClamp 8 | |
| Electrophysiology analysis software | Molecular devices | Clampfit 8 | |
| Imaging analysis software | ImageJFIJI | Open source software. FIJI version including plug in package. | |
| Vector image editor | Adobe | Illustrator CS4 | |
| Spreadsheet application | Microsoft Office | Excel 2010 |
참고문헌
- Condamine, S., Lavoie, R., Verdier, D., Kolta, A. Functional rhythmogenic domains defined by astrocytic networks in the trigeminal main sensory nucleus. Glia. 66 (2), 311-326 (2018).
- Verkhratsky, A., Orkand, R. K., Kettenmann, H. Glial calcium: homeostasis and signaling function. Physiological Review. 78 (1), 99-141 (1998).
- Christensen, R. K., Petersen, A. V., Perrier, J. F. How do glial cells contribute to motor control?. Current Pharmaceutical Design. 19 (24), 4385-4399 (2013).
- Verkhratsky, A., Steinhauser, C. Ion channels in glial cells. Brain Research Review. 32 (2-3), 380-412 (2000).
- Harada, K., Kamiya, T., Tsuboi, T. Gliotransmitter Release from Astrocytes: Functional, Developmental, and Pathological Implications in the Brain. Frontiers Neuroscience. 9, 499 (2015).
- Montero, T. D., Orellana, J. A. Hemichannels: new pathways for gliotransmitter release. Neuroscience. 286, 45-59 (2015).
- Araque, A., et al. Gliotransmitters travel in time and space. Neuron. 81 (4), 728-739 (2014).
- Augustin, V., et al. Functional anisotropic panglial networks in the lateral superior olive. Glia. 64 (11), 1892-1911 (2016).
- Houades, V., Koulakoff, A., Ezan, P., Seif, I., Giaume, C. Gap junction-mediated astrocytic networks in the mouse barrel cortex. Journal of Neuroscience. 28 (20), 5207-5217 (2008).
- Roux, L., Benchenane, K., Rothstein, J. D., Bonvento, G., Giaume, C. Plasticity of astroglial networks in olfactory glomeruli. Proceedings of the National Academy of Science of the United State of America. 108 (45), 18442-18446 (2011).
- Morquette, P., et al. An astrocyte-dependent mechanism for neuronal rhythmogenesis. Nature Neuroscience. 18 (6), 844-854 (2015).
- Brocard, F., Verdier, D., Arsenault, I., Lund, J. P., Kolta, A. Emergence of intrinsic bursting in trigeminal sensory neurons parallels the acquisition of mastication in weanling rats. Journal of Neurophysiology. 96 (5), 2410-2424 (2006).
- Anders, S., et al. Spatial properties of astrocyte gap junction coupling in the rat hippocampus. Philosophical Transactions of the Royal Society of London. Series B, Biological Science. 369 (1654), (2014).
- Houades, V., et al. Shapes of astrocyte networks in the juvenile brain. Neuron Glia Biology. 2 (1), 3-14 (2006).
- Rouach, N., Koulakoff, A., Abudara, V., Willecke, K., Giaume, C. Astroglial metabolic networks sustain hippocampal synaptic transmission. Science. 322 (5907), 1551-1555 (2008).
- Claus, L., et al. Barreloid Borders and Neuronal Activity Shape Panglial Gap Junction-Coupled Networks in the Mouse Thalamus. Cerebral Cortex. 28 (1), 213-222 (2018).
- Cameron, M. A., et al. Prolonged Incubation of Acute Neuronal Tissue for Electrophysiology and Calcium-imaging. Journal of Visualized Experiments. (120), (2017).
- Kafitz, K. W., Meier, S. D., Stephan, J., Rose, C. R. Developmental profile and properties of sulforhodamine 101--Labeled glial cells in acute brain slices of rat hippocampus. Journal of Neuroscience Methods. 169 (1), 84-92 (2008).
- Neher, E. Correction for liquid junction potentials in patch clamp experiments. Methods in Enzymology. , 123-131 (1992).
- Giaume, C., Leybaert, L., Naus, C. C., Saez, J. C. Connexin and pannexin hemichannels in brain glial cells: properties, pharmacology, and roles. Frontiers in Pharmacology. 4, 88 (2013).
- Torres, A., et al. Extracellular Ca(2)(+) acts as a mediator of communication from neurons to glia. Science Signaling. 5 (208), ra8 (2012).
- Ye, Z. C., Wyeth, M. S., Baltan-Tekkok, S., Ransom, B. R. Functional hemichannels in astrocytes: a novel mechanism of glutamate release. Journal of Neuroscience. 23 (9), 3588-3596 (2003).
- Ma, B., et al. Gap junction coupling confers isopotentiality on astrocyte syncytium. Glia. 64 (2), 214-226 (2016).
- Meme, W., Vandecasteele, M., Giaume, C., Venance, L. Electrical coupling between hippocampal astrocytes in rat brain slices. Neuroscience Research. 63 (4), 236-243 (2009).
- Ransom, B. R., Kettenmann, H. Electrical coupling, without dye coupling, between mammalian astrocytes and oligodendrocytes in cell culture. Glia. 3 (4), 258-266 (1990).
- Audesirk, G., Audesirk, T., Bowsher, P. Variability and frequent failure of lucifer yellow to pass between two electrically coupled neurons in Lymnaea stagnalis. Journal of Neurobiology. 13 (4), 369-375 (1982).
- Ewadinger, N., Syed, N., Lukowiak, K., Bulloch, A. Differential Tracer Coupling between Pairs of Identified Neurones of the Mollusc Lymnaea Stagnalis. Journal of Experimental Biology. 192 (1), 291-297 (1994).
- Griemsmann, S., et al. Characterization of Panglial Gap Junction Networks in the Thalamus, Neocortex, and Hippocampus Reveals a Unique Population of Glial Cells. Cerebral Cortex. 25 (10), 3420-3433 (2015).
- Kuwajima, T., et al. ClearT: a detergent- and solvent-free clearing method for neuronal and non-neuronal tissue. Development. 140 (6), 1364-1368 (2013).
- Gourine, A. V., et al. Astrocytes control breathing through pH-dependent release of ATP. Science. 329 (5991), 571-575 (2010).
- Forsberg, D., Ringstedt, T., Herlenius, E. Astrocytes release prostaglandin E2 to modify respiratory network activity. eLife. 6, (2017).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유