Method Article
كشف البلطي بحيرة الفيروسات باستخدام التقليدية RT-PCR وسيبر الأخضر RT-قبكر
In This Article
Summary
هذا البروتوكول تشخيص "الفيروس بحيرة البلطي" (تيلف) في أنسجة البلطي استخدام منهجيات RT-PCR. ويرد وصف الأسلوب كامل من تشريح الأنسجة إلى مجموع استخراج الحمض النووي الريبي، تليها كدنا التوليف وكشف تيلف بكر التقليدية أو PCR الكمي دسدنا ملزمة صبغة فلورسنت ملزم باستخدام.
Abstract
والهدف من هذا الأسلوب لتسهيل كشف "الفيروس بحيرة البلطي" (تيلف) سريعة وحساسة ومحددة في الأنسجة البلطي. يمكن استخدام هذا البروتوكول كجزء من برامج المراقبة وتدابير السلامة البيولوجية في المختبرات البحثية الأساسية تيلف. معيار الذهب لتشخيص الفيروس عادة ما ينطوي على عزل الفيروس متبوعاً بتقنيات تكميلية مثل النسخ العكسي تفاعل البوليميراز المتسلسل (RT-PCR) لمزيد من التحقق. وهذا يمكن أن تكون مرهقة، وتستغرق وقتاً طويلاً ويتطلب عادة عينات الأنسجة بشكل كبير مصاب بالفيروس. استخدام الرايت-الكمية (q) PCR في الكشف عن الفيروسات مفيد بسبب طبيعته الكمية وحساسية عالية، وخصوصية، والتدرجية ووقتها السريع يؤدي إلى. هنا، يقوم الأسلوب الكامل من بكر النهج تيلف الكشف وصف، من البلطي جهاز تقطيع، مجموع الحمض النووي الريبي (الرنا) استخراج استخدام الحل ثيوسيانات-الفينول-كلوروفورم جوانيديوم، والكمي الجيش الملكي النيبالي، متبوعاً بكر خطوتين أنا صبغ تنطوي على البروتوكول، توليف مكملة الحمض الخلوي الصبغي (كدنا) وكشف تيلف بكر التقليدية أو تحديد الكمية عن طريق qPCR استخدام سيبر الخضراء. يتطلب خطوات بوست-بكر بكر التقليدية وستبلغ ببساطة عن وجود الفيروس. سوف تسمح للقياس الكمي المطلق تيلف وصولاً إلى أقل قدر 2 نسخ النهج الأخير واستثنائية وبالتالي مفيد لتشخيص تيلف في الحالات السريرية الفرعية. وصف مفصل للنهج بكر، نتائج تمثيلية من مختبرين اثنين ومناقشة مستفيضة للمعلمات حرجة على حد سواء قد أدرجت للتأكد من أن الباحثين ونفسيين العثور على الأكثر مناسبة وقابلة للتطبيق أسلوب للكشف عن تيلف.
Introduction
إمدادات الأسماك العالمية الفرد بلغ رقماً قياسياً جديداً 20 كجم في عام 2014، وكان هذا بسبب النمو القوى في تربية الأحياء المائية. الاستزراع المائي لا يزال واحداً من أسرع الأغذية الحيوانية القطاعات المنتجة في جميع أنحاء العالم، وهو قطاع الأغذية الحيوانية فقط المنتجة التي ينمو بوتيرة أسرع من السكان البشرية1. وتشمل سيتشيلدس تيلابييني ثاني أهم الأسماك المياه العذبة المستزرعة في جميع أنحاء العالم مع إجمالي إنتاج عالمي من 6.4 مليون طن (طن متري) وتقدر قيمتها ب9.8 بیلیون دولار أمريكي بحلول عام 20152. المنتجين العشرة الأوائل من البلطي هي الصين (1.78 مليون طن)، إندونيسيا (1.12 مليون طن) ومصر (0.88 طن متري)، متبوعاً ببنغلاديش، وفيتنام، والفلبين، والبرازيل وتايلند، وكولومبيا وأوغندا2. ومن المتوقع أن يكون إنتاج البلطي العالمي حوالي 7.3 مليون طن بحلول عام 20303. وقد أصبحت البلطي مثل هذا مصدر الغذائي عالمي هام ليس فقط لأنها مصدر رخيص للبروتين4 بل أيضا لأنها سهلة تولد في القدرة في إطار طائفة واسعة من المياه والمناخ الشروط5،6. عقود قليلة مضت، كان يعتقد أن هناك عدد قليل من الأمراض التي تهدد استزراع البلطي تجارياً كبيرا، لكن هذا لم يعد صحيحاً. هو مرض فيروسي ناشئة تسمى البلطي بحيرة فيروس المرض (تيلفد) العثور على أول وباء المرض الحرجة من أي وقت مضى في البلطي والصناعة برمتها في خطر. هذا المرض له عواقب اجتماعية-اقتصادية خطيرة، ويشكل تهديدا مباشرا على الأمن الغذائي للملايين من الناس في7من أفريقيا، آسيا وأمريكا الجنوبية. في بداية عام 2018، ذكرت "المنظمة العالمية" للصحة الحيوانية (OIE) أن وكيل المسببة لهذا المرض، تيلف، اكتشفت رسميا في ثلاث قارات تشمل ثمانية بلدان8 ونظرا لهذه البطاقة المعلومات الممرض تم تحديث هناك المزيد من التقارير من تيلف في تنزانيا، أوغندا9و10من إندونيسيا، تايوان11 وبيرو12. تيلف فيروس الحمض النووي الريبي المفرد-الذين تقطعت بهم السبل رواية وصف ليكون فيروسات مثل أورثوميكسو لأنه يحتوي على مجموعة متنوعة من الخصائص تذكرنا أورثوميوكسوفيروسيس أخرى مثل الإنفلونزا أو المعدية السلمون فقر الدم الناجم عن الفيروس (إيساف)13. أنها المرة الأولى في أعقاب خسائر جسيمة في البلطي المستزرعة والبرية في "بحيرة طبرية، إسرائيل"14. وبعد ذلك، تفشي الأمراض المماثلة المشار إليها نفوق الصيف وشهر واحد متلازمة الوفيات المرتبطة بالإصابة تيلف أفيد في هجين البلطي الأحمر والبلطي النيلي (Oreochromis niloticus) في مصر15 والنيل (Oreochromis spp.) في16من تايلند، على التوالي. تاريخيا يجري الكشف عن فيروسات الحيوانات المائية بالنمو وعزل الفيروسات في خلية ثقافة. تم اختبار خطوط الخلايا المختلفة لإكثار والعزل بما في ذلك الخلايا E-11 المستمدة من الأفعى الأسماك (سترياتوس أوفيوسيفالوس)،من1718، مكتب الإدارة والميزانية، والتي تنشأ من Oreochromis TmB تيلف mossambicus18، وأونلب وأونل التي تنشأ من النيل البلطي (النيلي)19. في حين ثقافة الفيروس يتميز بأنه يقدم مادة لتجارب أخرى، فقد عيب فإنه يتطلب على الأقل 4-7 أيام لمراقبة تشكيل تأثيرات سيتوباثيك (CPE)، ومن الأهمية بمكان مختلف الفيروسات بيسسيني، التي أكثر ملاءمة تكرار قد يكون نشر وإنتاج CPE مماثلة.
في العقود القليلة الماضية، كان هناك الابتعاد عن طرق التشخيص التقليدية، وغالباً ما تستغرق وقتاً طويلاً مثل زراعة الخلايا، والأمصال والكشف عن مستضد واستبدالها ب اختبارات الحمض النووي أسرع وأكثر حساسية على أساس الكشف عن20، 21. وهذا واضح من حقيقة أن العديد من قبكر فحوصات قد وضعت كأساليب تشخيصية هامة للعديد من الأمراض الفيروسية في الحيوانات المائية، مثل إيساف22،23، فيروس تسمم الدم النزفية الفيروسية (فهسف)24 ،25، بيتانودافيروس،من2627 alphavirus السلمونيات28، والأسماك إيريدوفيروس29، أنجويليد هربس 1 (AngHV1)30، وليمفوسيستيس مرض فيروس (لكدف)31 . طرق قوية للتشخيص والممرض مراقبة هناك حاجة عاجلة الحد من انتشار تيلف. وينبغي أن تسمح هذه الأساليب الكشف المبكر عن الإصابة قبل وضع علامات سريرية والكشف عن الفيروس منخفضة الأحمال. وحتى الآن، بروتوكولات بكر مختلفة بما في ذلك14،RT-PCR32، وضعت متداخلة RT-PCR18وشبه متداخلة RT-PCR33RT-قبكر32،34 للكشف عن تيلف في أنسجة الأسماك. مقارنة لعزل RT-قبكر والفيروسات في خطوط الخلايا عرضه للكشف عن تيلف كشفت أن الرايت قبكر ألف مرة أكثر حساسية من عزل الفيروس32. على الرغم من أن كل بروتوكول PCR المنشورة قد ذكرت حساسيات مختلفة للكشف عن تيلف، معظم فحوصات حساسة للغاية مع حدود الكشف عن النسخ الفيروسية في 7.5 نسخ33, 7 نسخ18 أو 2 نسخ32 دولاراً رد فعل.
والهدف من هذه المقالة أساليب لشرح كيفية إجراء فحوصات الكشف عن تيلف، بدءاً بجمع الأنسجة البلطي، إلى مجموع استخراج الحمض النووي الريبي، كدنا التوليف، بالتفصيل، وثم بكر تيلف محددة على أساس فحوصات. على وجه التحديد، وقد وصف بروتوكولات شاملة سواء RT-PCR التقليدية وأيضا سيبر المستندة إلى الأخضر RT-qPCR لنداء إلى مجموعة واسعة من العلماء تهدف إلى الكشف عن تيلف. السابقة هو أقل حساسية ولكن عادة ما يكون هو خيار الكشف عن أرخص. الأخير يتطلب بنية تحتية أكثر تفصيلاً مثل جهاز PCR كمي والكاشفات أكثر تكلفة، ولكن لديها مزايا الكمية وسريعة وحساسة للغاية، بمعنى أنه يمكن استخدامه للكشف عن تيلف في الفرعية سريرياً الأسماك المصابة. RT-PCR والبروتوكولات الرايت قبكر أجريت في مختبرات مختلفة اثنين مع يعزل الجغرافية المتميزة تيلف وتسليط الضوء على النتائج شملت الحساسية وإمكانية تكرار نتائج لفحوصات الموصوفة هنا.
Protocol
وأقر البروتوكول استخدام الحيوان لهذه الدراسة "لجنة الأخلاقيات الحيوان جامعة كاسيتسارت" تحت رقم تصريح ACKU 59-التعليم والتدريب المهني-016.
ملاحظة: يرجى الرجوع إلى الجدول للمواد اللازمة لمعلومات موسعة بشأن المواد الكاشفة والمعدات المقترحة لهذا البروتوكول.
1-الأنسجة جمع العينات
- Euthanize الأسماك باستخدام جرعة زائدة من زيت القرنفل (الحجم يعتمد على حجم الأسماك وتركيز للمنتجات، وعادة ما تكون أكثر من 3 مل/لتر). تزج ربع مقص ملقط ومايو كلينيك في الإيثانول 95% (v/v) متبوعاً بحرق المعدات باستخدام موقد الكحول لتعقيم المعدات.
ملاحظة: يمكن استخدام تريكيني ميثانيسولفوناتي (مرض التصلب العصبي المتعدد-222) بدلاً من زيت القرنفل. - العثور على الكبد وقطع قطعة صغيرة (حوالي 20-100 ملغ) أو جمع 200 ميليلتر من المخاط باستخدام الزجاج غطاء أو شفرة جراحية لإزالة المخاط من عرفت الخلفي أسماك البلطي ووضع العينات في أنبوب ميكروسينتريفوجي 1.5 مل.
- على الفور، نماذج عملية تخزين في الجيش الملكي النيبالي تثبيت الحل أو نقلها إلى-80 درجة مئوية حتى استخدامها مرة أخرى.
ملاحظة: إعداد جزيئات الحمض النووي الريبي سليمة مهمة أكبر في العمل مع الجيش الملكي النيبالي وإبقائها سليمة في جميع أرجاء أي هاندلينجس اللاحقة. العمود الفقري من الجيش الملكي النيبالي الفطرة أكثر حساسية للأضرار من الحمض النووي. الاستخراج والعزل من مجموع الجيش الملكي النيبالي من خلايا الأنسجة يتطلب تقنية المختبرات دقيق؛ اتخاذ جميع احتياطات لمنع تلوث رناسي بارتداء القفازات، واستخدام رناسي المياه مجاناً، الكواشف، المعدات، وير البلاستيك، والأواني الزجاجية، ومساحة العمل واستخدام عامل تصفية نصائح بيبيتينج.
2-جوانيديوم ثيوسيانات-الفينول-كلوروفورم استخراج الحمض النووي الريبي
- أضف 1 مل من محلول أحادي الطور الذي يحتوي على الفينول وغوانيدين isothiocyanate في أنبوب يحتوي على عينات الأنسجة من الباب 1.
تحذير: هذا الحل هو سامة جداً ويجب التعامل معها بعناية في غطاء الاندفاق الصفحي مع المعدات الواقية وارتداء قفازات واقية مناسبة في نظارات وملابس والسلامة. - طحن العينة الأنسجة استخدام الخالطون مدقة أنسجة حتى متجانسة.
ملاحظة: عينات يمكن أيضا أن يكون تجانس استخدام الخالطون طاقة جنبا إلى جنب مع حبات السيراميك. التأكد من أن عينة الأنسجة هو تجانس تماما قبل الانتقال إلى الخطوة التالية أو إيقاف البروتوكول هنا وتخزين العينات المتجانس تماما في-80 درجة مئوية حتى استخدامها مرة أخرى. - إضافة 200 ميليلتر من كلوروفورم لمرحلة الانفصال.
تنبيه كلوروفورم المخدرة محتملة وخطرة للغاية. أنه يجب التعامل مع الرعاية في غطاء الاندفاق الصفحي مع المعدات الواقية وكذلك بارتداء قفازات واقية مناسبة في نظارات وملابس والسلامة. كأقل سمية البديلة، 1-برومو-3-تشلوروبروباني يمكن أن تستخدم أيضا.
ملاحظة: حجم وحدات التخزين لأعلى أو لأسفل عند الاقتضاء. على سبيل المثال، إلا إذا كانت تستخدم 500 ميليلتر من حل أحادي الطور الذي يحتوي على الفينول وغوانيدين isothiocyanate، ثم إضافة فقط 100 ميليلتر من كلوروفورم في هذه الخطوة.- تخلط العينات جيدا بانعكاس لمدة 15 ثانية.
- احتضان عينات لمدة 3 دقائق في درجة حرارة الغرفة (RT).
- أجهزة الطرد المركزي لمدة 15 دقيقة في 12,000 × ز و 4 درجة مئوية.
ملاحظة: يجب أن يكون هناك فصل واضح إلى مرحلة عضوية أقل، من الطور البيني بيضاء ومرحلة مائية العليا التي تحتوي على الحمض النووي الريبي. هذه المرحلة الأعلى عادة عديم اللون ولكن تبعاً لنوع وكمية من النسيج المتجانس، فإنه يمكن أن يكون مظهر وردي خفيفة. - نقل الطبقة المائية العليا (حوالي 500 ميليلتر) إلى أنبوب ميكروسينتريفوجي جديدة دون الإخلال الطور البيني.
ملاحظة: لا تحاول نقل المرحلة المائية كاملة، وترك مبلغ صغير لمنع أي تلوث محتمل للجيش الملكي النيبالي تتضمن المرحلة المائية مع العضوية أو الطور البيني. - إضافة إلى حجم 1 من الايزوبروبانول 100% يعجل بالجيش الملكي النيبالي.
- بشكل اختياري، إذا تم استخدام كميات صغيرة جداً من الأنسجة، ثم إضافة 1 ميليلتر (5-10 ميكروغرام) من الجليكوجين رناسي خالية لكل عينة لتعزيز كفاءة الجيش الملكي النيبالي هطول الأمطار. وهذا سيساعد تحديد بيليه الجيش الملكي النيبالي في خطوة 2.8.
ملاحظة: الجليكوجين يعمل كناقل للجيش الملكي النيبالي وسوف يمنع الشائكة إلى جانب الأنبوب كميات صغيرة من الحمض النووي الريبي. - أنابيب المزيج جيدا بعكس عدة مرات.
- تخزين العينات ل 2 (ح) بين عشية وضحاها في-20 درجة مئوية.
- بشكل اختياري، إذا تم استخدام كميات صغيرة جداً من الأنسجة، ثم إضافة 1 ميليلتر (5-10 ميكروغرام) من الجليكوجين رناسي خالية لكل عينة لتعزيز كفاءة الجيش الملكي النيبالي هطول الأمطار. وهذا سيساعد تحديد بيليه الجيش الملكي النيبالي في خطوة 2.8.
- عينات للطرد المركزي لمدة 15 دقيقة في 12,000 س ز و 4 درجة مئوية.
- تجاهل المادة طافية، مع الحرص على عدم إزاحة بيليه الجيش الملكي النيبالي في الجزء السفلي من أنبوب ميكروسينتريفوجي.
- أضف 1 مل إيثانول 75% (v/v)، ومزج عينات الحمض النووي الريبي بعكس الأنبوبة عدة مرات.
- أجهزة الطرد المركزي لمدة 15 دقيقة 10 آلاف س ز و 4 درجة مئوية.
ملاحظة: يمكن إيقاف البروتوكول هنا ويمكن تخزين العينات التي تضم بيليه الجيش الملكي النيبالي في الإيثانول 75% في-20 درجة مئوية حتى استخدامها مرة أخرى. - تجاهل المادة طافية، يجري الساهرة لا لإزاحة بيليه الجيش الملكي النيبالي في الجزء السفلي من أنبوب ميكروسينتريفوجي.
- بشكل اختياري، كرر الخطوات من 2.9-2.11 استخدام الإيثانول 70% (v/v). دقة الغسيل بيليه الجيش النيبالي الملكي سيتم تصغير أي الملح أو سيتم ترحيل المواد الملوثة التي قد تتداخل تطبيقات المتلقين للمعلومات الحساسة.
- استخلاص الإيثانول المتبقية باستخدام ماصة وثم أيردري بيليه الجيش الملكي النيبالي في درجة حرارة الغرفة لمدة لا تزيد على 5 إلى 10 دقيقة.
ملاحظة: الكريات الإفراط المجففة سيكون من الصعب إعادة تعليق. - إضافة 30-60 ميليلتر من المياه خالية من رناسي، استعد مسبقاً إلى 55-60 درجة مئوية إلى جعل بيليه الجيش الملكي النيبالي.
- وضع الجيش الملكي النيبالي على الجليد للاستخدام الفوري أو مخزن في-80 درجة مئوية لاستخدامها في وقت لاحق.
3-قياس "تركيز الجيش الملكي النيبالي" استخدام "جهاز المطياف الضوئي" الصغير الحجم
- تبديل إعدادات جهاز المطياف الضوئي للجيش الملكي النيبالي.
- استخدام 1-2 ميليلتر من المياه خالية من رناسي كقرص فارغ.
- استخدم 1-2 ميليلتر لكل عينة من الحمض النووي الريبي لتقييم كمية الحمض النووي الريبي.
- تسجيل القراءات في 230 نيوتن متر، 260 nm و 280 نيوتن متر لكل عينة.
- تخفف من الجيش الملكي النيبالي إلى 200 نانوغرام/ميليلتر استخدام مياه خالية من رناسي.
4-توليف الحمض النووي التكميلية (كدنا) استخدام مجموع الجيش الملكي النيبالي
- مزيج 1 ميكروغرام من مجموع الجيش الملكي النيبالي من البروتوكول 2، 2 ميكرومتر اليغو (dT)، خليط دنتبس 0.5 مم وإحضار وحدة التخزين النهائي إلى 10 ميليلتر مع المياه خالية من نوكلاس. لذلك، تعد RT-ماجستير-مزيج وفقا للعدد من العينات، وضوابط لفحصها.
ملاحظة: عناصر التحكم عينة المنتسخة العكسية ناقص (-RT) حيث يتم استبدال إنزيم RT مع المياه خالية من نوكلاس (راجع الخطوة 4، 3) ولا قالب تحكم (المجلس الوطني الانتقالي) حيث يضاف الماء خالية من نوكلاس إلى الرئيسية--مزيج بدلاً من قالب الحمض النووي الريبي.- تخلط العينات جيدا من قبل بيبيتينج متبوعاً الطرد المركزي موجزة.
- احتضان هذه العينات عند 65 درجة مئوية لمدة 5 دقائق متبوعة حضانة 2 دقيقة على الجليد.
- باختصار الطرد المركزي العينات لجمع كل من السائل في الجزء السفلي من الأنابيب.
- أضف 1 x المخزن المؤقت المنتسخة العكسية، المنتسخة العكسية يو 100 والحجم النهائي لكل عينة من 20 ميليلتر استخدام مياه خالية من نوكلاس.
- تخلط العينات جيدا من قبل بيبيتينج متبوعاً الطرد المركزي موجزة.
- احتضان هذه العينات في 42 درجة مئوية لمدة 60 دقيقة تليها 85 درجة مئوية لمدة 5 دقائق.
- تمييع كدنا تجميعي لتركيز المطلوب عن طريق إضافة وحدة تخزين مناسبة من المياه خالية من نوكلياسي والمكان كدنا على الجليد للاستخدام الفوري أو تخزينها في-20 درجة مئوية لاستخدامها في وقت لاحق.
5-تيلف التقليدية بكر
- استخدام كدنا والعينات والضوابط، ولدت في البروتوكول القسم 4 كقوالب لفعل PCR باستخدام أي من أزواج التمهيدي المتبعة بالتفصيل في الجدول 1، جنبا إلى جنب مع بوليميريز الحمض النووي للاختيار.
ملاحظة: عنصر تحكم القالب لا إضافية (المجلس الوطني الانتقالي) ينبغي أن تدرج هنا عن طريق استبدال كدنا للمياه خالية من نوكلاس في تفاعل PCR. عنصر إيجابي، إذا كانت متوفرة، كما ينبغي أن يشمل تضم عينات إيجابية تيلف سابقا تم التحقق منها أو الجزء كدنا تيلف مناسبة المستنسخة في بلازميد. - إعداد ماجستير مزيج PCR وفقا للمبادئ التوجيهية للنظام دنا بوليميريز المستخدمة وعدد العينات وعناصر التحكم التي يتم اختبارها. ينبغي أن يشمل هذا المزيج التمهيدي إلى الأمام، وعكس التمهيدي، دنتبس، مجكل2 وبوليميراز الدنا مختارة، جنبا إلى جنب مع المخزن المؤقت الخاص به.
- وفقا للمبادئ التوجيهية التي وضعتها بوليميراز الدنا مختارة، الجمع بين وحدة التخزين المعينة الرئيسية--مزيج من المبلغ المقترح كدنا العينات وعينات السيطرة.
ملاحظة: إعداد 0.5 x الزائدة رد فعل يكون من المفيد غالباً حيث يتم فقدان بعض من الرئيسية-المزيج أثناء بيبيتينج. - إجراء PCR ركوب الدراجات الشروط وفقا للمبادئ التوجيهية للنظام تستخدم دنا بوليميريز واستخدام درجة حرارة انلينغ مناسبة للإشعال في استخدام (الجدول 1). عادة، مثل هذا برنامج سوف تنطوي تمسخ أولى عند 95 درجة مئوية لمدة دقيقة 2-5، تليها 30-40 دورات تمسخ عند 95 درجة مئوية لمدة 30 ثانية، الصلب في درجة الحرارة الموصى بها 30 ثانية واستطالة عند 72 درجة مئوية لمدة 30 ثانية، متبوعاً استطالة نهائي عند 72 درجة مئوية لمدة 5-10 دقيقة.
- تحميل ميليلتر 5-15 من كل رد فعل بكر وسلم الحمض النووي مناسب في الآبار من 1-2% [اغروس] هلام، تبعاً لحجم المنتج بكر المتوقعة. فصل تضخيم الحمض النووي بالتفريد جل ووصمة عار الجل قبل اثيديوم بروميد (اثبر) لتسهيل التخيل عصابات الحمض النووي من الحجم المتوقع (الجدول 1) في آلة جل وثائق باستخدام الأشعة فوق البنفسجية.
تنبيه: أتبر السامة؛ أنه يجب التعامل مع العناية بارتداء ملابس واقية مناسبة وقفازات السلامة.
| الجزء المتعلق بالجينوم تيلف الهدف | التمهيدي إلى الأمام 5 '-3' | عكس التمهيدي 5 '-3' | حجم المنتج بكر (bp) | Tm ° C | المرجع الأصلي | ||||
| 1 | ككااكجتاتكتكتاتاكجكاك | جكااتاتتكتكتكاتكجككت | 1641 | 50 | سوراتشيتبونج et al., 2017 | ||||
| 1 | ككتكاتككتكجتجتجتاجت | أجاجتجكتجتججتاتاج | 1000 | 62 | موجيمبا et al., 2018 | ||||
| 2 | أكتكتكتاتاككااتاكاتتاكت | تاككاتاتاتاتاجتجاجك | 1445 | 45 | سوراتشيتبونج et al., 2017 | ||||
| 2 | جتككاججكجتاتجتاتج | كتاكجكتجاكاجتكتكتاج | 834 | 62 | موجيمبا et al., 2018 | ||||
| 3 | جتججكاكاجكاتككتا | تاتكاكجتجكجتاكتكجتكاجت | 250 | 56 | اينجر et al., 2014 | ||||
| 3 | تاتجكاجتاكتتكككتجكك | تجكتكتجاجكاجاجتاكك | 491 | 57 | اينجر et al., 2014 | ||||
| 3 | أككككتاتككتاتاجاككجتا | كككاتاتككتكتاتاجاكجتكجت | 1352 | 50 | سوراتشيتبونج et al., 2017 | ||||
| 3 | جتكجاجكاتككاجاجتاج | جاجكتاججاكجكتاتج | 834 | 62 | موجيمبا et al., 2018 | ||||
| 4 | أجكاجكاجكاجاجااجاج | أككجتككتجتتكتجاتج | 358 | 60 | نيكلسون et al., 2017 | ||||
| 4 | ككااجتتاكتككتاتاكككاجا | جكااتكتتكتككاتاككجتكت | 1250 | 50 | سوراتشيتبونج et al., 2017 | ||||
| 4 | جكككاتجتكككاتاتكت | جكككاتجتكككاتاتكت | 12° | 62 | موجيمبا et al., 2018 | ||||
| 5 | ككااتجتتكتكتاتكتكاجاكتك | كتتتتكتكاجتتاككاكتتاتج | 1087 | 57 | سوراتشيتبونج et al., 2017 | ||||
| 5 | كاكتكتاجككتككجاتاك | كجتكتجكاكتججتاكا | 696 | 62 | موجيمبا et al., 2018 | ||||
| 6 | ككااتتتاككتكتكجكات | تكاجكاكتاااكتجتاكك | 1027 | 45 | سوراتشيتبونج et al., 2017 | ||||
| 6 | كككاكاكجاكاجاكاتاتاج | جاجتجكتاججتجاتاجا | 948 | 62 | موجيمبا et al., 2018 | ||||
| 7 | كتكتكتتجكاتجكاتاككجت | جاككاتاتكككتجكتتكا | 704 | 57 | سوراتشيتبونج et al., 2017 | ||||
| 7 | تككتتاججاتجكاكتاك | تككاتكجاكتجكتككتاجا | 486 | 62 | موجيمبا et al., 2018 | ||||
| 8 | أككتكاتكتاكاكتاكاتتككا | تكاتكاتاكاكااتجاجتاجكت | 637 | 50 | سوراتشيتبونج et al., 2017 | ||||
| 8 | كتاججككاتككتجتكاتك | تجكتكااتكككاكاكتا | 476 | 62 | موجيمبا et al., 2018 | ||||
| 9 | تجتجاتجتكاكجاتجاتا | أجتكتاتكجككاجككاتجت | 351 | 60 | نيكلسون et al., 2017 | ||||
| 9 | أكاجتككجاتاكتتتتككجك | تكتتكتكاكجتككتااجتكا | 530 | 50 | سوراتشيتبونج et al., 2017 | ||||
| 9 | جاتاتككتككاكاتجاكككتك | جتاكجتكاكتتجتجككاتاك | 261 | 62 | موجيمبا et al., 2018 | ||||
| 10 | آكككتاكتاكاككااتاتاجكت | كتتكككتكتجاكاكككتجت | 450 | 50 | سوراتشيتبونج et al., 2017 | ||||
| 10 | تككتكتكتجتكككتكتجت | كاجاتجاجتجتجكاجاتات | 276 | 62 | موجيمبا et al., 2018 | ||||
الجدول 1- نشر أول كتاب أزواج لتضخيم كدنا تيلف باستخدام نقطة نهاية PCR. واستخدمت التمهيدي تعيين تظهر باللون الغامق لتوليد نتائج الممثل هو موضح في الشكل 3 ألف و 3 باء.
6-تيلف "الكمية تفاعل البوليميراز المتسلسل" (qPCR)
- استخدام بلازميد تتضمن تيلف المناسبة كدنا الجينوم الجزء 3 كمعيار، مثل بتيلف32، إعداد سلسلة تمييع مسلسل إذ المكررة أو تريبليكاتيد.
- إعداد مزيج ماجستير qPCR لجميع العينات، والمعايير والضوابط، وأخذا في الاعتبار أن ردود الفعل التي ينبغي أن يقوم بتكرار أو تتبع استخدام ميليلتر 0.4 من المياه خالية من نوكلاس، ميليلتر 0.3 من التمهيدي إلى الأمام، 0.3 ميليلتر لعكس التمهيدي و 5 ميليلتر من 2 × الأخضر سيبر بوليميراز الدنا الرئيسي--ميكس كل رد فعل.
- استخدم كبسولة تفجير بتركيز 10 ميكرون، والمعلومات التمهيدي بتيلف القياسية كما يلي:
إلى الأمام التمهيدي: تيلف-112F (-كتجاجكتااجاجكاتاتجات 5 '-3')
عكس التمهيدي: تيلف-112R (-كجتجكجتاكتكجتكاجتاتاجتكت 5 '-3')
PTiLV:10 القياسية بيكوغرام/ميليلتر
ملاحظة: إذا كان العدد الإجمالي للعينات، وضوابط 10 وسيتم تنفيذه في تريبليكاتيس، وهذا يساوي قبكر ماجستير-مزيج يتألف من 12 المياه خالية من نوكلاس ميليلتر والتمهيدي إلى الأمام ميليلتر 9، 9 ميليلتر عكس التمهيدي و 150 ميليلتر من "سيبر الأخضر دنا" بوليميريز ماجستير-ميكس. تجارياً بشراء 2 × سيبر العالمي "الأخضر الحمض النووي" بوليميريز ماجستير-يمزج تحتوي على جميع العناصر اللازمة لرد فعل قبكر، هما "الأخضر سيبر" أنا صبغ، بوليميراز "الدنا بوليميراز" الساخنة ابدأ، دنتبس، مجكل2 والأصباغ إشارة سلبية. حماية مزيج الرئيسي "الأخضر سيبر" من الضوء.
- استخدم كبسولة تفجير بتركيز 10 ميكرون، والمعلومات التمهيدي بتيلف القياسية كما يلي:
- الاستغناء عن ميليلتر 6 قبكر الماجستير-المزيج من qPCR قطاع أنابيب أو صفيحة جيدا 96 متوافقة مع الجهاز قبكر في الاستخدام.
- إضافة 4 ميليلتر من قالب كدنا أو عناصر التحكم أو تسلسلياً المخفف تيلف المعايير في أنابيب أو الآبار 96 اللوحة جيدا.
- إغلاق الأنابيب qPCR أو ختم 96 لوحة جيدا مع غطاء لوحة متوافقة لالة قبكر في الاستخدام
- بلطف نفض الغبار أنابيب qPCR لخلط الحل وتدور أسفل أنابيب qPCR أو 96 لوحة جيدا باستخدام أجهزة الطرد مركزي لجمع كل من السائل في الجزء السفلي من هذه السفن.
- وضع أنابيب أو لوحة في cycler الحرارية في الوقت الحقيقي.
- برنامج ثيرموسيكلير قبكر أداء تمسخ أولى عند 95 درجة مئوية لمدة دقيقة 3، تليها دورات 40 من 95 درجة مئوية ل 10 s و 60 درجة مئوية لمدة 30 ثانية للصلب التمهيدي واستطالة، تنتهي بخطوة منحنى ذوبان 65 درجة مئوية إلى 95 درجة مئوية مع زيادة 0.5 درجة مئوية/5 s.
- حدد سيبر كصبغة فلوروفوري، ثم حدد معروف كنوع عينة وإدراج اسم في مربع اسم عينة.
- فتح غطاء الجهاز RT qPCR وضع قطاع قبكر في الآبار التي تم تعيينها، ثم أغلق الغطاء.
- إجراء المقايسة RT-قبكر مع الشروط المحددة. سوف تبدأ الجهاز لتشغيل بعد الغطاء قد وصلت إلى درجة الحرارة المطلوبة. جمع الأسفار كل عينة بعد كل خطوة التمديد رصد التقدم المحرز في رد الفعل.
ملاحظة: آلة قبكر، والبرمجيات ذات الصلة سوف تلقائياً حساب كافة المعلمات المقايسة وعرض منحنيات التضخيم في الوقت الحقيقي، في حين سيتم إنشاء المنحنى المعياري ومنحني ذوبان في نهاية دورة qPCR. - إجراء تحليل البيانات واقتناء بضمان الأولى أن ذوبان المنحنيات لكل عينة ومستوى الذروة موحد واحد في درجة الحرارة المتوقعة أمبليكون.
- تقييم منحنيات التضخيم من العينات والمعايير ومجموعة العتبة في منطقة كانت نسبة التضخيم كدناس هي نفسها في جميع العينات. وهذا عادة يؤديها البرنامج تلقائياً ولكن ينبغي فحصها بعناية.
- حساب عدد النسخ تيلف استخدام المنحنى القياسي.
النتائج
بعد البروتوكول هو موضح في القسم 1، كانت euthanized المحتضرة هجين البلطي الأحمر عرض علامات سريرية تيلف الإصابة (الشكل 1A) بالاستحمام في تركيزات عالية من زيت القرنفل، الذي يعمل كمخدر. الأعراض السريرية المبلغ عنها متغير ولكن يبدو أن الأعراض الشائعة الخمول وتآكل الجلد وتلون، اكسوفثالميا، وجداول منفصلة، والجروح المفتوحة/الآفة والسلوك الشاذ15،،من1633، 35،36، البعض منها يمكن رؤيتها بوضوح في الشكل 1A. تمت إزالة جدار البطن لجمع الأجهزة الداخلية مثل الكبد أو الطحال أو الكلية الرأس (الشكل 1B). تم جمع عينات المخاط أيضا في هذه المرحلة بلطف كشط الجلد من الأمامي إلى الخلفي من الأسماك باستخدام الزجاج غطاء أو شفرة جراحية37.

الشكل 1 . البلطي جمع التشريح وعينه- أ-إصابة تيلف هجين البلطي الأحمر مع ليسونس الجلد، احمرار حول الفم و operculum، وتآكل الجلد وعتامه القرنية. ب. سيكتيونيد هجين البلطي الأحمر للسماح لجمع الأنسجة من الطحال الكبد (عند نقطة السهم الأزرق)، أو أجهزة الكلي الرأس. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
بعد ذلك، وأعقب البروتوكول بالتفصيل في القسم 2 لاستخراج جوانيديوم ثيوسيانات-الفينول-كلوروفورم من مجموع الجيش الملكي النيبالي والجيش الملكي النيبالي الكمي كما هو مبين في القسم 3 أجرى لتقييم نقاوة العينة بحساب نسب النقاء و دراسة الملامح الطيفية (الشكل 2). يبين الشكل 2 ألف نتيجة ممثل من إجراء استخراج الحمض النووي الريبي مجموع ناجحة، بينما يمثل الرقم 2 سوء إعداد الجيش الملكي النيبالي. الأحماض النووية قد ماكسيما امتصاص في 260 بينما البروتينات يكون لهم في 280 نانومتر. نسبة القياسات في 260 nm و 280 nm تبين نقاء كل عينة ونسب من 1.9 إلى 2.1 تشير إلى الحمض النووي الريبي نقية كما الحال بالنسبة للعينة في الشكل 2 ألف. انخفاض نسب A260/280 لاحظ في الشكل 2 (ب) تشير إلى إمكانية تلوث البروتين أو الفينول بقايا من إجراءات استخراج الحمض النووي الريبي. امتصاص في 230 شمال البحر الأبيض المتوسط يمكن أن يكون نتيجة لتلوث العينة ونسبة A260/230 نيوتن متر ويحسب أيضا لهذا السبب. ينبغي أن تكون هذه النسبة في حدود 2.2 2.0 لاستعدادات الجيش الملكي النيبالي نقية كما يتضح من قيمة 2.03 للعينة في الشكل 2 ألف، بينما الشكل 2B يحتوي على نسبة منخفضة من A260/230 من 1.07 والشخصية الطيفية يظهر تحولاً في الحوض الصغير في 230 شمال البحر الأبيض المتوسط نحو 240 شمال البحر الأبيض المتوسط مما يدل غوانيدين المتبقية أو الفينول في العينة. للعينة هو مبين في الشكل 2 باء، قد يحسن يعجل بإعادة الجيش الملكي النيبالي لإزالة التلوث نقاء العينة.
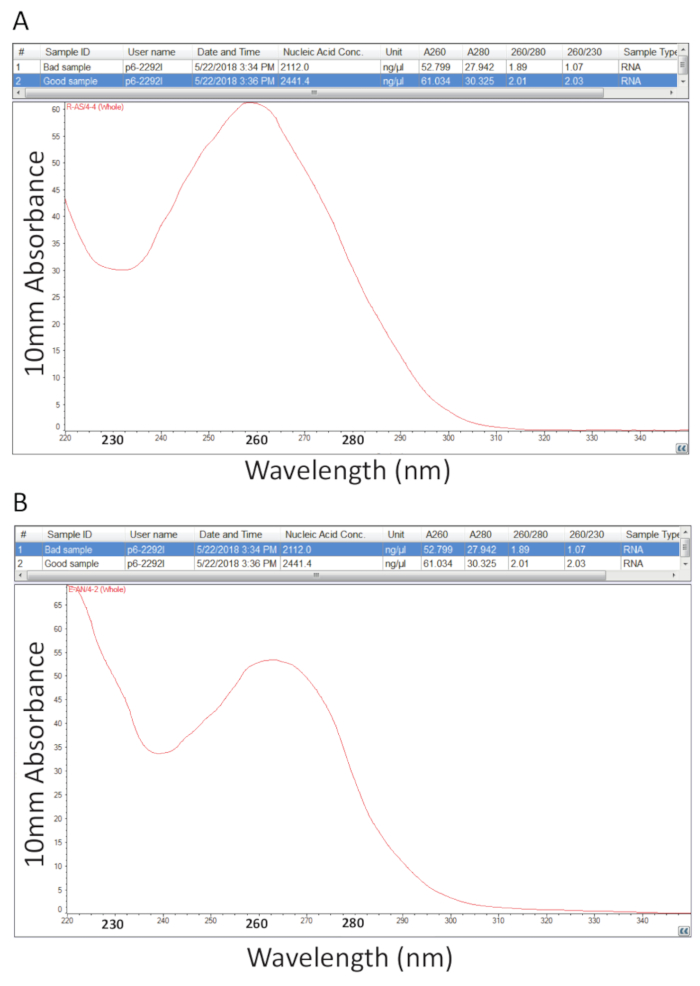
الشكل 2 . سبيكتروفوتوميتريك الكمي لمجموع الحمض النووي الريبي المستخرج من أنسجة مريضة البلطي. أ-نسب النقاء وملامح الطيفية من إعداد الجيش الملكي النيبالي ناجحة. ب-"ألف"، باستثناء ممثل إجراء استخراج الحمض النووي الريبي الفقراء. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
للكشف عن تيلف من الرايت-بكر، عينات نقية مثل تلك الممثلة في الشكل 2A عكس يدون (البروتوكول 4) إلى كدنا واستخدامه كقالب لبكر الاعتداء مفصلة في الباب 5 وتظهر نتائج الممثل في الشكل 3A. كبسولة تفجير يبدي في غامق في الجدول 1 واستخدمت لتضخيم جزء bp 491 تيلف الجينوم الجزء 314. منتجات PCR مفصولة بالتفريد جل والملون مع أتبر للتصور. يبين الشكل 3 ألف نتائج خطوتين RT-PCR استخدام 4 كدنا عينات (S1-S4)، المستمدة من كبد مريضة البلطي معزولة في تايلند، وفي كل عينة، عصابة نظيفة واحدة من حوالي 500 bp يمكن ملاحظتها وهكذا عينات 1-4 تيلف إيجابية. تم الحصول على نفس المنتج بكر من عينة مراقبة إيجابية، تضم كدنا تيلف الجزء 3 المستنسخة في بلازميد32 في حين لم تسفر عن لا قالب عنصر التحكم (المجلس الوطني الانتقالي) منتجات PCR. تم إجراء المقايسة في الشكل 3B استخدام الإشعال ذاتها كما في الشكل 3 ألف ولكن في مختبر مختلفة، باستخدام نهج RT-PCR خطوة واحدة ومع 5 عينات الحمض النووي الريبي المستمدة من أنسجة الكلي الرأس البلطي منشؤها الاستزراع المائي المصري 15-تقرر استخدام هذا الفحص الكشف عن أن عينات 1 و 3 و 5 من تيلف إيجابية بينما العينات 2 و 4 هي تيلف السلبية حيث تم العثور على أي منتج PCR في الحجم الصحيح. عناصر سلبية، بينهم اثنان ناقص ضوابط المنتسخة العكسية، وتتباين اثنين لم يولد أي منتجات PCR. وأجرى مقايسة RT-PCR خطوة واحدة أيضا استهداف الجين أكتينب البلطي. حجم amplicon 217 bp تم إنشاؤها في كل عينة (S1-S5) ك المتوقعة38. وعمل هذا الفحص كعنصر تحكم للسلامة لعينات الحمض النووي الريبي، فضلا عن السماح بإجراء فحص شبه كمي للعينات الإيجابية تيلف. نظراً لأن المنتج الذي تم إنشاؤه "أكتب البلطي" متساوية نسبيا، ثم الخلافات مبلغ تيلف المنتج PCR المحددة التي تم إنشاؤها يمكن تفسيره انعكاسا حقيقيا لكمية تيلف في عينة نسيج معين.
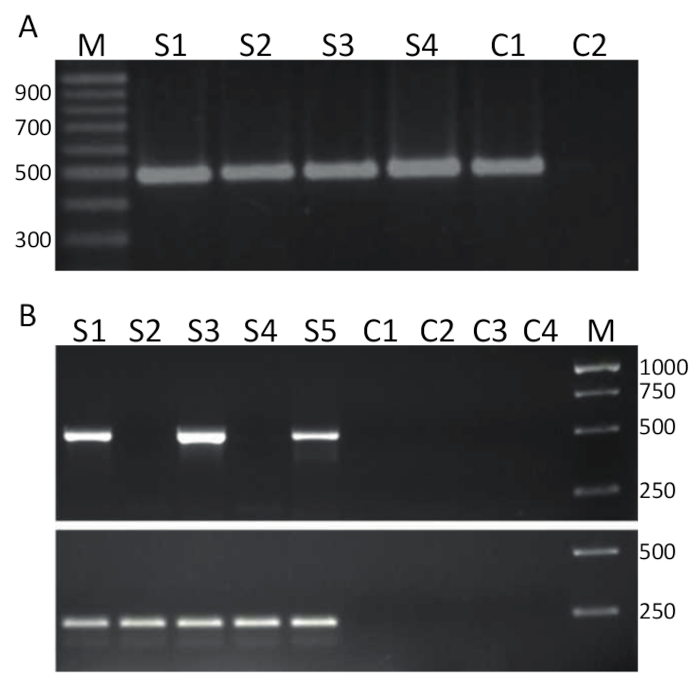
الشكل 3 . تيلف RT-PCR. أ. جمع عينات كدنا المنتجة من أنسجة الكبد من البلطي المريضة، من تايلند كانت الشاشة للإصابة تيلف استخدام كبسولة تفجير محددة للجزء 3 (سيظهر في جريئة في الجدول 1) من تيلف استخدام مقايسة RT-PCR خطوة 2. M = علامة تظهر في أزواج حقيرة؛ S1-S4 = العينات 1-4؛ C1 = التحكم الإيجابي باستخدام بتيلف كقالب بكر؛ و C2 = لا قالب التحكم (المجلس الوطني الانتقالي). ب-RT-PCR "خطوة واحدة" باستخدام كبسولة تفجير نفسه كما هو الحال في ألف وجمع عينات من أنسجة الكلي رأس المريضة البلطي من مصر15. M = علامة تظهر في أزواج حقيرة؛ S1-S5 = العينات 1-5. ضوابط C1-C2 ناقص ضوابط المنتسخة العكسية و C3-C4 NTCs. أسفل لوحة RT-PCR في خطوة واحدة استخدام كبسولة تفجير ضد إنتاج البلطي أكتينب38 (انظر النص للحصول على التفاصيل) منتج PCR قاعدة 217-أزواج. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
وخلافا لنقطة النهاية تقارير إتمام المشروعات ممثلة في الشكل 3، فحوصات قبكر التي سيتم شرحها في البروتوكول 6، قياس كمية المنتج بكر بعد كل دورة PCR. تضخيم الحمض النووي الهدف هو الكشف عن استخدام جزيئات الفلورسنت التي تتفاعل مع الحمض النووي المتولدة من كل جولة من رد فعل. واستخدمت هنا، "الأخضر سيبر" أنا صبغ، التي إينتيركالاتيس مع الحمض النووي المزدوج-الذين تقطعت بهم السبل. يتبع الإشارات الفلورسنت أثناء عملية التفاعل وتتصل بالكثافة كمية المنتج شكلت 39،،من4041،،من4243. وأجريت فحوصات qPCR تيلف كما هو موضح في البروتوكول 6 في مختبرات مختلفة باستخدام مختلف الكواشف الأخضر سيبر وآلات قبكر وعينات من مختلف البلدان. وترد في الشكل 4A و 4Bمنحنيات التضخيم الناتج. يمكن ملاحظة أن مسار التجربة لكل فحص، له أربع مراحل: مرحلة الأرض الخطية، والمرحلة المبكرة من الأسى، أواخر المرحلة الأسية والهضبة. تحدث المرحلة الخطية الأرض خلال الدورات في وقت مبكر حيث الازدواجية الحمض النووي لا يمكن تحديده بعد بسبب كميات الحمض النووي تنتج نسبة إشارة غير كافية/الخلفية. يتم حساب الأسفار الأساس خلال هذه المرحلة. بعد ذلك، يبدأ الحمض النووي المستهدف إلى ضعف في التركيز مع كل دورة حمل إشارة لتصبح قابلة للكشف أعلاه الخلفية وزيادة أضعافاً مضاعفة. كفاءة التضخيم مقايسة qPCR جيدا الأمثل (ه) مرتفع جداً (بالقرب من 100 في المائة) في بداية الرد وما زالت مستقرة خلال هذه المرحلة الأسية المبكر التضخيم، وهو في هذه المرحلة أن إجراء التقدير الكمي، عندما فعالية رد فعل لا تزال ثابتة. في دورات لاحقة يبدأ الإشارة هضبة، ولم يعد يرتبط كثافة الأسفار إلى رقم نسخة قالب البداية لمكوناتها رد فعل استنفاد44. أيضا قد يحدث التشبع بسبب المنافسة من إعادة انلينغ ردود فعل، أن نسب تركيز المتغيرة من المكونات، أو مقدار وحدات الإنزيم إلى جزيئات الحمض النووي الركازة. ربما، هذه المعلمات مراعاة للاختلافات بين منحنيات التضخيم لفحوصات هو موضح في الشكل 4A و 4B. لم يقم بإنشاء عناصر التحكم المضمنة هذه المنحنيات التضخيم المميزة.
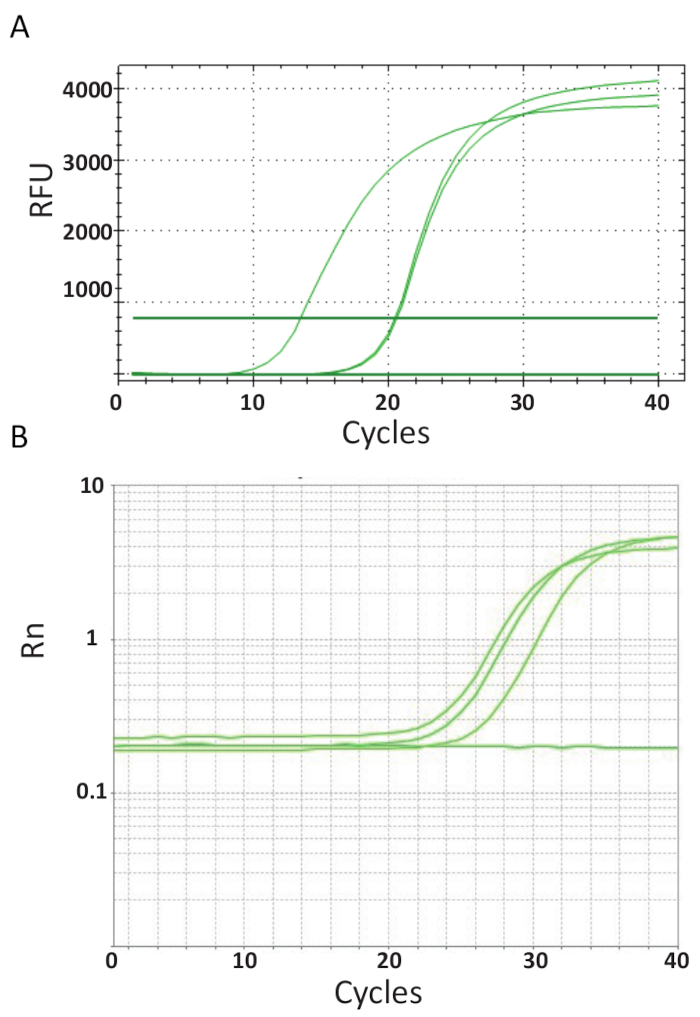
الشكل 4 . يرسم التضخيم لإظهار تراكم المنتج خلال مدة الفحص PCR الوقت الحقيقي. أ-منحنيات التضخيم تيلف إيجابية العينات المستمدة من تايلند وتتباين بلازميد الإيجابية والتحكم استخدام سيبر-أخضر أنا الإنزيم قبكر 2-الخطوة. تم إنشاء المخطط بالتآمر fluorescence النسبي (رفو) مقابل عدد دورة. ب-منحنيات التضخيم تيلف العينات الإيجابية المستمدة من مصر، كما هو الحال في الشكل 3 (ب) والمجلس الوطني الانتقالي. هو المنحنى التضخيم الأسفار إشارة مراسل تطبيع للأسفار صبغة ROX السلبي المدرجة في التحليل (Rn) مقابل عدد دورة. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
في نهاية ثيرموسيكلينج قبكر على الأجهزة المختلفة في كل مختبر، الحصول على البيانات وتحليلها. الشكل 5A و 5B إظهار المنحنيات ذوبان الممثل من فحوصات أداؤها في كل مختبر. كان مبرمجاً كل آلة qPCR لإجراء تحليل منحنى ذوبان في النهاية. وكان ذلك عن طريق زيادة درجة الحرارة بشكل متزايد ورصد الأسفار كدالة لدرجة الحرارة. عند درجة حرارة عالية بما فيه الكفاية لتجريدها دسدنا، يتم تسجيل انخفاض كبير في الأسفار لأنه يتم تحرير جزيء فلوروفوري. حساب البرنامج لكل صك qPCR انلينغ درجة الحرارة (Tm) من بيانات منحنى ذوبان بالتآمر درجة الحرارة مقابل المشتقة الأولى السلبية (الشكل 5). يمكن أن ينظر إليه في الشكل 5A و 5B أن المنتجات التي تشكلت في مجموعات مختلفة من عينة أن الانتقال ذوبان موحدة في درجة الحرارة المتوقعة حوالي 80 درجة مئوية للفحص. لم يلاحظ أي قمم أخرى في درجات الحرارة المنخفضة. نظراً لصغر حجمها، تم من مبلمر عادة أقل من الهدف تسلسل الحمض النووي. ولذلك، هذا الفرق بين تيمليجعل من السهل تحديد-مبلمر المحتملة أو غيرها من منتجات التضخيم غير محددة. لم يقم بإنشاء منحنيات تذوب مثل عينات إيجابية تيلف ومعايير الضوابط ويمكن اعتبار خط أفقي تقريبا في الجزء السفلي من التخطيطات في الشكل 5A و 5B.
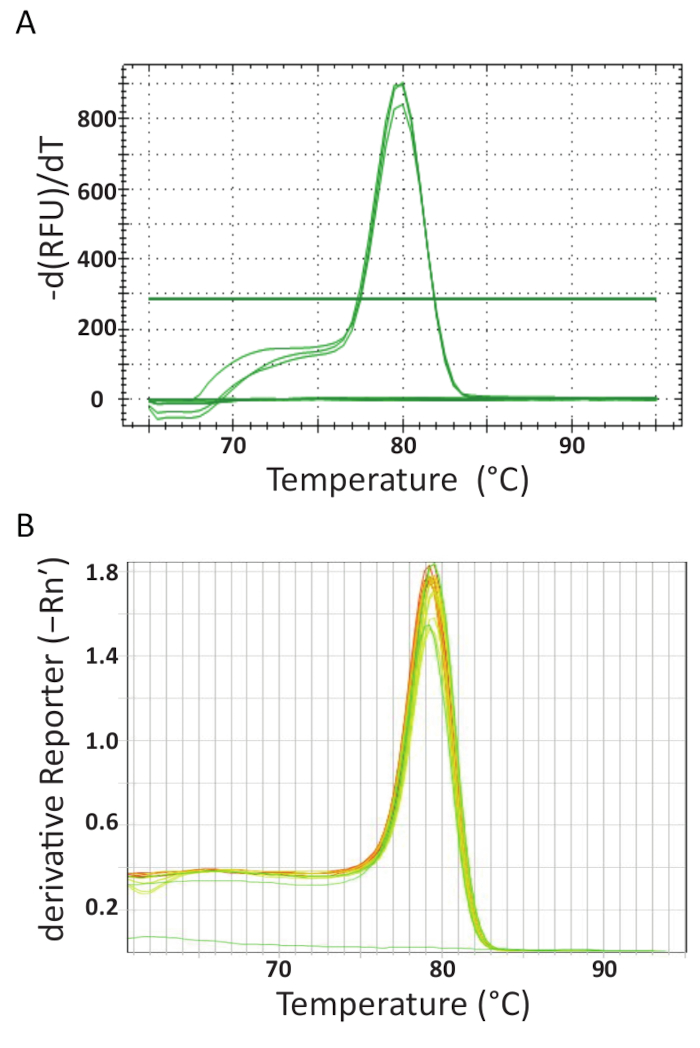
الشكل 5 . تذوب تحليل منحنى لضمان خصوصية المقايسة ومنتجات PCR مختلفة يمكن أن تكون متباينة من سماتها ذوبان. أ تذوب منحنى تحليل العينات إيجابية تيلف الناشئة من تايلند والمراقبة السلبية والتحكم بلازميد إيجابية. ب-إذابة تحليل منحنى تيلف العينات الإيجابية المستمدة من المعايير بتيلف ومصر المجلس الوطني الانتقالي. رسم الخرائط في أ وب كلاهما إظهار التغيير في الأسفار مقسوماً على التغير في درجة الحرارة ضد الحرارة لإنتاج صورة واضحة عن ديناميات ذوبان. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
تأتي معظم qPCR آلات مع برامج تيسير مواصلة تقييم qPCR تشغيل وسيتم قياس العينات عن طريق توليد منحنى قياسي بالتآمر عتبة دورة (جر) تلقائياً على لوغاريتم قالب المعايير بتيلف نسخ الرقم كما هو موضح في الشكل 6 ألف و 6B للمختبرات المستقلة اثنين. بإيجاز، جر هو الوحدة المستخدمة لتقييم نتائج qPCR. قيمةt C تشير إلى عدد الدورات اللازمة للوصول إلى مستوى إشارة fluorescence عتبة مجموعة. أكبر مبلغ ابتداء من قالب، قل عدد دورات أنه يلزم لبلوغ مستوى الأسفار الاكتشاف. في الواقع، سيكون عينات مع شحنة عالية من تيلف قيمt ج أقل من العينات مع حمولة منخفضة من تيلف كما هو الحال في الأسماك بمرض دون سريرية. لتحديد قيمt C، يتم خصم مستويات fluorescence الخلفية أولاً من البيانات الخام. المقبل، البرامج المقترنة بالجهاز qPCR تلقائياً حدد عتبة الأسفار بمنحنيات البيانات لكل عينة البحث وإدراجt C تمثل فيها العينة عبرت العتبة. ويتم ذلك بشكل منفصل لكل تحليل وكل عتبة ينبغي إجراء تقييم دقيق، ضمان أنه تم تحديد العتبة في الجزء اللوغاريتمية منحنيات التضخيم وفي مكان حيث تكون جميع منحنيات موازية. وهكذا، ج محددةt المكتسبة قيمة نسبية بالنسبة انطلاق القالب نسخة رقم45، ولكن كما أنها محددة للجهاز قبكر ووالكواشف المستخدمة، وكفاءة التضخيم بكر والحساسية للكشف عن. هذه المعلمات تساهم الاختلافات ولاحظ استخدام التحليل نفسه في الشكل 6.
أجريت من المنحنيات القياسية في الشكل 6، تحليل الانحدار، بما في ذلك حساب المنحدرات المنحنى المعياري (m) وقراءتها والتضخيم الكفاءة (100 × (1/م -1 من 10))46 والخطي لرد الفعل. واستخدمت أيضا تحليلات المنحنى المعياري لتأكيد حساسية (حد كشف)، والتكرار، وإمكانية تكرار نتائج للفحص. نظرياً، تتم مضاعفة كمية الحمض النووي مع بكر كل دورة، بمعنى أن الكفاءة (ه) يساوي 100%. ومع ذلك، في الممارسة هذه كفاءة مثالية نادراً ما التوصل إلى نتيجة ظروف بكر دون المستوى الأمثل، مثل تثبيط بوليميريز الحمض النووي، والملوثات، والكثير كدنا وبيبيتينج أخطاء47. بشكل عام، التضخيم ه تتراوح بين 90-110% لفحوصات جيدة، في الشكل 6A كفاءة 94.5 في المائة كانت محسوبة باستخدام عينات بتيلف متسلسل المخفف 8، بينما، كفاءة الإنزيم في المقايسة هو موضح في الشكل 6B استخدام بتيلف المخفف متسلسل 7 وكان عينات 101.2%. كفاءة أكثر من 100 في المائة عادة بسبب وجود مثبطات بكر في المقايسة. تحليل الانحدار الخطي للمؤامرة القياسية كما يسمح لحساب عدد النسخ تيلف في كل عينة41،،من4245، كما يمكن أن يلاحظ لثلاث عينات تيلف هو مبين في الحمراء في الشكل 6B وهو تمشيا مع نتائج العينات S1، S3 و S5 هو موضح في الشكل 3 (ب).
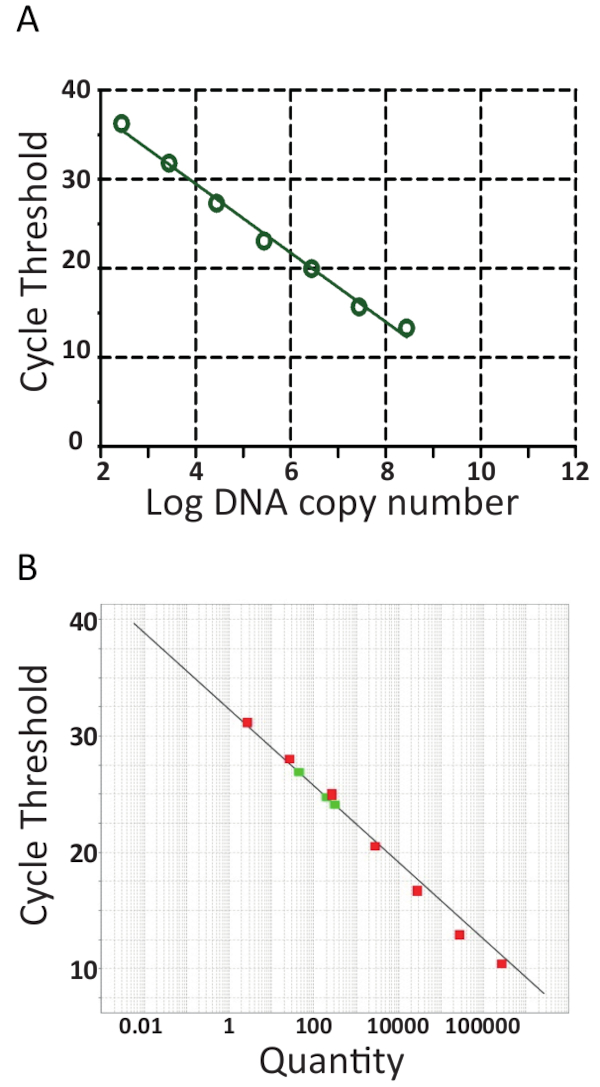
الرقم 6 . RT-qPCR المنحنيات القياسية. PCR الوقت الحقيقي لتخفيف المسلسل إذ من بتيلف، القياسية المستخدمة في المختبرات على حد سواء. أ 8 بتيلف المخفف متسلسل عينات اختبار، كل من تركيز معلوم وترتبط بعدد النسخ تيلف/رد فعل. تم إنشاء المنحنى المعياري برسم تسجيل نسخة رقم مقابل دورة عتبة (جر). الميل =-3.462، ص2 = 0.9992 والكفاءة 94.47%. ب-كما هو الحال في ألف، باستثناء 7 بتيلف متسلسل المخفف (الأخضر) اختبار عينات ويعرض المخطط دورة عتبة على المحور الصادي وعدد نسخ تيلف (الكمية) على المحور س. التقاطع y = 32.327، المنحدر-3.292، ص2 = = 0.98 والكفاءة 101.2%. لكل منحنيات معايير تستخدم في A و B، الميل والتقاطع y وقيم معامل الارتباط (ص2) لفهم أداء المقايسة. الأهم من ذلك، يجب أن تكون قيمة2 R قريبة من 1 نظراً لأنها مقياس للخطى للمنحنى المعياري. المنحدر يستخدم لقياس كفاءة PCR حيث يقابل كفاءة 100% إلى منحدر-3.32، انظر النص الرئيسي للمعادلة ومزيدا من التفاصيل. وقد رد فعل qPCR جيدة عموما كفاءة بين 90-110% ربط إلى منحدر من بين-3.58 و-3.10. منحنى قياسي يستخدم للقياس الكمي المطلق لعينات إيجابية تيلف غير معروفة ويحدد العدد الدقيق لنسخ تيلف/رد فعل، كما هو الحال بالنسبة للعينات الإيجابية تيلف ثلاثة اللون الأحمر في باء.
Discussion
تيلف ذكر أولاً في عام 2014 في إسرائيل14 ومنذ ذلك الحين، تم التعرف عليه في العديد من البلدان بما فيها مصر، وكولومبيا، والهند، وماليزيا، وأوغندا وتنزانيا وتايلاند15،،من1618، 35 , 48-الوعي العالمي، خاصة، في البلطي البلدان المنتجة قد وضعت المزيد من الاهتمام على الفيروس ومختلف القيود وتدابير الرقابة من جانب السلطات الحكومية قد نفذت محاولة للحيلولة دون انتشار تيلف. هنا، فسر بروتوكول مفصل لكشف تيلف في الأنسجة البلطي، تشمل جمع العينات، وعزل الحمض النووي الريبي، كدنا فحوصات التوليف وبكر و qPCR. وهناك جوانب مختلفة لهذه الأساليب التي تستحق المناقشة محددة. تم التعرف على تيلف في الأسماك تمتد متنوعة أحجام9،،من1214،،من1549 ، وأنواع البلطي حتى الآن، بما في ذلك البلطي الهجين المستزرعة (o. النيلي × المذهبة O.)11،14، النيل البلطي (النيلي)9،،من1014،،من1516، 33 , 35 , 36 , 49 , 50 والأحمر البلطي (Oreochromis sp.)16،33،،من4851، كما جيدا كما هو الحال في البرية النيل البلطي9،12، أسود حددت البلطي51 وزيلي ت.14،15، س. جاليلايوس، O. المذهبة و انترميديا سيمونيس ت.14 ومؤخرا جداً تيلف في البرية الكارب (باربونيموس شوانينفيلدي)52. يمكن جمعها من البلطي صحية فضلا عن تحتضر بغض النظر عن السن أو الحجم أو الأنواع عينات الأنسجة من الأعضاء الداخلية (غيل، الطحال، الكبد، القلب، الكلي الرأس) أو مخاط37 وتجهيزها لعزل الحمض النووي الريبي. ويستخدم البروتوكول استخراج الحمض النووي الريبي الإجمالية المبينة هنا حل أحادي الطور من ثيوسيانات الفينول وجوانيدينيوم، وعامل يشوه تشاوتروبيك. هي تجانس الأنسجة مباشرة في هذا الحل تليها إضافة كلوروفورم والطرد المركزي لتحقيق انفصال حيث يتم إنشاؤها الحمض النووي الريبي واضحة تتضمن المرحلة المائية العليا والطور البيني ومرحلة عضوية أقل. الجيش الملكي النيبالي معزولة من مرحلة مائي بترسيب الايزوبروبانول، متبوعاً بالغسيل من الجيش الملكي النيبالي المستردة للتخلص من الملوثات. كان رائدا بيوتر تشومكزينسكي وساكي نيكوليتا عزلة من الجيش الملكي النيبالي بهذه المنهجية وكان يشار جوانيدينيوم استخراج ثيوسيانات-الفينول-كلوروفورم53،54. هذا النوع من كاشف المستخدمة لاستخراج الحمض النووي الريبي يمكن شراؤها تجارياً أو المحرز في المختبر (انظر الجدول للمواد للحصول على مزيد من المعلومات). هذا البروتوكول وقتاً أطول قليلاً من الأساليب القائمة على عمود مثل تنقية القائم على السليكا، ولكن بشكل عام، أكثر فعالية من حيث التكلفة وغلة أكثر الجيش الملكي النيبالي.
في هذا البروتوكول، والتحديد الكمي للجيش الملكي النيبالي باستخدام قيم A260 ترد حيث كانت قيم يمكن أن تشير إلى نوعية الحمض النووي الريبي (A260/A280 = 1.9-2.1). في حين أن هذه الطريقة سوف تعطي مؤشرا جيدا لنقاء العينة، لا يمكن على الإطلاق إطلاع نوعية الجيش الملكي النيبالي المستخرجة. بشكل صحيح تحديد ما إذا كان الجيش الملكي النيبالي سليمة أو المتدهورة جزئيا، عينات يمكن فصل قبل [اغروس] هلام التفريد فيه تلطيخ أتبر الملون 18S وعصابات الرنا الريباسي 28S تشير إلى تدهور الجيش الملكي النيبالي. وقد تشمل مزيد من التحقق من نوعية الجيش الملكي النيبالي باستخدام أداة مختبر على رقاقة. وعلاوة على ذلك، أيضا مهم لهضم الجيش الملكي النيبالي المنقي مع الدناز الأول لإزالة تلوث المضيف الحمض النووي، مما قد يؤدي إلى نتائج خاطئة استناداً إلى التطبيقات المتلقين للمعلومات. إذا هو تلويث جدنا المضيفة لا تزال عينة الحمض النووي الريبي إلى حد كبير، يمكن أيضا إجراء علاج دناسي إضافية في نهاية الإجراء استخراج الحمض النووي الريبي (انظر الجدول للمواد).
تركيب الدنا تكميلية يمكن أن تؤثر إلى حد كبير نتائج قبكر العامة وجانبا من الأسلوب الذي يمكن أن يعرض الاختلاف. يتضمن البروتوكول كدنا تدعو إلى هنا لإنشاء مكون واحد استخدام اليغو (dT) وهكذا فقط المحاضر مرناس المحتوية على ذيول بوليا. يسمح عنصر التحكم المستخدم للضبط المكونات التي تريد استخدامها في رد فعل النسخ العكسي، وهذا النمط من كدنا وتوليف أثبت نجاحه ل الكشف عن تيلف32. كبديل لهذا التشكيل هو مزيج الرئيسي اشترى تجارياً تحتوي على جميع العناصر اللازمة لرد فعل عكسي من النسخ وسريع جداً وبسيطة دون البروتوكول خطوة متعددة، بيبيتينج ودرجة الحرارة متعددة المعتادة. وهذا مفيد لأنه يقلل من مناولة ويعزز التوحيد عبر كافة العينات. وغالباً ما تشمل هذه الأصول الرأسمالية-يمزج oligo(dT) وكبسولة تفجير عشوائي يجعلها تنطبق على مختلف الحمض النووي الريبي قوالب وتوليد كدنا الممثل نسخاً من تسلسل من طول الكشف في عدد سكان (الفيروسية والبلطي استضافة مرناً) ومن الناحية النظرية، يمكن قياس كل أنواع الحمض النووي الريبي المطلوب ثم بالتقليدية بكر أو qPCR من عينة من هذا القبيل. هذا التنوع هو الميزة الرئيسية لنهج RT-PCR الخطوة 2؛ وهو يوفر حمام سباحة طويلة الأجل التي يمكن استخدامها للعديد من التجارب المختلفة. كانت تمثل نهجاً RT-PCR خطوة واحدة في النتائج، حيث كانت تستخدم تسلسل معين الإشعال (الجدول 1) و RT وبكر أجريت في أنبوب واحد (انظر قائمة المواد). وبصفة عامة، تسلسل الإشعال محددة تسمح بكفاءة RT أعلى من الهدف محدد الحمض النووي الريبي من استخدام فتيلة عشوائية، ولكن الهدف محدد الحمض النووي الريبي هي الوحيدة التي يمكن قياسها كمياً في عينة كدنا هذه التي قد يكون الهدف الوحيد من مختبرات معينة (انظر جدول المواد لكدنا توليف الاقتراحات المنتج).
في حين يبدو RT-PCR التقليدي الشائع استخدامها حتى الآن في تيلف تشخيص9،13،14،15،16،،من1718، 33 , 35 , 48 , 55-RT-qPCR قد ثبت أن تكون أداة أكثر قوة للكشف والتحديد الكمي لكميات صغيرة من تيلف في أنسجة الأسماك أو مخاط32،37. وبوجه عام، يستخدم على نطاق واسع في مختبرات التشخيص السريري في علم الفيروسات نظراً لحساسية عالية، وخصائصه، وإمكانية تكرار نتائج جيدة، ودينامية واسعة النطاق والسرعة21qPCR. بينما qPCR قد يكون أكثر تكلفة في البداية تنفيذا من التقليدية الرايت-بكر، تقدم العديد من المزايا الهامة عبر PCR التقليدية؛ فقد أسرع تحول وقتاً من عينة للنتائج وأنها لا تتطلب أي خطوات بوست-PCR. هذه النقطة الأخيرة تعني أن هناك الحد الأدنى من المخاطر لتلوث المختبرات، ويمكن تكييفها بسهولة أكبر لحالات الفائق كما هو الحال في حالة تفشي. وعلاوة على ذلك، فمن طبيعتها أكثر حساسية من التقليدية الرايت-بكر، الذي يتسم بأهمية حيوية للكشف عن انخفاض الأحمال الفيروسية في الإصابات السريرية الفرعية21. وهذا يتطلب اتباع نهج بكر متداخلة تتطلب النسخ العكسي، اثنين كذلك بكر ردود الفعل ومن ثم تحليل من [اغروس] هلام التفريد. العديد من الخطوات يستغرق الكثير من الوقت وتزيد من فرص الأخطاء أو التلوث. ومع ذلك، نظراً لحساسية عالية، يطالب RT-qPCR التصميم التجريبي الدقيق، وفهم دقيق لتقنيات القياس الكمي لتوليد نتائج دقيقة56،57.
فلوروفوري ربط الحمض النووي، "سيبر الأخضر" قد أثبت في هذا البروتوكول. وصبغة ربط الحمض النووي غير محدد دسدنا وهكذا تكمن خصوصية المقايسة كلياً في مجموعة الإشعال، مما قد يولد المغلوطة58. ولذلك، بينما دسدنا ذوبان تحليل منحنى في نهاية كل بكر جزء مهم خاصة لتفاعل PCR لأنه يؤكد أن amplicon PCR واحد فقط من تي الصحيح يتم إنتاجم (ويجب أيضا أن يتحقق بهلام التفريد عندما يجري فحوصات جديدة). تيم من جزء من الحمض النووي يعتمد على مجموعة متنوعة من الميزات مثل الطول، تكوين GC، تسلسل، التكامل حبلا، وتركيز فضلا عن المخزن المؤقت المكونات ومحسنات PCR. التحليلات منحنى ذوبان في نتائج تمثيلية سيظهر اثنان من المختبرات لم تكشف عن الوجود-مبلمر أو منتجات PCR الأخرى غير المرغوب فيها ولكن إذا كان هذا هو لاحظ مع عينات أخرى و/أو الهياكل التجريبية، ثم ينبغي أن يكون الفحص إعادة الأمثل. QPCR تكنولوجيات أكثر تقدما لا تتطلب مثل هذه خطوة منحنى ذوبان وفي الواقع، منذ هذه الأساليب كتب الورقة، تكمان أساس تيلف RT-qPCR وضعت استخدام كبسولة تفجير اثنين وتحقيق يجعلها شديدة محددة تيلف34.
مما لا شك فيه، كبسولة تفجير مصممة لفحوصات RT qPCR تعتبر أساسية لنجاح الفحص والإشعال هنا صممت استناداً إلى البيانات الجينومية تيلف متاحة للجمهور في الساعة32. ومع ذلك، فيروسات الرنا معروفة ليحمل طفرة ارتفاع أسعار وسلالات ممكن سوف الهروب الاختبارات التشخيصية الحالية، كما لوحظ إيساف59. دائماً سيكون من الصعب لمثل هذه الأنواع من الفيروسات لتوليد الرايت تيلف عموم عالمي-الإنزيم قبكر وهذه الاختبارات سيتم فقط باستمرار تحسين إذا توفرت بيانات الجينوم تيلف أكثر من مواقع بعيدة المدى والفترات الزمنية.
وأخيراً، من الضروري لتشغيل مكررة أو ثلاث إذا كان ذلك ممكناً، ردود فعل في داخلها على حد سواء وجملة فحوصات qPCR. إذا كانت قيمt ج عالية جداً، ثم استخدام replicates مهم بشكل خاص للتأكد من أن رد فعل PCR موثوق بها واستنساخه. بشكل عام، إذا كان تكرار البيانات من ردود الفعل تتفاوت الدورات أكثر من 0.5، ردود الفعل ينبغي أن يتكرر ويعيد إذا تختلف قيمt C استمرار دورات > 0.5 في، التحليل، ينبغي أن يكون الأمثل إعادة. ويساعد استخدام روبوت بيبيتينج qPCR المتكاملة هائلة مع هذه المسألة، ولكن أداة الرفاهية. مع أي تجربة، وضوابط كافية ومناسبة إدراج أهمية قصوى لتطوير فحوصات الجزيئية قوية، لا سيما في مختبرات التشخيص فيها مثل هذه الاختبارات يجب أن تكون معتمدة. ينبغي أن تتضمن عناصر إيجابية (الإيجابية تيلف عينة، تيلف بلازميد القياسية) وعناصر سلبية العينات (المجلس الوطني الانتقالي و-RT)، فضلا عن الكشف عن الجينات التدبير المنزلي البلطي الذاتية. هذه الضوابط لا يمكن الاستهانة به، وينبغي أن تدرج في كل تحليل بشكل صحيح فهم نوعية كل خطوة التحليل وتفسير النتائج بشكل صحيح.
Disclosures
الكتاب ليس لها علاقة بالكشف عن.
Acknowledgements
ونحن ممتنون لمعهد علم الجراثيم البيطرية، كلية فيتسويسي، وجامعة بيرن لدعمهم. تم تمويل هذا العمل من اللجنة "تعزيز الأكاديمية للباحثين الوظيفي المبكر" والمساواة بين الجنسين في كلية فيتسويسي، جامعة برن من 120% نموذج التمويل الممنوح للسندات الإذنية. WS والعلاقات العامة معتمدة من قبل مركز الدراسات المتقدمة للزراعة والأغذية، ومعهد الدراسات المتقدمة، جامعة كاسيتسارت، بانكوك، تايلند، في إطار تعزيز بحوث التعليم العالي والوطنية أبحاث جامعة المشروع في تايلند، مكتب تايلند اللجنة، وزارة التعليم والتعليم العالي. ونود أن نشكر الدكتور سيريكانتشانا كونروي لبلدها السرد وسكارين بيياواتشارا لتحرير الفيديو.
Materials
| Name | Company | Catalog Number | Comments |
| Tissue collection | Step 1 | ||
| Tricaine methanesulfonate | Sigma-Aldrich | E10521 | An alternative to clove oil. Step 1.1 |
| RNAlater stabilization solution | Thermo Fisher Scientific | AM7020 | For storing tissues if they cannot be processed immediately Step 1.3 |
| RNA extraction | Step 2 | ||
| TRIreagent | Sigma-Aldrich | Step 2.1 | |
| TRIzol | Thermo Fisher Scientific (Invitrogen) | 15596026 | Step 2.1 |
| GENEzol | Geneaid | GZR100 | Step 2.1 |
| Trisure | Bioline | BIO-38032 | Step 2.1 |
| Homemade solution | - | - | 94.53 g/L (800 mM) guanidine thiocyanate 30.45 g/L (400 mM) ammonium thiocyanate 8.20 g/L (100 mM) sodium acetate 380 mL/L (38 % v/v) phenol 50 mL/L (5 % v/v) glycerol 1.0 g/L (0.1 % w/v) 8-quinolinol, pH 5.0 Store up to 2 years at 4oC Step 2.1 |
| MagNA Lyser Green Beads | Roche | 3358941001 | An alternative tissue homogenization method used in conjunction with tissue lysing machines detailed below Step 2.2 |
| Lysing Matrix D, 2 mL Tube | MP BIOMEDICALS | 116913050 | |
| Chloroform | Sigma-Aldrich | C2432 | Step 2.3 |
| Chloroform | RCI Labscan | AR1027E-G2.5L | Step 2.3 |
| 1-Bromo-3-chloropropane | Sigma-Aldrich | B9673 | A less toxic alternative to chloroform Step 2.3 |
| Isopropanol (GC) ≥ 99.8 % | Sigma-Aldrich | 59300 | Step 2.6 |
| Isopropanol (ACS, ISO Reag. Ph Eur) | Merck KGaA (EMSURE) | 1.09634.2500 | Step 2.6 |
| Glycogen, molecular biology grade (e.g., Sigma, cat. no. G1767) | Thermo Fisher Scientific (Thermo Scientific) | R0551 | Useful step if tissue starting material is small to maximise RNA precipitation optional |
| Ethanol (purity (GC) ≥ 99.9 % | Sigma-Aldrich (EMD Millipore) | 1.00983 | Step 2.9 |
| Ethanol (ACS, ISO Reag. Ph Eur) | Merck (EMSURE) | 1.00983.2500 | Step 2.9 |
| Nuclease-free water | Promega | P1193 | Step 2.13 |
| Nuclease-free water | Multicell | 809-115-CL | Step 2.13 |
| Ambion TURBO DNA-free kit | Thermo Fisher Scientific (Invitrogen) | AM1907 | Can be performed at the end of the RNA extraction protocol optional |
| cDNA synthesis | Step 4 | ||
| Viva cDNA Synthesis Kit | Vivantis | cDSK01 | Step 4.1 & 4.3 |
| ReverTra Ace qPCR RT MasterMix with gDNA remover | Toyobo | A1172K | An alternative option see discussion |
| ReverTra Ace qPCR RT Kit | Toyobo | FSQ-101 | An alternative option see discussion |
| AffinityScript Multiple Temperature Reverse Transcriptase | Agilent Technologies | 600107 | An alternative option |
| PCR | Step 5 | ||
| DNA polymerase systems: | Step 5.2 | ||
| - Platinum II Hot-Start Green PCR Master Mix (2X) | Thermo Fisher Scientific (Invitrogen) | 14001012a | Step 5.2 |
| - GoTaq Mastermix | Promega | M7122 | Step 5.2 |
| Separate PCR mixture components: | Step 5.2 | ||
| 10mM dNTP Mix | Vivantis | NP2409 | Step 5.2 |
| 25mM MgCl2 | Thermo Fisher Scientific | R0971 | Step 5.2 |
| 10X Taq Buffer with KCl | Thermo Fisher Scientific | 00348114 | Step 5.2 |
| Taq DNA polymerase | Vivantis | PL1202 | Step 5.2 |
| - Verso 1-step RT-PCR ReddyMix with ThermoPrime Taq | Thermo Fisher Scientific | AB1454 | One step RT-PCR exemplified in Figure 3B |
| Gel electrophoresis: | For visulation of PCR products from steps 5.1-5.4 | ||
| Ethidium Bromide solution (10 mg/mL) | Thermo Fisher Scientific | 17898 | Step 5.5 |
| Tris/Acetic/EDTA (TAE) buffer: | Step 5.5 | ||
| - Tris | Vivantis | PR0612-1KG | Step 5.5 |
| - Acetic acid (glacial) (ACS, ISO, Reag. Ph Eur) | Merck KGaA (EMSURE) | 1.00063.2500 | Step 5.5 |
| - Ethylenediaminetetraacetic acid (EDTA) | BIO-RAD | 161-0729 | Step 5.5 |
| Agarose | Vivantis | PC0701-100G | Step 5.5 |
| DNA ladders and markers | Vivantis | NL1405 | Step 5.5 |
| DNA gel loading dye (6X) | Thermo Fisher Scientific | R0611 | Step 5.5 |
| qPCR | Step 6 | ||
| PowerUP SYBR Green Master Mix | Thermo Fisher Scientific (Applied Biosystems) | A25779 | Exemplified in Figures 4-6B Step 6.2 |
| iTaq Universal SYBR Green Supermix | BIO-RAD | 1725120 | Exemplified in the video and in Figures 4-6A Step 6.2 |
| Equipment | |||
| Dounce tissue grinder pestle | Sigma-Aldrich | P1110 | Protocol 2 |
| MagNA Lyser Instrument | Roche | 3358976001 | An alternative tissue homogenizing option for protocol 2 which are used in conjunction with the lysing beads detailed above Step 2.2 |
| FastPrep-24 5G Homogenizer | MP BIOMEDICALS | 116005500 | |
| Refrigerated microcentrifuge | Eppendorf | Eppendorf 5427R | Protocol 2 Step 2.4, 2.7 & 2.10 |
| Refrigerated microcentrifuge | Eppendorf | Eppendorf 5418R | |
| Heat box | Labnet | AccuBlock Digital Dry Bath | Protocol 2 Step 2.13 |
| Microvolume spectrophotometer | Thermo Fisher Scientific (Applied Biosystems) | Nanodrop 2000 | Protocol 3 Step 3.1 - 3.4 |
| PCR machine | BIO-RAD | T100 Thermal Cycler | Protocol 5 Step 5.4 |
| Power supply | BIO-RAD | PowerPac HC | Protocol 5 Step 5.5 |
| Horizontal gel electrophoresis | BIO-RAD | Mini ReadySub-Cell GT Cell #1704487edu | Protocol 5 Step 5.5 |
| Mini microcentrifuge | Corning | LSE 6766 | Useful to quickly spin down PCR reaction tubes in protocols 4, 5 & 6 Step 6.5.1 |
| Microcentrifuge | LioFuge | LM-60 | Step 6.5.1 |
| qPCR machine and software | Thermo Fisher Scientific | 7500 Fast Real-Time PCR System with 7500 Software v2.0 | Protocol 6 Step 6.6-6.8 |
| qPCR machine and software | BIO-RAD | CFX96 Touch Real-Time PCR Detection System with CFX Manager software | |
| General Materials | |||
| Mayo scissors | Step 1.1-1.2 | ||
| Forceps | Step 1.1-1.2 | ||
| Pipette | Rainin | Pipette-Lite XLS | |
| Aerosol-barrier pipette tips | Sigma-Aldrich | Z333328, Z333336, Z333344 | |
| Nuclease-free 1.5-ml microcentrifuge tubes | Eppendorf |
References
- FAO. . The State of World Fisheries and Aquaculture, 2014. Opportunities and Challenges. , (2014).
- FAO. . The State of World Fisheries and Aquaculture, 2016. Contributing to Food Security and Nutrition for all. , (2016).
- WorldBank. . FISH TO 2030: Prospects for Fisheries and Aquaculture. Agriculture and Environmental Services Discussion Paper 03. , (2013).
- Wing-Keong, N., Nicholas, R. A review of the nutrition and feeding management of farmed tilapia throughout the culture cycle. Reviews in Aquaculture. 5 (4), 220-254 (2013).
- Cleasby, N., et al. The socio-economic context for improving food security through land based aquaculture in Solomon Islands: A peri-urban case study. Marine Policy. 45, 89-97 (2014).
- Ponzoni Raul, W., et al. Genetic improvement of Nile tilapia (Oreochromis niloticus) with special reference to the work conducted by the WorldFish Center with the GIFT strain. Reviews in Aquaculture. 3 (1), 27-41 (2011).
- Hounmanou, Y. M. G., et al. Tilapia lake virus threatens tilapiines farming and food security: Socio-economic challenges and preventive measures in Sub-Saharan Africa. Aquaculture (Amsterdam, Netherlands). 493, 123-129 (2018).
- OIE. . Tilapia Lake Virus (TiLV) - a novel orthomyxo-like virus. OIE technical disease cards. , (2018).
- Mugimba, K. K., et al. Detection of tilapia lake virus (TiLV) infection by PCR in farmed and wild Nile tilapia (Oreochromis niloticus) from Lake Victoria. Journal of Fish Diseases. , (2018).
- Koesharyani, I., Gardenia, L., Widowati, Z., Khumaira, D. D., Rustianti, Studi kasus infeksi tilapia lake virus (tilv) pada ikan nila (Oreochromis niloticus). Jurnal Riset Akuakultur. 13 (1), 85-92 (2018).
- OIE. . Tilapia lake virus disease (TiLV), Chinese Taipei. Immediate Notification. , (2017).
- OIE. . Tilapia Lake Virus Disease (TiLV), Peru. Immediate Notification. , (2018).
- Bacharach, E., et al. Characterization of a Novel Orthomyxo-like Virus Causing Mass Die-Offs of Tilapia. MBio. 7 (2), e00431-e00416 (2016).
- Eyngor, M., et al. Identification of a novel RNA virus lethal to tilapia. Journal of Clinical Microbiology. 52 (12), 4137-4146 (2014).
- Nicholson, P., et al. Detection of Tilapia Lake Virus in Egyptian fish farms experiencing high mortalities in 2015. Journal of Fish Diseases. 40 (12), 1925-1928 (2017).
- Surachetpong, W., et al. Outbreaks of Tilapia Lake Virus Infection, Thailand, 2015-2016. Emerging Infectious Diseases. 23 (6), 1031-1033 (2017).
- Tattiyapong, P., Dachavichitlead, W., Surachetpong, W. Experimental infection of Tilapia Lake Virus (TiLV) in Nile tilapia (Oreochromis niloticus) and red tilapia (Oreochromis spp.). Veterinary Microbiology. 207, 170-177 (2017).
- Kembou Tsofack, J. E., et al. Detection of Tilapia Lake Virus in Clinical Samples by Culturing and Nested Reverse Transcription-PCR. Journal of Clinical Microbiology. 55 (3), 759-767 (2017).
- Thangaraj, R. S., et al. Derivation of two tilapia (Oreochromis niloticus) cell lines for efficient propagation of Tilapia Lake Virus (TiLV). Aquaculture (Amsterdam, Netherlands). 492, 206-214 (2018).
- Hanson, L. A., Rudis, M. R., Vasquez-Lee, M., Montgomery, R. D. A broadly applicable method to characterize large DNA viruses and adenoviruses based on the DNA polymerase gene. Virology Journal. 3, 28-28 (2006).
- Josko, D. Molecular virology in the clinical laboratory. Clinical Laboratory Science. 23 (4), 231-236 (2010).
- Munir, K., Kibenge, F. S. Detection of infectious salmon anaemia virus by real-time RT-PCR. Journal of Virological Methods. 117 (1), 37-47 (2004).
- Snow, M., et al. Developement, application and validation of a Taqman real-time RT-PCR assay for the detection of infectious salmon anaemia virus (ISAV) in Atlantic salmon (Salmo salar). Developments in Biologicals. 126, 133-145 (2006).
- Matejusova, I., McKay, P., McBeath, A. J., Collet, B., Snow, M. Development of a sensitive and controlled real-time RT-PCR assay for viral haemorrhagic septicaemia virus (VHSV) in marine salmonid aquaculture. Diseases of Aquatic Organisms. 80 (2), 137-144 (2008).
- Garver, K. A., et al. Development and validation of a reverse transcription quantitative PCR for universal detection of viral hemorrhagic septicemia virus. Diseases of Aquatic Organisms. 95 (2), 97-112 (2011).
- Dalla Valle, L., et al. Development of a sensitive and quantitative diagnostic assay for fish nervous necrosis virus based on two-target real-time PCR. Veterinary Microbiology. 110 (3-4), 167-179 (2005).
- Hodneland, K., Garcia, R., Balbuena, J. A., Zarza, C., Fouz, B. Real-time RT-PCR detection of betanodavirus in naturally and experimentally infected fish from Spain. Journal of Fish Diseases. 34 (3), 189-202 (2011).
- Hodneland, K., Endresen, C. Sensitive and specific detection of Salmonid alphavirus using real-time PCR (TaqMan). Journal of Virological Methods. 131 (2), 184-192 (2006).
- Wang, X. W., Ao, J. Q., Li, Q. G., Chen, X. H. Quantitative detection of a marine fish iridovirus isolated from large yellow croaker, Pseudosciaena crocea, using a molecular beacon. Journal of Virological Methods. 133 (1), 76-81 (2006).
- van Beurden, S. J., et al. Development and validation of a real-time PCR assay for the detection of anguillid herpesvirus 1. Journal of Fish Diseases. 39 (1), 95-104 (2016).
- Ciulli, S., et al. Development and application of a real-time PCR assay for the detection and quantitation of lymphocystis disease virus. Journal of Virological Methods. 213, 164-173 (2015).
- Tattiyapong, P., Sirikanchana, K., Surachetpong, W. Development and validation of a reverse transcription quantitative polymerase chain reaction for tilapia lake virus detection in clinical samples and experimentally challenged fish. Journal of Fish Diseases. 41 (2), 255-261 (2018).
- Dong, H. T., et al. Emergence of tilapia lake virus in Thailand and an alternative semi-nested RT-PCR for detection. Aquaculture (Amsterdam, Netherlands). 476, 111-118 (2017).
- Waiyamitra, P., et al. A TaqMan RT-qPCR assay for tilapia lake virus (TiLV) detection in tilapia. Aquaculture (Amsterdam, Netherlands). 497, 184-188 (2018).
- Behera, B. K., et al. Emergence of Tilapia Lake Virus associated with mortalities of farmed Nile Tilapia Oreochromis niloticus (Linnaeus 1758) in India. Aquaculture (Amsterdam, Netherlands). 484, 168-174 (2018).
- Ferguson, H. W., et al. Syncytial hepatitis of farmed tilapia, Oreochromis niloticus (L.): a case report. Journal of Fish Diseases. 37 (6), 583-589 (2014).
- Liamnimitr, P., Thammatorn, W., U-thoomporn, S., Tattiyapong, P., Surachetpong, W. Non-lethal sampling for Tilapia Lake Virus detection by RT-qPCR and cell culture. Aquaculture (Amsterdam, Netherlands). 486, 75-80 (2018).
- Yang, C. G., et al. Evaluation of reference genes for quantitative real-time RT-PCR analysis of gene expression in Nile tilapia (Oreochromis niloticus). Gene. 527 (1), 183-192 (2013).
- Bustin, S. A. Real-time, fluorescence-based quantitative PCR: a snapshot of current procedures and preferences. Expert Review of Molecular Diagnostics. 5 (4), 493-498 (2005).
- Fleige, S., Pfaffl, M. W. RNA integrity and the effect on the real-time qRT-PCR performance. Molecular Aspects of Medicine. 27 (2-3), 126-139 (2006).
- Kubista, M., et al. The real-time polymerase chain reaction. Molecular Aspects of Medicine. 27 (2-3), 95-125 (2006).
- Mackay, I. M., Arden, K. E., Nitsche, A. Real-time PCR in virology. Nucleic Acids Research. 30 (6), 1292-1305 (2002).
- Wong, M. L., Medrano, J. F. Real-time PCR for mRNA quantitation. Biotechniques. 39 (1), 75-85 (2005).
- Bustin, S. A. Absolute quantification of mRNA using real-time reverse transcription polymerase chain reaction assays. Journal of Molecular Endocrinology. 25 (2), 169-193 (2000).
- Heid, C. A., Stevens, J., Livak, K. J., Williams, P. M. Real time quantitative PCR. Genome Research. 6 (10), 986-994 (1996).
- Rutledge, R. G., Côté, C. Mathematics of quantitative kinetic PCR and the application of standard curves. Nucleic Acids Research. 31 (16), e93-e93 (2003).
- Svec, D., Tichopad, A., Novosadova, V., Pfaffl, M. W., Kubista, M. How good is a PCR efficiency estimate: Recommendations for precise and robust qPCR efficiency assessments. Biomolecular Detection and Quantification. 3, 9-16 (2015).
- Amal, M. N. A., et al. A case of natural co-infection of Tilapia Lake Virus and Aeromonas veronii in a Malaysian red hybrid tilapia (Oreochromis niloticus × O. mossambicus) farm experiencing high mortality. Aquaculture (Amsterdam, Netherlands). 485, 12-16 (2018).
- Fathi, M., et al. Identification of Tilapia Lake Virus in Egypt in Nile tilapia affected by ‘summer mortality’ syndrome. Aquaculture (Amsterdam, Netherlands). 473, 430-432 (2017).
- OIE. . Tilapia Lake Virus disease (TiLV), Philippines. Immediate Notification. , (2017).
- OIE. . Tilapia lake virus disease (TiLV), Malaysia. Immediate Notification. , (2017).
- Abdullah, A., et al. First detection of tilapia lake virus (TiLV) in wild river carp (Barbonymus schwanenfeldii) at Timah Tasoh Lake, Malaysia. Journal of Fish Diseases. 41 (9), 1459-1462 (2018).
- Chomczynski, P., Sacchi, N. Single-step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction. Analytical Biochemistry. 162 (1), 156-159 (1987).
- Chomczynski, P., Sacchi, N. The single-step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction: twenty-something years on. Nature Protocols. 1 (2), 581-585 (2006).
- Del-Pozo, J., et al. Syncytial Hepatitis of Tilapia ( Oreochromis niloticus L.) is Associated With Orthomyxovirus-Like Virions in Hepatocytes. Veterinary Pathology. 54 (1), 164-170 (2017).
- Bustin, S. A., et al. The MIQE guidelines: minimum information for publication of quantitative real-time PCR experiments. Clinical Chemistry. 55 (4), 611-622 (2009).
- Purcell, M. K., Getchell, R. G., McClure, C. A., Garver, K. A. Quantitative polymerase chain reaction (PCR) for detection of aquatic animal pathogens in a diagnostic laboratory setting. Journal of Aquatic Animal Health. 23 (3), 148-161 (2011).
- Simpson, D. A., Feeney, S., Boyle, C., Stitt, A. W. Retinal VEGF mRNA measured by SYBR green I fluorescence: A versatile approach to quantitative PCR. Molecular Vision. 6, 178-183 (2000).
- Kibenge, M. J., et al. Discovery of variant infectious salmon anaemia virus (ISAV) of European genotype in British Columbia, Canada. Virology Journal. 13, 3 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved