Method Article
Обнаружение тилапии озеро вирус с помощью обычных RT-PCR и SYBR зеленый RT-ПЦР
В этой статье
Резюме
Этот протокол диагнозов тилапии озеро вирус (TiLV) в тканях тилапии с помощью ПЦР-методологии. Весь метод описан от рассечение тканей в общее извлечение RNA, следуют синтеза cDNA и обнаружения TiLV обычных ПЦР или количественного PCR используя dsDNA привязки краска люминесцентные привязки.
Аннотация
Цель этого метода заключается в содействии быстрый, чувствительной и конкретных обнаружения вируса тилапии озеро (TiLV) в тканях тилапии. Этот протокол может использоваться в рамках программ наблюдения, мер по обеспечению биозащищенности и в TiLV основных исследовательских лабораториях. Золотым стандартом диагностики вируса обычно включает изоляции вируса, следуют дополнительные методы, такие как обратное транскрипция полимеразной цепной реакции (ПЦР) для дальнейшей проверки. Это может быть громоздким, времени и обычно требует образцов тканей, сильно заражены вирусом. Из-за его количественный характер, высокая чувствительность, специфичность, масштабируемость и его быстрое время, чтобы привести выгодно использование количественного RT-PCR (q) для обнаружения вирусов. Здесь весь метод ПЦР на основе подходов для обнаружения описано, от тилапии орган резания, Общая рибонуклеиновой кислоты (РНК) добычи с помощью guanidium тиоцианат фенол хлороформ раствор, количественного определения РНК, следуют ПЦР двухэтапный TiLV влекущие за собой протокол, синтез взаимодополняющих дезоксирибонуклеиновой кислоты (кДНК) и обнаружения TiLV обычных ПЦР или количественных идентификации через ПЦР с помощью SYBR зеленый я красителя. Обычные PCR требует шагов пост ПЦР и будет просто сообщить о присутствии вируса. Последний подход позволит абсолютной количественной оценки TiLV вниз как 2 копии и таким образом является исключительно полезным для диагностики TiLV в югу клинических случаях. Подробное описание двух подходов PCR, представитель результаты из двух лабораторий и тщательное обсуждение критических параметров обоих были включены обеспечить, что исследователи и диагносты найти их наиболее подходящим и применимым метод обнаружения TiLV.
Введение
Поставка рыбы глобальной душу достиг новой записи 20 кг в 2014 году, и это было вследствие энергичного роста в аквакультуре. Аквакультура остается одним из наиболее быстро растущих животных продуктов питания производство секторов во всем мире и является сектор только животных производства продовольствия, которое растет быстрее, чем население1. Tilapiine cichilds составляют второй наиболее важный пресноводная рыба, выращиваемых во всем мире с общего глобального производства 6,4 миллиона тонн (МТ) и предполагаемое значение 9,8 млрд долларов США в 2015 году2. Топ 10 производителей тиляпии являются Китай (1,78 MT), Индонезия (1.12 MT) и Египет (0,88 MT), а затем2Бангладеш, Вьетнама, Филиппин, Бразилии, Таиланда, Колумбии и Уганды. Ожидается, что глобальная тилапии производство будет около 7,3 MT 20303. Тилапии стали таким важным глобальным источником пищи, не только потому, что они являются недорогой источник белка4 , но и потому, что они легко размножаются в емкость под широкий спектр водных и климатических условий5,6. Всего лишь несколько десятилетий назад, считалось, что там было несколько коммерчески значимых заболеваний угрожает тилапии земледелия, но это больше не так. Новые вирусная болезнь под названием тилапии озеро вирусных заболеваний (TiLVD) — первый когда-либо критического заболевания эпидемии в тилапии и вся промышленность находится в опасности. Эта болезнь имеет серьезные социально экономические последствия и представляет собой прямую угрозу для продовольственной безопасности для миллионов людей в Африке7, Азии и Южной Америке. В начале 2018 Всемирной организации по здоровью животных (МББЭ) сообщил, что этиологический агент этого заболевания, TiLV, было официально выявлено на трех континентах, охватывающий восемь стран8 , и поскольку этот возбудитель информационная карточка Обновление там были больше сообщения о TiLV в Танзании, Уганда9, Индонезия10, Тайвань11 и Перу12. TiLV — Роман одноцепочечной РНК вирус описанных быть orthomyxo как вирус, потому что он содержит целый ряд характеристик напоминают другие orthomyoxoviruses, таких как грипп или инфекционный лосося анемии вирус (ISAV)13. Она была впервые выявлена в результате массовые потери диких и выращиваемых тилапии в озеро Кинерет, Израиль14. Впоследствии аналогичные вспышки заболеваний, упоминаемые как летняя смертность и один месяц, синдром смертности, связанные с TiLV инфекцией сообщалось в Нил тилапии (Oreochromis niloticus) в Египте15 и Нила и красных гибридных тилапии (Oreochromis sрр.) в Таиланде16соответственно. Исторически обнаружение водных животных вирусов осуществляется роста и изоляции вируса в культуре клеток. Были протестированы различные клеточные линии для распространения и изоляции TiLV, в том числе, E-11 клетки, полученные из змееголов рыб (Ophiocephalus striatus)17,18, OmB и ТМБ возникая от Oreochromis mossambicus18и OnlB и OnlL, возникая от Нила тилапии (O. niloticus)19. В то время как вирус культура имеет то преимущество, что она предоставляет материал для дальнейших экспериментов, он имеет тот недостаток, что он требует по крайней мере 4-7 дней, чтобы наблюдать за формирование цитопатического воздействия (CPE) и критически, piscine различные вирусы, которые больше подходят для Репликация может быть унаследован и производить аналогичные CPE.
В последние несколько десятилетий наблюдается отход от традиционных, зачастую много времени методы диагностики как культуру клеток, серологии и обнаружения антигена и замена с быстрее и более чувствительных нуклеиновой кислоты на основе обнаружения испытаний20, 21. Это становится очевидным тот факт, что многие анализы ПЦР были разработаны как важные диагностические методы для множества вирусных заболеваний водных животных, таких как для ISAV22,23, вирусная геморрагическая септицемия вирус (VHSV)24 25 ,, betanodavirus,2627 лососевых альфавирус28, рыбы iridovirus29, Anguillid герпеса 1 (AngHV1)30и Lymphocystis болезни вирус (НКУ)31 . Надежные методы для диагностики и возбудителя наблюдения необходимы для уменьшения распространения TiLV. Такие методы должны позволить раннего обнаружения инфекции, прежде чем разработать клинические признаки и низкой вирусной нагрузки. На сегодняшний день, различные протоколы PCR, включая ПЦР-14,32, вложенные ПЦР-18, полу вложенных ПЦР-33и RT-ПЦР32,34 были разработаны для обнаружения TiLV в тканях рыбы. Сравнение RT-ПЦР и вирус изоляции в восприимчивых клеточных линий для обнаружения TiLV показало, что RT-ПЦР 1000 раз чувствительнее, чем вирус изоляции32. Хотя каждый опубликованный протокол PCR разные чувствительности для обнаружения TiLV, большинство анализов являются весьма чувствительными с пределов обнаружения вирусных копий на 7,5 копии33, 7 копий18 или 2 копии32 в реакция.
Цель этой статьи методов является объяснить в деталях, как для выполнения анализов обнаружения TiLV, начиная с тилапия ткани коллекции, чтобы общее извлечение RNA, синтез cDNA и затем TiLV конкретного ПЦР на основе анализов. В частности всеобъемлющей протоколы обычных RT-PCR и SYBR на основе зеленого RT-ПЦР были описаны призыв к широкому спектру ученых стремится обнаружить TiLV. Первая менее чувствителен, но обычно является более дешевый вариант обнаружения. Последнее требует более сложной инфраструктуры, например Количественная ПЦР машины и дороже реагенты, но она имеет преимущества количественных, быстро и чувствительный, означает, что он может использоваться для обнаружения TiLV в суб-клинически зараженной рыбы. RT-PCR и RT-ПЦР протоколы были исполнены в двух разных лабораториях с различных географических изолятов TiLV и включенные результаты выделения чувствительность и воспроизводимости анализов, описанных здесь.
протокол
Использование животных протокол для этого исследования был одобрен Комитетом Этика животных Касетсарт университета под номером разрешения ACKU 59-VET-016.
Примечание: Пожалуйста, обратитесь к Таблице материалы для расширенной информации, касающейся реагенты и оборудование, предложенные для этого протокола.
1. ткань образец коллекции
- Усыпить рыбы с использованием передозировки гвоздичного масла (объем зависит от размера рыбы и концентрации продуктов, обычно более чем 3 мл/Л). Погрузите одну четвертую часть ножницы пинцет и Майо в 95% (v/v) этанола, следуют сжигание оборудование, с помощью спиртовая горелка для стерилизации оборудования.
Примечание: Tricaine Метансульфонат (MS-222) может использоваться вместо гвоздичное масло. - Найти печени и отрезать кусочек (примерно 20-100 мг) или собирать 200 мкл слизи, с использованием стекла или хирургическое лезвие для удаления слизи из предшествовавшие задней рыбы тиляпии и поместить образцы в пробки microcentrifuge 1,5 мл.
- Процесс образцы сразу, хранить в РНК, стабилизации решения или переместить их до-80 ° C до дальнейшего использования.
Примечание: Большая задача в работе с РНК готовит нетронутыми молекул РНК и держать их неповрежденных всей любой последующей расправы. Костяк РНК врожденной более чувствительны к повреждениям, чем ДНК. Добыча и изоляции всего РНК из клеток ткани требует тщательного лабораторного техника; принять все положения для предотвращения загрязнения РНКазы носить перчатки, используя РНКазы свободной воды, реагентов, оборудования, пластиковая посуда, посуда, рабочее пространство и используя фильтр советы для пипетирования.
2. Guanidium тиоцианат - фенол - хлороформ добыча РНК
- Добавьте 1 мл раствора монофазных, содержащих фенол и гуанидина Изотиоцианаты в пробирку, содержащую образец ткани из раздела 1.
Предупреждение: Это решение весьма токсичен и должны быть обработаны с осторожностью в Ламинарный шкаф с защитным оборудованием и надлежащие защитные очки, Одежда и защитные перчатки. - Измельчить образец ткани, с использованием гомогенизатора пестик ткани до однородной.
Примечание: Образцы можно также гомогенизированные с использованием гомогенизатора мощности, в сочетании с керамической дробью. Убедитесь, что образец ткани полностью гомогенизированные перед переходом к следующему шагу или остановить протокол здесь и хранить полностью гомогенизированных образцов-80 ° C до дальнейшего использования. - 200 мкл метилхлороформа для отделения фазы.
ОСТОРОЖНО хлороформ является потенциальным наркотических и является чрезвычайно опасным. Его следует подходить с осторожностью в Ламинарный шкаф с защитного снаряжения, а также надлежащие защитные очки, Одежда и защитные перчатки. Как менее токсичны альтернативных, 1-бром-3-chloropropane может также использоваться.
Примечание: Масштаб тома вверх или вниз, где это уместно. Например если только 500 мкл раствора монофазных, содержащих фенол и гуанидина Изотиоцианаты было использовано, то только мкл 100 метилхлороформа на этот шаг.- Mix образцы хорошо инверсии для 15 s.
- Проинкубируйте образцы 3 мин при комнатной температуре (RT).
- Центрифуги для 15 мин на 12 000 × g и 4 ° C.
Примечание: Там должно быть четкое разделение на нижней органические фазы, белый межфазной и верхняя водной фазе, содержащие РНК. Этот верхний этап обычно бесцветен, но в зависимости от типа и количества гомогенизированные ткани, она может иметь вид светло розовый. - Не нарушая интерфаза передать свежие microcentrifuge трубки верхний водный слой (примерно 500 мкл).
Примечание: не пытайтесь перевести весь водяной участок, оставить небольшую сумму, чтобы не допустить любого потенциального загрязнения РНК, содержащие водной фазе с органических или межфазное. - Добавьте 1 объем 100% изопропиловый спирт для РНК.
- При необходимости если использовались очень небольшое количество ткани, затем добавьте 1 мкл (5-10 мкг) бесплатно РНКазы гликогена для каждого образца для поощрения эффективных осадков РНК. Это поможет определение РНК Пелле в шаге 2.8.
Примечание: Гликоген действует как несущая РНК и предотвратит небольшие количества РНК от прилипания к стороне трубки. - Смесь хорошо, инверсии трубы несколько раз.
- Хранение образцов для 2 h для ночевки при-20 ° C.
- При необходимости если использовались очень небольшое количество ткани, затем добавьте 1 мкл (5-10 мкг) бесплатно РНКазы гликогена для каждого образца для поощрения эффективных осадков РНК. Это поможет определение РНК Пелле в шаге 2.8.
- Образцы центрифуги для 15 мин при 12000 x g и 4 ° C.
- Выбросите супернатанта, соблюдая осторожность, чтобы не вытеснить Пелле РНК в нижней части пробки microcentrifuge.
- Добавьте 1 mL этанола 75% (v/v) и перемешать образцов РНК, инвертирование трубке несколько раз.
- Центрифуги для 15 мин на 10000 x g и 4 ° C.
Примечание: Протокол может быть остановлено здесь и образцы, составе РНК Пелле в 75% этанола могут храниться при температуре-20 ° C до дальнейшего использования. - Выбросите супернатанта, быть бдительным, чтобы не вытеснить Пелле РНК в нижней части пробки microcentrifuge.
- При необходимости повторите шаги 2.9-2.11 с помощью этанол 70% (v/v). Тщательно мытья РНК Пелле сведет к минимуму любой соли или переноса загрязняющих веществ, которые могут помешать будет чувствительных нисходящие приложения.
- Вытянуть остальные этанола, с помощью пипетки и затем просушите Пелле РНК при комнатной температуре не более 5-10 мин.
Примечание: Чрезмерное сухие гранулы будет трудно вновь приостановить. - 30-60 мкл РНКазы свободной воды, предварительно нагретой до 55-60 ° C до солюбилизировать последнего Пелле РНК.
- Место РНК на льду для немедленного использования или хранения при температуре-80 ° C для последующего использования.
3. количественную оценку концентрации РНК с помощью спектрофотометра микро-Тома
- Переключение параметров спектрофотометра РНК.
- Используйте 1-2 мкл РНКазы свободной воды как пустой.
- Используйте 1-2 мкл каждого образца РНК для оценки количества РНК.
- Записать показания на 230 Нм, 260 Нм и 280 Нм для каждого образца.
- Разбавить РНК до 200 нг/мкл, используя РНКазы свободной воды.
4. синтез комплементарной ДНК — (cDNA кДНК) с использованием общей РНК
- Смешать 1 мкг всего РНК из протокола 2, 2 мкм oligo (dT), дНТФ смеси 0,5 мм и довести окончательный объем до 10 мкл с нуклеиназы свободной воды. Для этого подготовьте RT-Мастер микс соответствии количество образцов и элементов управления для проверки.
Примечание: Элементы управления являются образцом минус обратной транскриптазы (-RT) которой RT фермента заменяется нуклеиназы свободной воды (см. шаг 4.3) и не шаблон элемента (NTC) которой нуклеиназы свободной воды добавляется к Мастер микс вместо шаблона РНК.- Смешайте образцы хорошо закупорить следуют краткие центрифугирования.
- Проинкубируйте образцы при 65 ° C за 5 мин, после 2 минут инкубации на льду.
- Кратко Центрифугуйте образцы собрать все жидкости в нижней части трубы.
- Добавить 1 x обратной транскриптазы буфера, 100 U обратной транскриптазы и довести окончательный объем каждого образца до 20 мкл, с использованием воды, свободной от нуклеиназы.
- Смешайте образцы хорошо закупорить следуют краткие центрифугирования.
- Проинкубируйте образцы при 42 ° C 60 мин, после чего 85 ° C за 5 мин.
- Разбавить синтезированных cDNA к желаемой концентрации, добавив соответствующий объем свободной от нуклеиназы воды и поместите cDNA на льду для немедленного использования или храните его при 20 ° C для последующего использования.
5. TiLV обычных PCR
- Используйте cDNA, примеры и элементы управления, созданные в протоколе раздел 4 как шаблоны для реакции PCR, используя любую из установленных грунтовка пар, подробно изложены в таблице 1, наряду с ДНК-полимеразы выбора.
Примечание: Дополнительный элемент управления без шаблон (NTC) следует включить сюда, подставляя cDNA нуклеиназы свободной воды в реакции PCR. Положительный контроль, если таковые имеются, должны быть также включены, включающий предпроверочный TiLV положительные образцы или соответствующий фрагмент TiLV cDNA клонирования в к плазмиды. - Подготовка мастер смесь ПЦР согласно указаниям системы ДНК-полимеразы и количество образцов и элементов управления для проверки. Эта смесь должна включать вперед грунт, обратный грунт, дНТФ, MgCl2 и выбранный ДНК-полимераза, наряду с его буфер.
- Согласно руководящим принципам выбранного ДНК-полимераза объединить назначенный объем Мастер микс с предлагаемое количество cDNA проб и управления.
Примечание: Подготовка 0.5 x излишек реакция часто выгодно так как некоторые из Мастер микс теряется во время закупорить. - Выполняйте ПЦР Велоспорт условий согласно руководящим принципам использования ДНК-полимеразы системы и с использованием соответствующей температуры отжига для грунтовки в эксплуатации (Таблица 1). Как правило, такая программа будет включать первоначальный Денатурация при 95 ° C для 2-5 мин, затем 30-40 циклов денатурации на 95 ° C за 30 сек, отжиг при рекомендуемой температуре 30 s и удлинение 72 ° C за 30 сек, после чего окончательный Удлинение 72 ° C за 5-10 мин.
- Загрузка 5-15 мкл каждого реакции PCR и соответствующие ДНК лестница в скважинах геля агарозы 1-2%, в зависимости от ожидаемого размера продукта PCR. Отдельные амплифицированного ДНК электрофорезом геля и пятно гель, бромид ethidium (EthBr) для облегчения визуализации полос ДНК ожидаемого размера (Таблица 1) в машине гель документации с помощью ультрафиолета.
Предупреждение: Бромистый этидий токсичен; Это должны быть обработаны с осторожностью ношение надлежащей защитную одежду и защитные перчатки.
| Целевой сегмент генома TiLV | Форвард грунтовка 5' - 3' | Обратный грунтовка 5' - 3' | Размер продукта ПЦР (bp) | Tm ° C | Оригинальные ссылки | ||||
| 1 | CCAAACGTTATCTCTTAATTACGCAC | GCAAATATTTCTCTCATTCGCCT | 1641 | 50 | Surachetpong et al., 2017 | ||||
| 1 | CCTCATTCCTCGTTGTGTAAGT | AGGAGTTGCTGTTGGGTTATAG | 1000 | 62 | Mugimba et al., 2018 | ||||
| 2 | ACTCTCTATTACCAAATACATTTACT | TTACCATATATATAGTGAAGGC | 1445 | 45 | Surachetpong et al., 2017 | ||||
| 2 | GTCCAGGGCGGTATGTATTG | CTTACGGCTGACAAGTCTCTAAG | 834 | 62 | Mugimba et al., 2018 | ||||
| 3 | GTTGGGCACAAGGCATCCTA | TATCACGTGCGTACTCGTTCAGT | 250 | 56 | Eyngor et al., 2014 | ||||
| 3 | TATGCAGTACTTTCCCTGCC | TTGCTCTGAGCAAGAGTACC | 491 | 57 | Eyngor et al., 2014 | ||||
| 3 | ACCCCTTAATCCTTAATAGACCGTTA | CCCATAATCCTCTATTAGAACGTCGT | 1352 | 50 | Surachetpong et al., 2017 | ||||
| 3 | GTCGAGGCATTCCAGAAGTAAG | GAGCTAAGGGAACGGCTATTG | 834 | 62 | Mugimba et al., 2018 | ||||
| 4 | AGCAGCAGCAGGAGAAAGAG | ACCGTCCTGTTTCTGAATGG | 358 | 60 | Николсон et al., 2017 | ||||
| 4 | CCAAAGTTTACTCCTATTACCCAGA | GCAAATCTTTCTCCAATTACCGTCT | 1250 | 50 | Surachetpong et al., 2017 | ||||
| 4 | GCCCAATGGTTCCCATATCT | GCCCAATGGTTCCCATATCT | 524 | 62 | Mugimba et al., 2018 | ||||
| 5 | CCAAATGTTTCTCTTATCTCAGACTC | CTTTTTCTCAGTTTACCACTTTATG | 1087 | 57 | Surachetpong et al., 2017 | ||||
| 5 | CAACTCTTAGCCTCCGGAATAC | CGTTCTGCACTGGGTTACA | 696 | 62 | Mugimba et al., 2018 | ||||
| 6 | CCAAATTTTACCTCTCGCAT | TCAAGCACTTAAAACTGTACC | 1027 | 45 | Surachetpong et al., 2017 | ||||
| 6 | CCCACACGACAGGACATATAG | GAGTTGGCTTAGGGTGATAAGA | 948 | 62 | Mugimba et al., 2018 | ||||
| 7 | CTCTCTTTGCATTGCATACCGT | GACCAATTATCCCTGCTTTCA | 704 | 57 | Surachetpong et al., 2017 | ||||
| 7 | TCCTTTAGGGATTGGCACTAAC | TTCCATCGACTGCTCCTAGA | 486 | 62 | Mugimba et al., 2018 | ||||
| 8 | ACCTCATCTACACTAACATTTCCA | TCATCATTACACAAATGGAGTAGCT | 637 | 50 | Surachetpong et al., 2017 | ||||
| 8 | CTTAAGGGCCATCCTGTCATC | TGGCTCAAATCCCAACACTAA | 476 | 62 | Mugimba et al., 2018 | ||||
| 9 | TTGGTGATGTCACGATGGATA | AGTTCTATCGCCAGCCATGT | 351 | 60 | Николсон et al., 2017 | ||||
| 9 | ACAAGTCCGATTACTTTTTCCGC | TCTTTCTCACGTCCTTAAAGTCA | 530 | 50 | Surachetpong et al., 2017 | ||||
| 9 | GATATCCTCCACATGACCCTTC | GTACGTCACTTTGTGCCATTAC | 261 | 62 | Mugimba et al., 2018 | ||||
| 10 | AACCCTACTAACACCAAATATAGCT | CTTTCCCTCTGACACCCTGT | 450 | 50 | Surachetpong et al., 2017 | ||||
| 10 | TCCTCTCTGTCCCTTCTGTT | CAGGATGAGTGTGGCAGATTAT | 276 | 62 | Mugimba et al., 2018 | ||||
Таблица 1. Опубликованные грунтовка пар для амплификации кДНК TiLV, используя конечную точку ПЦР. Грунтовка, набор отображается жирным шрифтом были использованы для создания представительных результаты, показанные на рисунке 3A и 3B.
6. TiLV количественные полимеразной цепной реакции (ПЦР)
- С помощью плазмида, содержащий соответствующие TiLV геномной сегмент 3 cDNA в качестве стандарта, например pTiLV32, подготовит серию десятикратного серийный разрежения дублируется или triplicated.
- Подготовка мастер смесь ПЦР для всех образцов, стандартов и контроля, принимая во внимание, что реакция должна быть выполнена в двойные или тройные используя 0.4 мкл нуклеиназы свободной воды, 0,3 мкл вперед грунт, 0,3 мкл обратный грунтовка и 5 мкл 2 x SYBR Грин ДНК-полимераза Мастер микс за реакции.
- Используйте праймеры в концентрации 10 мкм и грунтовка информации и стандартных pTiLV следующим образом:
Вперед грунтовка: TiLV-112F (5'-CTGAGCTAAAGAGGCAATATGGATT-3')
Обратный грунтовка: TiLV-112R (5'-CGTGCGTACTCGTTCAGTATAAGTTCT-3')
Стандартные pTiLV:10 ПГ/мкл
Примечание: Если общее количество образцов и контроля 10 и будет проводиться в triplicates, это приравнивается к ПЦР Мастер микс из 12 мкл нуклеиназы свободной воды, 9 мкл вперед грунтовка, 9 мкл обратный грунтовка и 150 мкл SYBR Зеленый ДНК полимеразы Мастер микс. Коммерчески приобрели 2 x универсальные SYBR Зеленый ДНК полимеразы мастер смеси содержат все необходимые компоненты для ПЦР-реакции, а именно, SYBR зеленый я покрасить, горячий старт полимеразы дна Taq, дНТФ, MgCl2 и пассивного ведения красители. Главный микс SYBR зеленый защищайте от света.
- Используйте праймеры в концентрации 10 мкм и грунтовка информации и стандартных pTiLV следующим образом:
- Лунки 6 мкл ПЦР Мастер микс в трубки газа ПЦР или 96 хорошо плиты совместим с ПЦР машины в использовании.
- Мкл 4 шаблон cDNA, элементы управления или серийно разбавленных TiLV стандартов в трубы или скважин 96 хорошо пластины.
- Закройте ПЦР трубы или печать 96 также пластины с совместимым покрытие для ПЦР машины используется
- Осторожно проведите ПЦР трубы смешать раствор и спин вниз трубы ПЦР или 96 хорошо пластины, собрать все жидкости в нижней части судов с помощью центрифуги.
- Место труб или пластины в реальном времени тепловая велосипедист.
- Программа Термоциклер ПЦР для выполнения первоначального Денатурация при 95 ° C на 3 мин, затем 40 циклов 95 ° c 10 s и 60 ° C за 30 s для отжига праймера и удлинение, заканчивая плавления кривая шага 65 ° c до 95 ° C с шагом 0,5 ° C / 5 s.
- Выберите SYBR как Флюорофор краситель, затем выберите Неизвестный тип образца и вставьте имя в поле Имя образца.
- Откройте крышку RT-ПЦР машины и место газа ПЦР в назначенных скважины, а затем закройте крышку.
- Выполнение анализа RT-ПЦР с выбранным условиям. Машина начнет работать после того, как крышка достиг нужной температуры. Соберите флуоресценции каждого образца после каждого шага расширение для контроля за ходом реакции.
Примечание: ПЦР машины и программное обеспечение будет автоматически вычислить все параметры анализа и отображения амплификации кривых в режиме реального времени, в то время как стандартный и плавления кривой будет создаваться в конце цикла ПЦР. - Выполнить анализ данных и приобретения обеспечивая первый, что таяние кривые для каждого образца и стандарта имеют один единый пик на ожидаемой температуре для amplicon.
- Оценивать усиления кривых образцов и стандартов и установить порог в регионе были уровень усиления cDNAs одинакова во всех пробах. Это обычно выполняется автоматически программное обеспечение, но должны быть тщательно проверены.
- Рассчитайте количество копий TiLV, с использованием стандартной кривой.
Результаты
После протокол, описанных в разделе 1 умирающий красных гибридных тилапии, отображение клинические признаки инфекции TiLV (рис. 1A) были умерщвлены, купание в высокой концентрации масла гвоздики, который выступает в качестве обезболивающего. О клинических симптомов являются переменными, но общие симптомы, как представляется, летаргия, эрозии кожи и обесцвечивание, пучеглазие, отдельностоящий весы, открытые раны/поражения и ненормальное поведение15,16,33, 35,36, некоторые из них ясно видно на рисунке 1A. Брюшной стенки был удален для сбора внутренних органов, как печень, селезенка или головы почек (рис. 1B). Слизь образцы были также собраны на этой стадии нежно очищая кожу от передней к задней рыбы с помощью покровным стеклом или хирургическое лезвие37.

Рисунок 1 . Диссекции и образец коллекции тилапии. А. TiLV инфицированных красных гибридных тилапии с leisons кожи, покраснение вокруг рта и крышечки, эрозии кожи и прозрачность роговицы. Б. Sectioned красных гибридных тилапии для коллекции тканей печени (точке синяя стрелка), селезенки или органов головы почек. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
После этого последовали протокол, подробно изложены в разделе 2 для извлечения Guanidium тиоцианат-фенол-хлороформ всего РНК и РНК количественной оценки, как указано в разделе 3 была выполнена для оценки чистоты образца расчет соотношений чистоту и исследование спектральных профилей (рис. 2). Рисунок 2A показывает представитель результатом успешной общая процедура извлечения РНК, а Рисунок 2B представляет плохой подготовки РНК. Нуклеиновые кислоты имеют максимумы поглощения на 260 а белки их на 280 nm. Отношение измерения на 260 Нм и 280 Нм указывают чистоту каждого образца и соотношения 1,9 до 2,1 указывают чистой РНК, как в случае для примера на рисунке 2A. Нижняя A260/280 соотношение наблюдается в Рисунок 2B указывают на возможное загрязнение белка или фенол, оставшихся от процедуры извлечения РНК. Поглощения в 230 Нм может быть результатом загрязнения образцов и по этой причине также рассчитывается коэффициент A260/230 Нм. Это отношение должно быть в диапазоне 2,0-2,2 для чистой РНК препараты как показано значение 2.03 для образца в рисунок 2A, в то время как Рисунок 2B имеет низкий коэффициент A260/230 1,07 и спектральные профиль показывает сдвиг в корыто на 230 Нм при направлении 240 Нм, что свидетельствует об остаточных гуанидина или фенола в образце. Для примера, показано на рисунке 2B, повторно вызовет РНК для удаления загрязнения может улучшить чистоты образца.
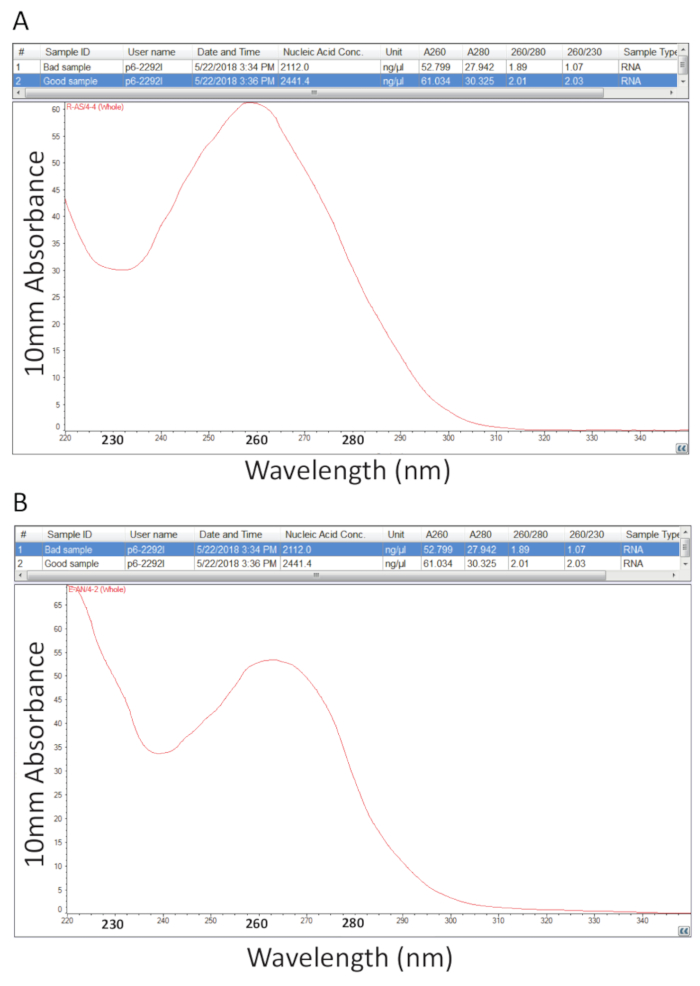
Рисунок 2 . Спектрофотометрические количественной оценки общего РНК, извлеченные из тканей больного тилапии. А. Коэффициенты чистоты и спектральные профили от успешной подготовки РНК. Б. как, за исключением представителя бедных процедуры извлечения РНК. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Для выявления TiLV, RT-PCR, чистые образцы таких, как представлены в рисунок 2A были обратной транскрипции (протокол 4) в cDNA и используется как шаблон для ПЦР анализа подробно говорится в разделе 5 и представитель результаты показаны на рис 3А. Грунты, показано жирным шрифтом в таблице 1 были использованы для того чтобы усилить 491 bp фрагмент TiLV геномной сегмент 314. Продукты PCR были отделены электрофорезом геля и витражи с бромистый этидий для визуализации. На рисунке 3A показывает результаты двухэтапный RT-PCR с использованием 4 cDNA выборок (S1-S4), производные от печени пораженной тилапии, изолированных в Таиланде и в каждой пробе, чистой однодиапазонный приблизительно 500 bp может наблюдаться и таким образом, образцы 1-4 TiLV положительный. Один и тот же продукт PCR был получен из образца положительный контроль, включающий cDNA TiLV сегмента 3 клонирован в плазмиду32 , а не элемент управления-шаблон (NTC) не дают продукты PCR. Проба на рисунке 3B проводилось с использованием же грунты, как показано на рисунке 3A , но в другой лаборатории, используя одноэтапный подход RT-PCR и с 5 РНК образцов, полученных из головы почки тканей тилапии, происходящих в египетских аквакультуры 15. было установлено, используя этот assay обнаружения, что образцы 1, 3 и 5 при TiLV положительные образцы 2 и 4 являются TiLV отрицательный, поскольку не продукт PCR был найден на правильный размер. Негативный контроль, включая два минус управления обратной транскриптазы и два фнт сделал не создает каких-либо продуктов ПЦР. Одношаговая ПЦР-анализа также была исполнена ориентации тилапии ActinB гена. Ампликон размер 217 bp был сгенерирован в каждом образце (S1-S5) как ожидаемый38. Этот assay служил в качестве элемента управления для обеспечения целостности образцов РНК, а также позволяет для полуколичественного анализа позитивных образцов TiLV. Учитывая, что сгенерированный тилапии ActB продукт является относительно равных, различия в размере TiLV конкретного ПЦР продукта создается может интерпретироваться как подлинное отражение количество TiLV в образец данной ткани.
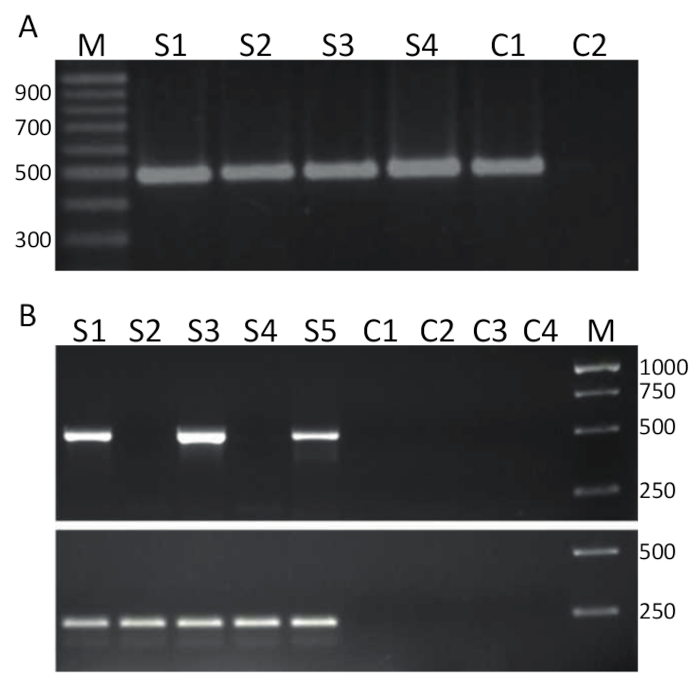
Рисунок 3 . TiLV RT-PCR. А. cDNA производится из печени тканей больного тилапия, пробы из Таиланда были экрана для TiLV инфекции, используя конкретные Праймеры для этапа 3 (показано полужирным шрифтом в таблице 1) из TiLV, с помощью анализа ПЦР-2-шаг. M = маркер, показано в пар оснований; S1-S4 = образцы 1-4; C1 = положительный контроль, используя pTiLV в качестве шаблона ПЦР; и C2 = нет шаблона управления (NTC). Б. одношаговый RT-PCR используя же грунтовки как A и пробы из головы почки тканей больного тилапии из Египта15. M = маркер, показано в пар оснований; S1-S5 = образцы 1-5. Элементы управления C1-C2 минус элементы управления обратной транскриптазы и C3-C4 фнт. Нижняя панель используется одношаговый RT-PCR праймеры, направленные против тилапии ActinB38 (см. текст для подробной информации) производства продукт PCR 217 пар оснований. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
В отличие от конечной точки PCRs, представлены на рис. 3, ПЦР-анализов, которые описаны в протоколе 6, Измерьте количество продукта PCR после каждого цикла PCR. Амплификация ДНК целевой обнаруживается с помощью флуоресцентных молекул, которые взаимодействуют с ДНК, созданный из каждого раунда реакции. Здесь SYBR Грин я красителя использовался, который встраивается с двуцепочечной ДНК. Флуоресцентного сигнала следует во время реакции и его интенсивность относится к количество продукта формируется 39,40,,4142,43. Анализы ПЦР TiLV были проведены, как описано в протоколе 6 в разных лабораториях с использованием различных реагентов SYBR Грин, ПЦР машины и образцы из разных стран. В результате усиления кривых показано в рисунке 4A и 4B. Можно отметить, что для калибровочных, ход эксперимента имеет четыре фазы: этапа линейной земли, ранней экспоненциальной фазе, конце экспоненциальная фаза и фаза плато. Фаза линейного земли происходит во время ранних циклов где дублирования ДНК пока не могут быть определены из-за количества ДНК, производства недостаточно сигнал/фон соотношение. Базовые флуоресценции вычисляется во время этой фазы. После этого цель ДНК начинает двойной концентрации с каждым циклом, вызывая сигнал стать обнаруживаемая выше фона и возрастать по экспоненте. Усиления эффективности (E) хорошо оптимизированный ПЦР анализа очень высок (около 100%) в начале реакции и остается стабильной на этом этапе ранней экспоненциальной амплификация, и это является на данный момент выполнена количественная оценка, когда эффективность реакции до сих пор горит. В более поздних циклах сигнал начинает плато, и интенсивность флуоресценции больше не коррелируется с стартовый номер копии шаблона, потому что компоненты реакции в исчерпаны44. Насыщение может также возникать из-за конкуренции со стороны вновь отжига реакции, изменение соотношения концентрации компонентов, или количество единиц фермента ДНК молекул субстрата. Возможно такие параметры учитывать различия между амплификации кривых для анализов, показано на рисунке 4A и 4B. Включить элементы управления не создает эти характерные амплификации кривых.
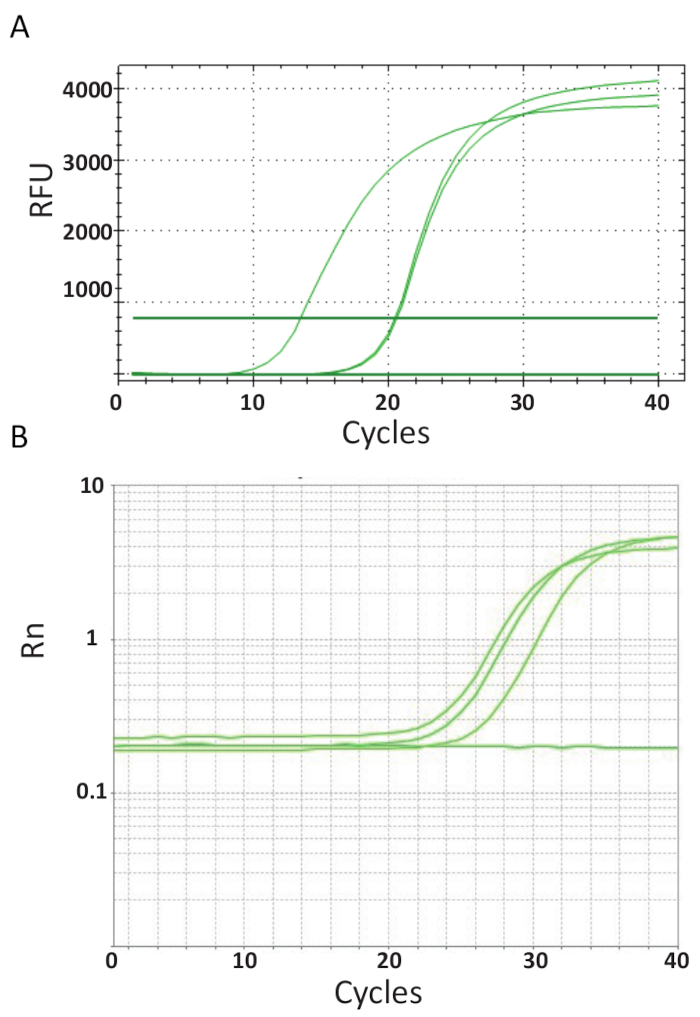
Рисунок 4 . Усиления участков Показать накопление продукта с длительностью в реальном времени анализа ПЦР. А. усиление кривые TiLV положительных образцов производных из Таиланда, ФНТ и положительных плазмид управления с помощью SYBR-зеленый 2-шаг ПЦР анализа. График был создан путем построения относительной флуоресцирования (РФС) vs. номер цикла. Б. амплификации кривые TiLV положительных образцов, полученных из Египта, как показано на рисунке 3B и NTC. Амплификация кривая является флуоресценции репортер сигнала, нормализуются к флуоресцирования пассивного ROX краситель, включены в Пробирной (Rn) против номер цикла. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
В конце thermocycling ПЦР на различных машинах в каждой лаборатории данные были приобретены и проанализированы. Рисунок 5А и 5B показать представителя плавления кривых из анализов, выполненных в каждой лаборатории. Каждая машина ПЦР был запрограммирован для анализа в конце плавки кривой. Это было достигнуто путем постепенного повышения температуры и мониторинга флуоресценции как функция температуры. Когда температура достаточно высока, чтобы денатурировать dsDNA, большая капля в флуоресцировании записывается потому что выпущен молекулы Флюорофор. Программное обеспечение каждого инструмента ПЦР рассчитывается отжига температура (Tm) от плавления кривой данных путем построения негативные первой производной против температуры (рис. 5). Можно увидеть, что в рисунке 5А и 5B , что продукция образуется в комплектов различных образцов имеют равномерное плавления перехода ожидаемой температуре около 80 ° C для assay. Были замечены другие пики, при более низких температурах. Из-за их малого размера Tm грунт-димеров обычно ниже, чем у целевого объекта последовательности ДНК. Таким образом эта разница между Tmделает его легким для определения потенциальных грунт димеры или других продуктов амплификации неспецифической. Элементы управления не создают расплава кривые, как TiLV положительных образцов и стандартов и может рассматриваться как почти горизонтальной линии в нижней части диаграммы в Рисунок 5А и 5B.
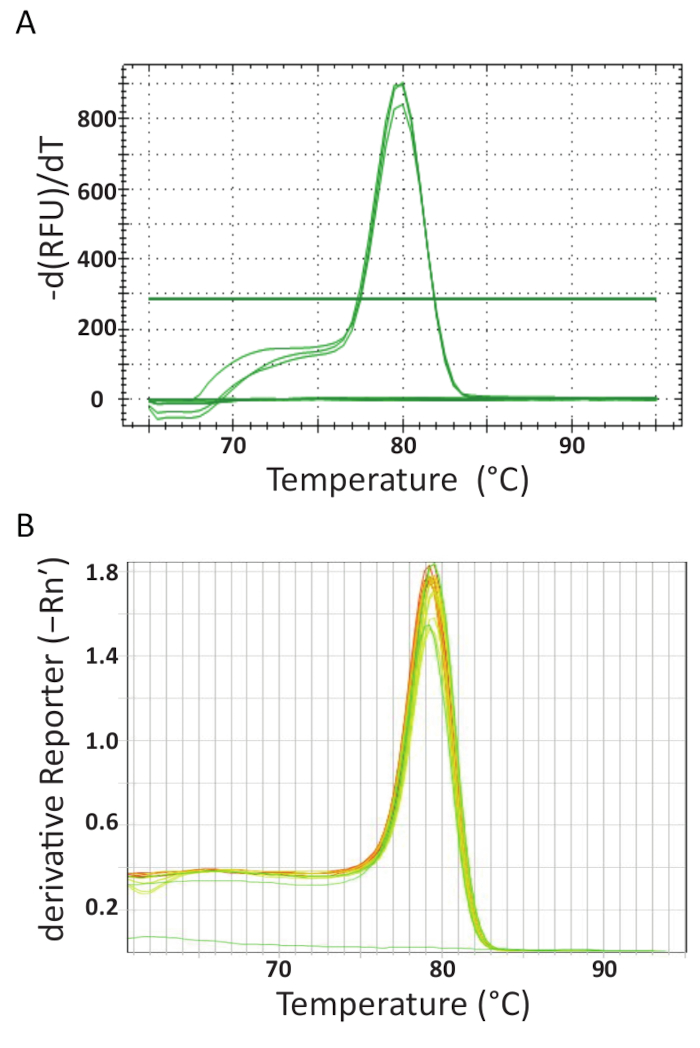
Рисунок 5 . Расплава анализа кривой для обеспечения анализа специфики и различных продуктов ПЦР могут быть продифференцированы их плавления черты. А. расплава анализа кривой TiLV положительных образцов из Таиланда, отрицательного контроля и управления положительных плазмид. Б. расплавить кривой анализ положительных образцов, полученных из Египта, pTiLV стандартов и NTC TiLV. Графики в A и B оба показывают изменения в флуоресцировании, деленное на изменения температуры заговор против температуры производить четкую картину динамики плавления. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Большинство ПЦР машины поставляются с программного обеспечения содействия дальнейшей оценки ПЦР запуска и будет количественно образцы, создавая калибровочной кривой, автоматически заговоре против логарифм pTiLV стандартов шаблон цикла порога (tC) скопируйте номер, как показано на рисунке 6A и 6B для двух независимых лабораторий. Вкратце Ct является единица, используемая для оценки результатов ПЦР. Значениеt C обозначает количество циклов, необходимых для достижения установленного порогового уровня сигнала флуоресценции. Чем больше количество начиная шаблон, тем меньше циклов он принимает для достижения уровне обнаружению флуоресценции. Действительно образцов с высокой нагрузкой TiLV будет иметь более низкие значенияt C чем образцы с низкой нагрузкой TiLV таких как в рыбе с субклинический инфекции. Чтобы определить значенияt C, фоновые уровни флюоресценции, сначала вычитаются из необработанных данных. Далее программное обеспечение, связанные с устройством ПЦР автоматически выберет флуоресценции порог путем поиска данных кривые для каждого образца и включения Ct , представляющий, где образца переступив порог. Это делается отдельно для каждого пробирного и необходимо тщательно анализировать каждый порог, обеспечивая, что порог был создан в части логарифмических кривых амплификации и в месте, где все кривые являются параллельными. Таким образом конкретные Ct приобрела является относительное значение и это относительно отправной шаблон копирования номер45, но это также специфически для ПЦР машины и реагенты используемые, эффективности амплификации PCR и чувствительность обнаружения. Эти параметры способствуют различия, используя же пробу на рисунке 6.
От стандартных кривых на рисунке 6, регрессионного анализа, включая расчет калибровочной кривой трассы (m) и перехватывает, усиление эффективности (100 x (101/m -1))46 и линейность реакции были исполнены. Калибровочной кривой анализа также использовались для подтверждения чувствительность (предел обнаружения), повторяемости и воспроизводимости assay. Теоретически, количество ДНК удваивается с каждый ПЦР цикла, означает, что эффективность (E) равен 100%. Однако на практике такой идеальной эффективности редко достигается благодаря югу оптимальные условия PCR например, ингибирования ДНК-полимеразы, загрязнений, слишком много cDNA и закупорить ошибки47. Как правило усиление E колеблется от 90-110% для хороших анализов, в рисунке 6A эффективность 94,5% была рассчитана с использованием 8 образцы серийно разбавленных pTiLV, то время как, анализа эффективности в assay показано на Рисунок 6B с использованием 7 серийно разбавленных pTiLV образцы составил 101,2%. КПД свыше 100% обычно объясняется присутствие ингибиторов ПЦР в assay. Линейный регрессионный анализ стандартных участка также позволяет для расчета числа TiLV копий в каждом образце41,42,45, как можно наблюдать для трех образцов TiLV показано красным в Рисунок 6B который соответствует результаты для образцов S1 и S3, S5, показано на рисунке 3B.
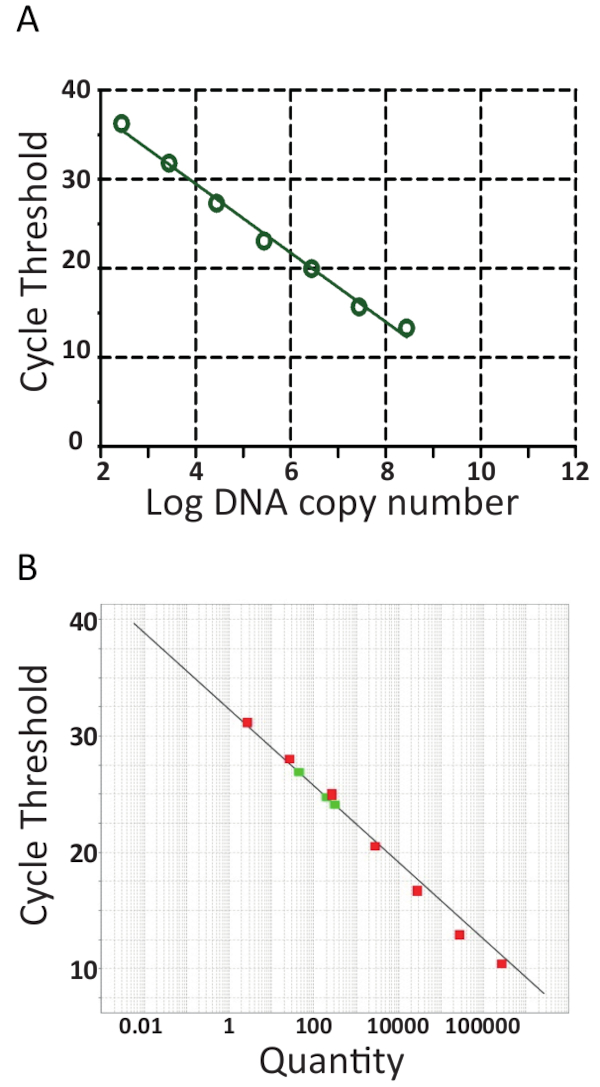
Рисунок 6 . RT-ПЦР стандартных кривых. Реальном масштабе времени PCR десятикратного серийных разведений pTiLV, стандарт, используемый в обеих лабораториях. A. 8 образцы серийно разбавленных pTiLV были протестированы, все известные концентрации и коррелирует с количество копий TiLV / реакции. Калибровочной кривой был создан путем построения журнала копии номер против цикла порога (tC). Наклон =-3.462, R2 = 0.9992 и эффективность составляет 94,47%. Б. как A, за исключением 7 серийно разбавленных pTiLV были протестированы образцы (зеленый) и диаграмма отображает цикл порогового значения по оси y и копировать количество TiLV (количество) на оси x. Y пересечение = 32.327, склон =-3.292, R2 = 0,98 и эффективность 101,2%. Для обоих стандартов кривых в A и B, наклон и y пересечение значения коэффициента корреляции (R2) используются для анализа производительности assay. Важно отметить, что значение R2 должна быть близка к 1, так как это мера линейность калибровочной кривой. Наклон используется для измерения эффективности ПЦР, которой соответствует 100% эффективность склоне -3.32, основной текст для уравнения и более подробную информацию см. Хороший ПЦР-реакции обычно имеет эффективность между 90-110%, сопоставляя на склоне между-3.58 и -3.10. Калибровочной кривой используется для абсолютной количественного определения неизвестных TiLV положительных образцов и определяет точное количество копий TiLV / реакция, как и в случае трех положительных образцов TiLV цветные красный в б.
Обсуждение
TiLV впервые сообщалось в 2014 году в Израиле14 и с тех пор, она была обнаружена в нескольких странах, включая Египет, Колумбия, Индия, Малайзия, Уганда, Танзания и Таиланд15,16,18, 35 , 48. глобальной осведомленности, в частности, в тилапии, производства стран уделяет больше внимания на вирус и различные ограничения и меры контроля со стороны государственных органов были выполнены пытается предотвратить распространение TiLV. Здесь было объяснено подробный протокол для обнаружения TiLV в тилапии ткани, охватывающих проб, РНК изоляции, cDNA синтеза, ПЦР и ПЦР-анализов. Существуют различные аспекты этих методов, которые требуют конкретного обсуждения. TiLV была обнаружена в рыбе, охватывающих различные размеры9,12,14,15,49 и виды тиляпии до настоящего времени, включая выращиваемых гибридные тилапии (O. niloticus x O. aureus)11,14, Нил тилапии (O. niloticus)9,10,14,,1516, 33 , 35 , 36 , 49 , 50 и красный тилапии (Oreochromis sp.)16,33,48,51, как хорошо как дикие Нила тилапии9,12, черный тилапии51, zilli т.14,15, S. galilaeus, O. стафилококка и т. Симонис Интермедиа14 и совсем недавно TiLV была выявлена в сазана (Barbonymus schwanenfeldii)52. Образцы ткани из внутренних органов (Гилл, селезенка, печень, сердце, голову почек) или слизь37 можно собранные как здоровых, так и умирающий тилапии независимо от возраста, размера или вида и обрабатываются для изоляции РНК. Общая РНК добыча протокол изложенные здесь использует монофазные раствор фенола и Гуанидиновые тиоцианат, который является агентом денатурируя chaotropic. Ткани непосредственно гомогенизации в этом решении, с последующим добавлением хлороформе и центрифугирования для достижения разделения этап которой генерируется ясно РНК, содержащие верхние водной фазе, интерфаза и Нижняя органические фазы. РНК изолирован от водной фазе высыпанием изопропиловый спирт, после мытья восстановленные РНК избавиться от загрязнений. Изоляция РНК по этой методологии было pioneered Петр Chomczynski и Николетта Sacchi и был передан как Гуанидиновые тиоцианат фенол хлороформ извлечения53,54. Этот тип реагент, который используется для извлечения РНК может быть коммерчески приобрели или в лаборатории (см. Таблицу материалов для получения дополнительной информации). Этот протокол занимает немного больше времени, чем методы, основанные на столбце, например очистки на основе силики, но в целом, он является более экономически эффективным и дает более РНК.
В этом протоколе, количественного определения РНК с помощью значения A260 шла whereby спектрофотометрии значения могут указывать на качество РНК (A260/A280 = 1,9-2.1). Хотя этот метод даст хорошее представление о образец чистоты, он не может абсолютно сообщить о качестве извлеченного РНК. Правильно определить, является ли РНК нетронутыми или частично деградировавших, образцы могут быть разделение электрофорезом геля агарозы которой размытие бромистый этидий окрашенных 18S и 28S рРНК полосы указывают РНК деградации. Дальнейшей проверки качества РНК могут включать в себя с помощью инструмента лаборатории на чипе. Кроме того, это также важно усвоить очищенный РНК с DNase I для удаления загрязнения принимающей геномной ДНК, который в зависимости от нисходящие приложения может привести к ложным результатам. Если хост геномная ДНК еще загрязнять образца РНК в значительной степени, дополнительное лечение DNaseI может также выполняться в конце процедуры извлечения РНК (см. Таблицу материалы).
Дополнительные синтеза ДНК может сильно повлиять на общие результаты ПЦР и является аспектом метода, который могут внести изменения. Протокол cDNA, выступает здесь состоит из одного компонента установки с помощью oligo (dT) и таким образом только транскрибирует мРНК, содержащие поля хвосты. Это позволяет точно какие компоненты для использования в реакции обратной транскрипции и этот режим cDNA синтез оказался успешным для обнаружения TiLV32пользовательский элемент управления. Альтернативой этой настройки является коммерчески купил Мастер микс содержащие все компоненты, необходимые для обратной транскрипции реакции и очень быстро и просто без обычных многоступенчатый, дозирования и температурными протокол. Это выгодно, потому что он сводит к минимуму обработку и способствует единообразия во всех образцах. Такие мастер смеси часто включают в себя как oligo(dT), так и случайных праймеров, что делает его применимым к различным РНК шаблоны и создания представительного cDNA копии последовательностей из всей длине РНК в популяции (вирусных и тилапии принимающей мРНК) и в теории, Затем каждый желаемый вид РНК может быть измерен обычных ПЦР или ПЦР из такого образца. Эта универсальность является главным преимуществом 2-шаг ПЦР подхода; Она обеспечивает долгосрочный бассейн, который может использоваться для многих различных экспериментов. В результаты, был представлен подход RT-PCR одношаговый которой последовательности конкретных грунтовки (Таблица 1) были использованы и RT и PCR были выполнены в одной трубе (см. список материалов). В общем последовательность конкретных грунтовки позволяют для более высокой эффективности RT конкретные цели РНК, чем использование случайных грунтовки, но конкретных целевых РНК является единственной, которая может быть определена количественно в такой образец cDNA, которая может быть единственной целью некоторых лабораторий (см. Таблица материалов для синтеза cDNA продукта предложения).
В то время как обычные RT-PCR, как представляется, широко используется так далеко в TiLV диагноз9,13,14,,1516,17,18, 33 , 35 , 48 , 55. RT-ПЦР было показано, чтобы быть более мощным инструментом для выявления и количественной оценки небольших количеств TiLV в тканях рыбы или слизь32,37. В общем ПЦР широко используется в клинической вирусологии диагностических лабораторий из-за его высокую чувствительность, специфичность, хорошая воспроизводимость, широкий динамический диапазон и скорость21. Хотя ПЦР могут быть изначально дороже, реализовать, чем обычные RT-PCR, он предлагает много важных преимуществ над обычными ПЦР; Он имеет быстрый оборот вокруг времени из образца результатов и не требует каких-либо шагов пост ПЦР. Этот последний момент означает, что существует минимальный риск для лабораторных загрязнения, и она может быть легко адаптирована к высок объём ситуаций таких, как в случае вспышки. Кроме того это по сути более чувствителен, чем обычные RT-PCR, который имеет жизненно важное значение для выявления низкой вирусной нагрузкой в субклинический инфекции21. Это потребует вложенных ПЦР подход, требующий обратной транскрипции, два дальнейших реакциях PCR и затем анализ агарозы электрофорез геля. Эти многие шаги занять много времени и увеличить шансы на ошибки или загрязнения. Тем не менее из-за его высокой чувствительности, RT-ПЦР требует тщательной экспериментальной разработки и глубокого понимания методов количественной оценки для генерации точных результатов56,57.
Привязки Флюорофор ДНК, SYBR Грин я продемонстрировал в этом протоколе. Это dsDNA неспецифических ДНК связывание красителя, и таким образом специфика assay полностью лежит в наборе грунты, которые может создавать ложных срабатываний58. Таким образом, в то время как dsDNA плавления выполняется в конце каждого ПЦР анализа кривой является особенно важной частью реакции PCR, потому, что он подтверждает, что только один Ампликон ПЦР правильную тм производится (это должно также достигаться путем гель электрофорез, когда реализуются новые анализы). Tm фрагмента ДНК зависит целый ряд функций, таких как его длина, GC композиция, последовательности, взаимодополняемости прядь, а также концентрация буфера компонентов и ПЦР усилители. Плавления анализ кривой в представитель результаты от двух лабораторий не выявили присутствия Димеры праймера или других нежелательных продуктов ПЦР, но если это наблюдается с другими образцами и/или экспериментальных установок, то проба должна быть повторно оптимизирован. Более продвинутые технологии ПЦР не требуют такого шага плавления кривой и действительно, поскольку этот документ был написан, методы TaqMan на основе TiLV RT-ПЦР была разработана использования двух праймеров и зонда, что делает его весьма конкретных TiLV34.
Несомненно грунты, предназначенные для RT-ПЦР-анализов имеют основополагающее значение для успеха пробирного и грунты здесь были разработаны основанные на общедоступных геномных данных TiLV на время32. Однако РНК-вирусов хорошо известны высокой мутации темпы и возможных штаммов будет избежать текущих диагностические тесты, как было отмечено для ISAV59. Он всегда будет трудно для таких типов вируса для создания универсальной Пан TiLV RT-ПЦР анализа и такие анализы будут только постоянно совершенствоваться если больше TiLV геномных данных из далеко идущих мест и периодов времени.
Наконец крайне важно для выполнения повторяющихся или если возможно, тройные реакции в обоих intra и Интер анализы ПЦР. Если значенияt C очень высоки, то использование реплицирует это особенно важно, чтобы удостовериться, что реакция PCR надежных и воспроизводимых. В общем если реплицировать данные от реакции зависит от более чем 0,5 циклов, реакции следует повторить и если Ct последовательно значения > 0,5 циклов в реплицирует, assay должны быть оптимизированы, повторно. Использование интегрированных ПЦР дозирования робота помогает больш с этим вопросом, но это роскошь инструмент. Как с любой эксперимент, включение адекватные и соответствующие элементы управления имеют первостепенное значение для развития надежных молекулярные анализы, особенно в диагностических лабораториях, где такие анализы должны быть аккредитованы. Элементы управления должны включать позитивные (положительное TiLV образца, плазмида TiLV стандарт) и негативный контроль (NTC и -RT) образцы, а также обнаружения эндогенного тилапии уборки генов. Такие элементы управления нельзя недооценивать и должны быть включены в калибровочных правильно понять качество каждого шага анализа и правильно интерпретировать результаты.
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Мы благодарны института ветеринарной бактериология, Vetsuisse факультет, Университет Берн за их поддержку. Эта работа финансировалась Комитета для поощрения из ранней карьеры ученых и гендерного равенства на Vetsuisse факультете, Университет Берн 120% модель финансирования присуждена PN. WS и PR поддерживаются центр перспективных исследований для сельского хозяйства и продовольствия, Институт продвинутых исследований, Университет Касетсарт, Бангкок, Таиланд под высшего образования поощрения исследований и национальных исследований университета проект Таиланда, офис Высшее образование Комиссии, министерства образования, Таиланд. Мы хотели бы поблагодарить д-ра Kwanrawee Sirikanchana для своего повествования и Piyawatchara Sikarin для редактирования видео.
Материалы
| Name | Company | Catalog Number | Comments |
| Tissue collection | Step 1 | ||
| Tricaine methanesulfonate | Sigma-Aldrich | E10521 | An alternative to clove oil. Step 1.1 |
| RNAlater stabilization solution | Thermo Fisher Scientific | AM7020 | For storing tissues if they cannot be processed immediately Step 1.3 |
| RNA extraction | Step 2 | ||
| TRIreagent | Sigma-Aldrich | Step 2.1 | |
| TRIzol | Thermo Fisher Scientific (Invitrogen) | 15596026 | Step 2.1 |
| GENEzol | Geneaid | GZR100 | Step 2.1 |
| Trisure | Bioline | BIO-38032 | Step 2.1 |
| Homemade solution | - | - | 94.53 g/L (800 mM) guanidine thiocyanate 30.45 g/L (400 mM) ammonium thiocyanate 8.20 g/L (100 mM) sodium acetate 380 mL/L (38 % v/v) phenol 50 mL/L (5 % v/v) glycerol 1.0 g/L (0.1 % w/v) 8-quinolinol, pH 5.0 Store up to 2 years at 4oC Step 2.1 |
| MagNA Lyser Green Beads | Roche | 3358941001 | An alternative tissue homogenization method used in conjunction with tissue lysing machines detailed below Step 2.2 |
| Lysing Matrix D, 2 mL Tube | MP BIOMEDICALS | 116913050 | |
| Chloroform | Sigma-Aldrich | C2432 | Step 2.3 |
| Chloroform | RCI Labscan | AR1027E-G2.5L | Step 2.3 |
| 1-Bromo-3-chloropropane | Sigma-Aldrich | B9673 | A less toxic alternative to chloroform Step 2.3 |
| Isopropanol (GC) ≥ 99.8 % | Sigma-Aldrich | 59300 | Step 2.6 |
| Isopropanol (ACS, ISO Reag. Ph Eur) | Merck KGaA (EMSURE) | 1.09634.2500 | Step 2.6 |
| Glycogen, molecular biology grade (e.g., Sigma, cat. no. G1767) | Thermo Fisher Scientific (Thermo Scientific) | R0551 | Useful step if tissue starting material is small to maximise RNA precipitation optional |
| Ethanol (purity (GC) ≥ 99.9 % | Sigma-Aldrich (EMD Millipore) | 1.00983 | Step 2.9 |
| Ethanol (ACS, ISO Reag. Ph Eur) | Merck (EMSURE) | 1.00983.2500 | Step 2.9 |
| Nuclease-free water | Promega | P1193 | Step 2.13 |
| Nuclease-free water | Multicell | 809-115-CL | Step 2.13 |
| Ambion TURBO DNA-free kit | Thermo Fisher Scientific (Invitrogen) | AM1907 | Can be performed at the end of the RNA extraction protocol optional |
| cDNA synthesis | Step 4 | ||
| Viva cDNA Synthesis Kit | Vivantis | cDSK01 | Step 4.1 & 4.3 |
| ReverTra Ace qPCR RT MasterMix with gDNA remover | Toyobo | A1172K | An alternative option see discussion |
| ReverTra Ace qPCR RT Kit | Toyobo | FSQ-101 | An alternative option see discussion |
| AffinityScript Multiple Temperature Reverse Transcriptase | Agilent Technologies | 600107 | An alternative option |
| PCR | Step 5 | ||
| DNA polymerase systems: | Step 5.2 | ||
| - Platinum II Hot-Start Green PCR Master Mix (2X) | Thermo Fisher Scientific (Invitrogen) | 14001012a | Step 5.2 |
| - GoTaq Mastermix | Promega | M7122 | Step 5.2 |
| Separate PCR mixture components: | Step 5.2 | ||
| 10mM dNTP Mix | Vivantis | NP2409 | Step 5.2 |
| 25mM MgCl2 | Thermo Fisher Scientific | R0971 | Step 5.2 |
| 10X Taq Buffer with KCl | Thermo Fisher Scientific | 00348114 | Step 5.2 |
| Taq DNA polymerase | Vivantis | PL1202 | Step 5.2 |
| - Verso 1-step RT-PCR ReddyMix with ThermoPrime Taq | Thermo Fisher Scientific | AB1454 | One step RT-PCR exemplified in Figure 3B |
| Gel electrophoresis: | For visulation of PCR products from steps 5.1-5.4 | ||
| Ethidium Bromide solution (10 mg/mL) | Thermo Fisher Scientific | 17898 | Step 5.5 |
| Tris/Acetic/EDTA (TAE) buffer: | Step 5.5 | ||
| - Tris | Vivantis | PR0612-1KG | Step 5.5 |
| - Acetic acid (glacial) (ACS, ISO, Reag. Ph Eur) | Merck KGaA (EMSURE) | 1.00063.2500 | Step 5.5 |
| - Ethylenediaminetetraacetic acid (EDTA) | BIO-RAD | 161-0729 | Step 5.5 |
| Agarose | Vivantis | PC0701-100G | Step 5.5 |
| DNA ladders and markers | Vivantis | NL1405 | Step 5.5 |
| DNA gel loading dye (6X) | Thermo Fisher Scientific | R0611 | Step 5.5 |
| qPCR | Step 6 | ||
| PowerUP SYBR Green Master Mix | Thermo Fisher Scientific (Applied Biosystems) | A25779 | Exemplified in Figures 4-6B Step 6.2 |
| iTaq Universal SYBR Green Supermix | BIO-RAD | 1725120 | Exemplified in the video and in Figures 4-6A Step 6.2 |
| Equipment | |||
| Dounce tissue grinder pestle | Sigma-Aldrich | P1110 | Protocol 2 |
| MagNA Lyser Instrument | Roche | 3358976001 | An alternative tissue homogenizing option for protocol 2 which are used in conjunction with the lysing beads detailed above Step 2.2 |
| FastPrep-24 5G Homogenizer | MP BIOMEDICALS | 116005500 | |
| Refrigerated microcentrifuge | Eppendorf | Eppendorf 5427R | Protocol 2 Step 2.4, 2.7 & 2.10 |
| Refrigerated microcentrifuge | Eppendorf | Eppendorf 5418R | |
| Heat box | Labnet | AccuBlock Digital Dry Bath | Protocol 2 Step 2.13 |
| Microvolume spectrophotometer | Thermo Fisher Scientific (Applied Biosystems) | Nanodrop 2000 | Protocol 3 Step 3.1 - 3.4 |
| PCR machine | BIO-RAD | T100 Thermal Cycler | Protocol 5 Step 5.4 |
| Power supply | BIO-RAD | PowerPac HC | Protocol 5 Step 5.5 |
| Horizontal gel electrophoresis | BIO-RAD | Mini ReadySub-Cell GT Cell #1704487edu | Protocol 5 Step 5.5 |
| Mini microcentrifuge | Corning | LSE 6766 | Useful to quickly spin down PCR reaction tubes in protocols 4, 5 & 6 Step 6.5.1 |
| Microcentrifuge | LioFuge | LM-60 | Step 6.5.1 |
| qPCR machine and software | Thermo Fisher Scientific | 7500 Fast Real-Time PCR System with 7500 Software v2.0 | Protocol 6 Step 6.6-6.8 |
| qPCR machine and software | BIO-RAD | CFX96 Touch Real-Time PCR Detection System with CFX Manager software | |
| General Materials | |||
| Mayo scissors | Step 1.1-1.2 | ||
| Forceps | Step 1.1-1.2 | ||
| Pipette | Rainin | Pipette-Lite XLS | |
| Aerosol-barrier pipette tips | Sigma-Aldrich | Z333328, Z333336, Z333344 | |
| Nuclease-free 1.5-ml microcentrifuge tubes | Eppendorf |
Ссылки
- FAO. . The State of World Fisheries and Aquaculture, 2014. Opportunities and Challenges. , (2014).
- FAO. . The State of World Fisheries and Aquaculture, 2016. Contributing to Food Security and Nutrition for all. , (2016).
- WorldBank. . FISH TO 2030: Prospects for Fisheries and Aquaculture. Agriculture and Environmental Services Discussion Paper 03. , (2013).
- Wing-Keong, N., Nicholas, R. A review of the nutrition and feeding management of farmed tilapia throughout the culture cycle. Reviews in Aquaculture. 5 (4), 220-254 (2013).
- Cleasby, N., et al. The socio-economic context for improving food security through land based aquaculture in Solomon Islands: A peri-urban case study. Marine Policy. 45, 89-97 (2014).
- Ponzoni Raul, W., et al. Genetic improvement of Nile tilapia (Oreochromis niloticus) with special reference to the work conducted by the WorldFish Center with the GIFT strain. Reviews in Aquaculture. 3 (1), 27-41 (2011).
- Hounmanou, Y. M. G., et al. Tilapia lake virus threatens tilapiines farming and food security: Socio-economic challenges and preventive measures in Sub-Saharan Africa. Aquaculture (Amsterdam, Netherlands). 493, 123-129 (2018).
- OIE. . Tilapia Lake Virus (TiLV) - a novel orthomyxo-like virus. OIE technical disease cards. , (2018).
- Mugimba, K. K., et al. Detection of tilapia lake virus (TiLV) infection by PCR in farmed and wild Nile tilapia (Oreochromis niloticus) from Lake Victoria. Journal of Fish Diseases. , (2018).
- Koesharyani, I., Gardenia, L., Widowati, Z., Khumaira, D. D., Rustianti, Studi kasus infeksi tilapia lake virus (tilv) pada ikan nila (Oreochromis niloticus). Jurnal Riset Akuakultur. 13 (1), 85-92 (2018).
- OIE. . Tilapia lake virus disease (TiLV), Chinese Taipei. Immediate Notification. , (2017).
- OIE. . Tilapia Lake Virus Disease (TiLV), Peru. Immediate Notification. , (2018).
- Bacharach, E., et al. Characterization of a Novel Orthomyxo-like Virus Causing Mass Die-Offs of Tilapia. MBio. 7 (2), e00431-e00416 (2016).
- Eyngor, M., et al. Identification of a novel RNA virus lethal to tilapia. Journal of Clinical Microbiology. 52 (12), 4137-4146 (2014).
- Nicholson, P., et al. Detection of Tilapia Lake Virus in Egyptian fish farms experiencing high mortalities in 2015. Journal of Fish Diseases. 40 (12), 1925-1928 (2017).
- Surachetpong, W., et al. Outbreaks of Tilapia Lake Virus Infection, Thailand, 2015-2016. Emerging Infectious Diseases. 23 (6), 1031-1033 (2017).
- Tattiyapong, P., Dachavichitlead, W., Surachetpong, W. Experimental infection of Tilapia Lake Virus (TiLV) in Nile tilapia (Oreochromis niloticus) and red tilapia (Oreochromis spp.). Veterinary Microbiology. 207, 170-177 (2017).
- Kembou Tsofack, J. E., et al. Detection of Tilapia Lake Virus in Clinical Samples by Culturing and Nested Reverse Transcription-PCR. Journal of Clinical Microbiology. 55 (3), 759-767 (2017).
- Thangaraj, R. S., et al. Derivation of two tilapia (Oreochromis niloticus) cell lines for efficient propagation of Tilapia Lake Virus (TiLV). Aquaculture (Amsterdam, Netherlands). 492, 206-214 (2018).
- Hanson, L. A., Rudis, M. R., Vasquez-Lee, M., Montgomery, R. D. A broadly applicable method to characterize large DNA viruses and adenoviruses based on the DNA polymerase gene. Virology Journal. 3, 28-28 (2006).
- Josko, D. Molecular virology in the clinical laboratory. Clinical Laboratory Science. 23 (4), 231-236 (2010).
- Munir, K., Kibenge, F. S. Detection of infectious salmon anaemia virus by real-time RT-PCR. Journal of Virological Methods. 117 (1), 37-47 (2004).
- Snow, M., et al. Developement, application and validation of a Taqman real-time RT-PCR assay for the detection of infectious salmon anaemia virus (ISAV) in Atlantic salmon (Salmo salar). Developments in Biologicals. 126, 133-145 (2006).
- Matejusova, I., McKay, P., McBeath, A. J., Collet, B., Snow, M. Development of a sensitive and controlled real-time RT-PCR assay for viral haemorrhagic septicaemia virus (VHSV) in marine salmonid aquaculture. Diseases of Aquatic Organisms. 80 (2), 137-144 (2008).
- Garver, K. A., et al. Development and validation of a reverse transcription quantitative PCR for universal detection of viral hemorrhagic septicemia virus. Diseases of Aquatic Organisms. 95 (2), 97-112 (2011).
- Dalla Valle, L., et al. Development of a sensitive and quantitative diagnostic assay for fish nervous necrosis virus based on two-target real-time PCR. Veterinary Microbiology. 110 (3-4), 167-179 (2005).
- Hodneland, K., Garcia, R., Balbuena, J. A., Zarza, C., Fouz, B. Real-time RT-PCR detection of betanodavirus in naturally and experimentally infected fish from Spain. Journal of Fish Diseases. 34 (3), 189-202 (2011).
- Hodneland, K., Endresen, C. Sensitive and specific detection of Salmonid alphavirus using real-time PCR (TaqMan). Journal of Virological Methods. 131 (2), 184-192 (2006).
- Wang, X. W., Ao, J. Q., Li, Q. G., Chen, X. H. Quantitative detection of a marine fish iridovirus isolated from large yellow croaker, Pseudosciaena crocea, using a molecular beacon. Journal of Virological Methods. 133 (1), 76-81 (2006).
- van Beurden, S. J., et al. Development and validation of a real-time PCR assay for the detection of anguillid herpesvirus 1. Journal of Fish Diseases. 39 (1), 95-104 (2016).
- Ciulli, S., et al. Development and application of a real-time PCR assay for the detection and quantitation of lymphocystis disease virus. Journal of Virological Methods. 213, 164-173 (2015).
- Tattiyapong, P., Sirikanchana, K., Surachetpong, W. Development and validation of a reverse transcription quantitative polymerase chain reaction for tilapia lake virus detection in clinical samples and experimentally challenged fish. Journal of Fish Diseases. 41 (2), 255-261 (2018).
- Dong, H. T., et al. Emergence of tilapia lake virus in Thailand and an alternative semi-nested RT-PCR for detection. Aquaculture (Amsterdam, Netherlands). 476, 111-118 (2017).
- Waiyamitra, P., et al. A TaqMan RT-qPCR assay for tilapia lake virus (TiLV) detection in tilapia. Aquaculture (Amsterdam, Netherlands). 497, 184-188 (2018).
- Behera, B. K., et al. Emergence of Tilapia Lake Virus associated with mortalities of farmed Nile Tilapia Oreochromis niloticus (Linnaeus 1758) in India. Aquaculture (Amsterdam, Netherlands). 484, 168-174 (2018).
- Ferguson, H. W., et al. Syncytial hepatitis of farmed tilapia, Oreochromis niloticus (L.): a case report. Journal of Fish Diseases. 37 (6), 583-589 (2014).
- Liamnimitr, P., Thammatorn, W., U-thoomporn, S., Tattiyapong, P., Surachetpong, W. Non-lethal sampling for Tilapia Lake Virus detection by RT-qPCR and cell culture. Aquaculture (Amsterdam, Netherlands). 486, 75-80 (2018).
- Yang, C. G., et al. Evaluation of reference genes for quantitative real-time RT-PCR analysis of gene expression in Nile tilapia (Oreochromis niloticus). Gene. 527 (1), 183-192 (2013).
- Bustin, S. A. Real-time, fluorescence-based quantitative PCR: a snapshot of current procedures and preferences. Expert Review of Molecular Diagnostics. 5 (4), 493-498 (2005).
- Fleige, S., Pfaffl, M. W. RNA integrity and the effect on the real-time qRT-PCR performance. Molecular Aspects of Medicine. 27 (2-3), 126-139 (2006).
- Kubista, M., et al. The real-time polymerase chain reaction. Molecular Aspects of Medicine. 27 (2-3), 95-125 (2006).
- Mackay, I. M., Arden, K. E., Nitsche, A. Real-time PCR in virology. Nucleic Acids Research. 30 (6), 1292-1305 (2002).
- Wong, M. L., Medrano, J. F. Real-time PCR for mRNA quantitation. Biotechniques. 39 (1), 75-85 (2005).
- Bustin, S. A. Absolute quantification of mRNA using real-time reverse transcription polymerase chain reaction assays. Journal of Molecular Endocrinology. 25 (2), 169-193 (2000).
- Heid, C. A., Stevens, J., Livak, K. J., Williams, P. M. Real time quantitative PCR. Genome Research. 6 (10), 986-994 (1996).
- Rutledge, R. G., Côté, C. Mathematics of quantitative kinetic PCR and the application of standard curves. Nucleic Acids Research. 31 (16), e93-e93 (2003).
- Svec, D., Tichopad, A., Novosadova, V., Pfaffl, M. W., Kubista, M. How good is a PCR efficiency estimate: Recommendations for precise and robust qPCR efficiency assessments. Biomolecular Detection and Quantification. 3, 9-16 (2015).
- Amal, M. N. A., et al. A case of natural co-infection of Tilapia Lake Virus and Aeromonas veronii in a Malaysian red hybrid tilapia (Oreochromis niloticus × O. mossambicus) farm experiencing high mortality. Aquaculture (Amsterdam, Netherlands). 485, 12-16 (2018).
- Fathi, M., et al. Identification of Tilapia Lake Virus in Egypt in Nile tilapia affected by ‘summer mortality’ syndrome. Aquaculture (Amsterdam, Netherlands). 473, 430-432 (2017).
- OIE. . Tilapia Lake Virus disease (TiLV), Philippines. Immediate Notification. , (2017).
- OIE. . Tilapia lake virus disease (TiLV), Malaysia. Immediate Notification. , (2017).
- Abdullah, A., et al. First detection of tilapia lake virus (TiLV) in wild river carp (Barbonymus schwanenfeldii) at Timah Tasoh Lake, Malaysia. Journal of Fish Diseases. 41 (9), 1459-1462 (2018).
- Chomczynski, P., Sacchi, N. Single-step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction. Analytical Biochemistry. 162 (1), 156-159 (1987).
- Chomczynski, P., Sacchi, N. The single-step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction: twenty-something years on. Nature Protocols. 1 (2), 581-585 (2006).
- Del-Pozo, J., et al. Syncytial Hepatitis of Tilapia ( Oreochromis niloticus L.) is Associated With Orthomyxovirus-Like Virions in Hepatocytes. Veterinary Pathology. 54 (1), 164-170 (2017).
- Bustin, S. A., et al. The MIQE guidelines: minimum information for publication of quantitative real-time PCR experiments. Clinical Chemistry. 55 (4), 611-622 (2009).
- Purcell, M. K., Getchell, R. G., McClure, C. A., Garver, K. A. Quantitative polymerase chain reaction (PCR) for detection of aquatic animal pathogens in a diagnostic laboratory setting. Journal of Aquatic Animal Health. 23 (3), 148-161 (2011).
- Simpson, D. A., Feeney, S., Boyle, C., Stitt, A. W. Retinal VEGF mRNA measured by SYBR green I fluorescence: A versatile approach to quantitative PCR. Molecular Vision. 6, 178-183 (2000).
- Kibenge, M. J., et al. Discovery of variant infectious salmon anaemia virus (ISAV) of European genotype in British Columbia, Canada. Virology Journal. 13, 3 (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены