A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
وضع بروتوكول رهيزوبوكس الأمثل لتصور النمو الجذري والقدرة على الاستجابة للعناصر المغذية مترجمة
In This Article
Summary
تصور وقياس الجذر النمو في الموقع صعبة للغاية. نحن نقدم طريقة رهيزوبوكس لتخصيص لتتبع جذور التنمية وانتشارها على مر الزمن استجابة للمغذيات. يتم استخدام هذا الأسلوب لتحليل الاختلافات قد الذرة في جذر اللدونة ردا على مصدر نيتروجين العضوي.
Abstract
الجذور، يصعب دراسة. التربة حاجز البصرية والميكانيكية، مما يجعل من الصعب تتبع جذور في الموقع دون حصاد المدمرة أو معدات باهظة الثمن. نقدم أسلوب رهيزوبوكس بأسعار معقولة وقابلة للتخصيص الذي يسمح التصور غير المدمرة لنمو الجذر على مر الزمن، وخاصة مناسبة تماما لدراسة اللدونة الجذر ردا على بقع الموارد المترجمة. تم التحقق من صحة الأسلوب بتقييم التباين أوضح الذرة في الردود اللدونة للبقع التي تحتوي على بقايا البقوليات المسمى ن 15. أساليب موصوفة للحصول على القياسات التنموية الممثل مع مرور الوقت وقياس كثافة طول الجذر في البقع التي تحتوي على الموارد والتحكم وحساب معدلات النمو الجذري وتحديد 15ن الانتعاش بجذور النباتات ويطلق النار. وتناقش أيضا المزايا والمحاذير والتطبيقات المستقبلية المحتملة للأسلوب. على الرغم من أن يجب الحرص على التأكد من أن الظروف التجريبية لا تحيز البيانات النمو الجذري، غلة البروتوكول رهيزوبوكس المقدمة هنا نتائج موثوقة إذا ما نفذت بالاهتمام الكافي بالتفاصيل.
Introduction
على الرغم من أن كثيرا ما يغفل عنها مقارنة بنظرائهم سطحي، الجذور تلعب دوراً حاسما في اكتساب المغذيات النباتية. نظراً لتكلفة الكربون كبيرة جذر البناء والصيانة، تطورت النباتات آليات لتطوير الجذور فقط حيث تستخدم علفاً يستحق الاستثمار. نظم جذور يمكن وبذلك كفاءة وحيوي الألغام بقع الموارد التي تنتشر في المناطق الساخنة، upregulating معدلات الإقبال والمغذيات ترانسلوكاتينج سريعاً إلى لحاء لمواصلة النقل1. يمكن أن تختلف الاستجابات اللدونة على نطاق واسع بين النباتات من الأنواع أو الأنماط الجينية2،3 ، وتبعاً لشكل المواد الكيميائية المعنية المغذيات4،5. التباين في جذر اللدونة وينبغي استكشاف المزيد، فهم استجابات الجذرية المعقدة لموارد التربة غير المتجانسة يمكن إبلاغ استراتيجيات إدارة لزيادة كفاءة استخدام المغذيات في الزراعة وتربية.
وبالرغم من ضرورة وأهمية لفهم النظم النباتية تصور وتحديد مقدار اللدونة الجذر في الجداول ذات الصلة تحديات التقنية. حفر التاج الجذر من التربة (6من "شوفيلوميكس") أسلوب شائع، لكن استغلال جذور غرامة المسام الصغيرة بين المجاميع التربة، وحفر يؤدي لا محالة إلى درجة ما من فقدان هذه الجذور الهشة. وعلاوة على ذلك، الحصاد المدمرة يجعل من المستحيل على تتبع التغييرات في نظام جذر واحد على مر الزمن. في الموقع من أساليب التصوير مثل التصوير المقطعي بالأشعة السينية المحسوبة السماح التصور مباشرة من الجذور وموارد التربة في عالية الدقة المكانية7، لكن غالية الثمن ويتطلب معدات متخصصة. تجارب تربة تجنب القيود المرتبطة باستخراج الجذور من التربة، ولكن تختلف مورفولوجيا الجذر والهندسة المعمارية في الوسط المائي مقارنة بالقيود الميكانيكية وتعقيد الفيزيائية للتربة8،9. أخيرا، لا يمكن دمجها rhizosphere العمليات والوظائف مع اللدونة التنموية في هذه الوسائط المصطنعة.
نقدم بروتوكول لبناء واستخدام رهيزوبوكسيس (حاويات مستطيلة ضيقة، وواضحة من جانب) كوسيلة منخفضة التكلفة وقابلة للتخصيص لوصف النمو الجذري في التربة مع مرور الوقت. إطارات مصممة خصيصا تشجيع الجذور تنمو بشكل تفضيلي ضد الفريق مرة أخرى بسبب جرافيتروبيسم، زيادة دقة قياسات طول الجذر. رهيزوبوكسيس تستخدم عادة لدراسة النمو الجذري و rhizosphere التفاعلات10،،من1112، ولكن الأسلوب الذي قدم هنا يوفر ميزة في البساطة مع تصميم حجرة واحدة وغير مكلفة المواد، وهو مصمم لدراسة الردود الجذر على المغذيات المترجمة. ومع ذلك، الأسلوب يمكن أيضا تكييف لدراسة مجموعة من عمليات الجذر ورهيزوسفيري أخرى مثل المنافسة داخل/إينتيرسبيسيس، والتوزيع المكاني للمركبات الكيميائية أو الميكروبات، أو نشاط إنزيم. هنا، نحن التحقيق أوضح الاختلافات بين هجن الذرة ردا على بقع من 15البقول المسمى ن بقايا وتسليط الضوء على الممثل النتائج للتحقق من صحة الأسلوب رهيزوبوكس.
Protocol
1-إعداد الجبهة ولوحات الخلفي، والفواصل
- إعداد اللوحات الأمامية والخلفية.
- قص قطعتين من اﻷكريليك واضحة 0.635 سم سميكة إلى 40.5 سم × 61 سم طويلة كل مربع أو شراء القطع قبل قطع (انظر الجدول للمواد).
- استخدام مثقاب مصممة للإكريليك، حفر ثقوب 0.635 سم 1.3 سم من الحواف الجانبية في 2.5، 19 و 38 و 53.3 سم من الأعلى. حفر ثقوب 1.3 سم من الحافة السفلية في 2.5 و 20.3 سم 38 من الجهة اليسرى (الشكل 1).
ملاحظة: والأكثر كفاءة لاستخدام صحفي الحفر لكومة من أوراق ستة إلى عشرة في وقت واحد، ولكن يمكن أيضا أن تستخدم ثاقب. - إزالة أي أغطية واقية من اﻷكريليك وتنظيف كلا الفريقين بلطف قبل تجميع المربعات.
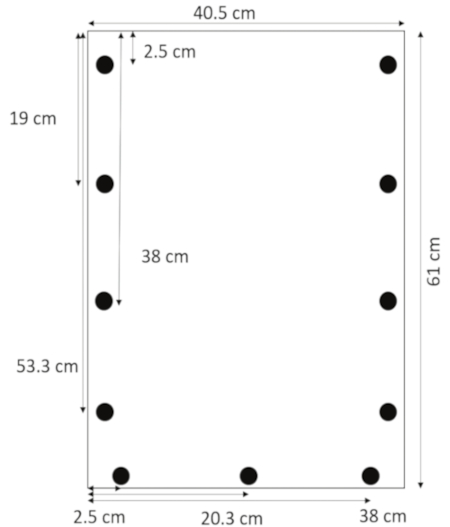
رقم 1: التخطيط لحفر ثقوب. هي ثقوب حفر 1.3 سم من الحواف الجانبية 2.5، 19، 38، و 53.3 سم من الأعلى و 1.3 سم من الحافة السفلية في 2.5 و 20.3 سم 38 من الهامش الأيمن. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
- إعداد الفواصل الجانبية والسفلي.
- قطع ثلاثة الفواصل كل مربع من البولي إيثيلين عالية الكثافة (HDPE) أو شراء اثنين قبل قطع الجانب الفواصل (0.635 سم, 2.5 سم، طولها 57 سم)، ومباعدة السفلي قبل قطع واحد (0.635 سم, 2.5 سم، طول 40.5 سم). انظر الجدول للمواد.
- قم بمحاذاة الفواصل بين الألواح الأمامية والخلفية على طول الجانبين وأسفل المربع. استخدام ثاقب أو الصحافة حفر، حفر من خلال الثقوب الموجودة في الجبهة والعودة مرة أخرى حيث أن الثقوب تمر عبر جميع الطبقات الثلاث نظيفة.
- عقد بوضع الطبقات باستخدام المشابك أو عن طريق تركيب مزيج من مسامير، والجوز، وغسالات في كل حديثا حفر حفرة (راجع الخطوة 3.1).
2-تركيب شريط من البوليستر الضرب في الجزء السفلي من مربع
ملاحظة: هذا سوف يمنع التربة والمياه من تسرب من خلال المفاصل بين الفواصل.
- قص البوليستر الضرب إلى 2.5 سم واسعة شرائط طويلة 40.5 سم (انظر الجدول للمواد).
- مع اللوحة الخلفية الكذب مسطحة والفواصل وعلى رأس ذلك، يكمن الضرب مباشرة فوق فاصل أسفل والاحتفاظ بها في مكان مع لوحة أعلى (الشكل 2).
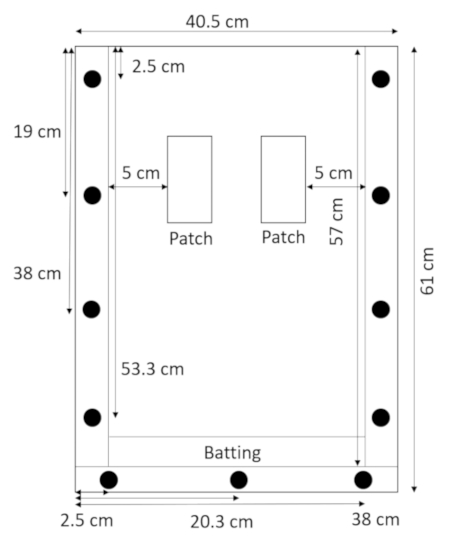
رقم 2: تجميع رهيزوبوكس مع الضرب- يمنع قطاع ضيق من الضرب في الجزء السفلي من رهيزوبوكس التربة والرمال من تسرب. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
3-الجمعية رهيزوبوكسيس
- تجميع رهيزوبوكسيس استخدام مسامير 20-الخيط (طول 3.2 سم بقطر 0.635 سم)، وغسالات (0.635 سم قطرها الداخلي)، والمكسرات عرافة (الحجم لتناسب المسامير، انظر الجدول للمواد.
- تشديد المسمار كل من خلال غسالة، اللوحة الأمامية، ومباعدة، واللوحة الخلفية، غسالة، وعرافة الجوز. تأكد من المسامير ضيقة جداً؛ إذا كان يتم تجميعها في المربع فضفاضة، سوف تسرب التربة بها من خلال الفجوات بين الألواح والفواصل الجانب.
ملاحظة: يتم بسهولة خدش اﻷكريليك، والخدوش يمكن أن تتداخل مع قياسات الجذر، حتى التعامل مع مربعات تجميعها بعناية. تجنب مربعات التراص ما لم يتم وضع مادة واقية بينهما. - إعداد اثنين التصحيح الفواصل (الفواصل) التي سيتم استخدامها لإنشاء بقع العلاج والسيطرة على كل مربع. قص الفواصل من البولي إيثيلين عالية الكثافة (HDPE) أوراق أو شرائها قبل قطع (0.635 سم، 3.8 سم، 28 سم طويلة؛ انظر الجدول للمواد). حفر حفرة واحدة 0.635 سم في كل فاصل، 2 سم من أعلى على طول خط منتصف (الشكل 3).
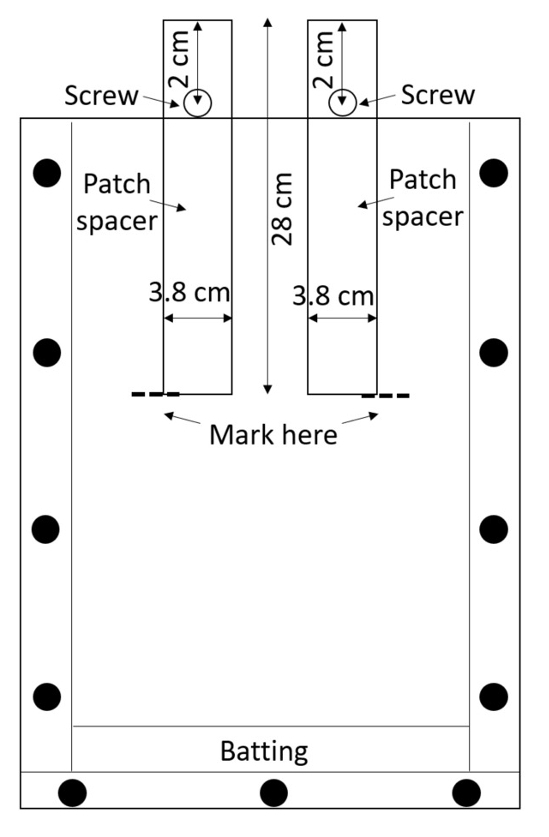
الشكل 3: التصحيح الفواصل. مسامير إدراجها عن طريق شرائط مركز الكثافة منعهم من الوقوع في المربع. رهيزوبوكس مليئة بالتربة المحيطة الفواصل وترطب التربة وتتم إزالة الفواصل كي يترك بقع فارغة في العلاج والسيطرة على. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
- تأمين المسمار من خلال كل فتحه مع الجوز بحيث يمكن إدراجها المباعدة جزئيا في رهيزوبوكس حتى المسمار يمنعها من الذهاب كذلك (الشكل 3).
ملاحظة: عندما هو ترطب التربة حولها الفواصل وتتم إزالة الفواصل، ستظل مسافتين فارغة التي يمكن أن تملأ بركائز المناسبة لتصحيح المعاملة المحتوية على النتروجين والتصحيح عنصر التحكم.
4-بناء PVC إطارات لدعم رهيزوبوكسيس في زاوية
ملاحظة: عندما يتم وضع المربع في زاوية، ستشجع جرافيتروبيسم الجذور تنمو ضد اللوحة الخلفية بحيث تكون مرئية لتتبع جذور جميع. كلوريد البوليفينيل (PVC) أبعاد في النتيجة الرقم 4 في إطار الذي يحافظ رهيزوبوكس في حوالي 55 ° زاوية على مقاعد البدلاء.
- قطع 13 قطعة من قطر 1.3 سم PVC كل مربع: 2 × 44 سم أطوال وأطوال سم × 42 3، 2 × 36.3 سم أطوال، 2 × 25.4 سم أطوال و 4 × 3.8 سم أطوال (انظر الجدول للمواد).
ملاحظة: ينصح منشار فرم للكفاءة والتخفيضات حتى. - استخدام المرفقين طريقة 2 × 4 و 2 × 3-طريقة المرفقين 4 T-المفاصل (انظر الجدول للمواد) لتجميع المربع كما هو مبين في الشكل 4.
ملاحظة: يجب أن تكون الإطارات مستقرة دون الغراء إضافية، ولكن يمكن استخدام الغراء PVC إذا لزم الأمر.
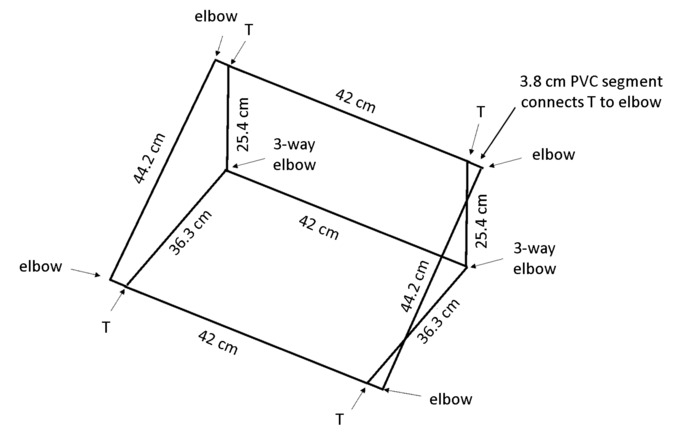
الشكل 4: الإطار لدعم رهيزوبوكسيس. هي التي شيدت من PVC قطع بأطوال محددة ومتصلة باستخدام أنواع المشترك أشار إلى الإطار خفيفة الوزن. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
5-الخياطة الحالات الواقية تعكس الضوء والحرارة
ملاحظة: جذور تجنب الضوء، حتى استبعاد هذه الحالات الخفيفة من أجل التأكد من أن لاحظت الردود اللدونة الجذر مدفوعة حسب مصدر المغذيات في البقع وليس عن طريق تجنب الضوء. النسيج الحرمان الخفيفة يقلل أيضا من درجة الحرارة داخل رهيزوبوكسيس، المساعدة على تفادي الإجهاد الحراري.
- قطع نسيج الحرمان الخفيفة (المواد المتخصصة هو الأبيض على جانب واحد والأسود الأخرى) إلى قطع حوالي 95 سم وطولها 69 سم (انظر الجدول للمواد). مطلوب قطعة واحدة كل مربع.
- طي كل قطعة نصفين على طول الحافة الطويلة لتشكيل الأكمام 47.5 سم × 69 سم. باستخدام إبرة آلة الخياطة المصممة الجينز والموضوع اللحف الثقيلة، والتماس ضيقة، خياطة على طول الجزء السفلي و ¾ من الطريق حتى الجانب من كل كم. دبوس الزوايا العليا جنبا إلى جنب مع دبوس الأمان.
6-إعداد التربة 1:1 (V/V): الرمال الركيزة لملء في رهيزوبوكسيس
- جمع حوالي 1,000 سم3 من تربة الحقل (من الموقع للفائدة) كل مربع. الجاف للتربة إلى وزن ثابت في علب الضحلة في 60 درجة مئوية.
ملاحظة: تم جمع التربة لهذه التجربة بعد الحصاد في حقل ذرة عضويا مدارة مباشرة من 0\u201210 سم عمق. - طحن التربة بقذائف الهاون والمدقة لتمريرها من خلال غربال 2 مم. قياس كثافة التربة السائبة التي تزن كمية معروفة من التربة.
- الحصول على الرمال (مثل اللعب الرمال، التي يمكن شراؤها من متجر لأجهزة الكمبيوتر غير مكلفة؛ انظر الجدول للمواد)، وقياس كثافة الكتلة.
- قياس كميات متساوية الرمال والتربة في دلو ومزيج دقيق. استخدام قمع لملء المربع ببطء وبشكل متساو إلى 2.5 سم من الأعلى، دون تهز مربع تسبب الركيزة تسوية. قياس هذا الحجم من الركازة؛ ينبغي أن يكون حوالي 1,272 سم3.
- تتضاعف كثافة الرمال السائبة بنصف هذا الحجم للحصول على كتلة الرمل اللازمة لكل مربع. القيام بالشيء نفسه مع الكثافة الظاهرية للتربة للحصول على كتلة التربة اللازمة لكل مربع.
ملاحظة: لحقل التربة والرمال المستخدمة في هذه التجربة، كان هذا ز 976 من الرمال وز 774 من التربة، ولكن هذه المبالغ سوف تختلف تبعاً الكثافة الظاهرية للتربة المستخدمة. - تسمية واحدة كبيرة أعلى الرمز البريدي كيس بلاستيك كل رهيزوبوكس وزن الجماهير المناسبة من الرمال والتربة في الكيس، وتجانسه تماما.
- تحليل هذه التربة 1:1-والركيزة لمحتوى المغذيات ووفرة الطبيعية 15N (δ15N).
7-إعداد الركيزة للعلاج ومراقبة بقع
- قم بتسمية اثنين أعلى الرمز البريدي أكياس بلاستيكية صغيرة كل رهيزوبوكس، وواحد للتصحيح العلاج وواحد للتصحيح عنصر التحكم. تزن 30 جرام التربة: الرمال الركيزة من كل كيس كبير (الخطوة 6.6) في اثنين من أكياس صغيرة المقابلة.
- مزيج من الركازة مع مصدر نيتروجين N المسمى 15للتصحيح في المعاملة. لهذا، تزن من 1 غرام من بقايا النبات المسمى ن 15أو المصادر الأخرى ن (يمكن تعديل المبلغ المطلوب) في كل كيس العلاج (حقيبة صغيرة أعلى الرمز البريدي)، ومزيج دقيق.
ملاحظة: هذه التجربة، تم استخدام خليط من 15المسمى ن البرسيم وبقايا بيقه. بذور البرسيم وبيقه زرعت في مزيج 1:1 الفيرميكوليت والرمال، ونمت تحت ظروف الاحتباس الحراري. وكانت النباتات الرطبة يوميا مع المياه ومرتين أسبوعيا مع قوة لونغ أشتون حل13 التي تحتوي على مصادر النيتروجين N المسمى 151/100. كان حصاد الكتلة الحيوية فوق الأرض كل أربعة أسابيع بعد الغرس، المجففة، والأرضية لتمريرها من خلال غربال 2 مم. إذا تم اختيار مغذيات مختلفة، لا سيما إذا كان هذا العنصر المتنقلة في التربة، وتجارب رائدة لاختبار الارتشاح وتشجع. يمكن أن تستخدم أشكال الإفراج بطيئة للمواد الغذائية، أو يمكن اختيار تصميم رهيزوبوكس مختلفة لتقييد الارتشاح (مثلاً بحجرات منفصلة10) إذا لزم الأمر.
8-تحميل رهيزوبوكس مع الركازة، وتحديد العلاج ومراقبة بقع
- تزن كل رهيزوبوكس الفارغة وتسجيل الأوزان لاستخدامها في وقت لاحق.
- إدراج اثنين من الفواصل التصحيح (راجع الخطوة رقم 3.2) في رهيزوبوكس واحدة حتى المسمار تمنعهم من الذهاب إلى أبعد. مارك عمق الحافة السفلي مع علامة ضوء على جانب رهيزوبوكس (الشكل 3) وإزالة الفواصل.
- استخدام قمع مع فتح جذعية تضييق كفتح رهيزوبوكس، وملء رهيزوبوكس من كيس كبير المقابلة من الركازة إلى عمق ملحوظ. نقل القمع جيئة وذهابا ببطء وبشكل متساو حيث أنه الركيزة يملأ شكل موحد، ولا يقوم بإنشاء قنوات تدفق تفضيلية.
- عندما يصل مستوى الركازة عمق ملحوظ، وضع الفواصل مرة أخرى في 5 سم من كل جانب للمربع. مواصلة ملء المربع حتى مستوى الركازة 5 سم تقريبا من أعلى المربع (ينبغي أن تكون الركيزة المتبقية في الحقيبة).
- ويت مستفيضة حول كل فاصل.
ملاحظة: في هذه التجربة، وقد تحقق بتسليم 50 مل الماء عن طريق التنقيط بواعث إدراجها بين الحافة الخارجية لكل فاصل وإلى جانب رهيزوبوكس، وصب 50 مل من المياه بالتساوي بين الفواصل اثنين. الري بطيئة ضروري لترطيب موحد. - إزالة الفواصل بينما التربة الرطبة، تاركاً تجويف فارغ للبقع.
- شريط فيلم شفافية إلى خارج كل رهيزوبوكس (انظر الجدول للمواد). وضع علامة على جانب واحد كعلاج وواحد كعنصر تحكم، وملء البقع من الحقائب المناسبة استخدام القمع. تتبع حدود كل التصحيح على شفافية باستخدام علامة دائمة.
- تعبئة في رهيزوبوكس بالتساوي مع الركيزة المتبقية. تتبع الجزء العلوي من الركازة على الشفافية.
- كرر رهيزوبوكسيس المتبقية. حفظ جميع الحقائب لموسم الحصاد.
9-وحتى الري إلى 60% القدرة على الاحتفاظ بالمياه
ملاحظة: تم العثور على هذه الكمية من رطوبة التربة للحيلولة دون حصول النباتات التي تعاني من إجهاد الجفاف بينما منع تطور ظروف وصول أو نمو الطحالب.
- قياس القدرة على الاحتفاظ بالماء (لجنة التراث العالمي) الركيزة14.
- حساب الوزن المثالي لكل مربع؛ تعرف هنا بأنها مجموع وزن رهيزوبوكس الفارغة جنبا إلى جنب مع وزن الركيزة في القدرة على الاحتفاظ بالمياه 60 في المائة.
- تتكاثر في لجنة التراث العالمي (غراما من الماء/غرام من الركازة جاف) من 0.6 الحصول على كتلة المياه الذي عقد في الركيزة في 60% لجنة التراث العالمي. إضافة هذه الكتلة إلى كتلة الركازة جاف والكتلة من 15ن المصدر.
- إضافة وزن كل مربع فارغ إلى الرقم الحصول عليها أعلاه.
- وزن المربعات بمجرد أنهم قد تم شغلها. قم بطرح وزن كل مربع (ز) عند هذه النقطة من وزنه المثالي (في ز) المحسوبة في الخطوة 9، 2. مع هذا الحجم (في مل) من الماء دي (دي) الماء المتأين ببطء وبشكل متساو.
ملاحظة: هذه الخطوة يمكن القيام بذلك باستخدام الري بالتنقيط أو الري باليد. إذا سقي باليد، السماح للمياه ترشح تماما قبل إضافة المزيد من الجهود لتجنب ظروف رطوبة التربة المتباينين وقنوات تدفق تفضيلية.
10-البذور الإنبات، وزرع الأعضاء
- في حالة استخدام عناصر تحكم مشكلة، جانبا تلك رهيزوبوكسيس.
- السطح-تعقيم بذور الذرة الصفراء بالتحريك لدقيقة 1 في 5% ناوكل، ثم شطف جيدا في المياه دي.
ملاحظة: استخدمت بذور ستة الأنماط الجينية الذرة المختلفة في هذه التجربة، بغية التحقيق أوضح الاختلافات في اللدونة الجذر. - تنبت بذور معقمة بوضعها على أنسجة مختبرية رطب (مثلاً، كيمويبي) داخل أطباق بيتري، وتغطي مع الأنسجة رطبة أخرى. وينبغي أن لا يكون هناك أي المياه الراكدة. أطباق "بيتري مكان" في مكان مظلم ح 48\u201272 حتى جذير مجرد تبدأ في الظهور.
- استخدام ملعقة ضيقة لحفر حفرة بعمق 2.5 سم في وسط كل رهيزوبوكس. زرع بذرة نبتت في الحفرة، ضمان أن جذير يتجه مباشرة أسفل.
ملاحظة: إذا كانت الزاوية جذير اتجاه أما التصحيح، سوف يكون متحيزا مقارنة معدلات النمو الجذري. - تتبع موقع البذور على الشفافية.
- تغطية البذور والمياه مع تصل إلى 50 مل مياه دي.
11-النباتات النمو
- زراعة النباتات لمدة 25 يوما (أو ما دام المطلوب)، والحفاظ على نسبة 60% لجنة التراث العالمي طوال فترة النمو. رصد النمو الجذري عن طريق تتبع الجذور.
- تزن كل مربع كل أيام 3\u20124 والماء حتى يتم داخل 5 غ وزنها المثالي. وقف سقي رهيزوبوكسيس أربعة أيام قبل الحصاد تيسيرا للفصل بين الفريقين. إزالة الأعشاب باليد كثيرا ما حيث تكون جذور النباتات فقط من الفائدة الحالية.
- تتبع جذور مرئية كل أيام 3\u20124 استخدام علامة دائمة مع ألوان مميزة ومن الواضح لكل يوم التتبع.
ملاحظة: يمكن استخدام علامات مختلفة القطر للجذور الأساسية والجانبية، إذا رغبت في ذلك. يمكن أن تكون مفيدة لتحديد معايير لتتبع الجذر في البداية حيث تشارك بدرجة من الذاتية، لا سيما إذا كان الباحثون متعددة سيتم تتبع جذور أو إذا أردنا أن الجذور لأوامر مختلفة أو قطر الموقر بعلامات مختلفة. في هذه التجربة، تم اختبار دقة تتبع جذور مرئية على جانب واحد فقط من المربع عن طريق تتبع جذور مرئية على كلا الجانبين ومقارنة طول الجذر مجموع تقاس على الورق الشفاف الممسوحة ضوئياً إلى جذر مجموع طول يقاس بالغسيل والمسح جذور. العلاقة بين طول تتبع وتفحص جذر مهم بغض النظر عما إذا تم استخدام شفافية الخلفية فقط أو الورق الشفاف على حد سواء. ولذلك فمن الممكن لمجرد تتبع جذور مرئية على اللوحة الخلفية.
12-حصاد يطلق النار، والحصول على الجذر وعينات من التربة لتحليلها
- وضع رهيزوبوكس أول شقة وإزالة جميع المسامير.
- حصاد العينات تبادل لإطلاق النار. مقطع يطلق النار في القاعدة وشطف أي التربة مع المياه دي وجاف عند 60 درجة مئوية. طحن يطلق النار بقذائف الهاون والمدقة تمريرها من خلال غربال 2 مم وتزن عنها في كبسولات القصدير لتحليل النظائر المشعة (انظر المادة 14).
- استخدام الشفافية كدليل، قطع حول البقع العلاج والتحكم بشفرة حلاقة. استخدام ملعقة أو ملعقة لحلج القطن الجذور والتربة rhizosphere المنضمة في كيس العلاج أو التحكم الخاصة بكل منها.
ملاحظة: في حين توجد أساليب عديدة لتربة rhizosphere منفصلة والتربة تحت تأثير النبات جذور15، ويمكن اعتبار rhizosphere تدرج بدلاً من منطقة محددة بدقة16، يتبع هذه الطريقة المستخدمة على نطاق واسع تعريف التربة التي تتمسك بزرع جذور بعد الهز17. - حلج القطن الجذور والتربة المتبقية داخل الحقيبة الثالثة.
- يمر العلاج، والسيطرة، ومعظم العينات من خلال غربال 2 مم لفصل الجذور من الركازة، إزالة أي جذور مرئية أو الشظايا > 1 سم في الطول مع ملاقط غرامة. الاحتفاظ بهذه العينات منفصلة عن بعضها البعض لما مجموعة ثلاث الجذر وثلاث عينات الركازة.
13-التحقق من وسم وتقدير معدلات نمو الجذر النسبي
- مسح العلاج، والسيطرة، ومعظم العينات وحساب طول الجذر.
- العمل مع عينة واحدة في وقت واحد، شطف الجذور بعناية مع المياه دي لإزالة أي الركازة المتبقية. ترتيب العينات في صينية واضحة حيث أن الجذور ليست متداخلة.
- فحص العينات باستخدام ماسح ضوئي متوافق مع برنامج تحليل الجذر (مثلاً، وينرهيزو). التأكد من أن البرنامج هو معايرة موثوق بها التمييز بين جذور من خلفية الصورة.
- استخدام البرنامج لقياس طول المجموع الجذري وطول الجذر في فئات القطر للفائدة (مثلاً < 0.2 مم، 0.2\u20120.4 مم 0.4\u20120.8 مم 0.8\u20121.6 مم، > 1.6 ملم).
- حساب الجذر طول كثافة (RLD) للعلاج ومراقبة بقع وكل رهيزوبوكس ككل.
- حساب حجم بقع العلاج والتحكم بضرب منطقة تتبع كل الشفافية (راجع الخطوة 8، 1) في 0.635 سم، عمق المربع. استخدام وحدات التخزين هذه لحساب كثافة طول الجذر في بقع العلاج ومراقبة استخدام طول المجموع الجذري في تصحيح كل (راجع الخطوة 13.1.3).
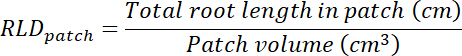
- حساب حجم الركيزة في كل رهيزوبوكس بضرب منطقة تتبع على الشفافية (راجع الخطوة 8، 1) قبل 0.635 سم. حساب RLD أما بالنسبة للعلاج والسيطرة على بقع.
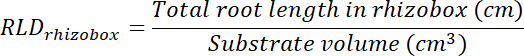
- حساب حجم بقع العلاج والتحكم بضرب منطقة تتبع كل الشفافية (راجع الخطوة 8، 1) في 0.635 سم، عمق المربع. استخدام وحدات التخزين هذه لحساب كثافة طول الجذر في بقع العلاج ومراقبة استخدام طول المجموع الجذري في تصحيح كل (راجع الخطوة 13.1.3).
- التحقق من صحة جذر تتبع الأسلوب بمقارنة نظم جذور الممسوحة ضوئياً وتتبع الصور.
- مسح كل الشفافية وحساب طول المجموع الجذري باستخدام البرمجيات. حفظ الصورة الملتقطة بالماسح الضوئي لنمو معدل العمليات الحسابية.
- مجموع قياسات طول المجموع الجذري للعلاج، والسيطرة، ومعظم العينات لكل مربع (راجع الخطوة 13.1.3).
- اختبار القياسات الممسوحة ضوئياً وتتبع لطول المجموع الجذري معرفة ما إذا كان الارتباط ذات دلالة إحصائية أم لا.
ملاحظة: إذا كان الأمر كذلك، يتم التحقق من صحة أسلوب التعقب، ويمكن حساب معدلات النمو النسبية في كل مرة نقطة. إذا لم يكن الأمر كذلك، يوفر البيانات الممسوحة ضوئياً جذر النظام فقط مؤشرا دقيقا على نمو الجذر. يمكن أن يكون هذا هو الحال إذا كان تتبع منهجية غير متسقة أو إذا كانت جذور غير مرئية على قدم المساواة لجميع الأنماط الجينية، على سبيل المثال.
- إذا تم التحقق من صحة أسلوب التعقب، حساب معدلات نمو الجذر النسبي لكل رهيزوبوكس.
- استخدام برمجيات تحليل الجذر معايرة للتمييز بين الألوان المختارة تتبع لقياس طول المجموع الجذري في العلاج، والسيطرة، ومعظم العينات في كل نقطة في الوقت. حساب طول الجذر المجموع التراكمي عند كل نقطة في الوقت.
- حساب معدلات نمو الجذر النسبي (رجرالجذر) لكل رهيزوبوكس، وكذلك فيما يتعلق بالعلاج ومراقبة بقع لكل الوقت t الفاصل1-تي2 على النحو التالي.
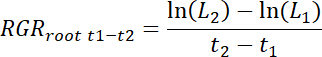
ملاحظة: هنا ل1 طول المجموع الجذري في التصحيح (المجموع التراكمي من 11.3) في الأيام1 ر بعد زرع (دات) و ل2طول المجموع الجذري في التصحيح في تي2 dat.
14-تحليل 15ن التقسيم بين عينات التربة الجذر وتبادل لإطلاق النار، والعلاج
- الجاف للجذور عند 60 درجة مئوية وزن الكتلة الأحيائية، وطحن لتمريرها من خلال غربال 2 مم.
- عنها الجافة للتربة المعالجة عند 60 درجة مئوية.
- مجموعة جذور والعلاج في كبسولات القصدير كما هو الحال مع يطلق النار.
ملاحظة: وزن عينة مثالية لكل كبسولة ينبغي حساب منفصل ليطلق النار والجذور والتربة استناداً إلى نسبة c/N المقدرة المادية لتحقيق المبلغ المستهدف من مجموع N للتحليل. اتصل مرفق النظائر المستقرة فيها العينات التي ستقدم للحصول على مزيد من المعلومات. لهذه التجربة، كانت تعليمات إعداد العينة و "العينة حاسبة الوزن" المقدمة من مرفق النظائر المستقرة ديفيس UC يتبع18.
تنبيه: أن الرعاية الخاصة لخلط العينات بالتساوي قبل التعبئة والتغليف في كبسولات وإعداد كبسولات متعددة كل عينة. إذا كانت العينات غير مختلطة بالتساوي، الانتعاش الواضح من 15N يمكن أن يتجاوز المبلغ الحالي أصلاً. - تحليل مجموع N، و δ15، ومحتوى 15N لكل تبادل لإطلاق النار، والجذرية، وعينه التربة المعالجة.
ملاحظة: في هذه التجربة، مصنع تم تحليل عينات عن طريق الاحتراق مع محلل عنصري بدز يوروبا ANCA-رتبة الخدمة الميدانية موصول إلى "بدز يوروبا" 20-20 نظائر مطياف كتلة نسبة في "مرفق النظائر مستقرة" جامعة كاليفورنيا ديفيس (SIF كلية جامعة دبلن). وجرى تحليل عينات التربة مع محلل عنصري المنطار فاريو ش المكعب ربطه إلى "يوروبا بدز" 20-20 نظائر نسبة كتلة مطياف في كلية جامعة دبلن SIF. - حساب المبلغ 15ن الحصول عليها من التسمية في مصنع إطلاق النار، والجذر عينات.
- أولاً، حساب مقدار 15ن تتجاوز الغلاف الجوي 15ن في كل تجمع، 15ف *:
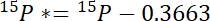
أين يوجد 15ف المحتوى 15N % الذري تجمع للفائدة. - وثانيا، حساب مقدار 15ن تتجاوز الغلاف الجوي 15N في التسمية، 15ل *:
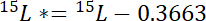
أين يوجد 15ل المحتوى 15N % الذري من المصدر ن المسمى. - وثالثاً، حساب كمية ن المجموع في كل تجمع، نف:
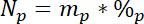
حيث مف هو كتلة تجمع (مثلاً مجموع إطلاق النار الجافة أو جذر الكتلة الحيوية) و %p هو النسبة المئوية من N لأن بركة. - وأخيراً، استخدام نتائج 14.5.1\u201214.5.3 في المعادلة ندف19 لحساب مقدار ن الحصول عليها من التسمية، نل:
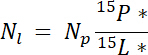
ملاحظة: يتم استخدام المعادلة ندف لتحديد مقدار N من مصدر مسماة التي يتم استردادها بالنباتات. أنها تفترض أن أي تمييز النظائر يحدث أثناء امتصاص N بالمصنّع وصالحة عموما ن مصادر الإثراء ~1\u201210%19.
- أولاً، حساب مقدار 15ن تتجاوز الغلاف الجوي 15ن في كل تجمع، 15ف *:
النتائج
نمت جذور تفضيلي ضد الجزء الخلفي المربع، كما كان متوقعا. تتبع مجموع طول الجذر على الجزء الخلفي مربع تتراوح من 400 إلى سم 1,956، مقارنة ب 93-758 سم على الجزء الأمامي المربع. وحسبت معاملات الارتباط بيرسون اقتران بين طول الجذر الممسوحة ضوئياً وطول تتبع الجذر على الجزء الأمامي المرب?...
Discussion
رهيزوبوكسيس الموصوفة في هذا البروتوكول يمكن استخدامها للرد على أسئلة متنوعة في علم الجذر ورهيزوسفيري، ولقد وجدت متنوعة يستخدم في أماكن أخرى10،،من2021،،من2223 , 24 , 25
Disclosures
الكتاب ليس لها علاقة بالكشف عن.
Acknowledgements
المؤلف يود أن ينوه المراجعين المجهول للتغذية المرتدة، فضلا عن كاهيل كيركراده وتأن باو للتوجيه الأولى بشأن وضع بروتوكول رهيزوبوكس. تم توفير التمويل بالأساس للأغذية والزراعة البحوث، لنا وزارة للزراعة (وزارة الزراعة) المعهد الوطني للأغذية والزراعة، زراعية تجربة محطة كاليفورنيا المشروع-د-الثابتة والمتنقلة-2332-ح، إلى جي وإدارة جامعة كاليفورنيا ديفيس من المصنع العلوم من خلال زمالة إلى ج. س.
Materials
| Name | Company | Catalog Number | Comments |
| 1.27 cm diameter PVC pipe | JM Eagle | 530048 | 305 cm per box, cut into lengths as specified in the protocol |
| PVC side elbows | Lasco | 315498 | 2 per box |
| PVC 90-degree elbows | Charlotte | PVC 02300 0600 | 4 per box |
| PVC T joints | Charlotte | PVC 02402 0600 | 4 per box |
| Extruded acrylic panes | TAP Plastics | N/A | 2 per box, 0.64 cm thick x 40.5 cm wide x 61 cm long |
| HDPE spacers (sides) | TAP Plastics | N/A | 2 per box, 0.64 cm thick x 2.5 cm wide x 57 cm long |
| HDPE spacers (bottom) | TAP Plastics | N/A | 1 per box, 0.64 cm thick x 2.5 cm wide x 40.5 cm long |
| HDPE spacers (patch) | TAP Plastics | N/A | 2 per box, 0.64 cm thick x 3.8 cm wide x 28 cm long |
| Polyester batting | Fairfield | #A-X90 | 2.5 cm x 40.5 cm strip per box |
| 20-thread screws | N/A | N/A | 3.2 cm long, 0.64 cm diameter |
| Washers | N/A | N/A | 0.64 cm internal diameter |
| Hex nuts | N/A | N/A | sized to fit the screws |
| Light deprivation fabric | Americover, Inc. | Bold 8WB26.5 | 1 piece 95 cm wide and 69 cm long per box |
| Sand | Quikrete | No. 1113 | |
| Field soil | N/A | N/A | |
| Transparencies for tracing | FXN | FXNT1319100S | One per side of the box to be traced |
References
- Hodge, A. Roots: The Acquisition of Water and Nutrients from the Heterogeneous Soil Environment. Progress in Botany 71. , 307-337 (2010).
- Grossman, J. D., Rice, K. J. Evolution of root plasticity responses to variation in soil nutrient distribution and concentration. Evolutionary Applications. 5 (8), 850-857 (2012).
- Zhang, H., Forde, B. G. An Arabidopsis MADS box gene that controls nutrient-induced changes in root architecture. Science. 279 (5349), 407-409 (1998).
- Hodge, A., Stewart, J., Robinson, D., Griffiths, B. S., Fitter, A. H. Competition between roots and soil micro-organisms for nutrients from nitrogen-rich patches of varying complexity. Journal of Ecology. 88 (1), 150-164 (2000).
- Trachsel, S., Kaeppler, S. M., Brown, K. M., Lynch, J. P. Shovelomics: high throughput phenotyping of maize (Zea mays L.) root architecture in the field. Plant and Soil. 341 (1-2), 75-87 (2011).
- Rogers, E. D., Monaenkova, D., Mijar, M., Nori, A., Goldman, D. I., Benfey, P. N. X-ray computed tomography reveals the response of root system architecture to soil texture. Plant Physiology. , (2016).
- Groleau-Renaud, V., Plantureux, S., Guckert, A. Effect of mechanical constraint on nodal and seminal root system of maize plants. Comptes Rendus De L Academie Des Sciences Serie Iii-Sciences De La Vie-Life Sciences. 321 (1), 63-71 (1998).
- Lin, Y., Allen, H. E., Di Toro, D. M. Barley root hair growth and morphology in soil, sand, and water solution media and relationship with nickel toxicity. Environmental Toxicology and Chemistry. 35 (8), 2125-2133 (2016).
- Wenzel, W. W., Wieshammer, G., Fitz, W. J., Puschenreiter, M. Novel rhizobox design to assess rhizosphere characteristics at high spatial resolution. Plant and Soil. 237 (1), 37-45 (2001).
- Spohn, M., Carminati, A., Kuzyakov, Y. Soil zymography - A novel in situ method for mapping distribution of enzyme activity in soil. Soil Biology and Biochemistry. 58, 275-280 (2013).
- Vollsnes, A. V., Futsaether, C. M., Bengough, A. G. Quantifying rhizosphere particle movement around mutant maize roots using time-lapse imaging and particle image velocimetry. European Journal of Soil Science. 61 (6), 926-939 (2010).
- Hewitt, E. J. . Sand and Water Culture Methods Used in the Study of Plant Nutrition. , (1966).
- Choudhary, M. I., Shalaby, A. A., Al-Omran, A. M. Water holding capacity and evaporation of calcareous soils as affected by four synthetic polymers. Communications in Soil Science and Plant Analysis. 26 (13-14), 2205-2215 (1995).
- Bakker, P. A. H. M., Berendsen, R. L., Doornbos, R. F., Wintermans, P. C. A., Pieterse, C. M. J. The rhizosphere revisited: root microbiomics. Frontiers in Plant Science. 4, 2013 (2013).
- McNear, D. H. The Rhizosphere - Roots, Soil, and Everything In Between. Nature Education Knowledge. 4 (3), 1 (2013).
- Ortas, I. Determination of the extent of rhizosphere soil. Communications in Soil Science and Plant Analysis. 28 (19-20), 1767-1776 (1997).
- . Carbon (13C) and Nitrogen (15N) Sample Preparation Available from: https://stableisotopefacility.ucdavis.edu/13cand15nsamplepreparation.html (2018)
- Barraclough, D. 15N isotope dilution techniques to study soil nitrogen transformations and plant uptake. Fertilizer research. 42 (1-3), 185-192 (1995).
- Belter, P. R., Cahill, J. F. Disentangling root system responses to neighbours: identification of novel root behavioural strategies. AoB PLANTS. 7, (2015).
- Nagel, K. A., et al. GROWSCREEN-Rhizo is a novel phenotyping robot enabling simultaneous measurements of root and shoot growth for plants grown in soil-filled rhizotrons. Functional Plant Biology. 39 (11), 891-904 (2012).
- Adu, M. O., Yawson, D. O., Bennett, M. J., Broadley, M. R., Dupuy, L. X., White, P. J. A scanner-based rhizobox system enabling the quantification of root system development and response of Brassica rapa seedlings to external P availability. Plant Root. 11, 16-32 (2017).
- Neumann, G., George, T. S., Plassard, C. Strategies and methods for studying the rhizosphere-the plant science toolbox. Plant and Soil. 321 (1-2), 431-456 (2009).
- Bodner, G., Alsalem, M., Nakhforoosh, A., Arnold, T., Leitner, D. RGB and Spectral Root Imaging for Plant Phenotyping and Physiological Research: Experimental Setup and Imaging Protocols. JoVE (Journal of Visualized Experiments). (126), e56251-e56251 (2017).
- Kuchenbuch, R. O., Ingram, K. T. Image analysis for non-destructive and non-invasive quantification of root growth and soil water content in rhizotrons. Journal of Plant Nutrition and Soil Science. 165 (5), 573-581 (2002).
- Dresbøll, D. B., Thorup-Kristensen, K., McKenzie, B. M., Dupuy, L. X., Bengough, A. G. Timelapse scanning reveals spatial variation in tomato (Solanum lycopersicum L.) root elongation rates during partial waterlogging. Plant and Soil. 369 (1-2), 467-477 (2013).
- Wu, J., et al. RhizoChamber-Monitor: a robotic platform and software enabling characterization of root growth. Plant Methods. 14 (1), 44 (2018).
- Rogers, S. W., Moorman, T. B., Ong, S. K. Fluorescent In Situ Hybridization and Micro-autoradiography Applied to Ecophysiology in Soil. Soil Science Society of America Journal. 71 (2), 620-631 (2007).
- Eickhorst, T., Tippkötter, R. Detection of microorganisms in undisturbed soil by combining fluorescence in situ hybridization (FISH) and micropedological methods. Soil Biology and Biochemistry. 40 (6), 1284-1293 (2008).
- Spohn, M., Kuzyakov, Y. Distribution of microbial- and root-derived phosphatase activities in the rhizosphere depending on P availability and C allocation - Coupling soil zymography with 14C imaging. Soil Biology and Biochemistry. 67, 106-113 (2013).
- Lv, G., Kang, Y., Li, L., Wan, S. Effect of irrigation methods on root development and profile soil water uptake in winter wheat. Irrigation Science. 28 (5), 387-398 (2010).
- Asseng, S., Ritchie, J. T., Smucker, A. J. M., Robertson, M. J. Root growth and water uptake during water deficit and recovering in wheat. Plant and Soil. 201 (2), 265-273 (1998).
- Hernandez-Ramirez, G., et al. Root Responses to Alterations in Macroporosity and Penetrability in a Silt Loam Soil. Soil Science Society of America Journal. 78 (4), 1392-1403 (2014).
- Zhang, Y. L., Wang, Y. S. Soil enzyme activities with greenhouse subsurface irrigation. Pedosphere. 16 (4), 512-518 (2006).
- Robinson, D., Hodge, A., Griffiths, B. S., Fitter, A. H. Plant root proliferation in nitrogen-rich patches confers competitive advantage. Proceedings of the Royal Society of London B: Biological Sciences. 266 (1418), 431-435 (1999).
- Lobet, G., Draye, X. Novel scanning procedure enabling the vectorization of entire rhizotron-grown root systems. Plant Methods. 9, 1 (2013).
- Swarup, R., Wells, D. M., Bennett, M. J. Root Gravitropism. Plant Roots: The Hidden Half. , (2013).
- Smit, A. L., Bengough, A. G., Engels, C., van Noordwijk, M., Pellerin, S., van de Geijn, S. C. . Root Methods: A Handbook. , (2000).
- van Dusschoten, D., et al. Quantitative 3D Analysis of Plant Roots Growing in Soil Using Magnetic Resonance Imaging1[OPEN]. Plant Physiology. 170 (3), 1176-1188 (2016).
- Metzner, R., et al. Direct comparison of MRI and X-ray CT technologies for 3D imaging of root systems in soil: potential and challenges for root trait quantification. Plant Methods. 11, 17 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved