JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
루트 성장 및 지역화 된 양분에 응답을 시각화 하는 최적화 된 Rhizobox 프로토콜
요약
시각화 및 루트 성장에서 제자리에 매우 도전 이다. 우리는 루트 개발 및 영양 농축에 대 한 응답에서 시간이 지남에 확산을 추적 하는 사용자 정의 rhizobox 방법을 제시. 이 메서드는 루트 소성 유기 질소 소스에 대 한 응답에서에 옥수수 genotypic 차이 분석 하는 데 사용 됩니다.
초록
뿌리는 악명 높게 공부 하기 어렵다. 토양은 둘 다 시각과 기계적 장벽, 어려운 추적 하 뿌리 제자리에 파괴적인 수확 또는 비싼 장비 없이. 우리는 시간이 지남에 루트 성장의 비 파괴적인 시각화 수 있으며 특히 패치 지역화 된 리소스에 대 한 응답에서 루트 소성 공부에 적합 하는 사용자 정의 하 고 저렴 한 rhizobox 메서드를 제시. 메서드는 15N 표시 된 콩과 식물 잔류물을 포함 하는 패치를 소성 응답에 옥수수 genotypic 변화를 평가 하 여 확인 했다. 메서드는 대표적인 발달 측정 시간이 지남에 얻을, 리소스를 포함 하 고 제어 패치 루트 길이 밀도 측정, 계산 하 루트 성장 속도, 식물 뿌리와 새싹에 의해 15N 복구 확인 설명. 장점, 주의 사항, 및 방법의 잠재적인 미래의 애플 리 케이 션도 설명 되어 있습니다. 실험 조건 루트 성장 데이터를 바이어스 되지 않습니다 않도록 주의 해야 합니다, 하지만 여기에 제시 된 rhizobox 프로토콜 세부 사항에 충분 한 주의 함께 실시 하는 경우 신뢰할 수 있는 결과 생성 합니다.
서문
종종 간과 되지만 그들의 지상에 비해 뿌리 역할을 중요 한 식물 영양소 인수에서. 루트 건설 및 유지 보수의 실질적인 탄소 비용을 감안할 때, 식물 뿌리만 구하고 투자 가치를 개발 하는 메커니즘을 진화 했다. 루트 시스템 수 있습니다 따라서 효율적이 고 동적으로 내 리소스 패치 핫스팟, 통풍 관, 그리고 더 전송1에 대 한 체 관 부에 급속 하 게 translocating 영양분의 upregulating 속도에 확산 하 여. 소성 응답 식물 종 또는 genotypes2,3 중 및5영양소 관련된4,화학 형태에 따라 크게 달라질 수 있습니다. 루트 소성에 변화는 또한, 이기종 토양 자원에 대 한 복잡 한 루트 응답 사육 및 농업에 영양소 이용 효율 증가를 관리 전략을 알릴 수 있는 이해 탐험 한다.
필요성 및 이해 플랜트 시스템에 대 한 관련성에도 불구 하 고 시각화 및 측정 관련 비늘에서 루트 소성 기술 도전 포즈. 일반적인 방법 이다 ("shovelomics"6) 토양에서 루트 크라운을 발굴 하지만 잘 뿌리 토양 집계, 사이 작은 구멍을 악용 그리고 발굴 필연적으로 어느 정도 이러한 연약한 뿌리의 손실의. 또한, 파괴적인 수확 하기가 불가능 한 루트 시스템에 변경 시간이 지남에 따라. 계산 하는 x 선 단층 촬영 등 현장에서 이미징 방법 높은 공간 해상도7, 뿌리와 토양 자원의 직접적인 시각화를 허용 하지만 비싸다 및 특수 장비가 필요. 수경 실험 토양에서 뿌리 추출와 관련 된 제약을 방지 하지만 루트 형태학 및 건축 기계 제약와 토양8,9의 생물 복잡성 수성 매체에서 다. 마지막으로, rhizosphere 프로세스 및 기능 발달가 소성이 인공 미디어에서와 통합 될 수 없습니다.
선물이 건설과 시간이 지남에 토양에 뿌리 성장을 하는 낮은-비용, 사용자 정의 방법으로 rhizoboxes (좁은, 일반 단면 사각형 컨테이너)의 사용에 대 한 프로토콜. 특별히 설계 된 프레임 gravitropism, 루트 길이 측정의 정확도 증가 때문에 후면 패널에 대 한 우선적으로 성장 하는 뿌리를 권장 합니다. Rhizoboxes는 일반적으로 루트 성장 및 rhizosphere 상호 작용10,,1112, 공부 하는 데 사용 됩니다 하지만 여기에 제시 된 방법 제공 단순 단일 구획 설계와 저렴 한 장점이 재료, 지역화 된 영양소에 대 한 루트 응답을 공부 하도록 설계 되었습니다. 그러나, 방법 또한 다양 한 내부/interspecies 경쟁 등 다른 루트와 rhizosphere 프로세스, 화합물, 미생물 또는 효소 활동의 공간 배급을 공부에 적응 수 있습니다. 여기, 우리는 패치 15N 표시 된 콩과 식물 잔류물 및 하이라이트 대표 결과의 rhizobox 메서드를 사용 하면 유효성 검사에 대 한 응답 genotypic 옥수수 하이브리드 차이 조사 합니다.
Access restricted. Please log in or start a trial to view this content.
프로토콜
1. 전면 및 후면 패널 및 스페이서의 준비
- 전면 및 후면 패널을 준비 합니다.
- 잘라 두 조각의 40.5 cm 폭 61cm 분명 0.635 cm 두꺼운 아크릴 상자 당 긴 또는 미리 잘라 조각 ( 재료의 표참조)을 구입.
- 아크릴을 위한 드릴 비트를 사용 하 여, 드릴 구멍 0.635 cm 직경 1.3 c m에서 2.5, 19, 38, 및 53.3 cm 상단에서 측면 가장자리. 2.5, 20.3, 그리고 왼쪽 (그림 1)에서 38 cm 아래쪽 가장자리에서 1.3 c m의 구멍을 드릴 합니다.
참고: 한 번에 6 ~ 10 시트의 스택에 대 한 드릴 프레스를 사용 하 여 가장 효율적 이지만 핸드 드릴을 사용할 수 있습니다. - 아크릴에서 모든 보호 재를 제거 하 고 부드럽게 두 패널 상자 조립 전에 청소.
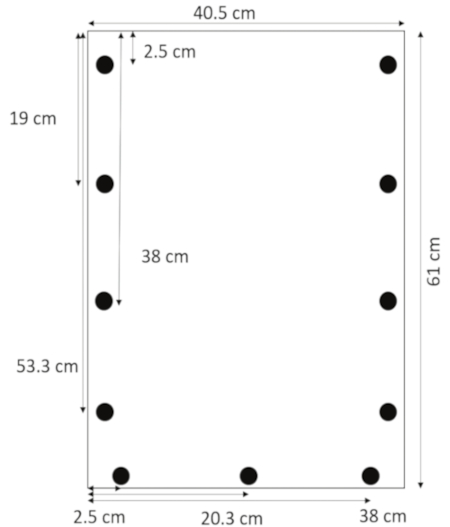
그림 1: 드릴된 구멍의 레이아웃. 구멍 뚫고 1.3 c m에서 2.5, 19, 38, 측면 가장자리 그리고 정상에서 53.3 cm 2.5, 20.3, 그리고 왼쪽된 여백에서 38 cm 아래쪽 가장자리에서 1.3 c m 있다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
- 측면과 하단 스페이서를 준비 합니다.
- 잘라 3 고밀도 폴 리 에틸렌 (HDPE)에서 상자 당 스페이서 또는 구매 두 미리 잘라 측면 스페이서 (0.635 cm 두께 2.5 c m, 길이 57 c m), 한 미리 잘라 아래쪽 공백 (0.635 cm 두께, 폭 2.5 c m, 길이 40.5 c m). 자료의 테이블을 참조 하십시오.
- 측면과 상자 아래쪽 전면 및 후면 패널 사이의 스페이서를 맞춥니다. 핸드 드릴 또는 드릴 프레스를 사용 하, 전면에 기존 구멍을 통해 드릴 고 구멍 모든 3 개의 층에 깔끔하게 통과 되도록 다시.
- 클램프를 사용 하 여 레이어 배치 또는 설치 하 여 볼트, 너트, 그리고 각 와셔의 조합을 새로 구멍을 뚫고 (단계 3.1 참조).
2. 상자 아래쪽에 폴 리 에스테 타격의 스트립의 설치
참고: 이용이 스페이서 사이 관절을 통해 새 기에서 토양 및 물 되지 것입니다.
- 폴 리 에스테 여 넓은 2.5 cm로 타율을 잘라 40.5 cm 긴 스트립 ( 테이블의 자료를 참조).
- 후면 패널 평면 및 그것의 위에 스페이서 거짓말, 하단 공백 바로 위에 타격을 최고 패널 (그림 2) 제자리에.
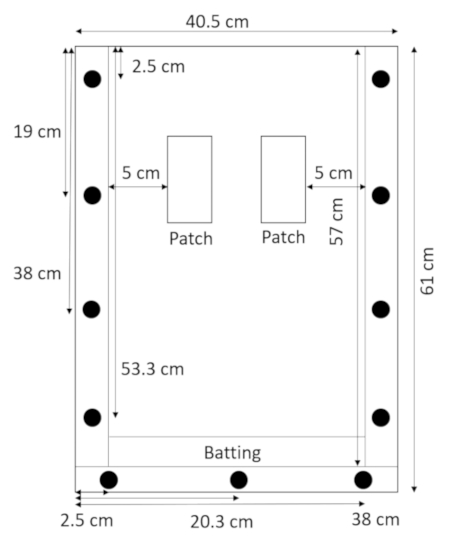
그림 2: 조립 타격과 rhizobox. rhizobox의 하단에 타격의 좁은 스트립 밖으로 유출에서 토양 및 모래를 방지 합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
3입니다. 어셈블리는 Rhizoboxes의
- Rhizoboxes 20 스레드 나사 (0.635 cm 직경에 의해 3.2 cm 길이), 세탁기 (0.635 cm 내부 직경), 육각 너트 (나사에 맞게 테이블의 자료를 참조 하십시오 크기를 사용 하 여 조립.
- 세탁기, 전면 패널, 스페이서, 후면 패널, 세탁기, 그리고 육각 너트를 통해 각 나사를 조입니다. 나사는 매우 빡 빡; ㄴ 다는 것을 확인합니다 상자는 느슨하게 조립은, 토양 패널 및 측면 스페이서 사이 격차를 통해 밖으로 유출 된다.
참고: 아크릴 쉽게 긁 히, 고 흠집 루트 측정을 방해할 수 있습니다, 그래서 주의 조립된 박스 처리. 보호 자료 들 사이 위치 하지 않는 한 스택 상자를 하지 마십시오. - 상자 당 2 명의 패치 스페이서 (간격 장치 치료 및 제어 패치를 생성 하는 데 사용)를 준비 합니다. 잘라 스페이서에서 고밀도 폴 리 에틸렌 (HDPE) 시트 또는 그들 자르는 (0.635 cm 두께, 너비 3.8 c m, 길이 28 m; 참조 테이블의 재료)를 구입. 하나는 드릴 구멍 0.635 cm 각 공백, (그림 3) 중간 라인을 따라 위에서 2 cm 직경에.
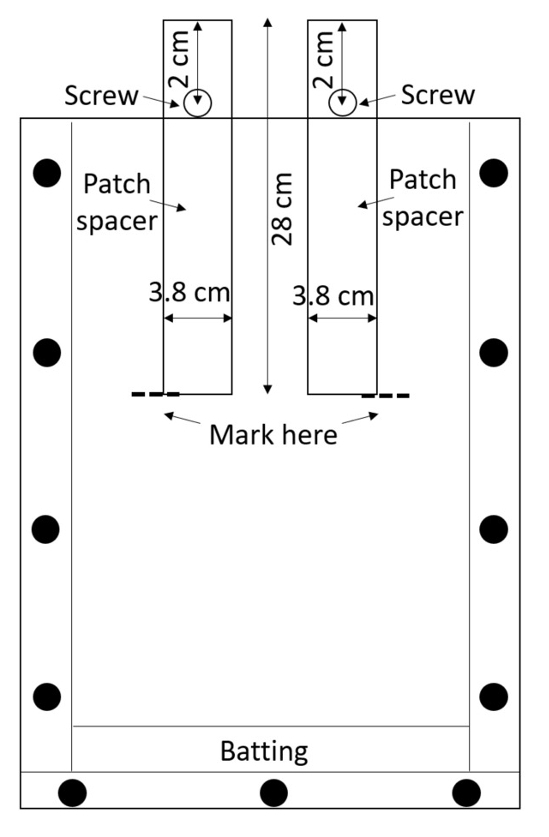
그림 3: 스페이서 패치. 나사 센터의 고밀도 폴 리 에틸렌 스트립을 통해 삽입 상자에 떨어지기에서 그들을 유지. rhizobox 같은 건 주변의 흙으로 가득, 토양 침수, 이며 같은 건 빈 치료 및 제어 패치를 남겨두기 위하여 제거 됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
- 너트와 함께 각 구멍을 통해 나사를 보호 하는 스페이서 부분적으로에 삽입 될 수 있는 rhizobox 나사가 그것을 방지할 수 때까지 추가 (그림 3).
참고: 같은 건 주위 토양 접촉은 고는 스페이서 제거, 두 개의 빈 공간 유지 됩니다 때 하 수 가득 치료 패치 질소를 포함 하 고 제어 패치에 대 한 적절 한 기판.
4. 건물 PVC 프레임 각도에서 Rhizoboxes를 지원 하기 위해
참고: 상자 각도에 배치 됩니다, gravitropism 모든 뿌리 추적에 대 한 표시 되도록 후면 패널에 대 한 성장 뿌리 장려 것 이다. 그림 4 에서 rhizobox를 유지 하는 프레임에에서는 폴 리 염화 비닐 (PVC) 치수는 벤치에 약 55 ° 각도.
- 1.3 cm 직경 PVC 상자 당 13 조각을 잘라: 2 × 44 ㎝ 길이, 3 × 42 c m 길이, 2 × 36.3 c m 길이, 2 × 25.4 cm 길이, 및 4 × 3.8 cm 길이 ( 재료의 표참조).
참고: 절단 톱 효율성과 심지어 상처에 대 한 매우 좋습니다. - 4 × 2 방향 팔꿈치, 2 × 3 방향 팔꿈치, 그리고 4 T-조인트 ( 재료의 표참조)를 사용 하 여 그림 4와 같이 상자를 조립 하.
참고: 프레임 추가 접착제 없이 안정 되어야 하지만 필요한 경우 PVC 접착제를 사용할 수 있습니다.
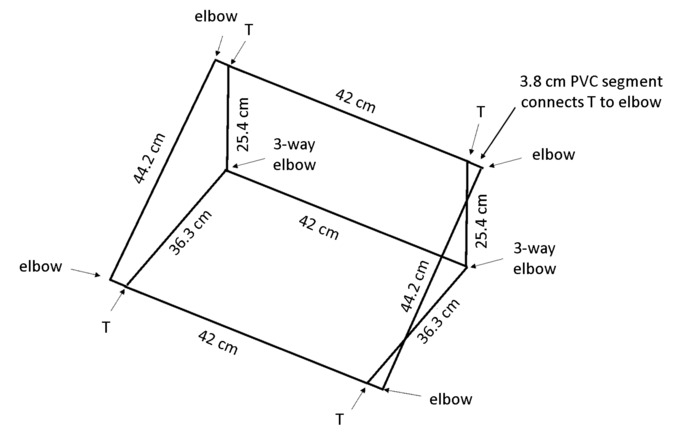
그림 4: rhizoboxes를 지원 하기 위해 프레임. 경량 프레임 PVC 지정 된 길이를 잘라내어 표시 공동 종류를 사용 하 여 연결에서 생성 됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
5. 바느질 빛과 열을 반영 하기 위해 보호 케이스
참고: 뿌리 하지 마십시오 빛을, 그래서 이러한 경우 있는지 확인 하기 위해 빛을 제외 관찰 루트 소성 응답 빛 회피와 영양 소스 패치에 의해 구동 됩니다. 빛 부족 직물 또한 열 스트레스를 피할 수 있도록 rhizoboxes, 내부 온도 감소.
- 빛 부족 직물 (전문된 자료를 1 개의 측에 백색과 검정에) 조각 약 95 c m 폭 및 길이 69 c m으로 잘라 ( 재료의 표참조). 상자 당 한 조각이 필요 합니다.
- 47.5 c m × 69 c m 소매를 긴 가장자리를 따라 반으로 각 부분을 접어. 데님, 중장비 퀼 팅 실, 좁은 솔 기를 위한 재봉틀 바늘을 사용 하 여, 하단 및 각 소매의 측면까지 방법의 ¾ 따라 바느질. 안전 핀 함께 위쪽 모서리를 고정 합니다.
6. 1:1 (V/V) 토양의 준비: 모래는 Rhizoboxes을 채우기 위해 기판
- 약 1000 cm3 상자 당 (관심 사이트)에서 필드 토양을 수집 합니다. 60 ° c.에 얕은 쟁반에 일정 한 무게에 토양을 건조
참고:이 실험에 대 한 토양 0\u201210 cm 깊이에서 유기적으 관리 되는 옥수수 밭에서 수확 직후 수집 되었다. - 박격포와 유 봉 2 mm 체를 통과 하는 토양을 갈아. 알려진된 볼륨 토양의 무게에 의해 토양의 대량 밀도 측정 합니다.
- 모래 (놀이 모래, 철물점에서 저렴 하 게 구입하실 수 있습니다; 테이블의 자료참조) 등을 대량 밀도 측정 합니다.
- 동일한 볼륨 모래와 흙을 양동이로 측정 하 고 철저 하 게 혼합. 퍼 널을 사용 하 여 채우기 위해 상자 천천히 그리고 고르게 2.5 cm, 상단에서 떨고 기판 정착 되도록 상자 없이. 이 볼륨 기판;의 측정 약 1,272 cm3이어야 한다.
- 각 상자에 필요한 모래의 질량을 얻기 위해이 절반 볼륨에 의해 모래의 대량 밀도 곱하면 됩니다. 각 상자에 필요한 토양의 질량을 얻기 위해 토양의 대량 밀도와 같은 마십시오.
참고: 필드 토양 및 모래가이 실험에 사용, 이것은 모래와 흙, 774 g 976 g 하지만이 금액 사용 토양의 대량 밀도 따라 달라 집니다. - Rhizobox 당 하나의 큰 지퍼 탑 비닐 봉투 라벨, 무게는 가방에 모래와 흙의 적절 한 대 중 하 고 철저 하 게 균질.
- 이 1:1 토양 분석-고 영양 콘텐츠 및 15N의 자연적인 풍부 (δ15N)에 대 한 기판.
7. 기판 준비 치료 및 컨트롤 패치
- 두 개의 작은 지퍼 탑 비닐 봉지 당 rhizobox, 치료 패치 한 컨트롤 패치 한 라벨. 30 g는 토양의 무게: 각 큰 가방 (단계 6.6)에서 기판 두 해당 작은 가방에 모래.
- 치료 패치에 대 한 15질소 N 표시 된 소스와 기판 믹스. 이 위해 15N 표시 된 식물 잔류물 또는 다른 N-소스 1 g으로 무게 (금액 조정 될 수 있다으로 원하는) 각 치료 가방 (작은 지퍼 상단 가방)에 철저 하 게 혼합 하 고.
참고:이 실험을 위해 15N 표시 된 클로버와 야생 완 두 잔류물의 혼합물은 사용 됩니다. 클로버, 야생 완 두 씨앗 질 석과 모래를 1:1 믹스에 심어 져 있었고 온실 조건 하에서 성장. 식물 했다 이온된 수로 매일 물 이나 긴 애쉬 튼 솔루션13 15N 표시 된 질소 소스 포함의 1/100 강도 두번 주간. 모든 지상 바이오 매스 건조, 고 2 mm 체를 통과 하 땅, 후에 4 주에 수확 했다. 다른 영양소를 선택 하면 해당 요소는 토양에서 모바일 하는 경우에 특히 leaching에 대 한 테스트 파일럿 실험은 좋습니다. 느리게 출시 형태의 영양소를 사용할 수 또는 다른 rhizobox 디자인 leaching (예를 들어, 별도 구획10) 필요한 경우 제한 선택 될 수 있습니다.
8. 로드와 기판, Rhizobox와 치료 및 컨트롤 패치
- 각 빈 rhizobox 무게 하 고 나중에 사용에 대 한 가중치를 기록 합니다.
- 까지 나사 더에서 그들을 방지 한 rhizobox에 (단계 3.2 참조) 두 명의 패치 스페이서를 삽입 합니다. Rhizobox (그림 3) 측면에 빛 마크 아래쪽 가장자리의 깊이 표시 하 고는 스페이서를 제거 합니다.
- 줄기 오프닝 퍼 널을 사용 하 여 rhizobox 오프닝으로 좁은, 표시 된 깊이에 기판의 해당 큰 가방에서 rhizobox를 작성. 앞뒤로 천천히 그리고 고르게 퍼 널을 이동 기판 균일 하 게 칠 하 고 우선 흐름 채널을 생성 하지 않습니다.
- 기판 수준에 표시 된 깊이 도달 하면, 상자의 양쪽에서 5 cm에 다시는 스페이서를 넣어. 기판 (기판 가방에 남아 있어야 함) 상자 위에서 대략 5 cm는 될 때까지 상자를 채우는 것을 계속 한다.
- 각 공백 주위 철저 하 게 젖은.
참고:이 실험에서이 물방울이 미터 각 스페이서의 외부 가장자리와 rhizobox의 측면과 두 스페이서 사이 균등 하 게 물을 붓는 50 mL 사이 삽입을 통해 물 50 mL를 제공 함으로써 달성 되었다. 느린 관개는 균일 한 일로 필요 합니다. - 흙이 젖은, 패치에 대 한 빈 구멍을 떠나는 동안에 스페이서를 제거 합니다.
- 각 rhizobox의 외부에 투명 필름 테이프 ( 재료의 표참조). 치료로 1 개의 측 및 제어로 표시 하 고 퍼 널을 사용 하 여 적절 한 가방에서 패치를 입력 합니다. 영구 마커를 사용 하 여 투명도에 각 패치의 경계를 추적 합니다.
- 나머지 기판으로는 rhizobox를 균등 하 게 채우십시오. 투명도에 기판의 상단을 추적 합니다.
- 나머지 rhizoboxes를 반복 합니다. 수확에 대 한 모든 가방을 저장 합니다.
9.도 60%에 급수 물 보유 용량
참고: 토양 수 분이이 양의 무산 소 조건 또는 조류 성장 개발을 방지 하는 동안 가뭄 스트레스를 겪고에서 식물을 방지 하기 위해 발견 되었습니다.
- 기판14의 물 보유 용량 (WHC)를 측정 합니다.
- 각 상자;의 이상적인 무게를 계산 여기 물 보유 용량을 60%에서 기판의 무게와 함께 빈 rhizobox의 무게의 합으로 정의.
- 곱하기는 WHC (물의 그램 / 그램 건조 기판의) 물 질량을 얻기 위해 0.6으로 60%에서 기판에 개최 WHC. 건조 기판의 질량을 질량 15N 소스의이 질량을 추가 합니다.
- 위에서 얻은 숫자를 각 상자의 빈 무게를 추가 한다.
- 그들은 입력 된 상자를 무게. 9.2 단계에서 계산 그것의 이상적인 중량 (g)에서이 시점에서 각 상자 (g)의 무게를 뺍니다. 천천히 그리고 고르게 물이이 양의 (mL)에 드 물 (디)를 이온화.
참고:이 단계를 수행할 수 있습니다 또는 물방울 관개를 사용 하 여 손으로 급수. 손으로 급수 하는 경우 이기종 토양 수 분 조건 및 우대 흐름 채널에 더 많은 것을 추가 하기 전에 완전히 여과를 물을 수 있습니다.
10. 씨앗 발 아 및 이식
- Unplanted 컨트롤을 사용 하 여, 그 rhizoboxes를 따로 설정.
- 표면-소독 옥수수 씨앗 5 %NaOCl, 1 분 후 디 물에 철저 하 게 린스 교 반에 의해.
참고:이 실험에서 6 다른 옥수수 genotypes의 씨앗 루트 소성 genotypic 차이 조사 하기 위하여 사용 되었다. - 접시 안에 (예를 들어, Kimwipe) 젖은 연구소 조직에 그들을 배치 하 고 다른 촉촉한 조직으로 취재 하 여 멸 균된 씨를 출 아 할. 거기에 서 있는 물 서는 안됩니다. 48\u201272 h는 radicle 그냥 등장 하기 시작 때까지 어두운 장소에서 장소 페 트리 요리.
- 좁은 주걱을 사용 하 여 각 rhizobox의 센터에서 2.5 c m 깊이 구멍을 파 다. 보장 하는 radicle 지향 직접 구멍에 세균된 씨 이식 아래쪽.
참고:는 radicle은 어느 패치 향해 직각, 편 파 수는 루트 성장 속도의 비교. - 투명도에 씨앗의 위치를 추적 합니다.
- 씨와 디 물 50 mL를 함께 물 커버.
11. 식물 성장
- 25 일 (원하는 만큼) 식물 성장, 60%를 유지 하 WHC 성장 기간 내내. 뿌리를 추적 하 여 모니터 루트 성장입니다.
- 그것은 그것의 이상적인 무게 5g 이내까지 모든 3\u20124 일 및 물 각 상자 무게. 급수는 rhizoboxes 4 일 패널의 분리를 촉진 하기 위하여 수확을 하기 전에 중지 합니다. 잡 초를 손으로 자주를 제거 관심의 식물 뿌리만 있는지.
- 영구 마커를 사용 하 여 각 추적 하루를 명확 하 게 구별할 수 색 3\u20124 일 마다 보이는 뿌리를 추적.
참고: 다른 직경 마커 원하는 경우 기본 및 측면 루트에 사용할 수 있습니다. 그것은 주관의 학위 관련 여러 연구 추적 뿌리 될 경우에 특히 이후 또는 다른 주문 또는 직경의 뿌리는 다른 표식으로 구분할 경우 처음에 루트 추적에 대 한 조건을 정의 하려면 유용할 수 있습니다. 이 실험에서 양쪽에 보이는 뿌리를 추적 하 여 박스의 한 면에만 보이는 뿌리를 추적의 정확성 테스트 하 고 세척 하 고 뿌리를 스캔 하 여 측정 하는 전체 루트 길이 스캔된 투명에 측정 총 루트 길이 비교 합니다. 추적 및 스캔 루트 길이 사이의 상관 관계 여부 다시 투명도 또는 두 투명 사용 되었다에 중요 했다. 따라서 그냥 후면 패널에 보이는 뿌리를 추적할 수 있다.
12. 촬영, 수확 및 분석에 대 한 루트와 토양 샘플을 얻기
- 첫 번째 rhizobox 누워 평평 하 고 모든 나사를 제거.
- 촬영 샘플을 수확. 기지에서 촬영 클립, 디 물, 어떤 흙을 씻어 내 고 60 ° c.에 건조 갈기는 박격포와 유 봉 2 mm 체를 통과 하 여 동위 원소 분석 (섹션 14 참조)에 대 한 주석 캡슐에 샘플이 무게으로 쏜다.
- 치료 및 제어 패치 주위 면도칼으로 잘라 가이드로, 투명도 사용 하 여. 숟가락이 나 주걱을 사용 하 여 각각 치료 또는 컨트롤 가방에는 뿌리와 접착 rhizosphere 토양을 특 종.
참고: 별도 rhizosphere 토양에 존재 하는 많은 방법, 식물의 영향을 받아 토양 뿌리15, 그리고 그라데이션 보다는 엄격히 delineated 영역16는 rhizosphere 여겨질 수 있다, 하는 동안이 방법은 널리 사용 되 17떨고 후 식물의 뿌리에 고착 하는 토양의 정의입니다. - 세 번째 가방으로 나머지 뿌리와 토양을 특 종.
- 처리, 제어, 고 기판, 모든 보이는 뿌리 또는 파편 제거에서 뿌리를 분리 하는 2 mm 체를 통해 샘플을 대량 > 고급 핀셋으로 길이 1 cm. 이러한 샘플 3 루트의 총 다른 별도 및 3 기판 샘플 계속.
13. 경시 및 상대 루트 성장 속도의 추정의 유효성 검사
- 처리, 제어, 검색 하 고 샘플을 대량 루트 길이 계산.
- 한 번에 하나의 예제와 함께 working, 뿌리 신중 하 게 모든 나머지 기판 제거 하 디 물으로 린스. 뿌리는 중복 하지 있도록 명확한 쟁반에 샘플을 정렬 합니다.
- 루트 분석 소프트웨어 (예: WinRhizo)와 호환 되는 스캐너를 사용 하 여 샘플을 검색 합니다. 이미지 배경에서 안정적으로 뿌리를 구별 하는 소프트웨어 보정 됩니다 확인 하십시오.
- 전체 루트 길이 관심 (예를 들어, < 0.2 m m, 0.2\u20120.4 m m, 0.4\u20120.8 m m, 0.8\u20121.6 m m, > 1.6 m m)의 직경 클래스에서 루트 길이 측정 하는 소프트웨어를 사용 합니다.
- 루트 길이 밀도 (RLD) 치료 및 제어 패치 및 각 rhizobox에 대 한 전체적으로 계산 합니다.
- 각 투명도에 추적 영역을 곱하여 계산 처리 및 제어 패치의 볼륨 (단계 8.1 참조) 0.635 cm, 상자의 깊이 의해. 해당 볼륨을 사용 하 여 각 패치에서 총 루트 길이 사용 하 여 치료 및 제어 패치에서 루트 길이 밀도 계산 (단계 13.1.3 참조).
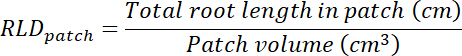
- 투명도에 추적 영역을 곱하여 계산 각 rhizobox에 기판의 볼륨 (단계 8.1 참조)에 의해 0.635 cm. 계산 RLD 치료 및 제어 패치에 관해서는.
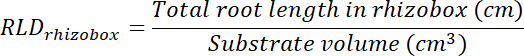
- 각 투명도에 추적 영역을 곱하여 계산 처리 및 제어 패치의 볼륨 (단계 8.1 참조) 0.635 cm, 상자의 깊이 의해. 해당 볼륨을 사용 하 여 각 패치에서 총 루트 길이 사용 하 여 치료 및 제어 패치에서 루트 길이 밀도 계산 (단계 13.1.3 참조).
- 스캔 한 루트 시스템을 비교 하 여 메서드를 추적 하 고 추적 이미지 루트를 확인 합니다.
- 각 투명도 검사 하 고 전체 루트 길이 소프트웨어를 사용 하 여 계산. 성장에 대 한 스캔된 이미지 저장 속도 계산 합니다.
- 전체 루트 길이 측정, 제어, 처리의 합계 및 각 상자에 대 한 샘플을 대량 (단계 13.1.3 참조).
- 통계적으로 유의 한 상관 관계 인지를 확인 전체 루트 길이의 스캔 및 추적 측정 테스트.
참고: 그렇다면, 추적 방법의 유효성을 검사 하 고 각 시간 지점에서 상대 성장 속도 계산할 수 있다. 그렇지 않은 경우에 스캔된 루트 시스템 데이터 루트 성장의 정확한 표시를 제공 합니다. 이 경우 추적 방법론 일치 하지 않은 경우 또는 뿌리 예를 들어 모든 genotypes에 대 한 동일 하 게 표시 되지 않은 경우 수 있습니다.
- 추적 메서드는 유효성을 검사 하는 경우 각 rhizobox에 대 한 상대적인 루트 성장 속도 계산 합니다.
- 교정 치료, 컨트롤, 전체 루트 길이 측정 하 여 각 시간 지점에서 샘플을 대량 선택한 추적 색상 구분 하 루트 분석 소프트웨어를 사용 합니다. 각 시간 지점에서 누적 총 루트 길이 계산 합니다.
- 치료 및 각 시간 간격 t1-t2 에 대 한 컨트롤 패치 뿐만 아니라 각 rhizobox에 대 한 상대적인 루트 성장 속도 (RGR루트)를 다음과 같이 계산 합니다.
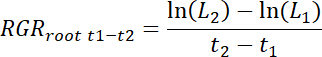
참고: 여기 L1 패치 (11.3에서 누적 합계) 총 루트 길이 t (DAT) 이식 후1 일 이며 L2는 t2 DAT. 패치 총 루트 길이
14. 15N 루트, 촬영, 및 치료 토양 샘플 중 분할의 분석
- 60 ° C에서 건조 뿌리 그리고 바이오 매스, 무게 2 mm 체를 통과 하는 그 라인 드.
- 60 ° c.에 치료 토양의 건조 샘플이
- 촬영과 같이 뿌리와 주석 캡슐에 치료 패키지.
참고: 이상적인 샘플 무게 캡슐 당 싹, 뿌리, 및 토양 분석에 대 한 총 N의 목표 금액을 달성 하기 위해 자료의 예상된 c/N 비율에 따라 별도로 계산 되어야 한다. 샘플에 대 한 자세한 제출 하는 안정 동위 원소 시설에 문의. 이 실험에 대 한 샘플 준비 지침 및 샘플 무게 계산기 UC 데이비스 안정 동위 원소 시설을 제공한 뒤18했다.
주의: 캡슐에 포장 전에 균등 하 게 샘플을 혼합 하 여 여러 캡슐 샘플 당 준비 특별 한 주의. 샘플 균등 하 게 혼합 되지 15N의 명백한 복구 원래 현재 금액을 초과할 수 있습니다. - 총 N, δ15, 및 각 촬영, 루트 및 치료 토양 샘플의 15N 콘텐츠를 분석 합니다.
참고:이 실험에서 식물 샘플 분석 되었다 연소를 통해 PDZ 유로 파 머-GSL 원소 분석기 PDZ 유로 파 20-20 동위 원소 비율 질량 분석기에서 UC 데이비스 안정 동위 원소 시설 (UCD SIF) 인터페이스와 함께. 토양 샘플은 PDZ 유로 파 20-20 동위 원소 비율 질량 분 서 계에 UCD SIF 인터페이스 Elementar Vario 엘 큐브 원소 분석기로 분석 되었다. - 양을 계산 15공장에서 라벨에서 얻은 N의 촬영 및 샘플 루트.
- 첫째, 15N 대기 15N 각 풀 15P *초과 금액 계산:
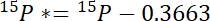
여기서 15P 관심의 수영장의 원자에서 15N 콘텐츠입니다. - 둘째, 15N 대기 15N 레이블에서 15L *초과 금액 계산:
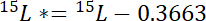
여기서 15L 레이블이 N 소스의 원자에서 15N 콘텐츠입니다. - 셋째, 각 풀, Np에 총 N의 계산:
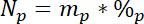
여기서 mp 는 풀 (예: 총 건조 촬영 또는 루트 바이오 매스)와 %p 의 질량은 그 풀의 N의 %. - 마지막으로, 레이블, Nl에서 얻은 N의 양을 계산 하 Ndff 방정식19 에 14.5.1\u201214.5.3의 결과 사용:
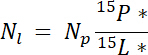
참고: Ndff 방정식은 식물에 의해 복구 되는 레이블이 지정 된 소스에서 N의 양을 결정 하는 데 사용 됩니다. 그것은 가정 동위 원소 차별 N 통풍 관 식물에 의해 발생 하는 일반적으로 N 소스 풍부한 ~1\u201210%19.
- 첫째, 15N 대기 15N 각 풀 15P *초과 금액 계산:
Access restricted. Please log in or start a trial to view this content.
결과
뿌리는 상자 뒷면에 대 한 우선적으로 성장 예상. 총은 400에서 상자의 앞에 93-758 cm에 비해 1956 cm에 배열 했다 상자 뒷면에 루트 길이 추적. 스캔된 루트 길이와 상자, 상자, 다시의 앞에 추적된 루트 길이 없음을 피어슨 상관 계수 계산 그리고 전면 및 후면의 합 여부 전체 루트 길이 반영 정확 하 게 추적 확인 하 사용 되었다 (n = 23, 한 상자에 공장 사망 실험 기간 동안). 스?...
Access restricted. Please log in or start a trial to view this content.
토론
이 프로토콜에서 설명 하는 rhizoboxes 루트 및 rhizosphere 과학, 다양 한 질문에 대답 하 고 다양 한 사용 하 여 다른10,20,21,,2223 발견을 사용할 수 있습니다. , 24 , 25. 다른 연구자의 rhizoboxes21,,<...
Access restricted. Please log in or start a trial to view this content.
공개
저자는 공개 없다.
감사의 말
저자 제 케이 힐 뿐만 아니라 그들의 의견에 대 한 익명 검토자와 rhizobox 프로토콜 개발에 대 한 초기 지침에 대 한 탄 바오를 인정 하 고 싶습니다. 음식과 농업 연구, 식품 및 농업, 농업 실험 역 프로젝트 캘리포니아-D-PLS-2332-H, ag는 하의 미국 농 무부 (USDA) 국립 연구소에 대 한 재단에 의해와 UC 데이비스 부 식물에 의해 제공 된 자금 화목 제를 통해 과학
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| 1.27 cm diameter PVC pipe | JM Eagle | 530048 | 305 cm per box, cut into lengths as specified in the protocol |
| PVC side elbows | Lasco | 315498 | 2 per box |
| PVC 90-degree elbows | Charlotte | PVC 02300 0600 | 4 per box |
| PVC T joints | Charlotte | PVC 02402 0600 | 4 per box |
| Extruded acrylic panes | TAP Plastics | N/A | 2 per box, 0.64 cm thick x 40.5 cm wide x 61 cm long |
| HDPE spacers (sides) | TAP Plastics | N/A | 2 per box, 0.64 cm thick x 2.5 cm wide x 57 cm long |
| HDPE spacers (bottom) | TAP Plastics | N/A | 1 per box, 0.64 cm thick x 2.5 cm wide x 40.5 cm long |
| HDPE spacers (patch) | TAP Plastics | N/A | 2 per box, 0.64 cm thick x 3.8 cm wide x 28 cm long |
| Polyester batting | Fairfield | #A-X90 | 2.5 cm x 40.5 cm strip per box |
| 20-thread screws | N/A | N/A | 3.2 cm long, 0.64 cm diameter |
| Washers | N/A | N/A | 0.64 cm internal diameter |
| Hex nuts | N/A | N/A | sized to fit the screws |
| Light deprivation fabric | Americover, Inc. | Bold 8WB26.5 | 1 piece 95 cm wide and 69 cm long per box |
| Sand | Quikrete | No. 1113 | |
| Field soil | N/A | N/A | |
| Transparencies for tracing | FXN | FXNT1319100S | One per side of the box to be traced |
참고문헌
- Hodge, A. Roots: The Acquisition of Water and Nutrients from the Heterogeneous Soil Environment. Progress in Botany 71. , 307-337 (2010).
- Grossman, J. D., Rice, K. J. Evolution of root plasticity responses to variation in soil nutrient distribution and concentration. Evolutionary Applications. 5 (8), 850-857 (2012).
- Melino, V. J., Fiene, G., Enju, A., Cai, J., Buchner, P., Heuer, S. Genetic diversity for root plasticity and nitrogen uptake in wheat seedlings. Functional plant biology. , Available from: http://agris.fao.org/agris-search/search.do?recordID=US201600101375 (2015).
- Zhang, H., Forde, B. G. An Arabidopsis MADS box gene that controls nutrient-induced changes in root architecture. Science. 279 (5349), 407-409 (1998).
- Hodge, A., Stewart, J., Robinson, D., Griffiths, B. S., Fitter, A. H. Competition between roots and soil micro-organisms for nutrients from nitrogen-rich patches of varying complexity. Journal of Ecology. 88 (1), 150-164 (2000).
- Trachsel, S., Kaeppler, S. M., Brown, K. M., Lynch, J. P. Shovelomics: high throughput phenotyping of maize (Zea mays L.) root architecture in the field. Plant and Soil. 341 (1-2), 75-87 (2011).
- Rogers, E. D., Monaenkova, D., Mijar, M., Nori, A., Goldman, D. I., Benfey, P. N. X-ray computed tomography reveals the response of root system architecture to soil texture. Plant Physiology. , (2016).
- Groleau-Renaud, V., Plantureux, S., Guckert, A. Effect of mechanical constraint on nodal and seminal root system of maize plants. Comptes Rendus De L Academie Des Sciences Serie Iii-Sciences De La Vie-Life Sciences. 321 (1), 63-71 (1998).
- Lin, Y., Allen, H. E., Di Toro, D. M. Barley root hair growth and morphology in soil, sand, and water solution media and relationship with nickel toxicity. Environmental Toxicology and Chemistry. 35 (8), 2125-2133 (2016).
- Wenzel, W. W., Wieshammer, G., Fitz, W. J., Puschenreiter, M. Novel rhizobox design to assess rhizosphere characteristics at high spatial resolution. Plant and Soil. 237 (1), 37-45 (2001).
- Spohn, M., Carminati, A., Kuzyakov, Y. Soil zymography - A novel in situ method for mapping distribution of enzyme activity in soil. Soil Biology and Biochemistry. 58, 275-280 (2013).
- Vollsnes, A. V., Futsaether, C. M., Bengough, A. G. Quantifying rhizosphere particle movement around mutant maize roots using time-lapse imaging and particle image velocimetry. European Journal of Soil Science. 61 (6), 926-939 (2010).
- Hewitt, E. J. Sand and Water Culture Methods Used in the Study of Plant Nutrition. , Commonwealth Bureau. London. (1966).
- Choudhary, M. I., Shalaby, A. A., Al-Omran, A. M. Water holding capacity and evaporation of calcareous soils as affected by four synthetic polymers. Communications in Soil Science and Plant Analysis. 26 (13-14), 2205-2215 (1995).
- Bakker, P. A. H. M., Berendsen, R. L., Doornbos, R. F., Wintermans, P. C. A., Pieterse, C. M. J. The rhizosphere revisited: root microbiomics. Frontiers in Plant Science. 4, 2013(2013).
- McNear, D. H. Jr The Rhizosphere - Roots, Soil, and Everything In Between. Nature Education Knowledge. 4 (3), 1(2013).
- Ortas, I. Determination of the extent of rhizosphere soil. Communications in Soil Science and Plant Analysis. 28 (19-20), 1767-1776 (1997).
- UC Davis Stable Isotope Facility. Carbon (13C) and Nitrogen (15N) Sample Preparation. , Available from: https://stableisotopefacility.ucdavis.edu/13cand15nsamplepreparation.html (2018).
- Barraclough, D. 15N isotope dilution techniques to study soil nitrogen transformations and plant uptake. Fertilizer research. 42 (1-3), 185-192 (1995).
- Belter, P. R., Cahill, J. F. Disentangling root system responses to neighbours: identification of novel root behavioural strategies. AoB PLANTS. 7, (2015).
- Nagel, K. A., et al. GROWSCREEN-Rhizo is a novel phenotyping robot enabling simultaneous measurements of root and shoot growth for plants grown in soil-filled rhizotrons. Functional Plant Biology. 39 (11), 891-904 (2012).
- Adu, M. O., Yawson, D. O., Bennett, M. J., Broadley, M. R., Dupuy, L. X., White, P. J. A scanner-based rhizobox system enabling the quantification of root system development and response of Brassica rapa seedlings to external P availability. Plant Root. 11, 16-32 (2017).
- Neumann, G., George, T. S., Plassard, C. Strategies and methods for studying the rhizosphere-the plant science toolbox. Plant and Soil. 321 (1-2), 431-456 (2009).
- Bodner, G., Alsalem, M., Nakhforoosh, A., Arnold, T., Leitner, D. RGB and Spectral Root Imaging for Plant Phenotyping and Physiological Research: Experimental Setup and Imaging Protocols. JoVE (Journal of Visualized Experiments). (126), e56251-e56251 (2017).
- Kuchenbuch, R. O., Ingram, K. T. Image analysis for non-destructive and non-invasive quantification of root growth and soil water content in rhizotrons. Journal of Plant Nutrition and Soil Science. 165 (5), 573-581 (2002).
- Dresbøll, D. B., Thorup-Kristensen, K., McKenzie, B. M., Dupuy, L. X., Bengough, A. G. Timelapse scanning reveals spatial variation in tomato (Solanum lycopersicum L.) root elongation rates during partial waterlogging. Plant and Soil. 369 (1-2), 467-477 (2013).
- Wu, J., et al. RhizoChamber-Monitor: a robotic platform and software enabling characterization of root growth. Plant Methods. 14 (1), 44(2018).
- Rogers, S. W., Moorman, T. B., Ong, S. K. Fluorescent In Situ Hybridization and Micro-autoradiography Applied to Ecophysiology in Soil. Soil Science Society of America Journal. 71 (2), 620-631 (2007).
- Eickhorst, T., Tippkötter, R. Detection of microorganisms in undisturbed soil by combining fluorescence in situ hybridization (FISH) and micropedological methods. Soil Biology and Biochemistry. 40 (6), 1284-1293 (2008).
- Spohn, M., Kuzyakov, Y. Distribution of microbial- and root-derived phosphatase activities in the rhizosphere depending on P availability and C allocation - Coupling soil zymography with 14C imaging. Soil Biology and Biochemistry. 67, 106-113 (2013).
- Lv, G., Kang, Y., Li, L., Wan, S. Effect of irrigation methods on root development and profile soil water uptake in winter wheat. Irrigation Science. 28 (5), 387-398 (2010).
- Asseng, S., Ritchie, J. T., Smucker, A. J. M., Robertson, M. J. Root growth and water uptake during water deficit and recovering in wheat. Plant and Soil. 201 (2), 265-273 (1998).
- Hernandez-Ramirez, G., et al. Root Responses to Alterations in Macroporosity and Penetrability in a Silt Loam Soil. Soil Science Society of America Journal. 78 (4), 1392-1403 (2014).
- Zhang, Y. L., Wang, Y. S. Soil enzyme activities with greenhouse subsurface irrigation. Pedosphere. 16 (4), 512-518 (2006).
- Robinson, D., Hodge, A., Griffiths, B. S., Fitter, A. H. Plant root proliferation in nitrogen-rich patches confers competitive advantage. Proceedings of the Royal Society of London B: Biological Sciences. 266 (1418), 431-435 (1999).
- Lobet, G., Draye, X. Novel scanning procedure enabling the vectorization of entire rhizotron-grown root systems. Plant Methods. 9, 1(2013).
- Swarup, R., Wells, D. M., Bennett, M. J. Root Gravitropism. Plant Roots: The Hidden Half. , (2013).
- Smit, A. L., Bengough, A. G., Engels, C., van Noordwijk, M., Pellerin, S., van de Geijn, S. C. Root Methods: A Handbook. , Springer Science & Business Media. (2000).
- van Dusschoten, D., et al. Quantitative 3D Analysis of Plant Roots Growing in Soil Using Magnetic Resonance Imaging1[OPEN]. Plant Physiology. 170 (3), 1176-1188 (2016).
- Metzner, R., et al. Direct comparison of MRI and X-ray CT technologies for 3D imaging of root systems in soil: potential and challenges for root trait quantification. Plant Methods. 11, 17(2015).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유