Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Оптимизированный протокол Rhizobox для визуализации рост корня и реагировать локализованных питательные вещества
В этой статье
Резюме
Визуализация и измерения корень роста в situ является чрезвычайно сложной задачей. Мы представляем настраиваемый rhizobox метод для отслеживания корневого разработки и распространения со временем в ответ на обогащение питательными веществами. Этот метод используется для анализа кукурузы генотипического различия в корень пластичности в ответ на источник органического азота.
Аннотация
Корни являются заведомо трудно учиться. Почва является визуальные и механические барьер, затрудняет отслеживание корни в situ без разрушительных урожая или дорогостоящего оборудования. Мы представляем настраиваемый и доступной rhizobox метод, который позволяет неразрушающего визуализации рост корня с течением времени и особенно хорошо подходит для изучения пластичность корня в ответ на патчи локализованных ресурсов. Этот метод был подтвержден оценки кукурузы генотипического различия в пластичности ответы патчи, содержащий 15N-меченых бобовых остатков. Методы описаны для получения представительной развития измерений со временем, измерения плотности длина корня в патчи содержащие ресурсов и управления, расчета темпов роста корня и определить 15N восстановления растений корни и побеги. Также обсуждаются преимущества, предостережения и потенциального будущего применения метода. Хотя ухода должны быть приняты для обеспечения что экспериментальных условиях не смещения корня роста данных, протокол rhizobox, представленные здесь дает надежные результаты, если осуществляется с достаточным вниманием к деталям.
Введение
Хотя часто упускается из виду по сравнению с их коллегами-трава, корни играют важную роль в приобретение растений питательных веществ. Учитывая существенные углерода стоимость корневой строительства и технического обслуживания, растения эволюционировали механизмов для разработки корней, только когда взятка стоит инвестиций. Корневые системы могут таким образом эффективно и динамически шахты ресурсов патчи, размножающихся в горячих точках, upregulating темпы поглощения, и быстро translocating питательных веществ к флоэма для дальнейшей перевозки1. Пластичность ответы могут широко варьироваться среди растений видов и генотипов2,3 и в зависимости от химической формы питательных веществ участвующих в4,5. Вариации в корень пластичности следует продолжить, как понимание сложных корень ответы на гетерогенных почвенных ресурсов может информировать селекции и стратегии управления для повышения эффективности использования питательных веществ в сельском хозяйстве.
Несмотря на свою необходимость и актуальность для понимания систем растений визуализации и количественного определения пластичность корня на соответствующих уровнях создает технические проблемы. Раскопки корень корону из почвы (6«shovelomics») является распространенным методом, но тонкой корни использовать небольшие поры между агрегатов почвы, и раскопки неизбежно приводит к некоторой степени утраты этих хрупких корней. Кроме того разрушительные урожай делает невозможным следовать изменения в одной корневой системы с течением времени. В situ тепловизионные методы, такие как рентгеновская компьютерная томография позволяют прямой визуализации корней и почвенных ресурсов в высокое пространственное разрешение7, но стоят дорого и требуют специализированного оборудования. Гидропонное эксперименты избежать ограничений, связанных с извлечение корней из почвы, но корень морфологии и архитектуры различаются в водной среде по сравнению с механической ограничений и биофизических сложности почвах8,9. Наконец ризосфере процессы и функции не могут быть интегрированы с развития пластичности в этих искусственных средств массовой информации.
Мы представляем собой протокол для строительства и использования rhizoboxes (узкая, ясно сторонняя прямоугольные контейнеры) как лоу кост, настраиваемый метод характеризуют рост корней в почве с течением времени. Специально разработанные рамки поощрения корни растут преимущественно против задней панели из-за геотропизм, повышение точности измерения длины корня. Rhizoboxes обычно используется для изучения роста корней и ризосфере взаимодействия10,11,12, но представленные здесь метод предлагает преимущество в простоте с его сингл купе дизайн и недорогой материалы и предназначен для изучения корня ответы на локализованных питательных веществ. Однако метод также может быть адаптирована для изучения ряда других процессов корня и ризосфере например intra/межвидовые конкуренции, пространственного распределения химических соединений, микробы или активность фермента. Здесь мы исследуем генотипического различия между гибриды кукурузы в ответ на патчи 15N-меченых бобовых остатков и выделить представителя результаты для проверки метода rhizobox.
протокол
1. Подготовка передней и задней панелей и распорки
- Подготовьте передней и задней панели.
- Вырезать две части ясно 0,635 см толщиной акриловые до 40,5 см Ширина 61 см длиной в коробке или приобрести предварительно вырезанные кусочки (см. Таблицу материалы).
- Используя сверло предназначен для акрила, просверлите отверстия диаметром 1,3 см от боковых граней в 2,5, 19, 38 и 53,3 см от верхней 0,635 см. Просверлите отверстия 1,3 см от нижнего края в 2,5, 20,3 и 38 см с левой стороны (рис. 1).
Примечание: Это наиболее эффективно использовать пресс дрель для стека листов шести до десяти в то время, но может также использоваться ручная дрель. - Удалите любые защитные покрытия из акрила и осторожно очистите обе панели перед монтажом коробки.
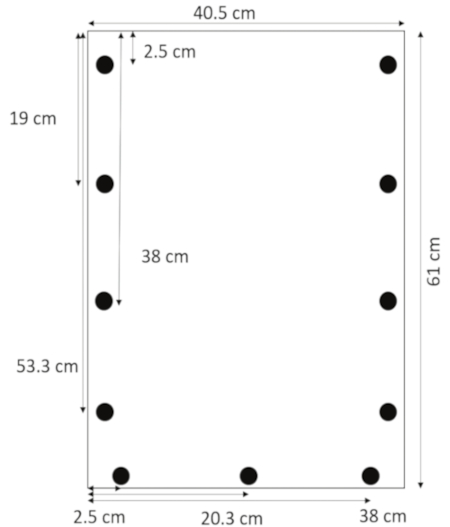
Рисунок 1: макет просверленных отверстий. Отверстия, просверленные 1,3 см от боковых граней в 2,5, 19, 38 и 53,3 см от верхней и 1,3 см от нижнего края в 2,5, 20,3 и 38 см от левого края. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
- Подготовьте и снизу распорки.
- Вырежьте три распорки в коробке из полиэтилена высокой плотности (HDPE) или приобрести две нарезанные стороне распорки (0,635 см толщиной, шириной 2,5 см, длиной 57 см) и один нарезанные нижней распорку (0,635 см толщиной, шириной 2,5 см, 40,5 см длиной). Смотрите в таблице материалов.
- Совместите распорки между передней и задней панелями по бокам и внизу окна. С помощью ручной дрели или пресс дрель, просверлите через существующие отверстия в передней и обратно таким образом, чтобы отверстия пройти через все три слоя чисто.
- Держите слои место с помощью хомутов или установив сочетание болты, гайки и шайбы в каждом недавно просверлил отверстие (см. шаг 3.1).
2. Установка полосы Синтепух в нижней части коробки
Примечание: Это позволит предотвратить почвы и воды от утечки через стыки между прокладками.
- Вырезать полиэстер, ватин в 2,5 см, широкие, 40,5 см длиной полосы (см. Таблицу материалов).
- С задней панели лежа с плоским и распорки поверх него заложить ватин непосредственно над нижней распорку и удерживать его на месте с верхней панели (Рисунок 2).
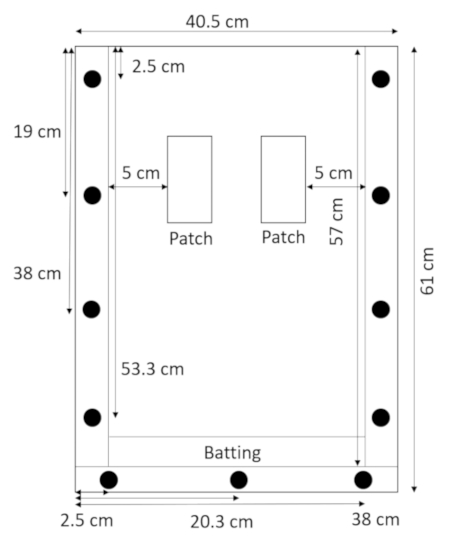
Рисунок 2: собрал rhizobox с ватин. Узкая полоса ватин в нижней части rhizobox предотвращает утечки почвы и песка. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
3. Ассамблея Rhizoboxes
- Соберите rhizoboxes, используя винты 20-поток (3,2 см длины с диаметром 0,635 см), шайбы (внутренний диаметр 0,635 см) и шестигранной гайки (размером Ввинтить винты, смотрите Таблицу материалов.
- Затяните каждый винт через шайбу, передней панели, прокладку, задней панели, Стиральная машина и шестиугольную гайку. Убедитесь, что винты очень туго; Если поле собрал слабо, почвы будет проливаться через зазоры между панелями и стороне распорки.
Примечание: Акрил легко царапается и царапины могут мешать измерения корень, так обработки собранных коробок с осторожностью. Избегайте укладки коробки, если защитный материал помещается между ними. - Подготовьте две распорки патч (прокладки, которые будут использоваться для создания патчей лечения и управления) в коробке. Вырезать распорки из полиэтилена высокой плотности (ПЭВП) листы или приобрести их предварительного разреза (0,635 см толщиной, 3,8 см, 28 см длиной; см. Таблицу материалы). Просверлите отверстие одной 0,635 см в диаметре в каждом распорка, 2 см от верхней вдоль осевой линии (рис. 3).
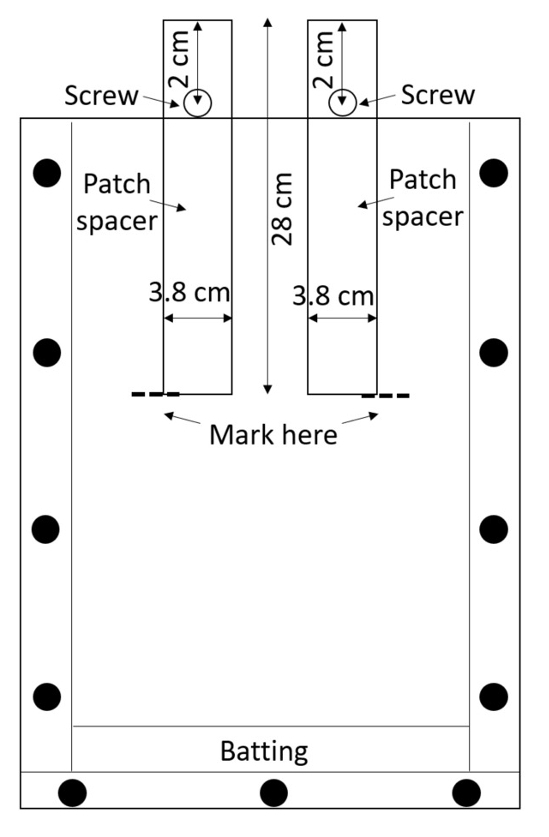
Рисунок 3: патч распорки. Винты, вставленные через центр HDPE полоски держать их от попадания в поле. Rhizobox наполнен почвы вокруг прокладки, увлажненные почвы и прокладки удаляются для того, чтобы оставить пустым лечения и управления патчи. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
- Зафиксируйте винт через каждое отверстие с гайкой, чтобы распорка может быть частично вставлен в rhizobox до тех пор, пока винт предотвращает его идя дальше (рис. 3).
Примечание: Когда почва смоченные вокруг прокладки и прокладки удаляются, останется две пустые пространства, может быть заполнена соответствующей субстраты для азот содержащие патч лечения и управления патч.
4. здание ПВХ рамы для поддержки Rhizoboxes на угол
Примечание: Когда поле помещается под углом, геотропизм будет поощрять корни расти против задней панели, так что все корни видны для трассировки. Поливинилхлорид (ПВХ) размеры в рисунке 4 результат в рамке, которая поддерживает rhizobox на приблизительно 55 ° угол скамейки.
- Вырезать 13 части 1,3 см в диаметре ПВХ в коробке: 2 × 44 см длиной, 3 × 42 см длины, 2 × 36,3 см длины, 2 × 25,4 см длины и 4 × 3,8 см длины (см. Таблицу материалы).
Примечание: Чоп видел настоятельно рекомендуется для эффективности и даже сокращения. - Используйте 4 × 2-полосная локти, 2 × 3-полосная локти и 4 Т-суставов (см. Таблицу материалы) для сборки в поле, как показано на рисунке 4.
Примечание: Фреймы должны быть стабильными без дополнительных клея, но ПВХ клей может использоваться при необходимости.
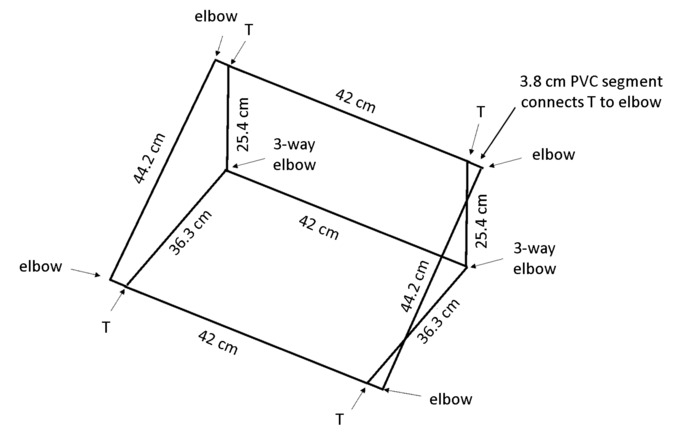
Рисунок 4: рамка для поддержки rhizoboxes. Легкий каркас изготовлен из ПВХ сократить до указанной длины и связаны с использованием совместных типов указал. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
5. швейная защитные чехлы для отражения света и тепла
Примечание: Корни избежать свет, поэтому эти случаи исключать свет для того, чтобы убедиться, которые отметила, что ответы пластичность корня определяются источником питательных веществ в патчи, а не свет избежания. Ткань легких лишения также уменьшает температуру внутри rhizoboxes, помогая избежать теплового стресса.
- Нарезать кусочки примерно 95 см шириной и длиной 69 см ткани легких лишения (специализированный материал, который является черно -белое с одной стороны с другой) (см. Таблицу материалы). Один кусок в коробке не требуется.
- Каждый кусок сложите пополам вдоль длинной стороны сформировать 47.5 см × 69 см рукав. С помощью иглы для швейных машин, предназначенных для денима, тяжелых выстегивать поток и узким швом, пришейте вдоль нижней и пути вверх в сторону каждый рукав ¾. Закрепите верхние углы вместе с булавкой.
6. Подготовка почвы 1:1 (V/V): песок субстрат для заполнения Rhizoboxes
- Собирают около 1000 см3 поля почвы (от сайта интересов) в коробке. Сухие почвы до постоянной массы в мелкой лотков при температуре 60 ° C.
Примечание: Почвы для этого эксперимента была собрана, сразу же после сбора урожая в органически управляемых кукурузное поле от 0\u201210 см (глубина). - Размолоть почва с ступку и пестик, чтобы пройти через сито 2 мм. Измерения объемной плотности почвы путем взвешивания известный объем почвы.
- Получения песка (например, песок игры, который можно недорого приобрести в хозяйственном магазине; см. Таблицу материалы) и измерения объемной плотности.
- Отмерьте равных объемов песка и почвы в ведро воды и тщательно перемешать. Используйте воронку для заполнения поле медленно и равномерно до 2,5 см от верхней, без встряхивания поле, чтобы вызвать субстрат урегулировать. Измерить этот объем субстрата; Она должна быть около 1 272 см3.
- Умножьте насыпная плотность песка на половину этого объема до получения массы песка, необходимых для каждого поля. Сделайте то же самое с насыпной плотностью почвы до получения массы почвы, необходимых для каждого поля.
Примечание: Для поля почвы и песка, используемые в этом эксперименте, это было 976 г песка и 774 г почвы, но эти суммы будут варьироваться в зависимости от объемной плотности почвы используется. - Пометить один большой пакет zip Топ на rhizobox, весят соответствующей массы песка и почвы в мешок и гомогенизации тщательно.
- Анализ этой почвы 1:1- и субстрат для содержания питательных веществ и естественный обилие 15N (δ15N).
7. Подготовка основания для лечения и управления патчи
- Ярлык два небольших пластиковых пакетов zip топ в rhizobox, один для лечения патч и один для патча контролю. Вес 30 г почвы: песок субстрат из каждой большой мешок (шаг 6.6) в двух соответствующих малых мешков.
- Смешайте субстрат с источником азота N-меченых 15для лечения патч. Для этого, весят, 1 g 15N-меченых растительных остатков или других N-источника (сумма может быть скорректирована по желанию) в каждый мешок лечение (мешочек zip Топ) и тщательно перемешать.
Примечание: Для этого эксперимента, была использована смесь 15N-меченых клевера и Вика остатков. Семена клевера и Вика были посажены в 1:1 смесь вермикулита и песка, а выращиваемые в тепличных условиях. Растения были поливал ежедневно с дейонизированной водой и два раза в неделю с 1/100 прочностью Лонг-Эштон решение13 15азота N-меченых источников. Все надземной биомассы было собрано на четыре недели после посадки, сушеные и наземное пройти через сито 2 мм. Если выбран другой питательных веществ, особенно, если этот элемент является мобильным в почве, экспериментальные эксперименты для проверки для выщелачивания поощряются. Медленно релиз форм питательных веществ могут быть использованы или другой rhizobox дизайн может быть выбран для ограничения выщелачивания (например, отдельные отсеки10) при необходимости.
8. Загрузка Rhizobox с подложкой и создание лечения и управления патчи
- Вес каждой пустой rhizobox и запишите весов для последующего использования.
- Вставьте две распорки патч (см. шаг 3.2) в один rhizobox до тех пор, пока винт мешает им идти дальше. Марк глубина нижнего края с отметкой света на стороне rhizobox (рис. 3) и удалите распорные детали.
- Используя воронку с стволовых открытия, что, как узкие как открытие rhizobox, заполните rhizobox от соответствующего большой мешок субстрата на отмеченные глубину. Воронка взад и вперед медленно и равномерно водите так что субстрат заполняет равномерно и не создавать льготные потоком каналов.
- Субстрат достижении заметного глубины, положите распорки обратно в 5 см с каждой стороны коробки. Продолжить заполнение коробки до тех пор, пока уровень субстрата составляет приблизительно в 5 см от верхней части окна (должно быть субстрата, оставаясь в сумке).
- Влажные тщательно вокруг каждую распорку.
Примечание: В этом эксперименте, это было достигнуто путем предоставления 50 мл воды через капельные эмиттеры вставлены между внешним краем каждую распорку и на стороне rhizobox и лить 50 мл воды равномерно между двумя распорки. Медленно орошения необходимо равномерное смачивание. - Удалите распорные детали, в то время как почва мокрый, оставляя пустой полости для исправления.
- Лента прозрачная пленка снаружи каждого rhizobox (см. Таблицу материалы). Марк одной стороны как лечение и один элемент управления и заполнить патчи от соответствующие пакеты, используя воронку. Трассировки границ каждого патч на прозрачности с помощью постоянного маркера.
- Заполните rhizobox равномерно с оставшихся субстрата. Трассировки в верхней части субстрата на прозрачности.
- Повторите для остальных rhizoboxes. Сохраните все мешки для сбора урожая.
9. даже полива до 60% водоудерживающей способности
Примечание: Это количество влаги в почве было обнаружено для предотвращения растений от испытывают стресса, обусловленного засухой, предотвращая развитие бескислородные условия или роста водорослей.
- Измерьте водоудерживающей способности (ЦВН) субстрат14.
- Рассчитать идеальный вес каждой коробки; Здесь определяется как сумма веса пустой rhizobox сочетании с весом субстрата на 60% водоудерживающей способности.
- Умножить КВН (граммов воды / граммов сухого субстрата) от 0,6 до получения массы воды, состоявшегося в субстрат в 60% КВН. Добавьте эту массу масса сухого субстрата и масса 15N источника.
- Добавьте пустой вес каждой коробки на номер, полученные выше.
- Вес коробки, после того, как они были заполнены. В этот момент из своего идеального веса (в g) рассчитаны на шаге 9.2 вычтите вес каждой коробки (в g). Воды с этого объема (в мл) де ионизированной воды (DI), медленно и равномерно.
Примечание: Этот шаг может быть сделано с использованием капельного орошения и полива вручную. Если полив вручную, дайте воде процеживать полностью перед добавлением больше, чтобы избежать разнородные влажности почвы и преференциальных поток каналы.
10. семян всхожесть и трансплантации
- При использовании unplanted элементов управления, установите эти rhizoboxes сторону.
- Поверхность стерилизации семян кукурузы при перемешивании за 1 мин в 5% NaOCl, затем промыть тщательно в воде ди.
Примечание: В этом эксперименте, семена шести различных генотипов кукурузы были использованы для того чтобы расследовать генотипического различия в корень пластичности. - Стерилизованные семена прорастают, поместив их на мокрой Лаборатория ткани (например, Kimwipe) внутри чашки Петри и покрытия с другой влажной ткани. Не должно быть каких-либо стоячей воды. Место Петри в темном месте для 48\u201272 h до тех пор, пока корешок только начинает появляться.
- Узкой лопаточкой вырыть яму глубиной 2,5 см в центре каждого rhizobox. Пересадка проросшие семена в отверстие, обеспечивая, что корешок ориентирован непосредственно вниз.
Примечание: Если корешок под углом к любой патч, Сравнение темпов роста корня будет предвзятым. - Трассировка местоположение семян на прозрачности.
- Обложка, семян и воды с помощью DI воды до 50 мл.
11. растения рост
- Растут растения на 25 дней (или покуда желаемого), поддержание 60% КВН на протяжении всего вегетационного периода. Отслеживать рост корня, отслеживание корни.
- Вес каждой коробки каждый 3\u20124 дней и воды до тех пор, пока оно находится в пределах 5 g своего идеального веса. Остановите полива rhizoboxes четыре дня до сбора урожая для облегчения разделения панелей. Удаление сорняков вручную часто так, что присутствуют только корни растений интерес.
- Проследить корни видны каждые 3\u20124 дней с помощью постоянного маркера с четко различимых цветов для каждого дня трассировки.
Примечание: Маркеры разного диаметра может использоваться для основного и боковые корни, при желании. Это может быть полезно определить критерии для корня трассировки в начале, поскольку степень субъективности участвует, особенно если несколько исследователей будет отслеживание корни или если корни различных заказов или диаметр следует отличать с различными маркерами. В этом эксперименте точность отслеживания видимых корни только на одной стороне коробки была протестирована путем отслеживания видимых корни с обеих сторон и сравнение общего корня длина измеряется на отсканированных пленки для общего корня длина измеряется мойки и сканирование корни. Корреляция между проследить и отсканированные корень длиной был значительным независимо от того, использовались ли только задней прозрачности или обе пленки. Таким образом можно проследить только видимые корни на задней панели.
12. сбор побегов и получение Root и образцы почвы для анализа
- Положите первый rhizobox плоские и удалите все винты.
- Урожай образцы стрелять. Обрезать побеги на базе, смойте любой почвы с ди водой и высушить при температуре 60 ° C. Молоть стреляет с ступку и пестик, чтобы пройти через сито 2 мм и весят проб в олова капсулы для изотопного анализа (см. раздел 14).
- Используя в качестве руководства прозрачность, обвести лечения и управления патчи с бритвой. Используйте ложкой или лопаточкой, чтобы выкопать корни и придерживаясь ризосфере почвы в соответствующих лечения или контроля мешок.
Примечание: Хотя многие методы существуют отдельные ризосфере почву, почву под влиянием растений корни15и ризосфере можно считать градиент, а не строго разграничены зоны16, этот метод следует широко используется определение почвы, которая придерживается к корням растений после встряхивания17. - SCOOP оставшиеся корни и почвы в третий мешок.
- Пройти лечение, управления и массовых проб через сито 2 мм для разделения корни от субстрата, удаление каких-либо видимых корни или фрагменты > 1 см в длину с тонкой пинцетом. Держите эти проб отдельно друг от друга для в общей сложности три корня и три субстрата.
13. Проверка Прориси и оценки темпов роста относительного корня
- Сканировать лечения, управления и сыпучих образцов и вычисления длины корня.
- Работая с одного образца, в то время, промойте корни тщательно с ди водой, чтобы удалить любые оставшиеся субстрата. Организовать образцов в подносе ясно, так что корни не являются перекрывающимися.
- Проверка образцов с помощью сканер совместим с корневой программного обеспечения для анализа (например, WinRhizo). Убедитесь, что программное обеспечение откалиброван надежно отличать корни от фонового изображения.
- Используйте программное обеспечение для измерения общего корня и корень длиной в классах диаметра интереса (например, < 0,2 мм, 0.2\u20120.4 мм, 0.4\u20120.8 мм, 0.8\u20121.6 мм, > 1,6 мм).
- Вычислите корень длиной плотность (RLD) для лечения и контроля патчи и для каждого rhizobox в целом.
- Рассчитать объем лечения и управления патчи, умножая области на каждом транспарентности (см. шаг 8.1) на 0,635 см, Глубина коробки. Использовать эти тома для расчета плотности длина корня в лечения и управления патчи, используя общий корень длиной в каждый патч (см. шаг 13.1.3).
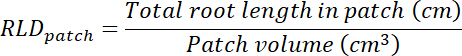
- Рассчитать объем субстрата в каждом rhizobox путем умножения области прослежены на прозрачности (см. шаг 8.1) на 0,635 см. рассчитать RLD что касается лечения и управления патчи.
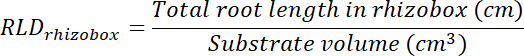
- Рассчитать объем лечения и управления патчи, умножая области на каждом транспарентности (см. шаг 8.1) на 0,635 см, Глубина коробки. Использовать эти тома для расчета плотности длина корня в лечения и управления патчи, используя общий корень длиной в каждый патч (см. шаг 13.1.3).
- Проверка корень трассировка метода путем сравнения отсканированных корневых систем и проследить изображений.
- Сканирование каждого прозрачности и рассчитать длину всего корня с помощью программного обеспечения. Сохранение сканированного изображения для роста скорость вычислений.
- Сумма измерений длины общий корень лечения, управления и сыпучих образцов для каждого поля (см. шаг 13.1.3).
- Протестируйте отсканированных и проследить измерения длины всего корень ли статистически значимые корреляции.
Примечание: Если это так, метод трассировки проверяется, и темпы относительного роста могут быть рассчитаны на каждом этапе. Если нет, то только отсканированные корневой системы данных обеспечивает точное указание роста корней. Это может быть случай, если трассировка методология согласуется или если корни не были столь же видимым для всех генотипов, например.
- Если был апробирован метод трассировки, рассчитайте темпы роста относительного корня для каждого rhizobox.
- Используйте программное обеспечение анализа корневых калиброванные различать цвета выбранной трассировки для измерения длины всего корня в лечении, управления и сыпучих образцов в каждый момент времени. Рассчитайте совокупный общий корень длиной в каждый момент времени.
- Рассчитайте темпы роста относительного корня (РГРкорень) для каждого rhizobox, а также для лечения и управления патчи для каждого времени интервал t1-t2 следующим образом.
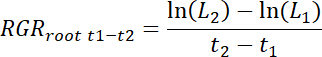
Примечание: Здесь L1 — общий корень длиной в патч (нарастающая сумма от 11,3) t1 дней после трансплантации (DAT) и L2— длина всего корня в патч на t2 DAT.
14. анализ 15N секционирования среди образцов почвы корень, стрелять и лечение
- Сухие корни при 60 ° C, весят биомассы и молоть пройти через сито 2 мм.
- Сухой проб почвы лечения при температуре 60 ° C.
- Пакет корни и лечения в олова капсулы с побегами.
Примечание: Вес идеальный образец на капсулу рассчитывается отдельно побегов, корни и почвы на основе сметных соотношение материала для достижения целевой суммы всего N для анализа. Связаться с Фондом стабильных изотопов, где образцы должны быть представлены для получения дополнительной информации. Для этого эксперимента образец инструкции по подготовке и калькулятор веса образца, предоставляемые Фондом стабильного изотопа UC Дэвис были после18.
Предупреждение: Уделять особое внимание mix образцы равномерно перед упаковкой в капсулы и подготовить несколько капсул на сэмпл. Если образцы не смешаны равномерно, очевидной восстановления 15N может превышать сумму, первоначально настоящего. - Анализ всего N, δ15 и 15N содержание каждого стрелять, корень и лечения образца грунта.
Примечание: В этом эксперименте, образцы растений были проанализированы через сгорания с элементарного анализатор PDZ Europa АНКА-GSL, сопряжена PDZ Europa 20-20 изотоп соотношение масс-спектрометр на объекте стабильного изотопа UC Дэвис (UCD SIF). Образцы почвы были проанализированы с Elementar Vario-Эль-куб Элементаль анализатора сопряжена PDZ Europa 20-20 изотоп соотношение масс-спектрометр в UCD SIF. - Рассчитать сумму 15N, полученные из метки в завод стрелять и корень образцы.
- Во-первых Рассчитайте количество 15N сверх атмосферного 15N в каждом бассейне, 15P *:
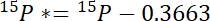
где 15P - 15N содержание в атомной % пула интерес. - Во-вторых Рассчитайте количество 15N сверх атмосферного 15N в метке, 15L *:
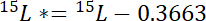
где 15Л — 15N содержание в атомной % помечены N источника. - В-третьих Рассчитайте сумму общего содержания N в каждом бассейне, Np:
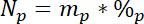
где mp масса пул (например, общий сухой стрелять или корень биомассы) и %p является процент N этого пула. - Наконец используйте результаты 14.5.1\u201214.5.3 в уравнение Ndff19 для вычисления количества N, полученные от лейбла, Nl:
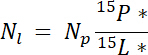
Примечание: Ndff уравнение используется для определения количества N из источника Приклеенные этикетку, который восстанавливается путем растений. Он предполагает, что дискриминации не изотопный происходит во время N поглощение завода и как правило действует для N источников обогащенный ~1\u201210%19.
- Во-первых Рассчитайте количество 15N сверх атмосферного 15N в каждом бассейне, 15P *:
Результаты
Корни преференциально вырос против обратно в коробку, как ожидалось. Длина всего проследить корня на задней части коробки, колебались от 400 до 1956 см, по сравнению с 93-758 см на передней панели. Были рассчитаны парные коэффициенты корреляции Пирсона между отсканированные ...
Обсуждение
Rhizoboxes, описанных в настоящем Протоколе может использоваться для разнообразных ответов в корень и ризосфере науки и обнаружили, что различные использует других10,-20,-21,-22,-23 , 24 ,
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Авторы хотели бы признать анонимные отзывы для их обратной связи, а также J.C. Кэхилл и Tan Bao для первоначальные руководящие указания по разработке протокола rhizobox. Финансирование было предоставлено Фондом для продовольствия и сельского хозяйства исследований, США Департамента из сельского хозяйства (USDA) Национального института продовольствия и сельского хозяйства, сельскохозяйственной опытной станции проекта CA-D-PLS-2332-H, чтобы а.г. и UC Davis отдела завода Наук через стипендий для и.с.
Материалы
| Name | Company | Catalog Number | Comments |
| 1.27 cm diameter PVC pipe | JM Eagle | 530048 | 305 cm per box, cut into lengths as specified in the protocol |
| PVC side elbows | Lasco | 315498 | 2 per box |
| PVC 90-degree elbows | Charlotte | PVC 02300 0600 | 4 per box |
| PVC T joints | Charlotte | PVC 02402 0600 | 4 per box |
| Extruded acrylic panes | TAP Plastics | N/A | 2 per box, 0.64 cm thick x 40.5 cm wide x 61 cm long |
| HDPE spacers (sides) | TAP Plastics | N/A | 2 per box, 0.64 cm thick x 2.5 cm wide x 57 cm long |
| HDPE spacers (bottom) | TAP Plastics | N/A | 1 per box, 0.64 cm thick x 2.5 cm wide x 40.5 cm long |
| HDPE spacers (patch) | TAP Plastics | N/A | 2 per box, 0.64 cm thick x 3.8 cm wide x 28 cm long |
| Polyester batting | Fairfield | #A-X90 | 2.5 cm x 40.5 cm strip per box |
| 20-thread screws | N/A | N/A | 3.2 cm long, 0.64 cm diameter |
| Washers | N/A | N/A | 0.64 cm internal diameter |
| Hex nuts | N/A | N/A | sized to fit the screws |
| Light deprivation fabric | Americover, Inc. | Bold 8WB26.5 | 1 piece 95 cm wide and 69 cm long per box |
| Sand | Quikrete | No. 1113 | |
| Field soil | N/A | N/A | |
| Transparencies for tracing | FXN | FXNT1319100S | One per side of the box to be traced |
Ссылки
- Hodge, A. Roots: The Acquisition of Water and Nutrients from the Heterogeneous Soil Environment. Progress in Botany 71. , 307-337 (2010).
- Grossman, J. D., Rice, K. J. Evolution of root plasticity responses to variation in soil nutrient distribution and concentration. Evolutionary Applications. 5 (8), 850-857 (2012).
- Zhang, H., Forde, B. G. An Arabidopsis MADS box gene that controls nutrient-induced changes in root architecture. Science. 279 (5349), 407-409 (1998).
- Hodge, A., Stewart, J., Robinson, D., Griffiths, B. S., Fitter, A. H. Competition between roots and soil micro-organisms for nutrients from nitrogen-rich patches of varying complexity. Journal of Ecology. 88 (1), 150-164 (2000).
- Trachsel, S., Kaeppler, S. M., Brown, K. M., Lynch, J. P. Shovelomics: high throughput phenotyping of maize (Zea mays L.) root architecture in the field. Plant and Soil. 341 (1-2), 75-87 (2011).
- Rogers, E. D., Monaenkova, D., Mijar, M., Nori, A., Goldman, D. I., Benfey, P. N. X-ray computed tomography reveals the response of root system architecture to soil texture. Plant Physiology. , (2016).
- Groleau-Renaud, V., Plantureux, S., Guckert, A. Effect of mechanical constraint on nodal and seminal root system of maize plants. Comptes Rendus De L Academie Des Sciences Serie Iii-Sciences De La Vie-Life Sciences. 321 (1), 63-71 (1998).
- Lin, Y., Allen, H. E., Di Toro, D. M. Barley root hair growth and morphology in soil, sand, and water solution media and relationship with nickel toxicity. Environmental Toxicology and Chemistry. 35 (8), 2125-2133 (2016).
- Wenzel, W. W., Wieshammer, G., Fitz, W. J., Puschenreiter, M. Novel rhizobox design to assess rhizosphere characteristics at high spatial resolution. Plant and Soil. 237 (1), 37-45 (2001).
- Spohn, M., Carminati, A., Kuzyakov, Y. Soil zymography - A novel in situ method for mapping distribution of enzyme activity in soil. Soil Biology and Biochemistry. 58, 275-280 (2013).
- Vollsnes, A. V., Futsaether, C. M., Bengough, A. G. Quantifying rhizosphere particle movement around mutant maize roots using time-lapse imaging and particle image velocimetry. European Journal of Soil Science. 61 (6), 926-939 (2010).
- Hewitt, E. J. . Sand and Water Culture Methods Used in the Study of Plant Nutrition. , (1966).
- Choudhary, M. I., Shalaby, A. A., Al-Omran, A. M. Water holding capacity and evaporation of calcareous soils as affected by four synthetic polymers. Communications in Soil Science and Plant Analysis. 26 (13-14), 2205-2215 (1995).
- Bakker, P. A. H. M., Berendsen, R. L., Doornbos, R. F., Wintermans, P. C. A., Pieterse, C. M. J. The rhizosphere revisited: root microbiomics. Frontiers in Plant Science. 4, 2013 (2013).
- McNear, D. H. The Rhizosphere - Roots, Soil, and Everything In Between. Nature Education Knowledge. 4 (3), 1 (2013).
- Ortas, I. Determination of the extent of rhizosphere soil. Communications in Soil Science and Plant Analysis. 28 (19-20), 1767-1776 (1997).
- . Carbon (13C) and Nitrogen (15N) Sample Preparation Available from: https://stableisotopefacility.ucdavis.edu/13cand15nsamplepreparation.html (2018)
- Barraclough, D. 15N isotope dilution techniques to study soil nitrogen transformations and plant uptake. Fertilizer research. 42 (1-3), 185-192 (1995).
- Belter, P. R., Cahill, J. F. Disentangling root system responses to neighbours: identification of novel root behavioural strategies. AoB PLANTS. 7, (2015).
- Nagel, K. A., et al. GROWSCREEN-Rhizo is a novel phenotyping robot enabling simultaneous measurements of root and shoot growth for plants grown in soil-filled rhizotrons. Functional Plant Biology. 39 (11), 891-904 (2012).
- Adu, M. O., Yawson, D. O., Bennett, M. J., Broadley, M. R., Dupuy, L. X., White, P. J. A scanner-based rhizobox system enabling the quantification of root system development and response of Brassica rapa seedlings to external P availability. Plant Root. 11, 16-32 (2017).
- Neumann, G., George, T. S., Plassard, C. Strategies and methods for studying the rhizosphere-the plant science toolbox. Plant and Soil. 321 (1-2), 431-456 (2009).
- Bodner, G., Alsalem, M., Nakhforoosh, A., Arnold, T., Leitner, D. RGB and Spectral Root Imaging for Plant Phenotyping and Physiological Research: Experimental Setup and Imaging Protocols. JoVE (Journal of Visualized Experiments). (126), e56251-e56251 (2017).
- Kuchenbuch, R. O., Ingram, K. T. Image analysis for non-destructive and non-invasive quantification of root growth and soil water content in rhizotrons. Journal of Plant Nutrition and Soil Science. 165 (5), 573-581 (2002).
- Dresbøll, D. B., Thorup-Kristensen, K., McKenzie, B. M., Dupuy, L. X., Bengough, A. G. Timelapse scanning reveals spatial variation in tomato (Solanum lycopersicum L.) root elongation rates during partial waterlogging. Plant and Soil. 369 (1-2), 467-477 (2013).
- Wu, J., et al. RhizoChamber-Monitor: a robotic platform and software enabling characterization of root growth. Plant Methods. 14 (1), 44 (2018).
- Rogers, S. W., Moorman, T. B., Ong, S. K. Fluorescent In Situ Hybridization and Micro-autoradiography Applied to Ecophysiology in Soil. Soil Science Society of America Journal. 71 (2), 620-631 (2007).
- Eickhorst, T., Tippkötter, R. Detection of microorganisms in undisturbed soil by combining fluorescence in situ hybridization (FISH) and micropedological methods. Soil Biology and Biochemistry. 40 (6), 1284-1293 (2008).
- Spohn, M., Kuzyakov, Y. Distribution of microbial- and root-derived phosphatase activities in the rhizosphere depending on P availability and C allocation - Coupling soil zymography with 14C imaging. Soil Biology and Biochemistry. 67, 106-113 (2013).
- Lv, G., Kang, Y., Li, L., Wan, S. Effect of irrigation methods on root development and profile soil water uptake in winter wheat. Irrigation Science. 28 (5), 387-398 (2010).
- Asseng, S., Ritchie, J. T., Smucker, A. J. M., Robertson, M. J. Root growth and water uptake during water deficit and recovering in wheat. Plant and Soil. 201 (2), 265-273 (1998).
- Hernandez-Ramirez, G., et al. Root Responses to Alterations in Macroporosity and Penetrability in a Silt Loam Soil. Soil Science Society of America Journal. 78 (4), 1392-1403 (2014).
- Zhang, Y. L., Wang, Y. S. Soil enzyme activities with greenhouse subsurface irrigation. Pedosphere. 16 (4), 512-518 (2006).
- Robinson, D., Hodge, A., Griffiths, B. S., Fitter, A. H. Plant root proliferation in nitrogen-rich patches confers competitive advantage. Proceedings of the Royal Society of London B: Biological Sciences. 266 (1418), 431-435 (1999).
- Lobet, G., Draye, X. Novel scanning procedure enabling the vectorization of entire rhizotron-grown root systems. Plant Methods. 9, 1 (2013).
- Swarup, R., Wells, D. M., Bennett, M. J. Root Gravitropism. Plant Roots: The Hidden Half. , (2013).
- Smit, A. L., Bengough, A. G., Engels, C., van Noordwijk, M., Pellerin, S., van de Geijn, S. C. . Root Methods: A Handbook. , (2000).
- van Dusschoten, D., et al. Quantitative 3D Analysis of Plant Roots Growing in Soil Using Magnetic Resonance Imaging1[OPEN]. Plant Physiology. 170 (3), 1176-1188 (2016).
- Metzner, R., et al. Direct comparison of MRI and X-ray CT technologies for 3D imaging of root systems in soil: potential and challenges for root trait quantification. Plant Methods. 11, 17 (2015).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены