A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
פרוטוקול Rhizobox ממוטבת כדי להמחיש צמיחה השורש והיענות לצרכי מזינים לשפות אחרות
In This Article
Summary
להמחיש ומדידת הבסיס לצמיחה בחיי עיר הוא מאוד מאתגר. אנו מציגים שיטה rhizobox להתאמה אישית כדי לעקוב אחר התפתחות שורש והתפשטות לאורך זמן בתגובה העשרה התזונתי. שיטה זו משמשת כדי לנתח את ההבדלים genotypic תירס שורש פלסטיות בתגובה מקור חנקן אורגני.
Abstract
. השורשים קשה לשמצה ללמוד. אדמה הן מחסום ויזואלי ועל מכניים, ומקשה לנהל מעקב אחר שורשי בחיי עיר ללא קציר הרסנית או ציוד יקר. אנו מציגים שיטה rhizobox להתאמה אישית ובמחירים סבירים זה מאפשר את הפריט החזותי הרסניות של צמיחה השורש לאורך זמן, במיוחד ולסדרם ללמוד שורש פלסטיות בתגובה תיקונים משאב מקומי. השיטה אומתה על-ידי הערכת וריאציה genotypic תירס פלסטיות התגובות תיקונים המכיל 15קטניות התווית על-ידי N שאריות. שיטות מתוארים להשיג נציג מדידות התפתחותיות לאורך זמן, למדוד צפיפות אורך הבסיס בכתמים המכיל משאבים ושליטה, לחשב שיעורי צמיחה השורש של לקבוע 15N שחזור על ידי הצמח רוטס & שוטס. יתרונות אזהרות, יישומים אפשריים בעתיד של השיטה נדונים גם. אמנם יש לנקוט על מנת להבטיח כי תנאי הניסוי לא הטיה נתוני צמיחה השורש, פרוטוקול rhizobox המובאת כאן מניבה תוצאות אמינות אם מתבצעת עם מספיק תשומת לב לפרטים.
Introduction
אמנם לעתים קרובות התעלמו לעומת עמיתיהם מעל פני הקרקע, שורשים לשחק תפקיד קריטי ברכישת חומר מזין הצמח. בהינתן העלות פחמן משמעותי של השורש בנייה ותחזוקה, הצמחים התפתחו מנגנונים לפתח שורשים רק איפה ליקוט מזון הוא שווה את ההשקעה. מערכות שורשים יכול ובכך ביעילות, באופן דינמי שלי משאב תיקונים מאת מתרבים בנקודות חמות, upregulating קולטני שערי ספיגת, והחומרים המזינים translocating במהירות שיפה עבור תחבורה נוספות1. תגובות פלסטיות יכולה להשתנות בין צמח מינים או אחרים2,3 , בהתאם את הטופס הכימי של חומר מזין מעורב4,5. וריאציה של השורש פלסטיות לבחון עוד יותר, כמו הבנת שורש מורכבים התגובות משאבי הקרקע הטרוגנית יכול ליידע הרבייה ואסטרטגיות ניהול כדי להגדיל את יעילות חומר מזין בחקלאות.
למרות הצורך שלה רלוונטיות עבור המערכות של מפעל הבנה, להמחיש וכימות שורש פלסטיות-סולמות הרלוונטיים מציב אתגרים טכניים. סטטורי הכתר שורש מן האדמה ("shovelomics"6) היא שיטה נפוצה, אבל השורשים בסדר לנצל נקבוביות קטנות בין קרקע אגרגטים, חפירה, מה שכמובן מוביל במידה מסוימת של אובדן של שורשים אלה שבירים. יתר על כן, קציר הרסני מקל אפשר לעקוב אחר שינויים במערכת השורש אחת לאורך זמן. ב באתרו שיטות הדמיה כגון טומוגרפיה הממחושבת טומוגרפיה אפשר פריט חזותי ישיר של שורשים, משאבי הקרקע רזולוציה מרחבית גבוהה7, אבל הם יקרים, דורשים ציוד מיוחד. ניסויים הידרופוני להימנע אילוצים הקשורים חילוץ שורשים בקרקע, אך השורש מורפולוגיה ואדריכלות נבדלים מדיה מימית בהשוואה אילוצי מכני והמורכבות ביופיזיקלי של קרקעות8,9. לבסוף, תהליכי rhizosphere ופונקציות לא יכול להיות משולב עם פלסטיות התפתחותית בתקשורת מלאכותיים אלה.
אנו מציגים פרוטוקול בנייה ושימוש rhizoboxes (צר, נקי-צידי מלבני מכולות) כשיטה נמוכים, להתאמה אישית כדי לאפיין צמיחה השורש באדמה לאורך זמן. מסגרות שתוכנן במיוחד מעודדים שורשים לגדול מעדיפים נגד הלוח האחורי בשל gravitropism, הגדלת דיוק מדידות אורך הבסיס. Rhizoboxes משמשים ללמוד צמיחה השורש ו rhizosphere אינטראקציות10,11,12, אבל השיטה המובאת כאן מציע יתרון בפשטות עם עיצוב חד-תא וזולה חומרים, והוא נועד ללמוד שורש התגובות מזינים לשפות אחרות. עם זאת, השיטה יכול גם להיות מותאם ללמוד מגוון של תהליכים אחרים בסיס, rhizosphere למשל, תחרות "אינטרה" / המידע, התפוצה המרחבית של תרכובות כימיות, חיידקים או פעילות אנזים. כאן, אנחנו חוקרים genotypic הבדלים בין כלאיים תירס בתגובה טלאים של 15קטניות התווית על-ידי N שאריות והאר נציג תוצאות כדי לאמת את שיטת rhizobox.
Access restricted. Please log in or start a trial to view this content.
Protocol
1. הכנת חזית לוחות האחורי ואת מפרידי
- הכינו את לוחות קדמית ואחורית.
- לחתוך שתי חתיכות של ס מ 0.635 ברור אקריליק עבה 40.5 ס מ לרוחב על 61 ס"מ ארוך לארגז או לרכוש חלקים חתוכות מראש (ראה טבלה של חומרים).
- באמצעות מקדחה המיועדת אקריליק, לקדוח חורים 0.635 ס מ בקוטר 1.3 ס מ לקצה-2.5, 19, 38 ו: 53.3 ס מ מהחלק העליון. לקדוח חורים 1.3 ס מ מהקצה התחתון-2.5, 20.3, ו- 38 ס מ בצד שמאל (איור 1).
הערה: זה יעיל ביותר לשימוש ערימה של שישה עד עשרה גיליונות לי. בכל פעם, אבל תרגיל יד יכול לשמש גם. - להסיר כל כיסויי מגן אקריליק, בעדינות לנקות בשתי החלוניות לפני הרכבת בתיבות.
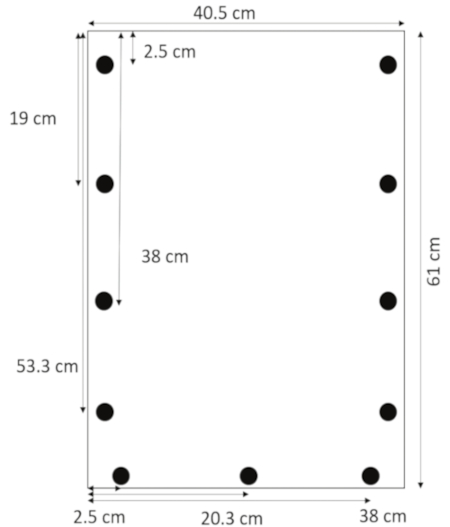
איור 1: הפריסה של קדיחת חורים. חורים הם קדח 1.3 ס מ לקצה 2.5, 19, 38, ו: 53.3 ס מ מהחלק העליון, 1.3 ס מ מהקצה התחתון-2.5, 20.3, ו- 38 ס מ מהשוליים. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
- להכין בצד והתחתון קפיציות.
- חותכים שלושה מפרידי לארגז מפוליאתילן בעל צפיפות גבוהה (HDPE) או לרכוש שני הצד חתוכות מראש מפרידי (0.635 ס מ עבה, רחב של 2.5 ס מ, 57 ס מ), ולא תחתון חתוכות מראש אחד מרווח (0.635 ס מ עבה, רחב של 2.5 ס מ, 40.5 ס מ). עיין בטבלה של חומרים.
- יישר קפיציות בין הלוחות קדמית ואחורית לאורך הצדדים, התחתון של התיבה. באמצעות תרגיל יד או העיתונות קודח, נקדח דרך החורים הקיימים בחזית ובחזרה כך החורים לעבור דרך כל שלוש שכבות נקיה
- להחזיק השכבות במקום באמצעות מלחציים או על-ידי התקנת שילוב של בריחים, אגוזים, דיסקיות בכל לאחרונה קדח חור (ראה שלב 3.1).
2. התקנה של רצועה של החבטות פוליאסטר בחלק התחתון של התיבה
הערה: זה ימנע קרקע ומים דולף דרך המפרקים בין מפרידי.
- לחתוך פוליאסטר החבטות לתוך 2.5 ס מ רחב על ידי 40.5 ס מ באורך רצועות (ראה את הטבלה של חומרים).
- עם הלוח האחורי שוכב שטוח, קפיציות מעליו, להניח את החבטות ישירות מעל מרווח התחתון, שיצמיד אותו למקום עם הפאנל העליון (איור 2).
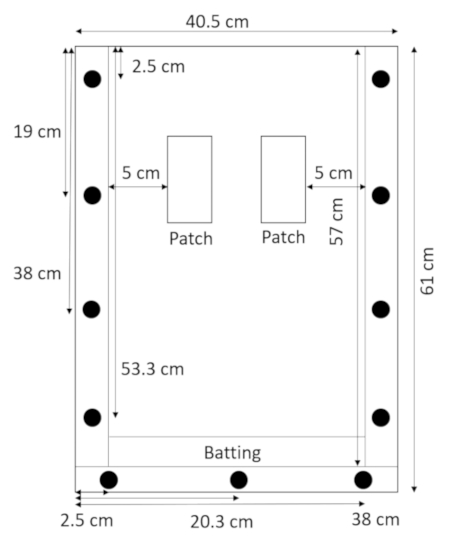
איור 2: מורכבים rhizobox עם החבטות. רצועה צרה של החבטות בתחתית rhizobox מונעת אדמה וחול דולף החוצה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
3. הרכבה של Rhizoboxes
- להרכיב את rhizoboxes באמצעות ברגים 20-חוט (3.2 ס מ אורך ידי 0.635 ס מ קוטר), דיסקיות (0.635 ס"מ קוטר פנימי) אגוזים הקסדצימאלי (בגודל מתאים את הברגים, ראה טבלה של חומרים.
- הדק כל בורג באמצעות מכונת, הפאנל הקדמי, מרווח, בלוח האחורי, מכונת כביסה, כביסה ומייבש אגוזים הקסדצימאלי. ודא הברגים צמוד מאוד; אם התיבה התכנסה באופן רופף, אדמת יישפך באמצעות הפערים בין לוחות הצד מפרידי.
הערה: אקריליק בקלות שרוטה, השריטות יכול להפריע שורש מדידות, אז לטפל בתיבות שהורכב בזהירות. להימנע קופסאות הערימה אלא אם חומר מגן מונחת ביניהם. - להכין שני מפרידי כלי תיקון (מפרידי שישמש כדי ליצור את המדבקות לטיפול ושליטה) לארגז. לחתוך מפרידי מפוליאתילן בעל צפיפות גבוהה (HDPE) גליונות או לרכוש אותם גזור מראש (0.635 ס מ עבה, 3.8 ס מ, 28 ס מ; ראה טבלה של חומרים). לקדוח חור אחד 0.635 ס מ קוטר, כל מרווח, 2 ס מ מהחלק העליון לאורך קו אמצע (איור 3).
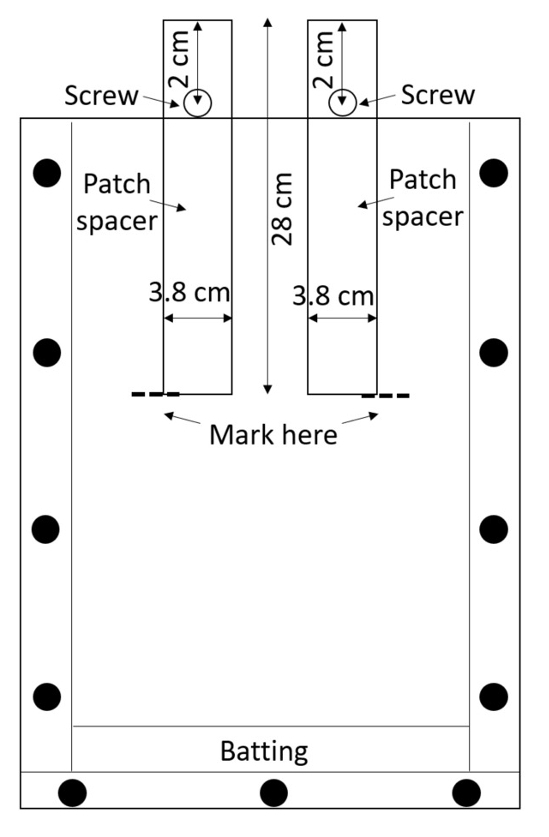
איור 3: תיקון מפרידי. ברגים מוכנס דרך רצועות מרכז של HDPE למנוע מהם ליפול לתוך התיבה. Rhizobox הוא מלא אדמה מסביב קפיציות, האדמה wetted, קפיציות יוסרו כדי להשאיר ריק המדבקות לטיפול ושליטה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
- לאבטח בורג דרך כל חור עם אגוז כך מרווח שניתן חלקית להוסיף את rhizobox עד הבורג המונעת ממנו הולך עוד יותר (איור 3).
הערה: כאשר הקרקע הוא שנרטבו סביב קפיציות קפיציות יוסרו, שני חללים ריקים יישאר זה יכול להיות מלא עם סובסטרטים המתאים עבור תיקון טיפול המכילות חנקן ו תיקון שליטה.
4. בניית PVC מסגרות כדי לתמוך את Rhizoboxes בזווית
הערה: כאשר התיבה ממוקמת בזווית, gravitropism יעודדו שורשים כדי לגדול נגד הלוח האחורי כך רק שורשים גלויים לעקיבה. פוליויניל כלוריד (PVC) מידות בתוצאת איור 4 בתוך מסגרת המתחזק את rhizobox-כ 55 ° זווית לספסל.
- לחתוך חתיכות בקוטר 1.3 ס מ PVC לארגז 13: 2 × 44 ס מ אורך, 3 × 42 ס מ אורך, 2 × 36.3 ס מ אורך, 2 × 25.4 ס"מ אורך ו 4 × 3.8 ס מ אורך (ראה טבלה של חומרים).
הערה: מסור chop מומלץ מאוד יעילות, אפילו חתכים. - השתמש 4 × 2-way המרפקים, 2 × 3-דרך המרפקים, 4 T-המפרקים (ראה טבלה של חומרים) להרכיב את תיבת כמוצג באיור4.
הערה: מסגרות צריך להיות יציב ללא דבק נוספים, אך ניתן להשתמש בדבק PVC במידת הצורך.
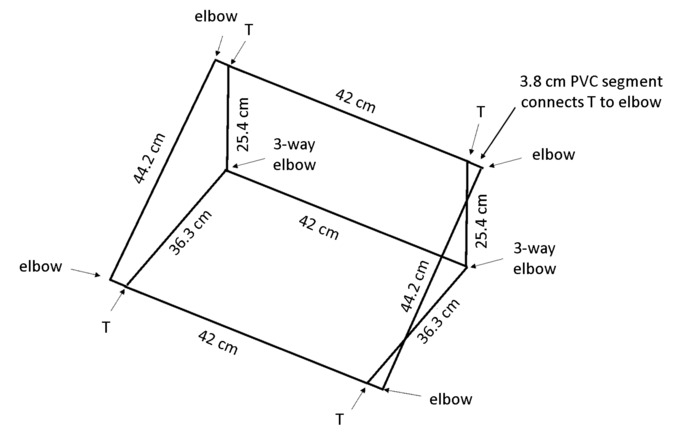
איור 4: מסגרת לתמיכה rhizoboxes. המסגרת קלת משקל בנוי מ- PVC לחתוך את אורך שצוינו, המחוברים באמצעות סוגי משותפת המצוין. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
5. תפירה המקרים מגן כדי לשקף אור וחום
הערה: שורשים להימנע אור, אז במקרים כאלה לא לכלול אור על מנת לוודא כי נצפו תגובות פלסטיות בסיס מונעים על ידי המקור התזונתי במדבקות ולא על ידי הימנעות אור. קיפוח אור בד גם מפחית את הטמפרטורה בתוך rhizoboxes, המסייע למנוע עומס חום.
- לחתוך את הבד קיפוח אור (חומר מיוחד זה לבן בצד אחד ושחור מאידך) חתיכות כ 95 ס"מ ו- 69 ס מ (ראה טבלה של חומרים). חתיכה אחת לכל תיבת נדרש.
- מקפלים כל חתיכה במחצית בשולי ארוכים ליצור שרוול 47.5 ס"מ × 69 ס"מ. באמצעות מחט תפירה מכונת תוכנן עבור ג ' ינס, quilting חזקות חוט תפר צר, לתפור לאורך החלק התחתון ו- ¾ דרכו את הצד של כל שרוול. להצמיד את פינות העליון יחד עם סיכת ביטחון.
6. הכנת קרקע 1:1 (V/V): חול המצע כדי למלא את Rhizoboxes
- לאסוף את ס מ 1,0003 של אדמת השדה (מתוך האתר של ריבית) לארגז. לייבש את הקרקע על משקל קבוע במגשים רדוד ב 60 מעלות צלזיוס.
הערה: קרקע עבור ניסוי זה נאסף מיד לאחר הקציר בשדה תירס אורגני מנוהל מ 0\u201210 ס מ עומק. - לטחון את האדמה עם ומכתש לעבור דרך מסננת 2 מ מ. למדוד את הצפיפות בצובר של הקרקע על ידי שקילה נפח ידוע של אדמה.
- להשיג חול (כמו חול משחקים, אשר ניתן לרכוש בזול חנות לחומרי; לראות טבלה של חומרים) ולמדוד את הצפיפות בצובר.
- למדוד את נפחים שווים חול ואדמה לתוך דלי ומערבבים היטב. השתמש משפך כדי למלא את התיבה לאט ובצורה שווה ל 2.5 ס מ מהחלק העליון, מבלי להרעיד את התיבה כדי לגרום את המצע להתיישב. למדוד את כמות המצע; זה צריך להיות בערך ס מ 1,2723.
- הכפל את הצפיפות בצובר של חול ב- חצי אמצעי אחסון זה כדי לקבל את המסה של חול הדרושים עבור כל תיבה. לעשות את אותו הדבר עם הצפיפות בצובר של אדמה על מנת להשיג את המסה של הקרקע הדרושים עבור כל תיבה.
הערה: עבור שדה אדמה וחול המשמשים את הניסוי הזה, זה היה 976 g של חול ו- g 774 של אדמה, אך סכומים אלה משתנים בהתאם הצפיפות בצובר של הקרקע המשמש. - תווית אחת-zip העליון שקית פלסטיק גדולה לכל rhizobox, שוקל את ההמונים המתאים של חול, אדמה לתוך השקית, homogenize ביסודיות.
- לנתח את אדמת 1:1- ו המצע מזין תוכן, את השפע הטבעי של 15N (אלפא15N).
7. המצע לקראת טיפול ותיקוני שליטה
- תווית שני-zip העליון שקיות פלסטיק קטן לכל rhizobox, אחד עבור התיקון טיפול ואחד עבור התיקון שליטה. שוקל 30 גרם של הקרקע: חול המצע מ בכל מזוודה גדולה (שלב 6.6) לתוך שתי שקיות קטנות המתאימות.
- מערבבים את המצע עם מקור חנקן התווית על-ידי N 15עבור התיקון טיפול. בשביל זה, לשקול את 1g של שארית של צמח התווית על-ידי N 15או N-ממקור אחר (הסכום ניתן לכוונן לפי הצורך) לתוך כל שקית טיפול (בתיק קטן-zip העליון), ומערבבים היטב.
הערה: עבור ניסוי זה, תערובת של 15תלתן התווית על-ידי N ושיירי וטץ שימש. תלתן ובקיה זרעים היו נטועים תערובת 1:1 של ורמיקוליט וחול, גדלו בתנאים החממה. הצמחים היו שמושקים מדי יום עם מים יונים פעמיים שבועי עם כוח 1/100 מערכו של פתרון ארוך-אשטון13 המכיל 15מקורות חנקן התווית על-ידי N. כל ביומסה מעל פני הקרקע היה נקצרו ארבעה שבועות לאחר השתילה, מיובשים על הקרקע. לעבור דרך מסננת 2 מ מ. אם נבחר של חומרי מזון שונים, במיוחד אם רכיב זה הוא נייד, באדמת טיס ניסויים לבדיקת שטיפת מעודדים. טפסי שחרור איטי של חומרים מזינים יכול לשמש, או בעיצוב שונה rhizobox יכולת לבחור להגביל שטיפת (למשל, על ידי תאים נפרדים10) במידת הצורך.
8. טעינת Rhizobox עם סובסטרט, ומיסוד טיפול ותיקוני שליטה
- שוקל כל rhizobox ריק ולהקליט את המשקולות לשימוש מאוחר יותר.
- הכנס שני מפרידי כלי תיקון (ראה שלב 3.2) rhizobox אחד עד הבורג מונעת מהם ממשיכים הלאה. לסמן את העומק של הקצה התחתון עם סימן קל בצד rhizobox (איור 3) והסר קפיציות.
- באמצעות משפך עם פתיחה גזע זה כמו לצמצם כמו הפתיחה rhizobox, למלא את rhizobox מתוך התיק גדול המתאים של מצע לעומק מסומן. להזיז את המשפך ואחורה לאט ובצורה שווה כך המצע ממלא בצורה אחידה אינה יוצרת ערוצי זרימה מועדף.
- כאשר רמת המצע מגיע העומק מסומן, שים קפיציות שם 5 ס מ מכל צד של התיבה. המשך מילוי התיבה עד רמת המצע היא כ- 5 ס מ מהחלק העליון של התיבה (שם צריך להיות המצע שנותרו בשקית).
- רטוב ביסודיות סביב כל מרווח.
הערה: ניסוי זה הושג על-ידי אספקת 50 מ של מים דרך מקרן טפטוף מוכנס בין הקצה החיצוני של כל מרווח ועל הצד של rhizobox שפיכת 50 מ של מים בצורה שווה בין שני קפיציות. השקיה איטי הוא הכרחי עבור הרטבה אחידה. - הסר קפיציות אמנם הקרקע רטובה, עוזב של חלל ריק על המדבקות.
- סרט סרט שקיפות עד החלק החיצוני של כל rhizobox (ראה טבלה של חומרים). מארק צד אחד כטיפול ואחד כפקד, ולמלא את המדבקות של התיקים המתאים באמצעות המשפך. לאתר את הגבולות של כל תיקון על השקיפות באמצעות הסמן הקבע.
- למלא את rhizobox באופן אחיד המצע הנותרים. להתחקות אחר החלק העליון של המצע על השקיפות.
- חזור על rhizoboxes הנותרים. שמור את כל התיקים לקציר.
9. אפילו השקיה ל- 60% קיבולת מים
הערה: נמצאה כמות זו של לחות הקרקע כדי למנוע צמחים חווה בצורת מתח תוך מניעת התפתחות תנאי אנאוקסיים או צמיחה אצה.
- למדוד את קיבולת מים (WHC) המצע14.
- לחשב את המשקל האידיאלי של כל תיבת; כאן מוגדרת כסכום של המשקל של rhizobox ריקה בשילוב עם המשקל של המצע-קיבולת 60% מים.
- להכפיל את WHC (גרם של מים / גרם של מצע יבש) על ידי 0.6 כדי לקבל את כמות המים שהתקיים המצע של 60% WHC. להוסיף את המונית הזו המסה של מצע יבש, המסה של מקור 15N.
- להוסיף משקל ריק של כל תיבת המספר שהתקבל לעיל.
- שוקלים את התיבות ברגע שהם היו מלאים. להחסיר את המשקל של כל תיבה (ב ז) בשלב זה מן המשקל האידיאלי שלו (ב ז) שחושבו בצעד 9.2. עם זה נפח (ב מ ל) מים מיוננים (DI) מים לאט ובצורה שווה.
הערה: שלב זה יכול להיעשות באמצעות השקיה בטפטוף או השקיה ידנית. אם השקייה ידנית, לאפשר למים לחלחל לגמרי לפני הוספת יותר להימנע בתנאי לחות קרקע heterogenous ואת ערוצי זרימה מועדף.
10. הזרעים הנביטה והשתלות
- אם משתמש פקדים לא זרוע, להפריש rhizoboxes האלה.
- השטח-לעקר את גרעיני תירס על ידי בחישה 1 דקות ב- 5% NaOCl, אז יש לשטוף ביסודיות במים DI.
הערה: בניסוי זה, זרעים של שישה אחרים תירס שונים שימשו כדי לחקור את ההבדלים genotypic שורש פלסטיות. - להנביט זרעים סטיריליים על-ידי הצבתם על ממחטה רטובה מעבדה (למשל, Kimwipe) בתוך צלחות פטרי וכיסוי עם עוד לחות. לא צריך להיות כל מים עומדים. המקום פטרי. במקום חשוך עבור h 48\u201272 עד radicle רק מתחילה להסתמן.
- השתמש במרית צר לחפור בור 2.5 ס מ עומק במרכזו של כל rhizobox. השתלה של הזרעים מונבטים לתוך החור, הקפדה radicle מכוון ישירות כלפי מטה.
הערה: אם radicle הוא בזווית לכיוון או תיקון, השוואת שיעורי צמיחה השורש יהיה מוטה. - לאתר את המיקום של הזרע על השקיפות.
- מכסים את הזרע ואת המים עם עד 50 מ ל מים DI.
11. צמחים צמיחה
- לגדל צמחים במשך 25 ימים (או זמן רב ככל הרצוי), שמירה על 60% WHC לאורך כל התקופה גדל. לפקח על צמיחה השורש ע י איתור השורשים.
- שוקל כל תיבת כל ימי 3\u20124 ומים עד שזה בתוך 5 גר' משקל אידיאלי. להפסיק להשקות את rhizoboxes ארבעה ימים לפני הקציר כדי להקל על הפרדה בין הלוחות. הסר עשבים ביד בתדירות גבוהה כך שורשי צמחים רק עניין נוכחים.
- להתחקות אחר שורשי גלוי כל ימים 3\u20124 באמצעות סמן קבוע עם צבעים ניתן להבחנה ברורה לכל יום העקיבה.
הערה: קוטר שונה סמני יכול לשמש שורשים ראשיים, לרוחב, אם רצונך בכך. זה יכול להיות שימושי להגדיר קריטריונים עבור שורש עקיבה בתחילת מאז מידה מסוימת של הסובייקטיביות מעורבת, במיוחד אם יהיו מספר חוקרים שורשים העקיבה או אם השורשים של הזמנות שונות או קוטר להיות מכובד עם סמנים שונים. בניסוי זה, הדיוק של איתור שורשים גלוי רק על צד אחד של תיבת נבדקה ע י איתור שורשים גלוי משני הצדדים, השוואת אורך הבסיס הכולל נמדדים על השקפים סרוקים אורך הבסיס הכולל נמדד על ידי שטיפה וסריקת שורשים. המתאם בין אורך הבסיס עקיבה וסקר היה משמעותי ללא קשר אם שימשו רק את השקיפות האחורי או שני שקפים. לכן ניתן רק לעקוב אחר השורשים גלוי בלוח האחורי.
12. קצירת נצרי ולאחר קבלת בסיס, דגימות. אדמה לניתוח
- להניח את rhizobox הראשונה שטוח ולהסיר את כל הברגים.
- הקציר הדגימות לירות. קליפ נצרי בבסיס, לשטוף כל אדמה במים DI ו יבש ב 60 מעלות צלזיוס. לטחון יורה עם ומכתש כדי לעבור דרך מסננת 2 מ מ והוא שוקל subsamples לתוך קפסולות בדיל לניתוח איזוטופ (ראו סעיף 14).
- באמצעות השקיפות כמדריך, לחתוך את המדבקות לטיפול ושליטה עם סכין גילוח. השתמש כף או מרית להגיש את השורשים והאדמה rhizosphere adhering לתוך השקית טיפול או שליטה בהתאמה.
הערה: בעוד שיטות רבות קיימים כדי rhizosphere נפרד אדמה, האדמה תחת השפעתו של צמח שורשים15, rhizosphere יכולה להיחשב הדרגתי יותר מאשר אזור מוגדרים היטב אך ורק16, שיטה זו מלווה בשימוש נרחב הגדרה של הקרקע על פי לשורשי צמחים לאחר טלטול17. - סקופ שורשים ואדמה הנותר לשקית השלישי.
- לעבור את הטיפול, שליטה, ולא גורפת דגימות ובמכתש 2 מ מ להפריד שורשים המצע, הסרת כל השורשים גלוי או שברי > 1 ס מ אורך עם פינצטה משובחים. לשמור את הדוגמיות הללו בנפרד אחד מן השני עבור סכום כולל של שורש שלוש שלוש דוגמאות המצע.
13. אימות של תצלומי מעקב, שערוך של שיעורי צמיחה השורש היחסי
- סרוק טיפול, בקרה, לרשימת תפוצה דגימות, לחשב את אורך הבסיס.
- עבודה עם דוגמא אחת בכל פעם, לשטוף השורשים היטב עם מים די כדי להסיר את כל המצע הנותרים. לסדר דגימות מגש ברורה כך השורשים לא חופפות.
- סרוק דגימות באמצעות סורק תואם עם שורש ניתוח תוכנה (לדוגמה, WinRhizo). ודא כי התוכנה מכויל לבידול שורשים רקע תמונה אמינה.
- להשתמש בתוכנה כדי למדוד את האורך הכולל בסיס ואורך שורש בכיתות קוטר עניין (לדוגמה, < 0.2 מ מ, 0.2\u20120.4 מ מ, 0.4\u20120.8 מ. מ., 0.8\u20121.6 מ מ, > 1.6 מ מ).
- לחשב שורש אורך צפיפות (שהכנסתי) עבור תיקונים הטיפול והשליטה ועבור כל rhizobox בכללותה.
- לחשב את עוצמת הקול של מדבקות לטיפול ושליטה על-ידי הכפלת האזור לאתר על כל שקיפות (ראה שלב 8.1) 0.635 ס מ, העומק של התיבה. להשתמש אחסון אלה כדי לחשב את השורש צפיפות אורך בכתמים טיפול ובקרה באמצעות אורך הבסיס סך כל תיקון (ראה שלב 13.1.3).
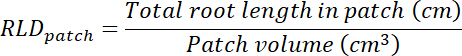
- לחשב את עוצמת הקול של המצע ב rhizobox כל על-ידי הכפלת האזור במעקב על השקיפות (ראה שלב 8.1) על ידי 0.635 ס"מ. חישוב שהכנסתי באשר המדבקות לטיפול ושליטה.
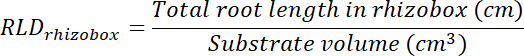
- לחשב את עוצמת הקול של מדבקות לטיפול ושליטה על-ידי הכפלת האזור לאתר על כל שקיפות (ראה שלב 8.1) 0.635 ס מ, העומק של התיבה. להשתמש אחסון אלה כדי לחשב את השורש צפיפות אורך בכתמים טיפול ובקרה באמצעות אורך הבסיס סך כל תיקון (ראה שלב 13.1.3).
- אמת השורש עקיבה שיטה על ידי השוואת מערכות שורשים סרוקים ועקב תמונות.
- סרוק השקפים, לחשב אורך הבסיס הכולל שימוש בתוכנה. לשמור את התמונה הסרוקה לצמיחה בחישובי שיעור.
- לסכם את המידות אורך הבסיס הכולל של טיפול, בקרה, ולא גורפת דוגמאות עבור כל תיבה (ראה שלב 13.1.3).
- בדוק את המידות סרוקים, עקיבה של השורש סה כ אורך כדי לראות אם המתאם משמעותיים מבחינה סטטיסטית.
הערה: אם כן, שיטת מעקב מאומת, שיעורי צמיחה יחסית יכול להיות מחושב בכל נקודה בזמן. אם לא, רק את נתוני מערכת השורשים סרוקים מספק אינדיקציה מדויקת של צמיחה השורש. זה יכול להיות המקרה אם מתודולוגיה מעקב עיקבי או אם השורשים היו לא פחות נראות לעין כל אחרים, למשל.
- אם שיטת מעקב אומתה, לחשב שיעורי צמיחה השורש היחסי עבור כל rhizobox.
- השתמש בתוכנת ניתוח שורש מכויל כדי להבחין בין הצבעים שבחרת העקיבה כדי למדוד אורך הבסיס הכולל טיפול, בקרה, לרשימת תפוצה דגימות בכל נקודה בזמן. חישוב אורך הבסיס הכולל המצטבר בכל נקודה בזמן.
- לחשב שיעורי צמיחה השורש היחסי (שורשRGR) עבור כל rhizobox כמו גם לגבי טיפול ותיקונים פקד עבור כל זמן מרווח זמן t1-t2 כדלקמן.
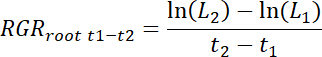
הערה: כאן L1 נמצא שורש סה כ אורך התיקון (סכום מצטבר מ- 11.3) t1 ימים לאחר משתילים (ש), L2הוא אורך הבסיס הכולל תיקון t2 ידיים למעלה
14. אנליזה של 15N מחיצות בין דגימות קרקע שורש, לירות, וטיפול
- השורשים יבש ב 60 מעלות צלזיוס, שוקל ביומסה, לטחון לעבור דרך מסננת 2 מ מ.
- Subsamples יבש של טיפול אדמה ב 60 מעלות צלזיוס.
- חבילת שורשים וטיפול לתוך קפסולות בדיל כמו עם נצרי.
הערה: משקל מדגם אידיאלי לכל כמוסה יש לחשב בנפרד יורה, השורשים של אדמת המבוססים על היחס C/N המשוער של החומר להגיע לסכום היעד של סה כ N לניתוח. קשר עם. המתקן איזוטופ יציב היכן הדגימות יוגשו לקבלת מידע נוסף. עבור ניסוי זה, הוראות הכנה מדגם של מחשבון משקל לדוגמה שסופק על-ידי המתקן איזוטופ UC יציב דייוויס היו שהופעלו18.
התראה: לקחת טיפול מיוחד כדי לערבב דגימות אחיד לפני האריזה לתוך קפסולות להכין קפסולות מרובים עבור דגימה. אם הדגימות לא מעורבבים באופן שווה, שחזור לכאורה של 15N יכול לחרוג מהסכום הנוכחי במקור. - לנתח את סה כ N, δ15 ותוכן 15N של כל לירות, שורש, טיפול דגימת האדמה.
הערה: בניסוי זה, דגימות צמח נותחו באמצעות בעירה עם מנתח היסודות PDZ אירופה לימור קלו-GSL לממשק כדי PDZ אירופה 20-20 איזוטופ יחס ספקטרומטר מסה במתקן ה-UC דיוויס יציב איזוטופ (UCD SIF). דגימות. אדמה נותחו עם מנתח היסודות Elementar Vario EL קוביה לממשק כדי PDZ אירופה 20-20 איזוטופ יחס ספקטרומטר מסה-סיף UCD. - חישוב הסכום של 15N המתקבל התווית בצמח לירות. ושורשי דגימות.
- ראשית, לחשב את סכום 15N מעל האטמוספירה 15N בכל בריכה, 15P *:
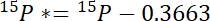
איפה 15P הוא התוכן 15N % אטומי של הבריכה של ריבית. - שנית, לחשב את סכום 15N מעל האטמוספירה 15N בהתווית 15L *:
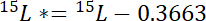
15L איפה התוכן 15N % אטומי של המקור N עם תוויות. - שלישית, לחשב את הסכום של N הכולל בכל בריכה, Np:
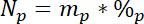
כאשר mp היא המסה של הבריכה (למשל, הכולל לירות יבש או שורש ביומסה) ו %p הוא האחוזים של N של הבריכה. - לבסוף, להשתמש בתוצאות של 14.5.1\u201214.5.3 משוואת Ndff19 כדי לחשב את הסכום של N המתקבל התווית, Nl:
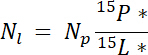
הערה: המשוואה Ndff משמש כדי לקבוע את הסכום של N ממקור שכותרתו הוא התאושש על ידי צמחים. ההנחה היא כי אין אפליה איזוטרופי מתרחשת תוך כדי ספיגת N ליד המפעל, הוא בדרך כלל עבור N מקורות מועשר ~1\u201210%19.
- ראשית, לחשב את סכום 15N מעל האטמוספירה 15N בכל בריכה, 15P *:
Access restricted. Please log in or start a trial to view this content.
תוצאות
השורשים גדלו מעדיפים נגד האחורי של התיבה, לפי התכנון. סה כ לייחס שורש אורך על הגב של תיבת נע בין 400 ס"מ 1,956, לעומת 93-758 ס מ בחלק הקדמי של התיבה. Pairwise מקדמי מתאם פירסון חושבו בין אורך הבסיס סרוקים אורך הבסיס עקיבה על החלק הקדמי של התיבה, האחורי של התיבה, ושימש סכום מלפנים ומאחור ?...
Access restricted. Please log in or start a trial to view this content.
Discussion
Rhizoboxes המתוארות פרוטוקול זה יכול לשמש כדי לענות על השאלות מגוונים במדעי בסיס, rhizosphere, ומצאו מגוונות משתמשת במקום אחר10,20,21,22,23 , 24 , 25. איזה שימוש אוטומטית מערכות
Access restricted. Please log in or start a trial to view this content.
Disclosures
המחברים אין לחשוף.
Acknowledgements
המחברים רוצה להכיר הבודקים אנונימי משוב, שלהם, כמו גם ג'יי קהיל, טאן באו להדרכה ראשונית על פיתוח פרוטוקול rhizobox. מימון סופק על ידי הקרן מזון, למחקר חקלאי, המכון הלאומי אותנו המחלקה של חקלאות (USDA) מזון וחקלאות, חקלאי ניסוי תחנת CA הפרוייקט-D-PLS-2332-H, כדי הכללי ועל ידי מחלקת דיוויס UC של הצמח מדעי באמצעות מלגת י. ס
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 1.27 cm diameter PVC pipe | JM Eagle | 530048 | 305 cm per box, cut into lengths as specified in the protocol |
| PVC side elbows | Lasco | 315498 | 2 per box |
| PVC 90-degree elbows | Charlotte | PVC 02300 0600 | 4 per box |
| PVC T joints | Charlotte | PVC 02402 0600 | 4 per box |
| Extruded acrylic panes | TAP Plastics | N/A | 2 per box, 0.64 cm thick x 40.5 cm wide x 61 cm long |
| HDPE spacers (sides) | TAP Plastics | N/A | 2 per box, 0.64 cm thick x 2.5 cm wide x 57 cm long |
| HDPE spacers (bottom) | TAP Plastics | N/A | 1 per box, 0.64 cm thick x 2.5 cm wide x 40.5 cm long |
| HDPE spacers (patch) | TAP Plastics | N/A | 2 per box, 0.64 cm thick x 3.8 cm wide x 28 cm long |
| Polyester batting | Fairfield | #A-X90 | 2.5 cm x 40.5 cm strip per box |
| 20-thread screws | N/A | N/A | 3.2 cm long, 0.64 cm diameter |
| Washers | N/A | N/A | 0.64 cm internal diameter |
| Hex nuts | N/A | N/A | sized to fit the screws |
| Light deprivation fabric | Americover, Inc. | Bold 8WB26.5 | 1 piece 95 cm wide and 69 cm long per box |
| Sand | Quikrete | No. 1113 | |
| Field soil | N/A | N/A | |
| Transparencies for tracing | FXN | FXNT1319100S | One per side of the box to be traced |
References
- Hodge, A. Roots: The Acquisition of Water and Nutrients from the Heterogeneous Soil Environment. Progress in Botany 71. , 307-337 (2010).
- Grossman, J. D., Rice, K. J. Evolution of root plasticity responses to variation in soil nutrient distribution and concentration. Evolutionary Applications. 5 (8), 850-857 (2012).
- Melino, V. J., Fiene, G., Enju, A., Cai, J., Buchner, P., Heuer, S. Genetic diversity for root plasticity and nitrogen uptake in wheat seedlings. Functional plant biology. , Available from: http://agris.fao.org/agris-search/search.do?recordID=US201600101375 (2015).
- Zhang, H., Forde, B. G. An Arabidopsis MADS box gene that controls nutrient-induced changes in root architecture. Science. 279 (5349), 407-409 (1998).
- Hodge, A., Stewart, J., Robinson, D., Griffiths, B. S., Fitter, A. H. Competition between roots and soil micro-organisms for nutrients from nitrogen-rich patches of varying complexity. Journal of Ecology. 88 (1), 150-164 (2000).
- Trachsel, S., Kaeppler, S. M., Brown, K. M., Lynch, J. P. Shovelomics: high throughput phenotyping of maize (Zea mays L.) root architecture in the field. Plant and Soil. 341 (1-2), 75-87 (2011).
- Rogers, E. D., Monaenkova, D., Mijar, M., Nori, A., Goldman, D. I., Benfey, P. N. X-ray computed tomography reveals the response of root system architecture to soil texture. Plant Physiology. , (2016).
- Groleau-Renaud, V., Plantureux, S., Guckert, A. Effect of mechanical constraint on nodal and seminal root system of maize plants. Comptes Rendus De L Academie Des Sciences Serie Iii-Sciences De La Vie-Life Sciences. 321 (1), 63-71 (1998).
- Lin, Y., Allen, H. E., Di Toro, D. M. Barley root hair growth and morphology in soil, sand, and water solution media and relationship with nickel toxicity. Environmental Toxicology and Chemistry. 35 (8), 2125-2133 (2016).
- Wenzel, W. W., Wieshammer, G., Fitz, W. J., Puschenreiter, M. Novel rhizobox design to assess rhizosphere characteristics at high spatial resolution. Plant and Soil. 237 (1), 37-45 (2001).
- Spohn, M., Carminati, A., Kuzyakov, Y. Soil zymography - A novel in situ method for mapping distribution of enzyme activity in soil. Soil Biology and Biochemistry. 58, 275-280 (2013).
- Vollsnes, A. V., Futsaether, C. M., Bengough, A. G. Quantifying rhizosphere particle movement around mutant maize roots using time-lapse imaging and particle image velocimetry. European Journal of Soil Science. 61 (6), 926-939 (2010).
- Hewitt, E. J. Sand and Water Culture Methods Used in the Study of Plant Nutrition. , Commonwealth Bureau. London. (1966).
- Choudhary, M. I., Shalaby, A. A., Al-Omran, A. M. Water holding capacity and evaporation of calcareous soils as affected by four synthetic polymers. Communications in Soil Science and Plant Analysis. 26 (13-14), 2205-2215 (1995).
- Bakker, P. A. H. M., Berendsen, R. L., Doornbos, R. F., Wintermans, P. C. A., Pieterse, C. M. J. The rhizosphere revisited: root microbiomics. Frontiers in Plant Science. 4, 2013(2013).
- McNear, D. H. Jr The Rhizosphere - Roots, Soil, and Everything In Between. Nature Education Knowledge. 4 (3), 1(2013).
- Ortas, I. Determination of the extent of rhizosphere soil. Communications in Soil Science and Plant Analysis. 28 (19-20), 1767-1776 (1997).
- UC Davis Stable Isotope Facility. Carbon (13C) and Nitrogen (15N) Sample Preparation. , Available from: https://stableisotopefacility.ucdavis.edu/13cand15nsamplepreparation.html (2018).
- Barraclough, D. 15N isotope dilution techniques to study soil nitrogen transformations and plant uptake. Fertilizer research. 42 (1-3), 185-192 (1995).
- Belter, P. R., Cahill, J. F. Disentangling root system responses to neighbours: identification of novel root behavioural strategies. AoB PLANTS. 7, (2015).
- Nagel, K. A., et al. GROWSCREEN-Rhizo is a novel phenotyping robot enabling simultaneous measurements of root and shoot growth for plants grown in soil-filled rhizotrons. Functional Plant Biology. 39 (11), 891-904 (2012).
- Adu, M. O., Yawson, D. O., Bennett, M. J., Broadley, M. R., Dupuy, L. X., White, P. J. A scanner-based rhizobox system enabling the quantification of root system development and response of Brassica rapa seedlings to external P availability. Plant Root. 11, 16-32 (2017).
- Neumann, G., George, T. S., Plassard, C. Strategies and methods for studying the rhizosphere-the plant science toolbox. Plant and Soil. 321 (1-2), 431-456 (2009).
- Bodner, G., Alsalem, M., Nakhforoosh, A., Arnold, T., Leitner, D. RGB and Spectral Root Imaging for Plant Phenotyping and Physiological Research: Experimental Setup and Imaging Protocols. JoVE (Journal of Visualized Experiments). (126), e56251-e56251 (2017).
- Kuchenbuch, R. O., Ingram, K. T. Image analysis for non-destructive and non-invasive quantification of root growth and soil water content in rhizotrons. Journal of Plant Nutrition and Soil Science. 165 (5), 573-581 (2002).
- Dresbøll, D. B., Thorup-Kristensen, K., McKenzie, B. M., Dupuy, L. X., Bengough, A. G. Timelapse scanning reveals spatial variation in tomato (Solanum lycopersicum L.) root elongation rates during partial waterlogging. Plant and Soil. 369 (1-2), 467-477 (2013).
- Wu, J., et al. RhizoChamber-Monitor: a robotic platform and software enabling characterization of root growth. Plant Methods. 14 (1), 44(2018).
- Rogers, S. W., Moorman, T. B., Ong, S. K. Fluorescent In Situ Hybridization and Micro-autoradiography Applied to Ecophysiology in Soil. Soil Science Society of America Journal. 71 (2), 620-631 (2007).
- Eickhorst, T., Tippkötter, R. Detection of microorganisms in undisturbed soil by combining fluorescence in situ hybridization (FISH) and micropedological methods. Soil Biology and Biochemistry. 40 (6), 1284-1293 (2008).
- Spohn, M., Kuzyakov, Y. Distribution of microbial- and root-derived phosphatase activities in the rhizosphere depending on P availability and C allocation - Coupling soil zymography with 14C imaging. Soil Biology and Biochemistry. 67, 106-113 (2013).
- Lv, G., Kang, Y., Li, L., Wan, S. Effect of irrigation methods on root development and profile soil water uptake in winter wheat. Irrigation Science. 28 (5), 387-398 (2010).
- Asseng, S., Ritchie, J. T., Smucker, A. J. M., Robertson, M. J. Root growth and water uptake during water deficit and recovering in wheat. Plant and Soil. 201 (2), 265-273 (1998).
- Hernandez-Ramirez, G., et al. Root Responses to Alterations in Macroporosity and Penetrability in a Silt Loam Soil. Soil Science Society of America Journal. 78 (4), 1392-1403 (2014).
- Zhang, Y. L., Wang, Y. S. Soil enzyme activities with greenhouse subsurface irrigation. Pedosphere. 16 (4), 512-518 (2006).
- Robinson, D., Hodge, A., Griffiths, B. S., Fitter, A. H. Plant root proliferation in nitrogen-rich patches confers competitive advantage. Proceedings of the Royal Society of London B: Biological Sciences. 266 (1418), 431-435 (1999).
- Lobet, G., Draye, X. Novel scanning procedure enabling the vectorization of entire rhizotron-grown root systems. Plant Methods. 9, 1(2013).
- Swarup, R., Wells, D. M., Bennett, M. J. Root Gravitropism. Plant Roots: The Hidden Half. , (2013).
- Smit, A. L., Bengough, A. G., Engels, C., van Noordwijk, M., Pellerin, S., van de Geijn, S. C. Root Methods: A Handbook. , Springer Science & Business Media. (2000).
- van Dusschoten, D., et al. Quantitative 3D Analysis of Plant Roots Growing in Soil Using Magnetic Resonance Imaging1[OPEN]. Plant Physiology. 170 (3), 1176-1188 (2016).
- Metzner, R., et al. Direct comparison of MRI and X-ray CT technologies for 3D imaging of root systems in soil: potential and challenges for root trait quantification. Plant Methods. 11, 17(2015).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved