Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Un protocole de Rhizobox optimisé pour visualiser la croissance racinaire et la réceptivité aux nutriments localisées
Dans cet article
Résumé
Visualisation et en mesurant la croissance racinaire in situ sont extrêmement difficile. Nous présentons une méthode de rhizobox personnalisable pour suivre le développement racinaire et prolifération au fil du temps en réponse à l’enrichissement en éléments nutritifs. Cette méthode est utilisée pour analyser les différences génotypiques maïs dans la plasticité de la racine en réponse à une source d’azote organique.
Résumé
Racines sont notoirement difficiles à étudier. Le sol est une barrière à la fois visuelle et mécanique, rend difficile de suivre les racines in situ sans récolte destructrice ou des équipements coûteux. Nous présentons une méthode de rhizobox personnalisable et abordable qui permet la visualisation non destructive de la croissance des racines au fil du temps et est particulièrement bien adapté à l’étude de plasticité de la racine en réponse à des plaques de ressources localisé. La méthode a été validée par l’évaluation de la variation génotypique maïs dans les réponses de la plasticité aux patches contenant des résidus de légumineuses marqué N 15. Méthodes sont décrites pour obtenir des mesures de développement représentant au fil du temps, mesurer la densité de longueur des racines dans des parcelles contenant des ressources et de contrôle, calculer le taux de croissance des racines et déterminer 15N récupération par les racines et les pousses. Avantages, mises en garde et le potentiel de futures applications de la méthode sont également discutées. Bien qu’il faut pour s’assurer que des conditions expérimentales ne pas biaiser les données sur la croissance racinaire, le protocole de rhizobox présenté ici donne des résultats fiables si réalisée avec suffisamment d’attention aux détails.
Introduction
Bien que souvent négligée par rapport à leurs homologues hors sol, les racines jouent un rôle essentiel dans l’acquisition de nutriments végétaux. Étant donné le coût de carbone importante de racine construction et d’entretien, les plantes ont évolué des mécanismes pour développer des racines seulement où se nourrir vaut l’investissement. Système racinaire peut ainsi efficacement et de manière dynamique mine patches de ressource de proliférer dans les hotspots, cytoprotectrices taux de captation et de nutriments rapidement translocation vers le phloème pour autre transport1. Les réponses de plasticité peuvent varier considérablement entre les plantes espèces ou génotypes2,3 et selon la forme chimique des nutriments impliqués4,5. Variation de la plasticité de la racine devrait être explorée davantage, comme compréhension réponses des racines complexes de ressources en sols hétérogènes pourraient informer reproducteurs et des stratégies de gestion pour accroître l’efficacité de l’utilisation des éléments nutritifs dans l’agriculture.
Malgré sa nécessité et sa pertinence pour les systèmes d’usine de compréhension, visualiser et quantifier la plasticité de la racine à des échelles pertinentes posent des défis techniques. Excavation de la Couronne de la racine dans le sol (« shovelomics »6) est une méthode commune, mais les racines fines exploitent petits pores entre les agrégats du sol, et excavation conduit inévitablement à un certain degré de perte de ces racines fragiles. En outre, récolte destructive rend impossible de suivre les changements dans un système racinaire au fil du temps. In situ des méthodes d’imagerie telles que la tomographie aux rayons x calculée permettent une visualisation directe des racines et des ressources en sols à haute résolution spatiale7, mais sont coûteux et nécessitent des équipements spécialisés. Hydroponiques expériences éviter les contraintes liées à l’extraction des racines dans le sol, mais architecture et la morphologie racinaire diffèrent en milieu aqueux par rapport aux contraintes mécaniques et de la complexité biophysique des sols8,9. Enfin, les fonctions et les processus de la rhizosphère ne peuvent être intégrées avec la plasticité développementale dans ces milieux artificiels.
Nous présentons un protocole pour la construction et l’utilisation de rhizoboxes (récipients rectangulaires étroits, clear-face) comme une méthode économique et personnalisable pour caractériser la croissance des racines dans le sol au fil du temps. Châssis spécialement conçu pour encouragent les racines à se développer préférentiellement contre le panneau arrière en raison de gravitropisme, augmentant la précision des mesures de longueur de racine. Rhizoboxes sont couramment utilisés pour étudier la croissance des racines et la rhizosphère des interactions10,11,12, mais la méthode présentée ici vous offre un avantage dans la simplicité grâce à sa conception du seul compartiment et peu coûteux matériaux et vise à étudier les réponses des racines aux nutriments localisées. Toutefois, la méthode pourrait être également adaptée pour étudier une gamme d’autres processus racine et rhizosphère tels que la concurrence intra/interspecies, distribution spatiale des composés chimiques, microbes ou de l’activité enzymatique. Ici, nous étudions les différences génotypiques parmi les hybrides de maïs en réponse à des plaques de 15N-étiqueté légumineuse résidus et point culminant résultats représentatifs pour valider la méthode de rhizobox.
Protocole
1. préparation des panneaux arrière et avant et entretoises
- Préparer les panneaux avant et arrière.
- Deux morceaux d’acrylique épais transparent 0,635 cm à 40,5 cm de large sur 61 cm de long par boîte ou acheter pièces prédécoupées (voir Table des matières).
- À l’aide d’un foret conçu pour le verre acrylique, percer des trous 0,635 cm de diamètre 1,3 cm des bords latéraux à 2,5, 19, 38 et 53,3 cm du haut. Percer les trous 1,3 cm du bord inférieur à 2,5, 20,3 et 38 cm du côté gauche (Figure 1).
Remarque : Il est plus efficace d’utiliser une perceuse à colonne pour une pile de six à dix feuilles à la fois, mais une perceuse à main peut également être utilisée. - Supprimer n’importe quel revêtement protecteur de l’acrylique et nettoyer doucement les deux panneaux avant d’assembler les boîtes.
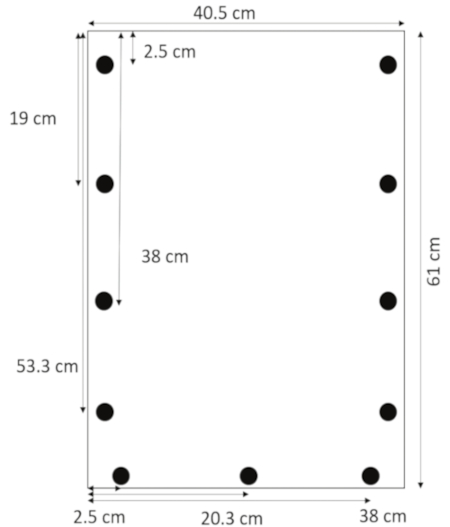
Figure 1 : mise en page des trous forés. Trous sont percés à 1,3 cm des bords latéraux à 2.5, 19, 38, 53,3 cm de haut et 1,3 cm du bord inférieur à 2,5, 20,3 et 38 cm de la marge de gauche. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
- Préparer les entretoises de côté et en bas.
- Coupez trois entretoises par boîte de polyéthylène haute densité (PEHD) ou achat deux entretoises côté prédécoupé (0,635 cm d’épaisseur, largeur 2,5 cm, 57 cm de long) et un bas prédécoupés entretoise (0,635 cm d’épaisseur, largeur 2,5 cm, 40,5 cm de long). Consultez la Table des matières.
- Aligner les entretoises entre les panneaux avant et arrière, le long des côtés et le bas de la boîte. À l’aide d’une perceuse à main ou une perceuse, percez les trous existants dans le front et vice-versa afin que les trous passent par l’intermédiaire de chacune des trois couches proprement.
- Tenir les couches placer à l’aide de pinces ou en installant une combinaison de boulons, écrous et rondelles chacune nouvellement percé trou (voir étape 3.1).
2. installation d’une bande de Polyester au bâton en bas de la boîte
NOTE : Cela empêchera l’eau et le sol contre les fuites à travers les joints entre les entretoises.
- Couper le polyester frappeur en 2,5 cm de large par 40,5 cm de long bandes (voir la Table des matières).
- Avec le panneau arrière située à plat et les entretoises dessus, posez la nappe directement au-dessus de la cale d’espacement inférieure et maintenez-la en place avec le panneau supérieur (Figure 2).
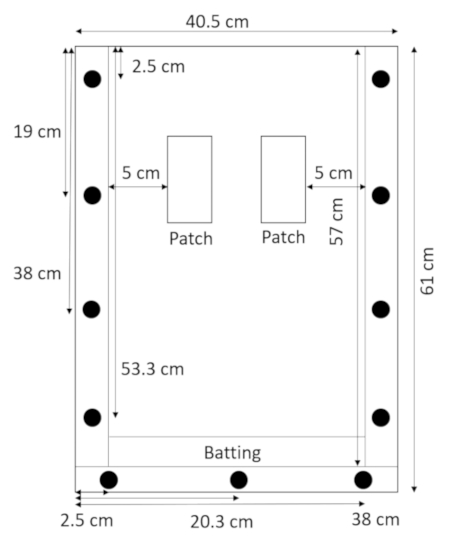
Figure 2 : assemblé rhizobox avec la vlieseline. Une étroite bande de vlieseline au fond de la rhizobox empêche le sol et le sable de fuir. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
3. montage de la Rhizoboxes
- Assembler le rhizoboxes à l’aide de vis 20 (3,2 cm de longueur par 0,635 cm de diamètre), rondelles (diamètre intérieur de 0,635 cm) et des écrous hexagonaux (taille à serrer les vis, voir Table des matières.
- Serrez chaque vis dans une machine à laver, façade, entretoise, panneau arrière, rondelle et écrou hexagonal. Assurez-vous que les vis sont très serrées ; Si la boîte est Assemblée sans serrer, sol renversera dehors par des fentes entre les panneaux et les écarteurs de côté.
NOTE : Acrylique est facilement rayé, et les rayures peuvent interférer avec les mesures de la racine, donc manipuler les boîtes assemblés avec soin. Évitez les boîtes empilables à moins que le matériau de protection est placée entre les deux. - Préparer deux entretoises de patch (entretoises qui seront utilisés pour créer les patchs de traitement et de contrôle) par boîte. Couper les espaceurs de polyéthylène haute densité feuilles (PEHD) ou les acheter pré-coupés (0,635 cm d’épaisseur, largeur 3,8 cm, 28 cm de long, voir Table des matières). Percer un trou de 0,635 cm de diamètre dans chaque cale, 2 cm du bord le long de la ligne médiane (Figure 3).
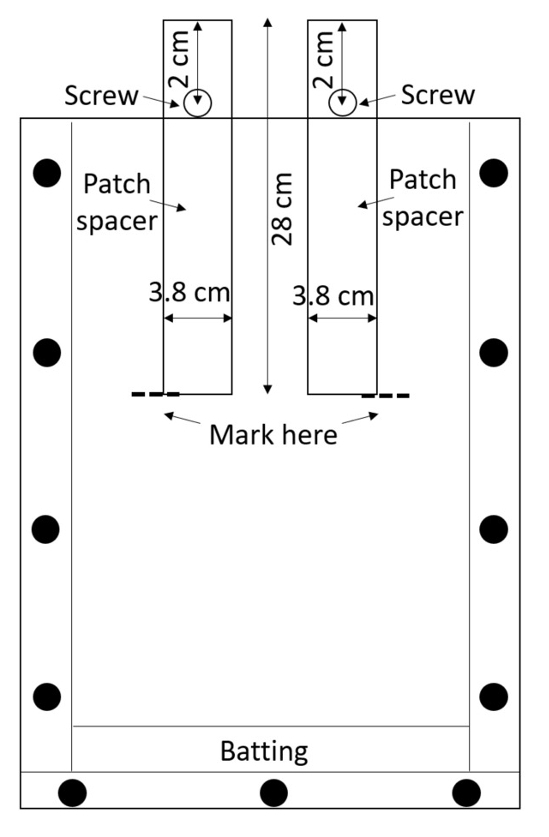
Figure 3 : Patch entretoises. Vis insérées par l’intermédiaire du centre de PEHD bandes les empêchent de tomber dans la boîte. Le rhizobox est rempli de terre autour des entretoises, le sol est humidifié et les entretoises sont supprimés afin de laisser vides patches de traitement et de contrôle. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
- Fixez une vis dans chaque trou avec un écrou de sorte que l’entretoise peut être partiellement insérée dans le rhizobox jusqu'à ce que la vis l’empêche d’aller plus loin (Figure 3).
Remarque : Lorsque le sol est humidifié autour les entretoises et les entretoises sont enlevés, deux espaces vides restera qui peut être rempli avec les substrats appropriés pour le patch de traitement contenant de l’azote et le patch control.
4. bâtiment PVC images à l’appui de la Rhizoboxes à un Angle
Remarque : Lorsque la boîte est placée à un angle, gravitropisme encouragera les racines à pousser contre le panneau arrière, afin que toutes les racines soient visibles pour le traçage. Le polychlorure de vinyle (PVC) dimensions en Figure 4 résultat dans un cadre qui maintient le rhizobox à un angle d’environ 55 ° sur le banc.
- Couper les 13 morceaux de 1,3 cm de diamètre en PVC par boîte : 2 longueurs de cm × 44, 3 longueurs de cm × 42, 2 longueurs de cm × 36,3, 2 longueurs de cm × 25,4 et 4 longueurs de cm × 3,8 (voir Table des matières).
Remarque : Une tronçonneuse est fortement recommandé pour l’efficacité et la même coupe. - Utiliser 4 × 2 voies coudes, coudes de 3 voies × 2 et 4 T-joints (voir Table des matières) pour assembler la boîte comme indiqué dans la Figure 4.
Remarque : Les cadres doivent être stables sans colle supplémentaire, mais la colle PVC peut être utilisée si nécessaire.
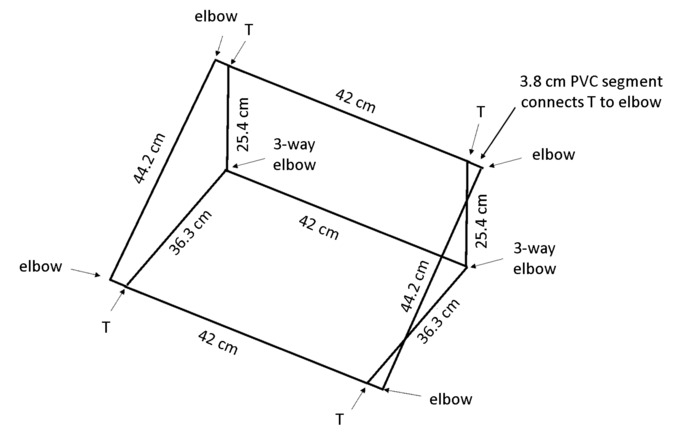
Figure 4 : cadre pour soutenir rhizoboxes. Le cadre léger est constitué de PVC coupées à la longueur et connecté à l’aide de type mixte indiqué. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
5. coudre cas protecteur afin de refléter la lumière et la chaleur
NOTE : Racines éviter la lumière, afin que ces cas éliminer la lumière afin de s’assurer que celle observée les réponses de la plasticité des racines sont conduits par la source d’éléments nutritifs dans les taches et non par évitement léger. Manque de lumière tissu réduit également la température à l’intérieur de la rhizoboxes, permettant d’éviter le stress thermique.
- Couper le tissu de manque de lumière (matériel spécialisé qui est blanc sur un côté et noir de l’autre) en morceaux environ 95 cm de large et 69 cm de long (voir Table des matières). Il faut une pièce pour chaque zone.
- Plier chaque morceau en deux le long du bord long pour former un manchon de 47,5 cm × 69 cm. À l’aide d’une aiguille de machine à coudre, conçue pour le denim, lourds quilting thread et coutures étroites, coudre le long de la partie inférieure et ¾ de la façon dont le côté de chaque manche. Epinglez les coins supérieurs avec une épingle de sûreté.
6. préparation du sol de 1:1 (V/V) : substrat pour remplir les Rhizoboxes de sable
- Prélever environ 1 000 cm3 de sol (extrait du site d’intérêt) par boîte. Sécher le sol jusqu'à poids constant dans des plateaux peu profonds à 60 ° C.
NOTE : Sol pour cette expérience ont été recueilli immédiatement après récolte dans un champ de maïs biologique managé de 0\u201210 cm de profondeur. - Moudre le sol avec un mortier et un pilon pour passer à travers un tamis de 2 mm. Mesurer la masse volumique du sol par pesée d’un volume connu de sol.
- Obtenir le sable (telles que le sable de jeu, qui peut être acheté à peu de frais dans une quincaillerie ; voir Table des matières) et mesurer la masse volumique.
- Mesurer des quantités égales de sable et le sol dans un seau et mélanger soigneusement. Utilisez un entonnoir pour remplir la boîte lentement et uniformément à 2,5 cm de haut, sans secouer la boîte pour provoquer le substrat pour s’installer. Mesurer ce volume de substrat ; Il faut environ 1 272 cm3.
- Multipliez la masse volumique de sable par moitié de ce volume pour obtenir la masse de sable nécessaire pour chaque boîte. Faites de même avec la masse volumique du sol pour calculer la masse du sol nécessaire à chaque zone.
Remarque : Pour le sol et le sable utilisé dans cette expérience, c’était 976 g de sable et 774 g de sol, mais ces quantités varient selon la masse volumique du sol utilisé. - Étiqueter un grand sac plastique zip-top par rhizobox, de soupeser les masses appropriées de sable et de terre dans le sac et homogénéiser soigneusement.
- Analyser ce sol de 1:1- et substrat pour la teneur en éléments nutritifs et de l’abondance naturelle de 15N (δ15N).
7. substrat préparation pour le traitement et le contrôle de patchs
- Deux petits sacs en plastique zip-top par rhizobox, un pour le patch de traitement et l’autre pour le patch de contrôle de l’étiquette. Peser 30 g du sol : sable de substrat de chaque grand sac (étape 6,6) dans les deux sacs petits correspondantes.
- Mélanger le substrat avec une source d’azote N marqué 15pour le patch de traitement. Pour ce faire, peser 1 g de résidus 15N-étiquetés ou autre N-source (le montant peut être réglé comme vous le souhaitez) dans chaque sac de traitement (petit sac zip-top) et bien mélanger.
Remarque : Pour cette expérience, un mélange de 15N-étiqueté trèfle et résidus de vesce a été utilisé. Graines de trèfle et vesce ont été plantés dans un mélange de 1:1 de vermiculite et sable et cultivées en serre. Les plantes sont arrosées tous les jours avec de l’eau désionisée et deux fois par semaine avec une force de 1/100 de Long-Ashton solution13 contiennent les sources d’azote N marqué 15. Toute la biomasse au-dessus du sol a été récoltée à quatre semaines après la plantation, séché et moulu pour passer à travers un tamis de 2 mm. Si vous choisissez un autre nutriment, particulièrement si cet élément est mobile dans le sol, des expériences pilotes pour tester la lixiviation sont encouragés. Formes à libération lente d’éléments nutritifs peuvent être utilisés ou un design différent rhizobox pouvait choisir de restreindre de lixiviation (p. ex., par des compartiments séparés10) si nécessaire.
8. chargement Rhizobox avec le substrat et l’établissement de traitement et contrôle de correctifs
- Peser chaque rhizobox vide et noter leur poids pour une utilisation ultérieure.
- Insérez les deux entretoises de patch (Voir l’étape 3.2) dans un rhizobox jusqu'à ce que la vis les empêche d’aller plus loin. Marquer la profondeur de la partie inférieure avec une légère marque sur le côté de la rhizobox (Figure 3) et retirer les entretoises.
- En utilisant un entonnoir avec une ouverture de la tige qui est aussi étroit que l’ouverture de rhizobox, remplir le rhizobox de la correspondant gros sac de substrat à la profondeur marquée. Déplacez l’entonnoir en arrière lentement et régulièrement afin que le substrat remplit uniformément et ne crée pas de canaux d’écoulement préférentiel.
- Lorsque le niveau de substrat atteint la profondeur marquée, remettre les entretoises dans 5 cm de chaque côté de la boîte. Continuer à remplir la boîte jusqu'à ce que le niveau de substrat est d’environ 5 cm du haut de la boîte (il faudrait substrat restant dans le sac).
- Mouiller complètement autour de chaque entretoise.
Remarque : Dans cette expérience, ceci a été réalisé en offrant 50 mL d’eau par le biais de goutteurs inséré entre le bord extérieur de chaque entretoise et le côté de la rhizobox et verser 50 mL d’eau uniformément entre les deux entretoises. Irrigation lente est nécessaire pour une humidification uniforme. - Enlever les entretoises tandis que le sol est humide, laissant une cavité vide pour les patchs.
- Un film transparent à l’extérieur de chaque rhizobox de bande (voir la Table des matières). Marquer un côté dans le traitement et l’autre en tant que contrôle et remplir les patchs des sacs appropriés à l’aide de l’entonnoir. Tracer les limites de chaque patch sur la transparence à l’aide de marqueur permanent.
- Remplissez le rhizobox uniformément avec le substrat restant. Tracer le dessus du substrat sur la transparence.
- Répéter pour le reste rhizoboxes. Enregistrez tous les sacs pour la récolte.
9. même arrosage à 60 % de la capacité de rétention d’eau
Remarque : Cette quantité d’humidité du sol a été trouvée pour empêcher les plantes de touchés par la sécheresse tout en empêchant le développement de conditions anoxiques ou la croissance des algues.
- Mesurer la capacité de rétention d’eau (WHC) du substrat14.
- Calculer le poids idéal de chaque zone ; ici définie comme la somme du poids de la rhizobox vide combiné avec le poids du substrat à la capacité de rétention d’eau de 60 %.
- Multipliez le WHC (grammes d’eau / grammes de substrat sec) de 0,6 à calculer la masse d’eau qui s’est tenue dans le substrat à 60 % HFC. Ajouter cette masse à la masse de substrat sec et la masse de la source de 15N.
- Ajouter le poids à vide de chaque case le nombre obtenue ci-dessus.
- Peser les cases une fois qu’ils ont été remplis. Soustraire le poids de chaque boîte (en g) à ce stade de son poids idéal (en g) calculé à l’étape 9.2. L’eau avec ce volume (en mL) de radiation (DI) de l’eau ionisée lentement et uniformément.
Remarque : Cette étape peut être faite à l’aide d’irrigation goutte à goutte ou d’arrosage à la main. Si l’arrosage à la main, laisser l’eau s’infiltrer complètement avant d’ajouter plus d’efforts pour éviter l’humidité du sol hétérogène et des canaux d’écoulement préférentiel.
10. amorcer la Germination et Transplantation
- Si vous utilisez des contrôles non ensemencés, mis de côté ces rhizoboxes.
- Surface-stériliser les graines de maïs en remuant pendant 1 min à 5 % NaOCl, puis rincer soigneusement à l’eau distillée.
NOTE : Dans cette expérience, les graines de six différents génotypes de maïs ont été utilisées afin d’étudier les différences génotypiques dans la plasticité de la racine. - Faire germer graines stérilisées en les plaçant sur un tissu humide de laboratoire (p. ex., Kimwipe) à l’intérieur des boîtes de Pétri et couvrir avec un autre tissu humide. Il faut éviter toute eau stagnante. Plats de Pétri de place dans un endroit sombre pour 48\u201272 h jusqu'à ce que la radicule commence seulement à émerger.
- Utilisez une spatule étroite pour creuser un trou de 2,5 cm de profondeur au centre de chaque rhizobox. Transplanter une graine germée dans le trou, en veillant à ce que la radicule est orientée directement vers le bas.
Remarque : Si la radicule est orientée vers un patch, la comparaison des taux de croissance des racines sera biaisée. - Tracer l’emplacement de la graine sur la transparence.
- Recouvrir les graines et eau avec jusqu'à 50 mL de l’eau distillée.
11. la croissance de plantes
- Faire pousser des plantes pendant 25 jours (ou aussi longtemps que désiré), maintien de 60 % WHC tout au long de la période de croissance. Surveiller la croissance des racines en traçant les racines.
- Peser chaque boîte de tous les jours de 3\u20124 et l’eau jusqu'à ce qu’il se trouve à 5 g de son poids idéal. Arrêter l’arrosage la rhizoboxes quatre jours avant la récolte pour faciliter la séparation des panneaux. Arrachez les mauvaises herbes à la main fréquemment afin que seules les racines des plantes d’intérêt sont présents.
- Retrouver les racines visibles tous les jours 3\u20124 à l’aide d’un marqueur permanent avec des couleurs bien distincts pour chaque jour de traçage.
NOTE : Marqueurs de diamètre différent peuvent être utilisés pour les racines principales et latérales, si vous le souhaitez. Il peut être utile de définir des critères pour le suivi de racine au départ car un degré de subjectivité est impliqué, en particulier si plusieurs chercheurs seront des racines de traçage ou si les racines de divers ordres ou diamètre doivent être distingués avec différents marqueurs. Dans cette expérience, la précision de reconstituer l’historique des racines visibles sur un seul côté de la boîte a été testée en traçant des racines visibles des deux côtés et en comparant la longueur totale des racines mesurée sur les transparents numérisés à la longueur totale des racines mesurée par lavage et balayage des racines. La corrélation entre la longueur des racines tracées et numérisée a été significative qu’uniquement la transparence arrière ou les deux transparents ont été utilisés. Il est donc possible de juste les racines visibles sur le panneau arrière.
12. récolte des pousses et en obtenant des racine et des échantillons de sol pour analyse
- Posez la première rhizobox plat et enlever toutes les vis.
- Récolter des échantillons de shoot. Couper les tiges à la base, rincer tous les sols avec l’eau distillée et sec à 60 ° C. Mouture pousses avec un mortier et un pilon à passer à travers un tamis de 2 mm et peser les sous-échantillons dans capsules étain pour l’analyse des isotopes (voir article 14).
- La transparence en utilisant comme guide, découpé les patchs de traitement et de contrôle avec un rasoir. Utilisez une cuillère ou une spatule pour enlever les racines et le sol adhérent de la rhizosphère dans le sac de traitement ou de contrôle respectif.
Remarque : Bien que beaucoup de méthodes existe pour la rhizosphère distincts, le sol sous l’influence des plantes racines15et la rhizosphère peut être considéré comme un dégradé plutôt qu’une zone strictement délimitée16, cette méthode suit le largement utilisé définition du sol qui adhère pour planter des racines après agitation17. - Ramasser les racines et le sol reste dans le sac de troisième.
- Passer le traitement, le contrôle et en vrac des échantillons à travers un tamis de 2 mm pour séparer les racines de substrat, enlever les racines visibles et les fragments de > 1 cm de longueur avec des pinces fines. Gardez ces échantillons distincts l’un de l’autre pour un total de trois racines et trois échantillons de substrat.
13. validation des tracés et Estimation des taux de croissance relatif des racines
- Scan de traitement, contrôle et en vrac des échantillons et calculer la longueur de la racine.
- Travaillant auprès d’un échantillon à la fois, rincez les racines soigneusement avec l’eau distillée pour enlever n’importe quel substrat restant. Organiser des échantillons dans une barquette transparente afin que les racines ne sont chevauchent pas.
- Analyser des échantillons à l’aide d’un scanner compatible avec le logiciel d’analyse de racine (par exemple, WinRhizo). S’assurer que le logiciel est étalonné pour distinguer sûrement les racines de l’arrière-plan de l’image.
- Le logiciel permet de mesurer la longueur totale des racines et la longueur des racines dans les classes de diamètre d’intérêt (par exemple, < 0,2 mm, 0.2\u20120.4 mm, 0.4\u20120.8 mm, 0.8\u20121.6 mm, > 1,6 mm).
- Calculer la longueur la densité des racines (DNR) pour traitement et contrôle des patchs et pour chaque rhizobox dans son ensemble.
- Calculer le volume de traitement et contrôle des patchs en multipliant la superficie tracée sur les transparents (voir étape 8.1) de 0,635 cm, la profondeur de la zone. Ces volumes permet de calculer la densité de longueur des racines dans le traitement et le contrôle des correctifs à l’aide de la longueur totale des racines dans chaque mise à jour (Voir l’étape 13.1.3).
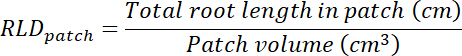
- Calculer le volume de substrat dans chaque rhizobox en multipliant la superficie tracée sur la transparence (voir étape 8.1) de 0,635 cm. calculer RLD en ce qui concerne les patchs de traitement et de contrôle.
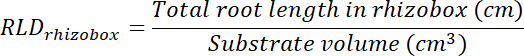
- Calculer le volume de traitement et contrôle des patchs en multipliant la superficie tracée sur les transparents (voir étape 8.1) de 0,635 cm, la profondeur de la zone. Ces volumes permet de calculer la densité de longueur des racines dans le traitement et le contrôle des correctifs à l’aide de la longueur totale des racines dans chaque mise à jour (Voir l’étape 13.1.3).
- Valider la racine méthode de suivi en comparant numérisée des systèmes racinaires et tracé des images.
- Numérisez les transparents et calculer la longueur totale des racines à l’aide du logiciel. Enregistrer l’image numérisée pour la croissance des calculs de taux.
- Les mesures de longueur totale des racines du traitement, le contrôle, la somme et en vrac des échantillons pour chaque boîte (voir étape 13.1.3).
- Tester les mesures numérisées et tracées d’une longueur totale des racines pour voir si la corrélation est significative.
Remarque : Dans l’affirmative, la méthode de traçage est validée et le taux de croissance relatif peut être calculé à chaque instant. Si ce n’est pas le cas, seules les données numérisées racine système fournissent une indication précise de la croissance des racines. Cela pourrait être le cas si la méthode de traçage est incompatible ou si les racines n’étaient pas aussi visibles pour tous les génotypes, par exemple.
- Si la méthode de traçage a été validée, calculer le taux de croissance relatif des racines pour chaque rhizobox.
- Utiliser les logiciels d’analyse de racine calibré pour faire la distinction entre les couleurs de traçage choisie pour mesurer la longueur totale des racines dans le traitement, contrôle et en vrac des échantillons à chaque instant. Calculer la longueur cumulée totale des racines à chaque instant.
- Calculer le taux de croissance relatif des racines (RGRracine) pour chaque rhizobox, aussi bien en ce qui concerne le traitement et contrôle des patchs pour chaque intervalle t1-t2 comme suit.
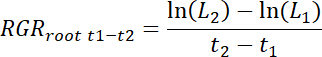
NOTE : Ici L1 est la longueur totale des racines dans le patch (somme cumulée de 11.3) à t1 jours après le repiquage (DAT) et L2est la longueur totale des racines dans le patch à t2 DAT.
14. l’analyse des 15N partitionnement chez racine, tige et le traitement des échantillons de sol
- Les racines séchées à 60 ° C, peser la biomasse et moudre pour passer à travers un tamis de 2 mm.
- Sécher les sous-échantillons de sol de traitement à 60 ° C.
- Paquet de racines et traitement en capsules étain comme pour les pousses.
NOTE : Poids idéal de l’échantillon par capsule doivent être calculé séparément pour les pousses, les racines et du sol basée sur le rapport c/n estimatif du matériel pour atteindre le montant objectif d’azote total pour l’analyse. Communiquer avec l’installation d’isotopes stables où les échantillons doivent être envoyés pour plus d’informations. Pour cette expérience, les instructions de préparation d’échantillon et une calculatrice de masse d’échantillon fourni par l’installation des isotopes stables de UC Davis ont suivi18.
ATTENTION : Prenez soin de mélanger les échantillons uniformément avant conditionnement en capsules et de préparer plusieurs capsules par exemple. Si les échantillons ne sont pas uniformément mélangés, rétablissement apparent de 15N peut dépasser le montant initialement présent. - Analyser l’azote total, δ15 et 15N contenu de chaque tige, racine et échantillon de sol de traitement.
Remarque : Dans cette expérience, plante échantillons ont été analysés par combustion avec un analyseur élémentaire PDZ Europa ANCA-GSL relié à un domaine PDZ Europa 20-20 spectromètre de masse isotopique à l’installation d’isotopes stables (UCD SIF) UC Davis. Des échantillons de sol ont été analysés avec un analyseur élémentaire Elementar Vario EL Cube couplé à un domaine PDZ Europa 20-20 spectromètre de masse isotopique à l’UCD SIF. - Calculer le montant de 15N provenant de l’étiquette dans la plante pousse et échantillons des racines.
- Tout d’abord, calculez le montant de 15N plus atmosphérique 15N dans chaque poule, 15P *:
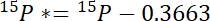
où 15P est le contenu de 15N % atomique de la piscine d’intérêt. - Deuxièmement, calculer le montant de 15N plus atmosphérique 15N dans l’étiquette, 15L *:
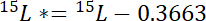
où 15L est la teneur de 15N % atomique de la source d’azote étiquetée. - En troisième lieu, calculer la quantité d’azote total dans chaque poule, Np:
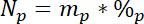
où p est la masse de la piscine (par exemple, totale des tiges sèches ou la biomasse racinaire) et %p est le pourcentage de N de ce pool. - Enfin, utiliser les résultats de 14.5.1\u201214.5.3 dans l' équation de Ndff19 pour calculer la quantité d’azote provenant de l’étiquette, Nl:
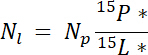
Remarque : L’équation de Ndff est utilisée pour déterminer la quantité d’azote provenant d’une source étiquetée qui est récupérée par les plantes. Il suppose qu’aucune discrimination isotopique se produit au cours de l’absorption d’azote par la plante et est généralement valable pour N sources enrichi ~1\u201210%19.
- Tout d’abord, calculez le montant de 15N plus atmosphérique 15N dans chaque poule, 15P *:
Résultats
Racines a grandi préférentiellement contre l’arrière de la boîte, comme prévu. Longueur totale des racines tracée sur le dos de la boîte varie de 400 à 1 956 cm, comparativement à 93-758 cm sur le devant de la boîte. Les coefficients de corrélation de Pearson ont été calculés entre la longueur des racines numérisés et la longueur des racines tracée sur le devant de la boîte, l’arrière de la boîte, et la somme avant et arrière a été utilisée pour déterminer si ...
Discussion
Les rhizoboxes décrits dans le présent protocole peut être utilisé pour répondre à des questions variées en science de racine et de la rhizosphère et ont trouvé divers utilise ailleurs10,20,21,22,23 , 24 , 25. d’autres chercheurs ont capté des images Time-lapse de rhizoboxes
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Les auteurs aimerait remercier des évaluateurs anonymes pour leurs commentaires, ainsi que J.C. Cahill et Tan Bao d’orientation initiale sur l’élaboration du protocole de rhizobox. A été financé par la Fondation pour l’alimentation et l’Agriculture Research, le US Department of Agriculture (USDA) National Institute of Food and Agriculture, Agricultural Experiment Station projet CA-D-PLS-2332-H, à A.G. et par le Department of Plant de UC Davis Sciences grâce à une bourse de J.S.
matériels
| Name | Company | Catalog Number | Comments |
| 1.27 cm diameter PVC pipe | JM Eagle | 530048 | 305 cm per box, cut into lengths as specified in the protocol |
| PVC side elbows | Lasco | 315498 | 2 per box |
| PVC 90-degree elbows | Charlotte | PVC 02300 0600 | 4 per box |
| PVC T joints | Charlotte | PVC 02402 0600 | 4 per box |
| Extruded acrylic panes | TAP Plastics | N/A | 2 per box, 0.64 cm thick x 40.5 cm wide x 61 cm long |
| HDPE spacers (sides) | TAP Plastics | N/A | 2 per box, 0.64 cm thick x 2.5 cm wide x 57 cm long |
| HDPE spacers (bottom) | TAP Plastics | N/A | 1 per box, 0.64 cm thick x 2.5 cm wide x 40.5 cm long |
| HDPE spacers (patch) | TAP Plastics | N/A | 2 per box, 0.64 cm thick x 3.8 cm wide x 28 cm long |
| Polyester batting | Fairfield | #A-X90 | 2.5 cm x 40.5 cm strip per box |
| 20-thread screws | N/A | N/A | 3.2 cm long, 0.64 cm diameter |
| Washers | N/A | N/A | 0.64 cm internal diameter |
| Hex nuts | N/A | N/A | sized to fit the screws |
| Light deprivation fabric | Americover, Inc. | Bold 8WB26.5 | 1 piece 95 cm wide and 69 cm long per box |
| Sand | Quikrete | No. 1113 | |
| Field soil | N/A | N/A | |
| Transparencies for tracing | FXN | FXNT1319100S | One per side of the box to be traced |
Références
- Hodge, A. Roots: The Acquisition of Water and Nutrients from the Heterogeneous Soil Environment. Progress in Botany 71. , 307-337 (2010).
- Grossman, J. D., Rice, K. J. Evolution of root plasticity responses to variation in soil nutrient distribution and concentration. Evolutionary Applications. 5 (8), 850-857 (2012).
- Zhang, H., Forde, B. G. An Arabidopsis MADS box gene that controls nutrient-induced changes in root architecture. Science. 279 (5349), 407-409 (1998).
- Hodge, A., Stewart, J., Robinson, D., Griffiths, B. S., Fitter, A. H. Competition between roots and soil micro-organisms for nutrients from nitrogen-rich patches of varying complexity. Journal of Ecology. 88 (1), 150-164 (2000).
- Trachsel, S., Kaeppler, S. M., Brown, K. M., Lynch, J. P. Shovelomics: high throughput phenotyping of maize (Zea mays L.) root architecture in the field. Plant and Soil. 341 (1-2), 75-87 (2011).
- Rogers, E. D., Monaenkova, D., Mijar, M., Nori, A., Goldman, D. I., Benfey, P. N. X-ray computed tomography reveals the response of root system architecture to soil texture. Plant Physiology. , (2016).
- Groleau-Renaud, V., Plantureux, S., Guckert, A. Effect of mechanical constraint on nodal and seminal root system of maize plants. Comptes Rendus De L Academie Des Sciences Serie Iii-Sciences De La Vie-Life Sciences. 321 (1), 63-71 (1998).
- Lin, Y., Allen, H. E., Di Toro, D. M. Barley root hair growth and morphology in soil, sand, and water solution media and relationship with nickel toxicity. Environmental Toxicology and Chemistry. 35 (8), 2125-2133 (2016).
- Wenzel, W. W., Wieshammer, G., Fitz, W. J., Puschenreiter, M. Novel rhizobox design to assess rhizosphere characteristics at high spatial resolution. Plant and Soil. 237 (1), 37-45 (2001).
- Spohn, M., Carminati, A., Kuzyakov, Y. Soil zymography - A novel in situ method for mapping distribution of enzyme activity in soil. Soil Biology and Biochemistry. 58, 275-280 (2013).
- Vollsnes, A. V., Futsaether, C. M., Bengough, A. G. Quantifying rhizosphere particle movement around mutant maize roots using time-lapse imaging and particle image velocimetry. European Journal of Soil Science. 61 (6), 926-939 (2010).
- Hewitt, E. J. . Sand and Water Culture Methods Used in the Study of Plant Nutrition. , (1966).
- Choudhary, M. I., Shalaby, A. A., Al-Omran, A. M. Water holding capacity and evaporation of calcareous soils as affected by four synthetic polymers. Communications in Soil Science and Plant Analysis. 26 (13-14), 2205-2215 (1995).
- Bakker, P. A. H. M., Berendsen, R. L., Doornbos, R. F., Wintermans, P. C. A., Pieterse, C. M. J. The rhizosphere revisited: root microbiomics. Frontiers in Plant Science. 4, 2013 (2013).
- McNear, D. H. The Rhizosphere - Roots, Soil, and Everything In Between. Nature Education Knowledge. 4 (3), 1 (2013).
- Ortas, I. Determination of the extent of rhizosphere soil. Communications in Soil Science and Plant Analysis. 28 (19-20), 1767-1776 (1997).
- . Carbon (13C) and Nitrogen (15N) Sample Preparation Available from: https://stableisotopefacility.ucdavis.edu/13cand15nsamplepreparation.html (2018)
- Barraclough, D. 15N isotope dilution techniques to study soil nitrogen transformations and plant uptake. Fertilizer research. 42 (1-3), 185-192 (1995).
- Belter, P. R., Cahill, J. F. Disentangling root system responses to neighbours: identification of novel root behavioural strategies. AoB PLANTS. 7, (2015).
- Nagel, K. A., et al. GROWSCREEN-Rhizo is a novel phenotyping robot enabling simultaneous measurements of root and shoot growth for plants grown in soil-filled rhizotrons. Functional Plant Biology. 39 (11), 891-904 (2012).
- Adu, M. O., Yawson, D. O., Bennett, M. J., Broadley, M. R., Dupuy, L. X., White, P. J. A scanner-based rhizobox system enabling the quantification of root system development and response of Brassica rapa seedlings to external P availability. Plant Root. 11, 16-32 (2017).
- Neumann, G., George, T. S., Plassard, C. Strategies and methods for studying the rhizosphere-the plant science toolbox. Plant and Soil. 321 (1-2), 431-456 (2009).
- Bodner, G., Alsalem, M., Nakhforoosh, A., Arnold, T., Leitner, D. RGB and Spectral Root Imaging for Plant Phenotyping and Physiological Research: Experimental Setup and Imaging Protocols. JoVE (Journal of Visualized Experiments). (126), e56251-e56251 (2017).
- Kuchenbuch, R. O., Ingram, K. T. Image analysis for non-destructive and non-invasive quantification of root growth and soil water content in rhizotrons. Journal of Plant Nutrition and Soil Science. 165 (5), 573-581 (2002).
- Dresbøll, D. B., Thorup-Kristensen, K., McKenzie, B. M., Dupuy, L. X., Bengough, A. G. Timelapse scanning reveals spatial variation in tomato (Solanum lycopersicum L.) root elongation rates during partial waterlogging. Plant and Soil. 369 (1-2), 467-477 (2013).
- Wu, J., et al. RhizoChamber-Monitor: a robotic platform and software enabling characterization of root growth. Plant Methods. 14 (1), 44 (2018).
- Rogers, S. W., Moorman, T. B., Ong, S. K. Fluorescent In Situ Hybridization and Micro-autoradiography Applied to Ecophysiology in Soil. Soil Science Society of America Journal. 71 (2), 620-631 (2007).
- Eickhorst, T., Tippkötter, R. Detection of microorganisms in undisturbed soil by combining fluorescence in situ hybridization (FISH) and micropedological methods. Soil Biology and Biochemistry. 40 (6), 1284-1293 (2008).
- Spohn, M., Kuzyakov, Y. Distribution of microbial- and root-derived phosphatase activities in the rhizosphere depending on P availability and C allocation - Coupling soil zymography with 14C imaging. Soil Biology and Biochemistry. 67, 106-113 (2013).
- Lv, G., Kang, Y., Li, L., Wan, S. Effect of irrigation methods on root development and profile soil water uptake in winter wheat. Irrigation Science. 28 (5), 387-398 (2010).
- Asseng, S., Ritchie, J. T., Smucker, A. J. M., Robertson, M. J. Root growth and water uptake during water deficit and recovering in wheat. Plant and Soil. 201 (2), 265-273 (1998).
- Hernandez-Ramirez, G., et al. Root Responses to Alterations in Macroporosity and Penetrability in a Silt Loam Soil. Soil Science Society of America Journal. 78 (4), 1392-1403 (2014).
- Zhang, Y. L., Wang, Y. S. Soil enzyme activities with greenhouse subsurface irrigation. Pedosphere. 16 (4), 512-518 (2006).
- Robinson, D., Hodge, A., Griffiths, B. S., Fitter, A. H. Plant root proliferation in nitrogen-rich patches confers competitive advantage. Proceedings of the Royal Society of London B: Biological Sciences. 266 (1418), 431-435 (1999).
- Lobet, G., Draye, X. Novel scanning procedure enabling the vectorization of entire rhizotron-grown root systems. Plant Methods. 9, 1 (2013).
- Swarup, R., Wells, D. M., Bennett, M. J. Root Gravitropism. Plant Roots: The Hidden Half. , (2013).
- Smit, A. L., Bengough, A. G., Engels, C., van Noordwijk, M., Pellerin, S., van de Geijn, S. C. . Root Methods: A Handbook. , (2000).
- van Dusschoten, D., et al. Quantitative 3D Analysis of Plant Roots Growing in Soil Using Magnetic Resonance Imaging1[OPEN]. Plant Physiology. 170 (3), 1176-1188 (2016).
- Metzner, R., et al. Direct comparison of MRI and X-ray CT technologies for 3D imaging of root systems in soil: potential and challenges for root trait quantification. Plant Methods. 11, 17 (2015).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon