Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Kök büyüme ve yerelleştirilmiş besin kavramaları görselleştirmek için en iyi duruma getirilmiş bir Rhizobox Protokolü
Bu Makalede
Özet
Görselleştirme ve kök büyüme in situ ölçme son derece zordur. Biz kök gelişimi ve nükleer silahların yayılmasına karşı zaman içinde yanıt-e doğru besin zenginleştirme izlemek için özelleştirilebilir rhizobox Yöntem mevcut. Bu yöntem kök plastisite yanıt bir organik azot kaynağı olarak Mısır genotypic farklılıklar analiz etmek için kullanılır.
Özet
Kökleri çalışmaya Rootkitler zordur. Toprak bir görsel ve mekanik bariyer, zor yapım izlemek için in situ yıkıcı hasat veya pahalı aletler olmadan kökleri. Biz kök büyüme zaman içinde non-yıkıcı görselleştirme sağlar ve özellikle iyi kök plastisite yanıt yerelleştirilmiş kaynak yamalar olarak eğitim için uygun bir özelleştirilebilir ve uygun fiyatlı rhizobox Yöntem mevcut. Yöntem plastisite yanıt 15N etiketli baklagil kalıntı içeren yamalar için Mısır genotypic varyasyon değerlendirmek tarafından doğrulandı. Zaman içinde temsilcisi gelişimsel ölçümler elde, kök uzunluğu dansitesi kaynağını içeren ve denetim yamalar ölçmek, kök büyüme oranları hesaplamak ve bitki kökleri ve sürgünler tarafından 15N kurtarma belirlemek için yöntemler açıklanmıştır. Avantajları, uyarılar ve yöntemin olası gelecekteki uygulamalar da ele alınmıştır. Deneysel koşullar kök büyüme verilerini önyargı değil emin olmak için bakım alınması gerekir, ancak, burada sunulan rhizobox Protokolü yeterli detaylara ile yürütüldü ise güvenilir sonuçlar verir.
Giriş
Her ne kadar genellikle gözden kaçan yerüstü meslektaşlarına göre kökleri bitki besin edinme kritik bir rol oynamaktadır. Kök yapım ve bakım önemli karbon maliyeti göz önüne alındığında, bitki kökleri sadece yiyecek arama yatırım değer nerede geliştirmek için mekanizmalar gelişmiştir. Kök sistemleri böylece verimli ve dinamik olarak kaynak yamalar etkin noktaları, alımı ve daha fazla taşıma1için phloem hızla translocating besin etkinleşmiş oranları Proliferasyona benim. Plastisite yanıt çok bitki türleri veya genotip2,3 arasında ve besin dahil4,5kimyasal forma bağlı olarak değişebilir. Değişim kök plastisite daha fazla anlayış karmaşık kök yanıtları türdeş olmayan toprak kaynakları için üreme ve besin kullanımı tarımda verimliliği artırmak için yönetim stratejileri haber keşfedilmeyi.
Görselleştirme ve kök plastisite ilgili ölçeklerde miktarının gereklilik ve alaka anlamak bitki sistemleri için rağmen teknik sorunlar teşkil etmektedir. ("Shovelomics"6) topraktan kök taç kazı bir ortak yöntem ama iyi kökleri toprak agrega arasındaki küçük gözenekleri yararlanmak ve kazı kaçınılmaz kaybı bu kırılgan köklerin bir dereceye kadar açar. Ayrıca, yıkıcı hasat zaman içinde bir kök sistemi değişiklikleri takip etmek imkansız kılıyor. Situ x-ışını bilgisayarlı tomografi gibi görüntüleme yöntemleri yüksek uzaysal çözünürlük7' de, kök ve toprak kaynakları doğrudan görselleştirme izin ama pahalı ve özel ekipman gerektirir. Hydroponic deneyler topraktan kökleri ayıklanması ile ilişkili kısıtlamaları önlemek, ancak kök Morfoloji ve mimarisi ile karşılaştırıldığında mekanik kısıtlamaları ve toprak8,9biyofiziksel karmaşıklık sulu ortamda farklı. Son olarak, rizosferde süreçleri ve fonksiyonlar bu yapay ortamda Gelişimsel plastisite ile entegre olamaz.
Biz inşaat ve zaman içinde toprakta kök büyüme karakterize etmek için düşük maliyetli, özelleştirilebilir bir yöntem olarak rhizoboxes (dar, açık taraflı dikdörtgen konteynerler) kullanımı için bir iletişim kuralı mevcut. Özel olarak tasarlanmış kare kökler tercihen gravitropism, kök uzunluğu Ölçümlerin doğruluğu artan nedeniyle arka panel karşı büyümeye teşvik ediyoruz. Rhizoboxes kök büyüme ve rizosferde etkileşimleri10,11,12incelemek için yaygın olarak kullanılır, ama burada sunulan yöntemi sadelik tek bölmeli tasarımıyla ve ucuz bir avantaj sunuyor malzemeler ve kök yanıtları için yerelleştirilmiş besin çalışma için tasarlanmıştır. Ancak, yöntem ayrıca çeşitli diğer kök ve rizosferde içi/interspecies rekabet gibi kimyasal bileşikler, mikrop veya enzim aktivitesi kayma dağılımını çalışmaya adapte olacaktır. Burada, yanıt rhizobox yöntemi doğrulamak için 15N etiketli baklagil kalıntı ve vurgulamak temsilcisi sonuçları yamalari olarak Mısır melez arasında genotypic farklar araştırıyoruz.
Protokol
1. ön ve arka panelleri ve çubukları hazırlanması
- Ön ve arka panelleri hazırlayın.
- Açık 0.635 cm kalın akrilik 40.5 cm 61 cm genişliğinde için kesilmiş iki adet kutu uzun veya önceden kesilmiş parçalar ( Tablo malzemelerigörmek) satın alın.
- Akrilik için tasarlanmış bir matkap kullanarak, 0.635 cm çapında 2.5, 19, 38 ve 53,3 cm üst yan kenarlarından 1.3 cm delik. 2.5, 20,3 ve sol tarafta (Şekil 1) 38 cm alt kenarından 1.3 cm delik.
Not: Matkap basın altı ila on sayfaları bir yığın için bir defada kullanmak için en etkili, ama el matkap de kullanılabilir. - Herhangi bir koruyucu kaplamalar akrilik çıkarın ve yavaşça kutuları montaj önce her iki panelleri temizleyin.
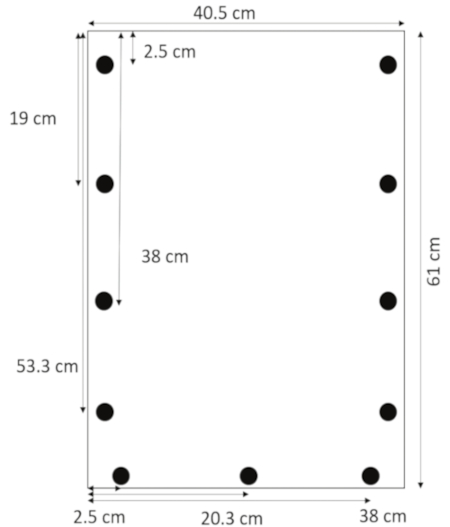
Şekil 1: delik yerleşimini. Delik delinmiş 1.3 cm 2,5, 19, 38, yan kenarlarından ve 53,3 cm üst ve 2.5, 20,3 ve sol kenar boşluğundan 38 cm alt kenarından 1.3 cm dir. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
- Yan ve alt çubukları hazırlayın.
- Üç çubukları yüksek yoğunluklu polietilen (HDPE) kutusundan başına veya satınalma iki önceden kesilmiş yan çubukları (0.635 cm kalınlığında, 2.5 cm genişliğinde, 57 cm uzunluğunda) ve bir önceden kesilmiş alt rondela (0.635 cm kalınlığında, 2.5 cm genişliğinde, 40.5 cm uzunluğunda) kesti. Tablo malzemelerinbakın.
- Kutusunun altında ve iki taraf birlikte ön ve arka paneller arasında boşluk ekleyiciler hizalayın. Bir el matkap veya matkap basın kullanarak, varolan ön delik aracılığıyla ulaşmak ve delikler tüm üç kat temiz bir şekilde geçmek böylece tekrar.
- Kelepçeler kullanılarak katmanları yerleştirin veya yükleyerek cıvata, somun ve pullar her bir arada yeni delik delinir basılı tutun (bkz. Adım 3.1).
2. yükleme Polyester vuruş kutusunun altındaki bir şerit
Not: Bu toprak ve su çubukları arasında eklem aracılığıyla sızıntı engeller.
- 2.5 cm geniş ile vuruş polyester kesmek 40.5 cm uzunluğunda ( Tablo reçetesigörmek) şeritler.
- Düz ve çubukları üstüne yalan arka panel ile vuruş doğrudan alt rondela yukarıda yatıyordu ve üst panel (Şekil 2) ile yerde tutun.
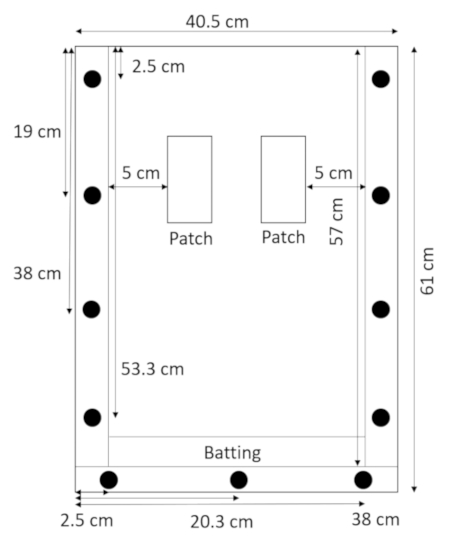
Resim 2: rhizobox vuruş ile toplandı. Vuruş rhizobox altındaki dar bir şerit sızıntı toprak ve kum engeller. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
3. Rhizoboxes Meclisi
- 20-iplik vidaları (3.2 cm uzunluğa 0.635 cm çapı göre), Pullar (0.635 cm iç çapında) ve altıgen somunlar (büyüklükte vidaları uygun, Tablo malzemelerigörmek için. kullanarak rhizoboxes bir araya
- Her bir çamaşır makinesi, ön panel, rondela, arka panel, çamaşır makinesi ve altıgen somun sıkıştırın. Vidaları çok sıkı olduğundan emin olun; kutuyu gevşek monte Eğer toprak dışarı yan çubukları ve paneller arasında boşluklar sayesinde dökülecek.
Not: Akrilik kolayca çizik ve çizikler kök ölçümleri ile müdahale, çok özenle toplanmış kutuları ele. Koruyucu malzeme aralarında yerleştirilir sürece İstifleme kutuları kaçının. - İki yama çubukları (tedavi ve kontrol yamalar oluşturmak için kullanılan ara levhaları) kutusu hazırlayın. Çubukları üzerinden yüksek yoğunluklu polietilen (HDPE) levhalar kesmek veya onları ön kesim (0.635 cm kalınlığında, 3.8 cm genişliğinde, 28 cm uzunluğunda; bkz: Malzemeler tablo) satın alın. Bir 0.635 cm her rondela üst orta hattı (Şekil 3) boyunca 2 cm çapında delik.
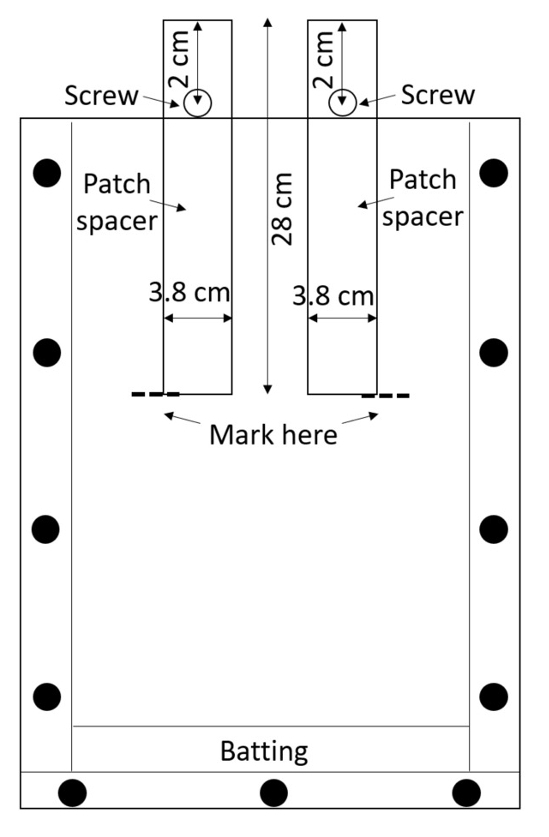
Şekil 3: yama çubukları. HDPE merkezi şeritler eklenen vida onları içine belgili tanımlık kutu düşmekten tutun. Rhizobox çubukları çevresindeki toprak doludur, toprak ıslak ve çubukları bırakın boş tedavi ve kontrol yamalar için kaldırılır. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
- Vida taşınmamıza engel olur kadar boşluk Ekleyici kısmen rhizobox eklenebilir bir vida bir somun her delikten güvenli (Şekil 3) daha fazla.
Not: toprak çubukları ıslak ve çubukları kaldırılır, iki boş boşluk kalır bu nitrojen içeren tedavi yama ve denetim yama için uygun yüzeyler ile doldurulabilir.
4. yapı PVC çerçeve açılı Rhizoboxes desteklemek için
Not: kutu bir açıyla yerleştirildiğinde, tüm kökleri için izlemeyi görünecek şekilde karşı arka panel büyümeye kökleri gravitropism teşvik edecektir. Polivinil klorür (PVC) Şekil 4 sonuç itibariyle rhizobox tutar bir çerçeve içinde boyutları bir tezgah için yaklaşık 55 ° açı.
- 1.3 cm çap PVC kutu başına 13 parçalar koparıp: 2 × 44 cm uzunlukta, 3 × 42 cm uzunlukta, 2 × 36,3 cm uzunlukta, 2 × 25,4 cm uzunlukta ve 4 × 3,8 cm uzunlukta (bkz: Malzemeler tablo).
Not: Chop testere verimliliği ve hatta kesim için önerilir. - 4 × 2 yönlü dirsek, 2 × 3'lü dirsek ve 4 T-eklem ( Tablo malzemelerigörmek) Şekil 4' te gösterildii gibi kutusunu düzenlemek için kullanın.
Not: Çerçeveler ek tutkal kararlı olmalıdır, ancak PVC yapıştırıcı-ebilmek var olmak kullanılmış eğer gerekli.
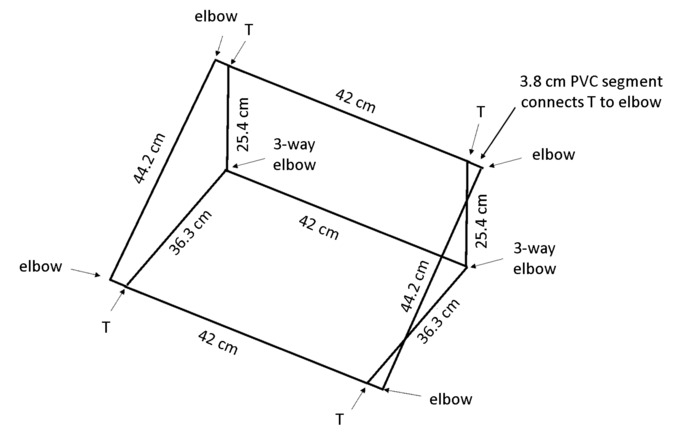
Şekil 4: çerçeve rhizoboxes destek. Hafif çerçeve için belirtilen uzunlukları kesme ve belirtilen ortak türleri kullanarak bağlı PVC inşa edilmiştir. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
5. ışık ve ısı yansıtmak için koruyucu durumlarda dikiş
Not: Bu gibi durumlarda emin olmak için ışık hariç bu yüzden kökleri ışık, kök plastisite yanıt-e doğru ışık kaçınma değil ve yamalar besin kaynağında tarafından tahrik edilmektedir gözlenen kaçının. Işık yoksunluğu kumaş Ayrıca rhizoboxes içindeki sıcaklık ısı stres önlemek için yardımcı azaltır.
- Işık yoksunluğu kumaş (bir tarafta beyaz ve siyah diğer özel malzeme) adet yaklaşık 95 cm genişliğinde ve 69 cm uzunluğunda kesmek ( Tablo malzemelerigörmek). Kutu başına tek parça gereklidir.
- Her parça bir 47,5 cm × 69 cm kol oluşturmak için uzun kenarı boyunca ikiye katlayın. Denim, ağır kapitone iplik ve dar bir dikiş için tasarlanmış bir dikiş makinesi iğne kullanarak, alt ve yan tarafa olan her kol ¾ dikmek. Çengelli iğne ile birlikte üst köşeleri pin.
6. 1:1 (V/V) toprak hazırlanması: kum substrat Rhizoboxes doldurmak için
- Yaklaşık 1000 cm3 kutu başına alan toprak (faiz sitesinden) toplamak. Toprak ile sığ tepsilerine 60 ° C'de sabit ağırlık Kuru
Not: Bu deneme için toprak hemen ardından hasat bir organik yönetilen Mısır alanında 0\u201210 cm derinlik toplanmıştır. - Bir harç ve 2 mm elekten geçirmek için havaneli ile toprak eziyet. Toprak, bilinen bir birim ağırlığında tarafından toprak toplu yoğunluğunu ölçmek.
- Kum (gibi ucuz bir donanım mağazadan satın alınabilir; Tablo malzemelerigörmek oyun kum) elde etmek ve toplu yoğunluğunu ölçmek.
- Eşit birimleri kum ve toprak bir kova içine dışarı ölçmek ve iyice karıştırın. Bir huni kutusu yavaş yavaş ve eşit için 2.5 cm en baştan yerleşmek belgili tanımlık substrate neden kutusunu sallayarak olmadan doldurmak için kullanın. Bu hacmi substrat ölçün; yaklaşık 1,272 cm3olması gerektiği.
- Kum toplu yoğunluğu her kutu için gerekli kum kütlesi elde etmek için yarım bu birim tarafından çarpın. Her kutu için gerekli toprak kütlesi elde etmek için toprak toplu yoğunluğu ile aynı işlemi uygulayın.
Not: alan toprak ve kum bu deneyde kullanılan için bu 976 g kum ve toprak 774 g, ama bu tutarlar kullanılan toprak toplu yoğunluğuna bağlı olarak değişir. - Bir büyük ZIP-üst plastik torba başına rhizobox etiket, kum ve toprak uygun kitleler torbaya tartmak ve iyice lunaparkçı.
- Bu 1:1 toprak analiz- ve substrat besin içeriği ve 15N (δ15N) doğal zenginliği için.
7. tedavi ve kontrol yamaları substrat hazırlık
- Rhizobox, bir tedavi yama ve bir denetim yama için her iki küçük ZIP-üst plastik çanta etiketleyin. Toprak 30 g tartmak: iki karşılık gelen küçük torbalar içine kum substrat her büyük çanta (adım 6,6).
- Belgili tanımlık substrate tedavi yama için bir 15N etiketli azot kaynağı ile karıştırın. Bunun için 15N etiketli bitki kalıntısı veya diğer N-kaynak 1 g tartmak (tutar-ebilmek var olmak ayarlamak istediğiniz gibi) her tedavi torbaya (küçük ZIP-top çanta) ve iyice karıştırın.
Not: Bu deneme için 15N etiketli yonca ve burçak kalıntı karışımı kullanıldı. Yonca ve fiğ tohumu vermikülit ve kum bir 1:1 karışım ekili ve sera koşullarında yetiştirilen. Bitkiler günlük deiyonize su ile sulanan ve iki kez 15N etiketli azot kaynakları içeren Long Ashton çözüm13 1/100 gücü ile haftalık. Tüm yerüstü biyokütle dikim, sonraki 4 hafta, kurutulmuş ve 2 mm elekten geçirmek için zemin hasat. Farklı bir besin seçilirse, özellikle bu öğe toprakta, mobil ise pilot deneyler leaching için test etmek için teşvik edilmektedir. Besinlerin yavaş salımlı formları kullanılabilir veya farklı rhizobox tasarım döngülerine (Örneğin, ayrı bölmeleri10) gerekirse kısıtlamak için seçilmiş.
8. Rhizobox substrat ile birlikte yüklenmesi ve kurulması tedavi ve kontrol yamalar
- Her boş rhizobox tartmak ve ağırlıkları daha sonra kullanmak için kaydedebilirsiniz.
- Vida onları daha fazla gitmekten engeller kadar iki yama çubukları (bkz. Adım 3.2) bir rhizobox sokun. Rhizobox (Şekil 3) kenarında hafif bir işareti ile alt kenarı derinliği işareti ve çubukları kaldırmak.
- Olduğu gibi bir kök açılış ile bir huni kullanarak rhizobox açılış olarak dar, substrat karşılık gelen büyük çanta rhizobox işaretli derinlik için doldurun. Huni ileri geri ve yavaş yavaş ve eşit olarak hareket böylece yüzey düzgün doldurur ve Tercihli akış kanalları oluşturmaz.
- İşaretli derinlik substrat düzeyine eriştiğinde, çubukları kutusunun her taraftan 5 cm geri koy. Substrat düzeyinde (çanta içinde kalan substrat olmalıdır) kutusunun üstünde yaklaşık 5 cm olana kutusunu doldurma devam edin.
- İyice her spacer ıslak.
Not: Bu deneyde, bu 50 mL su damla yayıcılar her spacer dış kenarı ile rhizobox tarafında ve iki boşluk ekleyiciler arasında eşit olarak su dökerek 50 mL arasına eklenen aracılığıyla sunarak sağlanır. Yavaş sulama için Tekdüzen ıslatma gereklidir. - Toprak yamaları için boş bir boşluk bırakarak ıslak iken çubukları kaldırmak.
- Her rhizobox dışına bir şeffaf film bant ( Tablo malzemelerigörmek). Tedavi olarak bir tarafı ve bir denetim olarak işaretlemek ve huni kullanarak uygun çanta yamalar doldurun. Kalıcı marker kullanarak saydamlık her karesinde sınırlarını takip et.
- Rhizobox eşit olarak kalan substrat ile doldurun. Belgili tanımlık substrate şeffaflık tepesine takip et.
- Kalan rhizoboxes için yineleyin. Hasat için tüm çanta kaydedin.
9. bile sulama için % 60'ı su tutma kapasitesi
Not: Bu miktarda toprak nemi anoksik koşulların veya yosun büyüme gelişme önlenmesi ise kuraklık stres yaşamaya gelen bitkiler önlemek için bulundu.
- Substrat14su tutma kapasitesi (WHC) ölçmek.
- Her kutu ideal kilo hesaplama; Burada % 60'ı su tutma kapasitesi, substrat ağırlığı ile birlikte boş rhizobox ağırlık toplamı olarak tanımlanan.
- WHC çarpma (gram su / kuru substrat gram) su kütlesi elde etmek için 0,6 tarafından düzenlenen içinde belgili tanımlık substrate % 60 WHC. Bu kitle kuru substrat kütlesi ve 15N kaynak kitle için ekleyin.
- Her kutu boş ağırlığı yukarıda elde numarasını ekleyin.
- Onlar doldurduktan sonra kutuları tartın. 9.2. adımda hesaplanan Bu noktada ideal ağırlığı (g) üzerinden her kutuda (g) ağırlığını çıkarma. Su (mL içinde) bu hacmi ile (DI) su yavaş yavaş ve eşit olarak de-iyonize.
Not: Bu adımı yapılabilir damla sulama kullanarak veya el ile sulama. El ile sulama, su tamamen hànzú toprak nem koşulları ve Tercihli akış kanalları önlemek için daha fazla eklemeden önce sızdırmak için izin.
10. tohum çimlenme ve nakli
- Unplanted denetimleri kullanıyorsanız, bu rhizoboxes bir kenara koyun.
- Yüzey-Mısır tohumu için %5 NaOCl 1 dk sonra durulama DI suda iyice karıştırmaya tarafından sterilize.
Not: Bu deneyde, altı farklı Mısır genotip tohumları kök plastisite genotypic farklılıkları araştırmak amacıyla kullanılmıştır. - Petri yemekler içinde (Örneğin, Kimwipe) ıslak laboratuvar doku onları yerleştirerek ve başka bir nemli dokusu ile kapsayan tarafından sterilize tohum çimlenme. Herhangi bir su olmamalıdır. Radicle sadece çıkmaya başlayana kadar 48\u201272 h için karanlık bir yerde yer Petri yemekler.
- Her rhizobox ortasına 2.5 cm derinlikte bir çukur kazmak için dar bir spatula kullanın. Radicle doğrudan odaklı sağlamak deliğe germinated tohum nakli aşağıya doğru.
Not: Eğer radicle ya da yama doğru açılı, önyargılı kök büyüme oranları karşılaştırılması. - Tohum şeffaflık konumunu takip et.
- Tohum ve su ilâ 50 mL DI su ile kapağı.
11. bitkiler büyüme
- 25 gün (veya istediğiniz gibi sürece) bitkiler büyümek, % 60'ı korumak WHC büyüyen süresi boyunca. Kök büyüme kökleri izini sürerek izlemek.
- İdeal ağırlığı 5 g içinde olana her kutu her 3\u20124 gün ve su düşünürüm. Rhizoboxes dört gün öncesine panellerinin ayrımı kolaylaştırmak için hasat sulama durdurmak. Böylece sadece bitki kökleri ilgi mevcut otlar el ile sık sık kaldırın.
- Görünür kökleri her 3\u20124 gün her izleme günlüğüne açıkça ayırt renkleri ile kalıcı bir kalem kullanarak izleyin.
Not: Farklı çap işaretleri isterseniz birincil ve yanal kökleri için kullanılabilir. Özellikle birden çok araştırmacılar izleme kökleri olacaksa bir ölçüde öznellik dahil beri veya farklı olan siparişleri veya çap kökleri farklı işaretleri ile ayırt edici olacaksak başlangıçta kök izleme ölçütlerini tanımlamak yararlı olabilir. Bu denemede kutusunun yalnızca bir tarafındaki görünür kökleri izleme doğruluğunu her iki tarafta görünür kökleri izleme tarafından test edildi ve yıkama ve kökleri tarama ölçülen toplam kök uzunluğu için taranan asetat üzerinde ölçülen toplam kök uzunluğu karşılaştırma. İzlenen ve taranan kök uzunluğu arasındaki korelasyon olup sadece arka saydamlığı veya her iki asetat kullanıldı ne olursa olsun önemli. Bu nedenle sadece arka panelde görünür kökleri izlemek mümkündür.
12. hasat sürgünler ve kök ve toprak örnekleri analiz için edinme
- İlk rhizobox yatıyordu düz ve tüm vidayı çıkarın.
- Ateş örnekleri hasat. Sürgünler tabanında küçük, herhangi bir toprak DI su ile durulayın ve 60 ° C'de Kuru Bir harç ve 2 mm elek ile geçmek ve subsamples izotop analizi (bakınız Bölüm 14) için teneke kapsül içine tartmak havaneli ile eziyet vuruyor.
- Şeffaflık bir kılavuz olarak kullanarak, tedavi ve kontrol yamalar jiletle kesti. Kökleri ve yapışan rizosferde toprak ilgili tedavi veya denetim torbaya kepçe için bir kaşık veya spatula kullanın.
Not: ayrı rizosferde toprak için pek çok yöntem var, toprak bitki etkisi altında15kökler ve rizosferde kesinlikle belirlendi bölge16yerine bir degrade kabul edilebilir olsa da, bu yöntemi yaygın olarak kullanılan izler bitki kökleri17sallayarak sonra'nin toprak tanımı. - Kalan kökler ve toprak üçüncü torbaya kepçe.
- Tedavi, kontrol, geçmek ve kökleri herhangi bir görünür kökleri veya parçaları kaldırarak substrat ayırmak için 2 mm elek aracılığıyla toplu örnekleri > 1 cm uzunluğunda ince cımbız ile. Bu örnekleri birbirinden ayrı üç kök toplamda dolar ve üç substrat örnek tutmak.
13. Tracings ve tahmini göreli kök büyüme oranları doğrulama
- Tedavi, kontrol, inceden inceye gözden geçirmek ve örnekleri toplu ve kök uzunluğu hesaplamak.
- Bir örnek ile bir anda çalışıyor, kökleri kalan herhangi bir yüzey kaldırmak için dikkatli bir şekilde DI su ile durulayın. Kökleri olmayan üst üste gelen açık bir tepsi örnekleri düzenleyin.
- (Örneğin, WinRhizo) kök analiz yazılımı ile uyumlu bir tarayıcı kullanarak örnekleri inceden inceye gözden geçirmek. Belgili tanımlık bilgisayar yazılımı güvenilir görüntü arka plandan kökleri ayırt etmek için kalibre edilmiş emin olun.
- Toplam kök uzunluğu ve ilgi (Örneğin, < 0.2 mm, 0.2\u20120.4 mm, 0.4\u20120.8 mm, 0.8\u20121.6 mm, > 1.6 mm) çapında sınıflarında kök uzunluğu ölçmek için yazılımı kullanın.
- Kök uzunluğu yoğunluğu (RLD) tedavi ve kontrol yamalar ve her rhizobox bir bütün olarak hesaplayın.
- Her şeffaflık takip alanı çarpılarak tedavi ve kontrol düzeltme ekleri hacmini hesaplamak (bkz. Adım 8.1) 0.635 cm, derinlik kutusunun. Bu birimlerin kök uzunluğu toplam kök uzunluğu her yama kullanılarak tedavi ve kontrol yamalar dansitesi hesaplamak için kullanın (bkz. adım 13.1.3).
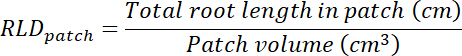
- Şeffaflık takip alan çarparak her rhizobox substrat hacmi hesaplamak (bkz. Adım 8.1) tarafından 0.635 cm. hesapla RLD tedavi ve kontrol yamalar gelince.
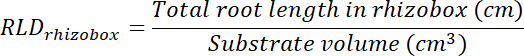
- Her şeffaflık takip alanı çarpılarak tedavi ve kontrol düzeltme ekleri hacmini hesaplamak (bkz. Adım 8.1) 0.635 cm, derinlik kutusunun. Bu birimlerin kök uzunluğu toplam kök uzunluğu her yama kullanılarak tedavi ve kontrol yamalar dansitesi hesaplamak için kullanın (bkz. adım 13.1.3).
- Taranan kök sistemleri karşılaştırarak yöntemi izleme ve resimleri takip kök doğrulayın.
- Her saydam inceden inceye gözden geçirmek ve toplam kök uzunluğu yazılımı kullanarak hesaplayın. Taranan resmin için büyüme oranı hesaplamalarını kaydedin.
- Tedavi, kontrol, toplam kök uzunluk ölçüleri toplamı ve toplu örnekleri her kutu için (bkz. adım 13.1.3).
- İlişki istatistiksel olarak anlamlı olup olmadığını görmek için toplam kök uzunluğu taranmış ve izlenen ölçümleri sınayın.
Not: Eğer öyleyse, izleme yöntemi doğrulanır ve göreli büyüme oranları her zaman noktası hesaplanabilir. Eğer değilse, yalnızca taranan kök sistemi veri kök büyüme hakkında doğru bir bilgi vermez. Bu durum izleme metodoloji tutarsız veya kökleri örneğin eşit olarak tüm genotip için görünür değildi olabilir.
- İzleme yöntemi doğrulandı, göreli kök büyüme oranları her rhizobox için hesaplar.
- Tedavi, kontrol, toplam kök uzunluğu ölçmek ve örnekleri, her zaman bir noktada toplu seçilen izleme renkleri ayırt etmek için kalibre kök analiz yazılımı kullanın. Kümülatif toplam kök uzunluğu, her zaman bir noktada hesaplayın.
- Göreli kök büyüme oranları (RGRkök) yanı sıra, tedavi ve kontrol düzeltme eklerini her zaman aralığı t1-t2 için her rhizobox için aşağıdaki gibi hesaplar.
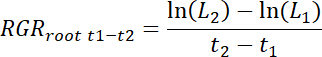
Not: Burada L1 yama (11,3 kümülatif toplamı) Toplam kök uzunluğu (DAT) nakli sonra t1 gün ve L2t2 dat yama içinde toplam kök uzunluğu
14. 15N kök, ateş ve tedavi toprak örnekleri arasında bölümleme analizi
- 60 ° C'de kuru kökleri biyokütle tartmak ve 2 mm elekten geçirmek için eziyet.
- 60 ° C'de tedavi toprak kuru subsamples
- Kökleri ve teneke kapsül tedaviye sürgünler gibi ile paket.
Not: Kapsül Ideal örnek ağırlığı ayrı ayrı sürgünler, kökleri ve toprak analizi için toplam N hedef miktarını elde etmek için malzeme tahmini C/N oranı temel hesaplanmalıdır. Daha fazla bilgi için sunulacak örnekleri nerede kararlı izotop ile temasa geçin. Bu deneme için izlenen18örnek hazırlama yönergeleri ve örnek ağırlık UC Davis kararlı izotop aracı tarafından sağlanan hesap makinesi vardı.
Dikkat: örnekleri eşit olarak önce ambalaj kapsül içine karıştırın ve örnek başına birden fazla kapsül hazırlamak için özel dikkat. Eğer örnekleri eşit olarak karışık değil, 15N belirgin kurtarma aslında mevcut miktar aşabilir. - Toplam N, δ15 ve 15N içeriği her ateş, kök ve tedavi toprak örneği analiz.
Not: Bu deneyde, bitki örnekleri yanma ile bir PDZ Europa 20-20 izotop oranı kütle spektrometre UC Davis kararlı izotop tesisinde (UCD SIF) arabirimli bir PDZ Europa ANCA-GSL elemental analyzer ile analiz edildi. Toprak örnekleri için bir PDZ Europa 20-20 izotop oranı kütle spektrometre UCD SIF at arabirimli bir durumda Vario EL küp elemental Çözümleyicisi ile analiz edildi. - Tutarı hesaplamak 15bitki etiketinde elde edilen N ateş ve kök örnekleri.
- İlk olarak, 15N atmosferik 15N her havuzda, 15P *aşan tutarı hesaplamak:
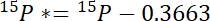
Havuzun ilgi atomik % 15N içerik 15P nerede. - İkinci olarak, 15N atmosferik 15N etiketindeki 15L *aşan tutarı hesaplamak:
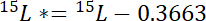
etiketli N kaynak atomik % 15N içerik 15L nerede. - Üçüncü olarak, toplam N Npher havuzda miktarını hesaplamak:
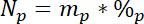
mp Havuzu (Örneğin, Toplam Kuru ateş ya da kök biyokütle) ve %p kitle nerede o havuza N ' dir. - Son olarak, 14.5.1\u201214.5.3 sonuçlarını Ndff denklem19 ' N Nletiketten elde edilen miktarını hesaplamak için kullanın:
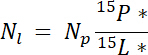
Not: Ndff Denklem N bitkiler tarafından kurtarılır etiketli bir kaynaktan gelen miktarını belirlemek için kullanılır. Bu izotopik hiçbir ayrımcılık N alımı sırasında bitki tarafından oluşan ve genellikle N kaynakları zenginleştirilmiş ~1\u201210%19için geçerli olduğunu varsayar.
- İlk olarak, 15N atmosferik 15N her havuzda, 15P *aşan tutarı hesaplamak:
Sonuçlar
Kökler tercihen kutusunun arka karşı beklenen büyüdü. Toplam izlenen kök uzunluğu 400 arası 1,956 cm, 93-758 cm kutusunun ön karşılaştırıldığında değişmekteydi kutusunun arkasında. İkili Pearson korelasyon katsayıları taranan kök uzunluğu ve izlenen kök uzunluğu kutusunun arkasında kutusunun ön arasında hesaplanan ve ön ve arka toplamı doğru izleme toplam kök uzunluğu yansıyan olup olmadığını belirlemek için kullanılan (n = 23, olarak bir kutu fa...
Tartışmalar
Bu protokol için açıklanan rhizoboxes kök ve rizosferde bilim çeşitli sorulara cevap ve çeşitli başka bir yerde10,20,21,22,23 kullanır-si olmak kurmak için kullanılabilir , 24 , 25. diğer araştırmacılar rhizoboxes21,25
Açıklamalar
Yazarlar ifşa gerek yok.
Teşekkürler
Yazarlar için onların geribildirim, hem de J.C. Cahill adsız yorumcular ve Tan Bao rhizobox Protokolü Geliştirme Başlangıç Kılavuzu için kabul etmek istiyorum. Finansman, UC Davis bölümü bitki ve gıda ve Tarım Araştırma, gıda ve tarım, tarım deney istasyonu projesi CA-D-PLS-2332-H, A.G. için bize Bakanlığı, Tarım (USDA) Ulusal Enstitüsü Vakfı tarafından sağlanan yapıldı. Bir arkadaş grubu için JS ile Bilimler
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1.27 cm diameter PVC pipe | JM Eagle | 530048 | 305 cm per box, cut into lengths as specified in the protocol |
| PVC side elbows | Lasco | 315498 | 2 per box |
| PVC 90-degree elbows | Charlotte | PVC 02300 0600 | 4 per box |
| PVC T joints | Charlotte | PVC 02402 0600 | 4 per box |
| Extruded acrylic panes | TAP Plastics | N/A | 2 per box, 0.64 cm thick x 40.5 cm wide x 61 cm long |
| HDPE spacers (sides) | TAP Plastics | N/A | 2 per box, 0.64 cm thick x 2.5 cm wide x 57 cm long |
| HDPE spacers (bottom) | TAP Plastics | N/A | 1 per box, 0.64 cm thick x 2.5 cm wide x 40.5 cm long |
| HDPE spacers (patch) | TAP Plastics | N/A | 2 per box, 0.64 cm thick x 3.8 cm wide x 28 cm long |
| Polyester batting | Fairfield | #A-X90 | 2.5 cm x 40.5 cm strip per box |
| 20-thread screws | N/A | N/A | 3.2 cm long, 0.64 cm diameter |
| Washers | N/A | N/A | 0.64 cm internal diameter |
| Hex nuts | N/A | N/A | sized to fit the screws |
| Light deprivation fabric | Americover, Inc. | Bold 8WB26.5 | 1 piece 95 cm wide and 69 cm long per box |
| Sand | Quikrete | No. 1113 | |
| Field soil | N/A | N/A | |
| Transparencies for tracing | FXN | FXNT1319100S | One per side of the box to be traced |
Referanslar
- Hodge, A. Roots: The Acquisition of Water and Nutrients from the Heterogeneous Soil Environment. Progress in Botany 71. , 307-337 (2010).
- Grossman, J. D., Rice, K. J. Evolution of root plasticity responses to variation in soil nutrient distribution and concentration. Evolutionary Applications. 5 (8), 850-857 (2012).
- Zhang, H., Forde, B. G. An Arabidopsis MADS box gene that controls nutrient-induced changes in root architecture. Science. 279 (5349), 407-409 (1998).
- Hodge, A., Stewart, J., Robinson, D., Griffiths, B. S., Fitter, A. H. Competition between roots and soil micro-organisms for nutrients from nitrogen-rich patches of varying complexity. Journal of Ecology. 88 (1), 150-164 (2000).
- Trachsel, S., Kaeppler, S. M., Brown, K. M., Lynch, J. P. Shovelomics: high throughput phenotyping of maize (Zea mays L.) root architecture in the field. Plant and Soil. 341 (1-2), 75-87 (2011).
- Rogers, E. D., Monaenkova, D., Mijar, M., Nori, A., Goldman, D. I., Benfey, P. N. X-ray computed tomography reveals the response of root system architecture to soil texture. Plant Physiology. , (2016).
- Groleau-Renaud, V., Plantureux, S., Guckert, A. Effect of mechanical constraint on nodal and seminal root system of maize plants. Comptes Rendus De L Academie Des Sciences Serie Iii-Sciences De La Vie-Life Sciences. 321 (1), 63-71 (1998).
- Lin, Y., Allen, H. E., Di Toro, D. M. Barley root hair growth and morphology in soil, sand, and water solution media and relationship with nickel toxicity. Environmental Toxicology and Chemistry. 35 (8), 2125-2133 (2016).
- Wenzel, W. W., Wieshammer, G., Fitz, W. J., Puschenreiter, M. Novel rhizobox design to assess rhizosphere characteristics at high spatial resolution. Plant and Soil. 237 (1), 37-45 (2001).
- Spohn, M., Carminati, A., Kuzyakov, Y. Soil zymography - A novel in situ method for mapping distribution of enzyme activity in soil. Soil Biology and Biochemistry. 58, 275-280 (2013).
- Vollsnes, A. V., Futsaether, C. M., Bengough, A. G. Quantifying rhizosphere particle movement around mutant maize roots using time-lapse imaging and particle image velocimetry. European Journal of Soil Science. 61 (6), 926-939 (2010).
- Hewitt, E. J. . Sand and Water Culture Methods Used in the Study of Plant Nutrition. , (1966).
- Choudhary, M. I., Shalaby, A. A., Al-Omran, A. M. Water holding capacity and evaporation of calcareous soils as affected by four synthetic polymers. Communications in Soil Science and Plant Analysis. 26 (13-14), 2205-2215 (1995).
- Bakker, P. A. H. M., Berendsen, R. L., Doornbos, R. F., Wintermans, P. C. A., Pieterse, C. M. J. The rhizosphere revisited: root microbiomics. Frontiers in Plant Science. 4, 2013 (2013).
- McNear, D. H. The Rhizosphere - Roots, Soil, and Everything In Between. Nature Education Knowledge. 4 (3), 1 (2013).
- Ortas, I. Determination of the extent of rhizosphere soil. Communications in Soil Science and Plant Analysis. 28 (19-20), 1767-1776 (1997).
- . Carbon (13C) and Nitrogen (15N) Sample Preparation Available from: https://stableisotopefacility.ucdavis.edu/13cand15nsamplepreparation.html (2018)
- Barraclough, D. 15N isotope dilution techniques to study soil nitrogen transformations and plant uptake. Fertilizer research. 42 (1-3), 185-192 (1995).
- Belter, P. R., Cahill, J. F. Disentangling root system responses to neighbours: identification of novel root behavioural strategies. AoB PLANTS. 7, (2015).
- Nagel, K. A., et al. GROWSCREEN-Rhizo is a novel phenotyping robot enabling simultaneous measurements of root and shoot growth for plants grown in soil-filled rhizotrons. Functional Plant Biology. 39 (11), 891-904 (2012).
- Adu, M. O., Yawson, D. O., Bennett, M. J., Broadley, M. R., Dupuy, L. X., White, P. J. A scanner-based rhizobox system enabling the quantification of root system development and response of Brassica rapa seedlings to external P availability. Plant Root. 11, 16-32 (2017).
- Neumann, G., George, T. S., Plassard, C. Strategies and methods for studying the rhizosphere-the plant science toolbox. Plant and Soil. 321 (1-2), 431-456 (2009).
- Bodner, G., Alsalem, M., Nakhforoosh, A., Arnold, T., Leitner, D. RGB and Spectral Root Imaging for Plant Phenotyping and Physiological Research: Experimental Setup and Imaging Protocols. JoVE (Journal of Visualized Experiments). (126), e56251-e56251 (2017).
- Kuchenbuch, R. O., Ingram, K. T. Image analysis for non-destructive and non-invasive quantification of root growth and soil water content in rhizotrons. Journal of Plant Nutrition and Soil Science. 165 (5), 573-581 (2002).
- Dresbøll, D. B., Thorup-Kristensen, K., McKenzie, B. M., Dupuy, L. X., Bengough, A. G. Timelapse scanning reveals spatial variation in tomato (Solanum lycopersicum L.) root elongation rates during partial waterlogging. Plant and Soil. 369 (1-2), 467-477 (2013).
- Wu, J., et al. RhizoChamber-Monitor: a robotic platform and software enabling characterization of root growth. Plant Methods. 14 (1), 44 (2018).
- Rogers, S. W., Moorman, T. B., Ong, S. K. Fluorescent In Situ Hybridization and Micro-autoradiography Applied to Ecophysiology in Soil. Soil Science Society of America Journal. 71 (2), 620-631 (2007).
- Eickhorst, T., Tippkötter, R. Detection of microorganisms in undisturbed soil by combining fluorescence in situ hybridization (FISH) and micropedological methods. Soil Biology and Biochemistry. 40 (6), 1284-1293 (2008).
- Spohn, M., Kuzyakov, Y. Distribution of microbial- and root-derived phosphatase activities in the rhizosphere depending on P availability and C allocation - Coupling soil zymography with 14C imaging. Soil Biology and Biochemistry. 67, 106-113 (2013).
- Lv, G., Kang, Y., Li, L., Wan, S. Effect of irrigation methods on root development and profile soil water uptake in winter wheat. Irrigation Science. 28 (5), 387-398 (2010).
- Asseng, S., Ritchie, J. T., Smucker, A. J. M., Robertson, M. J. Root growth and water uptake during water deficit and recovering in wheat. Plant and Soil. 201 (2), 265-273 (1998).
- Hernandez-Ramirez, G., et al. Root Responses to Alterations in Macroporosity and Penetrability in a Silt Loam Soil. Soil Science Society of America Journal. 78 (4), 1392-1403 (2014).
- Zhang, Y. L., Wang, Y. S. Soil enzyme activities with greenhouse subsurface irrigation. Pedosphere. 16 (4), 512-518 (2006).
- Robinson, D., Hodge, A., Griffiths, B. S., Fitter, A. H. Plant root proliferation in nitrogen-rich patches confers competitive advantage. Proceedings of the Royal Society of London B: Biological Sciences. 266 (1418), 431-435 (1999).
- Lobet, G., Draye, X. Novel scanning procedure enabling the vectorization of entire rhizotron-grown root systems. Plant Methods. 9, 1 (2013).
- Swarup, R., Wells, D. M., Bennett, M. J. Root Gravitropism. Plant Roots: The Hidden Half. , (2013).
- Smit, A. L., Bengough, A. G., Engels, C., van Noordwijk, M., Pellerin, S., van de Geijn, S. C. . Root Methods: A Handbook. , (2000).
- van Dusschoten, D., et al. Quantitative 3D Analysis of Plant Roots Growing in Soil Using Magnetic Resonance Imaging1[OPEN]. Plant Physiology. 170 (3), 1176-1188 (2016).
- Metzner, R., et al. Direct comparison of MRI and X-ray CT technologies for 3D imaging of root systems in soil: potential and challenges for root trait quantification. Plant Methods. 11, 17 (2015).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır