需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
一种优化的 Rhizobox 协议, 用于可视化根系生长和对局部营养素的响应
摘要
在原位可视化和测量根系生长是极具挑战性的。我们提出了一种可自定义的 rhizobox 方法, 可根据营养丰富的时间跟踪根系发育和增殖。该方法用于分析玉米根系可塑性对有机氮源反应的基因型差异。
摘要
根是众所周知的难以研究。土壤既是一种视觉和机械屏障, 在没有破坏性收获或昂贵设备的情况下, 很难在原地跟踪根。我们提出了一种可自定义且经济实惠的 rhizobox 方法, 可在一段时间内实现根系生长的无损可视化, 特别适合研究本地化资源修补程序的根塑性。通过对含有15个 n-标记豆科植物残渣的斑块的塑性响应进行了评价, 验证了玉米基因型的变化。方法描述了随着时间的推移获得代表性的发育测量值, 测量含资源和控制斑块中的根长度密度, 计算根系生长速率, 并通过植物根和芽来确定15N 的回收率。本文还讨论了该方法的优点、注意事项和潜在的未来应用。尽管必须注意确保实验条件不偏向根增长数据, 但在这里提出的 rhizobox 协议如果进行得足够注意细节, 就会产生可靠的结果。
引言
根系在植物养分采集中起着至关重要的作用, 但与地面上的同类相比往往被忽视。鉴于根系建造和维护的大量碳成本, 植物在觅食是值得投资的地方, 进化出了形成根系的机制。因此, 根系可以通过在热点中增殖、上调吸收率和快速转运养分向韧皮部进一步输送1, 从而高效、动态地挖掘资源斑块。可塑性反应在植物种类或基因型2、3和根据所涉及的养分的化学形式中有很大差异4,5。应进一步探讨根系可塑性的变化, 因为了解不同土壤资源的复杂根系反应, 可以告知育种和管理策略, 以提高农业的养分利用效率。
尽管它对了解植物系统的必要性和相关性, 但在相关的尺度上可视化和量化根塑性会带来技术挑战。从土壤中挖掘根冠 ("shovelomics"6) 是一种常见的方法, 但细根利用土壤骨料之间的小孔隙, 而开挖不可避免地导致这些脆弱的根的某种程度的损失。此外, 破坏性的收获使得不可能随着时间的推移在一个根系统中发生变化。原位成像方法, 如 X 射线计算机断层扫描允许直接可视化的根和土壤资源在高空间分辨率7, 但昂贵, 需要专门的设备。水培试验避免了从土壤中提取根的约束, 但与土壤的机械约束和生物物理复杂性相比, 在水性介质中根系形态和结构的差异8、9。最后, 在这些人工介质中, 根际过程和功能不能与发育可塑性相结合。
我们提出了一个用于构造和使用 rhizoboxes (窄的、透明的矩形容器) 的协议, 作为一种低成本、可定制的方法来表征土壤中的根系生长。特别设计的框架鼓励根在后面板上优先增长, 由于安歇, 提高根长度测量的准确性。Rhizoboxes 通常用于研究根系生长和根际相互作用10,11,12, 但这里提出的方法提供了简单的优势, 其单室设计和廉价材料, 旨在研究对局部营养素的根系反应。然而, 该方法也可用于研究一系列其他根和根际过程, 如内/种间竞争, 化合物的空间分布, 微生物, 或酶活性。在本文中, 我们研究了玉米杂交种对15个 n-标记豆科植物残留斑块的基因型差异, 并突出了代表性结果, 验证了 rhizobox 方法。
Access restricted. Please log in or start a trial to view this content.
研究方案
1. 前、后面板和垫片的准备工作
- 准备前面板和背板。
- 将两块透明0.635 厘米厚的亚克力切成40.5 厘米宽61厘米每盒或购买预切割件 (见材料表)。
- 使用专为亚克力设计的钻头孔, 从顶部的2.5、19、38和53.3 厘米的侧面边缘0.635 厘米直径1.3 厘米的钻孔。钻孔1.3 厘米从底部边缘在 2.5, 20.3 和38厘米从左侧 (图 1)。
注意: 一次使用钻床进行六到十页的堆叠效率最高, 但也可以使用手钻。 - 从亚克力上取下任何保护层, 并在组装盒前轻轻清洁两个面板。
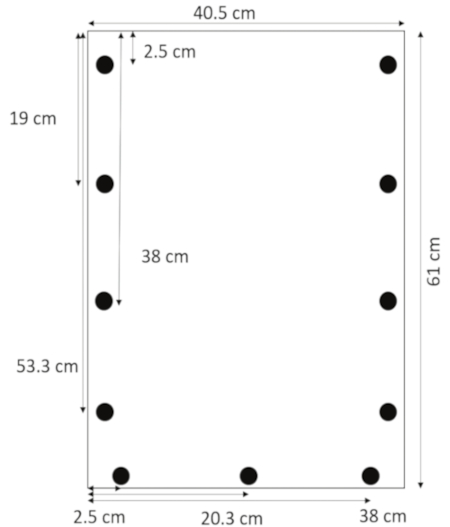
图 1: 钻孔的布局.孔钻1.3 厘米从侧面边缘在 2.5, 19, 38 和53.3 厘米从顶部, 和1.3 厘米从底部边缘在 2.5, 20.3 和38厘米从左边距。请点击这里查看这个数字的更大版本.
- 准备侧边和底部垫片。
- 每箱从高密度聚乙烯 (HDPE) 切割三个垫片, 或购买两个预切侧垫片 (0.635 厘米厚, 2.5 厘米宽, 57 厘米长), 和一个预切底部垫片 (0.635 厘米厚, 2.5 厘米宽, 40.5 厘米长)。请参阅材料表。
- 将前面板和背板之间的间隔沿框的两侧和底部对齐。使用手钻或钻床, 钻穿前面和后面的现有孔, 使孔穿过所有三层干净。
- 使用夹钳或在每个新钻孔的孔中安装螺栓、螺母和垫圈的组合来保持层位置 (参见步骤 3.1)。
2. 在包装箱底部安装聚酯击球条
注意: 这将防止土壤和水泄漏通过间隔之间的接缝。
- 将聚酯击球切成2.5 厘米宽40.5 厘米长的条 (见材料表)。
- 背面板平躺在上面的垫片上, 将击球直接放在底部垫片上方, 并将其固定在顶部面板上 (图 2)。
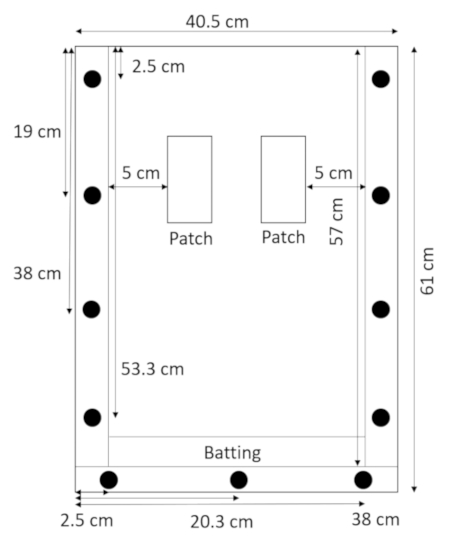
图 2: 装配 rhizobox 与击球.rhizobox 底部的一条狭窄的击球片可防止泥土和沙子渗漏。请点击这里查看这个数字的更大版本.
3. Rhizoboxes 的组装
- 使用20螺纹螺钉 (3.2 厘米长0.635 厘米直径)、垫圈 (0.635 厘米内径) 和六角螺母 (尺寸适合螺钉) 组装 rhizoboxes, 见材料表。
- 通过垫圈、前面板、垫片、背板、垫圈和六角螺母拧紧每个螺钉。确保螺丝非常紧;如果盒子是松散地组装, 土壤将溢出通过缝隙之间的面板和侧垫片。
注: 亚克力容易划伤, 划痕可能会干扰根测量, 所以小心处理组装好的箱子。除非在它们之间放置保护材料, 否则避免堆叠盒。 - 准备两个补丁间隔 (将用于创建处理和控制补丁) 每个框的间隔。从高密度聚乙烯 (HDPE) 板材切割垫片或购买预切 (0.635 厘米厚, 3.8 厘米宽, 28 厘米长; 见材料表)。钻一个孔0.635 厘米直径在每个间隔, 2 厘米从顶部沿中线 (图 3)。
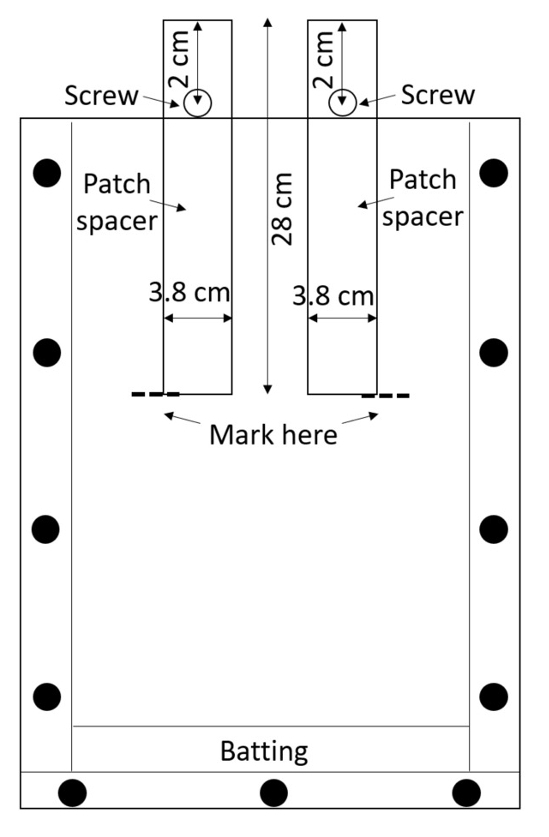
图 3: 补丁间隔.通过高密度聚乙烯条的中心插入的螺钉使它们不落入盒子中。rhizobox 填充在垫片周围的土壤, 土壤被润湿, 和垫片被删除为了留下空的处理和控制补丁。请点击这里查看这个数字的更大版本.
- 用螺母固定每个孔的螺钉, 使垫片可以部分插入 rhizobox, 直到螺钉阻止其进一步 (图 3)。
注: 当土壤在垫片周围润湿并除去垫片时, 将保留两个空空间, 可以用适当的衬底填充含氮处理贴片和控制片。
4. 构建 PVC 框架以支持 Rhizoboxes 的角度
注: 当方框放置在一个角度时, 安歇将鼓励根部对背板进行生长, 以便所有的根都可见以供追踪。图 4中的聚氯乙烯 (PVC) 尺寸使 rhizobox 的框架保持在接近55°角的工作台上。
- 每盒切割13件1.3 厘米直径的 PVC: 2×44厘米长, 3×42厘米长, 2×36.3 厘米长, 2×25.4 厘米长, 4×3.8 厘米长 (见材料表)。
注意: 我们强烈建议您使用切割锯, 以提高效率甚至削减开支。 - 使用 4×2路弯头、2×3向弯头和 4 T 形接头 (见材料表) 来组装框, 如图 4所示。
注意: 框架应该是稳定的, 没有额外的胶水, 但 PVC 胶水可以在必要时使用。
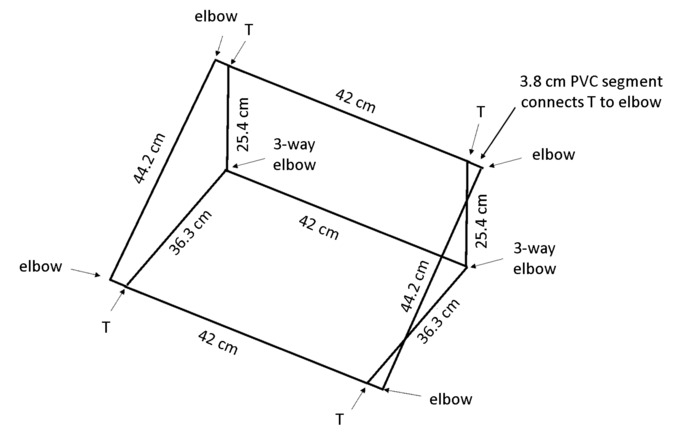
图 4: 支持 rhizoboxes 的帧.轻型框架由 PVC 切割到指定长度, 并使用所示的关节类型连接。请点击这里查看这个数字的更大版本.
5. 缝合保护壳以反射光和热
注意: 根避免光线, 因此这些情况下排除光, 以确保观察到的根塑性响应是由营养源在补丁程序中, 而不是通过避光的驱动。光剥夺织物也降低了 rhizoboxes 内的温度, 有助于避免热应力。
- 切光剥夺织物 (在一侧白色的专门材料和黑色在另一边) 成件约95厘米宽和69厘米长 (见材料表)。每盒一件是必需的。
- 沿长边折叠每片, 形成一个47.5 厘米 x 69 厘米的袖子。用缝纫机针设计的牛仔布, 重型绗缝线, 和一个狭窄的接缝, 缝沿底部和¾的方式向上两侧的每个袖子。将上角与安全别针固定在一起。
6. 1:1 (伏/伏) 土的制备: 砂基板填充 Rhizoboxes
- 每箱收集大约 1000 cm3的田间土壤 (从感兴趣的地点)。在60摄氏度的浅盘子中干燥土壤以保持重量。
注: 此试验的土壤在从 0 u201210 厘米深度的有机管理玉米田收割后立即收集。 - 用砂浆和杵研磨泥土, 穿过2毫米的筛子。通过称量已知的土壤量来测量土壤的体积密度。
- 获取沙子 (如玩沙子, 可以从硬件商店廉价购买; 请参阅材料表) 并测量体积密度。
- 测量出等量的沙子和泥土进入水桶, 并彻底混合。使用漏斗从顶部缓慢和均匀地填充盒子2.5 厘米, 而不摇动盒子, 使基底沉降。测量基底的体积;它应该是大约1272厘米3。
- 将沙子的体积密度乘以一半这个体积, 以获得每个箱子所需的沙子质量。对土壤的体积密度进行同样的处理, 以获得每个箱子所需的土壤质量。
注: 对于本试验中使用的田间土壤和沙子, 这是976克的沙子和774克的土壤, 但这些数量将根据所用土壤的体积密度而变化。 - 每 rhizobox 一个大的拉链塑料袋, 称量适当的沙子和泥土到袋子中, 并均匀地匀。
- 分析这1:1 土壤和基质的养分含量和自然丰度15n (δ15N)。
7. 处理和控制贴片的基底准备
- 每个 rhizobox 标签两个小拉链塑料袋, 一个用于治疗补丁, 一个用于控制补丁。重量30克的土壤: 从每个大袋子 (步骤 6.6) 砂基板到两个相应的小袋子。
- 将衬底与15N 标记的氮气源混合以处理修补程序。为此, 称 1 g 15N 标记的植物残渣或其他 n 源 (量可以根据需要调整) 到每个处理袋 (小拉链顶袋), 并彻底混合。
注: 对于本实验, 使用了15N 标记的三叶草和野豌豆残渣的混合物。三叶草和豌豆种子种植在1:1 混合蛭石和沙子, 并在温室条件下生长。植物每天用去离子水浇水, 每周两次, 1/100 强度的长阿什顿溶液13含有15N 标记氮源。所有地上生物量在种植、干燥和研磨后四周收获, 通过2毫米筛。如果选择了不同的养分, 特别是如果该元素在土壤中是流动的, 则鼓励试验进行浸出实验。如有必要, 可以使用缓释的养分形式, 也可以选择不同的 rhizobox 设计来限制浸出 (例如,分开隔间10)。
8. 使用基板加载 Rhizobox, 并建立处理和控制修补程序
- 称量每个空 rhizobox 并记录重量以供以后使用。
- 将两个补丁间隔 (参见步骤 3.2) 插入一个 rhizobox, 直到螺钉阻止它们进一步进行。将底部边缘的深度标记为 rhizobox 一侧的一个光标记 (图 3) 并卸下垫片。
- 使用与 rhizobox 开口一样窄的阀杆开口的漏斗, 将 rhizobox 从相应的大袋衬底填充到标记的深度。缓慢、均匀地来回移动漏斗, 使基底均匀填充, 不会产生优先流动通道。
- 当基底水平达到标记的深度时, 将垫片从盒子的两侧放回5厘米。继续填充盒, 直到基底水平约5厘米从盒子的顶部 (应该有基底留在袋子)。
- 在每个垫片周围彻底湿润。
注: 在本实验中, 通过在每个垫片的外边缘和 rhizobox 侧之间插入50毫升水, 并在两个垫片之间均匀浇注50毫升水, 实现了这一目标。缓慢灌溉对于均匀润湿是必要的。 - 当土壤湿润时, 取下垫片, 留下一个空腔用于修补。
- 将透明胶片贴在每个 rhizobox 的外部 (参见材料表)。标记一边作为治疗和一个作为控制, 并填充从适当的袋子使用漏斗的补丁。使用永久标记跟踪透明度上每个修补程序的边界。
- 用剩余的基底均匀地填充 rhizobox。在透明度上跟踪基底的顶部。
- 为剩余的 rhizoboxes 重复。保存所有的袋子收割。
9. 甚至浇水至60% 的保水能力
注意: 这一量的土壤水分被发现, 以防止植物遭受干旱胁迫, 同时防止缺氧条件或藻类生长的发展。
- 测量基底14的保水能力 (西隧)。
- 计算每个盒子的理想重量;此处定义为空 rhizobox 的重量总和, 与基底的重量结合在60% 的保水能力。
- 将西隧 (克水/干底物克) 乘以 0.6, 以获得60% 西隧基板上的水质量。将此质量添加到干基板的质量和15N 源的质量。
- 将每个框的空权重添加到上面获得的数字。
- 装满后再称量箱子。从在步骤9.2 中计算的理想权重 (g) 中减去每个框 (g) 的权重。水与此体积 (毫升) 的去离子化 (DI) 水缓慢和均匀。
注意: 这一步可以通过滴灌或手工浇水来完成。如果用手浇水, 在添加更多的水分之前, 先让水完全渗滤, 以避免土壤水分条件和优先流动通道。
10. 种子萌发和移植
- 如果使用荒芜控件, 请将这些 rhizoboxes 放在一旁。
- 对玉米种子进行表面杀菌, 搅拌1分钟, 在 5% NaOCl, 然后在 DI 水中彻底冲洗。
注: 在本试验中, 采用六种不同玉米基因型的种子, 以研究根可塑性的基因差异。 - 将灭菌的种子放在培养皿内的湿实验室组织 (例如 Kimwipe) 中, 并覆盖另一湿润组织,使其发芽。不应该有任何站立的水。把培养皿放在一个黑暗的地方 48 u201272 小时, 直到胚根才开始出现。
- 用一个窄的刮刀在每个 rhizobox 的中心挖一个洞到2.5 厘米深。将发芽的种子移植到洞中, 确保胚根直接定向向下。
注: 如果胚根朝向任何一个修补程序, 则根增长率的比较会有偏差。 - 跟踪种子在透明度上的位置。
- 用高达50毫升的 DI 水覆盖种子和水。
11. 植物生长
- 种植植物25天 (或尽可能长的时间), 维持60% 西隧在整个成长期。通过跟踪根来监视根增长。
- 每箱称量每 3 u20124 天和水, 直到其理想重量的 5 g 以内。在收割前四天停止浇水 rhizoboxes, 以方便分离面板。经常用手移除杂草, 以便只存在感兴趣的植物根。
- 每 3 \ u20124 天使用具有清晰区分颜色的永久标记跟踪每个跟踪日的可见根。
注: 如果需要, 不同直径的标记可用于初级和侧根。在一开始就定义根跟踪的标准是有用的, 因为涉及到一定程度的主观性, 特别是如果多个研究人员将跟踪根或不同的顺序或直径的根要区分不同的标记。在本实验中, 通过对两侧的可见根进行跟踪, 并将扫描的透明胶片上测量的总根长度与洗涤和扫描根部测量的总根长度进行对比, 测试了在盒子一侧追踪可见根的准确性。无论是否仅使用背透明度或两个透明胶片, 跟踪和扫描根长度之间的相关性都很重要。因此, 可以在后面板上跟踪可见的根。
12. 收获芽, 获得根和土壤样本进行分析
- 将第一 rhizobox 平, 卸下所有螺钉。
- 收获拍摄样本。在底座上夹芽, 用 DI 水冲洗任何土壤, 并在60摄氏度干燥。用砂浆和杵研磨芽, 通过一个2毫米筛, 并称个子采样为锡胶囊进行同位素分析 (见第14节)。
- 使用透明度作为指南, 用剃刀切割处理和控制补丁。使用勺子或刮刀铲根和粘附的根际土壤到各自的处理或控制袋。
注: 虽然有许多方法可以分离根际土壤, 但土壤在植物根15的影响下, 根际可以被认为是梯度而不是严格划定的区域16, 这种方法遵循广泛使用在摇晃17后附着在植物根部的土壤的定义。 - 把剩下的根和泥土舀进第三个袋子里。
- 通过2毫米筛将处理、控制和散装样品传递到从基底分离根, 用细镊子去除任何可见根或碎片 > 1 厘米长度。将这些样本彼此分开, 共三根和三个基底样品。
13. 踪迹的验证和相对根系生长速率的估计
- 扫描处理、控制和批量采样并计算根长度。
- 每次使用一个样品时, 用 DI 水仔细冲洗根部, 以除去剩余的基底。在透明纸盒中排列样品, 使根部不重叠。
- 使用与根分析软件兼容的扫描仪扫描样本 (例如WinRhizo)。确保对软件进行校准, 以可靠地将根与图像背景区分开来。
- 使用该软件测量感兴趣的直径类别中的总根长度和根长度 (例如< 0.2 mm、0.2 \ u20120.4 mm、0.4 \ u20120.8 mm、0.8 \ u20121.6 mm、> 1.6 mm)。
- 计算根长度密度 (rhizobox), 用于处理和控制修补程序, 并为每个提供一个整体。
- 通过将每个透明度所跟踪的区域乘以 0.635 cm (如方框的深度), 计算处理和控制修补程序的体积 (参见步骤 8.1)。使用这些卷可使用每个修补程序中的总根长度计算处理和控制修补程序中的根长度密度 (请参阅步骤 13.1.3)。
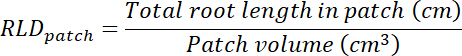
- 计算每个 rhizobox 中基底的体积, 方法是将透明度 (见步骤 8.1) 的面积乘以 0.635 cm. 计算和处理和控制补丁。
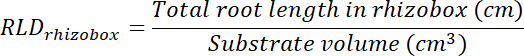
- 通过将每个透明度所跟踪的区域乘以 0.635 cm (如方框的深度), 计算处理和控制修补程序的体积 (参见步骤 8.1)。使用这些卷可使用每个修补程序中的总根长度计算处理和控制修补程序中的根长度密度 (请参阅步骤 13.1.3)。
- 通过比较扫描的根系统和跟踪的图像来验证根跟踪方法。
- 使用软件扫描每个透明度并计算总根长度。保存扫描的图像以进行增长率计算。
- 对每个框的处理、控制和大容量样本的总根长度测量值求和 (参见步骤 13.1.3)。
- 测试总根长度的扫描和跟踪测量值, 以查看相关性是否具有统计学意义。
注: 如果是这样, 则会验证跟踪方法, 并且可以在每个时间点计算相对增长率。否则, 只有扫描的根系统数据提供了根增长的准确指示。例如, 如果跟踪方法不一致, 或者如果根对所有基因型都不相同, 则可能出现这种情况。
- 如果跟踪方法经过验证, 则计算每个 rhizobox 的相对根增长率。
- 使用已校准的根分析软件来区分所选的跟踪颜色, 以测量每个时间点的处理、控制和批量样本中的总根长度。计算每个时间点的累计总根长度。
- 计算每个 rhizobox 的相对根增长率 (RGR根) 以及每个时间间隔 t1-t2的处理和控制修补程序, 如下所示。
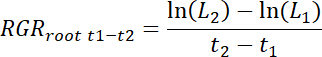
注: 在这里 l1 是总根长度在补丁 (累积总和从 11.3) 在 t1天移植后 (DAT) 和L2是总根长度在修补程序在 t2 DAT。
14. 在根、射和处理土壤样品中进行15N 分区分析
- 干根在60摄氏度, 称量生物量, 研磨通过2毫米筛。
- 干燥个子采样的处理土壤在60摄氏度。
- 包根和处理成锡胶囊与芽。
注: 每个胶囊的理想样品重量应分别计算芽、根和土壤根据估计的材料的碳/氮比, 以达到总 N 的目标量的分析。请联系稳定同位素设施, 在那里提交样品以获得更多信息。在本实验中, 采用了加州大学戴维斯分校稳定同位素设施提供的样品制备说明和样品重量计算器18。
注意: 在包装成胶囊之前, 请特别注意均匀地混合样品, 并为每个样品准备多个胶囊。如果样品不均匀混合, 15N 的表观回收率可能超过最初存在的量。 - 分析每个拍摄、根和处理土壤样品的总氮、δ15和15n 含量。
注: 在本实验中, 通过在 UC 戴维斯稳定同位素设施 (UCD SIF) 上与 PDZ 欧罗巴20-20 同位素比值质谱仪对接的 PDZ 欧罗巴 ANCA GSL 元素分析仪, 对植物样品进行了燃烧分析。用元素 Vario EL 立方体元素分析仪与 PDZ 欧罗巴20-20 同位素比值质谱仪进行了土壤样品的分析。 - 计算从工厂拍摄和根样本中的标签获得的15N 的量。
- 首先, 计算每个池中超过大气15n 的15n 的量, 15P *:
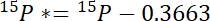
其中15P是在 atomic% 的15N 内容的兴趣池。 - 其次, 在标签中计算超过大气15n 的15n 的量, 15L *:
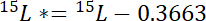
其中15L是标记 n 源的 atomic% 中的15N 内容。 - 第三, 计算每个池中总 n 的数量, np:
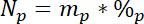
其中mp 是池的质量 (例如,总干射或根生物质), %p 是该池的 N 的百分比。 - 最后, 使用结果 14.5. 1 \ u201214.5 3 在 Ndff 方程式19计算从标签获得的 n 的数量 n l:
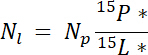
注: Ndff 方程式用于确定由植物回收的标记来源的 N 量。它假定在植物氮吸收过程中不会发生同位素歧视, 并且通常适用于富含 1 \ u201210%19的 n 源。
- 首先, 计算每个池中超过大气15n 的15n 的量, 15P *:
Access restricted. Please log in or start a trial to view this content.
结果
像预期的那样, 根在盒子后面的生长优先。盒背面的总追踪根长度介于400到 1956 cm 之间, 与盒前93-758 厘米相比。在扫描的根长度和追踪的根长度之间, 在盒子的前部、盒子的背面, 计算出成对皮尔逊相关系数, 并使用前后的总和来确定跟踪是否准确地反映了总根长度 (n = 23, 如在一个盒子里的植物在实验中死了)。扫描的总根长度与盒背面的追踪根长度显著相关 (
Access restricted. Please log in or start a trial to view this content.
讨论
本协议中描述的 rhizoboxes 可用于回答根和根际科学中的各种问题, 并在别处发现了不同用途10、20、21、22、23,24,25. 其他研究人员捕获了 rhizoboxes21、25、26
Access restricted. Please log in or start a trial to view this content.
披露声明
作者没有什么可透露的。
致谢
作者希望感谢匿名审阅者对他们的反馈意见, 以及 J.C. 卡希尔和谭宝在开发 rhizobox 协议方面的初步指导。资金由粮食和农业研究基金会、美国农业部 (USDA) 国家粮食和农业研究所、农业试验站项目 CA-D-PLS-2332-H、司法部和加州大学戴维斯分校提供。科学通过 J.S. 的奖学金
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| 1.27 cm diameter PVC pipe | JM Eagle | 530048 | 305 cm per box, cut into lengths as specified in the protocol |
| PVC side elbows | Lasco | 315498 | 2 per box |
| PVC 90-degree elbows | Charlotte | PVC 02300 0600 | 4 per box |
| PVC T joints | Charlotte | PVC 02402 0600 | 4 per box |
| Extruded acrylic panes | TAP Plastics | N/A | 2 per box, 0.64 cm thick x 40.5 cm wide x 61 cm long |
| HDPE spacers (sides) | TAP Plastics | N/A | 2 per box, 0.64 cm thick x 2.5 cm wide x 57 cm long |
| HDPE spacers (bottom) | TAP Plastics | N/A | 1 per box, 0.64 cm thick x 2.5 cm wide x 40.5 cm long |
| HDPE spacers (patch) | TAP Plastics | N/A | 2 per box, 0.64 cm thick x 3.8 cm wide x 28 cm long |
| Polyester batting | Fairfield | #A-X90 | 2.5 cm x 40.5 cm strip per box |
| 20-thread screws | N/A | N/A | 3.2 cm long, 0.64 cm diameter |
| Washers | N/A | N/A | 0.64 cm internal diameter |
| Hex nuts | N/A | N/A | sized to fit the screws |
| Light deprivation fabric | Americover, Inc. | Bold 8WB26.5 | 1 piece 95 cm wide and 69 cm long per box |
| Sand | Quikrete | No. 1113 | |
| Field soil | N/A | N/A | |
| Transparencies for tracing | FXN | FXNT1319100S | One per side of the box to be traced |
参考文献
- Hodge, A. Roots: The Acquisition of Water and Nutrients from the Heterogeneous Soil Environment. Progress in Botany 71. , 307-337 (2010).
- Grossman, J. D., Rice, K. J. Evolution of root plasticity responses to variation in soil nutrient distribution and concentration. Evolutionary Applications. 5 (8), 850-857 (2012).
- Melino, V. J., Fiene, G., Enju, A., Cai, J., Buchner, P., Heuer, S. Genetic diversity for root plasticity and nitrogen uptake in wheat seedlings. Functional plant biology. , Available from: http://agris.fao.org/agris-search/search.do?recordID=US201600101375 (2015).
- Zhang, H., Forde, B. G. An Arabidopsis MADS box gene that controls nutrient-induced changes in root architecture. Science. 279 (5349), 407-409 (1998).
- Hodge, A., Stewart, J., Robinson, D., Griffiths, B. S., Fitter, A. H. Competition between roots and soil micro-organisms for nutrients from nitrogen-rich patches of varying complexity. Journal of Ecology. 88 (1), 150-164 (2000).
- Trachsel, S., Kaeppler, S. M., Brown, K. M., Lynch, J. P. Shovelomics: high throughput phenotyping of maize (Zea mays L.) root architecture in the field. Plant and Soil. 341 (1-2), 75-87 (2011).
- Rogers, E. D., Monaenkova, D., Mijar, M., Nori, A., Goldman, D. I., Benfey, P. N. X-ray computed tomography reveals the response of root system architecture to soil texture. Plant Physiology. , (2016).
- Groleau-Renaud, V., Plantureux, S., Guckert, A. Effect of mechanical constraint on nodal and seminal root system of maize plants. Comptes Rendus De L Academie Des Sciences Serie Iii-Sciences De La Vie-Life Sciences. 321 (1), 63-71 (1998).
- Lin, Y., Allen, H. E., Di Toro, D. M. Barley root hair growth and morphology in soil, sand, and water solution media and relationship with nickel toxicity. Environmental Toxicology and Chemistry. 35 (8), 2125-2133 (2016).
- Wenzel, W. W., Wieshammer, G., Fitz, W. J., Puschenreiter, M. Novel rhizobox design to assess rhizosphere characteristics at high spatial resolution. Plant and Soil. 237 (1), 37-45 (2001).
- Spohn, M., Carminati, A., Kuzyakov, Y. Soil zymography - A novel in situ method for mapping distribution of enzyme activity in soil. Soil Biology and Biochemistry. 58, 275-280 (2013).
- Vollsnes, A. V., Futsaether, C. M., Bengough, A. G. Quantifying rhizosphere particle movement around mutant maize roots using time-lapse imaging and particle image velocimetry. European Journal of Soil Science. 61 (6), 926-939 (2010).
- Hewitt, E. J. Sand and Water Culture Methods Used in the Study of Plant Nutrition. , Commonwealth Bureau. London. (1966).
- Choudhary, M. I., Shalaby, A. A., Al-Omran, A. M. Water holding capacity and evaporation of calcareous soils as affected by four synthetic polymers. Communications in Soil Science and Plant Analysis. 26 (13-14), 2205-2215 (1995).
- Bakker, P. A. H. M., Berendsen, R. L., Doornbos, R. F., Wintermans, P. C. A., Pieterse, C. M. J. The rhizosphere revisited: root microbiomics. Frontiers in Plant Science. 4, 2013(2013).
- McNear, D. H. Jr The Rhizosphere - Roots, Soil, and Everything In Between. Nature Education Knowledge. 4 (3), 1(2013).
- Ortas, I. Determination of the extent of rhizosphere soil. Communications in Soil Science and Plant Analysis. 28 (19-20), 1767-1776 (1997).
- UC Davis Stable Isotope Facility. Carbon (13C) and Nitrogen (15N) Sample Preparation. , Available from: https://stableisotopefacility.ucdavis.edu/13cand15nsamplepreparation.html (2018).
- Barraclough, D. 15N isotope dilution techniques to study soil nitrogen transformations and plant uptake. Fertilizer research. 42 (1-3), 185-192 (1995).
- Belter, P. R., Cahill, J. F. Disentangling root system responses to neighbours: identification of novel root behavioural strategies. AoB PLANTS. 7, (2015).
- Nagel, K. A., et al. GROWSCREEN-Rhizo is a novel phenotyping robot enabling simultaneous measurements of root and shoot growth for plants grown in soil-filled rhizotrons. Functional Plant Biology. 39 (11), 891-904 (2012).
- Adu, M. O., Yawson, D. O., Bennett, M. J., Broadley, M. R., Dupuy, L. X., White, P. J. A scanner-based rhizobox system enabling the quantification of root system development and response of Brassica rapa seedlings to external P availability. Plant Root. 11, 16-32 (2017).
- Neumann, G., George, T. S., Plassard, C. Strategies and methods for studying the rhizosphere-the plant science toolbox. Plant and Soil. 321 (1-2), 431-456 (2009).
- Bodner, G., Alsalem, M., Nakhforoosh, A., Arnold, T., Leitner, D. RGB and Spectral Root Imaging for Plant Phenotyping and Physiological Research: Experimental Setup and Imaging Protocols. JoVE (Journal of Visualized Experiments). (126), e56251-e56251 (2017).
- Kuchenbuch, R. O., Ingram, K. T. Image analysis for non-destructive and non-invasive quantification of root growth and soil water content in rhizotrons. Journal of Plant Nutrition and Soil Science. 165 (5), 573-581 (2002).
- Dresbøll, D. B., Thorup-Kristensen, K., McKenzie, B. M., Dupuy, L. X., Bengough, A. G. Timelapse scanning reveals spatial variation in tomato (Solanum lycopersicum L.) root elongation rates during partial waterlogging. Plant and Soil. 369 (1-2), 467-477 (2013).
- Wu, J., et al. RhizoChamber-Monitor: a robotic platform and software enabling characterization of root growth. Plant Methods. 14 (1), 44(2018).
- Rogers, S. W., Moorman, T. B., Ong, S. K. Fluorescent In Situ Hybridization and Micro-autoradiography Applied to Ecophysiology in Soil. Soil Science Society of America Journal. 71 (2), 620-631 (2007).
- Eickhorst, T., Tippkötter, R. Detection of microorganisms in undisturbed soil by combining fluorescence in situ hybridization (FISH) and micropedological methods. Soil Biology and Biochemistry. 40 (6), 1284-1293 (2008).
- Spohn, M., Kuzyakov, Y. Distribution of microbial- and root-derived phosphatase activities in the rhizosphere depending on P availability and C allocation - Coupling soil zymography with 14C imaging. Soil Biology and Biochemistry. 67, 106-113 (2013).
- Lv, G., Kang, Y., Li, L., Wan, S. Effect of irrigation methods on root development and profile soil water uptake in winter wheat. Irrigation Science. 28 (5), 387-398 (2010).
- Asseng, S., Ritchie, J. T., Smucker, A. J. M., Robertson, M. J. Root growth and water uptake during water deficit and recovering in wheat. Plant and Soil. 201 (2), 265-273 (1998).
- Hernandez-Ramirez, G., et al. Root Responses to Alterations in Macroporosity and Penetrability in a Silt Loam Soil. Soil Science Society of America Journal. 78 (4), 1392-1403 (2014).
- Zhang, Y. L., Wang, Y. S. Soil enzyme activities with greenhouse subsurface irrigation. Pedosphere. 16 (4), 512-518 (2006).
- Robinson, D., Hodge, A., Griffiths, B. S., Fitter, A. H. Plant root proliferation in nitrogen-rich patches confers competitive advantage. Proceedings of the Royal Society of London B: Biological Sciences. 266 (1418), 431-435 (1999).
- Lobet, G., Draye, X. Novel scanning procedure enabling the vectorization of entire rhizotron-grown root systems. Plant Methods. 9, 1(2013).
- Swarup, R., Wells, D. M., Bennett, M. J. Root Gravitropism. Plant Roots: The Hidden Half. , (2013).
- Smit, A. L., Bengough, A. G., Engels, C., van Noordwijk, M., Pellerin, S., van de Geijn, S. C. Root Methods: A Handbook. , Springer Science & Business Media. (2000).
- van Dusschoten, D., et al. Quantitative 3D Analysis of Plant Roots Growing in Soil Using Magnetic Resonance Imaging1[OPEN]. Plant Physiology. 170 (3), 1176-1188 (2016).
- Metzner, R., et al. Direct comparison of MRI and X-ray CT technologies for 3D imaging of root systems in soil: potential and challenges for root trait quantification. Plant Methods. 11, 17(2015).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。