É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Um protocolo otimizado de Rhizobox para visualizar o crescimento da raiz e receptividade aos nutrientes localizadas
Neste Artigo
Resumo
Visualizar e medir raiz crescimento em situ são extremamente desafiador. Apresentamos um método rhizobox personalizável para controlar o desenvolvimento radicular e proliferação ao longo do tempo em resposta ao enriquecimento de nutrientes. Este método é usado para analisar diferenças genotípicas milho na plasticidade da raiz em resposta a uma fonte de nitrogênio orgânico.
Resumo
As raízes são notoriamente difíceis de estudar. O solo é tanto uma barreira visual e mecânica, tornando difícil rastrear raízes em situ sem colheita destrutiva ou equipamento caro. Apresentamos um método de rhizobox acessível e personalizável que permite a visualização não-destrutiva de crescimento das raízes ao longo do tempo e é particularmente bem adaptado para estudar a plasticidade da raiz em resposta a patches de recurso localizado. O método foi validado pela avaliação milho variação genotípica em respostas de plasticidade para patches contendo resíduo vegetal N-rotulado de 15. Métodos são descritos para obter medições do desenvolvimento representante ao longo do tempo, medir a densidade de comprimento raiz em patches contendo recursos e controle, calcular taxas de crescimento de raiz e determinar recuperação 15N pela planta raízes e brotos. Vantagens, limitações e potenciais aplicações futuras do método também são discutidas. Embora deve ter cuidado para garantir que as condições experimentais não viés dados de crescimento de raiz, o protocolo de rhizobox apresentado aqui produz resultados confiáveis se realizado com suficiente atenção aos detalhes.
Introdução
Embora muitas vezes negligenciado em comparação com suas contrapartes na superfície, as raízes desempenham um papel fundamental na aquisição de nutrientes de planta. Dado o custo do carbono substancial de manutenção e construção de raiz, as plantas desenvolveram mecanismos para desenvolver raízes somente onde forrageamento vale a pena o investimento. Sistemas da raiz pode, portanto, eficientemente e dinamicamente a mina patches de recurso por proliferando em hotspots, estrogenos taxas de absorção e rapidamente se nutrientes para o floema por mais transporte1. Respostas de plasticidade podem variar amplamente entre planta espécies ou genótipos2,3 e dependendo da forma química do nutriente envolvido4,5. Variação na plasticidade de raiz deve ser explorada ainda mais, como compreensão respostas raiz complexa de recursos heterogêneos solo poderiam informar reprodução e estratégias de gestão para aumentar a eficiência de utilização de nutrientes na agricultura.
Apesar de sua necessidade e relevância para os sistemas de planta de entendimento, Visualizar e quantificar a plasticidade de raiz em escalas relevantes coloca desafios técnicos. Escavando a coroa da raiz do solo (6de "shovelomics") é um método comum, mas raizes finas exploram pequenos poros entre agregados de solo, e escavação, inevitavelmente, leva a algum grau de perda dessas raízes frágeis. Além disso, colheita destrutiva torna impossível acompanhar as mudanças em um sistema de raiz ao longo do tempo. In situ métodos de imagem como tomografia computadorizada de radiografia computadorizada permitem a visualização directa dos recursos de solo e raízes em alta resolução espacial7, mas são caros e requerem o equipamento especializado. Hidropônicas experiências evitar restrições associadas com a extração de raízes do solo, mas arquitetura e morfologia da raiz diferem em meios aquosos em comparação com as restrições mecânicas e complexidade biofísica dos solos8,9. Finalmente, funções e processos de rizosfera não podem ser integradas com plasticidade do desenvolvimento nestes meios artificiais.
Apresentamos um protocolo para a construção e uso de rhizoboxes (recipientes retangulares estreitas, clear-face) como um método de baixo custo, personalizável para caracterizar o crescimento da raiz no solo ao longo do tempo. Quadros especialmente projetados incentivam as raizes cresçam preferencialmente contra o painel traseiro devido ao geotropismo, aumentando a precisão das medições de comprimento de raiz. Rhizoboxes são comumente usados para estudar o crescimento das raízes e rizosfera interações10,11,12, mas o método apresentado aqui oferece uma vantagem na simplicidade, com seu design único compartimento e barato materiais e é projetado para estudar respostas de raiz para nutrientes localizadas. No entanto, o método também pode ser adaptado para estudar uma gama de outros processos de raiz e rizosfera como concorrência intra/interspecies, distribuição espacial de compostos químicos, micróbios ou atividade enzimática. Aqui, vamos investigar diferenças genotípicas entre híbridos de milho em resposta a patches de 15N-rotulado vegetal resíduo e destaque resultados representativos para validar o método de rhizobox.
Protocolo
1. preparação da frente e traseiros painéis e espaçadores
- Prepare os painéis dianteiros e traseiros.
- Cortados dois pedaços de acrílico grosso de clara 0,635 cm a 40,5 cm de largura por 61 cm longo por caixa ou comprar peças pré-cortadas (ver Tabela de materiais).
- Usando uma broca projetada para acrílico, furos 0,635 cm de diâmetro de 1,3 cm entre as bordas de lado no 2.5, 19, 38 e 53,3 cm do topo. Furos de 1,3 cm da borda inferior a 2,5 e 20,3 cm 38 do lado esquerdo (Figura 1).
Nota: É mais eficiente usar uma furadeira para uma pilha de seis a dez folhas de cada vez, mas uma furadeira de mão também pode ser usada. - Remova quaisquer revestimentos protetores de acrílico e limpar delicadamente os dois painéis antes de montar as caixas.
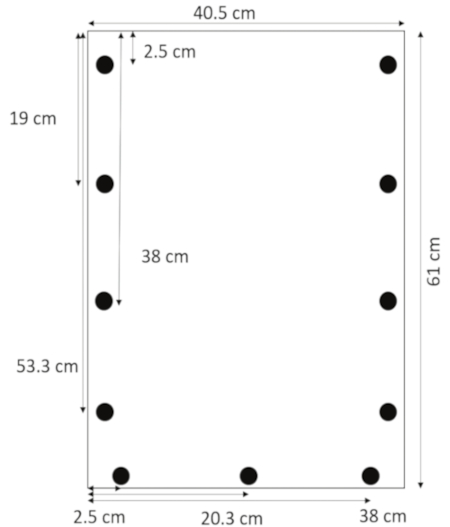
Figura 1: Layout de buracos perfurados. Furos são perfurado 1,3 cm entre as bordas de lado no 2.5, 19, 38 e 53,3 cm do topo e 1,3 cm da borda inferior no 2.5, 20,3 e 38 cm da margem esquerda. Clique aqui para ver uma versão maior desta figura.
- Prepare os espaçadores lateral e inferior.
- Corte três espaçadores por caixa de polietileno de alta densidade (PEAD) ou compra dois espaçadores de corte lateral (0,635 cm de espessura, 2,5 cm de largura, 57 cm de comprimento) e um corte fundo do espaçador (0,635 cm de espessura, 2,5 cm de largura, 40,5 cm de comprimento). Consulte a tabela de materiais.
- Alinhe os espaçadores entre os painéis frontais e traseiras ao longo dos lados e fundo da caixa. Usando uma broca de mão ou furadeira, broca através dos orifícios existentes na frente e novamente para que os furos atravessam todas as três camadas corretamente.
- Segure as camadas Coloque usando braçadeiras ou através da instalação de uma combinação de parafusos, porcas e arruelas em cada recém furo (ver passo 3.1).
2. instalação de uma tira de poliéster rebatidas na parte inferior da caixa
Nota: Isto irá impedir solo e água vazando através de articulações entre os espaçadores.
- Cortar o poliéster rebatidas em 2,5 cm de largura por 40,5 cm de comprimento tiras (consulte a Tabela de materiais).
- Com painel traseiro mentindo plana e os espaçadores em cima dele, colocar a batedura diretamente acima do espaçador de fundo e segure-o no lugar com o painel superior (Figura 2).
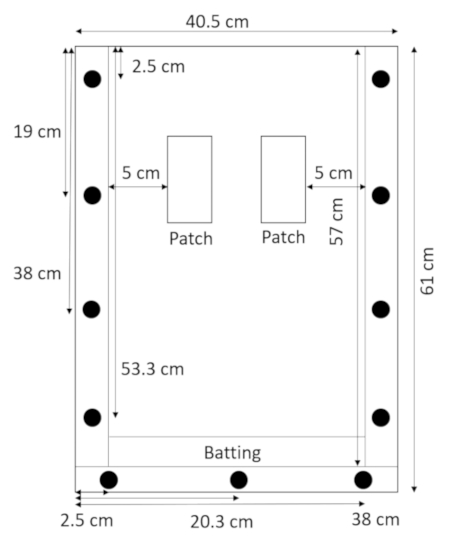
Figura 2: montado rhizobox com rebatidas. Uma estreita faixa de rebatidas na parte inferior da rhizobox impede a solo e areia de vazar. Clique aqui para ver uma versão maior desta figura.
3. montagem da Rhizoboxes
- Montar o rhizoboxes usando parafusos de rosca-20 (3,2 cm de comprimento por 0,635 cm de diâmetro), arruelas (0,635 cm de diâmetro interno) e porcas sextavadas (tamanho para encaixar os parafusos, ver Tabela de materiais.
- Aperte cada parafuso através de uma máquina de lavar, painel frontal, espaçador, painel traseiro, arruela e porca sextavada. Verifique se que os parafusos estão muito apertados; se a caixa é montada livremente, solo vai derramar para fora através de aberturas entre os painéis e os espaçadores de lado.
Nota: Acrílico é facilmente arranhado, e os arranhões podem interferir com as medições de raiz, para segurar as caixas montadas com cuidado. Evite empilhar caixas a menos material protetor é colocado entre eles. - Prepare dois espaçadores de remendo (espaçadores que serão usados para criar os patches de tratamento e controle) por caixa. Cortar os espaçadores de polietileno de alta densidade (PEAD) folhas ou comprá-los pré-cortado (0,635 cm de espessura, 3,8 cm de largura, 28 cm de comprimento; ver Tabela de materiais). Faça um furo 0,635 cm de diâmetro em cada espaçador, 2cm do topo ao longo da linha mediana (Figura 3).
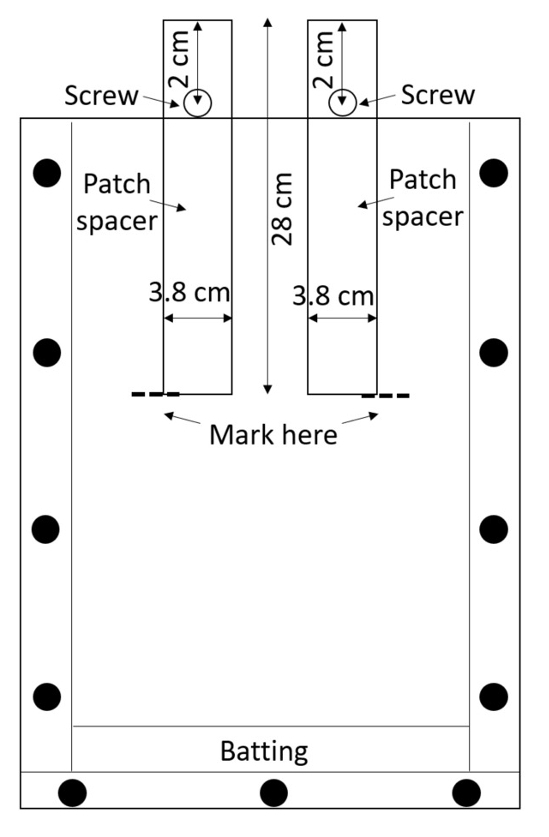
Figura 3: Patch espaçadores. Parafusos inseridos através as tiras de centro de HDPE mantém-los de cair no caixa. O rhizobox é preenchido com o solo em torno os espaçadores, o solo está molhado, e os espaçadores são removidos a fim de deixar vazios patches de tratamento e controle. Clique aqui para ver uma versão maior desta figura.
- Prenda um parafuso por cada buraco com uma porca, de modo a que o espaçador pode ser inserido parcialmente o rhizobox até o parafuso impede-o de ir mais longe (Figura 3).
Nota: Quando o solo está molhado ao redor os espaçadores e os espaçadores são removidos, permanecerão dois espaços vazios que pode ser preenchido com os substratos adequados para o remendo de tratamento contendo nitrogênio e patch de controle.
4. construção do PVC quadros para apoiar a Rhizoboxes em ângulo
Nota: Quando a caixa é colocada em um ângulo, geotropismo incentivará as raízes a crescer contra o painel traseiro para que todas as raízes são visíveis para rastreamento. Cloreto de polivinila (PVC) dimensões na Figura 4 resultado em um quadro que mantém a rhizobox em um ângulo de aproximadamente 55 ° para o banco.
- Corte 13 peças de 1,3 cm de diâmetro do PVC por caixa: 2 × 44 centímetros de comprimentos, 3 comprimentos de cm × 42, 2 × 36,3 cm comprimentos, 2 × 25,4 centímetros de comprimentos e 4 × 3,8 centímetros de comprimentos (consulte Tabela de materiais).
Nota: Uma serra é altamente recomendada para eficiência e até mesmo cortes. - Use os cotovelos de forma-2 × 4, 2 × 3 vias cotovelos e 4 T-junções (ver Tabela de materiais) para montar a caixa, como mostrado na Figura 4.
Nota: Os óculos devem ser estáveis sem colagem adicional, mas cola de PVC pode ser usada se necessário.
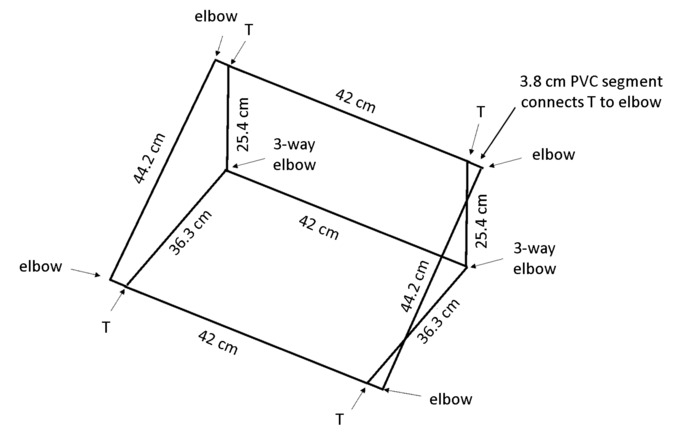
Figura 4: quadro de apoio rhizoboxes. O frame de pouco peso é construído de PVC cortado aos comprimentos especificados e conectado usando os tipos comuns indicados. Clique aqui para ver uma versão maior desta figura.
5. costura capas protetoras para refletir a luz e o calor
Nota: Raízes evita a luz, então estes casos eliminar a luz para se certificar de que observaram respostas de plasticidade de raiz são conduzidas pela fonte de nutrientes nas manchas e não por evasão de luz. Tecido leve de privação também reduz a temperatura no interior da rhizoboxes, ajudando a evitar o stress de calor.
- Corte o tecido de privação de luz (material especializado que é branco de um lado e preto do outro) em pedaços aproximadamente 95 cm de largura e 69 cm de comprimento (veja Tabela de materiais). Uma parte por caixa é necessária.
- Dobre cada pedaço ao meio ao longo da borda longa para formar uma manga de 47,5 cm x 69 cm. Usando uma agulha de costura máquina projetada para o denim, estofando pesados thread e uma fenda estreita, costure ao longo da parte inferior e ¾ do caminho até o lado de cada manga. Pino de topo cantos juntamente com um alfinete de segurança.
6. preparação do solo de 1:1 (V/V): substrato para encher o Rhizoboxes de areia
- Colete aproximadamente 1.000 cm3 de solo de campo (a partir do site de interesse) por caixa. Secar o solo até peso constante em bandejas rasas a 60 ° C.
Nota: O solo para este experimento foi coletado imediatamente após a colheita em um campo de milho organicamente gerenciado de 0\u201210 cm de profundidade. - Triture o solo com um almofariz e um pilão que passe por uma peneira de 2 mm. Medir a densidade do solo por pesagem, um volume conhecido de solo.
- Obter areia (como jogar areia, que pode ser comprada barata de uma loja de ferragem; consulte Tabela de materiais) e medir a densidade a granel.
- Medir volumes iguais de areia e solo em um balde e misture bem. Use um funil para encher a caixa lentamente e uniformemente a 2,5 cm do topo, sem tremer a caixa para fazer com que o substrato resolver. Medir este volume de substrato; deve ser aproximadamente 1.272 cm3.
- Multiplique a densidade de areia por metade deste volume para obter a massa de areia necessária para cada caixa. Faça o mesmo com a densidade do solo para obter a massa de solo necessária para cada caixa.
Nota: Para o solo de campo e areia utilizada neste experimento, foi 976 g de areia e 774 g de solo, mas estes valores variam de acordo com a densidade do solo usado. - Rotular um grande zip-top saco plástico por rhizobox, pesar as massas adequadas de solo e areia dentro do saco e homogeneizar completamente.
- Analisar este solo de 1:1- e substrato para o teor de nutrientes e a abundância natural de 15N (δ15N).
7. preparadores para o tratamento e controle de Patches
- Rotule pequenos sacos zip-top de plástico de dois por rhizobox, um para o patch de tratamento e uma para o patch de controle. Pesa 30 g de solo: substrato de cada saco grande (etapa 6.6) de areia para os dois sacos pequenos correspondentes.
- Misture o substrato com uma fonte de nitrogênio N-rotulado de 15para o patch de tratamento. Por isso, pesar 1 g de resíduo de 15N-rotulado planta ou outra fonte de N (a quantidade pode ser ajustada como desejado) em cada saco de tratamento (pequeno saco zip-top) e misture bem.
Nota: Para este experimento, foi usada uma mistura de 15N-rotulado trevo e ervilhaca resíduo. Sementes de trevo e ervilhaca foram plantadas em uma mistura 1:1 de vermiculita e areia e cultivadas sob condições de estufa. As plantas foram regada diariamente com água desionizada e duas vezes por semana com força de 1/100 de Long Ashton solução13 contendo 15fontes de nitrogênio N-rotulados. Todos biomassa acima do solo foi colhida em quatro semanas após o plantio, seco e moído para passar por uma peneira de 2 mm. Se for escolhido um nutriente diferente, especialmente se esse elemento é móvel no solo, experiências piloto para testar a lixiviação são incentivadas. Formas de liberação lenta de nutrientes podem ser usadas ou um design diferente rhizobox poderia ser escolhido para restringir a lixiviação (por exemplo, por compartimentos separados10) se necessário.
8. Rhizobox com substrato e estabelecendo o tratamento e o controle de carregamento Patches
- Pesar cada rhizobox vazio e registar os pesos para uso posterior.
- Inserir dois espaçadores de remendo (consulte a etapa 3.2) em um rhizobox até o parafuso os impede de ir mais longe. Marque a profundidade da borda inferior com uma marca de luz no lado do rhizobox (Figura 3) e retire os espaçadores.
- Usando um funil com uma abertura de tronco que é tão estreita como a abertura de rhizobox, preencher o rhizobox do saco grande correspondente de substrato para a profundidade de marcado. Mover o funil e para trás lentamente e uniformemente para que o substrato preenche uniformemente e não criar canais preferenciais de fluxo.
- Quando o nível de substrato atinge a profundidade marcada, coloque os espaçadores em 5 cm de cada lado da caixa. Continue enchendo a caixa até o nível de substrato é de aproximadamente 5 cm da parte superior da caixa (deve haver substrato restante no saco).
- Molhar cuidadosamente ao redor cada espaçador.
Nota: Neste experimento, isto foi conseguido através da entrega de 50 mL de água através de emissores de gotejamento inserido entre a borda externa de cada espaçador e do lado do rhizobox e derramando a 50 mL de água uniformemente entre os dois espaçadores. Irrigação lenta é necessária para molhamento uniforme. - Retire os espaçadores, enquanto que o solo está molhado, deixando uma cavidade vazia para os patches.
- Gravar um filme de transparência para o exterior de cada rhizobox (ver Tabela de materiais). Marcar um lado como tratamento e como controle e preencher os patches os sacos apropriados usando o funil. Traçar os limites de cada patch na transparência usando marcador permanente.
- Preencha o rhizobox uniformemente com o restante do substrato. Rastrear o topo do substrato sobre a transparência.
- Repita para o restante rhizoboxes. Salve todas as malas para a colheita.
9. mesmo molhando para 60% a capacidade de retenção de água
Nota: Esta quantidade de umidade do solo foi encontrada para impedir que as plantas estressado seca, evitando o desenvolvimento de condições anóxica ou crescimento das algas.
- Medir a capacidade de retenção de água (CRA) do substrato14.
- Calcular o peso ideal de cada caixa; aqui definido como a soma do peso do rhizobox vazio, combinado com o peso do substrato com 60% de capacidade de retenção de água.
- Multiplique a CRA (gramas de água / gramas de substrato seco) por 0,6 para obter a massa de água realizada no substrato em 60% CRA. Adicione esta massa para a massa de substrato seco e a massa da fonte 15N.
- Adicione o peso vazio de cada caixa para o número obtido acima.
- Pese as caixas, uma vez que eles foram preenchidos. Subtrai o peso de cada caixa (g) nesse ponto de seu peso ideal (em g) calculado na etapa 9.2. Água com esse volume (em mL) de eliminação ionizado (DI) água lentamente e uniformemente.
Nota: Este passo pode ser feito usando a irrigação por gotejamento ou molhar com a mão. Se molhar com a mão, deixe a água infiltrar completamente antes de adicionar mais para evitar condições de umidade do solo heterogêneo e canais preferenciais de fluxo.
10. sementes, germinação e transplante de órgãos
- Se usando controles unplanted, anular esses rhizoboxes.
- Superfície-esterilize as sementes de milho por agitação por 1 min em 5% NaOCl e, em seguida, enxaguar cuidadosamente em água DI.
Nota: Neste experimento, as sementes de seis diferentes genótipos de milho foram usadas para investigar diferenças genotípicas em plasticidade de raiz. - Germinar sementes esterilizadas colocando-os em um tecido de laboratório molhado (por exemplo, Kimwipe) no interior de placas de Petri e cobrindo com outro tecido úmido. Não deve haver qualquer água parada. Pratos de Petri de lugar em lugar escuro para 48\u201272 h até a radícula só começa a emergir.
- Use uma espátula estreita para escavar um furo a 2,5 cm de profundidade no centro de cada rhizobox. Transplantar uma semente germinada dentro do buraco, garantindo que a radícula é orientada diretamente para baixo.
Nota: Se a radícula é inclinada em direção de qualquer remendo, a comparação das taxas de crescimento de raiz vai ser tendencioso. - Marque a localização da semente na transparência.
- Cobrir a semente e a água com até 50 mL de água Desionizada.
11. plantas crescimento
- Cultivar plantas para 25 dias (ou contanto que desejado), mantendo 60% CRA durante todo o período de crescimento. Monitorar o crescimento da raiz ao traçar as raízes.
- Cada caixa pesa todos os dias de 3\u20124 e água até que fica a cerca de 5 g do seu peso ideal. Pare de regar o rhizoboxes quatro dias antes da colheita, para facilitar a separação dos painéis. Remova as ervas daninhas à mão com frequência para que apenas as raízes das plantas de interesse estão presentes.
- Rastrear as raízes visíveis todos os dias de 3\u20124 usando um marcador permanente com cores claramente distinguíveis por cada dia de rastreamento.
Nota: Os marcadores de diâmetro diferente podem ser usados para raízes principais e laterais, se desejado. Pode ser útil definir critérios para raiz rastreamento desde o início, desde um grau de subjetividade está envolvido, especialmente se vários pesquisadores será raízes de rastreamento ou raízes de diferentes ordens ou diâmetro para que sejam distinguidos com marcadores diferentes. Neste experimento, a precisão das raízes visíveis em apenas um lado da caixa de rastreamento foi testada traçando raízes visíveis em ambos os lados e comparar o comprimento total de raiz medido sobre as transparências digitalizadas para comprimento de raiz total, medido por lavagem e varredura de raízes. A correlação entre o comprimento de raiz rastreado e digitalizado foi significativa independentemente se só a transparência volta ou ambos transparências foram usadas. Portanto, é possível traçar apenas raízes visíveis no painel traseiro.
12. colheita de brotos e obtenção de raiz e amostras de solo para análise
- Coloque o rhizobox primeiro plano e retire todos os parafusos.
- Colheita das amostras de atirar. Clip de rebentos na base, enxaguar qualquer tipo de solo com água e seque a 60 ° C. Moagem atira com um almofariz e um pilão que passe por uma peneira de 2 mm e pesa subamostras para cápsulas de estanho para análise isotópica (ver seção 14).
- Usando a transparência como um guia, cortou os patches de tratamento e controle com uma navalha. Use uma colher ou espátula para colher as raízes e o solo rizosfera aderente dentro do respectivo saco de tratamento ou controle.
Nota: Embora muitos métodos existem para solo rizosfera separado, o solo sob a influência de planta raízes15e rizosfera pode ser considerada um gradiente ao invés de uma zona estritamente delineadas16, este método segue o amplamente utilizado definição de solo que adere para plantar raízes após agitação17. - Acrescente o restante raízes e solo o terceiro saco.
- Passar o tratamento, controle e do volume de amostras através de uma peneira de 2 mm para separar as raízes do substrato, removendo qualquer raízes visíveis ou fragmentos > 1 cm de comprimento com pinça fina. Mantenha estas amostras separadas um do outro para um total de três raiz e três amostras de substrato.
13. validação de traçados e estimativa das taxas de crescimento relativo de raiz
- Digitalizar o tratamento, controle e as amostras a granel e calcular o comprimento da raiz.
- Trabalhando com uma amostra de cada vez, enxague raízes cuidadosamente com água para remover qualquer substrato restante. Organize as amostras em uma bandeja de clara para que as raízes não se sobrepõem.
- Varredura de amostras usando um scanner compatível com software de análise de raiz (por exemplo, WinRhizo). Certifique-se de que o software está calibrado para confiantemente distinguir as raízes do plano de fundo da imagem.
- Use o software para medir o comprimento total da raiz e o comprimento de raiz nas classes de interesse (por exemplo, < 0.2 mm, 0.2\u20120.4 mm, 0.4\u20120.8 mm, 0.8\u20121.6 mm, > 1,6 mm) de diâmetro.
- Calcule a raiz comprimento densidade (RLD) para controle e tratamento de manchas e para cada rhizobox como um todo.
- Calcular o volume de tratamento e controle de patches multiplicando a área traçada em cada transparência (ver passo 8.1) por 0,635 cm, a profundidade da caixa. Usar esses volumes para calcular a densidade de comprimento raiz no tratamento e controle de patches usando o comprimento total de raiz em cada patch (consulte a etapa 13.1.3).
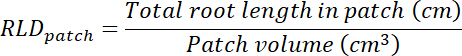
- Calcular o volume de substrato em cada rhizobox multiplicando a área traçada na transparência (ver passo 8.1) por 0,635 cm. Calculate RLD quanto os patches de tratamento e controle.
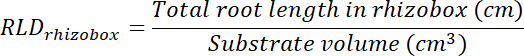
- Calcular o volume de tratamento e controle de patches multiplicando a área traçada em cada transparência (ver passo 8.1) por 0,635 cm, a profundidade da caixa. Usar esses volumes para calcular a densidade de comprimento raiz no tratamento e controle de patches usando o comprimento total de raiz em cada patch (consulte a etapa 13.1.3).
- Valide a raiz método de rastreamento, comparando sistemas digitalizados de raiz e cujas imagens.
- Varredura de cada transparência e calcular o comprimento total de raiz, usando o software. Salve a imagem digitalizada para o crescimento de cálculos da taxa.
- Resumir as medições de comprimento de raiz total de tratamento, controle e a maioria de amostras para cada caixa (consulte a etapa 13.1.3).
- Teste as medições digitalizadas e rastreadas de comprimento raiz total, para ver se a correlação é estatisticamente significativa.
Nota: Em caso afirmativo, o método de rastreamento é validado, e taxas de crescimento relativo podem ser calculadas em cada ponto de tempo. Se não, apenas os dados digitalizados de raiz de sistema fornecem uma indicação precisa do crescimento da raiz. Este poderia ser o caso se a metodologia de rastreamento foi inconsistente ou se as raízes não foram igualmente visíveis para todos os genótipos, por exemplo.
- Se o método de rastreamento foi validado, calcule taxas de crescimento relativo de raiz para cada rhizobox.
- Use o software de análise de raiz calibrado para distinguir entre as cores de rastreamento escolhido para medir o comprimento total da raiz no tratamento, controle e a maioria de amostras em cada ponto de tempo. Calcule o comprimento de raiz total cumulativo em cada ponto de tempo.
- Calcule taxas de crescimento de raiz relativa (RGRraiz) para cada rhizobox, bem como para o tratamento e controle de patches para cada intervalo do tempo t1-t2 , como segue.
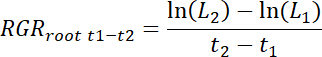
Nota: Aqui L1 é o comprimento total de raiz no patch (soma cumulativa de 11,3) em dias de1 t após o transplantio (DAT) e L2é o comprimento total de raiz no patch em t2 DAT.
14. análise de 15N particionamento entre raiz, atirar e tratamento de amostras de solo
- Raízes secas a 60 ° C, pesar a biomassa e moer para passar por uma peneira de 2 mm.
- Secas subamostras de solo de tratamento a 60 ° C.
- Pacote de raízes e tratamento para cápsulas de estanho como com os brotos.
Nota: Peso Ideal da amostra por cápsula deve ser calculado separadamente para brotos, raízes e solo baseada na relação C/N estimada do material para atingir a quantia de N total para análise. Entre em contato com o isótopo estável onde as amostras devem ser enviadas para obter mais informações. Para este experimento, as instruções de preparação de amostra e calculadora de peso de amostra fornecidos pela UC Davis estável Isotope facilidade foram seguidos18.
Atenção: Tenha especial cuidado ao misturar amostras uniformemente antes da embalagem em cápsulas e preparar várias cápsulas por amostra. Se as amostras não estão uniformemente misturadas, recuperação aparente de 15N pode exceder a quantidade originalmente presente. - Analise o N total, δ15 e 15N conteúdo de cada sessão, raiz e amostra de solo de tratamento.
Nota: Neste experimento, as amostras de plantas foram analisadas através de combustão com um analisador elementar PDZ Europa ANCA-GSL interfaceado com um PDZ Europa 20-20 isótopo relação espectrômetro de massa na UC Davis estável isótopo instalação (UCD SIF). Amostras de solo foram analisadas com um analisador elementar Elementar Vario EL cubo interfaceado com um PDZ Europa 20-20 isótopo relação espectrômetro de massa na UCD SIF. - Calcular a quantidade de 15N obtido a partir do rótulo na planta atirar e amostras de raiz.
- Em primeiro lugar, calcule o montante de 15N superiores a atmosférica 15N em cada piscina, 15P *:
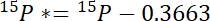
onde 15P é o conteúdo de 15N % atômica da piscina de interesse. - Em segundo lugar, calcule o montante de 15N superiores a atmosférica 15N no rótulo, 15L *:
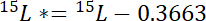
onde 15L é o conteúdo de 15N % atômica da fonte rotulada de N. - Em terceiro lugar, calcule a quantidade de N total em cada piscina, Np:
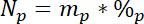
onde mp é a massa do pool (por exemplo, total tiro seco ou biomassa de raiz) e %p é a porcentagem de N de piscina. - Finalmente, use os resultados de 14.5.1\u201214.5.3 na Ndff equação19 para calcular a quantidade de N obtido a partir da etiqueta, Nl:
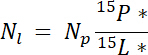
Nota: A equação de Ndff é usada para determinar a quantidade de N de uma fonte rotulada que é recuperada por plantas. Ele assume que não há discriminação isotópica ocorre durante a absorção de N pela planta e é geralmente válida para N fontes enriquecido ~1\u201210%19.
- Em primeiro lugar, calcule o montante de 15N superiores a atmosférica 15N em cada piscina, 15P *:
Resultados
As raízes cresceram preferencialmente contra a parte de trás da caixa, como previsto. Comprimento total rastreados raiz na parte de trás da caixa variou entre 400 e 1.956 cm, em comparação com 758-93 cm na frente da caixa. Coeficientes de correlação de Pearson emparelhados foram calculados entre tamanho de raiz digitalizada e rastreados raiz na frente da caixa, parte traseira da caixa, e a soma de frente e de trás foi usada para determinar se o rastreamento com precisão refletido...
Discussão
O rhizoboxes descrito neste protocolo pode ser usado para responder a perguntas variadas em raízes e rizosfera de ciência e ter encontrado diversas noutro local usa10,20,21,22,23 , 24 , 25. outros pesquisadores capturaram imagens do tempo-lapso de rhizoboxes21,...
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Os autores gostaria de reconhecer os revisores anônimos para seus comentários, bem como J.C. Cahill e Tan Bao para orientação inicial no desenvolvimento do protocolo rhizobox. O financiamento foi fornecido pela Fundação para alimentos e agricultura Research, Instituto Nacional nos departamento de agricultura (USDA) de alimentos e agricultura, agrícola Experiment Station projeto CA-D-PLS-2332-H, a A.G. e pela UC Davis departamento de planta Ciências através de uma bolsa de J.S.
Materiais
| Name | Company | Catalog Number | Comments |
| 1.27 cm diameter PVC pipe | JM Eagle | 530048 | 305 cm per box, cut into lengths as specified in the protocol |
| PVC side elbows | Lasco | 315498 | 2 per box |
| PVC 90-degree elbows | Charlotte | PVC 02300 0600 | 4 per box |
| PVC T joints | Charlotte | PVC 02402 0600 | 4 per box |
| Extruded acrylic panes | TAP Plastics | N/A | 2 per box, 0.64 cm thick x 40.5 cm wide x 61 cm long |
| HDPE spacers (sides) | TAP Plastics | N/A | 2 per box, 0.64 cm thick x 2.5 cm wide x 57 cm long |
| HDPE spacers (bottom) | TAP Plastics | N/A | 1 per box, 0.64 cm thick x 2.5 cm wide x 40.5 cm long |
| HDPE spacers (patch) | TAP Plastics | N/A | 2 per box, 0.64 cm thick x 3.8 cm wide x 28 cm long |
| Polyester batting | Fairfield | #A-X90 | 2.5 cm x 40.5 cm strip per box |
| 20-thread screws | N/A | N/A | 3.2 cm long, 0.64 cm diameter |
| Washers | N/A | N/A | 0.64 cm internal diameter |
| Hex nuts | N/A | N/A | sized to fit the screws |
| Light deprivation fabric | Americover, Inc. | Bold 8WB26.5 | 1 piece 95 cm wide and 69 cm long per box |
| Sand | Quikrete | No. 1113 | |
| Field soil | N/A | N/A | |
| Transparencies for tracing | FXN | FXNT1319100S | One per side of the box to be traced |
Referências
- Hodge, A. Roots: The Acquisition of Water and Nutrients from the Heterogeneous Soil Environment. Progress in Botany 71. , 307-337 (2010).
- Grossman, J. D., Rice, K. J. Evolution of root plasticity responses to variation in soil nutrient distribution and concentration. Evolutionary Applications. 5 (8), 850-857 (2012).
- Zhang, H., Forde, B. G. An Arabidopsis MADS box gene that controls nutrient-induced changes in root architecture. Science. 279 (5349), 407-409 (1998).
- Hodge, A., Stewart, J., Robinson, D., Griffiths, B. S., Fitter, A. H. Competition between roots and soil micro-organisms for nutrients from nitrogen-rich patches of varying complexity. Journal of Ecology. 88 (1), 150-164 (2000).
- Trachsel, S., Kaeppler, S. M., Brown, K. M., Lynch, J. P. Shovelomics: high throughput phenotyping of maize (Zea mays L.) root architecture in the field. Plant and Soil. 341 (1-2), 75-87 (2011).
- Rogers, E. D., Monaenkova, D., Mijar, M., Nori, A., Goldman, D. I., Benfey, P. N. X-ray computed tomography reveals the response of root system architecture to soil texture. Plant Physiology. , (2016).
- Groleau-Renaud, V., Plantureux, S., Guckert, A. Effect of mechanical constraint on nodal and seminal root system of maize plants. Comptes Rendus De L Academie Des Sciences Serie Iii-Sciences De La Vie-Life Sciences. 321 (1), 63-71 (1998).
- Lin, Y., Allen, H. E., Di Toro, D. M. Barley root hair growth and morphology in soil, sand, and water solution media and relationship with nickel toxicity. Environmental Toxicology and Chemistry. 35 (8), 2125-2133 (2016).
- Wenzel, W. W., Wieshammer, G., Fitz, W. J., Puschenreiter, M. Novel rhizobox design to assess rhizosphere characteristics at high spatial resolution. Plant and Soil. 237 (1), 37-45 (2001).
- Spohn, M., Carminati, A., Kuzyakov, Y. Soil zymography - A novel in situ method for mapping distribution of enzyme activity in soil. Soil Biology and Biochemistry. 58, 275-280 (2013).
- Vollsnes, A. V., Futsaether, C. M., Bengough, A. G. Quantifying rhizosphere particle movement around mutant maize roots using time-lapse imaging and particle image velocimetry. European Journal of Soil Science. 61 (6), 926-939 (2010).
- Hewitt, E. J. . Sand and Water Culture Methods Used in the Study of Plant Nutrition. , (1966).
- Choudhary, M. I., Shalaby, A. A., Al-Omran, A. M. Water holding capacity and evaporation of calcareous soils as affected by four synthetic polymers. Communications in Soil Science and Plant Analysis. 26 (13-14), 2205-2215 (1995).
- Bakker, P. A. H. M., Berendsen, R. L., Doornbos, R. F., Wintermans, P. C. A., Pieterse, C. M. J. The rhizosphere revisited: root microbiomics. Frontiers in Plant Science. 4, 2013 (2013).
- McNear, D. H. The Rhizosphere - Roots, Soil, and Everything In Between. Nature Education Knowledge. 4 (3), 1 (2013).
- Ortas, I. Determination of the extent of rhizosphere soil. Communications in Soil Science and Plant Analysis. 28 (19-20), 1767-1776 (1997).
- . Carbon (13C) and Nitrogen (15N) Sample Preparation Available from: https://stableisotopefacility.ucdavis.edu/13cand15nsamplepreparation.html (2018)
- Barraclough, D. 15N isotope dilution techniques to study soil nitrogen transformations and plant uptake. Fertilizer research. 42 (1-3), 185-192 (1995).
- Belter, P. R., Cahill, J. F. Disentangling root system responses to neighbours: identification of novel root behavioural strategies. AoB PLANTS. 7, (2015).
- Nagel, K. A., et al. GROWSCREEN-Rhizo is a novel phenotyping robot enabling simultaneous measurements of root and shoot growth for plants grown in soil-filled rhizotrons. Functional Plant Biology. 39 (11), 891-904 (2012).
- Adu, M. O., Yawson, D. O., Bennett, M. J., Broadley, M. R., Dupuy, L. X., White, P. J. A scanner-based rhizobox system enabling the quantification of root system development and response of Brassica rapa seedlings to external P availability. Plant Root. 11, 16-32 (2017).
- Neumann, G., George, T. S., Plassard, C. Strategies and methods for studying the rhizosphere-the plant science toolbox. Plant and Soil. 321 (1-2), 431-456 (2009).
- Bodner, G., Alsalem, M., Nakhforoosh, A., Arnold, T., Leitner, D. RGB and Spectral Root Imaging for Plant Phenotyping and Physiological Research: Experimental Setup and Imaging Protocols. JoVE (Journal of Visualized Experiments). (126), e56251-e56251 (2017).
- Kuchenbuch, R. O., Ingram, K. T. Image analysis for non-destructive and non-invasive quantification of root growth and soil water content in rhizotrons. Journal of Plant Nutrition and Soil Science. 165 (5), 573-581 (2002).
- Dresbøll, D. B., Thorup-Kristensen, K., McKenzie, B. M., Dupuy, L. X., Bengough, A. G. Timelapse scanning reveals spatial variation in tomato (Solanum lycopersicum L.) root elongation rates during partial waterlogging. Plant and Soil. 369 (1-2), 467-477 (2013).
- Wu, J., et al. RhizoChamber-Monitor: a robotic platform and software enabling characterization of root growth. Plant Methods. 14 (1), 44 (2018).
- Rogers, S. W., Moorman, T. B., Ong, S. K. Fluorescent In Situ Hybridization and Micro-autoradiography Applied to Ecophysiology in Soil. Soil Science Society of America Journal. 71 (2), 620-631 (2007).
- Eickhorst, T., Tippkötter, R. Detection of microorganisms in undisturbed soil by combining fluorescence in situ hybridization (FISH) and micropedological methods. Soil Biology and Biochemistry. 40 (6), 1284-1293 (2008).
- Spohn, M., Kuzyakov, Y. Distribution of microbial- and root-derived phosphatase activities in the rhizosphere depending on P availability and C allocation - Coupling soil zymography with 14C imaging. Soil Biology and Biochemistry. 67, 106-113 (2013).
- Lv, G., Kang, Y., Li, L., Wan, S. Effect of irrigation methods on root development and profile soil water uptake in winter wheat. Irrigation Science. 28 (5), 387-398 (2010).
- Asseng, S., Ritchie, J. T., Smucker, A. J. M., Robertson, M. J. Root growth and water uptake during water deficit and recovering in wheat. Plant and Soil. 201 (2), 265-273 (1998).
- Hernandez-Ramirez, G., et al. Root Responses to Alterations in Macroporosity and Penetrability in a Silt Loam Soil. Soil Science Society of America Journal. 78 (4), 1392-1403 (2014).
- Zhang, Y. L., Wang, Y. S. Soil enzyme activities with greenhouse subsurface irrigation. Pedosphere. 16 (4), 512-518 (2006).
- Robinson, D., Hodge, A., Griffiths, B. S., Fitter, A. H. Plant root proliferation in nitrogen-rich patches confers competitive advantage. Proceedings of the Royal Society of London B: Biological Sciences. 266 (1418), 431-435 (1999).
- Lobet, G., Draye, X. Novel scanning procedure enabling the vectorization of entire rhizotron-grown root systems. Plant Methods. 9, 1 (2013).
- Swarup, R., Wells, D. M., Bennett, M. J. Root Gravitropism. Plant Roots: The Hidden Half. , (2013).
- Smit, A. L., Bengough, A. G., Engels, C., van Noordwijk, M., Pellerin, S., van de Geijn, S. C. . Root Methods: A Handbook. , (2000).
- van Dusschoten, D., et al. Quantitative 3D Analysis of Plant Roots Growing in Soil Using Magnetic Resonance Imaging1[OPEN]. Plant Physiology. 170 (3), 1176-1188 (2016).
- Metzner, R., et al. Direct comparison of MRI and X-ray CT technologies for 3D imaging of root systems in soil: potential and challenges for root trait quantification. Plant Methods. 11, 17 (2015).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados