Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Eine optimierte Rhizobox-Protokoll zum Wurzelwachstum und Reaktionsfähigkeit auf lokalisierte Nährstoffe zu visualisieren
In diesem Artikel
Zusammenfassung
Visualisieren und Wurzel Wachstum in Situ Messung ist extrem schwierig. Wir präsentieren Ihnen eine anpassbare Rhizobox Methode um WURZELENTWICKLUNG und Verbreitung im Laufe der Zeit als Reaktion auf Nährstoffanreicherung zu verfolgen. Diese Methode wird verwendet, um Mais genotypischen Unterschiede in der Wurzel Plastizität als Reaktion auf eine organische Stickstoff-Quelle zu analysieren.
Zusammenfassung
Wurzeln sind notorisch schwierig zu studieren. Boden ist eine visuelle und mechanische Barriere, so dass es schwierig zu verfolgen Wurzeln in Situ ohne zerstörerische Ernte oder teure Ausrüstung. Wir präsentieren Ihnen eine anpassbare und erschwingliche Rhizobox Methode, die ermöglicht die zerstörungsfreie Visualisierung des Wurzelwachstums im Laufe der Zeit und ist besonders gut geeignet zum Studium Wurzel Plastizität als Reaktion auf lokalisierte Ressource Patches. Die Methode wurde durch die Bewertung Mais genotypischen Variation in Plastizität Antworten zu Patches, enthält 15N beschriftet Hülsenfrucht Rückstände überprüft. Methoden werden beschrieben erhalten repräsentative Entwicklungsstörungen Messungen im Laufe der Zeit, Wurzel Länge Dichte in Ressource-haltigen und Kontrolle-Patches zu messen, berechnen Wurzel Wachstumsraten und 15N Einziehung durch Pflanzenwurzeln und Triebe zu bestimmen. Vorteile, Einschränkungen und mögliche zukünftige Anwendungen der Methode werden ebenfalls behandelt. Obwohl darauf geachtet werden muss, um sicherzustellen, dass die Versuchsbedingungen Stamm Wachstum Daten nicht beeinflussen, ergibt das Rhizobox Protokoll hier vorgestellten zuverlässige Ergebnisse wenn genügend Aufmerksamkeit zum Detail durchgeführt.
Einleitung
Obwohl oft übersehen im Vergleich zu ihren oberirdischen Pendants, Wurzeln spielen eine wichtige Rolle im Werk Nährstoff Erwerb. Angesichts der erheblichen CO2-Kosten von Wurzel-Bau und Unterhalt, haben Pflanzen Mechanismen entwickelt, um die Wurzeln nur wo Nahrungssuche die Investition Wert ist. Wurzel-Systeme können so effizient und dynamisch Ressource Patches abbauen von proliferierenden in Hotspots, heraufregulierende Raten von Aufnahme und schnell translocating Nährstoffe, das Phloem für weiteren Transport1. Plastizität Antworten können variieren zwischen Werk Arten oder Genotypen2,3 und abhängig von der chemischen Form der Nährstoff mit4,5. Variation in Wurzel Plastizität sollte darüber hinaus als Verständnis für komplexe Wurzel Antworten auf heterogenen Bodenressourcen Zucht und Managementstrategien zur Effizienzsteigerung der Nährstoff Verwendung in der Landwirtschaft informieren könnte untersucht werden.
Trotz seiner Notwendigkeit und Relevanz für Verständnis Anlagensysteme bietet Visualisierung und Quantifizierung von Wurzel Plastizität bei relevanten Skalen technische Herausforderungen. Ausgraben der Wurzel-Krone aus dem Boden ("Shovelomics"6) ist eine gängige Methode, aber feine Wurzeln nutzen kleine Poren zwischen Bodenaggregate und Ausgrabung führt unweigerlich zu einem gewissen Grad der Verlust dieser fragilen Wurzeln. Des weiteren macht zerstörerischen Ernte es unmöglich, Veränderungen in einem Root-System im Laufe der Zeit zu folgen. In Situ bildgebende Verfahren wie berechnet Röntgentomographie ermöglichen direkten Visualisierung der Wurzeln und Bodenressourcen bei hoher räumlicher Auflösung7, aber sind teuer und erfordern speziellen Ausrüstung. Hydroponische Experimente vermeiden Sie Abhängigkeiten verbunden mit Wurzeln aus dem Boden zu extrahieren, aber Wurzel Morphologie und Architektur unterscheiden sich in wässrigen Medien im Vergleich zu mechanischen Einschränkungen und biophysikalischen Komplexität der Böden8,9. Schließlich können nicht mit Entwicklungsstörungen Plastizität in diesen künstlichen Medien Rhizosphäre Prozesse und Funktionen integriert werden.
Wir präsentieren Ihnen ein Protokoll für den Bau und die Verwendung von Rhizoboxes (schmal, Clear-seitig rechteckigen Behälter) als eine kostengünstige, anpassbare Methode Wurzelwachstum im Boden im Laufe der Zeit zu charakterisieren. Speziell gestaltete Rahmen fördern Wurzeln wachsen bevorzugt gegen die Rückwand durch Gravitropismus, Steigerung der Genauigkeit der Wurzel Längenmessungen. Rhizoboxes sind häufig verwendet, um das Wurzelwachstum und Rhizosphäre Interaktionen10,11,12zu studieren, aber die hier vorgestellte Methode bietet einen Vorteil in der Einfachheit mit seinem Einkammer-Design und preiswerte Materialien, und dient zur Wurzel Antworten auf lokalisierte Nährstoffe zu studieren. Die Methode könnte jedoch auch an eine Reihe von anderen Wurzel und Rhizosphäre Prozesse wie Intra/speziesübergreifenden Wettbewerb, räumliche Verteilung von chemischen Verbindungen, Mikroben oder Enzym-Aktivität zu studieren. Hier untersuchen wir genotypischen Unterschiede zwischen Maishybride als Reaktion auf Flecken von 15N beschriftet Hülsenfrucht Rückstände und Highlight repräsentative Ergebnisse, die Rhizobox-Methode zu validieren.
Protokoll
1. Vorbereitung der Vorder- und Rückwände und Abstandhalter
- Bereiten Sie die vorderen und hinteren Paneele.
- Schnitt zwei Stücke von klaren 0,635 cm dickem Acryl bis 40,5 cm breit und 61 cm lang pro Box oder vorgeschnittene Stücke (siehe Tabelle der Materialien) zu erwerben.
- Mit einem Bohrer für Acryl, Bohren Sie Löcher 0,635 cm Durchmesser 1,3 cm aus den seitlichen Rändern bei 2,5, 19, 38 und 53,3 cm von der Spitze. Bohren Sie Löcher 1,3 cm vom unteren Rand bei 2,5, 20,3 und 38 cm von der linken Seite (Abbildung 1).
Hinweis: Es ist am effizientesten, eine Bohrmaschine für einen Stapel von sechs bis zehn Blätter gleichzeitig verwenden, sondern eine Handbohrmaschine kann auch verwendet werden. - Entfernen Sie alle Abdeckungen aus Acryl und reinigen Sie sanft beide Platten vor der Montage der Boxen.
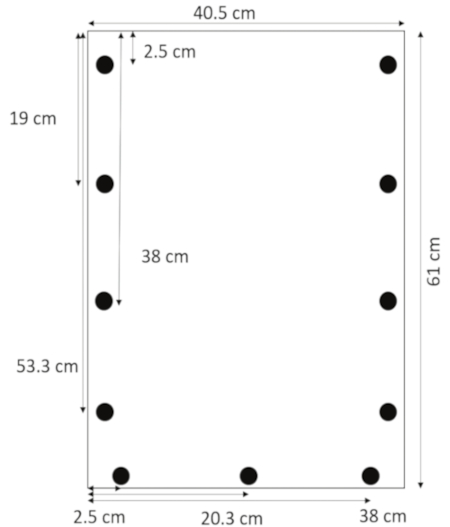
Abbildung 1: Anordnung der Bohrungen. Löcher sind gebohrte 1,3 cm aus den seitlichen Rändern bei 2,5, 19, 38, und 53,3 cm von oben und 1,3 cm vom unteren Rand bei 2,5, 20,3 und 38 cm vom linken Rand. Bitte klicken Sie hier für eine größere Version dieser Figur.
- Bereiten Sie die seitlichen und unteren Abstandhalter.
- Schneiden Sie drei Abstandshalter pro Box aus High-Density-Polyethylen (HDPE) oder Kauf zwei vorgeschnittene Seite Abstandshalter (0,635 cm dick, 2,5 cm breit, 57 cm lang) und eine vorgeschnittenen unteren Abstandhalter (0,635 cm dick, 40,5 cm lang, 2,5 cm breit). Siehe Tabelle der Materialien.
- Richten Sie die Abstandshalter zwischen den vorderen und hinteren Platten entlang der Seiten und der Boden der Box. Mit einer Handbohrmaschine oder Bohrmaschine, Bohren Sie durch die vorhandenen Löcher in der Front und wieder zurück, so dass die Löcher sauber durch alle drei Ebenen passieren.
- Halten Sie die Schichten erfolgt über Klemmen oder durch die Installation eine Kombination aus Schrauben, Muttern und Scheiben in jedem neu Loch gebohrt (siehe Punkt 3.1).
2. Installation des Streifens des Polyester Watte an der Unterseite der Box
Hinweis: Dies wird Boden und Wasser verhindert durch Fugen zwischen Abstandhalter undicht.
- Polyester Volumenvlies in 2,5 cm Breite durch Schneiden Streifen 40,5 cm lang (siehe die Tabelle der Materialien).
- Legen Sie mit der Rückseite liegen flach und die Abstandshalter oben drauf die Watte direkt oberhalb der unteren Abstandhalter und halten Sie es mit der Oberseite (Abbildung 2).
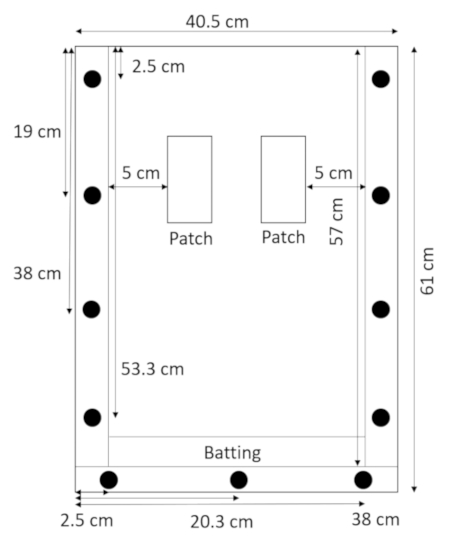
Abbildung 2: Rhizobox mit Watte montiert. Ein schmaler Streifen des Schlagens am unteren Rand der Rhizobox verhindert, dass Erde und Sand austreten. Bitte klicken Sie hier für eine größere Version dieser Figur.
3. Montage der Rhizoboxes
- Montieren Sie die Rhizoboxes mit 20-Gewinde Schrauben (3,2 cm Länge von 0,635 cm Durchmesser), Unterlegscheiben (0,635 cm Innendurchmesser) und Sechskantmuttern (Größe passen die Schrauben, siehe Tabelle der Materialien.
- Ziehen Sie jede Schraube durch eine Unterlegscheibe, Frontplatte, Abstandhalter, Rückwand, Scheibe und Sechskantmutter. Stellen Sie sicher, dass die Schrauben sehr eng sind; Wenn das Feld locker montiert ist, wird Boden durch Lücken zwischen den Platten und Seite Abstandhalter ergießen.
Hinweis: Acryl ist leicht zerkratzt, und die Kratzer können mit Wurzel Messungen beeinträchtigen, also die montierten Boxen mit Sorgfalt zu behandeln. Vermeiden Sie stapelnde Kisten, wenn Schutzmaterial dazwischen platziert ist. - Bereiten Sie zwei Patch-Abstandhalter (Abstandshalter, die verwendet werden, um die Behandlung und Kontrolle Patches erstellen) pro Box. Geschnitten Sie Abstandhalter aus High-Density-Polyethylen (HDPE) Blätter oder erwerben Sie diese Pre-Cut (0,635 cm dick, 3,8 cm breit, 28 cm lang; siehe Tabelle of Materials). Bohren Sie ein Loch 0,635 cm Durchmesser in jeder Abstandhalter, 2 cm von der Spitze entlang der Mittellinie (Abbildung 3).
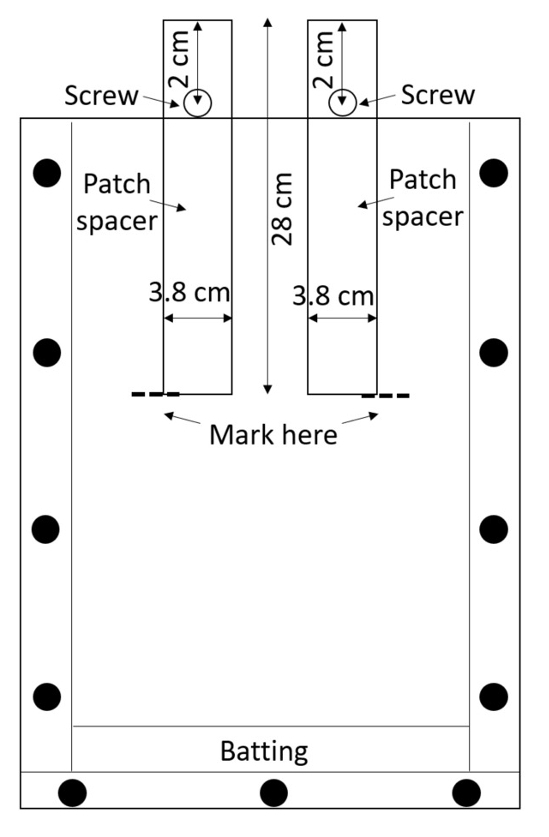
Abbildung 3: Patch Abstandshalter. Schrauben durch die Mitte der HDPE-Streifen halten sie vor dem Absturz in die Box. Die Rhizobox ist gefüllt mit Boden rund um die Abstandshalter, der Boden ist benetzt und die Abstandhalter werden entfernt, um leere Behandlung und Kontrolle Flecken hinterlassen. Bitte klicken Sie hier für eine größere Version dieser Figur.
- Eine Schraube durch jedes Loch mit Mutter sichern, so dass das Distanzstück teilweise in die Rhizobox eingefügt werden kann, bis die Schraube es geht verhindert weiter (Abbildung 3).
Hinweis: Die Erde ist rund um die Abstandshalter benetzt und die Abstandhalter entfernt, zwei Leerstellen bleiben kann, die mit der entsprechenden Substrate für die Stickstoff-haltigen Behandlung Patch und Kontrolle Patch gefüllt werden.
4. Gebäude PVC-Rahmen, die Rhizoboxes in einem Winkel zu unterstützen
Hinweis: Wenn das Feld schräg platziert wird, wird Gravitropismus fördern die Wurzeln, gegen die Rückwand zu wachsen, so dass alle Wurzeln sichtbar für die Ablaufverfolgung verwendet werden. Polyvinylchlorid (PVC) Maße in Abbildung 4 Ergebnis in einem Rahmen, der die Rhizobox bei verwaltet eine etwa 55 ° Winkel auf die Bank.
- 13 Stücke von 1,3 cm Durchmesser PVC pro Karton: 2 × 44 cm Länge, 3 × 42 cm Länge, 2 × 36,3 cm Länge, 2 × 25,4 cm Länge und 4 × 3,8 cm Länge (siehe Tabelle der Materialien).
Hinweis: Eine hiebsäge wird für Effizienz und sogar Schnitten empfohlen. - Verwenden Sie 4 × 2-Wege-Ellbogen, 2 × 3-Wege Ellbogen und 4 T-Verbindern (siehe Tabelle der Materialien), Feld, wie in Abbildung 4gezeigt zu montieren.
Hinweis: Frames sollte stabil ohne zusätzlichen Leim, aber PVC Kleber kann bei Bedarf verwendet werden.
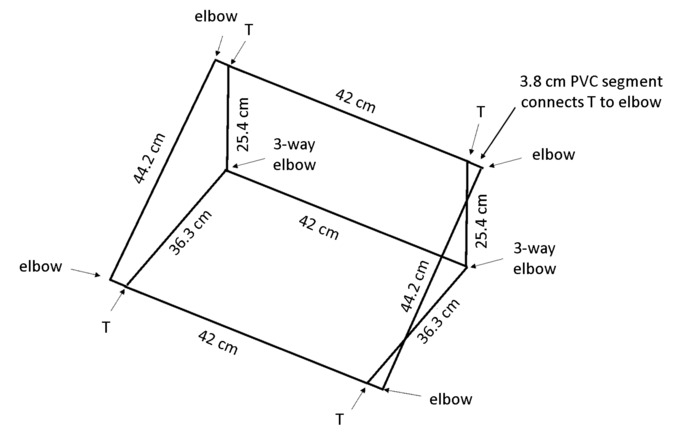
Abbildung 4: Rahmen, um Rhizoboxes zu unterstützen. Der leichte Rahmen ist aus PVC auf die angegebenen Längen geschnitten und verbunden mit der Verbindungstypen angegeben gebaut. Bitte klicken Sie hier für eine größere Version dieser Figur.
5. Nähen Schutzhüllen, Licht und Wärme zu reflektieren
Hinweis: Wurzeln vermeiden, Licht, so diesen Fällen Licht ausschließen, um sicherzustellen, die beobachtet, dass Wurzel Plastizität Antworten durch die Nährstoffquelle in den Patches und nicht durch leichte Vermeidung angetrieben werden. Leichten Entzug Gewebe reduziert auch die Temperatur im Inneren der Rhizoboxes helfen, um Hitze-Stress zu vermeiden.
- Schneiden Sie den leichten Entzug Stoff (spezielle Material, das auf der einen Seite weiß und schwarz auf der anderen) in Stücke ca. 95 cm Breite und 69 cm lang (siehe Tabelle der Materialien). Ein Stück pro Feld ist erforderlich.
- Falten Sie jedes Stück in der Mitte entlang der langen Kante eine 47,5 cm × 69 cm Ärmel bilden. Nähen Sie mit Hilfe einer nähmaschinennadel für Denim, Heavy-Duty Quilten Thread und eine schmale Naht entwickelt an, entlang der Unterseite und ¾ des Weges an der Seite von jedem Ärmel. Fixieren Sie die oberen Ecken zusammen mit einer Sicherheitsnadel.
6. Vorbereitung des Bodens 1:1 (V/V): Sand-Substrat, die Rhizoboxes zu füllen
- Sammeln Sie 1.000 cm3 Feld Erde (von der Website von Interesse) pro Box. Trocknen des Bodens zur Gewichtskonstanz in flachen Schalen bei 60 ° C.
Hinweis: Boden für dieses Experiment wurden unmittelbar nach der Ernte in einem biologisch bewirtschafteten Kornfeld aus 0\u201210 cm Tiefe. - Schleifen Sie den Boden mit einem Mörser und Stößel ein 2 mm Sieb passieren. Messen Sie die Rohdichte des Bodens, indem Sie mit einem Gewicht von einem bekannten Volumen des Bodens.
- Sand (z. B. spielen Sand, der aus dem Baumarkt kostengünstig erworben werden kann; siehe Tabelle der Materialien) zu erhalten und die Schüttdichte messen.
- Messen Sie gleiche Mengen Sand und Erde in einen Eimer und mischen Sie gründlich. Verwenden Sie einen Trichter, um das Feld langsam und gleichmäßig bis 2,5 cm von der Spitze zu füllen ohne schütteln das Kontrollkästchen, um das Substrat zu begleichen zu verursachen. Messen Sie das Volumen des Substrats; Es sollte ca. 1.272 cm3.
- Multiplizieren Sie die Rohdichte des Sandes mit Hälfte dieses Volumens, die Masse des Sandes benötigt für jede Box zu erhalten. Machen Sie dasselbe mit dem Schüttgewicht des Bodens, die Masse des Bodens benötigt für jede Box zu erhalten.
Hinweis: Für den Bereich Boden und Sand in diesem Experiment verwendet, dies war 976 g Sand und 774 g des Bodens, sondern diese Beträge ist abhängig von der Schüttdichte des Bodens verwendet. - Beschriften Sie einen großen Zip-Top-Plastikbeutel pro Rhizobox, wiegen Sie die entsprechenden Massen von Sand und Boden in den Beutel und homogenisieren Sie gründlich zu.
- Analysieren Sie diese 1:1-Boden- und Substrat für Nährstoffgehalt und die natürliche Fülle von 15N (δ15N).
(7) Substrataufbereitung zur Behandlung und Kontrolle Patches
- Beschriften Sie zwei kleine Zip-Top Plastiktüten pro Rhizobox, eine für die Behandlung-Patch und eine für den Steuerelement-Patch. Gewicht 30 g des Bodens: sand Substrat aus jeder große Tasche (Schritt 6.6) in die beiden entsprechenden kleinen Beutel.
- Mischen Sie das Substrat mit 15N beschriftet Stickstoffquelle für die Behandlung-Patch. Dafür wiegen 1 g 15N beschriftet Pflanzenresten oder andere N-Quelle (die Höhe ist einstellbar wie gewünscht) in jeder Behandlung Beutel (kleine Zip-Top), und gründlich mischen.
Hinweis: Für dieses Experiment war eine Mischung aus 15N etikettiert Klee und Wicken Rückstände verwendet. Klee und Wicken Samen wurden in einem 1:1 Mischung aus Vermiculit und Sand gepflanzt und unter Gewächshausbedingungen angebaut. Pflanzen waren täglich mit entionisiertem Wasser bewässert und zweimal wöchentlich mit 1/100 Stärke des Long-Ashton Lösung13 enthält 15Stickstoff N beschriftet. Alle oberirdischen Biomasse wurde vier Wochen nach der Pflanzung, geerntet, getrocknet und gemahlen, um ein 2 mm Sieb passieren. Wenn eine andere Nährstoff gewählt wird, besonders, wenn dieses Element Mobil im Erdreich kann, Pilotprojekte, um Auswaschung zu testen sollen. Slow-Release-Formen der Nährstoffe genutzt werden oder eine anderes Rhizobox Design könnte beschränkt Auswaschung (z. B. durch separate Fächer10) bei Bedarf gewählt werden.
8. Laden Rhizobox mit Substrat und Aufbau Behandlung und Kontrollfelder
- Wiegen Sie jede leere Rhizobox und notieren Sie die Gewichte für die spätere Verwendung.
- Legen Sie zwei Patch-Abstandshalter (siehe Punkt 3.2) in einer Rhizobox, bis die Schraube sie daran hindert, weiter zu gehen. Markieren Sie die Tiefe der Unterkante mit einer leichten Markierung auf der Seite der Rhizobox (Abbildung 3) und entfernen Sie die Abstandshalter.
- Mit einem Trichter mit einer Stamm-Öffnung, die als ist schmal wie die Rhizobox-Öffnung, die Rhizobox aus dem entsprechenden großen Beutel des Substrats auf die markierten Tiefe zu füllen. Der Trichter verschoben, hin und her langsam und gleichmäßig damit das Substrat gleichmäßig ausfüllt und keine bevorzugte Strömungskanäle schafft.
- Wenn das Substrat die markierten Tiefe erreicht hat, setzen Sie die Abstandhalter wieder 5 cm von jeder Seite des Feldes. Fahren Sie fort, das Feld füllen, bis das Substrat ca. 5 cm von der Spitze des Feldes ist (es sollte sein Substrat bleibt in der Tasche).
- Um jede Abstandhalter gründlich nass.
Hinweis: In diesem Experiment wurde dies durch die Bereitstellung von 50 mL Wasser durch Tropf-Strahler zwischen der Außenkante der einzelnen Abstandhalter und die Seite von der Rhizobox und Gießen 50 mL Wasser gleichmäßig zwischen die zwei Abstandshalter eingefügt. Langsame Bewässerung ist notwendig für gleichmäßige Benetzung. - Entfernen Sie die Abstandshalter, während der Boden nass ist, verlassen eines leeren Hohlraums für die Patches.
- Kleben Sie eine Transparentfolie an der Außenseite der einzelnen Rhizobox (siehe Tabelle der Materialien). Markieren Sie einer Seite als Behandlung und als Kontrolle, und füllen Sie die Patches aus dem entsprechenden Beutel mit dem Trichter. Die Grenzen jedes Pflaster auf die Transparenz mit permanent-Marker zu verfolgen.
- Füllen Sie die Rhizobox gleichmäßig mit dem restlichen Substrat. Verfolgen Sie oben auf das Substrat auf die Transparenz.
- Wiederholen Sie für die restlichen Rhizoboxes. Alle Taschen für die Ernte zu retten.
9. auch Bewässerung zu 60 % Wasser-Fassungsvermögen
Hinweis: Dieser Betrag der Bodenfeuchtigkeit erwies sich verhindern, dass Pflanzen erleben Trockenstress während der Entwicklung der anoxischen Bedingungen oder Algenwachstum zu verhindern.
- Messen Sie das Wasser-Fassungsvermögen (WHC) der Substrat-14.
- Das ideale Gewicht für jedes Feld zu berechnen; hier definiert als die Summe des Gewichts der leeren Rhizobox, kombiniert mit dem Gewicht des Substrats bei 60 % Wasser-Fassungsvermögen.
- Multiplizieren Sie die WHC (Gramm Wasser / Gramm trockene Substrat) von 0,6 bis die Masse des Wassers zu erhalten statt in das Substrat bei 60 % WHC. Diese Masse zu der Masse der trockenen Substrat und die Masse der 15N Quelle hinzufügen.
- Die Zahl oben erhalten fügen Sie das Leergewicht des jedes Feld hinzu.
- Wiegen Sie die Felder sie ausgefüllt haben. Subtrahieren Sie das Gewicht des jedes Feld (in g) an dieser Stelle von seinem ideal Gewicht (in g) in Schritt 9.2 berechnet. Wasser mit diesem Volumen (in mL) der de-ionisiertes (DI) Wasser, langsam und gleichmäßig.
Hinweis: Dieser Schritt kann erfolgen mit Tropfbewässerung oder Bewässerung von hand. Wenn per hand Gießen, damit das Wasser versickern vollständig vor dem Hinzufügen von mehr um heterogene Bodenbedingungen Feuchtigkeit und bevorzugte Strömungskanäle zu vermeiden.
10. Samen Sie Keimen und Transplantation
- Wenn Sie unbepflanzte Steuerelemente verwenden, die Rhizoboxes beiseite.
- Sterilisieren Sie Oberfläche-Maissaatgut durch Rühren für 1 min in 5 % NaOCl, dann spülen Sie gründlich mit VE-Wasser.
Hinweis: In diesem Experiment wurden Samen von sechs verschiedenen Mais Genotypen verwendet, um genotypischen Unterschiede in der Wurzel Plastizität zu untersuchen. - Keimen Sie sterilisiert Saatgut durch auf einem nassen Labor Gewebe (z. B. windex) in Petrischalen gelegt und mit einem anderen feuchten Tuch abdecken. Es sollte alle stehenden Gewässer. Ort Petrischalen an einem dunklen Ort für 48\u201272 h bis Keimwurzel gerade beginnt zu entstehen.
- Mit einem Spatel schmal bis 2,5 cm Tiefe in der Mitte jedes Rhizobox ein Loch zu graben. Transplantation eines gekeimten Samen in das Loch, um sicherzustellen, dass die Keimwurzel direkt ausgerichtet ist nach unten.
Hinweis: Wenn die Keimwurzel in Richtung entweder Patch abgewinkelt ist, wird der Vergleich der Wurzel Wachstumsraten voreingenommen sein. - Verfolgen Sie die Position des Samens auf die Transparenz.
- Bedecken Sie die Samen und das Wasser mit bis zu 50 mL VE-Wasser.
11 Pflanzen Wachstum
- Pflanzen wachsen, für 25 Tage (oder so lange wie gewünscht), 60 % Erhaltung WHC während der Vegetationsperiode. Monitor Wurzelwachstum durch die Wurzeln.
- Wiegen Sie jedes Feld alle 3\u20124 Tage und Wasser, bis es innerhalb von 5 g das Idealgewicht ist. Stoppen Sie, Bewässerung der Rhizoboxes vier Tage vor der Ernte bis zur Trennung der Platten zu erleichtern. Entfernen Sie Unkraut von hand häufig so, dass nur die Pflanzenwurzeln von Interesse vorhanden sind.
- Spur sichtbar Wurzeln alle 3\u20124 Tage mit einem permanent-Marker mit klar unterscheidbaren Farben für jeden Tag der Ablaufverfolgung.
Hinweis: Verschiedene Durchmesser-Marker können für Primär- und seitlichen Wurzeln verwendet werden, falls gewünscht. Es kann nützlich sein, legen Sie Kriterien für die Wurzel Rückverfolgung zu Beginn, da ein Maß an Subjektivität beteiligt ist, insbesondere dann, wenn mehrere Forscher Ablaufverfolgung Wurzeln sein werden, oder wenn Wurzeln von verschiedenen Aufträgen oder Durchmesser sind mit verschiedenen Markern unterschieden werden. In diesem Experiment die Genauigkeit der sichtbaren Wurzeln nur auf einer Seite des Feldes wurde von sichtbaren Wurzeln auf beiden Seiten getestet und insgesamt Wurzellänge Vergleich auf den gescannten Folien zu total Wurzellänge gemessen durch Waschen und Scannen Wurzeln gemessen. Die Korrelation zwischen zurückverfolgen und gescannte Wurzellänge war signifikant, unabhängig davon, ob nur die hinteren Transparenz oder beide Folien verwendet wurden. Es ist daher möglich, nur sichtbare Wurzeln auf der Rückseite zu verfolgen.
12. Ernte Triebe und Erlangung von Root und Bodenproben zur Analyse
- Legen Sie die erste Rhizobox flach und entfernen Sie die Schrauben.
- Ernten Sie die Shooting-Proben. Clip-Triebe an der Basis, jedem Boden mit VE-Wasser abspülen und Trocknen bei 60 ° C. Grind schießt mit einem Mörser und Stößel wiegen Teilproben in Zinn Kapseln für Isotopen-Analyse (siehe Abschnitt 14) und durch ein 2 mm Sieb passieren.
- Nutzen Sie die Transparenz als Leitfaden, um die Behandlung und Kontrolle Patches mit einem Rasiermesser geschnitten. Verwenden Sie einen Löffel oder Spatel zu den Wurzeln und der anhaftenden Rhizosphäre Boden in den jeweiligen Behandlung oder Kontrolle Beutel schöpfen.
Hinweis: Zwar gibt es viele Methoden zur separaten Rhizosphäre Boden, der Boden unter dem Einfluss der Pflanze15 Wurzeln, und die Rhizosphäre werden, einen Farbverlauf, anstatt eine streng abgegrenzte Zone16 betrachtet kann, folgt diese Methode die verbreitete Definition des Bodens, die sich um die Pflanzenwurzeln nach dem schütteln17hält. - Schöpfen Sie die verbleibenden Wurzeln und Boden in die dritte Tasche.
- Übergeben Sie die Behandlung, Kontrolle, und bulk-Proben durch ein 2 mm Sieb Substrat, entfernen alle sichtbaren Wurzeln oder Fragmente Wurzeln getrennt > 1 cm in der Länge mit einer feinen Pinzette. Bewahren Sie diese getrennt voneinander für eine Gesamtmenge von drei grundlegenden und drei Substrat Proben.
13. Validierung von Kurven und Abschätzung der relativen Wurzel Wachstumsraten
- Behandlung, Kontrolle, zu scannen und bulk-Proben und Berechnen der Wurzellänge.
- Spülen Sie mit einer Probe gleichzeitig arbeiten, Wurzeln vorsichtig mit VE-Wasser, alle restlichen Substrat zu entfernen. Ordnen Sie Proben in einem klaren Tablett so an, dass die Wurzeln nicht überlappen.
- Scannen Sie Proben mit einem Scanner kompatibel mit Wurzel-Analyse-Software (z. B. WinRhizo). Stellen Sie sicher, dass die Software kalibriert ist, um zuverlässig Wurzeln aus dem Bildhintergrund zu unterscheiden.
- Verwenden Sie die Software zur Messung insgesamt Wurzellänge und Wurzellänge in den Durchmesser-Klassen von Interesse (z. B. < 0,2 mm, 0.2\u20120.4 mm, 0.4\u20120.8 mm, 0.8\u20121.6 mm, > 1,6 mm).
- Wurzel Länge Dichte (RLD) für Behandlung und Kontrolle Patches und für jedes Rhizobox als Ganzes zu berechnen.
- Berechnen Sie das Volumen der Behandlung und Kontrolle Patches multipliziert Bereich auf jede Transparenz verfolgt (siehe Punkt 8.1) 0,635 cm, die Tiefe des Feldes. Diese Volumes verwenden, um Wurzel Länge Dichte in Behandlung und Kontrolle Patches mit der gesamten Wurzellänge in jedem Patch zu berechnen (siehe Schritt 13.1.3).
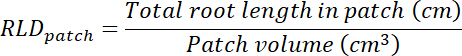
- Berechnen Sie das Volumen des Substrats in jeder Rhizobox durch Multiplikation der Gegend zurückgeführt auf die Transparenz (siehe Punkt 8.1) x 0,635 cm. berechnen RLD für die Behandlung und Kontrolle Patches.
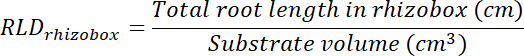
- Berechnen Sie das Volumen der Behandlung und Kontrolle Patches multipliziert Bereich auf jede Transparenz verfolgt (siehe Punkt 8.1) 0,635 cm, die Tiefe des Feldes. Diese Volumes verwenden, um Wurzel Länge Dichte in Behandlung und Kontrolle Patches mit der gesamten Wurzellänge in jedem Patch zu berechnen (siehe Schritt 13.1.3).
- Überprüfen Sie die Wurzel tracing Methode durch den Vergleich der gescannten Wurzelsysteme und Bilder verfolgt.
- Scannen Sie jede Transparenz und berechnen Sie total Wurzellänge, die Verwendung der Software zu. Speichern Sie das gescannte Bild für Wachstum Rate Berechnungen.
- Summe der gesamten Wurzel Längenmessungen der Behandlung, Kontrolle, und bulk-Proben für jede Box (siehe Schritt 13.1.3).
- Die gescannten und vektorisierte Testmessungen der gesamte Wurzellänge zu sehen, ob die Korrelation statistisch signifikant ist.
Hinweis: Wenn ja, die Ablaufverfolgung Methode validiert und relativen Wachstumsraten können zu jeden Zeitpunkt berechnet werden. Ist dies nicht der Fall, nur die gescannten Wurzelsystem Daten liefert eine genaue Angabe des Wurzelwachstums. Dies könnte der Fall sein, wenn die Ablaufverfolgung Methodik unvereinbar war oder Wurzeln zum Beispiel nicht gleichermaßen für alle Genotypen sichtbar waren.
- Wenn die Ablaufverfolgung Methode validiert wurde, berechnen Sie relative Wurzel Wachstumsraten für jedes Rhizobox.
- Wurzel-Analyse-Software kalibriert werden, um zu unterscheiden zwischen den ausgewählten Ablaufverfolgung Farben total Wurzellänge in Behandlung, Kontrolle, Messen und bulk-Proben zu jedem Zeitpunkt zu verwenden. Kumulative Summe Wurzellänge zu jedem Zeitpunkt zu berechnen.
- Relative Wurzel Wachstumsraten (RGRWurzel) für jede Rhizobox als auch für die Behandlung und Kontrolle Patches für jede Zeit Intervall t1-t2 wie folgt zu berechnen.
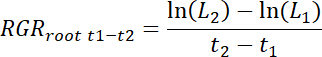
Hinweis: Hier L1 ist total Wurzellänge im Patch (kumulative Summe von 11,3) t1 Tage nach Transplantation (DAT) und L2ist total Wurzellänge in den Patch t2 DAT.
14. die Analyse von 15N Partitionierung unter Root, schießen und Behandlung Bodenproben
- Wurzeln bei 60 ° C trocknen, wiegen Biomasse und Schleifen durch ein 2 mm Sieb passieren.
- Trockenen Teilproben der Behandlung Boden bei 60 ° C.
- Wurzeln und Behandlung in Zinn Kapseln wie bei der Triebe zu verpacken.
Hinweis: Ideal Probengewicht pro Kapsel sollte separat für Triebe, Wurzeln und Boden basierend auf dem geschätzten C/N Verhältnis des Materials zu den Zielbetrag von insgesamt N für die Analyse berechnet werden. Kontaktieren Sie die stabilen Isotop Anlage wo die Proben müssen weitere Informationen eingereicht werden. Für dieses Experiment waren die Anweisungen zur Vorbereitung der Probe und Probe Weight Calculator zur Verfügung gestellt von der UC Davis stabiles Isotop Anlage folgten18.
Achtung: Besondere Vorsicht zu mischen Proben gleichmäßig vor dem Verpacken in Kapseln und bereiten Sie mehrere Kapseln pro Probe. Wenn Proben nicht gleichmäßig gemischt werden, kann scheinbare Erholung von 15N ursprünglich vorhandenen übersteigen. - Insgesamt N, δ15 und 15N Inhalt jedes Shooting, Wurzel und Behandlung Bodenprobe analysieren.
Hinweis: In diesem Experiment wurden Pflanzenproben über Verbrennung mit einem elementaren PDZ Europa ANCA-GSL-Analyzer eine Schnittstelle zu einem PDZ Europa 20-20-Isotop Verhältnis Massenspektrometer an der UC Davis stabiles Isotop Anlage (UCD SIF) analysiert. Bodenproben wurden mit einem Elementar Elementar Vario EL Cube-Analysator eine Schnittstelle zu einem PDZ Europa 20-20 Isotop Verhältnis Massenspektrometer an der UCD SIF analysiert. - Berechnen Sie die Menge schießen 15N aus dem Etikett im Werk gewonnen und Wurzel Proben.
- Berechnen Sie zunächst, den Betrag von 15N über atmosphärische 15N in jedem Pool 15P *:
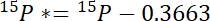
wo 15P 15N Inhalt in Atom-% des Pools von Interesse ist. - Zweitens: Berechnen Sie die Menge von 15N über atmosphärische 15N in der Bezeichnung, 15L *:
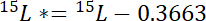
wo ist 15L 15N Inhalt in Atom-% der beschrifteten N Quelle. - Drittens: Berechnen Sie die Menge von insgesamt N in jedem Pool Np:
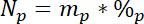
Wo befindet sich die Masse des Pool (z. B. total trocken schießen oder Wurzel Biomasse) und %p mp ist der Prozentsatz von N dieses Pools. - Schließlich verwenden Sie die Ergebnisse der 14.5.1\u201214.5.3 im Ndff Gleichung19 um das erhalten von dem Label, NlN berechnen:
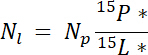
Hinweis: Die Ndff Gleichung wird verwendet, um die Menge an N aus einer beschrifteten Quelle bestimmen, die von Pflanzen gewonnen wird. Es wird davon ausgegangen, dass keine isotopischen Diskriminierung während der N-Aufnahme durch die Pflanze tritt und in der Regel gültig für N Quellen angereicherte ~1\u201210%19 ist.
- Berechnen Sie zunächst, den Betrag von 15N über atmosphärische 15N in jedem Pool 15P *:
Ergebnisse
Wurzeln wuchs bevorzugt gegen die Rückseite der Box, wie erwartet. Insgesamt verfolgt Wurzellänge auf der Rückseite der Box lag zwischen 400 und 1.956 cm, verglichen mit 93-758 cm auf der Vorderseite der Box. Paarweise Pearson Korrelationskoeffizienten zwischen gescannten Wurzellänge und vektorisierte Wurzellänge auf der Vorderseite der Box, Kabelverschraubungen, berechnet wurden und die Summe der Vorder- und Rückseite wurde verwendet, um festzustellen, ob genau nachzeichnen total W...
Diskussion
Die in diesem Protokoll beschriebenen Rhizoboxes kann verwendet werden, für vielfältige Fragen in der Wurzel und Rhizosphäre Wissenschaft, und haben festgestellt, dass diverse anderswo verwendet10,20,21,22,23 , 24 , 25. andere Forscher haben erfasst Zeitraffer Bilder von Rhizoboxes
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Die Autoren möchten anonyme Gutachter für ihr Feedback, sowie j.c. Cahill und Tan Bao für erste Orientierung auf die Entwicklung des Rhizobox-Protokolls zu bestätigen. Finanzierung wurde von der Stiftung für Nahrung und Landwirtschaft Forschung, das US Department of Agriculture (USDA) National Institute of Food and Agriculture, landwirtschaftliche Experiment-Station Projekt CA-D-PLS-2332-H, um A.G. und von der UC Davis Abteilung der Pflanze zur Verfügung gestellt Wissenschaften durch ein Stipendium um j.s.
Materialien
| Name | Company | Catalog Number | Comments |
| 1.27 cm diameter PVC pipe | JM Eagle | 530048 | 305 cm per box, cut into lengths as specified in the protocol |
| PVC side elbows | Lasco | 315498 | 2 per box |
| PVC 90-degree elbows | Charlotte | PVC 02300 0600 | 4 per box |
| PVC T joints | Charlotte | PVC 02402 0600 | 4 per box |
| Extruded acrylic panes | TAP Plastics | N/A | 2 per box, 0.64 cm thick x 40.5 cm wide x 61 cm long |
| HDPE spacers (sides) | TAP Plastics | N/A | 2 per box, 0.64 cm thick x 2.5 cm wide x 57 cm long |
| HDPE spacers (bottom) | TAP Plastics | N/A | 1 per box, 0.64 cm thick x 2.5 cm wide x 40.5 cm long |
| HDPE spacers (patch) | TAP Plastics | N/A | 2 per box, 0.64 cm thick x 3.8 cm wide x 28 cm long |
| Polyester batting | Fairfield | #A-X90 | 2.5 cm x 40.5 cm strip per box |
| 20-thread screws | N/A | N/A | 3.2 cm long, 0.64 cm diameter |
| Washers | N/A | N/A | 0.64 cm internal diameter |
| Hex nuts | N/A | N/A | sized to fit the screws |
| Light deprivation fabric | Americover, Inc. | Bold 8WB26.5 | 1 piece 95 cm wide and 69 cm long per box |
| Sand | Quikrete | No. 1113 | |
| Field soil | N/A | N/A | |
| Transparencies for tracing | FXN | FXNT1319100S | One per side of the box to be traced |
Referenzen
- Hodge, A. Roots: The Acquisition of Water and Nutrients from the Heterogeneous Soil Environment. Progress in Botany 71. , 307-337 (2010).
- Grossman, J. D., Rice, K. J. Evolution of root plasticity responses to variation in soil nutrient distribution and concentration. Evolutionary Applications. 5 (8), 850-857 (2012).
- Zhang, H., Forde, B. G. An Arabidopsis MADS box gene that controls nutrient-induced changes in root architecture. Science. 279 (5349), 407-409 (1998).
- Hodge, A., Stewart, J., Robinson, D., Griffiths, B. S., Fitter, A. H. Competition between roots and soil micro-organisms for nutrients from nitrogen-rich patches of varying complexity. Journal of Ecology. 88 (1), 150-164 (2000).
- Trachsel, S., Kaeppler, S. M., Brown, K. M., Lynch, J. P. Shovelomics: high throughput phenotyping of maize (Zea mays L.) root architecture in the field. Plant and Soil. 341 (1-2), 75-87 (2011).
- Rogers, E. D., Monaenkova, D., Mijar, M., Nori, A., Goldman, D. I., Benfey, P. N. X-ray computed tomography reveals the response of root system architecture to soil texture. Plant Physiology. , (2016).
- Groleau-Renaud, V., Plantureux, S., Guckert, A. Effect of mechanical constraint on nodal and seminal root system of maize plants. Comptes Rendus De L Academie Des Sciences Serie Iii-Sciences De La Vie-Life Sciences. 321 (1), 63-71 (1998).
- Lin, Y., Allen, H. E., Di Toro, D. M. Barley root hair growth and morphology in soil, sand, and water solution media and relationship with nickel toxicity. Environmental Toxicology and Chemistry. 35 (8), 2125-2133 (2016).
- Wenzel, W. W., Wieshammer, G., Fitz, W. J., Puschenreiter, M. Novel rhizobox design to assess rhizosphere characteristics at high spatial resolution. Plant and Soil. 237 (1), 37-45 (2001).
- Spohn, M., Carminati, A., Kuzyakov, Y. Soil zymography - A novel in situ method for mapping distribution of enzyme activity in soil. Soil Biology and Biochemistry. 58, 275-280 (2013).
- Vollsnes, A. V., Futsaether, C. M., Bengough, A. G. Quantifying rhizosphere particle movement around mutant maize roots using time-lapse imaging and particle image velocimetry. European Journal of Soil Science. 61 (6), 926-939 (2010).
- Hewitt, E. J. . Sand and Water Culture Methods Used in the Study of Plant Nutrition. , (1966).
- Choudhary, M. I., Shalaby, A. A., Al-Omran, A. M. Water holding capacity and evaporation of calcareous soils as affected by four synthetic polymers. Communications in Soil Science and Plant Analysis. 26 (13-14), 2205-2215 (1995).
- Bakker, P. A. H. M., Berendsen, R. L., Doornbos, R. F., Wintermans, P. C. A., Pieterse, C. M. J. The rhizosphere revisited: root microbiomics. Frontiers in Plant Science. 4, 2013 (2013).
- McNear, D. H. The Rhizosphere - Roots, Soil, and Everything In Between. Nature Education Knowledge. 4 (3), 1 (2013).
- Ortas, I. Determination of the extent of rhizosphere soil. Communications in Soil Science and Plant Analysis. 28 (19-20), 1767-1776 (1997).
- . Carbon (13C) and Nitrogen (15N) Sample Preparation Available from: https://stableisotopefacility.ucdavis.edu/13cand15nsamplepreparation.html (2018)
- Barraclough, D. 15N isotope dilution techniques to study soil nitrogen transformations and plant uptake. Fertilizer research. 42 (1-3), 185-192 (1995).
- Belter, P. R., Cahill, J. F. Disentangling root system responses to neighbours: identification of novel root behavioural strategies. AoB PLANTS. 7, (2015).
- Nagel, K. A., et al. GROWSCREEN-Rhizo is a novel phenotyping robot enabling simultaneous measurements of root and shoot growth for plants grown in soil-filled rhizotrons. Functional Plant Biology. 39 (11), 891-904 (2012).
- Adu, M. O., Yawson, D. O., Bennett, M. J., Broadley, M. R., Dupuy, L. X., White, P. J. A scanner-based rhizobox system enabling the quantification of root system development and response of Brassica rapa seedlings to external P availability. Plant Root. 11, 16-32 (2017).
- Neumann, G., George, T. S., Plassard, C. Strategies and methods for studying the rhizosphere-the plant science toolbox. Plant and Soil. 321 (1-2), 431-456 (2009).
- Bodner, G., Alsalem, M., Nakhforoosh, A., Arnold, T., Leitner, D. RGB and Spectral Root Imaging for Plant Phenotyping and Physiological Research: Experimental Setup and Imaging Protocols. JoVE (Journal of Visualized Experiments). (126), e56251-e56251 (2017).
- Kuchenbuch, R. O., Ingram, K. T. Image analysis for non-destructive and non-invasive quantification of root growth and soil water content in rhizotrons. Journal of Plant Nutrition and Soil Science. 165 (5), 573-581 (2002).
- Dresbøll, D. B., Thorup-Kristensen, K., McKenzie, B. M., Dupuy, L. X., Bengough, A. G. Timelapse scanning reveals spatial variation in tomato (Solanum lycopersicum L.) root elongation rates during partial waterlogging. Plant and Soil. 369 (1-2), 467-477 (2013).
- Wu, J., et al. RhizoChamber-Monitor: a robotic platform and software enabling characterization of root growth. Plant Methods. 14 (1), 44 (2018).
- Rogers, S. W., Moorman, T. B., Ong, S. K. Fluorescent In Situ Hybridization and Micro-autoradiography Applied to Ecophysiology in Soil. Soil Science Society of America Journal. 71 (2), 620-631 (2007).
- Eickhorst, T., Tippkötter, R. Detection of microorganisms in undisturbed soil by combining fluorescence in situ hybridization (FISH) and micropedological methods. Soil Biology and Biochemistry. 40 (6), 1284-1293 (2008).
- Spohn, M., Kuzyakov, Y. Distribution of microbial- and root-derived phosphatase activities in the rhizosphere depending on P availability and C allocation - Coupling soil zymography with 14C imaging. Soil Biology and Biochemistry. 67, 106-113 (2013).
- Lv, G., Kang, Y., Li, L., Wan, S. Effect of irrigation methods on root development and profile soil water uptake in winter wheat. Irrigation Science. 28 (5), 387-398 (2010).
- Asseng, S., Ritchie, J. T., Smucker, A. J. M., Robertson, M. J. Root growth and water uptake during water deficit and recovering in wheat. Plant and Soil. 201 (2), 265-273 (1998).
- Hernandez-Ramirez, G., et al. Root Responses to Alterations in Macroporosity and Penetrability in a Silt Loam Soil. Soil Science Society of America Journal. 78 (4), 1392-1403 (2014).
- Zhang, Y. L., Wang, Y. S. Soil enzyme activities with greenhouse subsurface irrigation. Pedosphere. 16 (4), 512-518 (2006).
- Robinson, D., Hodge, A., Griffiths, B. S., Fitter, A. H. Plant root proliferation in nitrogen-rich patches confers competitive advantage. Proceedings of the Royal Society of London B: Biological Sciences. 266 (1418), 431-435 (1999).
- Lobet, G., Draye, X. Novel scanning procedure enabling the vectorization of entire rhizotron-grown root systems. Plant Methods. 9, 1 (2013).
- Swarup, R., Wells, D. M., Bennett, M. J. Root Gravitropism. Plant Roots: The Hidden Half. , (2013).
- Smit, A. L., Bengough, A. G., Engels, C., van Noordwijk, M., Pellerin, S., van de Geijn, S. C. . Root Methods: A Handbook. , (2000).
- van Dusschoten, D., et al. Quantitative 3D Analysis of Plant Roots Growing in Soil Using Magnetic Resonance Imaging1[OPEN]. Plant Physiology. 170 (3), 1176-1188 (2016).
- Metzner, R., et al. Direct comparison of MRI and X-ray CT technologies for 3D imaging of root systems in soil: potential and challenges for root trait quantification. Plant Methods. 11, 17 (2015).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten