このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
根の生長およびローカライズされた栄養素に対する反応性を可視化する最適化された Rhizobox プロトコル
要約
可視化とルート成長の in situ測定は非常に困難です。根の発育と栄養への応答に時間をかけて増殖を追跡するカスタマイズ可能な rhizobox 法を提案します。このメソッドを使用して、ルート可塑性有機窒素源への応答でのトウモロコシの品種間差異を分析します。
要約
根が研究し悪名高くにくいです。土壌は両方視覚的・機械的障壁、困難を追跡するルーツをその場で破壊的な収穫や高価な機器なし。時間をかけて根の成長の非破壊的な描出が可能で、ローカライズされたリソースのパッチに対してルート可塑性の勉強に特に適しているカスタマイズ可能な手頃な価格の rhizobox 法を提案します。メソッドは、塑性応答に15N 標識マメ科植物残渣を含むパッチのトウモロコシの品種間差異を評価することによって検証されました。メソッドは、時間の経過とともに代表的な発育測定を取得、リソースを含む、コントロールのパッチで根長密度を測定、ルート成長率を計算する、植物の根およびシュートで15N 回復を決定するように記載されています。利点、注意点、およびメソッドの潜在的な将来のアプリケーション、また説明します。実験条件は、ルート成長データないバイアスを行うように注意する必要が、rhizobox プロトコルをここに提示することで、場合は十分な注意を払って実施の信頼性の高い結果が得られます。
概要
しばしば見過ごされているが地上相手に比べると、根植物栄養素獲得の重要な役割を果たします。ルート建設と保守の実質的な炭素コストを考えると、植物は根だけで投資価値がある採餌を開発するメカニズムを展開させた。ルート システム従って効率的かつ動的に採掘できますリソース パッチ摂取量及びさらなる輸送1師部を急速に通過栄養素の骨折率、ホット スポットの増殖によって。塑性応答は、植物の種や遺伝子型2,3と栄養関係4、5の化学形態によって広く変えることが。ルート可塑性の変化はさらに、複雑なルート異種土壌資源レスポンス通知繁殖および農業の栄養素利用効率を高める経営戦略の理解検討必要があります。
にもかかわらず、その必要性と植物システムの解明のための関連性、可視化と関連する縮尺ルート可塑性を定量化は様々 な技術的課題です。一般的な方法は、("shovelomics"6) 土壌から根クラウンを発掘、細根が土壌団粒の間に小さな孔を悪用する発掘必然的につながるこれらの壊れやすい根の損失のいくつかの程度に。また、破壊的な収穫の場合、時間をかけて 1 つのルート システムの変更を追跡することは不可能になります。その場x 線トモグラフィーなどのイメージング方法高空間分解能7根と土壌資源の直接可視化を許可するが、高く、特殊な装置を必要とします。水耕栽培実験は、土壌から根の抽出に関連付けられている制約を避けるため、機械的な制約と土8,9の生物物理学的複雑さと比較して水溶液中における根の形態と建築とは異なります。最後に、根の生理作用と機能は、これらの人工メディアの発育的可塑性に統合できません。
建設時間をかけて土壌で根の成長を特徴付けるための低コストでカスタマイズ可能な方法として rhizoboxes (狭い、クリア両面長方形容器) の使用のためのプロトコルを提案します。特別に設計されたフレームは、重力屈性、ルートの長さの測定の精度を高めるため背面パネルに対して優先的に成長する根をお勧めします。Rhizoboxes は根の生長と根圏相互作用10、11,12、研究に使われているが、ここで紹介した方法では、単一コンパートメント デザインと安価なシンプルさの利点材料、ルート レスポンス ローカライズされた栄養素を勉強する設計されています。ただし、メソッドは、適応イントラ/種間競争などの他のルート、根プロセスの範囲、化学物質、微生物、酵素活性の分布を研究する可能性があります。ここでは、 15N 標識マメ残渣とハイライト代表結果 rhizobox メソッドを検証するためのパッチに応答トウモロコシ品種間で品種間差を調べた。
Access restricted. Please log in or start a trial to view this content.
プロトコル
1. フロントと背面パネルとスペーサーの準備
- 前面と背面パネルを準備します。
- 40.5 cm 幅 61 cm 明確な 0.635 cm 厚いアクリルのカット 2 枚 1 箱かまたはカット済み作品 (材料の表を参照) を購入します。
- アクリル用ドリル刃を使用すると、ドリル穴直径 1.3 cm で上から 53.3 cm、38、19 2.5 側縁から 0.635 cm。2.5、20.3、左側にある (図 1) から 38 cm、下端から 1.3 cm の穴をドリルします。
注: それは、一度に 6 〜 10 枚スタックのドリル出版物を使用する最も効率的な手ドリルを使用もできます。 - アクリルから保護カバーを外し、そっと箱を組み立てる前に両方のパネルをきれい。
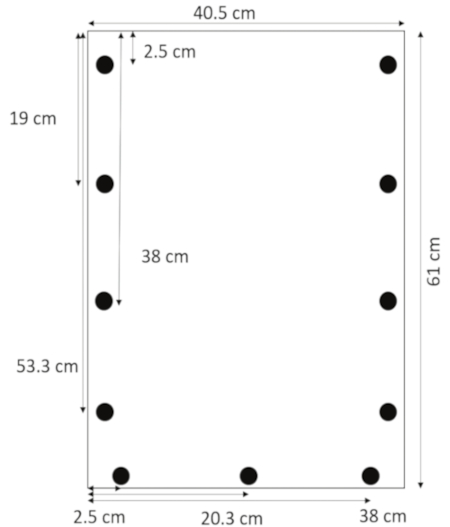
図 1: 穴のレイアウト。穴は上から 53.3 cm と 2.5、20.3、左余白から 38 cm、下端から 1.3 cm 2.5, 19, 38, 側端からドリル 1.3 cm。この図の拡大版を表示するのにはここをクリックしてください。
- 横や下のスペーサーを準備します。
- 3 高密度ポリエチレン (HDPE) から箱当たりスペーサーや購入 2 つカット済み側スペーサー (0.635 cm 厚、幅 2.5 cm、長さ 57 cm)、1 つのカット済み下スペーサー (0.635 cm 厚、幅 2.5 cm、長さ 40.5 cm) をカットします。材料の表を参照してください。
- 前面および背面パネルの側面とボックスの下部の間のスペーサーの位置を合わせます。ドリルまたはドリル出版物を使用する前に既存の穴をドリルし、穴がきれいにすべての 3 つの層を通過して再び。
- クランプを使用してレイヤーを配置またはインストールすることによって、ボルト、ナット、ワッシャー各などの組み合わせが新しく穴をあけ (ステップ 3.1 を参照してください)。
2. ポリエステル バッティング ボックスの下部のストリップのインストール
注: このスペーサー間の関節を介して漏れから土壌と水をできなくなります。
- ポリエステルに 2.5 cm 幅でバッティングをカット 40.5 cm 長いストリップ (材料の表を参照してください)。
- フラットとそれの上にスペーサーを横になっている背面パネル、下部のスペーサーの上に直接打撃を置くし、上部パネル (図 2) のある場所でそれを保持します。
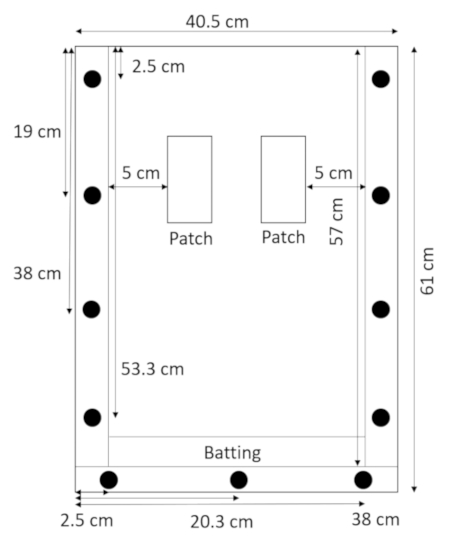
図 2: バッティングと rhizobox を組み立ています。Rhizobox の下部にバッティングの狭いストリップから漏れて、土や砂を防ぐことができます。この図の拡大版を表示するのにはここをクリックしてください。
3、Rhizoboxes のアセンブリ
- 20 スレッドのネジ (0.635 cm 直径 3.2 cm)、洗濯機 (0.635 cm 内径) 六角ナット (ネジに合わせて、材料表を参照してくださいサイズを使用して rhizoboxes を組み立てます。
- 洗濯機、フロント パネル、スペーサー、背面パネル、洗濯機,、六角ナットをネジを締めます。ネジは非常にタイトなことを確認します。ボックスが緩く組み立てられている場合に、土壌はパネルと側スペーサーの間の隙間からこぼれます。
注意: アクリルは傷つきやすいと傷できる根の測定と干渉するので注意して組み立てられたボックスを処理します。保護材がそれらの間に置かれていない限り、スタッキング ボックスを避けてください。 - ボックスあたり 2 つのパッチ スペーサー (スペーサー治療とコントロールのパッチを作成するために使用されます) を準備します。スペーサー高密度ポリエチレンから (HDPE) シートをカットまたはそれらにプレカット (0.635 cm 厚、幅 3.8 cm、長さ 28 cm; 参照テーブルの材料) を購入します。1 つ 0.635 cm 各のスペーサーは、(図 3) の中間の線に沿って、上から 2 cm の直径の穴をドリルします。
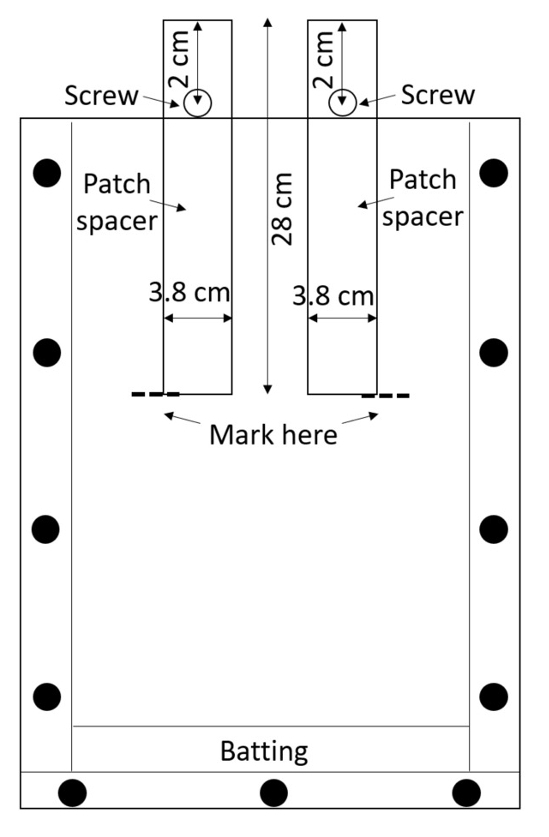
図 3: スペーサーをパッチします。HDPE センター ストリップを介して挿入されたネジは、ボックスに落ちてからそれらを保ちます。スペーサーの周りの土壌で、rhizobox がいっぱいです、土は接液、スペーサーが空の治療とコントロールのパッチを残すために削除されます。この図の拡大版を表示するのにはここをクリックしてください。
- スペーサー部分的に挿入できる、rhizobox ネジができなくなるまで、それぞれの穴にナットをネジ (図 3) をさらに。
注: スペーサー周辺土を湿ったとスペーサーを削除、2 つの空スペースが残ります、窒素を含む治療パッチと制御パッチの適切な基板を入力できます。
4. 建物 PVC フレーム角度で Rhizoboxes をサポートするには
注: 角度でボックスを配置すると、重力屈性はすべてのルートがトレースに表示されるように背面パネルに対して成長する根を奨励します。塩化ビニル (PVC) の寸法で rhizobox を保持するフレームの図 4の結果で、ベンチに約 55 ° の角度。
- 1.3 cm 径 PVC ボックスあたりの 13 枚をカット: 2 × 44 cm 長さ、3 × 42 cm 長さ、2 × 36.3 cm 長さ、2 × 25.4 cm 長さ、4 × 3.8 cm 長さ (材料の表を参照してください)。
注: チョップの鋸が効率ともカットのため勧めします。 - 図 4に示すように、ボックスを組み立てる 4 × 2 ウェイ肘・ 2 × 3 ウェイ肘・ 4 T 継手 (材料の表を参照) を使用します。
注: フレーム、その他接着剤なし安定する必要がありますが、塩ビ接着剤は、必要に応じて使用することができます。
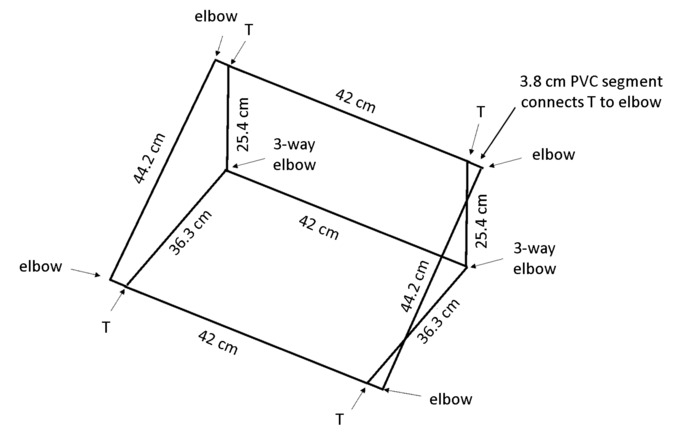
図 4: rhizoboxes をサポートするフレーム。軽量フレームは、指定した長さにカットし、示された共同の種類を使用して接続は塩ビから構成されます。この図の拡大版を表示するのにはここをクリックしてください。
5. 光と熱を反映するため保護ケースの縫製
注: 根を避けるため光、これらのケースを確認するために光を除外するのでパッチで栄養源とない光の回避によって駆動されるルート塑性応答を観察しました。光剥奪ファブリックは、熱ストレスを避けるために支援、rhizoboxes 内の温度も低減します。
- 作品約 95 cm と 69 cm に光剥奪生地 (片面白と他の黒は、特殊な素材) をカット (材料の表を参照してください)。ボックス 1 個が必要です。
- 各部分に 47.5 cm × 69 cm 袖を形成する長辺に沿って半分に折り。デニム用ミシン針を使用して、頑丈なキルティング スレッドと狭い縫い目に沿って上下各スリーブの側を上の方法の 3/4 を縫います。一緒に安全ピン上部の角を固定します。
6. 1:1 (V/V) 土壌の準備: 砂、Rhizoboxes に合わせて基板
- 約 1,000 cm3箱当たり (興味のサイト) から土壌を収集します。60 ° C で浅いトレイに一定の重量に土壌を乾燥させる
注: この実験のための土は 0\u201210 cm の深さから、有機管理トウモロコシ畑で収穫の直後を収集しました。 - 乳鉢と乳棒 2 mm ふるいを通過する土を挽きます。知られている土壌量を秤量することにより、土壌の密度を測定します。
- (再生砂は、ハードウェアのストアから、安価で購入することができます;材料の表を参照してください) などの砂を入手し、嵩密度を測定します。
- 等しいボリューム砂やバケツの中に土を測定し、徹底的に混ぜます。ボックスを埋めるためゆっくりと均等に 2.5 cm 上から解決するのに基板をさせるボックスを見失わず目標到達プロセスを使用します。基板のこの量を測定します。それは約 1,272 cm3をする必要があります。
- 砂の密度を各ボックスに必要な砂の質量を取得するこのボリュームが半分に掛けます。各ボックスに必要な土壌の質量を取得する土の密度と同じことを行います。
注: 土壌とこの実験で使用される砂は、これは砂と土の 774 g 976 g が、これらの金額は、使用する土の密度によって異なります。 - Rhizobox あたりの大きなジップトップ ビニール袋 1 つのラベル、袋に砂や土の適切な固まりの重さし、徹底的にホモジナイズしてください。
- この 1:1 土壌分析- と栄養成分と15N の自然な豊かさは、(δ15N) 用基板。
7. 基板治療とコントロールのパッチのための準備
- Rhizobox、治療パッチと制御パッチごとの小さなジップトップ ビニール袋 2 つのラベルを付けます。土の 30 グラムの重量を量る: 対応する 2 つの小さな袋にそれぞれ大きな袋 (ステップ 6.6) から基板を砂します。
- 治療パッチの15N 標識窒素源と基板をミックスします。15N 標識植物残渣または他の N ソースの 1 g を量り、(量を調整することができますに応じて) 各治療バッグ (小さいジップトップ バッグ) にし、よく混ぜます。
注: この実験の15N 標識クローバーとレンゲ残渣の混合物が使用されました。クローバーとレンゲの種子は砂、バーミキュ ライトの 1:1 混合植えされ、温室条件下で栽培します。植物は、脱イオン水で毎日骨抜きにされ、 15N 標識窒素源を含む長いアシュトン ソリューション13の 1/100 強度で週 2 回だった。すべての地上部現存量は、乾燥と 2 mm ふるいを通過するグランド植栽後 4 週間で収穫されました。異なる栄養を選択した場合その要素が土中では、モバイルの場合特にの溶出をテストするためのパイロット実験奨励されます。栄養素の遅いリリース フォームを使用できるまたは溶出 (例えば、別々 のコンパートメント10) 必要な場合を制限する別の rhizobox デザインが選ばれるか。
8 パッチ基板の処理と制御の確立と Rhizobox の読み込み
- 各空 rhizobox の重量を量るし、後で使用できる重量を記録します。
- ネジはさらに行くからそれらを防止するまで 1 つの rhizobox に 2 つパッチ スペーサー (3.2 を参照) を挿入します。Rhizobox (図 3) の側に光のマークと下部の縁の深さをマークし、スペーサーを削除します。
- 漏斗の使用としては、幹の開口部は rhizobox オープニングとして絞り込む、マークの深さに基板の対応する大きな袋から rhizobox を記入します。目標到達プロセスを移動、前後にゆっくりと均等になるよう基板に均一に表示され優遇流路は作成されません。
- 基板レベル マークの深さに達すると、ボックスの両側から 5 cm にスペーサーを置きます。基板レベルが (残りの袋に基板があるはず) ボックスの上から約 5 cm になるまでボックスの入力を続行します。
- 各スペーサーの周りに徹底的に濡れています。
注: この実験では、これは各スペーサーの外側の縁と、rhizobox の側と水の 2 つのスペーサーの間に均等に注ぐ 50 mL の間挿入点滴エミッターを水 50 mL を提供することによって達成されました。遅い灌漑は、均一な濡れを必要です。 - 土が濡れている、パッチの空の空洞を残して間スペーサーを削除します。
- 各 rhizobox の外側に透明フィルムをテープ (材料の表を参照してください)。治療としての 1 つの側面、1 つのコントロールとしてマークし、目標到達プロセスを使用して適切なバッグからパッチを入力します。永久的なマーカーを使用して、透過の各パッチの境界をトレースします。
- 残りの基板で、rhizobox を均等に満たしなさい。透明性に基板の上をトレースします。
- 残りの rhizoboxes を繰り返します。収穫のためのすべての袋を保存します。
9. も保水容量の 60% に散水
注: この土壌水分量は植物が無酸素状態や藻類の成長の開発を防ぎながら乾燥ストレスを経験していることを防ぐために見つかりました。
- 基板14の保水容量 (保水容量) の単位します。
- 各ボックスの理想体重を計算します。ここで保水容量の 60% で基板の重量と組み合わせて空 rhizobox の重量の合計として定義されています。
- 水を掛ける (水のグラム/乾燥基質のグラム) 水の質量を取得する 0.6 60% で基板で開催保水力。乾燥基質の量と15N ソースの量にこの固まりを追加します。
- 上記で入手した数に各ボックスの空重量を追加します。
- 一度彼らが入力されているボックスの重量を量る。9.2 のステップで計算の理想的な重量 (g) からこの時点で (g) で、各ボックスの重さを引きます。この量 (mL) の水は、ゆっくりと均等に解除 (DI) 水をイオン化。
メモ: この手順を実行する可能性があります点滴灌漑を使用してまたは手で水まき。手で水をまく、異種土壌水分条件と優遇の流路を避けるために多くを追加する前に完全に浸透する水を許可します。
10 種子の発芽と移植
- 裸地のコントロールを使用する場合これらの rhizoboxes 置いておきます。
- 表面-滅菌トウモロコシ種子 5 %naocl、1 分後・ ディ ・水で徹底的にリンスを攪拌します。
注: この実験では、六つの異なるトウモロコシ品種の種子がルート可塑性における品種間差異を調査するために使用されました。 - ウェット研究所組織 (例えばキムワイプ) ペトリ皿の中にそれらを配置することおよび別の湿った組織でカバーによって滅菌の種を発芽させます。ある任意の立って水をしないでください。48\u201272 h 幼根だけに出現し始めるまでの暗い場所で場所ペトリ皿。
- 狭いヘラを使用すると、各 rhizobox の中心に 2.5 cm の深さまで穴を掘る。幼根が直接指向であることを確認、穴に発芽種子を移植下。
注: 場合は幼根はどちらかのパッチに向かって傾斜され、ルート成長率の比較はバイアスされます。 - 透明度のシードの位置をトレースします。
- 種子と純水の最大 50 mL で水をカバーしてください。
11. 植物の成長
- 25 日 (または必要な限り)、植物を育てる、60% を維持する成長期間中の保水力。ルーツをたどることによって根の成長を監視します。
- すべての 3\u20124 日と水の理想的な体重の 5 g 以内になるまで各ボックスの重量を量る。散水、rhizoboxes パネルの分離を容易にするために収穫前に 4 日間を停止します。雑草を手で削除する頻繁興味の植物の根のみが存在するので。
- 各トレース日明確に区別できる色で永久的なマーカーを使用 3\u20124 日ごと表示のルーツをたどる。
注: 必要な場合、径の異なるマーカーはプライマリと外側の根のため使用できます。主観の度合いが関与している、特に場合は、複数の研究者がトレース ルートになりますので、または別のマーカーと区別する別の注文または直径の根が最初にルートをトレースするための条件を定義することができます。この実験では、両側に表示のルーツをたどることによってテストされたボックスの片側のみ表示のルーツをトレースの精度と洗浄し、根をスキャンによって測定した総根長にスキャンした透明フィルムで測定した総根長を比較します。トレース、スキャンした根の長さとの相関関係は背中透明のみまたは両方の透明フィルムが使用されたかどうかに関係なく有意であった。ちょうど背面パネルの表示のルーツをたどることはそのためです。
12 収穫シュートと解析の根や土壌のサンプルの取得
- 最初の rhizobox を置くフラット、すべてのネジを外します。
- 撮影サンプルを収穫します。クリップの撮影基地で、DI 水で任意の土壌を洗い流すし、60 ° C で乾燥乳鉢と乳棒 2 mm ふるいを通過し、同位体分析 (セクション 14 参照) 錫カプセル サブサンプルの重量を量ると挽くの撮影します。
- かみそりで治療とコントロールのパッチの周りカット ガイドとして透明度を使用する。それぞれの治療やコントロール バッグに根と付着根圏土壌をすくうスプーンやヘラを使用します。
注: 別の根圏土壌に存在する多くの方法、植物の影響の下で土根15、厳密に線引きゾーン16ではなく、グラデーション、根圏を考えることができる、このメソッド次広く使用されています。17の揺れの後の植物の根に付着した土の定義。 - 3 番目の袋に残りの根と土壌をスクープします。
- 治療、コントロールを渡すし、基板を任意の目に見える根またはフラグメントから根を分離する 2 mm ふるいのサンプルを一括 > 高級ピンセットで長さ 1 cm。これらのサンプルは、3 つの根の合計の 1 つの別から別と 3 つの基板サンプルを保ちます。
13. トレースおよびルートの相対成長率の推定の検証
- 治療、コントロールをスキャンし、サンプルを一括し、ルートの長さを計算します。
- 一度に 1 つのサンプルを操作する任意の残りの基板を削除する DI 水で慎重に根をすすいでください。根が重ならないように明確なトレイにサンプルを配置します。
- ルート解析ソフトウェア (例えばWinRhizo) と互換性のあるスキャナーを使用してサンプルをスキャンします。ソフトウェアはイメージの背景から根を確実に区別するために校正されたことを確認します。
- 総根長と関心 (例: < 0.2 ミリメートル、0.2\u20120.4 ミリメートル、0.4\u20120.8 ミリメートル、0.8\u20121.6 ミリメートル、> 1.6 mm) の直径のクラスの根長を測定するのにソフトウェアを使用します。
- 根長密度 (RLD) 治療とコントロールのパッチの各 rhizobox 全体を計算します。
- 各透明フィルム上でトレース エリアを乗じて治療とコントロールの更新プログラムのボリュームを計算 (手順 8.1 参照) 0.635 cm のボックスの深度。それらのボリュームを使用して、各パッチの総根長を用いた治療とコントロールのパッチで根長密度を計算する (手順 13.1.3 参照)。
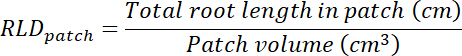
- 透明度のトレース領域を乗じて各 rhizobox の基板のボリュームを計算 (手順 8.1 参照) によって 0.635 cm。 計算 RLD 治療と制御パッチに関しては。
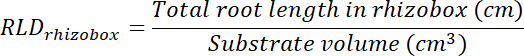
- 各透明フィルム上でトレース エリアを乗じて治療とコントロールの更新プログラムのボリュームを計算 (手順 8.1 参照) 0.635 cm のボックスの深度。それらのボリュームを使用して、各パッチの総根長を用いた治療とコントロールのパッチで根長密度を計算する (手順 13.1.3 参照)。
- スキャンした根系を比較することによりトレーシング法と画像をトレース ルートを検証します。
- 各透明フィルムをスキャンし、ソフトウェアを使用して総根長を計算します。率の計算の成長のためのスキャンした画像を保存します。
- コントロール、治療の総根長測定を合計し、各ボックスのサンプルを一括 (手順 13.1.3 参照)。
- 相関が統計的に有意かどうかを確認する総根長のスキャン、トレースを測定します。
注: 場合は、トレース メソッドを検証すると相対成長率は各時点で計算できます。されていない場合は、ルート システムをスキャン データのみが根の生育の正確な指標を提供します。これはトレース方法論は一貫していた場合、または根にたとえばすべて遺伝子型同様に認識されなかった場合かもしれない。
- トレース メソッドが検証された場合は、各 rhizobox のルートの相対成長率を計算します。
- ルート解析ソフトウェア コントロール、治療の総根長を測定し、各時点でサンプルの一括選択したトレース色を区別するために校正を使用します。各時点での累積総根長を計算します。
- 各 rhizobox は、治療および各時間間隔 t の1t2制御パッチに関しては同様のルートの相対成長率 (RGRルート) を次のように計算します。
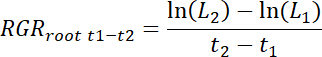
注: ここでL1は総根長パッチ (11.3 から累積的な合計) t1日 (DAT) を移植後、 L2t2ダットでパッチの総根長
14. 15N 分配ルート、撮影と治療の土壌試料の分析
- 60 ° C で乾燥した根は、バイオマスの重量を量るし、2 mm ふるいを通過する挽きます。
- 60 ° C で処理土壌のサブサンプルを乾燥します。
- シュートと根と錫のカプセルに治療をパッケージ化します。
注: カプセルあたり理想的なサンプルの重量は、芽、根、土壌分析の合計 N の目標額を達成するために材料の推定の C/N 比に基づくに別々 に計算する必要があります。サンプル詳細については堤出される、安定同位体の施設にお問い合わせください。この実験では、サンプル準備の手順と UC デービス安定同位体施設によって提供されるサンプル重量計算機続いて18でした。
注意: ミックス カプセルに包む前に均等にサンプル、サンプルごとの複数のカプセルを準備して特別な注意してください。サンプルが均一に混合されていないもの、 15N の明白な回復はもともと現在の金額を超えることができます。 - 合計 N、δ15、および各撮影、根、および治療の土壌サンプルの15N 内容を分析します。
注: この実験で植物のサンプルを行った燃焼を介して UC デイビス安定同位体施設 (UCD SIF) PDZ ヨーロッパ 20 20 同位体比質量分析インターフェース PDZ ヨーロッパ ANCA GSL 元素分析装置でPDZ ヨーロッパ 20 20 同位体比質量分析計で UCD SIF にインターフェース Elementar Vario EL キューブ元素分析装置の土壌サンプルを行った。 - 量を計算15工場でラベルから得られた N の撮影し、根のサンプル。
- まず、 15N を超える大気15N 15P *は、各プール内の量を計算します。
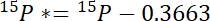
15Pは、関心のプールの原子15N コンテンツです。 - 第二に、大気15N のラベルの15L *を超える15N の量を計算します。
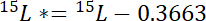
15Lは、ラベル付きの N 元の原子15N コンテンツです。 - 第三に、プールごとに、 Npで合計 N の量を計算します。
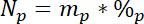
mpがある場合 (例えば、合計乾燥シュートや根バイオマス) プールとpの質量は、そのプールの N の割合です。 - 最後に、Ndff 方程式19の 14.5.1\u201214.5.3 の結果を使用して、ラベル、 Nlから得られた N の量を計算します。
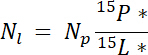
メモ: Ndff 式は、植物により回収されラベル付けされたソースから N の量を決定する使用されます。同位体の差別はないが植物によって N の取り込み中に発生する、N ソース濃縮 ~1\u201210%19一般に有効を前提としています。
- まず、 15N を超える大気15N 15P *は、各プール内の量を計算します。
Access restricted. Please log in or start a trial to view this content.
結果
根は、予想通り、ボックスの背面に対して優先的に育った。合計 〜 400、ボックスの前面に 93 758 cm と比べて、1,956 cm ボックスの背面根長をトレースします。スキャンした根長と、ボックスの背面のボックスの前面にトレースされた根長と一対ピアソンの相関係数を求めたし、フロントとバックの合計が正確にトレースすると、総根長が反映されているかを決定に使用...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
根と根圏科学の様々 な質問にお答えし、多様な使用場所10,20,21,22,23を発見したこのプロトコルで記述されている rhizoboxes を使用できます。,24,25. 他の研究者は、rhizoboxes21,25
Access restricted. Please log in or start a trial to view this content.
開示事項
著者が明らかに何もありません。
謝辞
著者は、j. c. ケーヒルと同様、彼らのフィードバック、匿名で審査とタン Bao rhizobox プロトコルの開発の初期指導のためたいと思います。食品と農業研究、食と農、農業試験場のプロジェクト カリフォルニア州-D-PLS-2332-H に a. g. の米国部門の農務省 (USDA) の国立研究所の基礎、UC デイビス科植物に提供された資金J. s. に親睦を通じて科学
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| 1.27 cm diameter PVC pipe | JM Eagle | 530048 | 305 cm per box, cut into lengths as specified in the protocol |
| PVC side elbows | Lasco | 315498 | 2 per box |
| PVC 90-degree elbows | Charlotte | PVC 02300 0600 | 4 per box |
| PVC T joints | Charlotte | PVC 02402 0600 | 4 per box |
| Extruded acrylic panes | TAP Plastics | N/A | 2 per box, 0.64 cm thick x 40.5 cm wide x 61 cm long |
| HDPE spacers (sides) | TAP Plastics | N/A | 2 per box, 0.64 cm thick x 2.5 cm wide x 57 cm long |
| HDPE spacers (bottom) | TAP Plastics | N/A | 1 per box, 0.64 cm thick x 2.5 cm wide x 40.5 cm long |
| HDPE spacers (patch) | TAP Plastics | N/A | 2 per box, 0.64 cm thick x 3.8 cm wide x 28 cm long |
| Polyester batting | Fairfield | #A-X90 | 2.5 cm x 40.5 cm strip per box |
| 20-thread screws | N/A | N/A | 3.2 cm long, 0.64 cm diameter |
| Washers | N/A | N/A | 0.64 cm internal diameter |
| Hex nuts | N/A | N/A | sized to fit the screws |
| Light deprivation fabric | Americover, Inc. | Bold 8WB26.5 | 1 piece 95 cm wide and 69 cm long per box |
| Sand | Quikrete | No. 1113 | |
| Field soil | N/A | N/A | |
| Transparencies for tracing | FXN | FXNT1319100S | One per side of the box to be traced |
参考文献
- Hodge, A. Roots: The Acquisition of Water and Nutrients from the Heterogeneous Soil Environment. Progress in Botany 71. , 307-337 (2010).
- Grossman, J. D., Rice, K. J. Evolution of root plasticity responses to variation in soil nutrient distribution and concentration. Evolutionary Applications. 5 (8), 850-857 (2012).
- Melino, V. J., Fiene, G., Enju, A., Cai, J., Buchner, P., Heuer, S. Genetic diversity for root plasticity and nitrogen uptake in wheat seedlings. Functional plant biology. , Available from: http://agris.fao.org/agris-search/search.do?recordID=US201600101375 (2015).
- Zhang, H., Forde, B. G. An Arabidopsis MADS box gene that controls nutrient-induced changes in root architecture. Science. 279 (5349), 407-409 (1998).
- Hodge, A., Stewart, J., Robinson, D., Griffiths, B. S., Fitter, A. H. Competition between roots and soil micro-organisms for nutrients from nitrogen-rich patches of varying complexity. Journal of Ecology. 88 (1), 150-164 (2000).
- Trachsel, S., Kaeppler, S. M., Brown, K. M., Lynch, J. P. Shovelomics: high throughput phenotyping of maize (Zea mays L.) root architecture in the field. Plant and Soil. 341 (1-2), 75-87 (2011).
- Rogers, E. D., Monaenkova, D., Mijar, M., Nori, A., Goldman, D. I., Benfey, P. N. X-ray computed tomography reveals the response of root system architecture to soil texture. Plant Physiology. , (2016).
- Groleau-Renaud, V., Plantureux, S., Guckert, A. Effect of mechanical constraint on nodal and seminal root system of maize plants. Comptes Rendus De L Academie Des Sciences Serie Iii-Sciences De La Vie-Life Sciences. 321 (1), 63-71 (1998).
- Lin, Y., Allen, H. E., Di Toro, D. M. Barley root hair growth and morphology in soil, sand, and water solution media and relationship with nickel toxicity. Environmental Toxicology and Chemistry. 35 (8), 2125-2133 (2016).
- Wenzel, W. W., Wieshammer, G., Fitz, W. J., Puschenreiter, M. Novel rhizobox design to assess rhizosphere characteristics at high spatial resolution. Plant and Soil. 237 (1), 37-45 (2001).
- Spohn, M., Carminati, A., Kuzyakov, Y. Soil zymography - A novel in situ method for mapping distribution of enzyme activity in soil. Soil Biology and Biochemistry. 58, 275-280 (2013).
- Vollsnes, A. V., Futsaether, C. M., Bengough, A. G. Quantifying rhizosphere particle movement around mutant maize roots using time-lapse imaging and particle image velocimetry. European Journal of Soil Science. 61 (6), 926-939 (2010).
- Hewitt, E. J. Sand and Water Culture Methods Used in the Study of Plant Nutrition. , Commonwealth Bureau. London. (1966).
- Choudhary, M. I., Shalaby, A. A., Al-Omran, A. M. Water holding capacity and evaporation of calcareous soils as affected by four synthetic polymers. Communications in Soil Science and Plant Analysis. 26 (13-14), 2205-2215 (1995).
- Bakker, P. A. H. M., Berendsen, R. L., Doornbos, R. F., Wintermans, P. C. A., Pieterse, C. M. J. The rhizosphere revisited: root microbiomics. Frontiers in Plant Science. 4, 2013(2013).
- McNear, D. H. Jr The Rhizosphere - Roots, Soil, and Everything In Between. Nature Education Knowledge. 4 (3), 1(2013).
- Ortas, I. Determination of the extent of rhizosphere soil. Communications in Soil Science and Plant Analysis. 28 (19-20), 1767-1776 (1997).
- UC Davis Stable Isotope Facility. Carbon (13C) and Nitrogen (15N) Sample Preparation. , Available from: https://stableisotopefacility.ucdavis.edu/13cand15nsamplepreparation.html (2018).
- Barraclough, D. 15N isotope dilution techniques to study soil nitrogen transformations and plant uptake. Fertilizer research. 42 (1-3), 185-192 (1995).
- Belter, P. R., Cahill, J. F. Disentangling root system responses to neighbours: identification of novel root behavioural strategies. AoB PLANTS. 7, (2015).
- Nagel, K. A., et al. GROWSCREEN-Rhizo is a novel phenotyping robot enabling simultaneous measurements of root and shoot growth for plants grown in soil-filled rhizotrons. Functional Plant Biology. 39 (11), 891-904 (2012).
- Adu, M. O., Yawson, D. O., Bennett, M. J., Broadley, M. R., Dupuy, L. X., White, P. J. A scanner-based rhizobox system enabling the quantification of root system development and response of Brassica rapa seedlings to external P availability. Plant Root. 11, 16-32 (2017).
- Neumann, G., George, T. S., Plassard, C. Strategies and methods for studying the rhizosphere-the plant science toolbox. Plant and Soil. 321 (1-2), 431-456 (2009).
- Bodner, G., Alsalem, M., Nakhforoosh, A., Arnold, T., Leitner, D. RGB and Spectral Root Imaging for Plant Phenotyping and Physiological Research: Experimental Setup and Imaging Protocols. JoVE (Journal of Visualized Experiments). (126), e56251-e56251 (2017).
- Kuchenbuch, R. O., Ingram, K. T. Image analysis for non-destructive and non-invasive quantification of root growth and soil water content in rhizotrons. Journal of Plant Nutrition and Soil Science. 165 (5), 573-581 (2002).
- Dresbøll, D. B., Thorup-Kristensen, K., McKenzie, B. M., Dupuy, L. X., Bengough, A. G. Timelapse scanning reveals spatial variation in tomato (Solanum lycopersicum L.) root elongation rates during partial waterlogging. Plant and Soil. 369 (1-2), 467-477 (2013).
- Wu, J., et al. RhizoChamber-Monitor: a robotic platform and software enabling characterization of root growth. Plant Methods. 14 (1), 44(2018).
- Rogers, S. W., Moorman, T. B., Ong, S. K. Fluorescent In Situ Hybridization and Micro-autoradiography Applied to Ecophysiology in Soil. Soil Science Society of America Journal. 71 (2), 620-631 (2007).
- Eickhorst, T., Tippkötter, R. Detection of microorganisms in undisturbed soil by combining fluorescence in situ hybridization (FISH) and micropedological methods. Soil Biology and Biochemistry. 40 (6), 1284-1293 (2008).
- Spohn, M., Kuzyakov, Y. Distribution of microbial- and root-derived phosphatase activities in the rhizosphere depending on P availability and C allocation - Coupling soil zymography with 14C imaging. Soil Biology and Biochemistry. 67, 106-113 (2013).
- Lv, G., Kang, Y., Li, L., Wan, S. Effect of irrigation methods on root development and profile soil water uptake in winter wheat. Irrigation Science. 28 (5), 387-398 (2010).
- Asseng, S., Ritchie, J. T., Smucker, A. J. M., Robertson, M. J. Root growth and water uptake during water deficit and recovering in wheat. Plant and Soil. 201 (2), 265-273 (1998).
- Hernandez-Ramirez, G., et al. Root Responses to Alterations in Macroporosity and Penetrability in a Silt Loam Soil. Soil Science Society of America Journal. 78 (4), 1392-1403 (2014).
- Zhang, Y. L., Wang, Y. S. Soil enzyme activities with greenhouse subsurface irrigation. Pedosphere. 16 (4), 512-518 (2006).
- Robinson, D., Hodge, A., Griffiths, B. S., Fitter, A. H. Plant root proliferation in nitrogen-rich patches confers competitive advantage. Proceedings of the Royal Society of London B: Biological Sciences. 266 (1418), 431-435 (1999).
- Lobet, G., Draye, X. Novel scanning procedure enabling the vectorization of entire rhizotron-grown root systems. Plant Methods. 9, 1(2013).
- Swarup, R., Wells, D. M., Bennett, M. J. Root Gravitropism. Plant Roots: The Hidden Half. , (2013).
- Smit, A. L., Bengough, A. G., Engels, C., van Noordwijk, M., Pellerin, S., van de Geijn, S. C. Root Methods: A Handbook. , Springer Science & Business Media. (2000).
- van Dusschoten, D., et al. Quantitative 3D Analysis of Plant Roots Growing in Soil Using Magnetic Resonance Imaging1[OPEN]. Plant Physiology. 170 (3), 1176-1188 (2016).
- Metzner, R., et al. Direct comparison of MRI and X-ray CT technologies for 3D imaging of root systems in soil: potential and challenges for root trait quantification. Plant Methods. 11, 17(2015).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved