È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Un protocollo di Rhizobox ottimizzato per visualizzare la crescita delle radici e tempi di risposta alle sostanze nutrienti localizzate
In questo articolo
Riepilogo
Visualizzazione e misurazione radice crescita in situ è estremamente impegnativo. Presentiamo un metodo rhizobox personalizzabile per tracciare lo sviluppo delle radici e la proliferazione nel tempo in risposta all'arricchimento in nutrienti. Questo metodo viene utilizzato per analizzare le differenze genotipiche mais nella plasticità di radice in risposta a una fonte di azoto organico.
Abstract
Le radici sono notoriamente difficili da studiare. Il suolo è sia una barriera meccanica e visiva, rendendo difficile per tenere traccia le sue radici in situ senza raccolto distruttivo o attrezzature costose. Presentiamo un metodo rhizobox personalizzabile e accessibile che permette la visualizzazione non distruttiva della crescita delle radici nel tempo ed è particolarmente adatto allo studio della plasticità di radice in risposta alle patch di risorsa localizzata. Il metodo è stato convalidato da valutare mais variazione genotipica nelle risposte di plasticità per patch contenente 15N-labeled legume residuo. Metodi sono descritti per ottenere misurazioni rappresentative dello sviluppo nel corso del tempo, misurare la densità di lunghezza di radice in cerotti contenenti risorse e controllo, calcolare i tassi di crescita di radice e determinare 15N recupero di radici e germogli. Vantaggi, avvertenze e le potenzialità future applicazioni del metodo inoltre sono discussi. Anche se deve prestare attenzione a garantire che le condizioni sperimentali non bias dati di crescita di radice, il protocollo di rhizobox presentato qui produce risultati affidabili se effettuati con sufficiente attenzione al dettaglio.
Introduzione
Anche se spesso trascurato rispetto alle loro controparti aboveground, radici svolgono un ruolo critico nell'acquisizione dei nutrienti vegetali. Dato il costo di carbonio sostanziale della radice costruzione e manutenzione, le piante hanno sviluppato meccanismi per sviluppare radici solo dove foraggiamento vale l'investimento. Sistemi della radice può così efficientemente e in modo dinamico miniera patch risorsa di proliferare negli hotspot, upregulating tassi di assorbimento e di sostanze nutritive rapidamente dispostamento per il floema per ulteriore trasporto1. Le risposte di plasticità possono variare ampiamente tra pianta specie o genotipi2,3 e a seconda della forma chimica dei nutrienti coinvolti4,5. Variazione nella plasticità di radice dovrebbe essere esplorato ulteriormente, come comprensione risposte radice complessa a risorse eterogenee del suolo potrebbero informare allevamento e strategie di gestione per aumentare l'efficienza di uso dei nutrienti in agricoltura.
Nonostante la sua necessità e pertinenza per impianti di comprensione, visualizzare e quantificare la plasticità di radice a rilevanti scale pone sfide tecniche. Scavo la corona di radice dal terreno ("shovelomics"6) è un metodo comune, ma radici fini sfruttano piccoli pori tra aggregati del suolo, e scavo porta inevitabilmente ad un certo grado di perdita di queste radici fragili. Inoltre, raccolto distruttivo rende impossibile seguire le modifiche in un unico sistema di radice nel corso del tempo. In situ metodi di imaging come la tomografia a raggi x computato consentono la visualizzazione diretta delle radici e delle risorse del suolo a elevata risoluzione spaziale7, ma sono costosi e richiedono attrezzature specializzate. Idroponici esperimenti evitare vincoli connessi con l'estrazione di radici dal terreno, ma architettura e morfologia della radice differiscono in mezzi acquosi rispetto i vincoli meccanici e biofisiche complessità di suoli8,9. Infine, funzioni e processi di rizosfera non possono essere integrate con plasticità inerente allo sviluppo in questi mezzi artificiali.
Vi presentiamo un protocollo per la costruzione e l'uso di rizobox (contenitori rettangolari strette, clear-parteggiato) come un metodo a basso costo, personalizzabile per caratterizzare la crescita delle radici nel terreno nel tempo. Telai appositamente progettati incoraggiano radici di crescere preferenzialmente contro il pannello posteriore dovuto gravitropismo, aumentando la precisione delle misurazioni di lunghezza della radice. Rizobox sono comunemente usati per studiare la crescita delle radici e rizosfera interazioni10,11,12, ma il metodo qui presentato offre un vantaggio nella semplicità con il suo design unico-vano e poco costoso materiali ed è progettato per lo studio delle risposte di radice ai nutrienti localizzate. Tuttavia, il metodo potrebbe anche essere adattato per studiare una gamma di altri processi di radice e rizosfera come concorrenza intra/interspecie, distribuzione spaziale dei composti chimici, microbi o attività dell'enzima. Qui, studiamo le differenze genotipiche tra ibridi di mais in risposta alle patch di 15N-labeled legume residuo ed evidenziare risultati rappresentativi per convalidare il metodo di rhizobox.
Access restricted. Please log in or start a trial to view this content.
Protocollo
1. preparazione di anteriore e posteriori pannelli e distanziali
- Preparare i pannelli anteriori e posteriori.
- Tagliate due pezzi di spessore acrilico chiaro 0,635 cm a 40,5 cm largo da 61 cm lungo per scatola o acquistare pezzi pre-tagliati (Vedi Tabella materiali).
- Utilizzando un trapano con progettato per acrilico, praticare fori 0,635 cm di diametro 1,3 cm dai bordi laterali a 2,5, 19, 38 e 53,3 cm dall'alto. Praticare fori 1,3 cm dal bordo inferiore a 2,5, 20,3 e 38 cm dal lato sinistro (Figura 1).
Nota: È più efficiente utilizzare un trapano per una pila di sei a dieci fogli alla volta, ma può anche essere usato un trapano a mano. - Rimuovere eventuali rivestimenti di protezione dall'acrilico e pulire delicatamente entrambi i pannelli prima di assemblare le caselle.
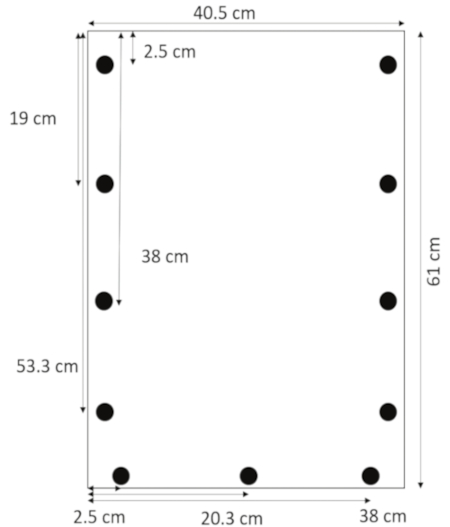
Figura 1: Layout di fori trapanati. Fori sono forati 1,3 cm dai bordi laterali a 2.5, 19, 38, 53,3 cm dall'alto e 1,3 cm dal bordo inferiore a 2,5, 20,3 e 38 cm dal margine sinistro. Clicca qui per visualizzare una versione più grande di questa figura.
- Preparare i distanziali laterali e inferiori.
- Tagliare tre distanziali per scatola da polietilene ad alta densità (HDPE) o acquisto due distanziali di pre-taglio laterale (0,635 cm di spessore, 2,5 cm di larghezza, 57 cm di lunghezza) e un pre-taglio inferiore del distanziatore (0,635 cm di spessore, 2,5 cm di larghezza, lunghezza 40,5 cm). Vedere la tabella dei materiali.
- Allineare i distanziali tra i pannelli anteriori e posteriori lungo i lati e il fondo della scatola. Utilizzando un trapano a mano o la pressa di trivello, trapano attraverso i fori esistenti nella parte anteriore ed indietro nuovamente in modo che i fori di passano attraverso tutti e tre i strati in modo pulito.
- Tenere gli strati posto con fascette o mediante l'installazione di una combinazione di bulloni, dadi e rondelle in ciascuna appena praticato foro (Vedi punto 3.1).
2. installazione di una striscia di ovatta di poliestere nella parte inferiore della finestra di
Nota: Ciò impedirà del suolo e dell'acqua che perdeva attraverso giunti tra distanziali.
- Tagliare poliestere ovatta in 2,5 cm largo da 40,5 cm lungo strisce (Vedi la Tabella materiali).
- Con il pannello posteriore menzogne piatto e i distanziali in cima esso, posare la battuta direttamente sopra il distanziale inferiore e tenerlo in posizione con il pannello superiore (Figura 2).
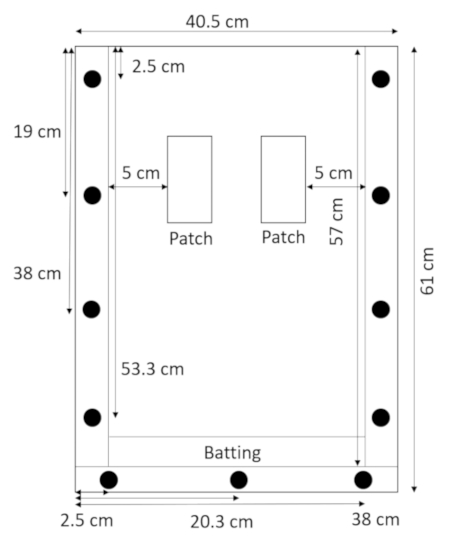
Figura 2: assemblati rhizobox ovatta di. Una stretta striscia di battuta nella parte inferiore della rhizobox previene terra e sabbia di fuoriuscire. Clicca qui per visualizzare una versione più grande di questa figura.
3. montaggio della rizobox
- Assemblare il rizobox utilizzando 20-filettatura delle viti (3,2 cm di lunghezza per 0,635 cm di diametro), rondelle (0,635 cm di diametro interno) e dadi esagonali (dimensionati per adattare le viti, Vedi Tabella materiali.
- Stringere ogni vite attraverso una rondella, pannello frontale, distanziale, pannello posteriore, rondella e dado esagonale. Assicurarsi che le viti sono molto strette; Se la casella viene assemblata senza bloccare, suolo sarà fuoriuscire attraverso le lacune tra i pannelli e i distanziali laterali.
Nota: Acrilico si graffia facilmente, e i graffi può interferire con le misurazioni di radice, quindi gestire le caselle assemblate con cura. Evitare di finestre di impilamento salvo materiale protettivo è posto tra di loro. - Preparare due distanziali di patch (distanziali che verranno utilizzati per creare le patch di trattamento e controllo) per scatola. Fogli singoli distanziali da polietilene ad alta densità (HDPE) o acquistarli pre-tagliato (0,635 cm di spessore, larghezza 3,8 cm, 28 cm di lunghezza; Vedi Tabella materiali). Praticare un foro 0,635 cm di diametro in ogni distanziale, 2 cm dalla cima lungo la linea mediana (Figura 3).
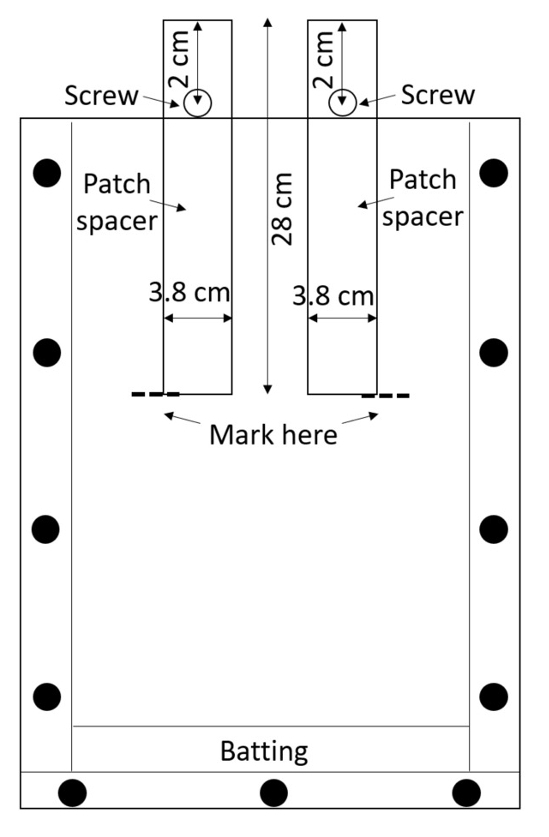
Figura 3: Patch distanziali. Viti inserite attraverso le strisce di centro di HDPE impediscono loro di cadere nella casella. Il rhizobox è riempito con terreno intorno i distanziali, il terreno è bagnato e i distanziatori vengono rimossi al fine di lasciare vuota patch di trattamento e controllo. Clicca qui per visualizzare una versione più grande di questa figura.
- Fissare una vite in ogni foro con un dado in modo che il distanziatore può essere parzialmente inserito il rhizobox fino a quando la vite impedisce di andare ulteriormente (Figura 3).
Nota: Quando il terreno è bagnato intorno i distanziali e i distanziatori vengono rimossi, rimarranno due spazi vuoti che può essere riempito con i substrati appropriati per la contenenti azoto trattamento patch e la patch per il controllo.
4. costruzione del PVC frame per supportare il rizobox ad angolo
Nota: Quando la casella è posizionata in un angolo, gravitropismo incoraggerà le radici a crescere contro il pannello posteriore in modo che tutte le radici sono visibili per l'analisi. Il cloruro di polivinile (PVC) dimensioni in Figura 4 risultato in una cornice che mantiene il rhizobox a un angolo di circa 55 ° in panchina.
- Tagliare 13 pezzi di diametro 1,3 cm in PVC per scatola: 2 × 44 cm di lunghezza, 3 lunghezze di cm × 42, 2 × 36.3 cm di lunghezza, 2 × 25,4 cm di lunghezza e 4 × 3,8 cm di lunghezza (Vedi Tabella materiali).
Nota: Una sega di taglio è altamente consigliata per efficienza e anche tagli. - Utilizzare 4 × 2 vie gomiti, gomiti di 3 vie × 2 e 4 T-giunti (Vedi Tabella materiali) per assemblare la finestra mostrata in Figura 4.
Nota: Frame devono essere stabile senza ulteriore colla, ma colla per PVC può essere utilizzato se necessario.
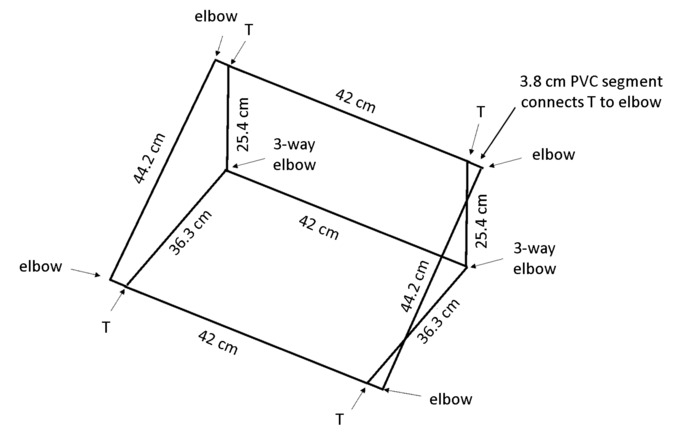
Figura 4: telaio per sostenere rizobox. Il leggerissimo telaio è costruito in PVC tagliato alla lunghezza specificata e collegato utilizzando i tipi di giunti indicati. Clicca qui per visualizzare una versione più grande di questa figura.
5. cucire Custodie protettive per riflettere la luce e calore
Nota: Le radici eviti la luce, così questi casi escludono la luce al fine di assicurarsi che osservate risposte plasticità radice sono guidate dalla fonte di nutrienti nei cerotti e non tramite l'evitare luce. Tessuto leggero privazione riduce anche la temperatura all'interno di rizobox, contribuendo a evitare lo stress da calore.
- Tagliare il tessuto leggero privazione (materiale specializzato che è bianco su un lato e nero da altra) in pezzi circa 95 cm di larghezza e lungo 69 cm (Vedi Tabella materiali). Un pezzo per scatola è necessario.
- Piegare ogni pezzo a metà lungo il lato lungo a formare un manicotto di 47,5 cm × 69 cm. Utilizzando un ago di cucito macchina progettato per il denim, per impieghi gravosi per quilting e una cucitura stretta, cucire lungo la parte inferiore e di ¾ del modo fino al lato di ogni manica. Pin gli angoli in alto insieme con una spilla di sicurezza.
6. preparazione del terreno di 1:1 (V/V): substrato per riempire il rizobox di sabbia
- Raccogliere circa 1.000 cm3 di terreno di campo (dal sito di interesse) per scatola. Asciugare il terreno fino a peso costante in vassoi superficiale a 60 ° C.
Nota: Il terreno per questo esperimento è stato raccolto immediatamente successivo la vendemmia in un campo di mais da agricoltura biologica gestita da 0\u201210 cm profondità. - Macinare il terreno con un mortaio e pestello per passare attraverso un setaccio di 2 mm. Misurare la densità apparente del suolo mediante pesatura un volume noto di suolo.
- Ottenere la sabbia (come la sabbia del gioco, che possa essere acquistato a buon mercato da un negozio di ferramenta; Vedi Tabella materiali) e misurare la densità di massa.
- Misurare volumi uguali di sabbia e terreno in un secchio e mescolare accuratamente. Usare un imbuto per riempire la casella lentamente e uniformemente a 2,5 cm dall'alto, senza agitare la casella per causare il substrato a stabilirsi. Misurare il volume di substrato; dovrebbe essere circa 1.272 cm3.
- Moltiplicare la densità di massa di sabbia per metà questo volume per ottenere la massa di sabbia necessario per ogni casella. Fare lo stesso con la densità apparente del suolo per ottenere la massa del terreno necessario per ogni casella.
Nota: Per il terreno del campo e la sabbia utilizzati in questo esperimento, questo è stato 976 g di sabbia e 774 di terreno, ma questi importi variano a seconda la densità apparente del suolo utilizzato. - Etichettare un grande sacchetto zip-top per rhizobox, pesare le masse appropriate di sabbia e terreno nel sacchetto e omogeneizzare accuratamente.
- Analizzare questo terreno di 1:1- e substrato per contenuto di nutrienti e l'abbondanza naturale di 15N (δ15N).
7. substrato preparazione per il trattamento e cerotti di controllo
- Etichetta due piccoli top zip sacchetti di plastica per rhizobox, uno per la patch di trattamento e uno per la patch di controllo. Peso 30 g di terreno: sabbia substrato da ogni borsa grande (punto 6.6) verso i due sacchi di piccoli corrispondenti.
- Mescolare il substrato con una fonte di azoto N-labeled 15per la patch di trattamento. Per questo, pesare 1 g 15N-etichettato pianta residuo o altra fonte di N (l'importo può essere regolata a piacere) in ogni sacchetto di trattamento (piccola borsa zip-top) e mescolare accuratamente.
Nota: Per questo esperimento, una miscela di 15N-labeled trifoglio e veccia residuo è stata utilizzata. Trifoglio e veccia semi sono stati piantati in un mix 1:1 di vermiculite e sabbia e coltivati in serra. Le piante erano innaffiati giornalmente con acqua deionizzata e due volte alla settimana con resistenza di 1/100 di Long Ashton soluzione13 contenenti fonti di azoto N-etichettato di 15. Tutta la biomassa fuori terra è stato raccolto in quattro settimane dopo la semina, essiccati e macinati per passare attraverso un setaccio di 2 mm. Se viene scelto un nutriente diverso, soprattutto se tale elemento è mobile nel suolo, esperimenti pilota per testare per lisciviazione sono incoraggiati. Forme di lento rilascio dei nutrienti potrebbero essere utilizzate o un design diverso rhizobox potrebbe essere scelto per limitare lisciviazione (ad es., di compartimenti separati10) se necessario.
8. caricamento Rhizobox con substrato e stabilire il trattamento e cerotti di controllo
- Pesare ogni rhizobox vuota e registrare i pesi per un uso successivo.
- Inserire un rhizobox due distanziali di patch (Vedi punto 3.2) fino a quando la vite impedisce loro di andare avanti. Segnare la profondità del bordo inferiore con un leggero segno sul lato del rhizobox (Figura 3) e rimuovere i distanziali.
- Utilizzando un imbuto con un'apertura di staminali che è come stretta come l'apertura di rhizobox, riempire il rhizobox dalla borsa grande corrispondente del substrato alla profondità contrassegnata. Spostare l'imbuto avanti e indietro lentamente e in modo uniforme così che il substrato si riempie uniformemente e non crea canali di flusso preferenziale.
- Quando il livello di substrato raggiunge la profondità contrassegnata, rimettere i distanziatori a 5 cm da ogni lato della scatola. Continuare a riempire la casella fino a quando il livello di substrato è di circa 5 cm dalla parte superiore della casella (dovrebbe esserci un substrato restanti nel sacchetto).
- Bagnare accuratamente intorno ogni distanziale.
Nota: In questo esperimento, questo è stato raggiunto fornendo 50 mL di acqua attraverso emettitori di gocciolamento inserito tra il bordo esterno di ogni distanziale e il lato della rhizobox e versare 50 mL di acqua in modo uniforme tra i due distanziatori. È necessario per la bagnatura uniforme irrigazione lenta. - Rimuovere i distanziali, mentre il terreno è bagnato, lasciando una cavità vuota per le patch.
- Un film di trasparenza verso l'esterno di ogni rhizobox del nastro (Vedi Tabella materiali). Contrassegnare un lato come trattamento e uno come controllo e riempire le patch da appositi sacchetti usando l'apposito imbuto. Tracciare i confini di ogni patch sulla trasparenza usando pennarello indelebile.
- Riempire il rhizobox uniformemente con il substrato rimanente. Tracciare la parte superiore del substrato sulla trasparenza.
- Ripetere per i rimanenti rizobox. Salvare tutte le borse per il raccolto.
9. anche irrigazione al 60% di capacità di trattenere l'acqua
Nota: Questa quantità di umidità del suolo è stata trovata per impedire che piante vivendo stress da siccità, impedendo lo sviluppo di condizioni anossiche o crescita delle alghe.
- Misurare la capacità di trattenere l'acqua (WHC) del substrato14.
- Calcolare il peso ideale di ogni casella; qui definito come la somma del peso del vuoto rhizobox combinato con il peso del substrato al 60% di capacità di trattenere l'acqua.
- Moltiplicare la WHC (grammi di acqua / grammi di substrato secco) da 0,6 per ottenere la massa d'acqua tenuta nel substrato al 60% WHC. Aggiungere questa messa a massa del substrato secco e la massa dell'origine 15N.
- Aggiungere il peso a vuoto di ogni casella il numero ottenuto in precedenza.
- Pesare le caselle già riempiti. Sottrarre il peso di ogni scatola (in g) a questo punto dal suo peso ideale (in g) calcolato al punto 9.2. Acqua con questo volume (in mL) di deionizzato (DI) acqua lentamente e uniformemente.
Nota: Questo passaggio può essere eseguita utilizzando l'irrigazione a goccia o di irrigazione manuale. Se irrigazione manuale, permettere all'acqua di filtrare completamente prima di aggiungere di più per evitare condizioni di umidità del terreno eterogeneo e canali di flusso preferenziale.
10. semi di germinazione e trapianto
- Se utilizzando controlli unplanted, mettere da parte quelle rizobox.
- Superficie-sterilizzare mediante agitazione per 1 min in 5% NaOCl, quindi risciacquare accuratamente in acqua DI semi di mais.
Nota: In questo esperimento, semi di sei differenti genotipi di mais sono stati utilizzati al fine di studiare le differenze genotipiche nella plasticità di radice. - Germinare i semi sterilizzati mettendoli su un tessuto di laboratorio bagnato (ad es., Kimwipe) all'interno di capsule di Petri e coprire con un altro tessuto umido. Non dovrebbe esserci alcun acqua stagnante. Capsule di Petri posto in un luogo buio per 48\u201272 h fino a quando la radichetta appena comincia ad emergere.
- Utilizzare una spatola stretta per scavare un buco a 2,5 cm di profondità al centro di ogni rhizobox. Trapiantare un seme germogliato nel foro, assicurando che la radichetta è orientata direttamente verso il basso.
Nota: Se la radichetta è angolata verso entrambi patch, il confronto dei tassi di crescita di radice sarà essere prevenuto. - Tracciare la posizione del seme sulla trasparenza.
- Coprire il seme e l'acqua con fino a 50 mL di acqua deionizzata.
11. piante crescita
- Coltivare piante per 25 giorni (o più a lungo desiderato), il mantenimento di 60% WHC durante tutto il periodo di crescita. Monitorare la crescita della radice tracciando le radici.
- Pesare ogni casella ogni 3\u20124 giorni e acqua fino a quando è all'interno di 5 g di un peso corporeo ideale. Interrompere l'irrigazione il rizobox quattro giorni prima del raccolto per facilitare la separazione dei pannelli. Rimuovere le erbacce a mano frequentemente in modo che solo le radici delle piante di interesse sono presenti.
- Trova le radici visibili ogni giorni di 3\u20124 usando un pennarello indelebile con colori chiaramente distinguibile per ogni giorno di tracciatura.
Nota: I marcatori di diverso diametro possono essere utilizzati per radici primarie e laterale, se lo si desidera. Può essere utile definire i criteri per la radice traccia fin dall'inizio, poiché un certo grado di soggettività è coinvolto, in particolare se i ricercatori più saranno le radici traccia o se le radici di diversi ordini o diametro devono essere distinti con diversi marcatori. In questo esperimento, la precisione di rintracciare radici visibili solo su un lato della scatola è stata testata da rintracciare radici visibili su entrambi i lati e confrontando radice totale lunghezza misurata sui lucidi digitalizzati per lunghezza della radice totale misurata lavando e radici di scansione. La correlazione tra lunghezza della radice tracciata e digitalizzati è stato significativa indipendentemente dal fatto che siano stati usati solo la trasparenza posteriore o entrambi lucidi. Pertanto è possibile rintracciare solo radici visibili sul pannello posteriore.
12. raccolta germogli e all'acquisizione di radice e campioni di terreno per l'analisi
- Posare il primo rhizobox piatto e rimuovere tutte le viti.
- Raccogliere i campioni di sparare. Germogli di clip alla base, risciacquare fuori qualsiasi terreno con dell'acqua distillata e asciugare a 60 ° C. Macinare spara con un mortaio e pestello per passare attraverso un setaccio di 2 mm e pesano sottocampioni in capsule in stagno per analisi isotopiche (Vedi sezione 14).
- Utilizzando la trasparenza come guida, tagliare intorno le patch trattamento e controllo con un rasoio. Utilizzare un cucchiaio o una spatola per scavare le radici e il suolo rizosferico aderente nel rispettivo sacchetto trattamento o controllo.
Nota: Mentre esistono molti metodi per suolo rizosferico separato, il terreno sotto l'influenza della pianta radici15e nella rizosfera può essere considerata una pendenza piuttosto che una zona rigorosamente delineato16, questo metodo segue l'ampiamente usato definizione di suolo che aderisce per piantare radici dopo agitazione17. - Scoop i restanti radici e terreno nel terzo sacchetto.
- Passare il trattamento, controllo e campioni di massa attraverso un setaccio di 2 mm per separare le radici dal substrato, rimuovere eventuali radici visibili o frammenti > 1 cm di lunghezza con una pinzetta bene. Mantenere questi campioni separati uno da altro per un totale di tre radice e tre campioni di substrato.
13. convalida di tracciati e stima dei tassi di crescita relativa radice
- Trattamento, controllo, la scansione e campioni di massa e calcolare la lunghezza della radice.
- Lavorando con un campione alla volta, sciacquare le radici accuratamente con dell'acqua distillata per rimuovere qualsiasi substrato rimanente. Organizzare i campioni in un vassoio in modo che le radici non sono sovrapposte.
- Scansione di campioni utilizzando uno scanner compatibile con software di analisi di radice (ad esempio, WinRhizo). Assicurarsi che il software sia calibrato per distinguere attendibilmente le radici dall'immagine di sfondo.
- Utilizzare il software per misurare la lunghezza totale della radice e lunghezza della radice nelle classi di interesse (ad esempio, < 0,2 mm, 0.2\u20120.4 mm, 0.4\u20120.8 mm, 0.8\u20121.6 mm, > 1,6 mm) di diametro.
- Calcolare la radice lunghezza densità (RLD) per trattamento e controllo di patch e per ogni rhizobox nel suo complesso.
- Calcolare il volume di trattamento e controllo patch moltiplicando l'area tracciata su ogni trasparenza (Vedi punto 8.1) da 0,635 cm, la profondità della scatola. Utilizzare tali volumi per calcolare la densità di lunghezza di radice nel trattamento e controllo patch utilizzando la lunghezza totale della radice in ogni patch (Vedi punto 13.1.3).
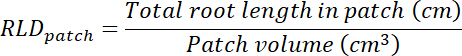
- Calcolare il volume di substrato in ogni rhizobox moltiplicando l'area tracciata sulla trasparenza (Vedi punto 8.1) da 0,635 cm. Calculate RLD per quanto riguarda le patch trattamento e controllo.
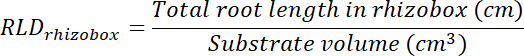
- Calcolare il volume di trattamento e controllo patch moltiplicando l'area tracciata su ogni trasparenza (Vedi punto 8.1) da 0,635 cm, la profondità della scatola. Utilizzare tali volumi per calcolare la densità di lunghezza di radice nel trattamento e controllo patch utilizzando la lunghezza totale della radice in ogni patch (Vedi punto 13.1.3).
- Convalidare la radice analisi Metodo confrontando digitalizzati sistemi della radice e rintracciati immagini.
- Scansione ogni trasparenza e calcolare la lunghezza totale della radice utilizzando il software. Salvare l'immagine acquisita per la crescita di calcoli di tasso.
- Sommare le misure di lunghezza totale radice del trattamento, controllo e campioni per ogni casella di massa (Vedi punto 13.1.3).
- Testare le misurazioni digitalizzate e tracciate della lunghezza totale della radice per vedere se la correlazione è statisticamente significativa.
Nota: In questo caso, il metodo di analisi viene convalidato, e tassi di crescita relativa possono essere calcolati in ogni punto del tempo. In caso contrario, solo i dati di sistema di radice analizzato forniscono un'indicazione accurata della crescita delle radici. Questo potrebbe essere il caso se la metodologia di analisi è stato incoerente o se le radici non erano altrettanto visibile per tutti i genotipi, ad esempio.
- Se il metodo di analisi è stato convalidato, calcolare i tassi di crescita relativa radice ogni rhizobox.
- Utilizzare software di analisi root calibrato per distinguere tra i colori di tracciatura selezionate per misurare la lunghezza totale della radice nel trattamento, controllo e campioni in ogni punto del tempo in massa. Calcola la lunghezza della radice totale cumulativo in ogni momento.
- Calcolare i tassi di crescita relativa radice (RGRradice) per ogni rhizobox anche per quanto riguarda il trattamento e cerotti di controllo per ogni tempo intervallo t1-t2 come segue.
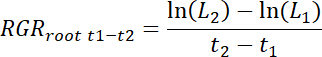
Nota: Qui L1 è la lunghezza totale della radice nella patch (somma cumulativa da 11,3) a t1 giorni dopo il trapianto (DAT) e L2è la lunghezza totale della radice nella patch a t2 DAT.
14. analisi di 15N partizionamento tra radice, sparare e trattamento di campioni di terreno
- Asciugare le radici a 60 ° C, pesare biomassa e macinare per passare attraverso un setaccio di 2 mm.
- Sottocampioni asciutte del terreno di trattamento a 60 ° C.
- Come con i germogli del pacchetto radici e trattamento in capsule in stagno.
Nota: Peso campione ideale per capsula dovrebbe essere calcolato separatamente per germogli, radici e basato sul rapporto c/n stimato del materiale per ottenere l'importo obiettivo di N totale per analisi del suolo. Contattare la nostra sede dell'isotopo stabile dove i campioni devono essere presentate per ulteriori informazioni. Per questo esperimento, le istruzioni di preparazione del campione e calcolatore del peso campione fornito dalla struttura dell'isotopo stabile di UC Davis erano seguiti18.
Attenzione: Prestare particolare attenzione per miscelare i campioni in modo uniforme prima del confezionamento in capsule e preparare più capsule al campione. Se i campioni non sono mescolati in modo uniforme, recupero apparente di 15N può superare l'importo originariamente presente. - Analizzare N totale, δ15 e 15N contenuto di ogni campione di terreno di trattamento, radice e scattare.
Nota: In questo esperimento, campioni di piante sono stati analizzati mediante la combustione con un analizzatore elementare PDZ Europa ANCA-GSL interfacciato ad uno spettrometro di massa di PDZ Europa 20-20 dell'isotopo rapporto presso l'impianto dell'isotopo stabile di UC Davis (UCD SIF). Campioni di terreno sono stati analizzati con un analizzatore elementare Elementar Vario EL cubo interfacciato ad un PDZ Europa 20-20 dell'isotopo rapporto spettrometro di massa presso il SIF UCD. - Calcolare l'importo di 15N ottenuti dall'etichetta in pianta sparare e campioni della radice.
- In primo luogo, calcolare la quantità di 15N superiori a atmosferica 15N in ogni pool, 15P *:
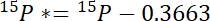
dove 15P è il contenuto di 15N in % atomico dello stagno di interesse. - In secondo luogo, calcolare la quantità di 15N superiori a atmosferica 15N nell'etichetta, 15L *:
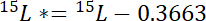
dove 15L è il contenuto di 15N in atomico % dell'origine con etichetta N. - In terzo luogo, calcolare la quantità di N totale in ogni pool, Np:
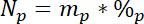
dove m.p è la massa della piscina (ad es., tiro secco totale o radice biomassa) e %p è la percentuale di N di quella piscina. - Infine, utilizzare i risultati di 14.5.1\u201214.5.3 a Ndff equazione19 per calcolare la quantità di N ottenuti dall'etichetta, Nl:
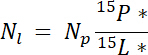
Nota: L'equazione di Ndff viene utilizzato per determinare la quantità di N da una fonte con etichetta che viene recuperata da piante. Si presuppone che nessuna discriminazione isotopica si verifica durante l'assorbimento N dalla pianta ed è generalmente valida per N fonti arricchito ~1\u201210%19.
- In primo luogo, calcolare la quantità di 15N superiori a atmosferica 15N in ogni pool, 15P *:
Access restricted. Please log in or start a trial to view this content.
Risultati
Radici è cresciuto preferenzialmente contro la parte posteriore della scatola, come anticipato. Lunghezza totale della radice tracciata sulla parte posteriore della scatola ha variata da 400 a 1.956 cm, rispetto ai 93-758 cm sulla parte anteriore della scatola. Sono stati calcolati i coefficienti di correlazione di Pearson pairwise tra lunghezza della radice digitalizzati e lunghezza della radice tracciata sulla parte anteriore della scatola, retro della scatola, e la somma della parte a...
Access restricted. Please log in or start a trial to view this content.
Discussione
Il rizobox descritto in questo protocollo può essere utilizzato per rispondere alle varie domande in radice e rizosfera scienza e hanno trovato diversi usi altrove10,20,21,22,23 , 24 , 25. altri ricercatori hanno catturato immagini time-lapse del rizobox21,
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Gli autori si desidera ringraziare anonimi utenti per loro feedback, così come J.C. Cahill e Tan Bao per primo orientamento sullo sviluppo del protocollo rhizobox. Finanziamento è stato fornito dalla Fondazione per l'alimentazione e l'agricoltura ricerca, l'Istituto nazionale di noi dipartimento dell'agricoltura (USDA) di alimentazione e l'agricoltura, Agricultural Experiment Station progetto CA-D-PLS-2332-H, a.g. e dall'UC Davis dipartimento di impianto Scienze attraverso una borsa di J.S.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| 1.27 cm diameter PVC pipe | JM Eagle | 530048 | 305 cm per box, cut into lengths as specified in the protocol |
| PVC side elbows | Lasco | 315498 | 2 per box |
| PVC 90-degree elbows | Charlotte | PVC 02300 0600 | 4 per box |
| PVC T joints | Charlotte | PVC 02402 0600 | 4 per box |
| Extruded acrylic panes | TAP Plastics | N/A | 2 per box, 0.64 cm thick x 40.5 cm wide x 61 cm long |
| HDPE spacers (sides) | TAP Plastics | N/A | 2 per box, 0.64 cm thick x 2.5 cm wide x 57 cm long |
| HDPE spacers (bottom) | TAP Plastics | N/A | 1 per box, 0.64 cm thick x 2.5 cm wide x 40.5 cm long |
| HDPE spacers (patch) | TAP Plastics | N/A | 2 per box, 0.64 cm thick x 3.8 cm wide x 28 cm long |
| Polyester batting | Fairfield | #A-X90 | 2.5 cm x 40.5 cm strip per box |
| 20-thread screws | N/A | N/A | 3.2 cm long, 0.64 cm diameter |
| Washers | N/A | N/A | 0.64 cm internal diameter |
| Hex nuts | N/A | N/A | sized to fit the screws |
| Light deprivation fabric | Americover, Inc. | Bold 8WB26.5 | 1 piece 95 cm wide and 69 cm long per box |
| Sand | Quikrete | No. 1113 | |
| Field soil | N/A | N/A | |
| Transparencies for tracing | FXN | FXNT1319100S | One per side of the box to be traced |
Riferimenti
- Hodge, A. Roots: The Acquisition of Water and Nutrients from the Heterogeneous Soil Environment. Progress in Botany 71. , 307-337 (2010).
- Grossman, J. D., Rice, K. J. Evolution of root plasticity responses to variation in soil nutrient distribution and concentration. Evolutionary Applications. 5 (8), 850-857 (2012).
- Melino, V. J., Fiene, G., Enju, A., Cai, J., Buchner, P., Heuer, S. Genetic diversity for root plasticity and nitrogen uptake in wheat seedlings. Functional plant biology. , Available from: http://agris.fao.org/agris-search/search.do?recordID=US201600101375 (2015).
- Zhang, H., Forde, B. G. An Arabidopsis MADS box gene that controls nutrient-induced changes in root architecture. Science. 279 (5349), 407-409 (1998).
- Hodge, A., Stewart, J., Robinson, D., Griffiths, B. S., Fitter, A. H. Competition between roots and soil micro-organisms for nutrients from nitrogen-rich patches of varying complexity. Journal of Ecology. 88 (1), 150-164 (2000).
- Trachsel, S., Kaeppler, S. M., Brown, K. M., Lynch, J. P. Shovelomics: high throughput phenotyping of maize (Zea mays L.) root architecture in the field. Plant and Soil. 341 (1-2), 75-87 (2011).
- Rogers, E. D., Monaenkova, D., Mijar, M., Nori, A., Goldman, D. I., Benfey, P. N. X-ray computed tomography reveals the response of root system architecture to soil texture. Plant Physiology. , (2016).
- Groleau-Renaud, V., Plantureux, S., Guckert, A. Effect of mechanical constraint on nodal and seminal root system of maize plants. Comptes Rendus De L Academie Des Sciences Serie Iii-Sciences De La Vie-Life Sciences. 321 (1), 63-71 (1998).
- Lin, Y., Allen, H. E., Di Toro, D. M. Barley root hair growth and morphology in soil, sand, and water solution media and relationship with nickel toxicity. Environmental Toxicology and Chemistry. 35 (8), 2125-2133 (2016).
- Wenzel, W. W., Wieshammer, G., Fitz, W. J., Puschenreiter, M. Novel rhizobox design to assess rhizosphere characteristics at high spatial resolution. Plant and Soil. 237 (1), 37-45 (2001).
- Spohn, M., Carminati, A., Kuzyakov, Y. Soil zymography - A novel in situ method for mapping distribution of enzyme activity in soil. Soil Biology and Biochemistry. 58, 275-280 (2013).
- Vollsnes, A. V., Futsaether, C. M., Bengough, A. G. Quantifying rhizosphere particle movement around mutant maize roots using time-lapse imaging and particle image velocimetry. European Journal of Soil Science. 61 (6), 926-939 (2010).
- Hewitt, E. J. Sand and Water Culture Methods Used in the Study of Plant Nutrition. , Commonwealth Bureau. London. (1966).
- Choudhary, M. I., Shalaby, A. A., Al-Omran, A. M. Water holding capacity and evaporation of calcareous soils as affected by four synthetic polymers. Communications in Soil Science and Plant Analysis. 26 (13-14), 2205-2215 (1995).
- Bakker, P. A. H. M., Berendsen, R. L., Doornbos, R. F., Wintermans, P. C. A., Pieterse, C. M. J. The rhizosphere revisited: root microbiomics. Frontiers in Plant Science. 4, 2013(2013).
- McNear, D. H. Jr The Rhizosphere - Roots, Soil, and Everything In Between. Nature Education Knowledge. 4 (3), 1(2013).
- Ortas, I. Determination of the extent of rhizosphere soil. Communications in Soil Science and Plant Analysis. 28 (19-20), 1767-1776 (1997).
- UC Davis Stable Isotope Facility. Carbon (13C) and Nitrogen (15N) Sample Preparation. , Available from: https://stableisotopefacility.ucdavis.edu/13cand15nsamplepreparation.html (2018).
- Barraclough, D. 15N isotope dilution techniques to study soil nitrogen transformations and plant uptake. Fertilizer research. 42 (1-3), 185-192 (1995).
- Belter, P. R., Cahill, J. F. Disentangling root system responses to neighbours: identification of novel root behavioural strategies. AoB PLANTS. 7, (2015).
- Nagel, K. A., et al. GROWSCREEN-Rhizo is a novel phenotyping robot enabling simultaneous measurements of root and shoot growth for plants grown in soil-filled rhizotrons. Functional Plant Biology. 39 (11), 891-904 (2012).
- Adu, M. O., Yawson, D. O., Bennett, M. J., Broadley, M. R., Dupuy, L. X., White, P. J. A scanner-based rhizobox system enabling the quantification of root system development and response of Brassica rapa seedlings to external P availability. Plant Root. 11, 16-32 (2017).
- Neumann, G., George, T. S., Plassard, C. Strategies and methods for studying the rhizosphere-the plant science toolbox. Plant and Soil. 321 (1-2), 431-456 (2009).
- Bodner, G., Alsalem, M., Nakhforoosh, A., Arnold, T., Leitner, D. RGB and Spectral Root Imaging for Plant Phenotyping and Physiological Research: Experimental Setup and Imaging Protocols. JoVE (Journal of Visualized Experiments). (126), e56251-e56251 (2017).
- Kuchenbuch, R. O., Ingram, K. T. Image analysis for non-destructive and non-invasive quantification of root growth and soil water content in rhizotrons. Journal of Plant Nutrition and Soil Science. 165 (5), 573-581 (2002).
- Dresbøll, D. B., Thorup-Kristensen, K., McKenzie, B. M., Dupuy, L. X., Bengough, A. G. Timelapse scanning reveals spatial variation in tomato (Solanum lycopersicum L.) root elongation rates during partial waterlogging. Plant and Soil. 369 (1-2), 467-477 (2013).
- Wu, J., et al. RhizoChamber-Monitor: a robotic platform and software enabling characterization of root growth. Plant Methods. 14 (1), 44(2018).
- Rogers, S. W., Moorman, T. B., Ong, S. K. Fluorescent In Situ Hybridization and Micro-autoradiography Applied to Ecophysiology in Soil. Soil Science Society of America Journal. 71 (2), 620-631 (2007).
- Eickhorst, T., Tippkötter, R. Detection of microorganisms in undisturbed soil by combining fluorescence in situ hybridization (FISH) and micropedological methods. Soil Biology and Biochemistry. 40 (6), 1284-1293 (2008).
- Spohn, M., Kuzyakov, Y. Distribution of microbial- and root-derived phosphatase activities in the rhizosphere depending on P availability and C allocation - Coupling soil zymography with 14C imaging. Soil Biology and Biochemistry. 67, 106-113 (2013).
- Lv, G., Kang, Y., Li, L., Wan, S. Effect of irrigation methods on root development and profile soil water uptake in winter wheat. Irrigation Science. 28 (5), 387-398 (2010).
- Asseng, S., Ritchie, J. T., Smucker, A. J. M., Robertson, M. J. Root growth and water uptake during water deficit and recovering in wheat. Plant and Soil. 201 (2), 265-273 (1998).
- Hernandez-Ramirez, G., et al. Root Responses to Alterations in Macroporosity and Penetrability in a Silt Loam Soil. Soil Science Society of America Journal. 78 (4), 1392-1403 (2014).
- Zhang, Y. L., Wang, Y. S. Soil enzyme activities with greenhouse subsurface irrigation. Pedosphere. 16 (4), 512-518 (2006).
- Robinson, D., Hodge, A., Griffiths, B. S., Fitter, A. H. Plant root proliferation in nitrogen-rich patches confers competitive advantage. Proceedings of the Royal Society of London B: Biological Sciences. 266 (1418), 431-435 (1999).
- Lobet, G., Draye, X. Novel scanning procedure enabling the vectorization of entire rhizotron-grown root systems. Plant Methods. 9, 1(2013).
- Swarup, R., Wells, D. M., Bennett, M. J. Root Gravitropism. Plant Roots: The Hidden Half. , (2013).
- Smit, A. L., Bengough, A. G., Engels, C., van Noordwijk, M., Pellerin, S., van de Geijn, S. C. Root Methods: A Handbook. , Springer Science & Business Media. (2000).
- van Dusschoten, D., et al. Quantitative 3D Analysis of Plant Roots Growing in Soil Using Magnetic Resonance Imaging1[OPEN]. Plant Physiology. 170 (3), 1176-1188 (2016).
- Metzner, R., et al. Direct comparison of MRI and X-ray CT technologies for 3D imaging of root systems in soil: potential and challenges for root trait quantification. Plant Methods. 11, 17(2015).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon