A subscription to JoVE is required to view this content. Sign in or start your free trial.
Methods Article
محلل البنية الفرعية: سير عمل سهل الاستخدام للاستكشاف السريع والتحليل الدقيق للأجسام الخلوية في صور المجهر الفلوري
In This Article
Summary
نقدم سير العمل المتوفرة مجانا بنيت لاستكشاف سريع وتحليل دقيق للأجسام الخلوية في مقصورات خلية محددة في الصور المجهرية الفلوريس. تم تصميم سير العمل سهل الاستخدام هذا على برنامج المصدر المفتوح Icy ويستخدم أيضًا وظائف ImageJ. خط الأنابيب بأسعار معقولة دون معرفة في تحليل الصور.
Abstract
وقد اتسم العقد الماضي باختراقات في تقنيات المجهر المفلورية التي يتضح منها تحسين الدقة المكانية ولكن أيضا في التصوير بالخلايا الحية وتقنيات المجهر عالية الإنتاجية. وأدى ذلك إلى زيادة مستمرة في كمية وتعقيد بيانات المجهر لتجربة واحدة. لأن التحليل اليدوي لبيانات المجهر يستغرق وقتا طويلا جدا، وذاتية، ويحظر التحليل الكمي، أتمتة تحليل الصورة الحيوية أصبح من المحتم تقريبا. لقد قمنا ببناء سير عمل معلوماتي يسمى محلل البنية الفرعية لأتمتة تحليل الإشارة بالكامل في الصور الحيوية من المجهر الفلورسنت. تم تطوير هذا العمل على منصة مفتوحة المصدر سهلة الاستخدام Icy ويتم إكمالها من قبل وظائف من ImageJ. ويشمل المعالجة المسبقة للصور لتحسين نسبة الإشارة إلى الضوضاء، وتجزئة الخلايا الفردية (الكشف عن حدود الخلايا) والكشف/القياس الكمي للأجسام الخلوية التي يتم إثراؤها في مقصورات خلايا محددة. وتتمثل الميزة الرئيسية لسير العمل هذا في اقتراح وظائف معقدة للتصوير الحيوي للمستخدمين الذين لا يتمتعون بخبرة في تحليل الصور من خلال واجهة سهلة الاستخدام. وعلاوة على ذلك، فهي وحدات معيارية بدرجة عالية ومتكيفة مع عدة مسائل من توصيف نقل التكنولوجيات النووية/السيتوبلازمية إلى التحليل المقارن لمختلف أجسام الخلايا في مختلف الهياكل الفرعية الخلوية. ويتضح من وظيفة هذا العمل من خلال دراسة الهيئات Cajal (ملفوف) في ظروف الإجهاد التأسدي (OS). تظهر البيانات المستقاة من المجهر المفلور أن سلامتها في الخلايا البشرية تتأثر بعد ساعات قليلة من تحريض نظام التشغيل. ويتميز هذا التأثير بانخفاض نوى اللفائف في الأجسام Cajal مميزة، المرتبطة إعادة توزيع نووكلوباسميك من الملف إلى عدد متزايد من بؤر أصغر. يشير الدور المركزي لللفائف في التبادل بين مكونات CB والنيوكلوباسم المحيطة به إلى أن نظام التشغيل المستحث بإعادة توزيع اللفائف يمكن أن يؤثر على تكوين ووظائف هيئات Cajal.
Introduction
المجهر الخفيف، وبشكل خاص، المجهر الفلوري هي تقنيات قوية ومتعددة الاستخدامات تستخدم عادة في العلوم البيولوجية. أنها تعطي الوصول إلى التعريب الدقيق للجزيئات الحيوية المختلفة مثل البروتينات أو الحمض النووي الريبي من خلال وضع العلامات الفلورية المحددة. وقد تميز العقد الماضي من التقدم السريع في تقنيات المجهر والتصوير كما يتضح من جائزة نوبل في الكيمياء 2014 منح اريك Betzig, ستيفان W. الجحيم ووليام E. Moerner لتطوير المجهر الفلورانس فائقة حل (SRFM)1. تتجاوز SFRM حد الانعراج من المجهر البصري التقليدي لإدخاله في نانوديمينسين. كما أن تحسين تقنيات مثل التصوير الحي أو نهج الفرز عالي الإنتاجية يزيد من كمية البيانات التي يجب معالجتها لكل تجربة وتعقيدها. في معظم الأحيان، يواجه الباحثون مجموعات سكانية غير متجانسة عالية من الخلايا ويريدون تحليل الأنماط الظاهرية على مستوى الخلية الواحدة.
في البداية، تم إجراء تحليلات مثل عد البؤر بالعين، وهو ما يفضله بعض الباحثين لأنه يوفر تحكمًا بصريًا كاملًا في عملية العد. ومع ذلك ، فإن التحليل اليدوي لهذه البيانات يستغرق وقتا طويلا للغاية ، ويؤدي إلى التباين بين المراقبين ، ولا يتيح الوصول إلى ميزات أكثر تعقيدا بحيث أصبحت النهج بمساعدة الكمبيوتر تستخدم على نطاق واسع ولا يمكن تجنبها تقريبا2. أساليب المعلوماتية الحيوية تزيد بشكل كبير من كفاءة تحليل البيانات وخالية من الذاتية المشغل لا يمكن تجنبها والتحيز المحتمل لتحليل العد اليدوي. أدى الطلب المتزايد في هذا المجال وتحسين قوة الكمبيوتر إلى تطوير عدد كبير من منصات تحليل الصور. وبعضها متاح مجاناً ويمنح إمكانية الوصول إلى أدوات مختلفة لإجراء التحليل باستخدام أجهزة الكمبيوتر الشخصية. وقد تم مؤخرا وضع تصنيف لأدوات الوصول المفتوح3 ويعرض Icy4 كبرمجيات قوية تجمع بين سهولة الاستخدام والوظائف. وعلاوة على ذلك ، فإن الجليدية لديها ميزة التواصل مع ImageJ.
بالنسبة للمستخدمين الذين لا يتمتعون بخبرة في تحليل الصور، فإن العقبات الرئيسية هي اختيار الأداة المناسبة وفقاً للمحددات الإشكالية والمتناغمة بشكل صحيح التي غالباً ما تكون غير مفهومة جيداً. وعلاوة على ذلك، غالباً ما تكون أوقات الإعداد طويلة. يقترح Icy واجهة نقطة وانقر سهلة الاستخدام تسمى "بروتوكولات" لتطوير سير العمل من خلال الجمع بين بعض الإضافات الموجودة ضمن مجموعة شاملة4. تصميم وحدات مرنة وواجهة نقطة وانقر جعل إعداد تحليل ممكن بالنسبة لغير المبرمجين. هنا نقدم سير العمل يسمى محلل الهيكل الفرعي، وضعت في واجهة الجليدية ، وظيفتها هي تحليل الإشارات الفلورية في مقصورات خلوية محددة وقياس ميزات مختلفة مثل السطوع ، وعدد بؤر ، وحجم بؤر ، والتوزيع المكاني. هذا سير العمل يعالج العديد من القضايا مثل الكم من نقل إشارة، وتحليل الخلايا المُصابة التي تعبر عن مراسل الفلورسنت، أو تحليل بؤر من الهياكل الفرعية الخلوية المختلفة في الخلايا الفردية. وهو يسمح بمعالجة صور متعددة في وقت واحد، ويتم تصدير نتائج المخرجات إلى ورقة عمل محددة بعلامات الجدولة يمكن فتحها في برامج جداول البيانات شائعة الاستخدام.
يتم عرض خط أنابيب محلل البنية الفرعية في الشكل 1. أولاً، يتم معالجة كافة الصور الموجودة في مجلد محدد مسبقًا لتحسين نسبة الإشارة إلى الضوضاء. هذه الخطوة يزيد من كفاءة الخطوات التالية ويقلل من وقت التشغيل. ثم يتم تحديد مناطق الاهتمام (ROIs) ، المقابلة لمناطق الصورة التي يجب اكتشاف إشارة الفلورسنت فيها ، وتقسيمها. وأخيراً، يتم تحليل إشارة الفلورسنت، ويتم تصدير النتائج إلى ورقة عمل محددة بعلامات الجدولة.
تجزئة الكائنات (الكشف عن الحدود) هي الخطوة الأكثر صعوبة في تحليل الصور، والكفاءة يحدد دقة القياسات الخلية الناتجة. الكائنات الأولى التي تم تحديدها في صورة (تسمى الكائنات الأولية) غالبا ما تكون نوية من الصور الملطخة بالحمض النووي (DAPI أو Hoechst تلطيخ)، على الرغم من أن الكائنات الأولية يمكن أن تكون أيضا خلايا كاملة، الخرز، البقع، الأورام، أو أيا كانت الكائنات الملطخة. في معظم الصور البيولوجية، الخلايا أو النوى لمس بعضها البعض أو التداخل مما تسبب في الخوارزميات البسيطة والسريعة للفشل. حتى الآن، لا يمكن لأي خوارزمية عالمية تنفيذ تجزئة مثالية لجميع الكائنات، ويرجع ذلك في الغالب إلى خصائصها (الحجم أو الشكل أو الملمس) تعدل كفاءة تجزئة5. تعتمد أدوات التقسيم التي يتم توزيعها عادةً مع برامج الفحص المجهري (مثل برنامج التصوير المتحول بواسطة الأجهزة الجزيئية6، أو برنامج أبحاث تقدمات NIS-Elements بواسطة Nikon7)بشكل عام على التقنيات القياسية مثل مطابقة الارتباط أو العتبة أو العمليات المورفولوجية. وعلى الرغم من كفاءة هذه الأساليب العامة في النظم الأساسية، فإن هذه الأساليب التي تتسم بالإفراط في التعميم تفرض بسرعة قيوداً عند استخدامها في سياقات أكثر صعوبة وتحديداً. في الواقع، تجزئة حساسة للغاية لالمعلمات التجريبية مثل نوع الخلية، وكثافة الخلية، أو المؤشرات الحيوية، وكثيراً ما يتطلب التعديل المتكرر لمجموعة بيانات كبيرة. يدمج سير عمل محلل الهيكل الفرعي كلاً من الخوارزميات البسيطة والأكثر تعقيدًا لاقتراح بدائل مختلفة تتكيف مع تعقيد الصورة واحتياجات المستخدم. ومن الجدير بالذكر أنه يقترح خوارزمية مستجمعات المياه القائمة على العلامة8 للكائنات متفاوتة المسافات العالية. تعتمد كفاءة أسلوب التجزئة هذا على تحديد علامات فردية على كل كائن. يتم اختيار هذه العلامات يدويا معظم الوقت للحصول على المعلمات الصحيحة لتقسيم كامل، والتي تستغرق وقتا طويلا للغاية عندما يواجه المستخدمون عددا كبيرا من الكائنات. محلل البنية الفرعية يقترح الكشف التلقائي لهذه العلامات، وتوفير عملية تجزئة عالية الكفاءة. تجزئة هو ، في معظم الأحيان ، والحد من خطوة تحليل الصور ويمكن أن تعديل بشكل كبير في وقت المعالجة اعتمادا على دقة الصورة ، وعدد الكائنات في الصورة الواحدة ، ومستوى التجمع من الكائنات. خطوط الأنابيب النموذجية تتطلب بضع ثوان إلى 5 دقائق لكل صورة على كمبيوتر سطح المكتب القياسية. تحليل الصور أكثر تعقيدا يمكن أن تتطلب جهاز كمبيوتر أكثر قوة وبعض المعرفة الأساسية في تحليل الصور.
ويتضح من مرونة هذا العمل ووظيفته مع مختلف الأمثلة في النتائج التمثيلية. وتظهر مزايا هذا العمل بشكل ملحوظ من خلال دراسة الهياكل الفرعية النووية في ظل ظروف الإجهاد التأسدي .( نظام التشغيل يتوافق مع اختلال التوازن في الأكسدة الحمراء لصالح المؤكد ويرتبط مع مستويات عالية من أنواع الأكسجين التفاعلي (ROS). منذ ROS بمثابة جزيئات الإشارة، والتغيرات في تركيزها وتوطين الخلايا الفرعية تؤثر إيجابا أو سلبا على عدد لا يحصى من المسارات والشبكات التي تنظم الوظائف الفسيولوجية، بما في ذلك نقل الإشارة، وآليات الإصلاح، والتعبير الجيني، وموت الخلايا، وانتشار9،,10. وبالتالي فإن نظام التشغيل يشارك بشكل مباشر في مختلف الأمراض (أمراض الأعصاب والقلب والأوعية الدموية والسرطان والسكري، وما إلى ذلك)، ولكن أيضا الشيخوخة الخلوية. لذلك، فك نتائج نظام التشغيل على تنظيم الخلية البشرية ووظيفته يشكل خطوة حاسمة في فهم أدوار نظام التشغيل في بداية وتطور الأمراض البشرية. وقد ثبت أن نظام التشغيل ينظم التعبير الجيني عن طريق تعديل النسخ من خلال عدة عوامل النسخ (P53، Nrf2، FOXO3A)11، ولكن أيضا عن طريق التأثير على تنظيم عدة عمليات المشاركة وما بعد النسخ مثل الربط البديل (AS) من ما قبل RNAs12،13،14. إن الربط البديل للنصوص الأولية للتشفير والنصوص غير البرمجةية هو آلية أساسية تزيد من قدرة الترميز على الجينوم عن طريق إنتاج أشكال متساوية. يتم تنفيذ AS بواسطة مجمع كبير ribonucleoprotein يسمى spliceosome ، يحتوي على ما يقرب من 300 بروتين و 5 U-الغنية RNAs النووية الصغيرة (UsnRNAs)15. يتم التحكم بإحكام في تجميع spliceosome و AS في الخلايا وتحدث بعض خطوات نضج الطمي داخل المقصورات النووية أقل غشاء اسمه الهيئات Cajal. وتتميز هذه الهياكل الفرعية النووية بالطبيعة الديناميكية لهيكلها وتكوينها، والتي تتم بشكل رئيسي من خلال التفاعلات متعددة التكافؤ لمكونات الحمض النووي الريبي والبروتين مع بروتين اللفائف. تحليل الآلاف من الخلايا مع سير عمل محلل الهيكل الفرعي سمح توصيف أبدا وصفها من آثار نظام التشغيل على الهيئات Cajal. في الواقع، تشير البيانات التي تم الحصول عليها إلى أن نظام التشغيل يعدل نووية الأجسام Cajal، مما يحفز إعادة توزيع نووكلوباسميك من بروتين اللفائف إلى العديد من بؤر النووية الصغيرة. مثل هذا التغيير في هيكل الهيئات Cajal قد تؤثر على نضوج spliceosome والمشاركة في تعديل AS بواسطة نظام التشغيل.
Protocol
ملاحظة: الدروس سهلة الاستخدام متوفرة على موقع أيسي http://icy.bioimageanalysis.org.
1. تحميل الجليدية وبروتوكول محلل تحت البنية
- تحميل الجليدية من موقع على شبكة الإنترنت الجليدية (http://icy.bioimageanalysis.org/download) وتحميل بروتوكول محلل الهيكل الفرعي : http://icy.bioimageanalysis.org/protocols?sort=latest.
ملاحظة: إذا كان استخدام نظام تشغيل 64 بت، تأكد من استخدام إصدار 64 بت من Java. هذا الإصدار يسمح لزيادة الذاكرة المخصصة للCy (تفضيلات| عام | أقصى الذاكرة).
2- فتح البروتوكول
- افتح Icy وانقر على أدوات في قائمة الشريط.
- انقر فوق البروتوكولات لفتح واجهة محرر البروتوكولات.
- انقر فوق تحميل وفتح بروتوكول محلل البنية الفرعية. يمكن أن يستغرق تحميل البروتوكول بضع ثوانٍ. تأكد من أن فتح البروتوكول قد اكتمل قبل استخدامه.
ملاحظة: يتكون سير العمل من 13 كتل عامة معروضة في الشكل 2a. يعمل كل كتلة كـ خط أنابيب يتكون من عدة مربعات تنفيذ المهام الفرعية معينة.
3. التفاعل مع سير العمل على الجليدية
ملاحظة: كل كتلة أو مربع هو ترقيم ولها رتبة محددة ضمن سير العمل(الشكل 2b). بالنقر على هذا الرقم، يتم تعيين أقرب موقف ممكن إلى الأول إلى كتلة / مربع المحدد ثم يتم إعادة تنظيم موقف كتل أخرى / مربعات. احترام الترتيب الصحيح للقوالب عند إعداد سير العمل. على سبيل المثال، كتلة Spot Detector تحتاج إلى ROIs محددة مسبقاً بحيث يجب تشغيل كتل التجزئة قبل كتل Spot Detector. لا تقم بتعديل موضع مربعات. لا تستخدم "." في اسم الصورة.
- بالنقر على رمز الزاوية اليسرى العليا، طي، توسيع، تكبير، ضيق، أو إزالة كتلة(الشكل 2b).
- يتميز كل خط أنابيب من سير العمل بشبكة من مربعات متصلة عن طريق المدخلات والمخرجات(الشكل 2b). لإنشاء اتصال، انقر فوق الإخراج والاحتفاظ بها حتى يصل المؤشر إلى إدخال. يمكن إزالة الاتصالات بالنقر على علامة الإخراج.
4. دمج قنوات صورة
- استخدم كتلة "قنوات دمج" لإنشاء الصور المدمجة. إذا لزم الأمر، أعد تسمية الملفات بحيث يكون التسلسلات التي سيتم دمجها البادئة نفس الاسم متبوعاً بفاصل مميز. على سبيل المثال، يتم تسمية تسلسلات القنوات الفردية من الصورة A: ImageA_red، ImageA_blue.
ملاحظة: للفاصل، لا تستخدم الأحرف الموجودة مسبقاً في اسم الصورة. - في نفس المجلد، قم بإنشاء مجلد جديد واحد لكل قناة لدمج. على سبيل المثال، لدمج القنوات الحمراء والأخضرة والزرقاء، قم بإنشاء 3 مجلدات، ثم قم بتخزين التسلسلات المطابقة في هذه المجلدات.
- استخدم فقط قنوات دمجالكتلة وإزالة الكتل الأخرى وحفظ البروتوكول كقنوات دمج.
- الوصول إلى المربعات لتعيين المعلمات. لكل قناة، قم بتعبئة المربعات رقم القناة X (مربعات 1، 5 أو 9)، رقم قناة المجلد X (مربعات 2، 6 أو 10)، رقم قناة الفاصل X (مربعات 3، 7 أو 11) وقناة خريطة اللون 0 (مربعات 4 و 8 و 12) على التوالي.
ملاحظة: يتم تجميع هذه المربعات أفقياً بواسطة أربعة، كل سطر المقابلة إلى نفس القناة. في كل سطر، يتوفر العرض أيضاً (مربعات 23 أو 24 أو 25) لتصور تسلسل القناة المقابلة بشكل مباشر.- في المربع رقم القناة X، اختر القناة التي تريد استخراجها (في صور RGB الكلاسيكية، 0=الأحمر، 1=الأخضر، 2= أزرق). المستخدم بسرعة الوصول إلى قنوات مختلفة من صورة ضمن إطار المفتش من الجليدية، في علامة التبويب تسلسل. اكتب أصغر قيمة القناة في السطر العلوي وأعلى واحد في السطر السفلي.
- في المربع رقم قناة المجلد X، اكتب \Name المجلد الذي يحتوي على صور للقناة X.
- في المربع رقم قناة الفاصل س، اكتب الفاصل المستخدم لاسم الصورة (في المثال السابق: "_red" و "_green" و "_blue").
- في مربع قناة Colormap س ،تشير مع عدد نموذج colormap لاستخدامها لتصور القناة المقابلة في الجليدية. تكون ملفات الألوان المتوفرة مرئية في علامة التبويب تسلسل من نافذة المفتش.
- في مربع تنسيق الصور المدمجة (المربع 28)، اكتب الملحق لحفظ الصور المدمجة: .tif أو .gif أو .jpg أو .bmp أو .png.
ملاحظة: لدمج قنوات 2 فقط، لا تقم بتعبئة المربعات الأربعة المطابقة للقناة الثالثة.
- في الزاوية اليسرى العليا من كتلة دمج القنوات، انقر على الرابط مباشرة إلى يمين المجلد. في مربع الحوار فتح الذي يظهر، انقر نقراً مزدوجاً فوق المجلد الذي يحتوي على تسلسلات القناة الأولى التي تم تعريفها في المربع رقم قناة المجلد 1 (المربع 2). ثم، انقر على فتح.
- تشغيل البروتوكول بالنقر فوق السهم الأسود في الزاوية اليسرى العليا من كتلة "قنوات دمج" (انظر الجزء 7 للحصول على مزيد من التفاصيل). يتم حفظ الصور المدمجة في مجلد دمج في نفس الدليل كمجلدات القنوات الفردية.
- الوصول إلى المربعات لتعيين المعلمات. لكل قناة، قم بتعبئة المربعات رقم القناة X (مربعات 1، 5 أو 9)، رقم قناة المجلد X (مربعات 2، 6 أو 10)، رقم قناة الفاصل X (مربعات 3، 7 أو 11) وقناة خريطة اللون 0 (مربعات 4 و 8 و 12) على التوالي.
5- تجزئة المناطق ذات الأهمية
ملاحظة: محلل البنية الفرعية يدمج كلاً من الخوارزميات البسيطة والأكثر تطوراً لاقتراح بدائل مختلفة تتكيف مع تعقيد الصورة واحتياجات المستخدم.
- حدد الكتلة المتكيفة.
- إذا لم يتم لمس الكائنات بعضها البعض أو لا يحتاج المستخدم إلى تمييز الكائنات متفاوتة المسافات بشكل فردي، استخدم كتلة تجزئة A: كائنات متفاوتة المسافات.
- عندما لا تلمس الكائنات بعضها البعض، ولكن بعضها قريب، استخدم كتلة تجزئة B: الكائنات متفاوتة المسافات.
- للكائنات ذات مستوى التكتل العالي وشكل محدب، استخدم كتلة تجزئة C: كائنات متفاوتة المسافات ذات أشكال محدبة.
- إذا كانت الكائنات تقدم مستوى تجميع عالي ولها أشكال غير منتظمة، استخدم كتلة التجزئة D: كائنات متفاوتة المسافات ذات أشكال غير منتظمة.
- استخدام كتلة التجزئة E: السيتوبلازم متفاوت المسافات لشريحة لمس السيتوبلازم بشكل فردي باستخدام نوات مجزأة كعلامات. هذه الكتلة تحتاج حتما نوى مجزأة لمعالجة.
ملاحظة: كتل تكييفها لعملية تجزئة الكائن الأساسي بشكل مستقل بحيث يمكن استخدام عدة كتل في نفس التشغيل لمقارنة كفاءتها لبنية فرعية معينة أو إلى تقسيم أنواع مختلفة من الهياكل الفرعية. إذا كان مستوى التجميع غير متجانس داخل نفس مجموعة الصور، ثم معالجة الكائنات الصغيرة و شديدة المسافات بشكل منفصل في كتل متكيفة.
- ربط الإخراج0 (ملف) كتلة تحديد مجلد لإدخال المجلد من كتلة التجزئة المختارة.
- تعيين معلمات كتلة التجزئة المختارة.
- تجزئة A: كائنات غير متفاوتة المسافات و C تجزئة: كائنات متفاوتة المسافات مع أشكال محدبة
- في إشارة قناة مربع (المربع 1)، تعيين قناة الكائنات إلى قطعة.
- كخيار، في مربع مرشح غاوسي (المربع 2) ، زيادة قيم س و ص سيغما إذا كانت الإشارة داخل الكائنات غير متجانسة. ينعم مرشح الغاوسي القوام للحصول على مناطق أكثر تناسقًا ويزيد من سرعة وكفاءة تجزئة النوى. أصغر الكائنات، أقل قيمة سيجما. تجنب قيم سيغما عالية. تعيين القيم الافتراضية إلى 0.
- في المربع HK-Means (المربع 3) ، تعيين المعلمة فئات الكثافة والحد الأدنى التقريبي والحد الأقصى للأحجام (بالبكسل) من الكائنات التي سيتم الكشف عنها.
ملاحظة: بالنسبة لفئات الكثافة، تصنّف قيمة 2 البيكسلات في فئتين: الخلفية والمقدمة. وهكذا يتم تكييفها عندما يكون التباين بين الكائنات والخلفية مرتفعًا. إذا كان الكائنات الأمامية لها كثافة مختلفة أو إذا كان التباين مع الخلفية منخفضًا، قم بزيادة عدد الفئات. الإعداد الافتراضي هو 2. يمكن تقييم حجم الكائن بسرعة عن طريق رسم عائد الاستثمار يدويا حول الكائن من الفائدة. حجم العائد على الاستثمار (الداخلية بالبكسل) يظهر مباشرة على الصورة عند الإشارة إليها مع المؤشر أو يمكن الوصول إليها في إطار إحصاءات ROI (فتحه من شريط البحث). معلمات الأمثل الكشف عن كل كائن المقدمة في عائد الاستثمارواحد. يمكن تعريفها يدويا في الجليدية(الكشف والتتبع | هونج كونج - الوسائل). - في المربع "محيطات النشطة" (المربع 4) ، وتحسين الكشف عن حدود الكائن. وثائق شاملة لهذا البرنامج المساعد متاح على الانترنت: http://icy.bioimageanalysis.org/plugin/Active_Contours. يمكن أيضاً تعريف المعلمات الصحيحة يدوياً في الجليدية(الكشف والتتبع | Active Contours).
- أثناء العملية، يتم إنشاء مجلد تلقائياً لحفظ صور الكائنات المجزأة. في المربع نص (المربع 6) ، اسم هذا المجلد (على: على شكل جزائح nuclei). لتعيين تنسيق لحفظ صور الكائنات المجزأة (Tiff، Gif، Jpeg، BMP، PNG)، قم بتعبئة تنسيق مربع صور الكائنات المجزأة. يتم إنشاء المجلد في المجلد الذي يحتوي على الصور المدمجة.
- تشغيل سير العمل (للحصول على التفاصيل، راجع الجزء 7).
- تجزئة B: كائنات متفاوتة المسافات
- اتبع نفس الخطوات كما في 5.3.1 لتعيين معلمات مربعات إشارة قناة، HK-يعني، Active Contours، Extension لحفظ الكائنات المجزأة والنص (صفوف مربعات ليست هي نفسها كما في الخطوة 5.3.1).
- في المربع استدعاء IJ المساعد (المربع 4) ، تعيين المعلمة المتداول للتحكم في طرح الخلفية. تعيين هذه المعلمة على الأقل حجم الكائن الأكبر الذي ليس جزءاً من الخلفية. إن تقليل هذه القيمة يزيد من إزالة الخلفية ولكن يمكن أن يؤدي أيضاً إلى فقدان إشارة المقدمة.
- في المربع معادلة الرسم البياني التكيفي (المربع 6)، تحسين التباينات بين الكائنات الأمامية والخلفية. زيادة المنحدر يعطي تسلسلات أكثر تباينا.
- تشغيل سير العمل (للحصول على التفاصيل، راجع الجزء 7).
- تجزئة D: كائنات متفاوتة المسافات ذات أشكال غير منتظمة
ملاحظة: ثلاث طرق مختلفة للتجزئة تنطبق على كل صورة: أولاً،HK-يعني التجمعجنبا إلى جنب معأسلوب "الكنتوري" النشطيتم تطبيق. ثم،خوارزمية مستجمعات المياه الكلاسيكية(باستخدام مخطط المسافة الإقليديان) يتم تطبيقه على الكائنات التي تم تقسيمها بشكل خاطئ في السابق. وأخيراً،خوارزمية مستجمعات المياه القائمة على العلامةيتم استخدام. فقط وسائل HK- وطرق مستجمعات المياه القائمة على العلامات تحتاج إلى تدخل المستخدم. لكل من الأسلوبين، يمكن تطبيق نفس المعلمات على جميع الصور (النسخة المؤتمتة بالكامل) أو يمكن تغييرها لكل صورة (نسخة شبه آلية). إذا لم يتم تدريب المستخدم على أساليب التجزئة هذه، يوصى بشدة بمعالجة شبه تلقائية. وأثناء معالجة هذه الكتلة، هناك حاجة إلى التدخل اليدوي. عند الانتهاء من أسلوب تجزئة يجب على المستخدم إزالة الكائنات غير المجزأة يدوياً قبل بداية أسلوب التجزئة التالي. يتم حفظ الكائنات المجزأة بنجاح ولا يتم اعتبارها في الخطوة التالية(الخطوات). يجب أن تكون هذه الكتلة متصلة باللكتلكتلة/غير متجانسة الأشكال الأساسية الكائنات مربع الحوار تجزئةللعمل بشكل صحيح.- تحميل مجموعة ImageJ MorphoLibJ على https://github.com/ijpb/MorphoLibJ/releases. يتم استخدام الإصدار 1.4.0 MorphoLibJ في هذا البروتوكول. وضع الملف MorphoLibJ_-1.4.0.jar في المجلد الجليدي / ij / الإضافات. يتوفر مزيد من المعلومات حول محتوى هذه المجموعة على https://imagej.net/MorphoLibJ.
- اتبع نفس الخطوات كما في الخطوة 5.3.1 لتعيين معلمات مربعات إشارة القناة، مرشح غاوسيان، Active Contours، Extension لحفظ الكائنات المجزأة والنص. صفوف مربعات ليست هي نفسها كما هو في الخطوة 5.3.1.
- تعيين معلمات مربع معادلة الرسم البياني التكيفي (راجع الخطوة 5.3.2.3).
- لتنشيط اطرح الخلفية، اكتب نعم في تطبيق طرح الخلفية؟ (المربع 5). وإلا، اكتب لا. إذا تم تنشيط المكون الإضافي، قم بتعيين المعلمة المتداولة (انظر الخطوة 5.3.2) في المربع اطرح المعلمة الخلفية (المربع 7).
- أتمتة من ال [هك-سّي]: لتطبيق نفس المعلمات لكافة الصور (معالجة مؤتمتة بالكامل) ، تعيين Nb من الفئات (المربع 11) ، الحد الأدنى للحجم (المربع 12) ، والحد الأقصى للحجم (box13) (انظر الخطوة 5.3.1). يجب تعيين هذه المعلمات لتحديد الحد أقصى من بكسل المقدمة وتحسين إضفاء الطابع الفردي للكائنات الأمامية. بالنسبة لإصدار المعالجة شبه المؤتمتة، لا يلزم التدخل.
- أتمتة عمليات استخراج العلامة: للنسخة المؤتمتة بالكامل، قم بتوسيع مربع استخراج علامات داخلية (المربع 27) وتعيين قيمة المعلمة "الديناميكية" في السطر 13 من البرنامج النصي. بالنسبة لإصدار المعالجة شبه المؤتمتة، لا يلزم التدخل.
ملاحظة: يتم استخراج علامات بواسطة تطبيق تحويل minima الموسعة على صورة إدخال التي تسيطر عليها معلمة "ديناميكية". في خوارزمية مستجمعات المياه المستندة إلى العلامة، يتم محاكاة الفيضانات من هذه العلامات لتنفيذ تجزئة الكائن. لتجزئة ناجحة من الكائنات الأمامية، يجب استخراج علامة واحدة لكل كائن المقدمة. إعداد المعلمة "ديناميكية" لاستخراج علامات الأمثل يعتمد في الغالب على دقة الصور. وهكذا، إذا لم تكن مألوفة مع هذه المعلمة، استخدم النسخة شبه المؤتمتة. - تشغيل سير العمل (للحصول على التفاصيل، راجع الجزء 7).
- في بداية المعالجة، مربعات الحوار المعلمات HK-يعني ومستجمعات المياه القائم على علامة فتح على التوالي. لتطبيق نفس المعلمات لجميع الصور (نسخة مؤتمتة بالكامل)، انقر على نعم. خلاف ذلك، انقر على NO. يفتح مربع المعلومات ، طالبا "تحديد أفضل ROIs مع HK -يعني البرنامج المساعد وصورة وثيقة". انقر على موافق وتطبيق يدويا HK-يعني البرنامج المساعد(الكشف والتتبع| HK-Means) على الصورة، التي تفتح تلقائيا. حدد الخيار تصدير ROIs في المربع البرنامج المساعد HK-Means. تطبيق أفضل المعلمات لجعل ROIs يحتوي على الحد أقصى من بكسل المقدمة وتحسين إضفاء الطابع الفردية للكائنات الأمامية. عندما يتم العثور على أفضل ROIs، أغلق الصورة مباشرة.
- في نهاية أسلوب التجزئة الأول، يفتح مربع معلومات ويطلب "إزالة ROIs غير المرغوب فيها وإغلاق الصورة". تتوافق هذه ROIs إلى حدود الكائنات المجزأة. حدد موافق وإزالة ROIs من الكائنات غير المجزأة في الصورة، والتي تفتح تلقائياً. يمكن إزالة عائد الاستثمار بسهولة عن طريق وضع المؤشر على حدوده واستخدام زر "حذف" من لوحة المفاتيح. أغلق الصورة. كرر نفس الإجراء بعد إكمال الخطوة تجزئة الثاني.
- في هذه المرحلة، إذا تم اختيار زر نعم لأتمتة الكامل من خوارزمية مستجمعات المياه القائمة على علامة، سيتم تطبيق المعلمات التي تم تعيينها سابقا على جميع الصور.
- إذا تم تحديد الزر NO، يتم فتح مربع معلومات، وطلب "تحديد العلامات الداخلية وضبطها". انقر على موافق وضمن واجهة ImageJ من الجليدية، انتقل إلى الإضافات | مورفورليبج | مينيما وماسمكا| الحد الأدنى والمُوسع. في العملية، حدد الموسع Minima.
- حدد معاينة لتصور مسبق على الصورة المفتوحة تلقائيًا نتيجة التحويل. نقل ديناميكية حتى يتم ملاحظة علامات الأمثل. العلامات هي مجموعات من وحدات البكسل بقيمة 255 (ليس بالضرورة بكسل أبيض). المعلمات المثلى تؤدي إلى علامة واحدة لكل كائن. التركيز على الكائنات المتبقية التي لم يتم تقسيم بشكل جيد مع أساليب التجزئة السابقتين.
- إذا لزم الأمر، تحسين علامات من خلال تطبيق عمليات مورفولوجية إضافية مثل "فتح" أو "إغلاق"(الإضافات | مورفورليبج | مرشحات مورفولوجية). عند الحصول على الصورة النهائية للعلامات ، والحفاظ على فتح وإغلاق جميع الصور الأخرى التي تنتهي مع الصورة المستخدمة في البداية كمدخل لعملية Minima الموسعة. انقر على لا إذا كان مربع ImageJ يطلب حفظ التغييرات على هذه الصورة.
- في المربع Nb الصور مع مربع المعلومات (المربع 14)، تحديد عدد الصور مع مربعات المعلومات يجب أن تظهر.
- تجزئة E: السيتوبلازم المتجمع
ملاحظة: تستخدم هذه الكتلة النوى المجزأة سابقاً كعلامات فردية لبدء تجزئة السيتوبلازم. تأكد من أن كتلة من تجزئة النوى قد تمت معالجتها قبل استخدامه.- في مربع قناة السيتوبلازم (المربع 1)، تعيين قناة إشارة السيتوبلازمية.
- في المربع تمديد النوى مجزأة (مربع 2)، وكتابة الشكل المستخدم لحفظ الصور من النوى مجزأة (tif، jpeg، bmp، png). التنسيق الافتراضي هو tif.
- في المربع Text (box3) ، اكتب \Name المجلد الذي يحتوي على نُوى مجزأة.
- في مربع تنسيق الصور من السيتوبلازمات المجزأة (المربع 4)، تعيين تنسيق لاستخدامها لحفظ الكائنات مجزأة الصور (تيف، جيف، Jpeg، BMP، بابوا نيو غينيا).
- أثناء العملية، يتم إنشاء مجلد تلقائيا لحفظ الصور من السيتوبلازمات المجزأة. في المربع نص (المربع 5) ، اسم هذا المجلد (على: cytoplasms مجزأة). يتم إنشاء المجلد في المجلد الذي يحتوي على الصور المدمجة.
- اتبع نفس الخطوات كما في الخطوة 5.3.1 لتعيين معلمات مربعات تصفية جاوسي و Contours النشطة (كن حذراً، صفوف مربع ليست هي نفسها كما في الخطوة 5.3.1).
- تشغيل سير العمل (للحصول على التفاصيل، راجع الجزء 7).
- تجزئة A: كائنات غير متفاوتة المسافات و C تجزئة: كائنات متفاوتة المسافات مع أشكال محدبة
6- الكشف عن الإشارات الفلورية وتحليلها
- حدد الكتلة المتكيفة.
- في كتلة تحليل Fluorescence A: 1 قناة، تنفيذ الكشف عن وتحليل بؤر في قناة واحدة داخل نوع واحد من كائن مجزأة: الكشف عن foci اللفائف (قناة حمراء) داخل النواة.
- في كتلة التحليل Fluorescence B: 2 قنوات في نفس المقصورة،وإجراء الكشف وتحليل بؤر في قناتين داخل نوع واحد من كائن مجزأة: الكشف عن ملفين (قناة حمراء) و 53BP1 (القناة الخضراء) بؤر داخل النواة.
- في كتلة التحليل Fluorescence C: 2 قنوات في مقصورتين، تنفيذ الكشف عن وتحليل البؤر في قناة واحدة أو قناتين ، وتحديدا داخل النوى والسيتوبلازم المقابلة لها : الكشف عن فوبين foci (القناة الحمراء) سواء داخل النواة وcytoplasm المقابلة لها أو الكشف عن foci Coilin (القناة الحمراء) داخل النواة وG3BPoci (القناة الخضراء) داخل cytoplasm المقابلة.
- في الكتلة التحليل الفلوري D: النقل العالمي، حساب النسبة المئوية للإشارة من قناة واحدة في مقصورتين خلويتين (أ و ب). على سبيل المثال، في فحص نقل السيتوبلازم/النواة، يتم تصدير نسب مئوية محسوبة من الإشارات النووية والإشارات السيتوبلازمية لكل صورة في جدول البيانات النهائي "النتائج". وترد أدناه الصيغة المستخدمة لحساب النسبة المئوية للإشارة النووية. يمكن استخدام هذا الجزء لأي حجرة فرعية:
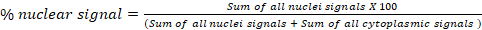
- في الكتلة التحليل الفلوري E: نقل الخلية الفردية، حساب النسبة المئوية للإشارة من قناة واحدة في مقصورتين خلويتين لكل خلية. تم تحسين هذه الكتلة خصيصًا لم مقايسة نقل النواة/السيتوبلازم على مستوى الخلية الواحدة.
ملاحظة: لأن كتلة تحليل Fluorescence E: فردي الخلية النقل ينفذ التحليل على مستوى خلية واحدة، وهناك حاجة إلى تجزئة فعالة من النواة والسيتوبلازم.
- ربط الإخراج0 (ملف) من كتلة حدد مجلد (كتلة 1) لإدخال المجلد (الأسهم البيضاء في الدوائر السوداء) من كتلة المختارة.
- تعيين معلمات الكتلة المختارة.
- تحليل الفلوريسنس A: قناة واحدة، تحليل الفلوريسنس B: قناتان في نفس المقصورة وتحليل الفلوريسنس C: قناتان في مقصورتين
- في مربع مجلد صور ROI، اكتب اسم المجلد الذي يحتوي على صور الكائنات المجزأة مسبوقة مائلة. (على سبيل المثال: \جزئي النوى).
- في مربع تنسيق صور الكائنات المجزأة (المربع 2) ، اكتب التنسيق المستخدم لحفظ صور الكائنات المجزأة (tif ، jpeg ، bmp ، png). التنسيق الافتراضي هو tif.
- في المربع "قتل الحدود"؟، اكتب نعم لإزالة الكائنات الحدودية. وإلا، اكتب لا. مطلوب تثبيت مجموعة MorphoLibJ من ImageJ لاستخدام هذه الدالة (راجع الخطوة 5.3.3).
- في مربع (es) قناة البقع إشارة، تعيين القناة حيث يجب الكشف عن البقع. في صور RGB الكلاسيكية، 0=أحمر، 1= أخضر، و 2= أزرق.
- في المربعات اسم جزيء مترجمة، وكتابة اسم جزيء المترجمة إلى البقع. يعتمد عدد الحقول التي يجب إدخالها على عدد الجزيئات.
- في المربع (es) كتلة الكشف عن بقعة الموجي، تعيين معلمات الكشف عن بقعة لكل قناة. تعيين مقياس (ق) (المشار إليها إلى حجم بقعة)، وحساسية الكشف (حساسية أصغر يقلل عدد البقع المكتشفة، والقيمة الافتراضية هي 100 والحد الأدنى للقيمة يجري 0). وثائق شاملة من هذا البرنامج المساعد متاح على الانترنت: http://icy.bioimageanalysis.org/plugin/Spot_Detector. يمكن أيضا أن تكون المعلمات يدويا في تعريف الجليدية(الكشف والتتبع | بقعة كاشف).
- كخيار، في المربع تصفية العائد على الاستثمار حسب الحجم، تصفية الكائنات المجزأة حيث يتم الكشف عن البقع عن طريق تعيين فاصل زمني للحجم (بالبكسل). هذه الخطوة مفيدة بشكل خاص لإزالة الكائنات تحت أو أكثر من مجزأة. لتقدير حجم الكائنات يدوياً، راجع الخطوة 5.3.1. لا تتضمن المعلمات الافتراضية تصفية ROIs حسب الحجم. تحتوي القناتان 2 في مقصورتين على صندوقين: نُوَيّة الترشيح حسب الحجم (المربع 19) وتصفية السيتوبلازم حسب الحجم (الإطار 46).
- اختياريا، في مربع تصفية البقع حسب الحجم،تصفية البقع المكتشفة وفقا لحجمها (بالبكسل) لإزالة القطع الأثرية غير المرغوب فيها. لتقدير حجم البقعة يدويًا، انقر على الاكتشاف والتتبع وافتح المكوّن الإضافي للكشف عن Spot. في خيارات الإخراج، حدد تصدير إلى عائد الاستثمار . كن حذراً أن المعلمات الافتراضية لا تتضمن تصفية البقع حسب الحجم، وأن البقع المصفاة لا تؤخذ في الاعتبار للتحليل. يعتمد عدد الحقول التي يتم إدخالها على عدد القنوات.
- اختياريا، في المربع تصفية البقع،وتطبيق مرشح إضافي (التباين، التجانس، محيط، استدارة) على البقع الكشف عنها. كن حذراً أن المعلمات الافتراضية لا تتضمن تصفية بقعة وأن البقع المصفاة لا تؤخذ في الاعتبار للتحليل. يعتمد عدد الحقول التي يتم إدخالها على عدد القنوات.
- اختياريا، في المربعات عتبة حجم بقعة، تعيين عتبة للمنطقة (بالبكسل) من البقع المحللة. يتم تصدير عدد النقاط التي تم عدها أسفل هذه العتبة وفوقها في جدول بيانات النتائج النهائي. يعتمد عدد الصناديق التي سيتم إبلاغها على عدد القنوات.
- تشغيل سير العمل (للحصول على التفاصيل، راجع الجزء 7). يتم تصدير البيانات في جدول بيانات نتائج محفوظ في المجلد الذي يحتوي على صور مدمجة.
- تحليل الفلورس D: النقل العالمي وتحليل الفلوريسين E: نقل الخلية الفردية:
- في المربعات صور المجلد (المربعين 1 و 2) ، اكتب \Name المجلد الذي يحتوي على صور الكائنات المجزأة. في الكتلة التحليل Fluorescence D: النقل العالمي، يتم تحديد نوعي عائد الاستثمار على أن عائد الاستثمار (ROI a) و ROI b. للكتلة تحليل Fluorescence E: نقل الخلية الفردية، في صور المجلدات ينجز نواة و مجلد صور cytoplasms صناديق مجزأة، وكتابة اسم المجلد الذي يحتوي على نوى مجزأة والسيتوبلازم، على التوالي.
- في مربع إشارة القناة (المربع 3)، أدخل قناة الإشارة.
- في مربع تنسيق الصور من الكائنات مجزأة (مربع 4) ، وكتابة تنسيق المستخدمة لحفظ الصور من الكائنات مجزأة (tif ، jpeg ، bmp ، بابوا غينيا الجديدة). التنسيق الافتراضي هو tif. يتوفر الخيار "حدود القتل" أيضاً لإزالة الكائنات حد (راجع الخطوة 6.3.1).
- اختياريا، في مربعات تصفية العائد على الاستثمار حسب الحجم، تصفية الكائنات مجزأة عن طريق تعيين فاصل زمني من الحجم (بالبكسل). قد تكون هذه الخطوة مفيدة لإزالة الكائنات تحت أو أكثر من تجزئة. لتقدير حجم الكائن يدوياً، راجع الخطوة 5.3.1. هناك حقلان للدخول، واحد لكل قناة. لا تتضمن المعلمات الافتراضية تصفية عائد الاستثمار حسب الحجم.
- تشغيل سير العمل (للحصول على التفاصيل، راجع الجزء 7). تصدير البيانات في جدول بيانات نتائج محفوظة في المجلد الذي يحتوي على الصور المدمجة.
- تحليل الفلوريسنس A: قناة واحدة، تحليل الفلوريسنس B: قناتان في نفس المقصورة وتحليل الفلوريسنس C: قناتان في مقصورتين
7. تشغيل البروتوكول
- لمعالجة كتلة واحدة في تشغيل، قم بإزالة الاتصال بين الكتلة المحددة و "مجلد تحديد الكتلة". ضع كتلة المطلوبين في رتبة 1st. في الزاوية اليسرى العليا من كتلة المطلوبين، انقر على الرابط مباشرة إلى يمين المجلد. في مربع الحوار فتح الذي يظهر، انقر نقراً مزدوجاً فوق المجلد الذي يحتوي على الصور المدمجة. ثم، انقر على فتح. انقر فوق تشغيل لبدء سير العمل. يمكن إيقاف المعالجة بالنقر على الزر Stop.
- لمعالجة كتل مختلفة في تشغيل، والحفاظ على اتصالات الكتل المختارة مع كتلة حدد مجلد (كتلة 1). تأكد من أن رتبتهم تسمح بمعالجة جيدة لسير العمل. على سبيل المثال، إذا احتاج كتلة معينة إلى كائنات مجزأة لمعالجة، تأكد من أن عمليات كتلة التجزئة قبل. قبل تشغيل سير العمل، قم بإزالة الكتل غير المستخدمة وحفظ البروتوكول الجديد باسم آخر.
- انقر فوق تشغيل لبدء سير العمل. عند ظهور مربع الحوار المفتوح، انقر نقراً مزدوجاً فوق المجلد الذي يحتوي على الصور المدمجة. ثم، انقر على فتح. يتم تشغيل سير العمل تلقائيًا. إذا لزم الأمر، قم بإيقاف المعالجة بالنقر على الزر إيقاف.
- في نهاية المعالجة، تحقق من أن الرسالة التي تم تنفيذها سير العمل بنجاح ظهرت في الزاوية اليمنى السفلى وأن يتم وضع علامة على كافة الكتل بعلامة خضراء(الشكل 2b). إذا لم يكن كذلك، كتلة وداخل مربع تقديم علامة الخطأ تشير إلى عنصر لتصحيح (الشكل 2b).
ملاحظة: بعد تنفيذ سير العمل بنجاح، لا يمكن بدء تشغيل جديد مباشرةً، ولمعالجة سير العمل مرة أخرى، يجب وضع علامة على كتلة واحدة على الأقل مع علامة "جاهز للمعالجة". لتغيير حالة كتلة حذف وإعادة إنشاء ارتباط بين مربعين داخل هذا الحظر أو ببساطة إغلاق ثم إعادة فتح البروتوكول. في حالة حدوث خطأ أثناء المعالجة، يمكن بدء تشغيل جديد مباشرة. أثناء تشغيل جديد، تتم معالجة كافة كتل خط الأنابيب، حتى إذا تم وضع علامة على بعضها مع علامة خضراء.
النتائج
وقد تم تنفيذ جميع التحليلات الموصوفة على كمبيوتر محمول قياسي (معالج رباعي النواة 64 بت بسرعة 2.80 جيجاهرتز مع ذاكرة وصول عشوائي 16 جيجابايت (RAM)) يعمل مع إصدار 64 بت من Java. ذاكرة الوصول العشوائي هو معلمة هامة للنظر، اعتمادا على كمية ودقة الصور لتحليل. باستخدام نسخة 32 بت من جافا يحد من الذاكرة إلى ح...
Discussion
عدد متزايد من البرمجيات الحرة المتاحة لتحليل الصور الخلايا المفلورة. يجب على المستخدمين اختيار البرامج المناسبة بشكل صحيح وفقا لتعقيد إشكالية ، إلى معرفتهم في معالجة الصور ، والوقت الذي يريدون قضاءه في تحليلهم. الجليدية، CellProfiler، أو ImageJ / فيجي هي أدوات قوية تجمع بين قابلية الاستخدام والوظ...
Disclosures
ليس لدى أصحاب البلاغ ما يكشفون عنه.
Acknowledgements
وقد تم دعم G.H. من قبل زمالة الدراسات العليا من Ministère Délégué à la Recherche et aux Technologies. وقد تم دعمها من قبل زمالة الدراسات العليا من معهد الكانتيرولوجيا دي لورين (ICL)، في حين تم دعم Q.T. من قبل منحة عامة أشرفت عليها وكالة البحوث الوطنية الفرنسية (ANR) كجزء من "Investissements d'Avenir" برنامج FIGHT-HF (المرجع: ANR-15-RHU4570004). وقد تم تمويل هذا العمل من قبل CNRS وجامعة لورين (UMR 7365).
Materials
| Name | Company | Catalog Number | Comments |
| 16% Formaldehyde solution (w/v) methanol free | Thermo Fisher Scientific | 28908 | to fix the cells |
| Alexa Fluor 488 of goat anti-rabbit | Thermo Fisher Scientific | A-11008 | fluorescent secondary antibody |
| Alexa Fluor 555 of goat anti-mouse | Thermo Fisher Scientific | A-21425 | fluorescent secondary antibody |
| Alexa Fluor 555 Phalloidin | Thermo Fisher Scientific | A34055 | fluorescent secondary antibody |
| Bovine serum albumin standard (BSA) | euromedex | 04-100-812-E | |
| DMEM | Sigma-Aldrich | D5796-500ml | cell culture medium |
| Duolink In Situ Mounting Medium with DAPI | Sigma-Aldrich | DUO82040-5ML | mounting medium |
| Human: HeLa S3 cells | IGBMC, Strasbourg, France | cell line used to perform the experiments | |
| Hydrogen peroxide solution 30% (H2O2) | Sigma-Aldrich | H1009-100ml | used as a stressing agent |
| Lipofectamine 2000 Reagent | Thermo Fisher Scientific | 11668-019 | transfection reagent |
| Mouse monoclonal anti-coilin | abcam | ab11822 | Coilin-specific antibody |
| Nikon Optiphot-2 fluorescence microscope | Nikon | epifluoresecence microscope | |
| Opti-MEM I Reduced Serum Medium | Thermo Fisher Scientific | 31985062 | transfection medium |
| PBS pH 7.4 (10x) | gibco | 70011-036 | to wash the cells |
| Rabbit polyclonal anti-53BP1 | Thermo Fisher Scientific | PA1-16565 | 53BP1-specific antibody |
| Rabbit polyclonal anti-EDC4 | Sigma-Aldrich | SAB4200114 | EDC4-specific antibody |
| Triton X-100 | Roth | 6683 | to permeabilize the cells |
References
- Möckl, L., Lamb, D. C., Bräuchle, C. Super-resolved fluorescence microscopy: Nobel Prize in Chemistry 2014 for Eric Betzig, Stefan Hell, and William E. Moerner. Angewandte Chemie. 53 (51), 13972-13977 (2014).
- Meijering, E., Carpenter, A. E., Peng, H., Hamprecht, F. A., Olivo-Marin, J. -. C. Imagining the future of bioimage analysis. Nature Biotechnology. 34 (12), 1250-1255 (2016).
- Wiesmann, V., Franz, D., Held, C., Münzenmayer, C., Palmisano, R., Wittenberg, T. Review of free software tools for image analysis of fluorescence cell micrographs. Journal of Microscopy. 257 (1), 39-53 (2015).
- de Chaumont, F., et al. Icy: an open bioimage informatics platform for extended reproducible research. Nature Methods. 9 (7), 690-696 (2012).
- Girish, V., Vijayalakshmi, A. Affordable image analysis using NIH Image/ImageJ. Indian J Cancer. 41 (1), 47 (2004).
- Zaitoun, N. M., Aqel, M. J. Survey on image segmentation techniques. Procedia Computer Science. 65, 797-806 (2015).
- . MetaMorph Microscopy Automation and Image Analysis Software Available from: https://www.moleculardevices.com/products/cellular-imaging-systems/acquisition-and-analysis-software/metamorph-microscopy (2018)
- . NIS-Elements Imaging Software Available from: https://www.nikon.com/products/microscope-solutions/lineup/img_soft/nis-element (2014)
- Meyer, F., Beucher, S. Morphological segmentation. Journal of Visual Communication and Image Representation. 1 (1), 21-46 (1990).
- Schieber, M., Chandel, N. S. ROS Function in Redox Signaling and Oxidative Stress. Current Biology. 24 (10), 453-462 (2014).
- D'Autréaux, B., Toledano, M. B. ROS as signalling molecules: mechanisms that generate specificity in ROS homeostasis. Nature Reviews. Molecular Cell Biology. 8 (10), 813-824 (2007).
- Davalli, P., Mitic, T., Caporali, A., Lauriola, A., D'Arca, D. ROS, Cell Senescence, and Novel Molecular Mechanisms in Aging and Age-Related Diseases. Oxidative Medicine and Cellular Longevity. 2016, 3565127 (2016).
- Disher, K., Skandalis, A. Evidence of the modulation of mRNA splicing fidelity in humans by oxidative stress and p53. Genome. 50 (10), 946-953 (2007).
- Takeo, K., et al. Oxidative stress-induced alternative splicing of transformer 2β (SFRS10) and CD44 pre-mRNAs in gastric epithelial cells. American Journal of Physiology - Cell Physiology. 297 (2), 330-338 (2009).
- Seo, J., et al. Oxidative Stress Triggers Body-Wide Skipping of Multiple Exons of the Spinal Muscular Atrophy Gene. PLOS ONE. 11 (4), 0154390 (2016).
- Will, C. L., Luhrmann, R. Spliceosome Structure and Function. Cold Spring Harbor Perspectives in Biology. 3 (7), 003707 (2011).
- Ljosa, V., Sokolnicki, K. L., Carpenter, A. E. Annotated high-throughput microscopy image sets for validation. Nature Methods. 9 (7), 637-637 (2012).
- Wang, Q., et al. Cajal bodies are linked to genome conformation. Nature Communications. 7, (2016).
- Carpenter, A. E., et al. CellProfiler: image analysis software for identifying and quantifying cell phenotypes. Genome Biology. 7, 100 (2006).
- McQuin, C., et al. CellProfiler 3.0: Next-generation image processing for biology. PLoS Biology. 16 (7), 2005970 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved