Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Methods Article
Анализатор подструктуры: удобный для пользователя рабочий процесс для быстрого исследования и точного анализа клеточных тел в флуоресценции Микроскопия изображения
В этой статье
Резюме
Мы представляем свободно доступный рабочий процесс, построенный для быстрого исследования и точного анализа клеточных тел в конкретных клеточных отсеках в изображениях флуоресценции микроскопии. Этот удобный рабочий процесс разработан на программном обеспечении с открытым исходным кодом Icy, а также использует функции ImageJ. Трубопровод доступен без знания в анализе изображений.
Аннотация
Последнее десятилетие характеризовалось прорывами в методах флуоресценции микроскопии, иллюстрируемых улучшением пространственного разрешения, а также в методах визуализации живых клеток и высокопроизводительной микроскопии. Это привело к постоянному увеличению количества и сложности данных микроскопии для одного эксперимента. Поскольку ручной анализ данных микроскопии занимает очень много времени, субъективен и запрещает количественный анализ, автоматизация анализа биоизображений становится почти неизбежной. Мы создали информационный рабочий процесс под названием Substructure Analyzer, чтобы полностью автоматизировать анализ сигналов в биоизображениях из флуоресцентной микроскопии. Этот рабочий процесс разработан на удобной для пользователя платформе с открытым исходным кодом Icy и завершается функциональными работами от ImageJ. Она включает в себя предварительную обработку изображений для улучшения соотношения сигнала к шуму, индивидуальную сегментацию клеток (обнаружение границ клеток) и обнаружение/количественное число тел клеток, обогащенных определенными отсеками клеток. Основным преимуществом этого рабочего процесса является предложение сложных функций биовизионства пользователям без опыта анализа изображений через удобный интерфейс. Кроме того, он является высоко модульным и адаптирован к нескольким вопросам от характеристики ядерного/цитоплазмического транслокации до сравнительного анализа различных клеточных тел в различных клеточных подструктурах. Функциональность этого рабочего процесса иллюстрируется в ходе изучения Cajal (спиральный) органов в условиях окислительного стресса (ОС). Данные флуоресценции микроскопии показывают, что их целостность в клетках человека влияет через несколько часов после индукции ОС. Этот эффект характеризуется уменьшением ядра катина в характерные Каджаальные тела, связанное с нуклеоплазматическим перераспределением катина в увеличенное число меньших очагов. Центральная роль катушкина в обмене между компонентами CB и окружающей нуклеоплазмой предполагает, что индуцированное распространение катушки может повлиять на состав и функциональность Cajal Bodies.
Введение
Легкая микроскопия и, в частности, флуоресценция микроскопии являются надежными и универсальными методами, обычно используемыми в биологических науках. Они дают доступ к точной локализации различных биомолекул, таких как белки или РНК, через их специфическую флуоресцентную маркировку. Последнее десятилетие характеризовалось быстрыми достижениями в области микроскопии и технологий визуализации, о чем свидетельствует Нобелевская премия по химии 2014 года, присужденная Эрику Бетцигу, Стефану У. Аду и Уильяму Е. Мёрнеру за разработку суперрешенной флуоресценции микроскопии (SRFM)1. SFRM обходит предел дифракции традиционной оптической микроскопии, чтобы привести его в наноимень. Улучшение таких методов, как live-imaging или подходы к скринингу высокой пропускной способности, также увеличивает количество и сложность данных для лечения каждого эксперимента. Большую часть времени исследователи сталкиваются с высокой неоднородной популяции клеток и хотят анализировать фенотипы на одноклеточном уровне.
Первоначально, анализы, такие как подсчет очагов были выполнены глазом, который предпочитается некоторыми исследователями, поскольку он обеспечивает полный визуальный контроль над процессом подсчета. Тем не менее, ручной анализ таких данных является слишком трудоемким, приводит к изменчивости между наблюдателями, и не дает доступа к более сложным функциям, так что компьютерные подходы становятся широко используемыми и почтинеизбежными 2. Методы информатизации bioimage существенно повышают эффективность анализа данных и свободны от неизбежной субъективности оператора и потенциальной предвзятости ручного анализа подсчета. Повышенный спрос в этой области и совершенствование вычислительной мощности привели к разработке большого количества платформ анализа изображений. Некоторые из них находятся в свободном доступе и предоставляют доступ к различным инструментам для проведения анализа с помощью персональных компьютеров. Классификация инструментов открытого доступа была недавно создана3 и представляет Icy4 как мощное программное обеспечение, сочетающее удобство использования и функциональность. Кроме того, Icy имеет преимущество общения с ImageJ.
Для пользователей без экспертизы анализа изображений, основные препятствия, чтобы выбрать соответствующий инструмент в соответствии с проблематичным и правильно настроить параметры, которые часто не очень хорошо понимают. Кроме того, время установки часто длинные. Icy предлагает удобный интерфейс «Протоколы» для разработки рабочего процесса, объединив некоторые плагины, найденные в исчерпывающей коллекции4. Гибкая модульная конструкция и интерфейс точки и щелчка делают настройку анализа возможной для непрограммистов. Здесь мы представляем рабочий процесс под названием Substructure Analyzer,разработанный в интерфейсе Icy, функция которого заключается в анализе флуоресцентных сигналов в конкретных сотовых отсеках и измерении различных функций, таких как яркость, число очагов, размер очагов и пространственное распределение. Этот рабочий процесс решает несколько вопросов, таких как количественная оценка транслокации сигнала, анализ трансфицированных клеток, выражающих флуоресцентный репортер, или анализ очагов из различных клеточных подструктур в отдельных клетках. Это позволяет одновременно обрабатывать несколько изображений, а результаты вывода экспортируются в таблицу, делимитированную в вкладке, которая может быть открыта в часто используемых программах электронных таблиц.
Конвейер Substructure Analyzer представлен на рисунке 1. Во-первых, все изображения, содержащиеся в указанной папке, предварительно обработаны для улучшения их соотношения сигнала к шуму. Этот шаг повышает эффективность следующих шагов и уменьшает время работы. Затем идентифицируются и сегментируются регионы интересов (ROIs), соответствующие области изображения, где должен быть обнаружен флуоресцентный сигнал. Наконец, анализируется флуоресцентный сигнал, и результаты экспортируются в таблицу, делимитированную в вкладке.
Сегментация объектов (обнаружение границ) является наиболее сложным шагом в анализе изображений, и его эффективность определяет точность полученных измерений клеток. Первые объекты, идентифицированные на изображении (так называемые первичные объекты), часто являются ядрами из изображений, окрашенных ДНК (DAPI или Hoechst окрашивания), хотя основными объектами также могут быть целые клетки, бусы, пятнышки, опухоли, или любой другой окрашенных объектов. В большинстве биологических изображений клетки или ядра прикасаются друг к другу или перекрываются, вызывая сбой простых и быстрых алгоритмов. На сегодняшний день ни один универсальный алгоритм не может выполнить идеальную сегментацию всех объектов, в основном потому, что их характеристики (размер, форма или текстура) модулируют эффективность сегментации5. Инструменты сегментации, широко распространяемые с помощью программного обеспечения микроскопии (например, программное обеспечение MetaMorph Imaging Software by Molecular Devices6, или NIS-Elements Advances Research Software от Nikon7),как правило, основаны на стандартных методах, таких как корреляция, пороговые или морфологические операции. Хотя эти методы чрезмерно обобщенных методов эффективны в своих основных системах, они быстро обувкут ограничения при использовании в более сложных и специфических условиях. Действительно, сегментация очень чувствительна к экспериментальным параметрам, таким как тип клеток, плотность клеток или биомаркеры, и часто требует повторной корректировки для большого набора данных. Рабочий процесс Substructure Analyzer интегрирует как простые, так и более сложные алгоритмы, чтобы предложить различные альтернативы, адаптированные к сложности изображения и потребностям пользователей. Он, в частности, предлагает маркер основе водораздела алгоритм8 для высокогруппиборированных объектов. Эффективность этого метода сегментации зависит от выбора отдельных маркеров на каждом объекте. Эти маркеры вручную выбираются большую часть времени, чтобы получить правильные параметры для полной сегментации, что очень много времени, когда пользователи сталкиваются с большим количеством объектов. Подструктурный анализатор предлагает автоматическое обнаружение этих маркеров, обеспечивая высокоэффективный процесс сегментации. Сегментация в большинстве случаев является ограничивающим этапом анализа изображений и может значительно изменять время обработки в зависимости от разрешения изображения, количества объектов на изображение и уровня кластеризации объектов. Типичные трубопроводы требуют от нескольких секунд до 5 минут на изображение на стандартном настольном компьютере. Анализ более сложных изображений может потребовать более мощного компьютера и некоторых базовых знаний в анализе изображений.
Гибкость и функциональность этого рабочего процесса иллюстрируются различными примерами в репрезентативных результатах. Преимущества этого рабочего процесса особенно проявляются в изучении ядерных подструктур в условиях окислительного стресса (ОС). ОС соответствует дисбалансу редокса гомеостаза в пользу окислителей и связана с высоким уровнем реактивных видов кислорода (ROS). Так как ROS выступает в качестве сигнальных молекул, изменения в их концентрации и субклеточной локализации влияют положительно или отрицательно множество путей и сетей, которые регулируют физиологические функции, в том числе трансдукции сигнала, механизмы ремонта, экспрессия генов, гибель клеток, и пролиферация9,10. Таким образом, ОС непосредственно участвует в различных патологиях (нейродегенеративных и сердечно-сосудистых заболеваний, рака, диабета и т.д.), но и клеточного старения. Поэтому расшифровка последствий ОС для организации и функции человеческой клетки представляет собой важнейший шаг в понимании роли ОС в наступлении и развитии патологий человека. Установлено, что ОС регулирует экспрессию генов, модулируя транскрипцию через несколько транскрипционных факторов (p53, Nrf2, FOXO3A)11,но также, влияя на регулирование нескольких со-и пост-транскрипционных процессов, таких как альтернативное сплайсирование (AS) предварительно РНК12,,13,,14. Альтернативное сращивание первичных кодирования и некодирующих стенограмм является важным механизмом, который увеличивает способность кодирования геномов, производя трансформы транскрипта. AS выполняется огромный комплекс рибонуклеопротеинов называется сплайсесома, содержащий почти 300 белков и 5 U-богатых малых ядерных РНК (UsnRNAs)15. Спласиосомная сборка и AS жестко контролируются в клетках, и некоторые этапы созревания сплайсесомы происходят в мембранных менее ядерных отсеках под названием Cajal Bodies. Эти ядерные подструктуры характеризуются динамическим характером их структуры и их составом, которые в основном проводятся многовалентными взаимодействиями их РНК и белковых компонентов с белком катушкина. Анализ тысяч клеток с помощью рабочего процесса Substructure Analyzer позволил охарактеризовать никогда не описанные эффекты ОС на телах Cajal. Действительно, полученные данные свидетельствуют о том, что ОС изменяет нуклеацию Cajal органов, вызывая нуклеоплазмического перераспределения белка coilin в многочисленных небольших ядерных очагов. Такое изменение структуры Cajal органов может повлиять на созревание сращивания и участвовать в модуляции AS ОС.
протокол
ПРИМЕЧАНИЕ: Удобные для пользователя учебники доступны на веб-сайте Icy http://icy.bioimageanalysis.org.
1. Скачать icy и протокол анализа подструктур
- Скачать Icy с сайта Icy(http://icy.bioimageanalysis.org/download) и скачать протокол Подструктуры Анализатор: http://icy.bioimageanalysis.org/protocols?sort=latest.
ПРИМЕЧАНИЕ: При использовании 64-разрядной ОС, не забудьте использовать 64-битную версию Java. Эта версия позволяет увеличить память, выделенную icy(Предпочтения Общие Макс памяти).
2. Открытие протокола
- Откройте Icy и нажмите на инструменты в меню Ленты.
- Нажмите на Протоколы, чтобы открыть интерфейс редактора протоколов.
- Нажмите на нагрузку и откройте протокол Анализатор подструктуры. Загрузка протокола может занять несколько секунд. Убедитесь, что открытие протокола завершено перед его использованием.
ПРИМЕЧАНИЕ: Рабочий процесс состоит из 13 общих блоков, представленных на рисунке 2a. Каждый блок работает как конвейер, состоящий из нескольких коробок, выполняющих определенные подзадаки.
3. Взаимодействие с рабочим процессом на icy
ПРИМЕЧАНИЕ: Каждый блок или поле пронумерованы и имеет определенный ранг в рабочем процессе(рисунок 2b). При нажатии на этот номер, ближайшее возможное положение к первому присваивается выбранному блоку/коробке, затем повторно организовано положение других блоков/коробок. Уважайте правильный порядок блоков при подготовке рабочего процесса. Например, блоку Spot Detector нужны заранее определенные РОЛИ, чтобы блоки сегментации должны были работать до блоков Spot Detector. Не изменяйте положение коробок. Не используйте "." в названии изображения.
- Нажав на верхний левый значок угла, обрушиться, расширить, увеличить, сузить, или удалить блок (Рисунок 2b).
- Каждый конвейер рабочего процесса характеризуется сетью коробок, соединенных через их вход и выход(рисунок 2b). Чтобы создать соединение, нажмите на выход и поддерживайте до тех пор, пока курсор не достигнет ввода. Соединения могут быть удалены, нажав на тег выход.
4. Слияние каналов изображения
- Используйте каналы слияния блока для создания объединенных изображений. При необходимости переименуйтесь в файлы таким образом, чтобы последовательности, которые должны быть объединены, имели один и тот же приставку с именем, за которой следовал отдельный сепаратор. Например, называются последовательности отдельных каналов из изображения А: ImageA_red, ImageA_blue.
ПРИМЕЧАНИЕ: Для сепаратора не используйте символы, уже присутствующие в названии изображения. - В той же папке создайте одну новую папку для слияния. Например, чтобы объединить красные, зеленые и синие каналы, создать 3 папки и хранить соответствующие последовательности в этих папках.
- Используйте только каналы слиянияблока, удалите другие блоки и сохраните протокол как каналы слияния.
- Доступ к ящикам для установки параметров. Для каждого канала заполните коробки Номер X (коробки 1, 5 или 9), Folder номер канала X (коробки 2, 6 или 10), сепараторный номер канала X (коробки 3, 7 или 11) и Colormap канал nb X (коробки 4, 8 и 12) соответственно.
ПРИМЕЧАНИЕ: Эти коробки горизонтально сгруппированы по четыре, каждая строка соответствует тому же каналу. В каждой строке также доступен дисплей (коробки 23, 24 или 25) для непосредственной визуализации последовательности соответствующего канала.- В поле Номер канала X, выберите, какой канал извлечь (в классических изображениях RGB, 0'Red, 1'Зеленый, 2'Синий). Пользователь быстро получает доступ к различным каналам изображения в окне инспектора Icy, во вкладке Sequence. Напишите значение наименьшего канала в верхней линии и наивысшее в нижней строке.
- В коробке Folder номер канала X, напишите «Имя папки, содержащей изображения канала X.
- В поле Separator номер канала X,напишите сепаратор, используемый для имени изображения (в предыдущем примере: "_red", "_green" и "_blue").
- В коробке Colormap канал nb X, указать с числом, какие colormap модель использовать для визуализации соответствующего канала в icy. Доступные цветные карты видны во вкладке Sequence из окна "Инспектор".
- В поле Формат объединенных изображений (коробка 28) напишите расширение для сохранения объединенных изображений: .tif, .gif, .jpg, .bmp или .png.
ПРИМЕЧАНИЕ: Чтобы объединить только 2 канала, не заполняйте четыре коробки, соответствующие третьему каналу.
- В левом верхнем углу блока Merge Channels нажмите на ссылку прямо справа от Folder. В открытом диалоговом окне, которое появляется, дважды нажмите на папку, содержащую последовательности первого канала, которые были определены в поле Folder канал номер 1 (коробка 2). Затем нажмите на Open.
- Выполнить протокол, нажав на черную стрелку в левом верхнем углу блока Merge Channels (подробнее см. часть 7). Слитые изображения сохраняются в папке Слияние в том же каталоге, что и папки отдельных каналов.
- Доступ к ящикам для установки параметров. Для каждого канала заполните коробки Номер X (коробки 1, 5 или 9), Folder номер канала X (коробки 2, 6 или 10), сепараторный номер канала X (коробки 3, 7 или 11) и Colormap канал nb X (коробки 4, 8 и 12) соответственно.
5. Сегментация регионов, представляющих интерес
ПРИМЕЧАНИЕ: Подструктурный анализатор интегрирует как простые, так и более сложные алгоритмы, чтобы предложить различные альтернативы, адаптированные к сложности изображения и потребностям пользователей.
- Выберите адаптированный блок.
- Если объекты не касаются друг друга, или пользователю не нужно дифференцировать кластерные объекты индивидуально, используйте блок сегментации A: Нерасгруппированные объекты.
- Когда объекты не касаются друг друга, но некоторые из них близки, используйте блок Сегментации B: Плохо сгруппированные объекты.
- Для объектов с высоким уровнем кластеризации и выпуклой формой используйте блок Сегментации C: Кластерные объекты с выпуклыми формами.
- Если объекты представляют высокий уровень кластеризации и имеют нерегулярные формы, используйте блок Сегментации D: Кластерные объекты с нерегулярными формами.
- Используйте блок сегментации E: кластерная цитоплазма для сегмента касаясь цитоплазм индивидуально, используя сегментированные ядра в качестве маркеров. Этот блок необходимо сегментированных ядер для обработки.
ПРИМЕЧАНИЕ: Блоки, адаптированные для процесса сегментации первичных объектов независимо, так что несколько блоков могут быть использованы в одном и том же запуске для сравнения их эффективности для определенной подструктуры или сегментации различных типов подструктур. Если уровень кластеризации неоднороден в одном наборе изображений, то обработайте небольшие и сильно сгруппированные объекты отдельно в адаптированных блоках.
- Свяжите выходной0 (файл) блока Select Folder с вводом папок выбранного блока сегментации.
- Установите параметры выбранного блока сегментации.
- Сегментация A: Негруппиугольные объекты и сегментация C: Кластерные объекты с выпуклыми формами
- В коробке канал сигнала (коробка 1), установите канал объектов к сегменту.
- В качестве опции, в коробке Гауссианский фильтр (коробка 2), увеличить X и Y сигма значения, если сигнал внутри объектов является неоднородным. Гауссианский фильтр сглаживает текстуры для получения более однородных областей и повышает скорость и эффективность сегментации ядер. Чем меньше объекты, тем ниже значение сигмы. Избегайте высоких значений сигмы. Установите значения по умолчанию до 0.
- В коробке HK-Means (коробка 3) установлен параметр классов интенсивности и приблизительные минимальные и максимальные размеры (в пикселях) объектов, которые необходимо обнаружить.
ПРИМЕЧАНИЕ: Для классов интенсивности значение 2 классифицирует пиксели в 2 классах: фон и передний план. Таким образом, он адаптируется, когда контраст между объектами и фоном высок. Если объекты переднего плана имеют различную интенсивность или если контраст с фоном низок, увеличьте количество классов. Параметр по умолчанию 2. Размер объекта можно быстро оценить, вручную нарисовав рентабельность инвестиций вокруг объекта, представляющий интерес. Размер рентабельности инвестиций (Interior in pixels) отображается непосредственно на изображении при указании на курсор или может быть доступ к нему в окне статистики рентабельности инвестиций (откройте его из панели поиска). Оптимальные параметры определяют каждый объект переднего плана в одном рентабельностиинвестиций. Они могут быть определены вручную в Icy(Обнаружение и отслеживание | HK-Means). - В коробке Active Contours (коробка 4) оптимизируют обнаружение границ объектов. Исчерпывающая документация для этого плагина доступна в Интернете: http://icy.bioimageanalysis.org/plugin/Active_Contours. Правильные параметры также могут быть определены вручную в Icy(Обнаружение и отслеживание | Активные контуры).
- Во время процесса автоматически создается папка для сохранения изображений сегментированных объектов. В поле Текст (коробка 6), назовите эту папку (на имя: Сегментированные ядра). Чтобы установить формат для сохранения изображений сегментированных объектов (Tiff, Gif, Jpeg, BMP, PNG), заполните формат коробки изображений сегментированных объектов. Папка создается в папке, содержащей объединенные изображения.
- Запустите рабочий процесс (для получения подробной информации см. часть 7).
- Сегментация B: Плохо сгруппированные объекты
- Следуйте тем же шагам, что и в 5.3.1, чтобы установить параметры коробок сигнала канала, HK-Means, Активные Контуры,Расширение для сохранения сегментированных объектов и текст (боксы не такие, как в шаге 5.3.1).
- В коробке Call IJ плагин (коробка 4), установите параметр Rolling для управления фоновой вычитания. Установите этот параметр, по крайней мере, размер самого большого объекта, который не является частью фона. Снижение этого значения увеличивает удаление фона, но может также вызвать потерю сигнала переднего плана.
- В коробке Адаптивная гистограмма выравнивания (коробка 6), улучшить контрасты между объектами переднего плана и фоном. Увеличение наклона дает более контрастные последовательности.
- Запустите рабочий процесс (для получения подробной информации см. часть 7).
- Сегментация D: Кластерные объекты с нерегулярными формами
ПРИМЕЧАНИЕ: К каждому изображению применяются три различных метода сегментации: во-первых,кластеризация HK-средствв сочетании сМетод активных контуровприменяется. Затемклассический алгоритм водораздела(с помощью карты расстояния Евклидов) применяется к ранее неправильно сегментированных объектов. Наконец,маркер основе водораздела алгоритмиспользуется. Только HK-средства и методы водораздела на основе маркеров нуждаются в вмешательстве пользователей. Для обоих методов одинаковые параметры могут быть применены ко всем изображениям (полностью автоматизированная версия) или изменены для каждого изображения (полуавтоматизированная версия). Если пользователь не обучен этим методам сегментации, рекомендуется полуавтоматическая обработка. При обработке этого блока требуется ручное вмешательство. Когда метод сегментации завершен, пользователь должен вручную удалить неправильно сегментированные объекты до начала следующего метода сегментации. Успешно сегментированные объекты сохраняются и не учитываются на следующем этапе. Этот блок должен быть подключен к блокуКластерные/неоднородные формы первичных объектов сегментации Dialog Boxправильно работать.- Скачать коллекцию ImageJ MorphoLibJ на https://github.com/ijpb/MorphoLibJ/releases. В этом протоколе используется версия MorphoLibJ 1.4.0. Поместите файл MorphoLibJ_-1.4.0.jar в папку ледяной / ij /plugins. Более подробная информация о содержании этой коллекции доступна на https://imagej.net/MorphoLibJ.
- Следуйте тем же шагам, что и в шаге 5.3.1, чтобы установить параметры коробок сигнала канала, гауссианского фильтра, Активных Контуров, Расширения для сохранения сегментированных объектов и текста. Боксы не такие, как в шаге 5.3.1.
- Установить параметры выравнивания адаптивной гистограммы коробки (см. шаг 5.3.2.3).
- Чтобы активировать вычитаемый фон, напишите да в Apply Subtract Background? (коробка 5). В противном случае, написать Нет. Если плагин активирован, установите скользящий параметр (см. шаг 5.3.2), в поле Вычесть фоновый параметр (коробка 7).
- Автоматизация HK-средств: Для применения одинаковых параметров для всех изображений (полностью автоматизированная обработка) установите Nb классов (коробка 11), минимальный размер (коробка 12) и максимальный размер (box13) (см. шаг 5.3.1). Эти параметры должны быть установлены для выбора максимум пикселей переднего плана и оптимизации индивидуализации объектов переднего плана. Для полуавтоматической версии обработки вмешательство не требуется.
- Автоматизация извлечения маркеров: для полностью автоматизированной версии расширьте коробку извлечения внутренних маркеров (коробка 27) и установите значение «динамического» параметра в строке 13 скрипта. Для полуавтоматической версии обработки вмешательство не требуется.
ПРИМЕЧАНИЕ: Маркеры извлекаются путем применения трансформации расширенного минимы на входном изображении, контролируемом "динамическим" параметром. В алгоритме водораздела на основе маркеров для сегментации объектов моделируется затопление этих маркеров. Для успешной сегментации объектов переднего плана необходимо извлечь один маркер на один объект переднего плана. Установка «динамического» параметра для извлечения оптимальных маркеров зависит в основном от разрешения изображений. Таким образом, если не знаком с этим параметром, используйте полуавтоматическую версию. - Запустите рабочий процесс (для получения подробной информации см. часть 7).
- В начале обработки, диалоговые окна HK-означает параметры и маркер основе водораздела последовательно открыты. Чтобы применить одинаковые параметры для всех изображений (полностью автоматизированная версия), нажмите на ДА. В противном случае, нажмите на НЕТ. Открывается информационный ящик с просьбой "Определить оптимальные РОВ с помощью плагина HK-Means и закрыть изображение". Нажмите на OK и вручную применить плагин HK-Means(Обнаружение и отслеживание| HK-Средства) на изображении, которое автоматически открывается. Выберите опцию Export ROIs в коробке плагина HK-Means. Примените лучшие параметры, чтобы иметь РОУ, содержащий максимум пикселей переднего плана, и оптимизировать индивидуализацию объектов переднего плана. При обнаружении оптимального ПИС непосредственно закройте изображение.
- В конце первого метода сегментации открывается информационный ящик, который просит "удалить нежелательные РОЛИ и закрыть изображение". Эти ROIs соответствуют границам сегментированных объектов. Выберите OK и удалите RO-Образ неправильно сегментированные объекты на изображении, которое автоматически открывается. Рентабельность инвестиций может быть легко удалена, разместив курсор на своей границе и используя кнопку "Удалить" клавиатуры. Закройте изображение. Повторите ту же процедуру после завершения второго шага сегментации.
- На этом этапе, если кнопка ДА была выбрана для полной автоматизации алгоритма водораздела на основе маркера, ранее установленные параметры будут применяться ко всем изображениям.
- Если кнопка NO была выбрана, открывается информационный ящик с просьбой "определить и настроить внутренние маркеры". Нажмите на OK и в интерфейсе ImageJ Icy, перейдите на Plugins | МорфоЛибДж Минима и Максима| Расширенный Мин и Макс. В операции выберите Extended Minima.
- Выберите Предварительный просмотр для предварительной визуализации на автоматически открытом изображении в результате преобразования. Перемещение динамической до тех пор, пока не будут наблюдаться оптимальные маркеры. Маркеры представляют собой группы пикселей значением 255 (не обязательно белые пиксели). Оптимальные параметры приводят к одному маркеру на каждый объект. Сосредоточьтесь на остальных объектах, которые не были хорошо сегментированы двумя предыдущими методами сегментации.
- При необходимости улучшайте маркеры, применяя дополнительные морфологические операции, такие как "Открытие" или "Закрытие"(Plugins) | МорфоЛибДж Морфологические фильтры). При получении окончательного изображения маркеров, держать его открытым и закрыть все другие изображения, заканчивающиеся с изображением, первоначально используемым в качестве ввода для расширенной операции Minima. Нажмите на кнопку "Нет", если поле ImageJ просит сохранить изменения на этом изображении.
- В поле Nb изображений с информационным ящиком (коробка 14), определить, сколько изображений с информационными ящиками должно появиться.
- Сегментация E: Кластерная цитоплазма
ПРИМЕЧАНИЕ: Этот блок использует ранее сегментированные ядра в качестве индивидуальных маркеров для инициирования сегментации цитоплазмы. Убедитесь, что блок сегментации ядер обработал перед его использованием.- В коробке канала цитоплазмы (коробка 1), установить канал цитоплазмического сигнала.
- В коробке Расширение сегментированных ядер (коробка 2), напишите формат, используемый для сохранения изображений сегментированных ядер (tif, jpeg, bmp, png). Формат по умолчанию является tif.
- В поле Текст (box3), напишите «Имя папки, содержащей сегментированные ядра.
- В коробке Формат изображений сегментированных цитоплазм (коробка 4) устанавливает формат использования для сохранения сегментированных объектов изображений (Tiff, Gif, Jpeg, BMP, PNG).
- Во время процесса автоматически создается папка для сохранения изображений сегментированных цитоплазм. В поле Текст (коробка 5), назовите эту папку (на имя: Сегментированные цитоплазмы). Папка создается в папке, содержащей объединенные изображения.
- Следуйте тем же шагам, что и в шаге 5.3.1, чтобы установить параметры коробок гауссианского фильтра и активных контуров (Будьте осторожны, ряды коробок не такие, как в шаге 5.3.1).
- Запустите рабочий процесс (для получения подробной информации см. часть 7).
- Сегментация A: Негруппиугольные объекты и сегментация C: Кластерные объекты с выпуклыми формами
6. Обнаружение и анализ флуоресцентных сигналов
- Выберите адаптированный блок.
- В блоке Флуоресценция Анализ A: 1 канал, выполнять обнаружение и анализ очагов в одном канале внутри одного типа сегментированного объекта: обнаружение катина foci (красный канал) в ядре.
- В блоке Флуоресценция Анализ B: 2 каналы в том же отсеке, выполнять обнаружение и анализ очагов в двух каналах внутри одного типа сегментированного объекта: обнаружение coilin (красный канал) и 53BP1 (зеленый канал) foci в ядре.
- В блоке Флуоресценция Анализ C: 2 каналы в двух отсеках, выполнить обнаружение и анализ очагов в одном или двух каналах, в частности внутри ядер и их соответствующих цитоплазмы: обнаружение Coilin foci (красный канал) как внутри ядра и его соответствующей цитоплазмы или обнаружения Coilin foci (красный канал) в пределах ядра и G3BP foci (зеленый канал) в пределах соответствующего цитоplasm.
- В блоке Флуоресценция Анализ D: Глобальная транслокация, рассчитать процент сигнала от одного канала в двух сотовых отсеках (a и b). Например, в анализе транслокации цитоплазмы/ядра экспорт рассчитывает проценты ядерных и цитоплазматических сигналов для каждого изображения в окончательной таблице "Результаты". Формула, используемая для расчета процента ядерного сигнала, показана ниже. Этот блок может быть использован для любого подклеточного отсека:
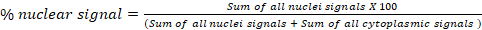
- В блоке Флуоресценция Анализ E: Индивидуальная транслокация клеток, рассчитать процент сигнала от одного канала в двух сотовых отсеков для каждой клетки. Этот блок специально оптимизирован для анализа транслокации ядра/цитоплазмы на одноклеточном уровне.
ПРИМЕЧАНИЕ: Поскольку блок флуоресценции Анализ E: Индивидуальная транслокация клеток выполняет анализ на одноклеточном уровне, необходима эффективная сегментация ядра и цитоплазмы.
- Свяжите выходной0 (файл) блока Select Folder (блок 1) с вводом папок (белые стрелки в черных кругах) выбранного блока.
- Установите параметры выбранного блока.
- Анализ флуоресценции A: 1 канал, анализ флуоресценции B: 2 канала в одном отсеке и анализ флуоресценции C: 2 канала в 2 отсеках
- В коробке Folder изображения ROI, написать название папки, содержащей изображения сегментированных объектов, предшествующих backslash. (Например: «Сегментированные ядра» (сегментированные ядра).
- В поле Формат изображений сегментированных объектов (коробка 2), напишите формат, используемый для сохранения изображений сегментированных объектов (tif, jpeg, bmp, png). Формат по умолчанию является tif.
- В коробке Kill Borders?, напишите Да, чтобы удалить пограничные объекты. В противном случае, написать Нет. Для использования этой функции требуется установка коллекции MorphoLibJ ImageJ (см. шаг 5.3.3).
- В поле (es) канал пятна сигнала,установить канал, где пятна должны быть обнаружены. В классических изображениях RGB, 0'Red, 1'Зеленый, и 2'Синий.
- В коробках Название локализованной молекулы,напишите название молекулы локализации в пятна. Количество полей для ввода зависит от количества молекул.
- В поле (es) Блок детектора Wavelet Spot,установите параметры обнаружения места для каждого канала. Установите шкалу (ы) (относится к размеру пятна) и чувствительность обнаружения (меньшая чувствительность уменьшает количество обнаруженных пятен, значение по умолчанию 100 и минимальное значение 0). Исчерпывающая документация этого плагина доступна в Интернете: http://icy.bioimageanalysis.org/plugin/Spot_Detector. Параметры также могут быть определены вручную в Icy(Обнаружение и отслеживание | Точечный детектор).
- В качестве опции в коробке фильтр ROI по размеруфильтр отфильтровы к фильтруют сегментированные объекты, где обнаруживаются пятна, устанавливая интервал размера (в пикселях). Этот шаг особенно полезен для удаления под-или чрезмерно сегментированных объектов. Чтобы вручную оценить размер объектов, см. шаг 5.3.1. Параметры по умолчанию не включают фильтрацию ROIs по размеру. Блок 2 каналов в двух отсеках содержит две коробки: ядра фильтра по размеру (коробка 19) и цитоплазма фильтра по размеру (коробка 46).
- Дополнительно, в коробке Фильтр пятна по размеру, фильтруют обнаруженные пятна в зависимости от их размера (в пикселях) для удаления нежелательных артефактов. Чтобы вручную оценить размер места, нажмите на обнаружение и отслеживание и откройте плагин детектора Spot. В вариантах вывода выберите Export to ROI. Будьте осторожны, чтобы параметры по умолчанию не включали фильтрацию пятен по размеру и чтобы фильтрованные пятна не учитывались при анализе. Количество полей для ввода зависит от количества каналов.
- Дополнительно, в коробке фильтр пятна,нанесите дополнительный фильтр (контраст, однородность, периметр, округлость) на обнаруженных пятен. Будьте осторожны, чтобы параметры по умолчанию не включали фильтрацию точек и чтобы фильтрованные пятна не учитывались при анализе. Количество полей для ввода зависит от количества каналов.
- Дополнительно, в коробках Spot порог размера,установить порог для области (в пикселях) анализируемых пятен. Количество подсчитанных пятен ниже и выше этого порога экспортируется в таблице окончательных результатов. Количество ящиков, которые должны быть информированы зависит от количества каналов.
- Запустите рабочий процесс (для получения подробной информации см. часть 7). Данные экспортируются в таблицу Результаты, сохраненную в папке, содержащей объединенные изображения.
- Анализ флуоресценции D: Глобальный транслокационный и флуоресценционный анализ E: Индивидуальная транслокация клеток:
- В коробках Folder изображения (коробки 1 и 2), написать "Имя папки, содержащей изображения сегментированных объектов. В блоке Флуоресценция Анализ D: Глобальная транслокация, два типа рентабельности инвестиций определяются как рентабельность инвестиций и рентабельность инвестиций b. Для блока Флуоресценция Анализ E: Индивидуальная транслокация клеток, в Folder изображения сегментированных ядер и Folder изображения сегментированных цитоплазм коробки, написать название папки, содержащей сегментированные ядра и цитоплазмы, соответственно.
- В поле канал сигнала (коробка 3), введите канал сигнала.
- В поле Формат изображений сегментированных объектов (коробка 4), напишите формат, используемый для сохранения изображений сегментированных объектов (tif, jpeg, bmp, png). Формат по умолчанию является tif. Опция Kill Borders также доступна для удаления пограничных объектов (см. шаг 6.3.1).
- Дополнительно, в коробках фильтр ROI по размеру,фильтровать сегментированные объекты, установив интервал размера (в пикселях). Этот шаг может быть полезен для удаления объектов с под-или чрезмерно сегментированной. Чтобы вручную оценить размер объекта, см. шаг 5.3.1. Есть два поля для входа, по одному на канал. Параметры по умолчанию не включают фильтрацию рентабельности инвестиций по размеру.
- Запустите рабочий процесс (для получения подробной информации см. часть 7). Экспортные данные в электронной таблице Результаты сохранены в папке, содержащей объединенные изображения.
- Анализ флуоресценции A: 1 канал, анализ флуоресценции B: 2 канала в одном отсеке и анализ флуоресценции C: 2 канала в 2 отсеках
7. Выполнить протокол
- Чтобы обработать один блок в запуске, удалите соединение между выбранным блоком и блоком Select Folder. Поместите разыскиваемый блок на1-й ранг. В левом верхнем углу разыскиваемого блока нажмите на ссылку прямо справа от папки. В открытом диалоговом окне, которое появляется, дважды нажмите на папку, содержащую объединенные изображения. Затем нажмите на Open. Нажмите на Run, чтобы начать рабочий процесс. Обработка может быть остановлена, нажав на кнопку "Стоп".
- Чтобы обработать различные блоки в перспективе, сохраняйте соединения выбранных блоков с блоком Select Folder (блок 1). Убедитесь, что их ранг позволяет хорошую обработку рабочего процесса. Например, если конкретному блоку нужны сегментированные объекты для обработки, убедитесь, что блок сегментации обрабатывается ранее. Перед запуском рабочего процесса удалите неиспользованные блоки и сохраните новый протокол с другим именем.
- Нажмите на Run, чтобы начать рабочий процесс. Когда появляется открытое диалоговое окно, дважды нажмите на папку, содержащую объединенные изображения. Затем нажмите на Open. Рабочий процесс выполняется автоматически. При необходимости прекратите обработку, нажав на кнопку Stop.
- В конце обработки проверьте, что сообщение Рабочий процесс успешно появился в нижнем правом углу и что все блоки помечены зеленым знаком(рисунок 2b). Если нет, блок и внутренняя коробка, представляющая знак ошибки, указывают на элемент для исправления(рисунок 2b).
ПРИМЕЧАНИЕ: После успешного выполнения рабочего процесса новый запуск не может быть запущен напрямую, и для повторной обработки рабочего процесса, по крайней мере один блок должен быть помечен знаком "готов к обработке". Чтобы изменить состояние блока, либо удалите и воссоздайте связь между двумя коробками внутри этого блока, либо просто закройте и вновь откройте протокол. Если ошибка происходит во время обработки, можно начать новый запуск. Во время нового запуска все блоки конвейера обрабатываются, даже если некоторые из них помечены зеленым знаком.
Результаты
Все описанные анализы были выполнены на стандартном ноутбуке (64-разрядный четырехъядерный процессор на 2,80 ГГц с 16 ГБ памяти случайного доступа (RAM)), работающей с 64-битной версией Java. Память случайного доступа является важным параметром для рассмотрения, в зависимости от количества и ра?...
Обсуждение
Для анализа изображений флуоресценций клетки имеется все большее число свободных программных средств. Пользователи должны правильно выбирать адекватное программное обеспечение в соответствии со сложностью их проблематично, к их знаниям в обработке изображений, и к времени, которое ?...
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Г.Х. был поддержан дипломом магистра в Министере Делегуэ а-ля Рехерш и Aux Технологии. Л.Х. был поддержан стипендией выпускника в Институте де Канчериотии Лотарингии (ICL), в то время как З.Т. был поддержан государственным грантом под надзором Французского национального исследовательского агентства (ANR) в рамках второй программы FIGHT-HF (справка: ANR-15-RHU457004). Эта работа была профинансирована CNRS и Университетом Лотарингии (UMR 7365).
Материалы
| Name | Company | Catalog Number | Comments |
| 16% Formaldehyde solution (w/v) methanol free | Thermo Fisher Scientific | 28908 | to fix the cells |
| Alexa Fluor 488 of goat anti-rabbit | Thermo Fisher Scientific | A-11008 | fluorescent secondary antibody |
| Alexa Fluor 555 of goat anti-mouse | Thermo Fisher Scientific | A-21425 | fluorescent secondary antibody |
| Alexa Fluor 555 Phalloidin | Thermo Fisher Scientific | A34055 | fluorescent secondary antibody |
| Bovine serum albumin standard (BSA) | euromedex | 04-100-812-E | |
| DMEM | Sigma-Aldrich | D5796-500ml | cell culture medium |
| Duolink In Situ Mounting Medium with DAPI | Sigma-Aldrich | DUO82040-5ML | mounting medium |
| Human: HeLa S3 cells | IGBMC, Strasbourg, France | cell line used to perform the experiments | |
| Hydrogen peroxide solution 30% (H2O2) | Sigma-Aldrich | H1009-100ml | used as a stressing agent |
| Lipofectamine 2000 Reagent | Thermo Fisher Scientific | 11668-019 | transfection reagent |
| Mouse monoclonal anti-coilin | abcam | ab11822 | Coilin-specific antibody |
| Nikon Optiphot-2 fluorescence microscope | Nikon | epifluoresecence microscope | |
| Opti-MEM I Reduced Serum Medium | Thermo Fisher Scientific | 31985062 | transfection medium |
| PBS pH 7.4 (10x) | gibco | 70011-036 | to wash the cells |
| Rabbit polyclonal anti-53BP1 | Thermo Fisher Scientific | PA1-16565 | 53BP1-specific antibody |
| Rabbit polyclonal anti-EDC4 | Sigma-Aldrich | SAB4200114 | EDC4-specific antibody |
| Triton X-100 | Roth | 6683 | to permeabilize the cells |
Ссылки
- Möckl, L., Lamb, D. C., Bräuchle, C. Super-resolved fluorescence microscopy: Nobel Prize in Chemistry 2014 for Eric Betzig, Stefan Hell, and William E. Moerner. Angewandte Chemie. 53 (51), 13972-13977 (2014).
- Meijering, E., Carpenter, A. E., Peng, H., Hamprecht, F. A., Olivo-Marin, J. -. C. Imagining the future of bioimage analysis. Nature Biotechnology. 34 (12), 1250-1255 (2016).
- Wiesmann, V., Franz, D., Held, C., Münzenmayer, C., Palmisano, R., Wittenberg, T. Review of free software tools for image analysis of fluorescence cell micrographs. Journal of Microscopy. 257 (1), 39-53 (2015).
- de Chaumont, F., et al. Icy: an open bioimage informatics platform for extended reproducible research. Nature Methods. 9 (7), 690-696 (2012).
- Girish, V., Vijayalakshmi, A. Affordable image analysis using NIH Image/ImageJ. Indian J Cancer. 41 (1), 47 (2004).
- Zaitoun, N. M., Aqel, M. J. Survey on image segmentation techniques. Procedia Computer Science. 65, 797-806 (2015).
- . MetaMorph Microscopy Automation and Image Analysis Software Available from: https://www.moleculardevices.com/products/cellular-imaging-systems/acquisition-and-analysis-software/metamorph-microscopy (2018)
- . NIS-Elements Imaging Software Available from: https://www.nikon.com/products/microscope-solutions/lineup/img_soft/nis-element (2014)
- Meyer, F., Beucher, S. Morphological segmentation. Journal of Visual Communication and Image Representation. 1 (1), 21-46 (1990).
- Schieber, M., Chandel, N. S. ROS Function in Redox Signaling and Oxidative Stress. Current Biology. 24 (10), 453-462 (2014).
- D'Autréaux, B., Toledano, M. B. ROS as signalling molecules: mechanisms that generate specificity in ROS homeostasis. Nature Reviews. Molecular Cell Biology. 8 (10), 813-824 (2007).
- Davalli, P., Mitic, T., Caporali, A., Lauriola, A., D'Arca, D. ROS, Cell Senescence, and Novel Molecular Mechanisms in Aging and Age-Related Diseases. Oxidative Medicine and Cellular Longevity. 2016, 3565127 (2016).
- Disher, K., Skandalis, A. Evidence of the modulation of mRNA splicing fidelity in humans by oxidative stress and p53. Genome. 50 (10), 946-953 (2007).
- Takeo, K., et al. Oxidative stress-induced alternative splicing of transformer 2β (SFRS10) and CD44 pre-mRNAs in gastric epithelial cells. American Journal of Physiology - Cell Physiology. 297 (2), 330-338 (2009).
- Seo, J., et al. Oxidative Stress Triggers Body-Wide Skipping of Multiple Exons of the Spinal Muscular Atrophy Gene. PLOS ONE. 11 (4), 0154390 (2016).
- Will, C. L., Luhrmann, R. Spliceosome Structure and Function. Cold Spring Harbor Perspectives in Biology. 3 (7), 003707 (2011).
- Ljosa, V., Sokolnicki, K. L., Carpenter, A. E. Annotated high-throughput microscopy image sets for validation. Nature Methods. 9 (7), 637-637 (2012).
- Wang, Q., et al. Cajal bodies are linked to genome conformation. Nature Communications. 7, (2016).
- Carpenter, A. E., et al. CellProfiler: image analysis software for identifying and quantifying cell phenotypes. Genome Biology. 7, 100 (2006).
- McQuin, C., et al. CellProfiler 3.0: Next-generation image processing for biology. PLoS Biology. 16 (7), 2005970 (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены