A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تصور ديناميات الانتشار من نانورود الذهب على غشاء الخلية باستخدام جسيمات نانوية واحدة Darkfield المجهرية
In This Article
Summary
هنا، نعرض استخدام المجهر التقليدي في مجال الظلام لمراقبة ديناميات نانورود الذهب (AuNRs) على غشاء الخلية. يتم الكشف عن موقع واتجاه AuNRs واحد باستخدام ImageJ MATLAB، وتتميز الدول الانتشارية من AuNRs بتحليل تتبع الجسيمات واحدة.
Abstract
تحليل ديناميات الانتشار من الجسيمات النانوية على غشاء الخلية يلعب دورا هاما في فهم أفضل لعملية امتصاص الخلوية ويوفر أساسا نظريا للتصميم العقلاني لتقديم الأدوية نانو. يمكن أن يسبر تحليل تتبع الجسيمات المفردة (SPT) موضع وتوجه الجسيمات النانوية الفردية على غشاء الخلية، ويكشف عن حالاتها الترجمية والدورانية. هنا، نعرض كيفية استخدام المجهر التقليدي في الحقل المظلم لمراقبة ديناميكيات نانورود الذهب (AuNRs) على غشاء الخلية الحية. كما نعرض كيفية استخراج موقع وتوجه AuNRs باستخدام ImageJ و MATLAB ، وكيفية توصيف الحالات المنتشرة في AuNRs. التحليل الإحصائي لمئات من الجسيمات تبين أن AuNRs واحد أداء حركة براونيان على سطح غشاء الخلية U87 MG. ومع ذلك، يظهر تحليل المسار الطويل الفردي أن لدى وحدات الـ "أو إن آر" نوعان مختلفان بشكل واضح من حالات الحركة على الغشاء، وهما النقل بعيد المدى والحبس المحدود المساحة. يمكن استخدام طرق SPT لدينا لدراسة انتشار الجسيمات داخل الخلايا أو السطح في الخلايا البيولوجية المختلفة ويمكن أن تصبح أداة قوية للتحقيقات في الآليات الخلوية المعقدة.
Introduction
ترتبط ديناميات الجسيمات النانوية (NPs) على الغشاء ارتباطًا وثيقًا بعملية الامتصاص الخلوية ، وهو أمر ضروري لفهم وظائف الخلايا والعدوى الفيروسية أو البكتيرية وتطوير أنظمة توصيل نانوميدية اصطناعية1،2. تقنية تتبع الجسيمات المفردة (SPT) هي أداة قوية لتميز السلوكيات غير المتجانسة لـ NPs3،4. بشكل عام، غشاء الخلية هو fluidic، مما يعني أن مكونات مثل البروتينات والدهون يمكن أن تتحرك أفقيا في الطائرة غشاء البلازما5،6،7. قد يؤدي التعقيد الزماني الزهيائي لتنظيم الغشاء وبنيته إلى عدم تجانس الزمانية في التفاعل بين مصادر القدرة النووية والغشاء. وبالتالي ، فإن التصور المباشر لحركة مصادر القدرة النووية على الغشاء يتطلب دقة مكانية وزمنية عالية.
تم تطوير المجهر تتبع الجسيمات واحد الذي يرصد توطين الجسيمات الفردية في الخلايا الحية مع القرار المكاني من عشرات نانومتر ودقة الوقت من ميلي ثانية لدراسة NPs أو ديناميات الجزيئات الغشاء8،9. وقد أصبحت تقنيات التصوير المجهري الفلورية المستندة إلى أدوات قيمة لمراقبة NPs / الجزيئات في بيئة الخلايا الحية9،10،11،12. على سبيل المثال ، تم استخدام المجهر الفلوري الداخلي الكلي ، الذي صور طبقات رقيقة (~ 100 نانومتر) من العينة في واجهة الركيزة / الحل مع دقة ارقائية عالية في دراسات ديناميات جزيئات الغشاء13،14. ومع ذلك ، فإن العيوب الكامنة في الفلوروفورات المفردة ، مثل الكثافة المنخفضة والضوائ السريع الذي لا رجعة فيه يقلل من دقة ومدة تتبع13. ولذلك، فإن NPs بلازمونية غير الفلورية، التي تحل محل المسابير الفلورية، جذبت المزيد والمزيد من الاهتمام في دراسات التصوير طويلة الأجل بسبب خصائصها البصرية الفريدة15. استنادا إلى إشارات تشتت تحقيقات NP plasmonic ، وقد استخدمت عدة أنواع من تقنيات التصوير المجهري البصري لدراسة آلية العمليات البيولوجية ، مثل المجهر في مجال الظلام (DFM)16، التداخل تشتت (iSCAT) المجهري17 والتداخل التفاضلي التباين المجهر (DICM)18. وبالإضافة إلى ذلك، يمكن الحصول على الحركة وتناوب دينامية AuNRs باستخدام سوق دبي المالي وDICM18،19،20،21،22. عادة، في تجربة SPT، يتم تسجيل حركة الجسم بواسطة المجهر البصري، ومن ثم تحليلها بواسطة أساليب التحليل SPT3. المسارات التي تم حلها في الوقت والزوايا التوجهية التي تولدها مصادر القدرة النووية الفردية عادة ما تكون عشوائية وغير متجانسة ، لذلك من الضروري تقديم معلومات ديناميكية وفيرة مع أساليب تحليل مختلفة.
هنا، نحن نقدم بروتوكول متكامل يراقب ديناميات AuNRs على غشاء الخلية باستخدام DFM، ويستخرج موقع واتجاه AuNRs مع ImageJ و MATLAB، ويميز انتشار AuNRs باستخدام أساليب التحليل SPT. وكعرض توضيحي، نعرض هنا كيفية استخدام بروتوكول SPT لتصور ديناميات أورون غير المعدلة (CTAB-AuNRs، التي يتم تصنيعها بواسطة جزيء بروميد الأمونيوم السيتيلتريلميثوم كعامل وقائي) على غشاء الخلية U87 MG. وقد ثبت أن CTAB-AuNRs يمكن أن adsorb البروتينات في البيئة البيولوجية، والانتقال على غشاء الخلية ومن ثم أدخل الخلايا2،20،22. U87 MG الخلية هو الورم الأكثر شيوعا والأكثر الخبيثة من الجهاز العصبي المركزي, ويتم التعبير عن مستقبلات الغشاء بشكل غير طبيعي. يمكن لمستقبلات الغشاء التفاعل مع البروتينات على AuNRs، والتي تؤثر على ديناميات أوارون. بروتوكولنا ينطبق بشكل عام على تجارب SPT الأخرى في مجال البيولوجيا.
Access restricted. Please log in or start a trial to view this content.
Protocol
1. خلية ثقافة
- إعداد المتوسطة كاملة لخلايا U87 MG عن طريق إضافة مصل الأبقار الجنين (التركيز النهائي 10٪) والبينسلين-ستربتوميسين (التركيز النهائي 1٪) إلى الحد الأدنى من الوسط الأساسي (MEM). استخدام طبق ثقافة الخلايا البلاستيكية لخلايا الثقافة الفرعية.
- مرور الخلايا 2 إلى 3 مرات في الأسبوع.
- إزالة المتوسطة الثقافة وشطف طبقة الخلية مع المحلولكة الفوسفات المخزنة (مد- PBS) 2 ~ 3 مرات عندما التقاء (80٪ ~ 90 ٪).
- إضافة 1.0 إلى 2.0 مل من تريبسين-EDTA حل لطبق ثقافة الخلية ومراقبة الخلايا تحت مجهر مقلوب حتى تصبح الخلايا جولة (3 ~ 5 دقائق).
- إضافة 3.0 مل من المتوسط الكامل المعدة وتفريق الخلايا عن طريق الأنابيب بلطف.
- إضافة تعليق الخلية (1 مل) إلى طبق ثقافة جديدة مع خلية متوسطة جديدة (3 مل) وإعادة ضغط الخلايا.
- الحفاظ على الخلايا عند 37 درجة مئوية و 5٪ CO2 في جو مرطب.
2. المجهر إعداد الشريحة
ملاحظة: تستخدم خلايا U87 MG من الجيل الثالث إلى العاشر مع نشاط عال في تجارب SPT.
- تعقيم 22 مم × 22 ملم يغطي بالفعل تنظيفها مع محلول بيرانا عن طريق الغمر في الإيثانول (99.9٪).
- استخدام ملقط لإخراج زلة الغطاء من محلول الإيثانول (الخطوة 2.1) وتعقيم عن طريق حرق الإيثانول على اللهب. مرة واحدة يتم حرق كل الإيثانول، مكان يغطي في طبق ثقافة الخلايا البلاستيكية (35 × 10 ملم) مليئة 2 مل من خلية المتوسطة (لا يوجد أحمر الفينول).
- إضافة 50 μL من تعليق الخلية من الخطوة 1.2.3 على غطاء ودفع بلطف الطبق ذهابا وإيابا واليسار واليمين لتوزيع الخلايا بالتساوي. ضعه في جو رطب.
- عندما تصل خلايا U87 MG على الغطاء إلى 20٪ –40٪ التقاء (~12 ساعة)، أضف 20 ميكرولتر من CTAB-AuNRs (138 م م) في الطبق وتفرق. احتضان في جو مرطب لمدة 5 دقائق.
- إضافة 100 μL من المتوسط ثقافة (لا يوجد أحمر الفينول) من طبق في الخطوة 2.4 في الأخدود من الشريحة الزجاجية مخدد (الشكل 1) الذي هو مُطَطَّطَطَط مع محلول بيرانا.
- أخرج الغطاء من الطبق ومقلوب على الجزء العلوي من الأخدود من الشريحة الزجاجية المجهر (الشكل 1). ختم مع طلاء الأظافر، والسماح لها الجافة ووضعها على خشبة المسرح لإجراء تجارب SPT.
3. تنفيذ تجارب تتبع الجسيمات واحدة مع المجهر darkfield (الشكل 1).
- ضع قطرة من الزيت على مكثف الحقول المظلمة المغمورة بالزيت (NA 1.43-1.20) واقلب مقبض الباب لجعل المكثف يتصل بالشريحة الزجاجية.
- وضع قطرة من النفط على الجزء العلوي من الزجاج الغطاء وتحويل مقبض التركيز لجعل هدف غمر النفط 60x (NA 0.7-1.25) لمس النفط.
- بدوره على مصدر الضوء وتحويل قليلا مقبض التركيز على التركيز على الطائرة التصوير.
ملاحظة: في مجال العرض، الخلفية سوداء، والخلايا مشرقة، و CTAB-AuNRs (نسبة الارتفاع ~ 2:1، الشكل 2)هي صغيرة ملونة (أحمر، أصفر، أو أخضر) بقع التشتت. - التقاط عينة تشتت الضوء بواسطة كاميرا CMOS اللون. انقر على" رمز الكاميرا" في البرنامج لتسجيل وتصدير تنسيق TIFF لحفظ الصور.
4 - الحصول على البيانات
- استخراج مسار واحد طويل الأجل
- تعمل كما هو موضح في الشكل 3 لتحويل الوقت سلسلة الظلام الميدانية الصور من وضع "RGB لون" إلى وضع "8 بت". في الصورة J انقر فوق صورة | اكتب | 8 بت. لضبط التباين، انقر على صورة | ضبط | | السطوع على النقيضمن ذلك .
- حدد الجسيمات المستهدفة وقطع الخلفيات سلسلة زمنية عن طريق الملاكمة وحذف الخلفية مع "Ctrl + X".
- فتح كشف الجسيمات والجسيمات ربط النافذة بالنقر على "الإضافات | الجسيمات تعقب | الكلاسيكية الجسيمات المقتفي".
- تعيين نصف القطر إلى 6، Cutoff إلى 0 و Percentile إلى 0.01٪.
ملاحظة: للكشف عن الجسيمات، ضبط أعلاه المعلمات الثلاثة بمساعدة المعاينة. تأكد من أن نصف القطر أكبر قليلاً من الجسيمات المستهدفة وأصغر من أصغر فصل بين الجسيمات. المئين هو الحد الأدنى لتوزيع الكثافة الذي يجب أن يكون جسيمات المرشح. - تعيين نطاق الارتباط إلى 5 والإزاحة إلى 10.
ملاحظة: لربط الجسيم بين الإطارات المتجاورة المتتالية، قم بضبط المعلمتين أعلاه. الإزاحة هي أقصى بكسل يمكن أن يتحرك بين الإطارات التالية، و Range range هو عدد الإطارات المتتالية التي يجب أخذها بعين الاعتبار عند تحديد أفضل تطابق. - انقر فوق "موافق" لفتح نافذة نتائج ParticleTracker لرؤية النتائج.
- انقر فوق "تصور جميع المسارات" لتفقد المسارات التي تم إنشاؤها.
- انقر على"إعادة ربط الجسيمات"القائمة في الجزء العلوي لإعادة ربط الجسيمات المكتشفة مع نطاق الارتباط مختلفة ومعلمات المئين، إذا كان المسار ولدت البرنامج لا تتطابق مع مسار متحرك من AuNR.
- انقر على "حفظ التقرير الكامل" لحفظ النتائج إذا كان المسار ولدت البرنامج والمسار المتحرك لل AuNR المتطابقة.
ملاحظة: مثال على استخراج مسار واحد طويل الأجل مع صورة J هو مبين في الشكل 4.
- استخراج مسارات متعددة
ملاحظة: مثال على استخراج مسارات متعددة مع فيجي مبين في الشكل 5. هناك عدة مراحل، وتشكل كل مرحلة خطوة في عملية التتبع. يتم عرض نتيجة كل خطوة على الفور، مما يسمح للمستخدم بالعودة إلى ضبط الإعدادات عندما يكون الإخراج غير مرض.- تعمل كما هو موضح في الشكل 3 لتحويل الوقت سلسلة الظلام الميدانية الصور من وضع "RGB لون" إلى وضع "8 بت". في مسار الصورة J انقر فوق "صورة | اكتب | 8 بت". لضبط التباين، انقر على"صورة | ضبط | | السطوع تباين".
- فتح لوحة البداية عن طريق النقر على "الإضافات | | التعقب TrackMate". انقر على "التالي".
- اختر "كاشف LoG" من القائمة المنسدلة وانقر على "التالي".
- ضبط معلمات لوحة تكوين الكاشف. تعيين قطر النقطة المقدرة إلى 10، تعيين عتبة إلى 0، وحدد"هل التعريب الفرعي بكسل".
- انقر فوق "التالي" لفتح لوحة تصفية التركيز الأولي.
ملاحظة: يمكن تعديل معلمات متعددة لزيادة تحسين النقاط الهدف. في هذا المثال، تم ضبط معلمات أخرى. - انقر على "التالي" وحدد "جهاز عرض HyperStack" من القائمة المنسدلة.
- انقر فوق "التالي" لفتح لوحة تصفية Spot. تعيين الجودة فوق 1.88، X فوق 38.86، ص فوق 56.54.
- انقر على "التالي" وحدد "تعقب بسيط في LAP" من القائمة المنسدلة. تكوين تعقب LAP بسيطة عن طريق ضبط ثلاث معلمات، أي، ربط المسافة القصوى = 15، الفجوة إغلاق أقصى المسافة = 15 والفجوة الحد الأقصى إغلاق الفجوة الإطار = 5.
ملاحظة: المسافة ذات الحد الأقصى للربط هي إزاحة الحد الأقصى للنقطة بين إطارين. المسافة القصوى لإغلاق الفجوة هي أقصى إزاحة من جزأين. الفجوة الحد الأقصى للفجوة الحد الأقصى هو الإطار الأكبر بين نقطتين يمكن سدها. - انقر فوق "التالي" لتعقب. عند الانتهاء، استمر في النقر فوق"التالي".
- تعيين المرشحات على المسارات، مثل تعيين عدد من البقع في المسار فوق 300.
- الحفاظ على النقر فوق "التالي" حتى لوحة الحفظ النهائي مفتوحة. حدد"تصدير المسارات إلى ملف XML"من القائمة المنسدلة، ثم انقر فوق "تنفيذ" لحفظ في تنسيق csv.
- قيم R/G
ملاحظة: يتم الحصول على كثافة التشتت من AuNRs المستهدفة في قنوات R و G من صور الحقول الداكنة اللون باستخدام رمز مكتوب في MATLAB (https://github.com/fenggeqd/JOVE-2020/tree/master/RGandPolarangle)، ويتم عرض مبدأ الاستخراج في الشكل 6.- استخدم دالة xycoordination.m للعثور على تنسيق بكسل الوسط لـ AuNR في كل إطار وفقًا لإحداثيات س ص (المستخرج بواسطة ImageJ/Fiji).
- استخدم وظيفة RGextraction.m لتحديد مصفوفة 3 × 3 بكسل، واستخراج قيم 9 مبعثر كثافة من قنوات R أو G، وحساب قيمة متوسطة (μ، تعرف بأنها R أو G).
ملاحظة: 3 × 3 بكسل المصفوفة هو توسيط على الإحداثيات بكسل الحصول عليها من الخطوة 4.3.1.
- زاوية قطبية
ملاحظة: الزاوية القطبية هي الزاوية بين خط الطول لـ AuNR والمحور البصري (كما هو موضح في الشكل 1)، والتي يمكن أن تعكس ديناميكيات الدوران المكانية (المحور Z) لـ AuNR.- استخدام وظيفة polarangle.m لحساب الزوايا القطبية (θ) من قبل طريقة تفاضلية مزدوجة القناة22،
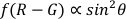 .
.
- استخدام وظيفة polarangle.m لحساب الزوايا القطبية (θ) من قبل طريقة تفاضلية مزدوجة القناة22،
5 - تحليل البيانات
ملاحظة: يعد وجود إطار تحليل بيانات منهجي وقوي أمرًا أساسيًا لأداء وكفاءة أساليب التحليل الخاصة بالـ SPT. يتم استخدام البرامج المخصصة المكتوبة في MATLAB (https://github.com/fenggeqd/JOVE-2020/tree/master/Analysis_parameters). يتم استخدام برنامج الرسم البياني والتحليل (انظر جدول المواد)لرسم المؤامرات.
- معلمات التحليل
- استخدم البرامج النصية csv_data_extract_dis_vel_ss.m csv_data_MSD.m لحساب المعلمات الديناميكية وفقًا للصيغ المبينة في الجدول 1.
ملاحظة: هذه المعلمات تستخدم لتحليل ديناميكيات أونورز وتتألف من ثلاثة أجزاء. (1) المسار المعلمات ذات الصلة: التشريد، وحجم الخطوة، والسرعة، ونصف قطر الدوران (Rز)،وتحول زاوية (Tأ); (2) معلمات MSD: معامل الانتشار (Dt)وأس الانتشار غير الطبيعي (α)؛ و (3) المعلمات ذات الصلة التناوب: زاوية القطبية والقدرة على الدوران (σ).
- استخدم البرامج النصية csv_data_extract_dis_vel_ss.m csv_data_MSD.m لحساب المعلمات الديناميكية وفقًا للصيغ المبينة في الجدول 1.
| التدابير | تعريف | معنى طبيعيّة | |
| التشريد | 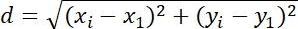 | التغييرات في موضع الكائنات | |
| حجم الخطوة | 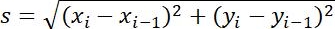 | المسافة بين نقطتين متجاورتين | |
| السرعه |  | سرعة حركة الكائنات | |
| Rز | 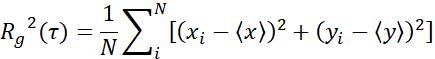 | نقل نطاق الكائنات في فاصل زمني محدد | |
| Ta | 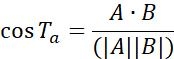 | اتجاه الحركة للأجسام بين نقطتين متجاورتين | |
| Msd | 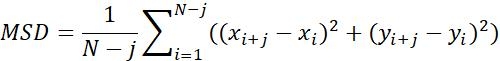 | متوسط المسافة المتحركة للكائنات في فاصل زمني محدد | |
| Dt | 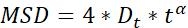 | قدرة انتشار الكائنات | |
| Α | 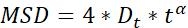 | انتشار عاديّة (α ~ 1) | |
| زاوية قطبية |  | معلومات اتجاه ثلاثي الأبعاد للكائنات | |
| σ |  | درجة تشتت مجموعة بيانات الزاوية القطبية | |
الجدول 1: ثلاثة أنواع من المعلمات المستخدمة في التحليل. وتشمل هذه المعلمات ذات الصلة بالمسار (التشريد، وحجم الخطوة، والسرعة، وRg و Ta)،والمعلمات MSD (MSD و Dt α) والمعلمات ذات الصلة بالتناوب (الزاوية القطبية والقدرة الدورانية).
- التحليل البصري للمسار
ملاحظة: يمكن أن يعرض تصور المسار بشكل حدسي التغاير الزمني لحركة الجسيمات وتوزيع المسار (الإحداثي) للبارامترات الديناميكية، مثل مسار رسم الوقت، Rg- و Dt-mapping مسار، ومسار رسم الخرائط بزاوية قطبية. ورسمت مسارات رسم الخرائط باستخدام برنامجي الرسم البياني والتحليل.- تعيين x إحداثيات كـ X، y إحداثيات كـ Y، والوقت (Rg،Dt،الزاوية القطبية) كـ Z.
- انقر على "| الرسم | مؤامرة مبعثر لون رسم الخرائط مؤامرة".
- إضافة شريط الألوان.
- تحليل MSD
ملاحظة: يمكن الحصول على نشاط الحركة ووضع الحركة للجسيمات بواسطة تحليل MSD23. كلما كانتTD أكبر ، كلما كانت حركة نشر الجسيمات أكثر نشاطًا. عندما α ~ 1 ، والجسيمات تفعل حركة الانتشار العادي ، وإلا فإنها تؤدي حركة انتشار غير طبيعية.- أرقام MSD-τ
- تعيين الفاصل الزمني (τ) كـ X، بيانات MSD كـ Y.
- انقر على "| الرسم مؤامرة مبعثر"
- احتواء البيانات بالنقر على"تحليل | تركيب | تركيب المنحنى غير الخطي (دالة: Allometricl)".
- MSD-τ مزدوجة لوغاريتمية الرقم
ملاحظة: MSD-τ 1-logarithmic الرقم، الذي المنحدر هو α واعتراض هو Dt،يمكن أن تقدم حدسي حركة الجسيمات.- تعيين الفاصل الزمني اللوغاريتمي كـ X، وMSD لوغاريتمي كـ Y.
- انقر على "| الرسم مؤامرة مبعثر".
- احتواء البيانات بالنقر على"تحليل | تركيب | منحنى خطي مناسب".
- D-τ الرقم (MSD/4t)
ملاحظة: D = MSD/4τ، هو دالة من عامل الوقت الشذوذ α، والرقم D-τ يظهر مباشرة التغير في معامل الانتشار مع مرور الوقت. عندما يزيد D مع مرور الوقت، α أكبر من 1 والجسيمات تفعل حركة فائقة.- تعيين الفاصل الزمني اللوغاريتمي (τ) كـ X، D اللوغاريتمي كـ Y.
- انقر على "| الرسم مؤامرة مبعثر".
- احتواء البيانات بالنقر على"تحليل | تركيب | تركيب المنحنى غير الخطي (دالة: "Allometricl")".
ملاحظة: كلما كانت المسارات أقصر، كلما ارتفعت عدم دقة تقديرات الانتشار. بشكل عام، Dt α من خلال تحليل MSD-τ من فترة زمنية طويلة (> 30 τ) تم الحصول عليها. ومع ذلك، فإن تركيب بسيطة وخامية سلاسة الخروج تفاصيل الحركة. وبالتالي، ينبغي إجراء تحليل MSD-τ لوقت الفاصل الزمني القصير (< 10 τ) لتحليل سلوك الحركة من الجسيمات في وقت قصير.
- أرقام MSD-τ
- التحليل الإحصائي
- التحليل الإحصائي متعدد الجسيمات
ملاحظة: يمكن أن يعكس التحليل الإحصائي متعدد الجسيمات حالة حركة الجسيمات في منطقة مكانية، مما يشير بشكل غير مباشر إلى بيئة التغاير المكانية. على سبيل المثال، إذا كان الرسم البياني لD t يعرض توزيعاً واسع النطاق أو توزيع قمم متعددة، فهذا يعني أن أنشطة الحركة للجسيمات غير متجانسة.- تعيين المعلمات الديناميكية (مثل Dt، Rز، أقصى النزوح) كما Y.
- انقر على "| الرسم الرسم البياني".
- انقر نقراً مزدوجاً فوق الرسم البياني، ثم قم بتعيين حجم القسمة أو عدد الأقسام. انقر على "تطبيق".
- تحليل إحصائي أحادي الجسيمات
ملاحظة: يمكن أن يبين التحليل الإحصائي لجسيمات مفردة سلوك حركة الجسيمات الفردية، والذي يعكس أيضا بشكل غير مباشر التغاير الزمني للورائية للبيئة المحيطة.- إطارات متعددة
- حساب المعلمات الديناميكية (مثلT،حجم الخطوة، الزاوية القطبية) من جميع إطارات مسار طويل واحد، ونسخ إلى جدول Origin وتعيين كـ Y.
- انقر على "| الرسم الرسم البياني".
- انقر نقراً مزدوجاً فوق الرسم البياني، ثم قم بتعيين حجم القسمة أو عدد الأقسام. انقر على "تطبيق".
ملاحظة: إذا كان كل من Tوخطوة حجم يحمل توزيع قيمة صغيرة، والجسيمات القيام بحركة نشر فائقة خطوة صغيرة.
- نقل النوافذ
- حساب المعلمات الديناميكية (مثل Rز،Dt)من جميع الإطارات من مسار طويل واحد من خلال تحريك النافذة طريقة (11 إطار)، ونسخ إلى جدول الأصل وتعيين كY.
- انقر على "| الرسم الرسم البياني".
- انقر نقراً مزدوجاً فوق الرسم البياني، ثم قم بتعيين حجم القسمة أو عدد الأقسام. انقر على "تطبيق".
- إطارات متعددة
- التحليل الإحصائي متعدد الجسيمات
- تحليل السلاسل الزمنية
ملاحظة: يمكن أن يكشف التحليل الإحصائي عن حالة الحركة من NPs، وتحليل السلاسل الزمنية يمكن أن يقدم سلوك الحركة كملحق. الجمع بين العديد من معلمات السلاسل الزمنية، فإنه يمكن التمييز بين سلوك الحركة من NPs على المستويين الزماني والمكاني.- تعيين الوقت كما X، المعلمات سلسلة زمنية كما Y (مثل التشريد، زاوية القطبيةوR ز).
- انقر على "| الرسم | مخطط متعدد الأجزاء | مخطط مكدس خط + رمز".
Access restricted. Please log in or start a trial to view this content.
النتائج
في البروتوكول، تم استخدام 40 × 85 نانومتر غير معدلة CTAB-AuNRs. كما هو مبين في الشكل 2B، الحد الأقصى لـ plasmonic الطولي هو 650 نانومتر (المنطقة الحمراء) والرنين العرضي هو في 520 نانومتر (المنطقة الخضراء). وقد كشفت الآداب السابقة أن الخصائص البصرية (مثل كثافة LSPR) من Plasmonic AuNRs سوف تتغير بشكل كب...
Access restricted. Please log in or start a trial to view this content.
Discussion
يتم استخدام البروتوكول المقدم لدراسة ديناميات الـ AuNRs على غشاء الخلية. ويتألف البروتوكول من أربعة أجزاء، بما في ذلك التصوير المجهري، واستخراج البيانات، وحساب المعايير الديناميكية، وطرق تحليل البيانات، وكل جزء مرن وعالمي. لذلك ، هناك العديد من التطبيقات المستقبلية المحتملة ، على سبيل ال?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
ليس لدى أصحاب البلاغ ما يكشفون عنه.
Acknowledgements
وقد دعم هذا العمل المؤسسة الوطنية الصينية للعلوم الطبيعية بالأرقام التي منحتها 21425519 و91853105 و21621003.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| CTAB coated gold nanorods(CTAB-AuNRs) | Nanoseedz | NR-40-650 | 85 nm * 40 nm |
| Color CMOS camera | Olympus | DP74 | Japan |
| Coverslips | Citoglas | z10212222C | 22*22 mm |
| Dark-field microscopy | Nikon | 80i | upright microscope |
| Fetal bovine serum (FBS) | Gibco | 10099141 | |
| Fiji | National Institutes of Health | 2.0.0-rc-69/1.52 p | a distribution of ImageJ |
| Grooved glass slide | Sail brand | 7103 | Single concave |
| Image J | National Institutes of Health | 1.52 j | |
| MATLAB | MathWorks | R2019b | |
| MATLAB Code | https://github.com/fenggeqd/JOVE-2020 | ||
| Minimum essential medium (MEM) | Gibco | 10-010-CVR | with phenol red |
| Minimum essential medium (MEM) | Gibco | 51200038 | no phenol red |
| Origin | OriginLab | Origin Pro 2018C | |
| Penicillin-streptomycin | Gibco | 15140122 | |
| Plastic cell culture dishes | Falcon | 353002 | |
| Plastic cell culture dishes | Falcon | 353001 | 35*10 mm |
| U87 MG cell | American Type Culture Collection | ATCC HTB-14 | a human primary glioblastoma cell line |
References
- Rees, P., Wills, J. W., Brown, M. R., Barnes, C. M., Summers, H. D. The origin of heterogeneous nanoparticle uptake by cells. Nature Communication. 10 (1), 2341(2019).
- Behzadi, S., et al. Cellular uptake of nanoparticles: journey inside the cell. Chemical Society Reviews. 46 (14), 4218-4244 (2017).
- Shen, H., et al. Single Particle Tracking: From Theory to Biophysical Applications. Chemical Reviews. 117 (11), 7331-7376 (2017).
- Saxton, M. J. Single-particle tracking: connecting the dots. Nature Methods. 5 (8), 671-672 (2008).
- Kusumi, A., et al. Dynamic organizing principles of the plasma membrane that regulate signal transduction: commemorating the fortieth anniversary of Singer and Nicolson's fluid-mosaic model. Annual Review of Cell and Developmental Biology. 28, 215-250 (2012).
- Jacobson, K., Liu, P., Lagerholm, B. C. The Lateral Organization and Mobility of Plasma Membrane Components. Cell. 177 (4), 806-819 (2019).
- Sezgin, E., Levental, I., Mayor, S., Eggeling, C. The mystery of membrane organization: composition, regulation and roles of lipid rafts. Nature Reviews Molecular Cell Biology. 18 (6), 361-374 (2017).
- von Diezmann, A., Shechtman, Y., Moerner, W. E. Three-Dimensional Localization of Single Molecules for Super-Resolution Imaging and Single-Particle Tracking. Chemical Reviews. 117 (11), 7244-7275 (2017).
- Rosenberg, J., Huang, J. Visualizing Surface T-Cell Receptor Dynamics Four-Dimensionally Using Lattice Light-Sheet Microscopy. Journal of Visualized Experiments. (155), e59914(2020).
- Kusumi, A., Tsunoyama, T. A., Hirosawa, K. M., Kasai, R. S., Fujiwara, T. K. Tracking single molecules at work in living cells. Nature Chemical Biology. 10 (7), 524-532 (2014).
- Rocha, J. M., Gahlmann, A. Single-Molecule Tracking Microscopy - A Tool for Determining the Diffusive States of Cytosolic Molecules. Journal of Visualized Experiments. (151), e59387(2019).
- Uphoff, S., Sherratt, D. J., Kapanidis, A. N. Visualizing protein-DNA interactions in live bacterial cells using photoactivated single-molecule tracking. Journal of Visualized Experiments. (85), e511177(2014).
- Pinaud, F., Clarke, S., Sittner, A., Dahan, M. Probing cellular events, one quantum dot at a time. Nature Methods. 7 (4), 275-285 (2010).
- Mehidi, A., et al. Transient Activations of Rac1 at the Lamellipodium Tip Trigger Membrane Protrusion. Current Biology. 29 (17), 2852-2866 (2019).
- Ye, Z., Wang, X., Xiao, L. Single-Particle Tracking with Scattering-Based Optical Microscopy. Analytical Chemistry. 91 (24), 15327-15334 (2019).
- Pan, Q., Zhao, H., Lin, X., He, Y. Spatiotemporal Heterogeneity of Reactions in Solution Observed with High-Speed Single-Nanorod Rotational Sensing. Angewandte Chemie. International Ed. in English. 58 (25), 8389-8393 (2019).
- Taylor, R. W., et al. Interferometric scattering microscopy reveals microsecond nanoscopic protein motion on a live cell membrane. Nature Photonics. 13 (7), 480-487 (2019).
- Chen, K., et al. Characteristic rotational behaviors of rod-shaped cargo revealed by automated five-dimensional single particle tracking. Nature Communication. 8 (1), 887(2017).
- Xu, D., He, Y., Yeung, E. S. Y. Direct observation of the orientation dynamics of single protein-coated nanoparticles at liquid/solid interfaces. Angewandte Chemie. International Ed. in English. 53 (27), 6951-6955 (2014).
- Lehui, X., Yan, H., Edward, S. Y. Three Dimensional Orientational Imaging of Nanoparticles with Darkfield Microscopy. Analytical Chemistry. 82, 5268-5274 (2010).
- Ge, F., Xue, J., Wang, Z., Xiong, B., He, Y. Real-time observation of dynamic heterogeneity of gold nanorods on plasma membrane with darkfield microscopy. Science China Chemistry. 62, 1072-1081 (2019).
- Tinevez, J. Y., et al. TrackMate: An open and extensible platform for single-particle tracking. Methods. 115, 80-90 (2017).
- Janczura, J., Weron, A. Ergodicity testing for anomalous diffusion: small sample statistics. The Journal of Chemical Physics. 142 (14), 144103(2015).
- Kim, D. H., et al. Single particle tracking-based reaction progress kinetic analysis reveals a series of molecular mechanisms of cetuximab-induced EGFR processes in a single living cell. Chemical Science. 8 (7), 4823-4832 (2017).
- Kurzthaler, C., et al. Probing the Spatiotemporal Dynamics of Catalytic Janus Particles with Single-Particle Tracking and Differential Dynamic Microscopy. Physical Review Letters. 121 (7), 078001(2018).
- Lin, X., Pan, Q., He, Y. In situ detection of protein corona on single particle by rotational diffusivity. Nanoscale. 11 (39), 18367-18374 (2019).
- Wei, L., et al. Sub-diffraction-limit localization imaging of a plasmonic nanoparticle pair with wavelength-resolved dark-field microscopy. Nanoscale. 9 (25), 8747-8755 (2017).
- Cheng, X., Dai, D., Xu, D., He, Y., Yeung, E. S. Subdiffraction-limited plasmonic imaging with anisotropic metal nanoparticles. Analytical Chemistry. 86 (5), 2303-2307 (2014).
- Belyy, V., et al. PhotoGate microscopy to track single molecules in crowded environments. Nature Communication. 8, 13978(2017).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved