Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Визуализация диффузной динамики золотых нанородов на клеточной мембране с помощью одной наночастицы Darkfield Microscopy
В этой статье
Резюме
Здесь мы показываем использование традиционной микроскопии темного поля для мониторинга динамики нанородов золота (AUNRs) на клеточной мембране. Местоположение и ориентация отдельных AUNRs обнаруживаются с помощью ImageJ и MATLAB, а диффузные состояния AUNRs характеризуются анализом отслеживания отдельных частиц.
Аннотация
Анализ диффузной динамики наночастиц на клеточной мембране играет значительную роль в лучшем понимании процесса поглощения клеток и обеспечивает теоретическую основу для рационального проектирования доставки нано-медицины. Анализ слежения за отдельными частицами (SPT) может исследовать положение и ориентацию отдельных наночастиц на клеточной мембране и выявить их трансляционные и вращательное состояния. Здесь мы покажем, как использовать традиционную микроскопию темного поля для мониторинга динамики нанородов золота (AUNRs) на мембране живых клеток. Мы также показываем, как извлечь расположение и ориентацию AuNRs с помощью ImageJ и MATLAB, и как охарактеризовать диффузные состояния AUNRs. Статистический анализ сотен частиц показывает, что одиночные AUNRs выполняют броуианское движение на поверхности мембраны клеток U87 MG. Однако индивидуальный анализ длинной траектории показывает, что AUNRs имеют два совершенно разных типа состояний движения на мембране, а именно транспортировку на большой дальности и ограничение зоны заключения. Наши методы SPT потенциально могут быть использованы для изучения поверхности или внутриклеточной диффузии частиц в различных биологических клетках и могут стать мощным инструментом для исследования сложных клеточных механизмов.
Введение
Динамика наночастиц (NPs) на мембране тесно связана с клеточным процессом поглощения, который необходим для понимания клеточных функций, вирусных или бактериальных инфекций и развития искусственных нанометических систем доставки1,2. Техника отслеживания отдельных частиц (SPT) является надежным инструментом для характеристики неоднородного поведения NPs3,4. В целом, клеточная мембрана является жидкой, что означает, что такие компоненты, как белки и липиды могут двигаться боково вплазменной мембране плоскости 5,6,7. Spatiotemporal сложность мембраны организации и структуры может привести к spatiotemporal неоднородность взаимодействия между NPs и мембраны. Следовательно, прямая визуализация движения NPs на мембране требует как высокого пространственного, так и временного разрешения.
Микроскопия слежения за отдельными частицами, которая отслеживает локализацию отдельных частиц в живых клетках с пространственным разрешением в десятки нанометров и разрешением времени миллисекунд, была хорошо разработана для изучения NPs или мембранных молекулдинамики 8,9. Флуоресценция основе микроскопических методов визуализации стали ценными инструментами для наблюдения NPs /молекулы в среде живых клеток 9,10,11,12. Например, общая внутренняя флуоресцентная микроскопия отражения, которая изображения тонких слоев (100 нм) образца на подложке / раствор интерфейс с высоким spatiotemporal разрешение широко используется в исследованиях мембранных молекулдинамики 13,14. Тем не менее, присущие недостатки одиночных флюорофоров, таких как низкая интенсивность и быстрое необратимое фотоотлив снижают точность и продолжительность отслеживания13. Таким образом, нефлуоресцентные плазмонные NPs, которые заменяют флуоресцентные зонды, привлекают все больше и больше внимания в долгосрочных исследованиях изображений из-за их уникальныхоптических характеристик 15. На основе рассеяния сигналов плазмонные зонды NP, несколько видов оптических микроскопических технологий визуализации были использованы для изучения механизма биологических процессов, таких как темно-полевой микроскопии (DFM)16, интерферометрические рассеяния (iSCAT)микроскопии 17 и дифференциального вмешательства контрастной микроскопии (DICM)18. Кроме того, динамику движения и вращения AUNRs можно получить с помощью DFM и DICM18,19,20,21,22. Как правило, в эксперименте SPT движение объекта записывается оптическим микроскопом, а затем анализируется методами анализа SPT3. Решенные по времени траектории и ориентационные углы, генерируемые отдельными NPs, как правило, стохастичны и неоднородны, поэтому необходимо представить обильную динамическую информацию с помощью различных методов анализа.
Здесь мы предоставляем интегрированный протокол, который отслеживает динамику AUNRs на клеточной мембране с помощью DFM, извлекает расположение и ориентацию AuNRs с ImageJ и MATLAB и характеризует распространение AuNRs с методами анализа SPT. В качестве демонстрации мы показываем здесь, как использовать протокол SPT для визуализации динамики неизмененных AuNRs (CTAB-AuNRs, синтезированных cetyltrimethylammonium молекулы бромида аммония в качестве защитного агента) на мембране клеток U87 MG. Было продемонстрировано, что CTAB-AuNRs может адсорбировать белки в биологической среде, двигаться по клеточной мембране, а затемвойти в клетки 2,20,22. Клетка U87 MG является наиболее распространенной и злокачественной опухолью центральной нервной системы, а ее мембранные рецепторы аномально выражены. Мембранные рецепторы могут взаимодействовать с белками на AUNRs, которые влияют на динамику AUNRs. Наш протокол, как правило, применим к другим экспериментам SPT в области биологии.
протокол
1. Культура клеток
- Подготовка полной среды для клеток U87 MG путем добавления сыворотки крупного рогатого скота плода (окончательная концентрация 10%) и пенициллин-стрептомицин (окончательная концентрация 1%) до минимальной необходимой среды (MEM). Используйте пластиковые клетки культуры блюдо для клеток субкультуры.
- Проходные ячейки от 2 до 3 раз в неделю.
- Удалите культурную среду и промойте клеточный слой фосфатным солевым раствором Dulbecco (D-PBS) в 2-3 раза при слиянии (80%-90%).
- Добавьте от 1,0 до 2,0 мл раствора трипсина-ЭДТА в блюдо клеточной культуры и наблюдайте за клетками под перевернутым микроскопом до тех пор, пока клетки не станут круглыми (3-5 мин).
- Добавьте 3,0 мл подготовленной полной среды и рассейте ячейки, аккуратно трубя.
- Добавьте клеточную суспензию (1 мл) в новое блюдо культуры со свежей клеточной средой (3 мл) и повторно посовестит клетки.
- Поддерживайте клетки при 37 градусах Цельсия и 5% CO2 во влажной атмосфере.
2. Микроскоп слайд подготовки
ПРИМЕЧАНИЕ: В экспериментах SPT используются клетки U87 MG третьего-десятого поколения с высокой активностью.
- Стерилизовать 22 мм × 22 мм крышки уже очищены раствором Piranha путем погружения в этанол (99,9%).
- Используйте типсы, чтобы вынул крышку скольжения из этанола раствор (шаг 2.1) и стерилизовать путем сжигания этанола на огне. После того, как весь этанол сжигается, поместите крышки в пластиковую тарелку культуры клеток (35 х 10 мм), наполненную 2 мл клеточной среды (без фенола красного цвета).
- Добавьте 50 МКЛ клеточной суспензии из шага 1.2.3 на крышку и аккуратно нажмите блюдо вперед и назад и влево и вправо, чтобы равномерно распределить клетки. Поместите его во увлажненную атмосферу.
- Когда U87 MG-клетки на крышке достигают 20%-40% слияния (12 л), добавьте в блюдо 20 л CTAB-AuNRs (138 pM) и рассейтесь. Инкубировать в увлажненной атмосфере в течение 5 минут.
- Добавьте 100 МКЛ среды культуры (без фенола красного) из блюда в шаге 2.4 в паз рифленого стеклянного слайда(рисунок 1), который предварительно почерпнут раствором Пиранья.
- Возьмите крышку из блюда и перевернутый на верхней части паза микроскопа стеклянный слайд (Рисунок 1). Печать с лаком для ногтей, дайте ему высохнуть и поместите его на сцену для выполнения экспериментов SPT.
3. Выполнение экспериментов по отслеживанию отдельных частиц с помощью микроскопии темного поля(рисунок 1).
- Поместите каплю масла на масляный конденсатор темного поля (NA 1.43-1.20) и поверните ручку, чтобы конденсатор соердировал со стеклянной горкой.
- Положите каплю масла в верхней части крышки стекла и поверните фокусировку ручку, чтобы сделать 60x цель погружения масла (NA 0.7-1.25) коснуться масла.
- Включите источник света и слегка поверните фокусировку ручки, чтобы сфокусировать плоскость изображения.
ПРИМЕЧАНИЕ: В поле зрения фон черный, клетки яркие, а CTAB-AuNRs (соотношение сторон 2:1, рисунок 2) являются небольшими цветными (красными, желтыми или зелеными) пятнами рассеяния. - Захват образца рассеяния света цветной камерой CMOS. Нажмите "Значок камеры" в программном обеспечении для записи и экспорта формата TIFF для сохранения изображений.
4. Сбор данных
- Извлечение одной долгосрочной траектории
- Работа, как описано на рисунке 3, чтобы преобразовать изображения темного поля тайм-ряда из режима "RGB color" в режим "8 бит". На изображении J нажмите Изображение | Тип | 8 бит. Чтобы настроить контраст, щелкните Image | Отрегулируйте | Яркость | Контрастность.
- Выберите целевую частицу и отрежьте фоны тайм-ряда, боксуя и удаляя фон спомощью " Ctrl-X".
- Откройте окно обнаружения частиц и соединения частиц, нажав на"Плагины | Частица Tracker Классический | Отслеживание частиц".
- Установите радиус до 6, отсечения до 0 и процентиль до 0,01%.
ПРИМЕЧАНИЕ: Чтобы обнаружить частицу, отрегулируйте выше трех параметров с помощью предварительного просмотра. Убедитесь, что радиус немного больше целевой частицы и меньше, чем самое маленькое разделение между частицами. Процентиль является нижним пределом распределения интенсивности, который должен быть кандидатом частиц. - Установите диапазон ссылок до 5 и перемещение до 10.
ПРИМЕЧАНИЕ: Чтобы связать частицу между последовательными смежными кадрами, отрегулируйте два вышеуказанных параметра. Перемещение является максимальным пикселей, что частица может перемещаться между двумя последующих кадров, и ссылка диапазон количество последовательных кадров, чтобы рассмотреть при определении наилучшего соответствующего соответствия. - Нажмите" OK", чтобы открыть окно результаты ParticleTracker, чтобы увидеть результаты.
- Нажмите "Visualize All Trajectories", чтобы проверить генерируемые траектории.
- Нажмитеменю Relink Particlesв верхней части, чтобы повторно связать обнаруженные частицы с различным диапазоном ссылок и параметрами процентиля, если траектория, генерируемая программным обеспечением, не соответствует траектории движения AuNR.
- Нажмитекнопку "Сохранить полныйотчет", чтобы сохранить результаты, если программное обеспечение генерируется траектории и траектории движения AuNR совпадают.
ПРИМЕЧАНИЕ: Пример извлечения одной долгосрочной траектории с изображением J показан на рисунке 4.
- Извлечение мульти-траекторий
ПРИМЕЧАНИЕ: Пример извлечения мульти-траекторий с Фиджи показан на рисунке 5. Есть несколько этапов, и каждый этап представляет собой шаг в процессе отслеживания. Результат каждого шага отображается немедленно, что позволяет пользователю вернуться к корректировке настроек, когда выход неудовлетворительный.- Работа, как описано на рисунке 3, чтобы преобразовать изображения темного поля тайм-ряда из режима "RGB color" в режим "8 бит". На изображении J путь нажмите "Image | Тип | 8 бит". Чтобы скорректировать их контраст, нажмите "Image | Отрегулируйте | Яркость | Контраст".
- Откройте панель старта, нажав "Плагины | Отслеживание | TrackMate". Нажмите кнопку"Следующий".
- Выберите«детектор LoG»из меню высадки и нажмите кнопку«Следующий».
- Отрегулируйте параметры панели конфигурации детектора. Установите расчетный диаметр капли до 10, установите порог до 0 и выберите«У субки пиксельной локализации».
- Нажмитекнопку"Следующий", чтобы открыть начальную панель фильтрации пятна.
ПРИМЕЧАНИЕ: Несколько параметров могут быть скорректированы для дальнейшей оптимизации целевых точек. В этом примере другие параметры не были скорректированы. - Нажмитекнопку"Следующий"и выберите "HyperStack displayer"из выпадают из меню.
- Нажмитекнопку"Следующий", чтобы открыть панель фильтрации Spot. Установите качество выше 1,88, X выше 38,86, Y выше 56,54.
- Нажмитекнопку"Следующий" ивыберите " Простойтрекер LAP " из выпадают меню. Настройте простой трекер LAP, регулируя три параметра, то есть, Связывающее максимальное расстояние No 15, максимальное расстояние разрыва 15 и разрыв-закрытие максимального разрыва кадра No 5.
ПРИМЕЧАНИЕ: Максимальное расстояние — это максимальное перемещение точки между двумя кадрами. Максимальное расстояние закрытия зазоров — это максимальное смещение двух сегментов. Разрыв закрытия максимальный разрыв кадра является крупнейшим кадр между двумя точками, которые будут решены. - Нажмитекнопку"Следующий", чтобы отслеживать. После завершения, продолжайте нажимать "Следующий".
- Установите фильтры на треки, такие как набор Количество пятен в треке выше 300.
- Продолжайте нажимать" Следующий" до окончательного сохранить панель открыта. Выберите«Экспортные треки в файл XML»из выпадают из меню, а затем нажмите«Execute»,чтобы сэкономить в формате csv.
- Значения R/G
ПРИМЕЧАНИЕ: Рассеяние интенсивности целевых AUNRs в R и G каналов получены из цветных изображений темного поля с помощью кода, написанного в MATLAB (https://github.com/fenggeqd/JOVE-2020/tree/master/RGandPolarangle), и принцип извлечения представлен на рисунке 6.- Используйте функцию ксикоординации.m чтобы найти центральную пиксельную координату AuNR в каждом кадре в соответствии с координатами x-y (извлеченными ImageJ/Fiji).
- Используйте функцию RGextraction.m чтобы разграничить матрицу 3 x 3 пикселей, извлечь 9 значений интенсивности рассеяния R или G и рассчитать среднее значение (μ, определяемое как R или G).
ПРИМЕЧАНИЕ: Матрица 3 x 3 пикселей сосредоточена на координатах пикселей, полученных с шага 4.3.1.
- Полярный угол
ПРИМЕЧАНИЕ: Полярный угол является углом между долготой AuNR и оптической оси (как показано на рисунке 1), который может отражать пространственную динамику вращения AuNR.- Используйте функцию полярного .m для расчета полярных углов (θ) методом дифференциаладвухканлайного канала 22,
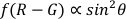 .
.
- Используйте функцию полярного .m для расчета полярных углов (θ) методом дифференциаладвухканлайного канала 22,
5. Анализ данных
ПРИМЕЧАНИЕ: Систематическая и надежная система анализа данных имеет важное значение для производительности и эффективности методов анализа SPT. Используется пользовательское программное обеспечение, написанное в MATLAB (https://github.com/fenggeqd/JOVE-2020/tree/master/Analysis_parameters). Для рисования участков используется программное обеспечение для графики ианализа (см. таблицу материалов).
- Параметры анализа
- Используйте скрипты csv_data_extract_dis_vel_ss.m и csv_data_MSD.m динамические параметры по формулам, показанным в таблице 1.
ПРИМЕЧАНИЕ: Эти параметры используются для анализа динамики AUNRs и состоят из трех частей. (1) Параметры, связанные с траекторией: смещение, размер шага, скорость, радиус gyration (Rg), и угол поворота (Ta); (2) Параметры MSD: коэффициент диффузии (Dt)и аномальный показатель диффузии (α); и (3) Параметры вращения: полярный угол и вращательное lability (σ).
- Используйте скрипты csv_data_extract_dis_vel_ss.m и csv_data_MSD.m динамические параметры по формулам, показанным в таблице 1.
| Меры | Определение | Физическое значение | |
| Смещения | 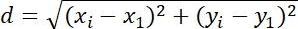 | Изменения в положении объектов | |
| Размер шага | 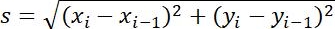 | Расстояние между двумя смежными точками | |
| Скорость |  | Скорость движения объектов | |
| Rг | 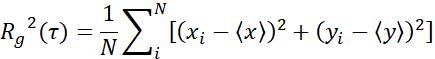 | Перемещение диапазона объектов в определенном промежутке времени | |
| Ta | 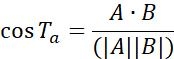 | Направление движения объектов между двумя смежными точками | |
| Msd | 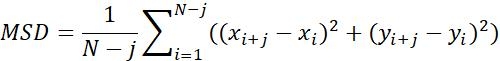 | Среднее расстояние перемещения объектов в определенном промежутке времени | |
| Dt | 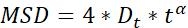 | Диффузионная способность объектов | |
| Α | 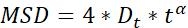 | Нормальная диффузия (α-1) | |
| Полярный угол |  | Информация о 3D-ориентации объектов | |
| Σ |  | Степень дисперсии набора данных полярного угла | |
Таблица 1: Три типа параметров, используемых для анализа. К ним относятся параметры, связанные с траекторией (перемещение, размер шага, скорость, Rg иT a), параметры MSD (MSD, Dt и α) и связанные с вращением параметры (полярный угол и лябельность вращения).
- Визуальный анализ траектории
ПРИМЕЧАНИЕ: Визуализация траектории может интуитивно представить spatiotemporal неоднородность движения частиц и траектории (координации) распределения динамических параметров, таких как траектория картирования времени, Rg- и Dt-картографическая траектория, и полярно-угловая картографическая траектория. Картографические траектории были составлены с помощью программного обеспечения для графики и анализа.- Установите x координаты как X, y координируйте как Y, и время (Rg,Dt,полярный угол) как q.
- Нажмите "Участок | Разрозненные сюжетные | Цвет-отображение Участок".
- Добавьте цветовую гамму.
- Анализ MSD
ПРИМЕЧАНИЕ: Активность движения и режим движения частиц могут быть получены с помощью анализа MSD23. Чем больше Dt, тем активнее диффузионные движения частиц. когда α 1, частицы делают нормальное движение диффузии, в противном случае они выполняют ненормальное движение диффузии.- Цифры MSD-q
- Установите интервал времени (я) как данные X, MSD как Y.
- Нажмите "Участок | Сюжет рассеяния"
- Fit данных, нажав "Анализ | Установка | Нелинейная установка кривой (Функция: Алометрия)".
- Двойная логаритмическая фигура MSD-й
ПРИМЕЧАНИЕ: MSD-й двойной logarithmic фигура, чей склон α и перехват Dт, может интуитивно представить движение частиц.- Установите логаритмический интервал времени, как X, и логаритмический MSD как Y.
- Нажмите "Участок | Сюжет рассеяния".
- Fit данных, нажав "Анализ | Установка | Линейная кривая фитинг".
- Цифра D-я (MSD/4t)
ПРИМЕЧАНИЕ: D'MSD/4 ", является функцией времени и аномалии фактор α, и D-й цифра непосредственно показывает изменение коэффициента диффузии со временем. Когда D увеличивается со временем, α больше, чем 1 и частицы делают сверхдиффузионные движения.- Установите логаритмический интервал времени (я) как X, и логаритмический D как Y.
- Нажмите "Участок | Сюжет рассеяния".
- Fit данных, нажав "Анализ | Установка | Нелинейная установка кривой (Функция: "Алометрия")".
ПРИМЕЧАНИЕ: Чем короче траектории, тем выше погрешность оценок диффузии. В целом, были получены Dt α, полученные с помощью анализа MSD-и длительного интервального времени (nogt; 30). Тем не менее, простая и грубая примерка сгладит детали движения. Таким образом, для анализа движения поведения частиц в короткие сроки следует провести анализ короткого интервального времени (lt; 10) MSD-q.
- Цифры MSD-q
- Статистический анализ
- Многочастицы статистического анализа
ПРИМЕЧАНИЕ: Многочастицы статистический анализ может отражать состояние движения частиц в пространственной области, что косвенно указывает на пространственную неоднородность окружающей среды. Например, если гистограмма Dt демонстрирует крупномасштабное распределение или мульти-пики распределения, это означает, что движение деятельности частиц являются неоднородными.- Установите динамические параметры (такие как Dt,Rg,max смещение) как Y.
- Нажмите "Участок | Гистограмма".
- Дважды щелкните гистограмму и установите размер деления или количество делений. Нажмите "Применить".
- Статистический анализ с одной частицей
ПРИМЕЧАНИЕ: Статистический анализ отдельных частиц может показать движение поведения отдельных частиц, что также косвенно отражает spatiotemporal неоднородность окружающей среды.- Несколько кадров
- Рассчитайте динамические параметры (такие как Ta, размер шага, полярный угол) всех кадров одной длинной траектории, а также скопировать в таблицу Origin и установить как Y.
- Нажмите "Участок | Гистограмма".
- Дважды щелкните гистограмму и установите размер деления или количество делений. Нажмите "Применить".
ПРИМЕЧАНИЕ: Если размер Ta и step имеет небольшое распределение значений, частицы делают малошаговое сверхраспределяемое движение.
- Перемещение окон
- Рассчитайте динамические параметры (такие как Rg,Dt)всех кадров одной длинной траектории с помощью метода перемещения окна (11 кадров), а также скопировать в таблицу Origin и установить как Y.
- Нажмите "Участок | Гистограмма".
- Дважды щелкните гистограмму и установите размер деления или количество делений. Нажмите "Применить".
- Несколько кадров
- Многочастицы статистического анализа
- Анализ тайм-рядов
ПРИМЕЧАНИЕ: Статистический анализ может выявить состояние движения NPs, и анализ тайм-ряда может представить поведение движения в качестве дополнения. Комбинируя несколько параметров временных рядов, он может различать поведение движения NPs на временных и пространственных уровнях.- Установите время, как X, параметры тайм-ряда, как Y (например, смещение, полярный угол и Rg).
- Нажмите "Участок | Многофайленая диаграмма | Сложенные сюжетные | Линия и символ".
Результаты
В протоколе использовались неизмененные 40 х 85 нм CTAB-AuNRs. Как показано на рисунке 2B, его продольный плазмонный максимум составляет 650 нм (красная область) и поперечный резонанс находится на уровне 520 нм (зеленая область). Предыдущие литературы показали, что оптические свойс...
Обсуждение
Представленный протокол используется для изучения динамики AUNRs на клеточной мембране. Протокол состоит из четырех частей, включая микроскопическую визуализацию, извлечение данных, расчет динамических параметров и методы анализа данных, и каждая часть является гибкой и универсальной....
Раскрытие информации
Авторов нечего раскрывать.
Благодарности
Эта работа была поддержана Национальным фондом естественных наук Китая с номерами грантов 21425519, 91853105 и 21621003.
Материалы
| Name | Company | Catalog Number | Comments |
| CTAB coated gold nanorods(CTAB-AuNRs) | Nanoseedz | NR-40-650 | 85 nm * 40 nm |
| Color CMOS camera | Olympus | DP74 | Japan |
| Coverslips | Citoglas | z10212222C | 22*22 mm |
| Dark-field microscopy | Nikon | 80i | upright microscope |
| Fetal bovine serum (FBS) | Gibco | 10099141 | |
| Fiji | National Institutes of Health | 2.0.0-rc-69/1.52 p | a distribution of ImageJ |
| Grooved glass slide | Sail brand | 7103 | Single concave |
| Image J | National Institutes of Health | 1.52 j | |
| MATLAB | MathWorks | R2019b | |
| MATLAB Code | https://github.com/fenggeqd/JOVE-2020 | ||
| Minimum essential medium (MEM) | Gibco | 10-010-CVR | with phenol red |
| Minimum essential medium (MEM) | Gibco | 51200038 | no phenol red |
| Origin | OriginLab | Origin Pro 2018C | |
| Penicillin-streptomycin | Gibco | 15140122 | |
| Plastic cell culture dishes | Falcon | 353002 | |
| Plastic cell culture dishes | Falcon | 353001 | 35*10 mm |
| U87 MG cell | American Type Culture Collection | ATCC HTB-14 | a human primary glioblastoma cell line |
Ссылки
- Rees, P., Wills, J. W., Brown, M. R., Barnes, C. M., Summers, H. D. The origin of heterogeneous nanoparticle uptake by cells. Nature Communication. 10 (1), 2341 (2019).
- Behzadi, S., et al. Cellular uptake of nanoparticles: journey inside the cell. Chemical Society Reviews. 46 (14), 4218-4244 (2017).
- Shen, H., et al. Single Particle Tracking: From Theory to Biophysical Applications. Chemical Reviews. 117 (11), 7331-7376 (2017).
- Saxton, M. J. Single-particle tracking: connecting the dots. Nature Methods. 5 (8), 671-672 (2008).
- Kusumi, A., et al. Dynamic organizing principles of the plasma membrane that regulate signal transduction: commemorating the fortieth anniversary of Singer and Nicolson's fluid-mosaic model. Annual Review of Cell and Developmental Biology. 28, 215-250 (2012).
- Jacobson, K., Liu, P., Lagerholm, B. C. The Lateral Organization and Mobility of Plasma Membrane Components. Cell. 177 (4), 806-819 (2019).
- Sezgin, E., Levental, I., Mayor, S., Eggeling, C. The mystery of membrane organization: composition, regulation and roles of lipid rafts. Nature Reviews Molecular Cell Biology. 18 (6), 361-374 (2017).
- von Diezmann, A., Shechtman, Y., Moerner, W. E. Three-Dimensional Localization of Single Molecules for Super-Resolution Imaging and Single-Particle Tracking. Chemical Reviews. 117 (11), 7244-7275 (2017).
- Rosenberg, J., Huang, J. Visualizing Surface T-Cell Receptor Dynamics Four-Dimensionally Using Lattice Light-Sheet Microscopy. Journal of Visualized Experiments. (155), e59914 (2020).
- Kusumi, A., Tsunoyama, T. A., Hirosawa, K. M., Kasai, R. S., Fujiwara, T. K. Tracking single molecules at work in living cells. Nature Chemical Biology. 10 (7), 524-532 (2014).
- Rocha, J. M., Gahlmann, A. Single-Molecule Tracking Microscopy - A Tool for Determining the Diffusive States of Cytosolic Molecules. Journal of Visualized Experiments. (151), e59387 (2019).
- Uphoff, S., Sherratt, D. J., Kapanidis, A. N. Visualizing protein-DNA interactions in live bacterial cells using photoactivated single-molecule tracking. Journal of Visualized Experiments. (85), e511177 (2014).
- Pinaud, F., Clarke, S., Sittner, A., Dahan, M. Probing cellular events, one quantum dot at a time. Nature Methods. 7 (4), 275-285 (2010).
- Mehidi, A., et al. Transient Activations of Rac1 at the Lamellipodium Tip Trigger Membrane Protrusion. Current Biology. 29 (17), 2852-2866 (2019).
- Ye, Z., Wang, X., Xiao, L. Single-Particle Tracking with Scattering-Based Optical Microscopy. Analytical Chemistry. 91 (24), 15327-15334 (2019).
- Pan, Q., Zhao, H., Lin, X., He, Y. Spatiotemporal Heterogeneity of Reactions in Solution Observed with High-Speed Single-Nanorod Rotational Sensing. Angewandte Chemie. International Ed. in English. 58 (25), 8389-8393 (2019).
- Taylor, R. W., et al. Interferometric scattering microscopy reveals microsecond nanoscopic protein motion on a live cell membrane. Nature Photonics. 13 (7), 480-487 (2019).
- Chen, K., et al. Characteristic rotational behaviors of rod-shaped cargo revealed by automated five-dimensional single particle tracking. Nature Communication. 8 (1), 887 (2017).
- Xu, D., He, Y., Yeung, E. S. Y. Direct observation of the orientation dynamics of single protein-coated nanoparticles at liquid/solid interfaces. Angewandte Chemie. International Ed. in English. 53 (27), 6951-6955 (2014).
- Lehui, X., Yan, H., Edward, S. Y. Three Dimensional Orientational Imaging of Nanoparticles with Darkfield Microscopy. Analytical Chemistry. 82, 5268-5274 (2010).
- Ge, F., Xue, J., Wang, Z., Xiong, B., He, Y. Real-time observation of dynamic heterogeneity of gold nanorods on plasma membrane with darkfield microscopy. Science China Chemistry. 62, 1072-1081 (2019).
- Tinevez, J. Y., et al. TrackMate: An open and extensible platform for single-particle tracking. Methods. 115, 80-90 (2017).
- Janczura, J., Weron, A. Ergodicity testing for anomalous diffusion: small sample statistics. The Journal of Chemical Physics. 142 (14), 144103 (2015).
- Kim, D. H., et al. Single particle tracking-based reaction progress kinetic analysis reveals a series of molecular mechanisms of cetuximab-induced EGFR processes in a single living cell. Chemical Science. 8 (7), 4823-4832 (2017).
- Kurzthaler, C., et al. Probing the Spatiotemporal Dynamics of Catalytic Janus Particles with Single-Particle Tracking and Differential Dynamic Microscopy. Physical Review Letters. 121 (7), 078001 (2018).
- Lin, X., Pan, Q., He, Y. In situ detection of protein corona on single particle by rotational diffusivity. Nanoscale. 11 (39), 18367-18374 (2019).
- Wei, L., et al. Sub-diffraction-limit localization imaging of a plasmonic nanoparticle pair with wavelength-resolved dark-field microscopy. Nanoscale. 9 (25), 8747-8755 (2017).
- Cheng, X., Dai, D., Xu, D., He, Y., Yeung, E. S. Subdiffraction-limited plasmonic imaging with anisotropic metal nanoparticles. Analytical Chemistry. 86 (5), 2303-2307 (2014).
- Belyy, V., et al. PhotoGate microscopy to track single molecules in crowded environments. Nature Communication. 8, 13978 (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены