A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
استكمال نشاط الربط بواسطة Galectin-3 - U1 SnRNP مجمع على الخرز
In This Article
Summary
تصف هذه المقالة الإجراءات التجريبية ل(أ) استنفاد U1 snRNP من المستخلصات النووية، مع ما يصاحب ذلك من فقدان نشاط الربط؛ (ب) استنفاد اليورانيوم 1 من اليورانيوم المستنفد لليورانيوم من المستخلصات النووية، مع ما يصاحب ذلك من فقدان نشاط الربط؛ (ب) استنفاد اليورانيوم من اليورانيوم 1 من اليورانيوم المستنفد للأوزون؛ (ج) استنفاد اليورانيوم من اليورانيوم غير النووي. و (ب) إعادة تشكيل نشاط الربط في استخراج U1 المنضب بواسطة الجسيمات galectin-3 - U1 SnRNP ملزمة بالخرز يقترن بشكل متناقض مع الأجسام المضادة المضادة للجاليكتين-3.
Abstract
وتشير التجارب الكلاسيكية لإعادة تشكيل الاستنفاد إلى أن الجيليكتين -3 عامل مطلوب للربط في المستخلصات النووية. يتم تناول آلية دمج galectin-3 في مسار الربط في هذه الورقة. الترسيب من المستخلصات النووية خلايا هيلا على 12٪ -32٪ التدرجات الجلسرين تسفر عن كسور المخصب في الجسيمات الذاتية ~ 10S التي تحتوي على galectin-3 و U1 snRNP. ونصف الآن بروتوكولا لاستنفاد المستخلصات النووية من U1 snRNP مع ما يصاحب ذلك من فقدان نشاط الربط. يمكن إعادة تشكيل نشاط الربط في استخراج U1 المستنفدة من قبل الجسيمات galectin-3 - U1 SnRNP المحاصرين على حبات الآغاروز بشكل مشترك مع الأجسام المضادة المضادة للجاليكتين-3. وتشير النتائج إلى أن galectin-3 - U1 snRNP - مجمع ما قبل ميرنا الترنيري هو مجمع E وظيفي يؤدي إلى وسيطة ومنتجات رد فعل الربط وأن galectin-3 يدخل مسار الربط من خلال ارتباطه مع U1 snRNP. قد ينطبق مخطط استخدام التعقيدات التي يتم اختيارها من ناحية التقارب أو المناعة على الخرز لإعادة تشكيل نشاط الربط في المستخلصات المستنفدة لعامل ربط محدد بشكل عام على أنظمة أخرى.
Introduction
إنتاج معظم RNAS رسول eukaryotic (mRNAs) ينطوي على إزالة introns وربط exons في عملية نووية يطلق عليها اسم ما قبل مرنا الربط1. نوعين من مجمعات بروتين الحمض النووي الريبي (RNPs) توجيه معالجة الحمض النووي الريبي قبل رسول في ميرنا ناضجة عبر مجمعات الطحال. يتم تشكيل فئة واحدة ، RNPs ما قبل الرسول الوليدة ، نسخا مشتركة من خلال ربط بروتينات RNP النووية غير المتجانسة وغيرها من البروتينات الملزمة للجيش الملكي النيبالي ، بما في ذلك بعض أفراد عائلة SR ، مما ينتج مجمعات hnRNP2. ويرتبط من الدرجة الثانية، RNPs النووية الصغيرة الغنية uracil (U snRNPs مع U1، U2، U4، U5، وU6 snRNAs) مع U محددة والبروتينات الأساسية3،4. تتفاعل UnRNPs بطريقة مرتبة مع مناطق محددة من RNPs ما قبل الرسول في مسار إعادة عرض ديناميكي حيث يتم استئصال السترونز وربط exons لإنتاج mRNPs5 ناضجة. ويشارك العديد من البروتينات النووية الإضافية في أحداث المعالجة هذه6.
Galectin-1 (Gal1) و galectin-3 (Gal3) هما بروتينان مطلوبان في مسار الربط كما هو موضح في دراسات إعادة تشكيل الاستنفاد7،8. إزالة كل من galectins من الربط المستخلصات النووية المختصة (NE) يلغي التجميع الربط ونشاط الربط في خطوة مبكرة. إضافة أي galectin إلى مثل هذه NE المنضب بشكل مضاعف يستعيد كلا النشاطين. Gal1 و Gal3 هي مكونات اللصقات النشطة كما يتضح من السبق المناعي المحدد لمرنا ما قبل، وسيطة الربط، ورنا ناضجة من قبل antiserum محددة إما Gal1 أو Gal39. الأهم من ذلك، Gal3 المنتسبين مع SnRNA U الذاتية التي تحتوي على جزيئات في NE خارج مسار الربط كما هو مبين من خلال هطول الأمطار من snRNPs من قبل antisera10 المضادة Gal3. وأخيرا، إسكات Gal3 في خلايا هيلا يغير أنماط الربط من الجينات العديدة11.
في NE قبل احتضان لتفكيك اللصقات مسبقة الشكل12، تم العثور على snRNPs في مجمعات متعددة الرسوب في تدرجات الجلسرين من 7S إلى أكبر من 60S. على الرغم من أن الكسر التدرج الجلسرين هو تقنية شائعة لعزل المجمعات والمكونات الطحال (انظر المراجع13,14,15 على سبيل المثال), لقد قمنا بتوسيع هذه الطريقة عن طريق توصيف كسور محددة باستخدام الأجسام المضادة المناعية. وsnRNP الرسوب في 10S يحتوي فقط U1 snRNA جنبا إلى جنب مع Gal3. إن التكسير المناعي للكسر 10S مع antisera محدد ل Gal3 أو U1 snRNP يشارك في التعجيل بكل من U1 و Gal3 مما يشير إلى أن بعض الجسيمات الأحادية U1 snRNP لا بد أن تكون Gal310. كما U1 snRNP هو أول مجمع يربط إلى ما قبل mRNP في التجميع spliceosomal1،5، تمثل هذه الخطوة موقع دخول محتمل لGal3 في مسار الربط. على هذا الأساس، أظهرنا أن 10S Gal3-U1 snRNP أحادية الجسيمات ملزمة المضادة Gal3 التي تحتوي على الخرز استعادة نشاط الربط إلى U1 snRNP استنفدت NE، وإنشاء هذا المجمع كآلية واحدة التي يتم تجنيد Gal3 في المسار الربط16. وهذا يتناقض مع محاولات عزل اللصقات في مراحل محددة في رد فعل الربط وفهرسة العوامل المرتبطة بها17,18. وفي مثل هذه الدراسات، يتم التأكد من وجود عوامل معينة في وقت ما ولكن ليس الآلية التي تم تحميلها بها.
كنا قد وصفنا بالتفصيل في إعداد NE، وركيزة الربط، وتجميع خليط رد فعل الربط، وتحليل المنتجات في توثيقنا لدور galectins في الربط قبل ميرنا19. ونصف الآن الإجراءات التجريبية لتجزئ المستخلصات النووية للحصول على جزء مثري في مجمع Gal3 - U1 snRNP ولانتقاء المناعة للمجمع الأخير لإعادة تشكيل نشاط الربط في مستخلص نووي مستنفد U1.
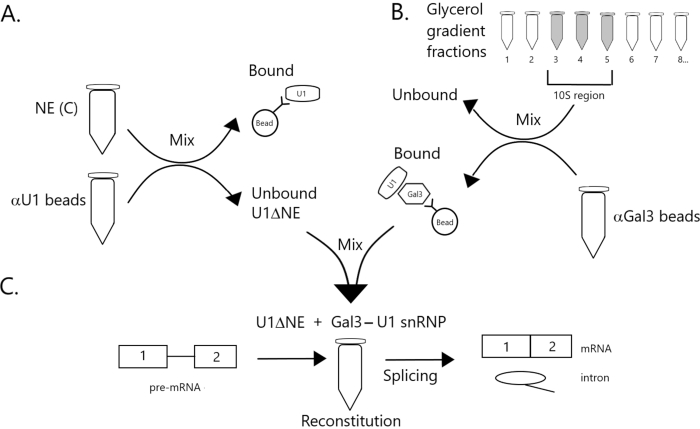
الشكل 1: مخطط تخطيطي يوضح استكمال نشاط الربط في استخراج نووي مستنزف من U1 snRNP بواسطة مجمع Gal3-U1 snRNP على الخرز. (A) NE في العازل C (NE(C)) يتم احتضانه بخرز البروتين A-Sepharose مقترنا بشكل متناقض مع حبات SnRNP المضادة U1 (حبات αU1). يتم استنفاد الكسر غير منضم من U1 snRNP (U1ΔNE). (ب) يتم تجزئة NE في المخزن المؤقت D (NE(D)) على تدرج جلسيرول 12٪-32٪ عن طريق الطرد المركزي الفائق. يتم الجمع بين الكسور المقابلة لمنطقة 10S (الكسور 3-5) وخلطها مع الخرز المقترن بشكل مشترك مع الأجسام المضادة المضادة ل Gal3 (حبات αGal3). المواد ملزمة الخرز يحتوي على Gal3-U1 snRNP أحادية الحزبية. (ج) يتم خلط مجمع Gal3-U1 snRNP من الجزء (B) مع U1ΔNE من الجزء (A) في مقايسة الربط باستخدام ركيزة MINX قبل ميرنا المسماة 32P ويتم تحليل وسيطة ومنتجات تفاعل الربط بواسطة الكتروفلوريس الهلامي والتصوير الإشعاعي التلقائي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Protocol
1. ملاحظات حول الإجراءات العامة
- تأكد من أن جميع المواد الكيميائية (المكونات العازلة، والإنزيمات، وما إلى ذلك) يتم الاحتفاظ بها خالية من الريبونوكليز (RNase). عزل جميع زجاجات الكاشف المشتراة تجاريا من الاستخدام العام للمختبر. ارتداء قفازات لجميع خطوات الإجراء التجريبي. استخدم فقط الأواني الزجاجية والأواني التي تم خبزها (انظر الخطوة 1.2 أدناه) والحلول التي تم علاجها مسبقا (انظر الخطوة 1.3 أدناه).
- خبز جميع الأواني الزجاجية (الأكواب، القوارير، زجاجات، ماصة، الخ) لمدة لا تقل عن 4 ساعة في 177 درجة مئوية. التفاف الأواني الأخرى (ملعقة، اثارة القضبان، الخ) في رقائق الألومنيوم قبل الخبز في ظل نفس الظروف.
- إعداد حل 0.1٪ (vol/vol) من ديثيليبيروكربونات (DEPC) في الماء المقطر المزدوج (ddH2O). باستخدام شريط اثارة المغناطيسي، واثارة هذا الحل بين عشية وضحاها ومن ثم الأوتوكلاف. استخدم H2O المعالج من DEPC لإجراء كافة الحلول التي تحتوي على Tris; ثم، تصفية تعقيم باستخدام فلتر فراغ أعلى زجاجة. استخدام ddH2O العادية لإعداد جميع الحلول الأخرى (دون تريس)؛ ثم، علاج مع DEPC (0.1٪، فول / فول) وautclave.
ملاحظة: يتم سرد المخازن المؤقتة المستخدمة في المجموعة التالية من الإجراءات التجريبية أبجديا في الجدول 1.
| اسم المخزن المؤقت | تكوين |
| المخزن المؤقت بورات | 0.2 م بورات الصوديوم، pH 9 |
| المخزن المؤقت C | 20 mM HEPES, pH 7.9, 25٪ (vol/vol) جلسيرول, 0.42 M NaCl, 1.5 مللي متر ملغCl2, 0.2 مللي متر EDTA, 0.5 m M فينيل ميثيل سلفونيل فلوريد (PMSF), 0.5 مللي متر ديثيوثريتول (DTT) |
| المخزن المؤقت D | 10 م م HEPES، pH 7.9، 20٪ (vol/vol) جلسيرول، 0.1 M KCl، 0.2 m M EDTA، 0.5 mM PMSF، 0.5 mM DTT |
| 60٪ مد | 60٪ المخزن المؤقت D و 40٪ H2O |
| الإيثانولامين | 0.2 مي الإيثانولامين، pH 8 |
| عازل ربط HEPES | 20 mM HEPES, pH 7.9 |
| HEPES غسل العازلة | 20 mM HEPES, pH 7.9, 0.5 M NaCl |
| مخزن تحميل الحمض النووي الريبي المؤقت | 90٪ فورماميد، 20 mM EDTA، pH 8، 0.05٪ (ث / v) بروموفينول الأزرق |
| المخزن المؤقت SDS-PAGE | 25 mM تريس، 169 مل سليسين، 0.1٪ كبريتات دودسيل الصوديوم (SDS)، pH 8.8 |
| المخزن المؤقت لعينة SDS | 62.5 mM تريس، سه 6.8، 2٪ SDS، 10٪ الجلسرين، 5٪ 2-ميركابتوثانول، 0.1٪ (ث / v) بروموفينول الأزرق |
| TBE العازلة لالمواد الهلامية الجيش الملكي النيبالي | 89 mM Tris، 89 mM حمض البوريك، 2.5 mM EDTA، درجة الحموضة 8.3 |
| TE المخزن المؤقت | 10 mM تريس، pH 8، 1 mM EDTA |
| نقل المخزن المؤقت | 25 mM تريس، 1.92 M الجليسين، 20٪ الميثانول، pH 8.3 |
| T-TBS المخزن المؤقت | 10 mM تريس، 0.5 M NaCl، 0.05٪ توين 20، pH 7.5 |
| مخزن TX المؤقت للغسيل | 0.05٪ تريتون X-100 (تكساس) في 60٪D |
الجدول 1: اسم المخازن المؤقتة وتكوينها
2. إعداد NE المنضب من U1 snRNP (U1 ΔNE)
- إعداد الخرز المضادة U1 لاستبداد المناعة
- قبل تضخم 50 ملغ البروتين A-Sepharose CL-4B الخرز في H2O DEPC المعالجة الزائدة لإنتاج ما يقرب من 200 ميكرولتر من الخرز منتفخة ومن ثم غسل في العازلة غسل HEPES.
- لهذا الغسيل وجميع يغسل اللاحقة، بيليه الخرز عن طريق الطرد المركزي (1000 × ز في الدوار دلو يتأرجح في 4 درجة مئوية لمدة 10-15 ق) وإزالة غسل غير منضم باستخدام micropipettor وتجاهل.
- مزيج 150 ميكرولتر من الخرز المغسول مع 150 ميكرولتر من مصل المناعة الذاتية البشرية محددة لU1 snRNP (حجم الأجسام المضادة لحجم الخرز في نسبة 1:1).
- ضبط، على أساس الحجم الإجمالي (~ 300 ميكرولتر من الخطوة 2.1.3 أعلاه)، الخليط إلى 20 م م HEPES، الرقم الحموضة 7.9، المقابلة لشروط العازلة ربط HEPES؛ احتضان هذا الخليط مع هزاز مستمر في درجة حرارة الغرفة لمدة 60 دقيقة.
- غسل الخرز ملزمة مع الأجسام المضادة مع 1 مل من المخزن المؤقت بورات (0.2 M بورات الصوديوم، pH 9) وإعادة الإنفاق في 1 مل من نفس المخزن المؤقت بورات.
- للزوجين بشكل متناقض الأجسام المضادة ملزمة حبات البروتين A-Sepharose، إضافة dimethylpimelimidate إلى تركيز النهائي من 20 mM واحتضان في درجة حرارة الغرفة مع هزاز لمدة 60 دقيقة.
- غسل الخرز مع 1 مل من المخزن المؤقت البورات.
- لمنع أي كاشف ربط متقاطع غير منقح، أضف 1 مل من 0.2 M الإيثانولامين (درجة الحموضة 8) واحتضن في درجة حرارة الغرفة مع هزاز لمدة 60 دقيقة.
- غسل الخرز المقترن بالأجسام المضادة ، الذي تم تعيينه فيما بعد كعرز مضاد U1 ، مرتين مع 0.5 مل من مخزن غسيل TX المؤقت (0.05٪ Triton X-100 في 60٪ D).
- استنفاد U1 snRNP من NE (انظر الشكل 1A)
ملاحظة: تم تطوير الإجراء لإعداد NE من خلايا هيلا في البداية من قبل Dignam et al.20. لقد وصفنا المواد والأساليب التفصيلية لإعداد NE لإجراء عمليات الفحص الربط19 (انظر الخطوتين 2.1 و 3.1 من هذا المرجع). NE، كما أعدت في البداية في المخزن المؤقت C وسيتم تعيينها فيما بعد NE (C). NE(C) dialyzed ضد وequilibrated مع المخزن المؤقت D سيتم تعيين NE(D).- احتضان 200 ميكرولتر من NE (C) مع 100 ميكرولتر من الخرز المضاد U1 من الخطوة 2.1.9 أعلاه.
- إضافة 5 ميكرولتر من RNasin إلى الخليط.
- تدوير رأس microtube فوق الذيل في 4 درجة مئوية لمدة 1 ساعة.
- بيليه الخليط عن طريق الطرد المركزي (1000 × ز في الدوار دلو يتأرجح في 4 درجة مئوية لمدة 10-15 ق) وجمع المواد غير منضمة (U1ΔNE) باستخدام حقنة هاملتون.
- Dialyze الحجم الكامل ل U1ΔNE، جنبا إلى جنب مع aquot 50 ميكرولتر منفصلة من NE (C) غير كامل الأصلي)، في مقصورات منفصلة من microdialyzer، مع اثارة، لمدة 75 دقيقة ضد 60٪ D باستخدام غشاء غسيل الكلى مع 8 K قطع الوزن الجزيئي.
- مباشرة بعد غسيل الكلى، تقسيم هذه الاستعدادات (U1ΔNE و NE في 60٪ D) إلى 20 ميكرولتر aliquots. ثم المفاجئة تجميد في حمام الثلج الجاف / الإيثانول وتخزينها في -80 درجة مئوية.
- تحليل الحمض النووي الريبي ومحتوى البروتين من U1ΔNE والمواد ملزمة على الخرز المضادة U1
- بعد إزالة المواد غير المنضمة (U1ΔNE) (الخطوة 2.2.4) ، اغسل المادة المرتبطة بالخرز المضاد U1 بإضافة 0.5 مل من مخزن غسيل TX المؤقت. بيليه الخليط عن طريق الطرد المركزي (1000 × ز في الدوار دلو يتأرجح في 4 درجة مئوية لمدة 10-15 ق) وإزالة supernatant باستخدام micropipettor وتجاهل.
- كرر خطوات الغسيل 2.3.1 مرتين.
- إزالة المواد ملزمة الخرز المضادة U1 بإضافة 100 ميكرولتر من 2x SDS عينة العازلة إلى 100 ميكرولتر من الخرز واحتضان لمدة 10 دقيقة في درجة حرارة الغرفة.
- بيليه الخليط عن طريق الطرد المركزي (1000 × ز في الدوار دلو يتأرجح في 4 درجة مئوية لمدة 10-15 ق)؛ إزالة supernatant بواسطة حقنة هاملتون، وتجميد المفاجئة في حمام الثلج الجاف / الإيثانول. يخزن عند -80 درجة مئوية.
- قارن NE غير كامل NE depleted (U1ΔNE) والمواد المرتبطة بالخرز (إزالتها من الخرز بواسطة المخزن المؤقت عينة SDS كما هو موضح في الخطوتين 2.3.3 و 2.3.4 أعلاه). اتبع الخطوات 2.3.6-2.3.8 لتحليل الحمض النووي الريبي أو الخطوات 2.3.9-2.3.10 لتحليل البروتين.
- لكل عينة، استخراج الحمض النووي الريبي مع 200 ميكرولتر من الفينول-الكلوروفورم (50:50، v/v)؛ ثم استخراج مرة أخرى مع 180 ميكرولتر من الكحول الكلوروفورم isoamyl (25:1، v/v). بعد الاستخراج، إضافة 300 ميكرولتر من الإيثانول الباردة 200 واقية، عكس لخلط، وتخزين الحمض النووي الريبي عجلت بين عشية وضحاها في -20 درجة مئوية.
- طرد مركزي من الحمض النووي الريبي المعجل بالإيثانول (12000 × غرام لمدة 10 دقائق عند 4 درجات مئوية). غسل الكريات مع 150 ميكرولتر من الإيثانول الباردة 70٪. جهاز الطرد المركزي مرة أخرى (12000 × غرام) عند 4 درجات مئوية لمدة 15 دقيقة. إزالة supernatant باستخدام micropipettor وتجفيف الكريات في سرعة فاك لمدة 10-15 دقيقة دون حرارة.
- Resuspend بيليه الحمض النووي الريبي المجفف في 10 ميكرولتر من الحمض النووي الريبي تحميل العازلة، دوامة بلطف، والحرارة إلى 75-85 درجة مئوية لمدة 90 ثانية، ومن ثم احتضان على الجليد لمدة 2 دقيقة. فصل SnRNAs بواسطة هلام electrophoresis (2 ساعة في 16 mA) من خلال 13٪ البولي أكريلاميد - 8.3 M اليوريا الهلامية ومن ثم وصمة عار إما مع بروميد الإيثيديوم أو تخضع للنشاف الشمالية10،16.
- تحميل عينات البروتين، في المخزن المؤقت عينة SDS من الخطوة 2.3.5، على 12.5٪ المواد الهلامية البولي أكريلاميد والكهربائية في 200 V لحوالي 45-50 دقيقة في SDS-PAGE (الصوديوم دودسيل كبريتات البولي أكريلاميد هلام الكهربائي) العازلة.
- نقل البروتينات المنفصلة إلى غشاء النيتروسليلوز في 400 mA لمدة 2 ساعة في المخزن المؤقت للنقل. بعد نقل، منع الغشاء عن طريق احتضان بين عشية وضحاها في T-TBS تحتوي على 10٪ الحليب الجاف غير الدهني. ثم، immunoblot الغشاء للكشف عن بروتينات محددة8،21.
3. الكسر المناعي للكسور 10S من التدرجات الجلسرين بواسطة المضادة Gal3
- إعداد الخرز المضادة للجال3 لاستبداد المناعة
ملاحظة: اشتقاق وتوصيف antisera متعدد النسيلة أرنب ضد Gal3 للأرنب # 2421 والأرنب # 4910 وقد وصفت سابقا.- استخدام مصل ما قبلمون من أرنب # 49 والسيطرة.
- لإعداد الخرز المضادة Gal3 اتبع الإجراء الموصوف سابقا لإعداد الخرز المضادة U1 (الخطوة 2.1)، باستثناء أن المقابلة للخطوة 2.1.3، ونسبة antiserum (على سبيل المثال، المضادة Gal3، # 49) إلى الخرز هو 3:1.
- قبل الاستخدام مباشرة، اغسل الخرز المقترن بالأجسام المضادة، الذي تم تعيينه فيما بعد كخرزات مضادة ل Gal3، مرتين مع 0.5 مل من مخزن غسيل TX المؤقت. إزالة supernatant، أولا مع micropipettor للحصول على معظم السائل ومن ثم مع حقنة هاملتون للحصول على السائل من الخرز. اطرح.
- مناعة الكسور التدرج الجلسرين بواسطة المضادة Gal3 (انظر الشكل 1B)
- كسر NE (D) على مدى 12٪-32٪ التدرج الجلسرين10. الجمع بين وخلط الكسور التدرج الجلسرين 3 و 4 و 5 (مرقم من أعلى التدرج)، والتي هي بالقرب من منطقة 10S من التدرج.
- إعداد عينتين، كل مع 150 ميكرولتر aliquot من الكسور التدرج مجتمعة 3-5 (الخطوة 3.2.1)، ومكان في 50 ميكروغرام من الخرز المضادة Gal3.
- بالتوازي، قم بإعداد عينتين لكل منهما 150 ميكرولتر من الكسر 1 (تحتوي على Gal3 غير معقدة مع U1 snRNP10؛ الخطوة 3.2.1) ووضعها في 50 ميكرولتر من الخرز المضاد ل Gal3.
- كعنصر تحكم، ضع 150 ميكرولتر من 60٪ D في ميكروتوب آخر من حبات مضادة ل Gal3 50 ميكرولتر.
- مزيج بلطف عن طريق النقر على الأنبوب، ثم تدوير microtube الرأس أكثر من الذيل في 4°C لمدة 1 ساعة.
- بيليه الخليط عن طريق الطرد المركزي لطيف (1000 × ز في الدوار دلو يتأرجح في 4 درجة مئوية لمدة 10-15 ق).
- إزالة supernatant (المواد غير منضم) باستخدام حقنة هاملتون. لا تغسل الخرز واستخدامها على الفور لإضافة ردود الفعل الربط (القسم 4.2).
- تحليل الحمض النووي الريبي ومحتوى البروتين في المواد غير المقيدة والملزمة من هطول الأمطار المضادة Gal3 من كسور الانحدار 10S
- لتحليل مكونات المواد المقيدة وغير المقيدة من هطول الأمطار المضادة Gal3 من كسور الانحدار 10S، وجمع المواد غير منضم (supernatant بعد الخطوة 3.2.6)، ونقل إلى microtube جديدة، وتجميد في -20 درجة مئوية.
- غسل الخرز عجلت من الخطوة 3.2.6 (تحتوي على مواد ملزمة المضادة Gal3) عن طريق إضافة 0.5 مل من TX غسل العازلة.
- بيليه الخليط عن طريق الطرد المركزي لطيف (1000 × ز في الدوار دلو يتأرجح في 4 درجة مئوية لمدة 10-15 ق)؛ إزالة supernatant باستخدام micropipettor وتجاهل. كرر خطوات الغسيل مرتين أكثر.
- إضافة 50 ميكرولتر من 2X SDS عينة المخزن المؤقت إلى الخرز غسلها والكريات المضادة Gal3.
- اخلطي الخرز برفق واحتضنيه لمدة 10 دقائق في درجة حرارة الغرفة.
- بيليه الخليط عن طريق الطرد المركزي لطيف (1000 × ز في الدوار دلو يتأرجح في 4 درجة مئوية لمدة 10-15 ق) ، وجمع supernatant من قبل حقنة هاملتون وتخزينها في microtube الطازجة في -20 درجة مئوية.
- قارن المواد غير المنضمة (القسم 3.3.1) والمادة المقيدة (الخطوة 3.3.6) من هطول الأمطار المضادة ل Gal3 من حيث الحمض النووي الريبي ومكونات البروتين، وذلك باستخدام الإجراءات على النحو المبين في الخطوات 2.3.6. إلى 2.3.10، على التوالي.
4. تجميع رد فعل الربط وتحليل المنتجات
- إعداد الركيزة الربط
ملاحظة: الركيزة ما قبل مرنا، MINX المعينة، يحتوي على تسلسلين exon وتسلسل واحد intron من Adenovirus22. تسلسل الحمض النووي MINX في البلازميد تحت سيطرة T3، T7، أو SP6 الحمض النووي الريبي بوليمراز المروجين. المواد والأساليب التفصيلية لتدوين الحمض النووي MINX plasmid مع endonuclease تقييد BamHI، النسخ من قبل SP6 RNA بوليمراز في وجود α-32P [GTP] وتنقية MINX المسمى 32P لإجراء فحوصات الربط موصوفة سابقا19 (انظر الخطوتين 2.2 و 3.2 من تلك الإشارة).- تخزين MINX تسمية إشعاعية كمعجل الإيثانول في -20 درجة مئوية; استخدام الركيزة الربط المسمى في غضون 4-6 أسابيع بعد النسخ.
- قبل الاستخدام مباشرة، عجلت أجهزة الطرد المركزي الإيثانول MINX 32P المسمى في 12،000 × ز لمدة 10 دقيقة في 4 درجة مئوية. إزالة supernatant مع micropipettor وتجاهل.
- أضف 150 ميكرولتر من الإيثانول والطرد المركزي بنسبة 70٪ عند 12,000 × غرام لمدة 15 دقيقة عند 4 درجات مئوية. تجاهل supernatant وتجفيف بيليه في سرعة فاك مع عدم وجود حرارة لمدة 15 دقيقة.
- إعادة ترطيب بيليه في 50 ميكرولتر من المياه DEPC. بقعة 2 ميكرولتر على كل من اثنين من مرشحات GF / C؛ تزج المرشحات في الباردة 5٪ حمض ثلاثي الكلور (TCA) لمدة 10 دقيقة. شطف مع TCA الباردة 5٪، تليها الإيثانول واقية من 180 على قارورة فراغ. الهواء الجاف المرشحات وتخضع لعد التلألؤ في 4 مل من السلامة حل.
- تمييع MINX 32P المسمى في 60٪ D إلى 104 cpm/μL لإجراء فحص الربط.
- تجميع رد الفعل الربط (انظر الشكل 1C)
- تجميع، على الجليد، وردود الفعل الربط في حجم إجمالي قدره 24 ميكرولتر (8 ميكرولتر U1ΔNE (من الخطوة 2.2.6)، 3.5 مللي متر ملغCl2، 1.5 mM ATP، 20 mm الكرياتين فوسفات، 0.5 mM DTT، 20 وحدة RNasin، 4 ميكرولتر 32P المسمى MINX الربط الركيزة (104 cpm/μL)، 60٪ D) وإضافة إلى كل أنبوب من الخرز من القسم 3.2.7. تجميع مجموعة متطابقة من ردود الفعل الربط في حجم إجمالي قدره 24 ميكرولتر ولكن من دون U1ΔNE وإضافة إلى كل أنبوب من الخرز من الخطوة 3.2.7.
- إعداد رد فعل الربط التحكم في حجم إجمالي 12 ميكرولتر (4 ميكرولتر NE(D)، 3.5 mM MgCl2، 1.5 mM ATP، 20 mm الكرياتين فوسفات، 0.5 mM DTT، 20 وحدة RNasin، 2 ميكرولتر 32P المسمى MINX الربط الركيزة (104 cpm/μL)، 60٪ D).
- اخلط الأنابيب برفق عن طريق النقر وتدوير نهاية الذيل عند 30 درجة مئوية لمدة 90 دقيقة. بيليه الخليط عن طريق الطرد المركزي لطيف في 1000 × ز في الدوار دلو يتأرجح في 4 درجة مئوية لمدة 10-15 ق.
- وقف رد الفعل وelute البروتينات قبالة الخرز عن طريق إضافة 24 ميكرولتر من 2x SDS عينة العازلة إلى الأنابيب التي تحتوي على الخرز، و 12 ميكروغرام من 2x SDS عينة عازلة إلى أنبوب التحكم التي تحتوي على NE ولكن لا الخرز. سخني الأنابيب عند 100 درجة مئوية لمدة 7 دقائق.
- طرد مركزي أنابيب بلطف في 1000 س غ في دوار دلو يتأرجح في 4 درجة مئوية لمدة 10-15 ق.
- نقل النتوازات (elutions) إلى الأنابيب الدقيقة الطازجة: حوالي 48 ميكرولتر من أنابيب الخرز و 24 ميكرولتر من أنبوب التحكم NE.
- إضافة بروتيناز K (20 ملغم / مل) لهضم وslubilize البروتينات: إضافة 5 ميكرولتر إلى 48 ميكرولتر elution من الخرز وإضافة 2.5 ميكرولتر إلى التحكم 24 ميكرولتر NE.
- احتضان الأنابيب في 37 درجة مئوية لمدة 40 دقيقة.
- طرد مركزي بلطف الأنابيب في 1000 × ز في الدوار دلو يتأرجح في 4 درجة مئوية لمدة 10 ق.
- تمييع الخرز مع 39.5 ميكرولتر TE و 10 ميكرولتر 3 M خلات الصوديوم. تمييع التحكم NE مع 63.5 μL TE و 10 ميكرولتر 3 M خلات الصوديوم.
- استخراج وتحليل الحمض النووي الريبي على النحو المبين أدناه (القسم 4.3).
- تحليل منتجات رد فعل الربط
- استخراج الرناس في كل عينة مع الفينول-الكلوروفورم، تليها الكحول الكلوروفورم-إيزاميل. يعجل RNAs مع الإيثانول، الطرد المركزي، وغسل الكريات، وإزالة supernatant وتجفيف الكريات بعد نفس الإجراء كما هو موضح في الخطوتين 2.3.6 و 2.3.7.
- Resuspend بيليه الحمض النووي الريبي المجفف في 10 ميكرولتر من الحمض النووي الريبي تحميل العازلة، دوامة بلطف، والحرارة إلى 75-85 درجة مئوية لمدة 90 ثانية، ومن ثم احتضان على الجليد لمدة 2 دقيقة.
- إعداد 20 مل من محلول يحتوي على 13٪ من البولي أكريلاميد (بيساكريلاميد: أكريلاميد، 1.9:50 [wt/wt]) في 8.3 M يوريا؛ يلقي المواد الهلامية 15 سم في الطول باستخدام هذا الحل.
- مرة واحدة يلقي هلام، electrophorese ذلك (دون أي عينات تحميل) في 400 V لمدة 20 دقيقة باستخدام TBE كعازل تشغيل. بعد هذه الخطوة، اغسل الآبار باستخدام المخزن المؤقت تشغيل TBE.
- تحميل عينات الجيش الملكي النيبالي، في مخزن تحميل الحمض النووي الريبي العازلة، وكهربائي مع TBE تشغيل العازلة في 400 V لمدة 3.5 إلى 4 ساعة. بعد الكهروفورسيس، قم بإزالة اليوريا عن طريق غمر وتدوير الجل في الماء المقطر لمدة 10 دقائق.
- فراغ الجافة هلام على ورقة تصفية 3 M، أولا لمدة 2 ساعة 15 دقيقة في 80 درجة مئوية ومن ثم لمدة 30 دقيقة دون حرارة لتبريد ببطء. إخضاع الجل المجفف للتصوير الإشعاعي التلقائي على الفيلم للكشف عن مواقع هجرة المكونات المشعة.
النتائج
NE المنضب من U1 snRNP (U1ΔNE من القسم 2.2.6) و Gal3 - U1 snRNP المجمعات من منطقة 10S من الجلسرين التدرج المناعي التي يتحرر منها المضادة Gal3 (الخطوة 3.2.7) كانت مختلطة في رد فعل الربط. يحتوي خليط التفاعل هذا على U1 snRNA (الشكل 2A ، حارة 3) ، وكذلك البروتين U1 محددة ، U1 - 70K (الش?...
Discussion
يقدم هذا التقرير التفاصيل التجريبية التي توثق مجمع Gal3 - U1 snRNP المحاصرين على الخرز المغلف المضاد ل Gal3 يمكن أن يرتبط بركيزة ما قبل مرنا ويمكن لهذا المجمع الترني استعادة نشاط الربط إلى NE. Gal3 المستنفدة ل U1 SnRNP هو عضو واحد في عائلة من البروتينات المعزولة في الأصل على أساس نشاطها الخا?...
Disclosures
وليس لدى صاحبي البلاغ ما يكشفان عنه.
Acknowledgements
وقد تم دعم هذا العمل من قبل المؤسسة الوطنية للعلوم منحة MCB-0092919 وجامعة ولاية ميشيغان منحة البحوث الداخلية 09-CDFP-2001 (إلى RJP) والمعاهد الوطنية للصحة منحة جنرال موتورز-38740 وميشيغان AgBioResearch مشروع MICL02455 (إلى JLW).
كانت ركيزة MINX قبل مرنا المستخدمة في المقايسات الربط هدية لطيفة من الدكتور سوزان بيرغيت (كلية بايلور للطب، هيوستن، تكساس، الولايات المتحدة الأمريكية).
Materials
| Name | Company | Catalog Number | Comments |
| anti-U1 snRNP | The Binding Site | Hu ENA-RNP #33471 | human autoimmune serum specific for U1 snRNP |
| bottle top vacuum filter | Fisher Scientific | Corning 431153 (0.22 μm; PES 150 ml) | for filtering solutions containing Tris |
| centrifuge | International Equipment Company | IEC Model PR-6 | for pelletting Sepharose beads in immunoprecipitation |
| diethylpyrocarbonate (DEPC) | Sigma-Aldrich | 159220-5G | for treatment of water used in preparation of all solutions |
| dimethylpimelimidate (DMP) | Sigma-Aldrich | 80490-5G | for cross-linking antibody to Sepharose beads |
| electrophoresis cell | BioRad Laboratories, Inc | Mini-Protean II | for SDS-PAGE separation of proteins |
| ethanolamine | Sigma-Aldrich | 411000-100ml | for blocking after the cross-linking reaction |
| gel electrophoresis system | Hoefer, Inc | HSI SE 500 Series | for separating snRNAs by gel electrophoresis |
| gel slab dryer | BioRad | Model 224 | for drying gel slabs for autoradiography |
| Hybond ECL membrane | GE Healthcare | RPN3032D (0.2 μm; 30 cm x 3 m) | for immunoblotting of proteins on membrane |
| microdialyzer (12 x 100 μl sample capacity) | Pierce | Microdialyzer System 100 | for exchanging the buffer of nuclear extract |
| microdialyzer membranes (8K cutoff) | Pierce | 66310 | for exchanging the buffer of nuclear extract |
| non-fat dry milk | Spartan Stores | Spartan Instant Non-fat Dry Milk | |
| Protein A Sepharose CL-4B | Millipore-Sigma | GE 17-0780-01 | for coupling antibody to beads |
| Proteinase K | Millipore-Sigma | P2308-5mg | for stopping the splicing reaction to isolate the RNAs |
| RNasin | Promega | N2111 | for inhibiting ribonuclease activity |
| rocker/rotator | Lab Industries, Inc | Labquake Shaker 400-110 | for mixing protein solutions in coupling reactions and in immunoprecipitation |
| Safety-Solve | Research Products International Corp. | No. 111177 | scintillation counting cocktail for determination of radioactivity in splicing substrate |
| scintillation counter | Beckman Instruments | LS6000SC | scintillation counter for determination of radioactivity |
| speed vaccum concentrator | Savant | SVC 100H | for drying ethanol-precipitated RNA pellets |
| Transphor electrophoresis unit | Hoefer, Inc | Hoefer TE Series Transphor | for protein transfer from SDS-PAGE to blotting membrane |
References
- Hoskins, A. A., Moore, M. J. The spliceosome: a flexible, reversible macromolecular machine. Trends In Biochemical Sciences. 37, 179-188 (2012).
- Choi, Y. D., Grabowski, P., Sharp, P. A., Dreyfuss, G. Heterogeneous nuclear ribonucleoproteins: role in RNA splicing. Science. 231, 1534-1539 (1986).
- Lerner, M., Steitz, J. A. Snurps and scyrps. Cell. 25, 298-300 (1981).
- Maniatis, T., Reed, R. The role of small nuclear ribonucleoprotein particles in pre-mRNA splicing. Nature. 325, 673-678 (1987).
- Hoskins, A. A., et al. Ordered and dynamic assembly of single spliceosomes. Science. 331, 1289-1295 (2011).
- Coppin, L., Leclerc, J., Vincent, A., Porchet, N., Pigny, P. Messenger RNA life-cycle in cancer: emerging role of conventional and non-conventional RNA-binding proteins. International Journal of Molecular Sciences. 19, 650-676 (2018).
- Dagher, S. F., Wang, J. L., Patterson, R. J. Identification of galectin-3 as a factor in pre-mRNA splicing. Proceedings of the National Academy of Sciences of the United States of America. 92, 1213-1217 (1995).
- Vyakarnam, A., Dagher, S. F., Wang, J. L., Patterson, R. J. Evidence for a role for galectin-1 in pre-mRNA splicing. Molecular and Cellular Biology. 17, 4730-4737 (1997).
- Wang, W., Park, J. W., Wang, J. L., Patterson, R. J. Immunoprecipitation of spliceosomal RNAs by antisera to galectin-1 and galectin-3. Nucleic Acids Research. 34, 5166-5174 (2006).
- Haudek, K. C., Voss, P. G., Locascio, L. E., Wang, J. L., Patterson, R. J. A mechanism for incorporation of galectin-3 into the spliceosome through its association with U1 snRNP. Biochemistry. 48, 7705-7712 (2009).
- Fritsch, K., et al. Galectin-3 interacts with components of the nuclear ribonucleoprotein complex. BMC Cancer. 16, 502-511 (2016).
- Conway, G. C., Krainer, A. R., Spector, D. L., Roberts, R. J. Multiple splicing factors are released from endogenous complexes during in vitro pre-mRNA splicing. Molecular and Cellular Biology. 9, 5273-5280 (1989).
- Dery, K. J., Yean, S. L., Lin, R. J. Assembly and glycerol gradient isolation of yeast spliceosomes containing transcribed or synthetic U6 snRNA. Methods in Molecular Biology. 488, 41-63 (2008).
- Yoshimoto, R., Kataoka, N., Okawa, K., Ohno, M. Isolation and characterization of post-splicing lariat-intron complexes. Nucleic Acids Research. 37, 891-902 (2009).
- Malca, H., Shomron, N., Ast, G. The U1 snRNP base pairs with the 5' splice site within a penta-snRNP complex. Molecular and Cellular Biology. 23, 3442-3455 (2003).
- Haudek, K. C., Voss, P. G., Wang, J. L., Patterson, R. J. A 10S galectin-3 - snRNP complex assembles into active spliceosomes. Nucleic Acids Research. 44, 6391-6397 (2016).
- Rappsilber, J., Ryder, U., Lamond, A. I., Mann, M. Large-scale proteomic analysis of the human spliceosome. Genome Research. 12, 1231-1245 (2002).
- Jurica, M. S., Moore, M. J. Capturing splicing complexes to study structure and mechanism. Methods. 28, 336-345 (2002).
- Patterson, R. J., Haudek, K. C., Voss, P. G., Wang, J. L. Examination of the role of galectins in pre-mRNA splicing. Methods in Molecular Biology. 1207, 431-449 (2015).
- Dignam, J. D., Lebovitz, R. M., Roeder, R. G. Accurate transcription initiation by RNA polymerase II in a soluble extract from isolated mammalian nuclei. Nucleic Acids Research. 11, 1475-1489 (1983).
- Agarwal, N., Sun, Q., Wang, S. Y., Wang, J. L. Carbohydrate-binding protein 35. I. Properties of the recombinant polypeptide and the individuality of the domains. Journal of Biological Chemistry. 268, 14932 (1993).
- Zillmann, M., Zapp, M. I., Berget, S. M. Gel electrophoretic isolation of splicing complexes containing U1 small nuclear ribonucleoprotein particles. Molecular and Cellular Biology. 8, 814-821 (1988).
- Barondes, S. H., et al. Galectins: a family of animal β-galactoside-binding proteins. Cell. 76, 597-598 (1994).
- Laing, J. G., Wang, J. L. Identification of carbohydrate binding protein 35 in heterogeneous nuclear ribonucleoprotein complex. Biochemistry. 27, 5329-5334 (1988).
- Vyakarnam, A., Lenneman, A. J., Lakkides, K. M., Patterson, R. J., Wang, J. L. A comparative nuclear localization study of galectin-1 with other splicing components. Experimental Cell Research. 242, 419-428 (1998).
- Michaud, S., Reed, R. An ATP-independent complex commits pre-mRNA to the mammalian spliceosome assembly pathway. Genes & Development. 5, 2534-2546 (1991).
- Chiu, Y. -. F., et al. Cwc25 is a novel splicing factor required after Prp2 and Yju2 to facilitate the first catalytic reaction. Molecular and Cellular Biology. 29, 5671-5678 (2009).
- Krishnan, R., et al. Biased Brownian ratcheting leads to pre-mRNA remodeling and capture prior to first-step splicing. Nature Structural and Molecular Biology. 20, 1450-1457 (2013).
- Gray, R. M., et al. Distinct effects on splicing of two monoclonal antibodies directed against the amino-terminal domain of galectin-3. Archives of Biochemistry and Biophysics. 475, 100-108 (2008).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved