È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Complementazione dell'attività di splicing da parte di un complesso snRNP Galectin-3 - U1 su perline
In questo articolo
Riepilogo
Questo articolo descrive le procedure sperimentali per (a) l'esaurimento di U1 snRNP da estratti nucleari, con concomitante perdita di attività di splicing; e (b) ricostituzione dell'attività di splicing nell'estratto impoverito di U1 da particelle di galectina-3 - U1 snRNP legate a perline accoppiate covalentemente con anticorpi anti-galectina-3.
Abstract
I classici esperimenti di deplezione-ricostituzione indicano che la galectina-3 è un fattore di giunzione richiesto negli estratti nucleari. Il meccanismo di incorporazione della galectina-3 nella via di giunzione è affrontato in questo documento. La sedimentazione di estratti nucleari di cellule HeLa su gradienti di glicerolo del 12% -32% produce frazioni arricchite in una particella endogena ~ 10S che contiene galectina-3 e U1 snRNP. Ora descriviamo un protocollo per esaurire gli estratti nucleari di U1 snRNP con concomitante perdita di attività di splicing. L'attività di splicing nell'estratto impoverito di U1 può essere ricostituita dalla particella galectina-3 - U1 snRNP intrappolata su perle di agarosio accoppiate covalentemente con anticorpi anti-galectina-3. I risultati indicano che il complesso ternario galectina-3 - U1 snRNP - pre-mRNA è un complesso E funzionale che porta a intermedi e prodotti della reazione di splicing e che la galectina-3 entra nella via di splicing attraverso la sua associazione con U1 snRNP. Lo schema di utilizzo di complessi affinati o immunoselezionati su perline per ricostituire l'attività di giunzione in estratti impoveriti di uno specifico fattore di giunzione può essere generalmente applicabile ad altri sistemi.
Introduzione
La produzione della maggior parte degli RNA messaggeri eucariotici (mRNA) comporta la rimozione degli introni e la legatura degli esoni in un processo nucleare chiamato splicing pre-mRNA1. Due classi di complessi RNA-proteina (RNP) dirigono l'elaborazione dell'RNA pre-messaggero in mRNA maturo tramite complessi spliceosomiali. Una classe, i nascenti RNP pre-messaggeri, è formata co-trascrizionalmente dal legame di proteine RNP nucleari eterogenee e altre proteine leganti l'RNA, inclusi alcuni membri della famiglia SR, producendo complessi hnRNP2. La seconda classe, piccoli RNP nucleari ricchi di uracile (U snRNPs con U1, U2, U4, U5 e U6 snRNA) è associata a proteine U-specifiche e core3,4. Gli U snNP interagiscono in modo ordinato con regioni specifiche di RNP pre-messaggeri in un percorso di rimodellamento dinamico mentre gli introni vengono asportati e gli esoni vengono legati per produrre mRNPs maturi5. Molte altre proteine nucleari partecipano a questi eventi di elaborazione6.
Galectin-1 (Gal1) e galectin-3 (Gal3) sono due proteine che sono fattori richiesti nella via di splicing, come dimostrato da studi di deplezione-ricostituzione7,8. La rimozione di entrambe le galectine dallo splicing di estratti nucleari competenti (NE) abolisce l'assemblaggio dello spliceosoma e l'attività di splicing in una fase precoce. L'aggiunta di una galectina a un NE così doppiamente impoverito ripristina entrambe le attività. Gal1 e Gal3 sono componenti di spliceosomi attivi, come evidenziato da immunoprecipitazione specifica di pre-mRNA, intermedi splicing e mRNA maturo mediante antisiero specifico per Gal1 o Gal39. È importante sottolineare che Gal3 si associa a u snRNA endogeni contenenti particelle nel NE al di fuori della via di splicing, come mostrato dalla precipitazione di snNP da anti-Gal3 antisera10. Infine, il silenziamento di Gal3 nelle cellule HeLa altera i modelli di splicing di numerosi geni11.
Nei NE pre-incubati per smontare spliceosomi preformati12, gli snRP si trovano in complessi multipli che sedimentano in gradienti di glicerolo da 7S a superiori a 60S. Sebbene il frazionamento con gradiente di glicerolo sia una tecnica comune per l'isolamento di complessi e componenti spliceosomiali (vedi riferimenti13,14,15 per esempio), abbiamo esteso questo metodo caratterizzando frazioni specifiche utilizzando immunoprecipitazioni anticorpali. Un sedimento snRNP a 10S contiene solo SnRNA U1 insieme a Gal3. L'immunoprecipitazione della frazione 10S con antisieri specifici per Gal3 o U1 snRNP co-precipita sia U1 che Gal3 indicando che alcune delle monoparticelle U1 snRNP sono legate a Gal310. Poiché U1 snRNP è il primo complesso che si lega al pre-mRNP nell'assemblaggio spliceosomiale1,5, questo passaggio rappresenta un potenziale sito di ingresso per Gal3 nella via di giunzione. Su questa base, abbiamo dimostrato che le monoparticelle di 10S Gal3-U1 snRNP legate a perline contenenti anti-Gal3 hanno ripristinato l'attività di splicing a un NE impoverito di SnRNP U1, stabilendo questo complesso come un meccanismo con cui Gal3 viene reclutato nella via spliceosomiale16. Ciò contrasta con i tentativi di isolare gli spliceosomi in fasi specifiche della reazione di splicing e di catalogare i fattori associati17,18. In tali studi, viene accertata la presenza di determinati fattori ad un certo punto del tempo, ma non il meccanismo con cui sono stati caricati.
In precedenza avevamo descritto in dettaglio la preparazione del NE, il substrato di splicing, l'assemblaggio della miscela di reazione di splicing e l'analisi dei prodotti nella nostra documentazione del ruolo delle galectine nello splicing pre-mRNA19. Descriviamo ora le procedure sperimentali per il frazionamento di estratti nucleari per ottenere una frazione arricchita nel complesso Gal3 - U1 snRNP e per l'immunoselezione di quest'ultimo complesso per ricostituire l'attività di splicing in un estratto nucleare impoverito di U1.
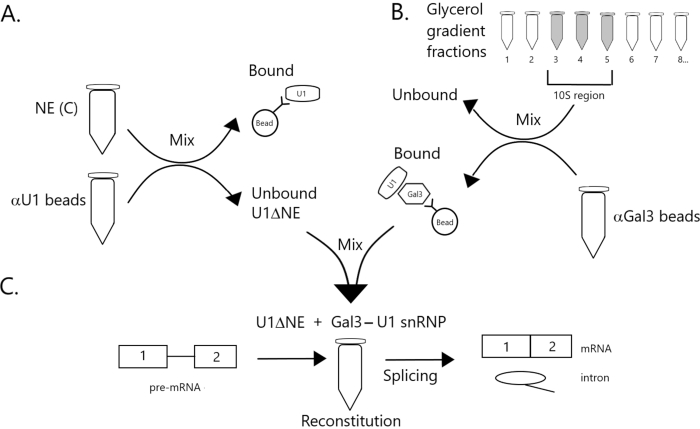
Figura 1: Diagramma schematico che illustra la complementazione dell'attività di splicing nell'estratto nucleare impoverito di U1 snRNP da un complesso snRNP Gal3-U1 su perline. (A) NE nel Buffer C (NE(C)) è incubato con perline di proteina A-sefarosio accoppiate covalentemente con snRNP anti-U1 (αU1 perline). La frazione non legata è impoverita di U1 snRNP (U1ΔNE). (B) NE nel tampone D (NE(D)) è frazionato su un gradiente di glicerolo del 12%-32% mediante ultracentrifugazione. Le frazioni corrispondenti alla regione 10S (frazioni 3-5) sono combinate e mescolate con perline accoppiate covalentemente con anticorpi anti-Gal3 (perline αGal3). Il materiale legato alle perline contiene una monoparticella Gal3-U1 snRNP. (C) Il complesso Gal3-U1 snRNP della Parte (B) viene miscelato con U1ΔNE della Parte (A) in un test di giunzione utilizzando substrato pre-mRNA MINX marcato con 32P e gli intermedi e i prodotti della reazione di splicing vengono analizzati mediante elettroforesi su gel e autoradiografia. Fare clic qui per visualizzare una versione più grande di questa figura.
Access restricted. Please log in or start a trial to view this content.
Protocollo
1. Note sulle procedure generali
- Assicurarsi che tutte le sostanze chimiche (componenti tampone, enzimi, ecc.) siano mantenute libere da ribonucleasi (RNasi). Sequestrare tutte le bottiglie di reagente acquistate commercialmente dall'uso generale del laboratorio. Indossare guanti per tutte le fasi della procedura sperimentale. Utilizzare solo bicchieri e utensili che sono stati cotti (vedere il passaggio 1.2 di seguito) e soluzioni che sono state pretrattate (vedere il passaggio 1.3 di seguito).
- Cuocere tutti gli oggetti di vetro (bicchieri, boccette, bottiglie, pipette, ecc.) per un minimo di 4 ore a 177 °C. Avvolgere altri utensili (spatole, barre di agitazione, ecc.) in un foglio di alluminio prima di cuocere nelle stesse condizioni.
- Preparare una soluzione allo 0,1% (vol/vol) di dietilpirocarbonato (DEPC) in acqua a doppia distillazione (ddH2O). Utilizzando una barra magnetica, mescolare questa soluzione durante la notte e quindi autoclave. Utilizzare questo H2O trattato con DEPC per realizzare tutte le soluzioni contenenti Tris; quindi, filtrare sterilizzare utilizzando un filtro a vuoto superiore della bottiglia. Utilizzare ddH2O regolare per preparare tutte le altre soluzioni (senza Tris); quindi, trattare con DEPC (0,1%, vol / vol) e autoclave.
NOTA: i buffer utilizzati nel seguente insieme di procedure sperimentali sono elencati in ordine alfabetico nella Tabella 1.
| Nome del buffer | Composizione |
| Tampone di borato | 0,2 M borato di sodio, pH 9 |
| Buffer C | 20 mM HEPES, pH 7,9, 25% (vol/vol) glicerolo, 0,42 M NaCl, 1,5 mM MgCl2, 0,2 mM EDTA, 0,5 mM fenilmetilsulfonilfluoruro (PMSF), 0,5 mM ditiotreitolo (DTT) |
| Buffer D | 10 mM HEPES, pH 7,9, 20% (vol/vol) glicerolo, 0,1 M KCl, 0,2 mM EDTA, 0,5 mM PMSF, 0,5 mM DTT |
| 60%D | 60% Buffer D e 40% H2O |
| Etanolamina | 0,2 M etanolamina, pH 8 |
| Buffer di legame HEPES | 20 mM HEPES, pH 7,9 |
| Tampone di lavaggio HEPES | 20 mM HEPES, pH 7,9, 0,5 M NaCl |
| Tampone di carico dell'RNA | 90% formammide, 20 mM EDTA, pH 8, 0,05% (p/v) blu bromofenolo |
| Buffer SDS-PAGE | 25 mM Tris, 169 mM glicina, 0,1% sodio dodecil solfato (SDS), pH 8,8 |
| Buffer di esempio SDS | 62,5 mM Tris, pH 6,8, 2% SDS, 10% glicerolo, 5% 2-mercaptoetanolo, 0,1% (p/v) blu bromofenolo |
| Tampone TBE per gel di RNA | 89 mM Tris, 89 mM acido borico, 2,5 mM EDTA, pH 8,3 |
| Buffer TE | 10 mM Tris, pH 8, 1 mM EDTA |
| Buffer di trasferimento | 25 mM Tris, 1,92 M glicina, 20% metanolo, pH 8,3 |
| Buffer T-TBS | 10 mM Tris, 0,5 M NaCl, 0,05% Tween 20, pH 7,5 |
| Tampone di lavaggio TX | 0,05% Triton X-100 (TX) in 60%D |
Tabella 1: Nome e composizione dei buffer
2. Preparazione di NE impoverito di U1 snRNP (U1 ΔNE)
- Preparazione di perline anti-U1 per l'immunoadsorbimento
- Pre-gonfiare 50 mg di proteine A-sefarosio CL-4B perline in eccesso di H2O trattato con DEPC per produrre circa 200 μL di perline gonfie e quindi lavare nel tampone di lavaggio HEPES.
- Per questo lavaggio e tutti i lavaggi successivi, pellet le perline mediante centrifugazione (1.000 x g in un rotore a benna oscillante a 4 °C per 10-15 s) e rimuovere il lavaggio non legato utilizzando un micropipetto e scartare.
- Mescolare 150 μL di perline lavate con 150 μL di siero autoimmune umano specifico per U1 snRNP (volume di anticorpi rispetto al volume di perline in un rapporto di 1:1).
- Regolare, sulla base del volume totale di (~300 μL dal punto 2.1.3 sopra), la miscela a 20 mM HEPES, pH 7,9, corrispondente alle condizioni del tampone legante HEPES; incubare questa miscela con dondolo continuo a temperatura ambiente per 60 min.
- Lavare le perline legate con anticorpi con 1 mL di tampone borato (0,2 M borato di sodio, pH 9) e risospese in 1 mL dello stesso tampone borato.
- Per accoppiare covalentemente l'anticorpo legato alle perle di proteina A-sefarosio, aggiungere dimetilpimilamidato a una concentrazione finale di 20 mM e incubare a temperatura ambiente con oscillazione per 60 minuti.
- Lavare le perline con 1 mL di tampone borato.
- Per bloccare qualsiasi reagente reticolante non reagito, aggiungere 1 mL di etanolamina 0,2 M (pH 8) e incubare a temperatura ambiente con dondolo per 60 minuti.
- Lavare le perle accoppiate agli anticorpi, di seguito designate come perle anti-U1, due volte con 0,5 mL di tampone di lavaggio TX (0,05% Triton X-100 in 60% D).
- Esaurimento di U1 snRNP da NE (vedi Figura 1A)
NOTA: La procedura per la preparazione di NE da cellule HeLa è stata inizialmente sviluppata da Dignam et al.20. Abbiamo descritto i materiali e i metodi dettagliati per la preparazione di NE per i saggi di giunzione19 (vedere i passaggi 2.1 e 3.1 di tale riferimento). NE, come inizialmente preparato, si trova nel buffer C e sarà in seguito designato come NE(C). NE(C) dializzato ed equilibrato con il Buffer D sarà designato come NE(D).- Incubare 200 μL di NE(C) con 100 μL di perline anti-U1 dal punto 2.1.9 di cui sopra.
- Aggiungere 5 μL di RNasin alla miscela.
- Ruotare il microtubo testa-sopra-coda a 4 °C per 1 ora.
- Pellettizzare la miscela per centrifugazione (1.000 x g in un rotore a benna oscillante a 4 °C per 10-15 s) e raccogliere il materiale non legato (U1ΔNE) utilizzando una siringa Hamilton.
- Dializzare l'intero volume di U1ΔNE, insieme a un'aliquota separata di 50 μL del NE(C) non disapletato originale, in compartimenti separati di un microdializzatore, con agitazione, per 75 minuti contro il 60% D utilizzando una membrana di dialisi con taglio di peso molecolare di 8 K.
- Immediatamente dopo la dialisi, dividere questi preparati (U1ΔNE e NE in 60% D) in aliquote da 20 μL; quindi congelare a scatto in un bagno di ghiaccio secco/etanolo e conservare a -80 °C.
- Analisi del contenuto di RNA e proteine di U1ΔNE e materiale legato su perline anti-U1
- Dopo la rimozione del materiale non legato (U1ΔNE) (punto 2.2.4), lavare il materiale legato alle perle anti-U1 aggiungendo 0,5 mL di tampone di lavaggio TX. Pellet la miscela per centrifugazione (1.000 x g in un rotore a benna oscillante a 4 °C per 10-15 s) e rimuovere il surnatante usando un micropipetto e scartare.
- Ripetere due volte i passaggi di lavaggio 2.3.1.
- Rimuovere il materiale legato alle perle anti-U1 aggiungendo 100 μL di 2x tampone campione SDS a 100 μL delle perline e incubando per 10 minuti a temperatura ambiente.
- Pellet la miscela per centrifugazione (1.000 x g in un rotore a benna oscillante a 4 °C per 10-15 s); rimuovere il surnatante della siringa Hamilton e congelare a scatto in un bagno di ghiaccio secco/etanolo. Conservare a -80 °C.
- Confrontare il NE non delegato, il NE impoverito (U1ΔNE) e il materiale legato alle perline (rimosso dalle perline dal buffer del campione SDS come descritto nei passaggi 2.3.3 e 2.3.4 sopra). Seguire i passaggi 2.3.6-2.3.8 per l'analisi dell'RNA o i passaggi 2.3.9-2.3.10 per l'analisi delle proteine.
- Per ogni campione, estrarre l'RNA con 200 μL di fenolo-cloroformio (50:50, v/v); quindi estrarre nuovamente con 180 μL di alcool cloroformio-isoamilico (25:1, v/v). Dopo l'estrazione, aggiungere 300 μL di etanolo freddo a prova di 200, invertire per miscelare e conservare l'RNA precipitato durante la notte a -20 °C.
- Centrifugare l'RNA precipitato con etanolo (12.000 x g per 10 minuti a 4 °C). Lavare il pellet con 150 μL di etanolo freddo al 70%. Centrifugare nuovamente (12.000 x g) a 4 °C per 15 min. Rimuovere il surnatante utilizzando un micropipetto e asciugare il pellet in una velocità vac per 10-15 minuti senza calore.
- Sospendere il pellet di RNA essiccato in 10 μL di tampone di carico dell'RNA, vortice delicatamente, riscaldare a 75-85 °C per 90 s, quindi incubare sul ghiaccio per 2 minuti. Separare gli snRNA mediante elettroforesi su gel (2 ore a 16 mA) attraverso il 13% di poliacrilammide - gel di urea 8,3 M e quindi colorare con bromuro di etidio o soggetto a northern blotting10,16.
- Caricare i campioni proteici, in tampone campione SDS dallo stadio 2.3.5, su gel di poliacrilammide al 12,5% ed elettroforesi a 200 V per circa 45-50 minuti in tampone SDS-PAGE (elettroforesi del gel poliacrilammidico dodecilsolfato di sodio).
- Trasferire le proteine separate sulla membrana nitrocellulosa a 400 mA per 2 ore nel tampone di trasferimento. Dopo il trasferimento, bloccare la membrana incubando durante la notte in T-TBS contenente il 10% di latte secco non grasso. Quindi, immunoblot la membrana per rivelare proteine specifiche8,21.
3. Immunoprecipitazione di frazioni 10S di gradienti di glicerolo da parte di anti-Gal3
- Preparazione di perline anti-Gal3 per l'immunoadsorbimento
NOTA: La derivazione e la caratterizzazione degli antisieri policlonali di coniglio contro Gal3 per coniglio #2421 e per coniglio #4910 sono state descritte in precedenza.- Utilizzare il siero preimmune del coniglio #49 come controllo.
- Per la preparazione di perline anti-Gal3 seguire la procedura precedentemente descritta per la preparazione di perline anti-U1 (fase 2.1), con l'eccezione che corrispondente al passaggio 2.1.3, il rapporto tra antisiero (ad esempio, anti-Gal3, #49) e perline è 3: 1.
- Poco prima dell'uso, lavare le perle accoppiate agli anticorpi, di seguito designate come perline anti-Gal3, due volte con 0,5 ml di tampone di lavaggio TX. Rimuovere il surnatante, prima con un micropipettatore per estrarre la maggior parte del liquido e poi con una siringa hamilton per estrarre il liquido dalle perline; scartare.
- Immunoprecipitatoton delle frazioni del gradiente di glicerolo da parte di anti-Gal3 (vedi Figura 1B)
- Frazionare NE(D) su un gradiente di glicerolo del 12%-32%10. Combinare e mescolare le frazioni di gradiente di glicerolo 3, 4 e 5 (numerate dalla parte superiore del gradiente), che si trovano vicino alla regione 10S del gradiente.
- Preparare due campioni, ciascuno con aliquota di 150 μL di frazioni di gradiente combinate 3-5 (fase 3.2.1), e posizionare in 50 μL di perline anti-Gal3.
- In parallelo, preparare due campioni ciascuno con 150 μL di frazione 1 (contenente Gal3 non in complesso con U1 snRNP10; fase 3.2.1) e inserire in 50 μL di perline anti-Gal3.
- Come controllo, posizionare 150 μL di 60% D in un altro microtubo di 50 μL di perline anti-Gal3.
- Mescolare delicatamente picchiettando il tubo, quindi ruotare il microtubo testa-sopra-coda a 4°C per 1 ora.
- Pellet la miscela mediante centrifugazione delicata (1.000 x g in un rotore a benna oscillante a 4 °C per 10-15 s).
- Rimuovere il surnatante (materiale non legato) utilizzando una siringa hamilton. Non lavare le perline e usare immediatamente per l'aggiunta delle reazioni di giunzione (punto 4.2).
- Analisi del contenuto di RNA e proteine nel materiale non legato e legato dalla precipitazione anti-Gal3 di frazioni di gradiente 10S
- Per l'analisi dei componenti del materiale legato e non legato dalla precipitazione anti-Gal3 delle frazioni di gradiente 10S, raccogliere il materiale non legato (surnatante dopo il passaggio 3.2.6), trasferirlo in un microtubo fresco e congelare a -20 °C.
- Lavare le perline precipitate dal punto 3.2.6 (contenente materiale legato all'anti-Gal3) aggiungendo 0,5 mL di tampone di lavaggio TX.
- Pellet la miscela mediante centrifugazione delicata (1.000 x g in un rotore a benna oscillante a 4 °C per 10-15 s); rimuovere il surnatante usando un micropipettor e scartare. Ripetere i passaggi di lavaggio altre due volte.
- Aggiungere 50 μL di tampone campione 2X SDS alle perline anti-Gal3 lavate e pellettate.
- Mescolare delicatamente le perline e incubare per 10 minuti a temperatura ambiente.
- Pellet la miscela mediante centrifugazione delicata (1.000 x g in un rotore a benna oscillante a 4 °C per 10-15 s), raccogliere il surnatante della siringa Hamilton e conservare in un microtubo fresco a -20 °C.
- Confrontare il materiale non legato (sezione 3.3.1) e il materiale legato (punto 3.3.6) della precipitazione anti-Gal3 in termini di RNA e componenti proteici, utilizzando le procedure descritte nei passaggi 2.3.6. al 2.3.10, rispettivamente.
4. Assemblaggio della reazione di giunzione e analisi dei prodotti
- Preparazione del substrato di giunzione
NOTA: il substrato pre-mRNA, designato MINX, contiene due sequenze di esoni e una sequenza di introne da Adenovirus22. La sequenza di DNA MINX nel plasmide è sotto il controllo dei promotori della RNA polimerasi T3, T7 o SP6. I materiali e i metodi dettagliati per la linearizzazione del DNA plasmidico MINX con endonucleasi di restrizione BamHI, la trascrizione da parte di SP6 RNA polimerasi in presenza di α-32P[GTP] e la purificazione di MINX marcata con 32P per saggi di splicing sono descritti in precedenza19 (vedi passaggi 2.2 e 3.2 di tale riferimento).- Conservare il MINX radiomarcato come precipitato di etanolo a -20 °C; utilizzare il substrato di splicing etichettato entro 4-6 settimane dalla trascrizione.
- Poco prima dell'uso, centrifugare l'etanolo precipitato 32P-marcato MINX a 12.000 x g per 10 minuti a 4 °C; rimuovere il surnatante con un micropipettor e scartare.
- Aggiungere 150 μL di etanolo al 70% e centrifugare a 12.000 x g per 15 minuti a 4 °C. Scartare il surnatante e asciugare il pellet in speed vac senza calore per 15 min.
- Reidratare il pellet in 50 μL di acqua DEPC. Spot 2 μL su ciascuno dei due filtri GF/C; immergere i filtri in acido tricloroacetico freddo al 5% (TCA) per 10 min. Risciacquare con TCA freddo al 5%, seguito da etanolo a prova di 180 su un pallone sottovuoto. Asciugare ad aria i filtri e sottoporre a scintillazione il conteggio in 4 mL di Safety-Solve.
- Diluire MINX marcato con 32P nel 60% D a 104 cpm/μL per il test di giunzione.
- Assemblaggio della reazione di giunzione (vedi Figura 1C)
- Assemblare, su ghiaccio, le reazioni di giunzione in un volume totale di 24 μL (8 μL U1ΔNE (dal passo 2.2.6), 3,5 mM MgCl2, 1,5 mM ATP, 20 mM creatina fosfato, 0,5 mM DTT, 20 unità RNasin, 4 μL 32P-marcato SUBSTRATO di giunzione MINX (104 cpm/μL), 60% D) e aggiungere a ciascun tubo di perline dal paragrafo 3.2.7. Assemblare un insieme identico di reazioni di giunzione in un volume totale di 24 μL ma senza U1ΔNE e aggiungere a ciascun tubo di perline dal punto 3.2.7.
- Preparare una reazione di splicing di controllo in un volume totale di 12 μL (4 μL NE(D), 3,5 mM MgCl2, 1,5 mM ATP, 20 mM creatina fosfato, 0,5 mM DTT, 20 unità RNasin, 2 μL 32P-marcato SUBSTRATO DI GIUNzione MINX (104 cpm/μL), 60% D).
- Mescolare delicatamente i tubi picchiettando e ruotare end-over-tail a 30°C per 90 min. Pellet la miscela mediante centrifugazione delicata a 1.000 x g in un rotore a benna oscillante a 4 °C per 10-15 s.
- Arrestare la reazione ed eluire le proteine dalle perline aggiungendo 24 μL di 2x tampone campione SDS alle provette contenenti perline e 12 μL di 2x tampone campione SDS alla provetta di controllo contenente NE ma senza perline. Riscaldare i tubi a 100 °C per 7 min.
- Centrifugare delicatamente i tubi a 1.000 x g in un rotore a benna oscillante a 4 °C per 10-15 s.
- Trasferire i supernatanti (eluizioni) in microtubi freschi: circa 48 μL dai tubi di perline e 24 μL dal tubo di controllo NE.
- Aggiungere la proteinasi K (20 mg/mL) per digerire e solubilizzare le proteine: aggiungere 5 μL all'eluizione di 48 μL dalle perline e aggiungere 2,5 μL al controllo NE da 24 μL.
- Incubare i tubi a 37°C per 40 min.
- Centrifugare delicatamente i tubi a 1.000 x g in un rotore a benna oscillante a 4 °C per 10 s.
- Diluire le eluizioni di perline con 39,5 μL te e 10 μL 3 M acetato di sodio. Diluire il controllo NE con 63,5 μL TE e 10 μL 3 M acetato di sodio.
- Estrarre e analizzare l'RNA come descritto di seguito (paragrafo 4.3).
- Analisi dei prodotti della reazione di giunzione
- Estrarre gli RNA in ogni campione con fenolo-cloroformio, seguito da alcool cloroformio-isoamilico; precipitare gli RNA con etanolo, centrifugare, lavare i pellet, rimuovere il surnatante e asciugare i pellet seguendo la stessa procedura descritta ai punti 2.3.6 e 2.3.7.
- Sospendere il pellet di RNA essiccato in 10 μL di tampone di carico dell'RNA, vortice delicatamente, riscaldare a 75-85 °C per 90 s, quindi incubare sul ghiaccio per 2 minuti.
- Preparare 20 mL di una soluzione contenente il 13% di poliacrilammide (bisacrilammide:acrilammide, 1,9:50 [wt/wt]) in urea 8,3 M; gel fusi di 15 cm di lunghezza utilizzando questa soluzione.
- Una volta che il gel è stato colato, elettroforesizzarlo (senza alcun campione caricato) a 400 V per 20 minuti utilizzando TBE come buffer di funzionamento. Dopo questo passaggio, lavare i pozzetti con il buffer di esecuzione TBE.
- Caricare i campioni di RNA, nel buffer di carico dell'RNA, ed elettroforesi con buffer tbe funzionante a 400 V per 3,5-4 ore. Dopo l'elettroforesi, rimuovere l'urea immergendo e ruotando il gel in acqua distillata per 10 minuti.
- Asciugare sottovuoto il gel su carta da filtro da 3 M, prima per 2 h 15 min a 80 °C e poi per 30 min senza calore per raffreddarlo lentamente. Sottoporre il gel essiccato ad autoradiografia su pellicola per rilevare le posizioni di migrazione dei componenti radioattivi.
Access restricted. Please log in or start a trial to view this content.
Risultati
NE impoverito di U1 snRNP (U1ΔNE dalla Sezione 2.2.6) e Gal3 - U1 snRNP complessi della regione 10S del gradiente del glicerolo immunoprecipitato da anti-Gal3 (fase 3.2.7) sono stati miscelati in una reazione di splicing. Questa miscela di reazione conteneva SnRNA U1 (Figura 2A, corsia 3), nonché la proteina specifica U1, U1-70K (Figura 2B, corsia 3). Come previsto, l'anti-Gal3 ha precipitato Gal3 (Figura ...
Access restricted. Please log in or start a trial to view this content.
Discussione
Questo rapporto fornisce i dettagli sperimentali che documentano un complesso snRNP Gal3 - U1 intrappolato su perline rivestite anti-Gal3 può legarsi al substrato pre-mRNA e questo complesso ternario può ripristinare l'attività di splicing a un NE impoverito di SnRNP U1. Gal3 è un membro di una famiglia di proteine originariamente isolate sulla base della sua attività di legame ai carboidrati specifica del galattosio23 . I primi studi di immunofluorescenza e frazionamento subcellulare hanno f...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato supportato dalla National Science Foundation Grant MCB-0092919 e dalla Michigan State University Intramural Research Grant 09-CDFP-2001 (a RJP) e dal National Institutes of Health Grant GM-38740 e dal Michigan AgBioResearch Project MICL02455 (a JLW).
Il substrato pre-mRNA MINX utilizzato nei saggi di giunzione è stato un gentile dono della dott.ssa Susan Berget (Baylor College of Medicine, Houston, TX, USA).
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| anti-U1 snRNP | The Binding Site | Hu ENA-RNP #33471 | human autoimmune serum specific for U1 snRNP |
| bottle top vacuum filter | Fisher Scientific | Corning 431153 (0.22 μm; PES 150 ml) | for filtering solutions containing Tris |
| centrifuge | International Equipment Company | IEC Model PR-6 | for pelletting Sepharose beads in immunoprecipitation |
| diethylpyrocarbonate (DEPC) | Sigma-Aldrich | 159220-5G | for treatment of water used in preparation of all solutions |
| dimethylpimelimidate (DMP) | Sigma-Aldrich | 80490-5G | for cross-linking antibody to Sepharose beads |
| electrophoresis cell | BioRad Laboratories, Inc | Mini-Protean II | for SDS-PAGE separation of proteins |
| ethanolamine | Sigma-Aldrich | 411000-100ml | for blocking after the cross-linking reaction |
| gel electrophoresis system | Hoefer, Inc | HSI SE 500 Series | for separating snRNAs by gel electrophoresis |
| gel slab dryer | BioRad | Model 224 | for drying gel slabs for autoradiography |
| Hybond ECL membrane | GE Healthcare | RPN3032D (0.2 μm; 30 cm x 3 m) | for immunoblotting of proteins on membrane |
| microdialyzer (12 x 100 μl sample capacity) | Pierce | Microdialyzer System 100 | for exchanging the buffer of nuclear extract |
| microdialyzer membranes (8K cutoff) | Pierce | 66310 | for exchanging the buffer of nuclear extract |
| non-fat dry milk | Spartan Stores | Spartan Instant Non-fat Dry Milk | |
| Protein A Sepharose CL-4B | Millipore-Sigma | GE 17-0780-01 | for coupling antibody to beads |
| Proteinase K | Millipore-Sigma | P2308-5mg | for stopping the splicing reaction to isolate the RNAs |
| RNasin | Promega | N2111 | for inhibiting ribonuclease activity |
| rocker/rotator | Lab Industries, Inc | Labquake Shaker 400-110 | for mixing protein solutions in coupling reactions and in immunoprecipitation |
| Safety-Solve | Research Products International Corp. | No. 111177 | scintillation counting cocktail for determination of radioactivity in splicing substrate |
| scintillation counter | Beckman Instruments | LS6000SC | scintillation counter for determination of radioactivity |
| speed vaccum concentrator | Savant | SVC 100H | for drying ethanol-precipitated RNA pellets |
| Transphor electrophoresis unit | Hoefer, Inc | Hoefer TE Series Transphor | for protein transfer from SDS-PAGE to blotting membrane |
Riferimenti
- Hoskins, A. A., Moore, M. J. The spliceosome: a flexible, reversible macromolecular machine. Trends In Biochemical Sciences. 37, 179-188 (2012).
- Choi, Y. D., Grabowski, P., Sharp, P. A., Dreyfuss, G. Heterogeneous nuclear ribonucleoproteins: role in RNA splicing. Science. 231, 1534-1539 (1986).
- Lerner, M., Steitz, J. A. Snurps and scyrps. Cell. 25, 298-300 (1981).
- Maniatis, T., Reed, R. The role of small nuclear ribonucleoprotein particles in pre-mRNA splicing. Nature. 325, 673-678 (1987).
- Hoskins, A. A., et al. Ordered and dynamic assembly of single spliceosomes. Science. 331, 1289-1295 (2011).
- Coppin, L., Leclerc, J., Vincent, A., Porchet, N., Pigny, P. Messenger RNA life-cycle in cancer: emerging role of conventional and non-conventional RNA-binding proteins. International Journal of Molecular Sciences. 19, 650-676 (2018).
- Dagher, S. F., Wang, J. L., Patterson, R. J. Identification of galectin-3 as a factor in pre-mRNA splicing. Proceedings of the National Academy of Sciences of the United States of America. 92, 1213-1217 (1995).
- Vyakarnam, A., Dagher, S. F., Wang, J. L., Patterson, R. J. Evidence for a role for galectin-1 in pre-mRNA splicing. Molecular and Cellular Biology. 17, 4730-4737 (1997).
- Wang, W., Park, J. W., Wang, J. L., Patterson, R. J. Immunoprecipitation of spliceosomal RNAs by antisera to galectin-1 and galectin-3. Nucleic Acids Research. 34, 5166-5174 (2006).
- Haudek, K. C., Voss, P. G., Locascio, L. E., Wang, J. L., Patterson, R. J. A mechanism for incorporation of galectin-3 into the spliceosome through its association with U1 snRNP. Biochemistry. 48, 7705-7712 (2009).
- Fritsch, K., et al. Galectin-3 interacts with components of the nuclear ribonucleoprotein complex. BMC Cancer. 16, 502-511 (2016).
- Conway, G. C., Krainer, A. R., Spector, D. L., Roberts, R. J. Multiple splicing factors are released from endogenous complexes during in vitro pre-mRNA splicing. Molecular and Cellular Biology. 9, 5273-5280 (1989).
- Dery, K. J., Yean, S. L., Lin, R. J. Assembly and glycerol gradient isolation of yeast spliceosomes containing transcribed or synthetic U6 snRNA. Methods in Molecular Biology. 488, 41-63 (2008).
- Yoshimoto, R., Kataoka, N., Okawa, K., Ohno, M. Isolation and characterization of post-splicing lariat-intron complexes. Nucleic Acids Research. 37, 891-902 (2009).
- Malca, H., Shomron, N., Ast, G. The U1 snRNP base pairs with the 5' splice site within a penta-snRNP complex. Molecular and Cellular Biology. 23, 3442-3455 (2003).
- Haudek, K. C., Voss, P. G., Wang, J. L., Patterson, R. J. A 10S galectin-3 - snRNP complex assembles into active spliceosomes. Nucleic Acids Research. 44, 6391-6397 (2016).
- Rappsilber, J., Ryder, U., Lamond, A. I., Mann, M. Large-scale proteomic analysis of the human spliceosome. Genome Research. 12, 1231-1245 (2002).
- Jurica, M. S., Moore, M. J. Capturing splicing complexes to study structure and mechanism. Methods. 28, 336-345 (2002).
- Patterson, R. J., Haudek, K. C., Voss, P. G., Wang, J. L. Examination of the role of galectins in pre-mRNA splicing. Methods in Molecular Biology. 1207, 431-449 (2015).
- Dignam, J. D., Lebovitz, R. M., Roeder, R. G. Accurate transcription initiation by RNA polymerase II in a soluble extract from isolated mammalian nuclei. Nucleic Acids Research. 11, 1475-1489 (1983).
- Agarwal, N., Sun, Q., Wang, S. Y., Wang, J. L. Carbohydrate-binding protein 35. I. Properties of the recombinant polypeptide and the individuality of the domains. Journal of Biological Chemistry. 268, 14932(1993).
- Zillmann, M., Zapp, M. I., Berget, S. M. Gel electrophoretic isolation of splicing complexes containing U1 small nuclear ribonucleoprotein particles. Molecular and Cellular Biology. 8, 814-821 (1988).
- Barondes, S. H., et al. Galectins: a family of animal β-galactoside-binding proteins. Cell. 76, 597-598 (1994).
- Laing, J. G., Wang, J. L. Identification of carbohydrate binding protein 35 in heterogeneous nuclear ribonucleoprotein complex. Biochemistry. 27, 5329-5334 (1988).
- Vyakarnam, A., Lenneman, A. J., Lakkides, K. M., Patterson, R. J., Wang, J. L. A comparative nuclear localization study of galectin-1 with other splicing components. Experimental Cell Research. 242, 419-428 (1998).
- Michaud, S., Reed, R. An ATP-independent complex commits pre-mRNA to the mammalian spliceosome assembly pathway. Genes & Development. 5, 2534-2546 (1991).
- Chiu, Y. -F., et al. Cwc25 is a novel splicing factor required after Prp2 and Yju2 to facilitate the first catalytic reaction. Molecular and Cellular Biology. 29, 5671-5678 (2009).
- Krishnan, R., et al. Biased Brownian ratcheting leads to pre-mRNA remodeling and capture prior to first-step splicing. Nature Structural and Molecular Biology. 20, 1450-1457 (2013).
- Gray, R. M., et al. Distinct effects on splicing of two monoclonal antibodies directed against the amino-terminal domain of galectin-3. Archives of Biochemistry and Biophysics. 475, 100-108 (2008).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon