A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
השלמת פעילות התרסיס על ידי מתחם גלקטין-3 - U1 snRNP על חרוזים
In This Article
Summary
מאמר זה מתאר את ההליכים הניסיוניים עבור (א) דלדול של U1 snRNP מתמציות גרעיניות, עם אובדן במקביל של פעילות splicing; ותואר (ב) שחזור של פעילות ההצמדה בתמצית U1-מרוקנת על ידי חלקיקי גלקטין-3 - U1 snRNP הקשורים חרוזים בשילוב עם נוגדנים אנטי-גלקטין-3.
Abstract
ניסויים קלאסיים של דלדול-שחזור מצביעים על כך שגלקטין-3 הוא גורם שיתוף נדרש בתמציות גרעיניות. מנגנון ההשתלבות של גלקטין-3 במסלול ההשתלבות מטופל במאמר זה. משקעים של תמציות גרעיניות תא HeLa על 12%-32% שיפועי גליסול מניב שברים מועשרים חלקיק אנדוגני ~ 10S המכיל גלקטין-3 ו U1 snRNP. כעת אנו מתארים פרוטוקול לרוקן תמציות גרעיניות של U1 snRNP עם אובדן במקביל של פעילות חיבור. פעילות הצמדה בתמצית U1-מרוקנת ניתן ליישב מחדש על ידי חלקיק גלקטין-3 - U1 snRNP לכוד על חרוזי אגרוז covalented בשילוב עם נוגדנים אנטי גלקטין-3. התוצאות מצביעות על כך galectin-3 - U1 snRNP - מתחם טרנרי טרום mRNA הוא קומפלקס E פונקציונלי המוביל למתווכים ומוצרים של תגובת החיבור וכי galectin-3 נכנס למסלול החיבור באמצעות הקשר שלה עם U1 snRNP. התוכנית של שימוש במתחמים זיקה- או immuno-שנבחרו על חרוזים כדי לשחזר את פעילות ההשתתבות בתמציות מרוקן של גורם חרוז מסוים עשוי להיות ישים בדרך כלל למערכות אחרות.
Introduction
הייצור של רוב RNAs שליח eukaryotic (mRNAs) כרוך בהסרת introns וקשירה של exons בתהליך גרעיני המכונה חיבור לפני mRNA1. שני סוגים של מתחמי חלבון RNA (RNPs) מכוונים את העיבוד של RNA לפני השליח ל- mRNA בוגר באמצעות מתחמים spliceosomal. מחלקה אחת, RNPs טרום שליח המתהווה, נוצרת שיתוף תמלול על ידי כריכה של חלבונים גרעיניים הטרוגניים וחלבונים אחרים מחייבים RNA, כולל כמה מבני משפחת SR, מניב מתחמי hnRNP2. ה-RNPs הגרעיניים הקטנים העשירים בארסיל (U snRNPs עם U1, U2, U4, U5 ו-U6 snRNAs) קשורים לחלבונים ספציפיים ל-U ולחלבוני ליבה3,4. ה- snRNPs של ארה"ב מתקשרים באופן מסודר עם אזורים ספציפיים של RNPs לפני השליח במסלול שיפוץ דינמי כאשר אינטרונים נקטעים ואקסונים קשורים כדי לייצר mRNPs5 בוגרים. חלבונים גרעיניים רבים נוספים משתתפים באירועי עיבוד אלה6.
גלקטין-1 (Gal1) וגלקטין-3 (Gal3) הם שני חלבונים הנדרשים במסלול ההשתלבות כפי שמוצג על ידי מחקרי דלדול-שיקום7,8. הסרת שני הגלקטינים מליזוב תמציות גרעיניות מוסמכות (NE) מבטלת את ההרכבה המשולבת ואת פעילות ההשתלבות בשלב מוקדם. תוספת של כל גלקטין ל- NE מרוקן כפליים משחזרת את שתי הפעילויות. Gal1 ו- Gal3 הם מרכיבים של spliceosomes פעיל כפי שמעידים אימונופרציפיטציה ספציפית של טרום mRNA, שילוב ביניים, ו- mRNA בוגר על ידי אנטי-ספירום ספציפי עבור Gal1 או Gal39. חשוב לציין, Gal3 מקשר עם snRNA U אנדוגני המכיל חלקיקים ב- NE מחוץ למסלול ההשתלבות כפי שמוצג על ידי משקעים של snRNPs על ידי אנטי-Gal3 antisera10. לבסוף, השתקה של Gal3 בתאי HeLa משנה דפוסי שכפול של גנים רבים11.
ב- NE דגירה מראש כדי לפרק spliceosomes preformed12, snRNPs נמצאים במתחמים מרובים המשקעים בשיפועים גליצריל מ 7S ליותר מ 60S. למרות שבר הדרגתי גליצול היא טכניקה נפוצה לבידוד של מתחמים ורכיבים spliceosomal (ראה הפניות13,14,15 למשל), הרחבנו שיטה זו על ידי אפיון שברים ספציפיים באמצעות חיסונים נוגדנים. משקעים snRNP ב- 10S מכיל רק U1 snRNA יחד עם Gal3. אימונופרציפיטציה של שבר 10S עם אנטי-רה ספציפית עבור Gal3 או U1 snRNP שיתוף מזרז הן U1 והן Gal3 המציין כמה חלקיקים U1 snRNP קשורים Gal310. מכיוון ש- U1 snRNP הוא המתחם הראשון שנקשר ל- pre-mRNP בהרכבה spliceosomal1,5, שלב זה מייצג אתר כניסה פוטנציאלי עבור Gal3 למסלול ההשתתפות. על בסיס זה, הראינו כי 10S Gal3-U1 snRNP מונו-חלקיקים הקשורים אנטי-Gal3 המכיל חרוזים משוחזרים פעילות splicing ל- U1 snRNP מרוקן NE, הקמת מורכב זה כמנגנון אחד שבאמצעותו Gal3 מגויס לתוך המסלול spliceosomal16. זאת בניגוד לניסיונות לבודד את התרסיסים בשלבים ספציפיים בתגובת ההשתלבות ולקטלג את הגורמים הקשורים 17,18. במחקרים כאלה, נוכחותם של גורמים מסוימים בנקודת זמן כלשהי מובהר אך לא המנגנון שבאמצעותו הם נטענו.
תיארנו בעבר בפירוט את הכנת NE, את מצע ההשתלבות, את ההרכבה של תערובת התגובה המשתלבת, ואת הניתוח של מוצרים בתיעוד שלנו של תפקיד הגלקטינים ב- splicing לפני mRNA19. כעת אנו מתארים את ההליכים הניסיוניים לפירוק תמציות גרעיניות כדי להשיג שבר מועשר במתחם Gal3 - U1 snRNP ולבחירה חיסונית של המתחם האחרון כדי לחדש את פעילות ההכלאה בתמצית גרעינית מרוקנת U1.
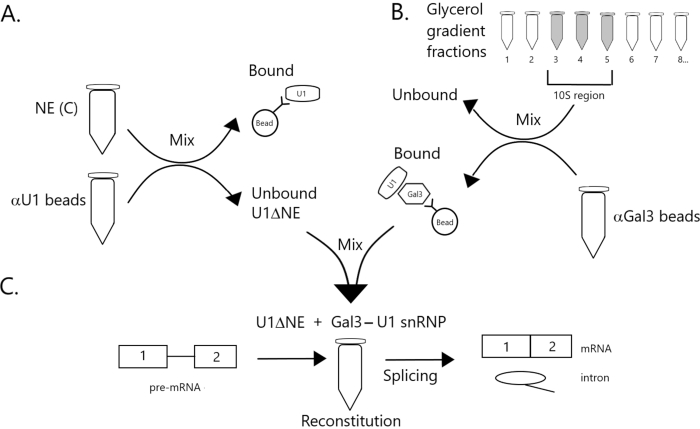
איור 1: תרשים סכמטי הממחיש את ההשלמה של פעילות ההצמדה בתמצית גרעינית מרוקנת מ- U1 snRNP על ידי קומפלקס Gal3-U1 snRNP על חרוזים. (A) NE במאגר C (NE(C)) הוא דגירה עם חרוזי חלבון A-Sepharose בשילוב עם נוגדי U1 snRNP (חרוזים αU1). השבר הלא מאוגד מתרוקן מ- U1 snRNP (U1ΔNE). (B) NE במאגר D (NE(D)) מחולק מעבר הדרגתי של 12%-32% גליצריל על-ידי אולטרה-צנטריפוגה. שברים המתאימים לאזור 10S (שברים 3-5) משולבים ומעורבבים עם חרוזים בשילוב עם נוגדנים נגד Gal3 (חרוזים αGal3). החומר הקשור החרוזים מכיל מונופרקל SnRNP 3-U1. (ג) מתחם Gal3-U1 snRNP מחלק (B) מעורבב עם U1ΔNE מחלק (A) בבדיקה משולבת באמצעות מצע קדם-mRNA של MINX עם תווית 32P והמתווכים והמוצרים של תגובת ההצמדה מנותחים על ידי אלקטרופורזה ג'ל ואוטרדיוגרפיה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Protocol
1. הערות על נהלים כלליים
- ודא כי כל הכימיקלים (רכיבי חוצץ, אנזימים, וכו ') נשמרים ללא ריבונוקלאז (RNase). לבודד את כל בקבוקי ריאגנט שנרכשו מסחרית משימוש כללי במעבדה. ללבוש כפפות לכל השלבים של ההליך הניסיוני. השתמש רק בכלי זכוכית וכלי נכי שנאפו (ראה שלב 1.2 להלן) ובפתרונות שטופלו מראש (ראה שלב 1.3 להלן).
- אופים את כל כלי הזכוכית (כוסיות, צלוחיות, בקבוקים, פיפטות וכו ') למשך מינימום של 4 שעות ב 177 °C (77 °F). עוטפים כלים אחרים (מריות, מוטות מוקפצים וכו') בנייר אלומיניום לפני האפייה באותם תנאים.
- הכן פתרון 0.1% (vol/vol) של דיאתילפירוקרבונט (DEPC) במים מזוקקים כפולים (ddH2O). באמצעות מוקפץ מגנטי, מערבבים את הפתרון הזה בן לילה ולאחר מכן autoclave. השתמש ב- H2O זה שטופל ב- DEPC כדי ליצור את כל הפתרונות המכילים את Tris; לאחר מכן, לסנן לחטא באמצעות מסנן ואקום העליון בקבוק. השתמש ddH2O רגיל כדי להכין את כל הפתרונות האחרים (ללא טריס); לאחר מכן, פנקו באמצעות DEPC (0.1%, vol/vol) ו- autoclave.
הערה: המאגרים המשמשים בערכה הבאה של הליכים ניסיוניים מפורטים בסדר אלפביתי בטבלה 1.
| שם המאגר | הרכב |
| מאגר בוראט | 0.2 M נתרן בוראט, pH 9 |
| מאגר C | 20 mM HEPES, pH 7.9, 25% (vol/vol) גליצרול, 0.42 M NaCl, 1.5 מ"מ MgCl2, 0.2 מ"מ EDTA, 0.5 mM פנילמתילסולפוניל פלואוריד (PMSF), 0.5 mM dithiothreitol (DTT) |
| מאגר D | 10 mM HEPES, pH 7.9, 20% (vol/vol) גליצרל, 0.1 M KCl, 0.2 מ"מ EDTA, 0.5 מ"מ PMSF, 0.5 mM DTT |
| 60%D | 60% חוצץ D ו-40% H2O |
| אתנולמין | 0.2 M אתנולמין, pH 8 |
| מאגר איגוד HEPES | 20 מ"מ HEPES, pH 7.9 |
| מאגר כביסה של HEPES | 20 מ"מ HEPES, pH 7.9, 0.5 M NaCl |
| מאגר טעינת RNA | 90% פורממיד, 20 מ"מ EDTA, pH 8, 0.05% (w/v) ברומופנול כחול |
| מאגר SDS-PAGE | 25 mM Tris, 169 מ"מ גליצין, 0.1% נתרן דודסיל סולפט (SDS), pH 8.8 |
| מאגר דוגמאות SDS | 62.5 mM טריס, pH 6.8, 2% SDS, 10% גליצריל, 5% 2-mercaptoethanol, 0.1% (w/v) ברומופנול כחול |
| מאגר TBE עבור ג'לים RNA | 89 mM Tris, 89 מ"מ חומצה בורית, 2.5 מ"מ EDTA, pH 8.3 |
| מאגר TE | 10 מ"מ טריס, pH 8, 1 mM EDTA |
| מאגר העברה | 25 מ"מ טריס, 1.92 M גליצין, 20% מתנול, pH 8.3 |
| מאגר T-TBS | 10 מ"מ טריס, 0.5 M NaCl, 0.05% טווין 20, pH 7.5 |
| מאגר כביסה TX | 0.05% טריטון X-100 (TX) ב-60% D |
טבלה 1: שם וקומפוזיציה של מאגרים
2. הכנת NE מרוקן של U1 snRNP (U1 ΔNE)
- הכנת חרוזי אנטי-U1 לאימונואדסורפטיון
- חרוזים CL-4B חלבון A-Sepharose לפני גל 50 מ"ג עודף DEPC מטופל H2O לייצר כ 200 μL של חרוזים נפוחים ולאחר מכן לשטוף במאגר לשטוף HEPES.
- עבור שטיפה זו וכל הכביסות הבאות, גלולה את החרוזים על ידי צנטריפוגה (1,000 x גרם ברוטור דלי מתנדנד ב 4 °C (10-15 s) ולהסיר את לשטוף unbound באמצעות micropipettor להשליך.
- לערבב 150 μL של חרוזים שטופים עם 150 μL של סרום אוטואימוני אנושי ספציפי עבור U1 snRNP (נפח של נוגדן לנפח של חרוזים ביחס של 1:1).
- כוונן, על בסיס הנפח הכולל של (~ 300 μL מהשלב 2.1.3 לעיל), התערובת ל 20 mM HEPES, pH 7.9, בהתאם לתנאים של מאגר איגוד HEPES; לדגור על תערובת זו עם נדנדה מתמשכת בטמפרטורת החדר במשך 60 דקות.
- לשטוף את החרוזים הקשורים עם נוגדנים עם 1 מ"ל של חוצץ borate (0.2 M נתרן borate, pH 9) ו resuspend ב 1 מ"ל של אותו חוצץ בוראט.
- כדי להצמיד את הנוגדן הקשור לחרוזים חלבון A-Sepharose, להוסיף דימתילפימלימידט לריכוז סופי של 20 mM ודגור בטמפרטורת החדר עם נדנדה במשך 60 דקות.
- לשטוף את החרוזים עם 1 מ"ל של חוצץ בוראט.
- כדי לחסום כל ריאגנט חוצה קישורים לא מתורגל, להוסיף 1 מ"ל של 0.2 M אתנולמין (pH 8) ודגרה בטמפרטורת החדר עם נדנדה במשך 60 דקות.
- לשטוף את החרוזים מצמיד נוגדנים, לאחר מכן מוגדר כמו חרוזים אנטי U1, פעמיים עם 0.5 מ"ל של חוצץ לשטוף TX (0.05% Triton X-100 ב 60% D).
- דלדול של U1 snRNP מ- NE (ראה איור 1A)
הערה: ההליך להכנת NE מתאי HeLa פותח בתחילה על ידי Dignam et al.20. תיארנו את החומרים והשיטות המפורטות להכנת NE לתחבולת בדיקות 19 (ראה שלבים 2.1 ו-3.1 של התייחסות זו). NE, כפי שהוכן בתחילה הוא במאגר C ולאחר מכן יוגדר כ- NE(C). NE(C) חיוג נגד ושווי משקל עם חוצץ D יוגדר כ- NE(D).- דגירה 200 μL של NE(C) עם 100 μL של חרוזי אנטי U1 מהשלב 2.1.9 לעיל.
- מוסיפים 5 μL של RNasin לתערובת.
- סובב את המיקרו-tube ראש מעל הזנב ב-4 °C (70°F) למשך שעה אחת.
- גלם את התערובת על ידי centrifugation (1,000 x גרם ברוטור דלי מתנדנד ב 4 °C (10-15 s) ולאסוף את החומר הלא מאוגד (U1ΔNE) באמצעות מזרק המילטון.
- חייג את כל הנפח של U1ΔNE, יחד עם 50 μL aliquot נפרד של NE המקורי ללא גמישות(C), בתאים נפרדים של microdialyzer, עם ערבוב, במשך 75 דקות נגד 60% D באמצעות קרום דיאליזה עם 8 K חיתוך משקל מולקולרי.
- מיד לאחר הדיאליזה, לחלק את ההכנות האלה (U1ΔNE ו- NE ב 60% D) לתוך 20 aliquots μL; ואז להקפיא באמבט קרח / אתנול יבש ולאחסן ב -80 מעלות צלזיוס.
- ניתוח של RNA ותכולת חלבון של U1ΔNE וחומר הקשורים חרוזים אנטי U1
- לאחר הסרת החומר הלא מאוגד (U1ΔNE) (שלב 2.2.4), לשטוף את החומר הקשור חרוזים anti-U1 על ידי הוספת 0.5 מ"ל של חוצץ לשטוף TX. גלם את התערובת על ידי centrifugation (1,000 x גרם ברוטור דלי מתנדנד ב 4 °C (10-15 s) ולהסיר את supernatant באמצעות micropipettor להשליך.
- חזור על שלבי הכביסה 2.3.1 פעמיים.
- הסר את החומר הקשור לחרוזים נגד U1 על ידי הוספת 100 μL של 2x SDS מאגר מדגם ל 100 μL של החרוזים ודגרה במשך 10 דקות בטמפרטורת החדר.
- גלולה את התערובת על ידי צנטריפוגה (1,000 x גרם ברוטור דלי מתנדנד ב 4 °C (10-15 s); הסר את supernatant על ידי מזרק המילטון, ולהצמיד להקפיא באמבט קרח / אתנול יבש. יש לאחסן ב-80 °C (70 °F).
- השווה את NE הלא מנוצל, את NE המדולדל (U1ΔNE) ואת החומר המאוגד החרוזים (הוסר מן החרוזים על ידי מאגר מדגם SDS כמתואר בשלבים 2.3.3 ו 2.3.4 לעיל). בצע את השלבים 2.3.6-2.3.8 לניתוח RNA או שלבים 2.3.9-2.3.10 לניתוח חלבונים.
- עבור כל מדגם, לחלץ את RNA עם 200 μL של פנול-כלורופורם (50:50, v/v); ואז לחלץ שוב עם 180 μL של אלכוהול כלורופורם-איזואמיל (25:1, v/v). לאחר החילוץ, להוסיף 300 μL של אתנול קר 200 הוכחה, הפוך לערבב, ולאחסן את RNA מזורם לילה ב -20 °C (50 °F).
- צנטריפוגה RNA מזורם אתנול (12,000 x גרם במשך 10 דקות ב 4 °C (70 °F). לשטוף את הכדורים עם 150 μL של קר 70% אתנול. צנטריפוגה שוב (12,000 x גרם) ב 4 °C (75 °F) במשך 15 דקות. הסר את supernatant באמצעות micropipettor ולייבש את הכדורים במהירות לפנות במשך 10-15 דקות ללא חום.
- resuspend כדורי RNA מיובשים ב 10 μL של חוצץ טעינת RNA, מערבולת בעדינות, חום ל 75-85 °C (90 s), ולאחר מכן דגירה על קרח במשך 2 דקות. הפרד את snRNAs על ידי אלקטרופורזה ג'ל (2 שעות ב 16 mA) דרך 13% polyacrylamide - 8.3 M ג'ל אוריאה ולאחר מכן גם כתם עם אתידיום ברומיד או בכפוף סופג צפוני10,16.
- טען את דגימות החלבון, במאגר מדגם SDS החל מהשלב 2.3.5, על 12.5% ג'לים פולאקרילמידים ואלקטרופורזה ב-200 V למשך כ-45-50 דקות במאגר SDS-PAGE (נתרן דודזיל סולפט פולאקרילמיד ג'ל אלקטרופורזה).
- מעבירים את החלבונים המופרדים לקרום ניטרוצלולוז ב-400 mA למשך 2 שעות במאגר ההעברה. לאחר ההעברה, לחסום את הממברנה על ידי דגירה לילה T-TBS המכיל 10% חלב יבש ללא שומן. לאחר מכן, אימונובלוט הממברנה לחשוף חלבונים ספציפיים8,21.
3. אימונופרציפיטציה של שברי 10S של שיפועי גליצריול על ידי אנטי-Gal3
- הכנת חרוזים נגד גל3 לאימונואדסורפטיה
הערה: נגזרת ואפיון של אנטיסרה פוליקלונלי ארנב נגד Gal3 עבור ארנב #2421 עבור ארנב #4910 תוארו בעבר.- השתמש בסרום פרה-חיסון מארנב מס' 49 כשליטה.
- להכנת חרוזים נגד Gal3 בצע את ההליך שתואר בעבר להכנת חרוזים נגד U1 (שלב 2.1), למעט כי המקביל לשלב 2.1.3, היחס של antiserum (למשל, אנטי-Gal3, #49) לחרוזים הוא 3:1.
- רגע לפני השימוש, יש לשטוף את החרוזים מצמידי הנוגדנים, המוגדרים בזאת כחרוזים נגד גל3, פעמיים עם 0.5 מ"ל של חוצץ כביסה TX. הסר את supernatant, תחילה עם micropipettor כדי לקבל את רוב הנוזל החוצה ולאחר מכן עם מזרק המילטון כדי לקבל את הנוזל מתוך החרוזים; זרק.
- אימונופרציפיטטון של שברי מעברי צבע גליצריל על-ידי אנטי-Gal3 (ראה איור 1B)
- חלק NE(D) מעל מעבר צבע של 12%-32% גליצריל10. שלבו וערבבו שברי מעבר צבע של גליצריול 3, 4 ו- 5 (ממוספרים מראש מעבר הצבע), הנמצאים ליד אזור 10S במעבר הצבע.
- הכן שתי דוגמאות, כל אחת עם 150 עליקוט μL של שברי הדרגתי משולבים 3-5 (שלב 3.2.1), ומניחים 50 μL של חרוזים נגד Gal3.
- במקביל, להכין שתי דגימות כל אחד עם 150 μL של שבר 1 (המכיל Gal3 לא במתחם עם U1 snRNP10; שלב 3.2.1) ומניחים 50 μL של חרוזים נגד Gal3.
- כפקד, למקם 150 μL של 60% D במיקרו-Tube אחר של 50 μL נגד Gal3 חרוזים.
- יש לערבב בעדינות על-ידי הקשה על הצינור, ולאחר מכן לסובב את המיקרו-tube ראש-מעל-זנב ב-4°C למשך שעה אחת.
- גלם את התערובת על ידי צנטריפוגה עדינה (1,000 x גרם ברוטור דלי מתנדנד ב 4 °C (10-15 s).
- הסר את supernatant (חומר לא מאוגד) באמצעות מזרק המילטון. אין לשטוף את החרוזים ולהשתמש מיד לתוספת תגובות ההשתתפות (סעיף 4.2).
- ניתוח תכולת הרנ"א והחלבון בחומר הלא מאוגד והכפוף מהמשפעים האנטי-Gal3 של שברי שיפוע של 10S
- לניתוח רכיבים של החומר הכבול והלא מאוגד ממשכוכי אנטי-Gal3 של שברי ההדרגה של 10S, אסוף את החומר הלא מאוגד (סופרנטאנט לאחר שלב 3.2.6), העבר למיקרו-tube טרי והקפא ב-20 °C (70 °F).
- לשטוף את החרוזים מזועזעים מ שלב 3.2.6 (המכיל חומר מאוגד אנטי-Gal3) על ידי הוספת 0.5 מ"ל של חוצץ לשטוף TX.
- גלולה את התערובת על ידי צנטריפוגה עדינה (1,000 x גרם ברוטור דלי מתנדנד ב 4 °C (10-15 s); להסיר את supernatant באמצעות micropipettor ולהשליך. חזור על שלבי הכביסה פעמיים נוספות.
- הוסף 50 μL של 2X SDS חוצץ מדגם חרוזים נגד Gal3 שטף וכדורים.
- מערבבים את החרוזים בעדינות ודגרה במשך 10 דקות בטמפרטורת החדר.
- גלולה את התערובת על ידי צנטריפוגה עדינה (1,000 x גרם ברוטור דלי מתנדנד ב 4 °C (10-15 s), לאסוף את supernatant על ידי מזרק המילטון ולאחסן microtube טרי ב -20 °C (50 °F).
- השווה את החומר הלא מאוגד (סעיף 3.3.1) ואת החומר הכבול (שלב 3.3.6) של המשקעים נגד Gal3 במונחים של רכיבי RNA וחלבון, תוך שימוש בהליכים כמתואר בשלבים 2.3.6. ל- 2.3.10, בהתאמה.
4. הרכבה של תגובה וניתוח של מוצרים
- הכנת מצע ההשתתפות
הערה: המצע שלפני mRNA, המיועד MINX, מכיל שני רצפי אקסון ורצף אינטרונים אחד מאדנווירוס22. רצף הדנ"א של MINX בפלסטיד נמצא בשליטתם של מקדמי פולימראז T3, T7 או SP6 RNA. החומרים והשיטות המפורטות ליניאריזציה של ה- DNA PLASmid MINX עם אנדונוקלאז הגבלת BamHI, שעתוק על ידי SP6 RNA פולימראז בנוכחות α-32P[GTP] וטיהור של 32P שכותרתו MINX עבור בדיקות splicing מתוארים בעבר19 (ראה שלבים 2.2 ו 3.2 של התייחסות זו).- לאחסן את ה- MINX עם תווית הרדיו כמזרז אתנול ב - -20 °C (70 °F); השתמש במצע ההכלאה המסומן בתוך 4-6 שבועות לאחר התמלול.
- ממש לפני השימוש, צנטריפוגה אתנול זירוז 32P שכותרתו MINX ב 12,000 x g במשך 10 דקות ב 4 °C (70 °F); להסיר את supernatant עם micropipettor ולהשליך.
- הוסף 150 μL של 70% אתנול וצנטריפוגה ב 12,000 x גרם במשך 15 דקות ב 4 °C (7 °F). להשליך את supernatant ולייבש את הכדור במהירות vac ללא חום במשך 15 דקות.
- Rehydrate הכדור ב 50 μL של מים DEPC. ספוט 2 μL על כל אחד משני מסנני GF /C; לטבול את המסננים קר 5% חומצה טריכלורואצטית (TCA) במשך 10 דקות. יש לשטוף עם TCA קר של 5%, ואחריו אתנול 180 חסין על בקבוק ואקום. אוויר לייבש את המסננים ובכפוף ספירת נוצץ ב 4 מ"ל של בטיחות-לפתור.
- לדלל 32P-תווית MINX ב 60% D כדי 104 cpm / μL עבור אסייד splicing.
- הרכבה של תגובת ההשתתפות (ראו איור 1C)
- להרכיב, על קרח, חיבור תגובות בנפח כולל של 24 μL (8 μL U1ΔNE (מ שלב 2.2.6), 3.5 מ"מ MgCl2, 1.5 מ"מ ATP, 20 mM קריאטין פוספט, 0.5 mM DTT, 20 יחידות RNasin, 4 μL 32P תווית MINX מצע חיבור (104 cpm / μL), 60% D) ולהוסיף לכל שפופרת של חרוזים מסעיף 3.2.7. להרכיב קבוצה זהה של תגובות חיבור בנפח כולל של 24 μL אבל ללא U1ΔNE ולהוסיף לכל שפופרת של חרוזים מ שלב 3.2.7.
- הכן תגובת שיתוף בקרה בנפח כולל של 12 μL (4 μL NE(D), 3.5 מ"מ MgCl2, 1.5 מ"מ ATP, 20 mM קריאטין פוספט, 0.5 mM DTT, 20 יחידות RNasin, 2 μL 32P תווית MINX מצע splicing (104 cpm/μL), 60% D).
- מערבבים את הצינורות בעדינות על ידי הקשה וסיבוב קצה-על-זנב ב 30°C במשך 90 דקות. גלולה את התערובת על ידי צנטריפוגה עדינה ב 1,000 x גרם ברוטור דלי מתנדנד ב 4 °C (55 מעלות צלזיוס) עבור 10-15 s.
- עצרו את התגובה והתחמקו מהחלבונים מהחרוזים על ידי הוספת 24 μL של 2x SDS חוצץ מדגם לצינורות המכילים חרוזים, ו 12 μL של 2x SDS אגם מדגם לצינור הבקרה המכיל NE אבל לא חרוזים. מחממים את הצינורות ב 100 °C (7 דקות).
- צנטריפוגות הצינורות בעדינות ב 1,000 x גרם ברוטור דלי מתנדנד ב 4 °C (55 °F) עבור 10-15 s.
- העבר את supernatants (elutions) microtubes טרי: כ 48 μL מצינורות החרוזים ו 24 μL מצינור הבקרה NE.
- הוסף Proteinase K (20 מ"ג / מ"ל) כדי לעכל ולהזיל את החלבונים: להוסיף 5 μL אל 48 μL אלוטיון חרוזים ולהוסיף 2.5 μL לבקרת 24 μL NE.
- לדגור על הצינורות ב 37°C במשך 40 דקות.
- צנטריפוגות בעדינות את הצינורות ב 1,000 x g ברוטור דלי מתנדנד ב 4 °C (50 °F) עבור 10 s.
- לדלל את חרוזים elutions עם 39.5 μL TE ו 10 μL 3 M נתרן אצטט. לדלל את בקרת NE עם 63.5 μL TE ו 10 μL 3 M נתרן אצטט.
- לחלץ ולנתח את ה- RNA כמתואר להלן (סעיף 4.3).
- ניתוח מוצרים של תגובת ההשתתפות
- לחלץ את RNAs בכל מדגם עם פנול-כלורופורם, ואחריו אלכוהול כלורופורם-איזואמיל; לזרז את RNAs עם אתנול, צנטריפוגה, לשטוף את הכדורים, להסיר את supernatant ולייבש את הכדורים בעקבות אותו הליך כפי שתואר בשלבים 2.3.6 ו 2.3.7.
- resuspend כדורי RNA מיובשים ב 10 μL של חוצץ טעינת RNA, מערבולת בעדינות, חום ל 75-85 °C (90 s), ולאחר מכן דגירה על קרח במשך 2 דקות.
- הכן 20 מ"ל של פתרון המכיל 13% פוליאקרילמיד (ביסאקרילמיד:אקרילאמיד, 1.9:50 [wt/wt]) ב 8.3 M אוריאה; ג'ל יצוק באורך 15 ס"מ באמצעות פתרון זה.
- לאחר הג'ל הוא יצוק, electrophorese אותו (ללא כל דגימות טעון) ב 400 V במשך 20 דקות באמצעות TBE כחוצץ פועל. לאחר שלב זה, לשטוף את הבארות עם חוצץ פועל TBE.
- טען את דגימות הרנ"א, במאגר טעינת RNA, ואלקטרופורזי עם חוצץ פועל TBE ב- 400 V למשך 3.5 עד 4 שעות. לאחר אלקטרופורזה, להסיר את אוריאה על ידי טבילה וסיבוב הג'ל במים מזוקקים במשך 10 דקות.
- ואקום לייבש את הג'ל על נייר מסנן 3 M, תחילה במשך 2 שעות 15 דקות ב 80 °C (80 °F) ולאחר מכן במשך 30 דקות ללא חום כדי לקרר אותו לאט. נושא את הג'ל המיובש לאוטוקרדיוגרפיה על הסרט כדי לזהות את מיקומי ההגירה של הרכיבים הרדיואקטיביים.
תוצאות
NE מרוקן של U1 snRNP (U1ΔNE מסעיף 2.2.6) ו Gal3 - מתחמי SnRNP U1 מאזור 10S של שיפוע גליצריול immunoprecipitated על ידי אנטי-Gal3 (שלב 3.2.7) היו מעורבים בתגובה splicing. תערובת תגובה זו הכילה U1 snRNA (איור 2A, נתיב 3), כמו גם חלבון ספציפי U1, U1-70K (איור 2B, נתיב 3). כצפוי, האנטי-גל3 הקדים את ...
Discussion
דו"ח זה מספק את הפרטים הניסיוניים המתעדים מתחם Gal3 - U1 snRNP הלכוד על חרוזים מצופים אנטי-Gal3 יכול להיקשר למצע טרום mRNA ומתחם טרנרי זה יכול לשחזר את פעילות החיבור ל- NE מרוקן U1 snRNP. Gal3 הוא חבר במשפחת חלבונים מבודדים במקור על בסיס פעילות מחייבת הפחמימות הספציפית לגלקטוז23 . מחקרי אימונופל?...
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי הקרן הלאומית למדע גרנט MCB-0092919 ומענק מחקר פנים-ארצי של אוניברסיטת מישיגן 09-CDFP-2001 (ל- RJP) ועל ידי המכונים הלאומיים לבריאות גרנט GM-38740 ופרויקט MICL02455 של מישיגן AgBioResearch (ל- JLW).
מצע הקדם-mRNA של MINX ששימש בבדיקות ההסתבכות היה מתנה חביבה מד"ר סוזן ברגט (מכללת ביילור לרפואה, יוסטון, TX, ארה"ב).
Materials
| Name | Company | Catalog Number | Comments |
| anti-U1 snRNP | The Binding Site | Hu ENA-RNP #33471 | human autoimmune serum specific for U1 snRNP |
| bottle top vacuum filter | Fisher Scientific | Corning 431153 (0.22 μm; PES 150 ml) | for filtering solutions containing Tris |
| centrifuge | International Equipment Company | IEC Model PR-6 | for pelletting Sepharose beads in immunoprecipitation |
| diethylpyrocarbonate (DEPC) | Sigma-Aldrich | 159220-5G | for treatment of water used in preparation of all solutions |
| dimethylpimelimidate (DMP) | Sigma-Aldrich | 80490-5G | for cross-linking antibody to Sepharose beads |
| electrophoresis cell | BioRad Laboratories, Inc | Mini-Protean II | for SDS-PAGE separation of proteins |
| ethanolamine | Sigma-Aldrich | 411000-100ml | for blocking after the cross-linking reaction |
| gel electrophoresis system | Hoefer, Inc | HSI SE 500 Series | for separating snRNAs by gel electrophoresis |
| gel slab dryer | BioRad | Model 224 | for drying gel slabs for autoradiography |
| Hybond ECL membrane | GE Healthcare | RPN3032D (0.2 μm; 30 cm x 3 m) | for immunoblotting of proteins on membrane |
| microdialyzer (12 x 100 μl sample capacity) | Pierce | Microdialyzer System 100 | for exchanging the buffer of nuclear extract |
| microdialyzer membranes (8K cutoff) | Pierce | 66310 | for exchanging the buffer of nuclear extract |
| non-fat dry milk | Spartan Stores | Spartan Instant Non-fat Dry Milk | |
| Protein A Sepharose CL-4B | Millipore-Sigma | GE 17-0780-01 | for coupling antibody to beads |
| Proteinase K | Millipore-Sigma | P2308-5mg | for stopping the splicing reaction to isolate the RNAs |
| RNasin | Promega | N2111 | for inhibiting ribonuclease activity |
| rocker/rotator | Lab Industries, Inc | Labquake Shaker 400-110 | for mixing protein solutions in coupling reactions and in immunoprecipitation |
| Safety-Solve | Research Products International Corp. | No. 111177 | scintillation counting cocktail for determination of radioactivity in splicing substrate |
| scintillation counter | Beckman Instruments | LS6000SC | scintillation counter for determination of radioactivity |
| speed vaccum concentrator | Savant | SVC 100H | for drying ethanol-precipitated RNA pellets |
| Transphor electrophoresis unit | Hoefer, Inc | Hoefer TE Series Transphor | for protein transfer from SDS-PAGE to blotting membrane |
References
- Hoskins, A. A., Moore, M. J. The spliceosome: a flexible, reversible macromolecular machine. Trends In Biochemical Sciences. 37, 179-188 (2012).
- Choi, Y. D., Grabowski, P., Sharp, P. A., Dreyfuss, G. Heterogeneous nuclear ribonucleoproteins: role in RNA splicing. Science. 231, 1534-1539 (1986).
- Lerner, M., Steitz, J. A. Snurps and scyrps. Cell. 25, 298-300 (1981).
- Maniatis, T., Reed, R. The role of small nuclear ribonucleoprotein particles in pre-mRNA splicing. Nature. 325, 673-678 (1987).
- Hoskins, A. A., et al. Ordered and dynamic assembly of single spliceosomes. Science. 331, 1289-1295 (2011).
- Coppin, L., Leclerc, J., Vincent, A., Porchet, N., Pigny, P. Messenger RNA life-cycle in cancer: emerging role of conventional and non-conventional RNA-binding proteins. International Journal of Molecular Sciences. 19, 650-676 (2018).
- Dagher, S. F., Wang, J. L., Patterson, R. J. Identification of galectin-3 as a factor in pre-mRNA splicing. Proceedings of the National Academy of Sciences of the United States of America. 92, 1213-1217 (1995).
- Vyakarnam, A., Dagher, S. F., Wang, J. L., Patterson, R. J. Evidence for a role for galectin-1 in pre-mRNA splicing. Molecular and Cellular Biology. 17, 4730-4737 (1997).
- Wang, W., Park, J. W., Wang, J. L., Patterson, R. J. Immunoprecipitation of spliceosomal RNAs by antisera to galectin-1 and galectin-3. Nucleic Acids Research. 34, 5166-5174 (2006).
- Haudek, K. C., Voss, P. G., Locascio, L. E., Wang, J. L., Patterson, R. J. A mechanism for incorporation of galectin-3 into the spliceosome through its association with U1 snRNP. Biochemistry. 48, 7705-7712 (2009).
- Fritsch, K., et al. Galectin-3 interacts with components of the nuclear ribonucleoprotein complex. BMC Cancer. 16, 502-511 (2016).
- Conway, G. C., Krainer, A. R., Spector, D. L., Roberts, R. J. Multiple splicing factors are released from endogenous complexes during in vitro pre-mRNA splicing. Molecular and Cellular Biology. 9, 5273-5280 (1989).
- Dery, K. J., Yean, S. L., Lin, R. J. Assembly and glycerol gradient isolation of yeast spliceosomes containing transcribed or synthetic U6 snRNA. Methods in Molecular Biology. 488, 41-63 (2008).
- Yoshimoto, R., Kataoka, N., Okawa, K., Ohno, M. Isolation and characterization of post-splicing lariat-intron complexes. Nucleic Acids Research. 37, 891-902 (2009).
- Malca, H., Shomron, N., Ast, G. The U1 snRNP base pairs with the 5' splice site within a penta-snRNP complex. Molecular and Cellular Biology. 23, 3442-3455 (2003).
- Haudek, K. C., Voss, P. G., Wang, J. L., Patterson, R. J. A 10S galectin-3 - snRNP complex assembles into active spliceosomes. Nucleic Acids Research. 44, 6391-6397 (2016).
- Rappsilber, J., Ryder, U., Lamond, A. I., Mann, M. Large-scale proteomic analysis of the human spliceosome. Genome Research. 12, 1231-1245 (2002).
- Jurica, M. S., Moore, M. J. Capturing splicing complexes to study structure and mechanism. Methods. 28, 336-345 (2002).
- Patterson, R. J., Haudek, K. C., Voss, P. G., Wang, J. L. Examination of the role of galectins in pre-mRNA splicing. Methods in Molecular Biology. 1207, 431-449 (2015).
- Dignam, J. D., Lebovitz, R. M., Roeder, R. G. Accurate transcription initiation by RNA polymerase II in a soluble extract from isolated mammalian nuclei. Nucleic Acids Research. 11, 1475-1489 (1983).
- Agarwal, N., Sun, Q., Wang, S. Y., Wang, J. L. Carbohydrate-binding protein 35. I. Properties of the recombinant polypeptide and the individuality of the domains. Journal of Biological Chemistry. 268, 14932 (1993).
- Zillmann, M., Zapp, M. I., Berget, S. M. Gel electrophoretic isolation of splicing complexes containing U1 small nuclear ribonucleoprotein particles. Molecular and Cellular Biology. 8, 814-821 (1988).
- Barondes, S. H., et al. Galectins: a family of animal β-galactoside-binding proteins. Cell. 76, 597-598 (1994).
- Laing, J. G., Wang, J. L. Identification of carbohydrate binding protein 35 in heterogeneous nuclear ribonucleoprotein complex. Biochemistry. 27, 5329-5334 (1988).
- Vyakarnam, A., Lenneman, A. J., Lakkides, K. M., Patterson, R. J., Wang, J. L. A comparative nuclear localization study of galectin-1 with other splicing components. Experimental Cell Research. 242, 419-428 (1998).
- Michaud, S., Reed, R. An ATP-independent complex commits pre-mRNA to the mammalian spliceosome assembly pathway. Genes & Development. 5, 2534-2546 (1991).
- Chiu, Y. -. F., et al. Cwc25 is a novel splicing factor required after Prp2 and Yju2 to facilitate the first catalytic reaction. Molecular and Cellular Biology. 29, 5671-5678 (2009).
- Krishnan, R., et al. Biased Brownian ratcheting leads to pre-mRNA remodeling and capture prior to first-step splicing. Nature Structural and Molecular Biology. 20, 1450-1457 (2013).
- Gray, R. M., et al. Distinct effects on splicing of two monoclonal antibodies directed against the amino-terminal domain of galectin-3. Archives of Biochemistry and Biophysics. 475, 100-108 (2008).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved