Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Boncuklar Üzerinde Galectin-3 - U1 snRNP Kompleksi ile Birleştirme Etkinliğinin Tamamlayıcısı
Bu Makalede
Özet
Bu makalede, (a) U1 snRNP'nin nükleer özlerden tükenmesi ve eşlik eden birleştirme aktivitesi kaybı ile ilgili deneysel prosedürler açıklanmaktadır; ve (b) U1-tükenmiş ekstrakttaki birleştirme aktivitesinin galektin-3 - Boncuklara bağlı U1 snRNP parçacıklarının anti-galektin-3 antikorları ile kovalent olarak birleştiğinde yeniden kavrar.
Özet
Klasik tükenme-rekonsyon deneyleri galectin-3'ün nükleer özlerde gerekli bir birleştirme faktörü olduğunu göstermektedir. Galectin-3'ün birleştirme yoluna dahil etme mekanizması bu makalede ele alınmıştır. HeLa hücreli nükleer özlerin %12-%32 gliserol gradyanları üzerindeki tortulasyonu, galektin-3 ve U1 snRNP içeren endojen ~10S parçacıkta zenginleştirilmiş fraksiyonlar verir. Şimdi U1 snRNP'nin nükleer özlerini birlikte birleştirme aktivitesi kaybıyla tükenmek için bir protokol açıklıyoruz. U1-tükenmiş ekstrakttaki birleştirme aktivitesi, anti-galektin-3 antikorları ile kovalent olarak birleştirilen agarose boncuklar üzerinde sıkışmış galectin-3 - U1 snRNP parçacığı tarafından yeniden inşa edilebilir. Sonuçlar, galectin-3 - U1 snRNP - pre-mRNA üçlü kompleksinin ara ürünlere ve birleştirme reaksiyonu ürünlerine yol açan işlevsel bir E kompleksi olduğunu ve galectin-3'ün U1 snRNP ile ilişkisi boyunca birleştirme yoluna girdiğini göstermektedir. Belirli bir birleştirme faktörünün tükendiğini ayıklayan özlerde birleştirme aktivitesini yeniden inşa etmek için boncuklar üzerinde seçilen kompleks benzeşimi veya immün olarak seçilen şema genellikle diğer sistemler için geçerli olabilir.
Giriş
Çoğu ökaryotik haberci RNA'larının (mRNA' lar) üretimi, mRNA öncesi birleştirme1 olarak adlandırdığı nükleer bir süreçte intronların kaldırılmasını ve eksonların ligasyonunu içerir. İki sınıf RNA-protein kompleksi (RNP), haberci öncesi RNA'nın işlenmesini spliceosomal kompleksler aracılığıyla olgun mRNA'ya yönlendiriyor. Bir sınıf, nascent pre-messenger RNPs, heterojen nükleer RNP proteinlerinin ve SR ailesinin bazı üyeleri de dahil olmak üzere diğer RNA bağlayıcı proteinlerin bağlanmasıyla eş transkripsiyonal olarak oluşturulur ve hnRNP kompleksleri verir2. İkinci sınıf, urasil bakımından zengin küçük nükleer RNP'ler (U1, U2, U4, U5 ve U6 snRNA'ları olan U snRNP'ler) U spesifik ve çekirdek proteinlerle ilişkilidir3,4. U snRNP'ler, intronlar eksize edildikçe ve exonlar olgun mRNPs5 üretmek için bağlandıkça dinamik bir yeniden şekillendirme yolunda haberci öncesi RNP'lerin belirli bölgeleriyle düzenli bir şekilde etkileşime girer. Bu işleme etkinliklerine birçok ek nükleer protein katılır6.
Galectin-1 (Gal1) ve galectin-3 (Gal3), tükenme-rekonsepsiyon çalışmalarında gösterildiği gibi birleştirme yolunda gerekli faktörler olan iki proteindir7,8. Her iki galektin de yetkin nükleer özlerin (NE) bir araya getirilmesi, spliceosome montajını ve birleştirme aktivitesini erken bir adımda ortadan kaldırır. Böyle iki kat tükenmiş bir NE'ye galektin eklenmesi her iki aktiviteyi de geri yükler. Gal1 ve Gal3, gal1 veya Gal39'a özgü antiserum tarafından pre-mRNA, birleştirme araları ve olgun mRNA'nın spesifik immün önkupitasyonu ile kanıtlanan aktif spliceosomes bileşenleridir. Daha da önemlisi, Gal3 anti-Gal3 antisera10 tarafından snRNP'lerin çökeltme gösterdiği gibi, birleştirme yolunun dışındaki NE'de parçacıklar içeren endojen U snRNA ile ilişkilidir. Son olarak, Gal3'ün HeLa hücrelerinde susturrulma, çok sayıda genin birleştirme kalıplarını değiştirir11.
Önceden biçimlendirilmiş spliceosomes12'yi sökmek için önceden inkübe edilen NE'de, snRNP'ler 7S'ten 60S'den büyük gliserol gradyanlarında çökelen birden fazla komplekste bulunur. Gliserol gradyan fraksiyonasyonu spliceosomal komplekslerin ve bileşenlerin izolasyonu için yaygın bir teknik olmasına rağmen (örneğin referanslar13,14,15), antikor immün önkupektasyonları kullanarak belirli fraksiyonları karakterize ederek bu yöntemi genişlettik. 10S'te çökeltici bir snRNP, Gal3 ile birlikte yalnızca U1 snRNA içerir. Gal3 veya U1 snRNP'ye özgü antisera ile 10S fraksiyonunun immünopipitasyonu, U1 SnRNP monopartiküllerinin bazılarının Gal310'a bağlı olduğunu gösteren hem U1 hem de Gal3'ü hızlandırır. U1 snRNP, spliceosomal derleme1,5'te mRNP öncesine bağlanan ilk kompleks olduğundan, bu adım Gal3 için birleştirme yoluna olası bir giriş alanını temsil eder. Bu temelde, boncuk içeren anti-Gal3'e bağlı 10S Gal3-U1 snRNP monopartiküllerinin, bir U1 snRNP tükenmiş NE'ye birleştirme aktivitesini geri yüklediğini ve bu kompleksi Gal3'ün spliceosomal yola alındığı bir mekanizma olarak kurduğunu gösterdik16. Bu, spliceosomes'ı birleştirme reaksiyonunda belirli aşamalarda izole etme ve ilişkili faktörleri kataloglama girişimleriyle tezat oluşturur17,18. Bu tür çalışmalarda, belirli faktörlerin bir zaman noktasında varlığı tespit edilir, ancak yüklendikleri mekanizma tespit edilir.
Daha önce NE'nin hazırlanmasını, birleştirme alt tabakasını, birleştirme reaksiyon karışımının montajını ve galektinlerin mRNA öncesi birleştirmedeki rolünü belgelememizde ürünlerin analizini ayrıntılı olarak anlatmıştık19. Gal3 - U1 snRNP kompleksinde zenginleştirilmiş bir fraksiyon elde etmek ve U1 tükenmiş bir nükleer özünde birleştirme aktivitesini yeniden inşa etmek için ikinci kompleksin immün seçimi için nükleer özlerin fraksiyonasyonu için deneysel prosedürleri açıklıyoruz.
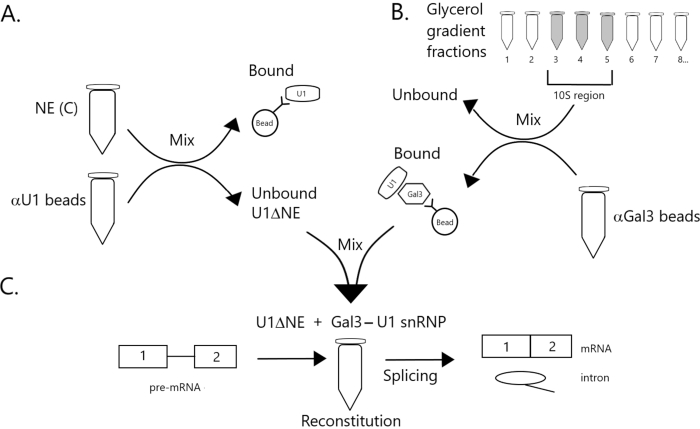
Şekil 1: U1 snRNP'nin yontma nükleer ekstresindeki birleştirme aktivitesinin boncuklar üzerinde bir Gal3-U1 snRNP kompleksi tarafından tamamlanacağını gösteren şematik diyagram. (A) Tampon C'deki NE (NE(C)), protein A-Sepharose boncukları ile kovalent olarak anti-U1 snRNP (αU1 boncuklar) ile birleştirilmiş olarak inkübe edilir. İlişkisiz kesir U1 snRNP (U1ΔNE) tükendi. (B) Tampon D'deki NE (NE(D)), ultrasantrifüjleme ile %12-%32 gliserol gradyanı üzerinden kesirlenmiştir. 10S bölgesine karşılık gelen fraksiyonlar (fraksiyonlar 3-5) birleştirilir ve anti-Gal3 antikorları (αGal3 boncuklar) ile birlikte yaygın olarak boncuklarla karıştırılır. Boncuklara bağlı malzeme bir Gal3-U1 snRNP monopartikül içerir. (C) Parça (B)'den Gal3-U1 snRNP kompleksi, 32P etiketli MINX pre-mRNA substratı kullanılarak bir birleştirme testinde Parçadan (A) U1ΔNE ile karıştırılır ve birleştirme reaksiyonunun ara maddeleri ve ürünleri jel elektroforezi ve otoradyografi ile analiz edilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Protokol
1. Genel prosedürlerle ilgili notlar
- Tüm kimyasalların (tampon bileşenleri, enzimler vb.) ribonikülazdan (RNaz) arındırılmış olduğundan emin olun. Sequester, genel laboratuvar kullanımından ticari olarak satın alınan reaktif şişelerin tümü. Deneysel prosedürün tüm adımları için eldiven giyin. Yalnızca pişirilmiş cam eşyalar ve mutfak eşyaları kullanın (aşağıdaki adım 1.2'ye bakın) ve önceden işlenmiş çözümleri kullanın (aşağıdaki adım 1.3'e bakın).
- Tüm cam eşyaları (beherler, şişeler, şişeler, pipetler vb.) 177 °C'de en az 4 saat pişirin. Aynı koşullarda pişirmeden önce diğer mutfak eşyaları (spatulalar, karıştırma çubukları vb.) alüminyum folyoya sarın.
- Çift damıtılmış suda (ddH2O) %0,1 (vol/vol) dietilptirokarbonat (DEPC) çözeltisi hazırlayın. Manyetik bir karıştırma çubuğu kullanarak, bu çözeltiyi gece boyunca karıştırın ve ardından otoklav. Tris içeren tüm çözümleri yapmak için bu DEPC işlemli H2O'yu kullanın; ardından, bir şişe üstü vakum filtresi kullanarak sterilize edin. Diğer tüm çözümleri hazırlamak için normal ddH2O kullanın (Tris olmadan); ardından DEPC (%0,1, vol/vol) ve otoklav ile tedavi edin.
NOT: Aşağıdaki deneysel yordamlar kümesinde kullanılan arabellekler Tablo 1'de alfabetik olarak listelenmiştir.
| Arabellek adı | Kompozisyon |
| Borat arabelleği | 0.2 M sodyum borat, pH 9 |
| Arabellek C | 20 mM HEPES, pH 7.9, %25 (vol/vol) gliserol, 0.42 M NaCl, 1.5 mM MgCl2, 0.2 mM EDTA, 0.5 mM fenililensülfonil florür (PMSF), 0.5 mM dithiothreitol (DTT) |
| Arabellek D | 10 mM HEPES, pH 7.9, %20 (vol/vol) gliserol, 0.1 M KCl, 0.2 mM EDTA, 0.5 mM PMSF, 0.5 mM DTT |
| 60%D | %60 Tampon D ve %40 H2O |
| Etanolamin | 0.2 M etanolamin, pH 8 |
| HEPES bağlama arabelleği | 20 mM HEPES, pH 7.9 |
| HEPES yıkama tamponu | 20 mM HEPES, pH 7.9, 0.5 M NaCl |
| RNA yükleme arabelleği | %90 formamid, 20 mM EDTA, pH 8, %0,05 (w/v) bromofenol mavisi |
| SDS-PAGE arabelleği | 25 mM Tris, 169 mM glisin, %0,1 sodyum dodecyl sülfat (SDS), pH 8,8 |
| SDS örnek arabelleği | 62,5 mM Tris, pH 6,8, %2 SDS, %10 gliserol, %5 2-mercaptoethanol, %0,1 (w/v) bromofenol mavisi |
| RNA jelleri için TBE tamponu | 89 mM Tris, 89 mM borik asit, 2,5 mM EDTA, pH 8,3 |
| TE arabelleği | 10 mM Tris, pH 8, 1 mM EDTA |
| Aktarım arabelleği | 25 mM Tris, 1.92 M glisin, %20 metanol, pH 8.3 |
| T-TBS arabelleği | 10 mM Tris, 0,5 M NaCl, %0,05 Ara 20, pH 7,5 |
| TX yıkama tamponu | %60 D'de %0,05 Triton X-100 (TX) |
Tablo 1: Arabelleklerin Adı ve Bileşimi
2. U1 snRNP'nin (U1 ΔNE) tükenen NE'nin hazırlanması
- İmmünadsorpsiyon için anti-U1 boncuklarının hazırlanması
- Yaklaşık 200 μL şişmiş boncuk üretmek ve daha sonra HEPES yıkama tamponunda yıkamak için aşırı DEPC ile işlenmiş H2O'da 50 mg Protein A-Sepharose CL-4B boncukları önceden şişirin.
- Bu yıkama ve sonraki tüm yıkamalar için, boncukları santrifüjleme ile peletin (10-15 s için 4 °C'de sallanan bir kova rotorunda 1.000 x g ) ve bir mikroppetör kullanarak ilişkisiz yıkamayı çıkarın ve atın.
- U1 snRNP'ye özgü 150 μL insan otoimmün serumu ile 150 μL yıkanmış boncuk karıştırın (1:1 oranında boncuk hacmine karşı antikor hacmi).
- Yukarıdaki adım 2.1.3'ten toplam hacme (~300 μL) dayanarak, karışımı HEPES bağlama tamponunun koşullarına karşılık gelen 20 mM HEPES, pH 7.9'a ayarlayın; bu karışımı oda sıcaklığında 60 dakika boyunca sürekli sallayarak kuluçkaya yatır.
- Antikorlarla bağlanmış boncukları 1 mL borat tamponu (0,2 M sodyum borat, pH 9) ile yıkayın ve aynı borat tamponunun 1 mL'sinde yeniden biriktirin.
- Protein A-Sepharose boncuklarına bağlı antikoru birlikte bir çift etmek için, 20 mM'lik son konsantrasyona dimetilpimelimidate ekleyin ve oda sıcaklığında 60 dakika sallanarak kuluçkaya yatın.
- Boncukları 1 mL borat tamponu ile yıkayın.
- Herhangi bir tepkisiz çapraz bağlama reaktifini engellemek için 1 mL 0,2 M etanolamin (pH 8) ekleyin ve oda sıcaklığında 60 dakika sallanarak kuluçkaya yatırın.
- Antikor bağlantılı boncukları, bundan sonra anti-U1 boncukları olarak belirlenmiş, iki kez 0,5 mL TX yıkama tamponu (%60 D'de 0,05% Triton X-100) ile yıkayın.
- U1 snRNP'nin NE'den tükenmesi (bkz. Şekil 1A)
NOT: HeLa hücrelerinden NE hazırlama prosedürü başlangıçta Dignam ve ark.20 tarafından geliştirilmiştir. Tahlilleri birekleme için NE'nin hazırlanması için malzemeleri ve ayrıntılı yöntemleri tanımladık19 (bu referansın 2.1 ve 3.1. adımlarına bakın). NE, başlangıçta hazırlandığı gibi C Tamponundadır ve bundan sonra NE(C) olarak atanacaktır. D Tamponu'nun karşı çapraz olarak adlandırılmış ve dengelenmiş NE(C) ne(D) olarak belirlenecektir.- Yukarıdaki adım 2.1.9'dan 100 μL anti-U1 boncuk ile 200 μL NE(C) kuluçkaya yatırın.
- Karışıma 5 μL RNasin ekleyin.
- Mikrotüpleri 4 °C'de 1 saat boyunca kuyruk üzerinde döndürün.
- Karışımı santrifüjleme ile peletleyin (10-15 s için 4 °C'de sallanan bir kova rotorunda 1.000 x g ) ve bir Hamilton şırınnası kullanarak ilişkisiz malzemeyi (U1ΔNE) toplayın.
- Orijinal unndepleted NE(C) ayrı bir 50 μL aliquot ile birlikte, bir mikrodiyalyzerin ayrı bölmelerinde, karıştırarak, 8 K moleküler ağırlık kesmeli bir diyaliz zarı kullanarak% 60 D'ye karşı 75 dakika boyunca tüm U1ΔNE hacmini dialyze edin.
- Diyalizden hemen sonra, bu preparatları (%60 D'de U1ΔNE ve NE) 20 μL aliquots'a bölün; daha sonra kuru bir buz / etanol banyosunda dondurun ve -80 ° C'de saklayın.
- U1ΔNE ve anti-U1 boncuklarına bağlı malzemenin RNA ve protein içeriğinin analizi
- İlişkisiz malzemenin (U1ΔNE) çıkarılmasından sonra (adım 2.2.4), 0,5 mL TX yıkama tamponu ekleyerek anti-U1 boncuklarına bağlı malzemeyi yıkayın. Karışımı santrifüjleme ile peletleyin (10-15 s için 4 °C'de sallanan bir kova rotorunda 1.000 x g ) ve bir mikroppetör kullanarak süpernatantı çıkarın ve atın.
- Yıkama adımları 2.3.1'i iki kez tekrarlayın.
- Boncukların 100 μL'sine 100 μL 2x SDS numune tamponu ekleyerek ve oda sıcaklığında 10 dakika kuluçkaya yatırarak anti-U1 boncuklarına bağlı malzemeyi çıkarın.
- Karışımı santrifüjleme ile peletleyin (10-15 s için 4 °C'de sallanan bir kova rotorunda 1.000 x g ); Hamilton şırınd tarafından süpernatantı çıkarın ve kuru bir buz / etanol banyosunda dondurun. -80 °C'de saklayın.
- Tükenmemiş NE' yi, tükenmiş NE'yi (U1ΔNE) ve boncuklara bağlı malzemeyi karşılaştırın (yukarıdaki 2.3.3 ve 2.3.4 adımlarında açıklandığı gibi SDS örnek arabelleği tarafından boncuklardan çıkarılır). RNA analizi için 2.3.6-2.3.8 adımlarını veya protein analizi için 2.3.9-2.3.10 adımlarını izleyin.
- Her örnek için, 200 μL fenol-kloroform (50:50, v / v) ile RNA'yı çıkarın; daha sonra 180 μL kloroform-izoamil alkol (25:1, v/v) ile tekrar ayıklayın. Ekstraksiyondan sonra, 300 μL soğuk 200 geçirmez etanol ekleyin, karıştırmak için ters çevirin ve çökemiş RNA'yı bir gecede -20 ° C'de saklayın.
- Etanol çökemiş RNA'yı santrifüjle (4 °C'de 10 dakika boyunca 12.000 x g ). Peletleri 150 μL soğuk% 70 etanol ile yıkayın. 15 dakika boyunca 4 °C'de tekrar santrifüj (12.000 x g). Bir mikroppetör kullanarak süpernatantı çıkarın ve peletleri ısı olmadan 10-15 dakika boyunca bir hız vac'ında kurutun.
- Kurutulmuş RNA peletini 10 μL RNA yükleme tamponunda, hafifçe girdapta, 90 s için 75-85 °C'ye ısıtın ve ardından 2 dakika boyunca buzda kuluçkaya yayalım. SnRNA'ları jel elektroforezi (16 mA'da 2 saat) ile % 13 poliakrilamid - 8,3 M üre jelleri ile ayırın ve ardından ethidyum bromür ile lekelenin veya kuzey şişkinliğe maruz kalma10,16.
- Protein örneklerini, adım 2.3.5'ten SDS numune tamponunda, SDS-PAGE (sodyum dodecyl sülfat poliakrilamid jel elektroforezi) tamponunda yaklaşık 45-50 dakika boyunca 200 V'ta% 12.5 poliakrilamid jellere ve elektrofora yükleyin.
- Ayrılan proteinleri transfer tamponunda 2 saat boyunca 400 mA'da nitroselüloz membranlara aktarın. Transferden sonra, %10 yağsız kuru süt içeren T-TBS'de gece boyunca kuluçkaya yatırarak zarı tıkayın. Daha sonra, belirli proteinleri ortaya çıkarmak için membranı immünoblot 8,21.
3. Gliserol gradyanlarının 10S fraksiyonlarının anti-Gal3 tarafından immün önksezisi
- İmmünadsorpsiyon için anti-Gal3 boncuklarının hazırlanması
NOT: Tavşan çok kutuplı antiseranın Gal3'e karşı tavşan #2421 ve tavşan #4910 için türetmesi ve karakterizasyonu daha önce tanımlanmıştır.- Kontrol olarak 49 numaralı tavşandan preimmün serum kullanın.
- Anti-Gal3 boncuklarının hazırlanması için, anti-U1 boncuklarının hazırlanması için daha önce açıklanan prosedürü izleyin (adım 2.1), adım 2.1.3'e karşılık gelen istisna dışında, antiserumun (örneğin, Gal3 karşıtı, #49) boncuklara oranı 3:1'dir.
- Kullanmadan hemen önce, antikor bağlantılı boncukları yıkayın, bundan sonra anti-Gal3 boncukları olarak belirlenmiş, iki kez 0,5 mL TX yıkama tamponu ile yıkayın. Sıvının çoğunu çıkarmak için önce bir mikroppetörle ve sonra sıvıyı boncuklardan çıkarmak için bir Hamilton şırıngasıyla süpernatant çıkarın; atmak.
- Anti-Gal3 ile gliserol gradyan fraksiyonlarının immünprecipitaton 'u (bkz. Şekil 1B)
- %12-%32 gliserol gradyan10 üzerinde fraksiyone NE(D). Degradenin 10S bölgesine yakın olan gliserol gradyan kesirleri 3, 4 ve 5'i (degradenin üstünden numaralı) birleştirin ve karıştırın.
- Her biri 3-5 (adım 3.2.1) kombine degrade fraksiyonlarının 150 μL aliquot'u olan iki örnek hazırlayın ve 50 μL anti-Gal3 boncuklarına yerleştirin.
- Buna paralel olarak, her biri 150 μL kesir 1 (Gal3 içeren U1 snRNP10 ile karmaşık değil; adım 3.2.1) ile iki örnek hazırlayın ve 50 μL anti-Gal3 boncuklarına yerleştirin.
- Kontrol olarak, 50 μL anti-Gal3 boncuklardan oluşan başka bir mikrotüpe% 60 D'nin 150 μL'sini yerleştirin.
- Tüpe dokunarak hafifçe karıştırın, ardından mikrotüp başını 4°C'de 1 saat boyunca kuyruk üzerinde döndürün.
- Karışımı hafif santrifüjleme ile peletleyin (10-15 s için 4 °C'de sallanan bir kova rotorunda 1.000 x g ).
- Bir Hamilton şırınnası kullanarak süpernatant (ilişkisiz malzeme) çıkarın. Boncukları yıkamayın ve birleştirme reaksiyonlarının eklenmesi için hemen kullanın (bölüm 4.2).
- 10S gradyan fraksiyonlarının Anti-Gal3 çökeltmesinden gelen ilişkisiz ve bağlı malzemedeki RNA ve protein içeriğinin analizi
- 10S gradyan fraksiyonlarının Anti-Gal3 çökeltmelerinden bağlı ve ilişkisiz malzeme bileşenlerinin analizi için, ilişkisiz malzemeyi toplayın (adım 3.2.6'dan sonra süpernatant), taze bir mikrotüp içine aktarın ve -20 °C'de dondurun.
- Çökemiş boncukları adım 3.2.6'dan (Anti-Gal3'e bağlı malzeme içeren) 0,5 mL TX yıkama tamponu ekleyerek yıkayın.
- Karışımı hafif santrifüjleme ile peletleyin (10-15 s için 4 °C'de sallanan bir kova rotorunda 1.000 x g ); bir mikroppettor kullanarak üstnatant çıkarın ve atın. Yıkama adımlarını iki kez daha tekrarlayın.
- Yıkanmış ve peletlenmiş Anti-Gal3 boncuklarına 50 μL 2X SDS numune tamponu ekleyin.
- Boncukları hafifçe karıştırın ve oda sıcaklığında 10 dakika kuluçkaya yatırın.
- Karışımı hafif santrifüjleme ile peletleyin (10-15 s için 4 °C'de sallanan bir kova rotorunda 1.000 x g ), Hamilton şırıngası tarafından süpernatantı toplayın ve -20 °C'de taze bir mikrotüpte saklayın.
- 2.3.6 adımlarında açıklandığı prosedürleri kullanarak, Gal3 karşıtı yağışın ilişkisiz malzemesini (bölüm 3.3.1) ve bağlı malzemesini (adım 3.3.6) RNA ve protein bileşenleri açısından karşılaştırın. sırasıyla 2.3.10'a kadar.
4. Birleştirme reaksiyonunun montajı ve ürünlerin analizi
- Birleştirme substratının hazırlanması
NOT: MINX olarak belirlenen pre-mRNA substratı, Adenovirus22'den iki ekson dizisi ve bir intron dizisi içerir. Plazmiddeki MINX DNA dizisi T3, T7 veya SP6 RNA polimeraz promotörlerinin kontrolü altındadır. MinX plazmid DNA'sının BamHI kısıtlama endonucleaz ile doğrusallaştırılması, sp6 RNA polimeraz tarafından α-32P[GTP] varlığında transkripsiyonu ve 32P etiketli MINX'in testlerin birleştirilmesi için saflaştırılması için malzemeler ve ayrıntılı yöntemler daha önce açıklanmıştır19 (bkz. adım 2.2 ve 3.2 bu başvurunun 2.2 ve 3.2).- Radyolabelli MINX'i -20 °C'de etanol çökeltici olarak saklayın; transkripsiyondan sonraki 4-6 hafta içinde etiketli birleştirme alt tabakasını kullanın.
- Kullanımdan hemen önce, etanol çökemiş 32P etiketli MINX'i 12.000 x g'da 4 °C'de 10 dakika boyunca santrifüj edin; bir mikroppettor ile süpernatant çıkarın ve atın.
- 4 °C'de 15 dakika boyunca 12.000 x g'da 150 μL%70 etanol ve santrifüj ekleyin. Süpernatantı atın ve peletin 15 dakika boyunca ısı olmadan hız vac'ında kurutun.
- Peletin suyunu 50 μL DEPC suda yeniden sulayın. İki GF/C filtresinin her birinde Nokta 2 μL; filtreleri 10 dakika boyunca soğuk% 5 trikloroasetik aside (TCA) daldırın. Soğuk% 5 TCA ile durulayın, ardından vakum şişesinde 180 geçirmez etanol. Filtreleri havayla kurulayın ve 4 mL Safety-Solve'da scintillation sayımına tabidir.
- Birleştirme tahlili için 32P etiketli MINX'i %60 D ila 104 cpm/μL olarak seyreltin.
- Birleştirme reaksiyonunun montajı (bkz. Şekil 1C)
- Toplam 24 μL (8 μL U1ΔNE (adım 2.2.6'dan itibaren), 3.5 mM MgCl2 , 1,5 mM ATP, 20 mM kreatin fosfat, 0,5 mM DTT, 20 birim RNasin, 4 μL 32P etiketli MINX birleştirme substratı (104 cpm/μL), %60 D) ve bölüm 3,2,7'den her boncuk tüpüne ekleyin. Toplam 24 μL hacimde, ancak U1ΔNE olmadan aynı birleştirme reaksiyonları kümesini birleştirin ve adım 3.2.7'den itibaren her boncuk tüpüne ekleyin.
- 12 μL toplam hacimde (4 μL NE(D), 3,5 mM MgCl2'de bir kontrol birleştirme reaksiyonu hazırlayın, 1,5 mM ATP, 20 mM kreatin fosfat, 0,5 mM DTT, 20 birim RNasin, 2 μL 32P etiketli MINX birleştirme substratı (104 cpm/μL), %60 D).
- 30°C'de 90 dk boyunca kuyruk ucuna dokunarak tüpleri hafifçe karıştırın ve döndürün. Karışımı 10-15 s için 4 °C'de sallanan bir kova rotorunda 1.000 x g'da hafif santrifüjleme ile peletleyin.
- Reaksiyonu durdurun ve boncuk içeren tüplere 24 μL 2x SDS numune tamponu ve NE içeren ancak boncuk içermeyen kontrol tüpüne 12 μL 2x SDS numune tamponu ekleyerek proteinleri boncuklardan ayıklayın. Tüpleri 100 °C'de 7 dakika ısıtın.
- Tüpleri 10-15 sn için 4 °C'de sallanan bir kova rotorunda 1.000 x g'da hafifçe santrifüj edin.
- Süpernatantları (elutionları) taze mikrotüplere aktarın: boncuk tüplerinden yaklaşık 48 μL ve NE kontrol tüpünden 24 μL.
- Proteinleri sindirmek ve çözünürlüklendirmek için Proteinaz K (20 mg/mL) ekleyin: boncuklardan 48 μL elüsyona 5 μL ekleyin ve 24 μL NE kontrolüne 2,5 μL ekleyin.
- Tüpleri 37°C'de 40 dakika kuluçkaya yatırın.
- Tüpleri 10 sn boyunca 4 °C'de sallanan bir kova rotorunda 1.000 x g'da hafifçe santrifüj edin.
- Boncuk elutionlarını 39,5 μL TE ve 10 μL 3 M sodyum asetat ile seyreltin. NE kontrolünü 63,5 μL TE ve 10 μL 3 M sodyum asetat ile seyreltin.
- RNA'yı aşağıda açıklandığı gibi ayıklayın ve analiz edin (bölüm 4.3).
- Birleştirme reaksiyonunun ürünlerinin analizi
- Her numunedeki RNA'ları fenol-kloroform ile çıkarın, ardından kloroform-izoamil alkol; RNA'ları etanol, santrifüj ile çökeltin, peletleri yıkayın, süpernatantı çıkarın ve 2.3.6 ve 2.3.7 adımlarında açıklandığı gibi aynı prosedürü izleyerek peletleri kurutun.
- Kurutulmuş RNA peletini 10 μL RNA yükleme tamponunda, hafifçe girdapta, 90 s için 75-85 °C'ye ısıtın ve ardından 2 dakika boyunca buzda kuluçkaya yayalım.
- 8,3 M ürede % 13 poliakrilamid (bisacrylamide:akrilamid, 1,9:50 [wt/wt]) içeren bir çözeltinin 20 mL'sini hazırlayın; bu çözeltiyi kullanarak 15 cm uzunluğunda dökme jeller.
- Jel döküldükten sonra, çalışan tampon olarak TBE kullanılarak 20 dakika boyunca 400 V'ta elektrofor (herhangi bir örnek yüklenmeden). Bu adımdan sonra, kuyuları TBE çalışan tamponla yıkayın.
- RNA örneklerini RNA yükleme tamponunda ve elektroforları 3,5 ila 4 saat boyunca 400 V'ta TBE çalışan tamponla yükleyin. Elektroforezden sonra, jeli damıtılmış suya 10 dakika daldırıp döndürerek üreyi çıkarın.
- Jeli 3 M filtre kağıdında vakumla kurutun, önce 80 °C'de 2 saat 15 dakika ve daha sonra yavaşça soğutmak için ısı olmadan 30 dakika boyunca kurutun. Radyoaktif bileşenlerin geçiş konumlarını tespit etmek için kurutulmuş jeli filmdeki otoradyografiye tabi edin.
Sonuçlar
Ne U1 snRNP (Bölüm 2.2.6'dan U1ΔNE) ve Gal3 - Gal3 - U1 snRNP kompleksleri anti-Gal3 (adım 3.2.7) tarafından immünprecipited gliserol gradyan 10S bölgesinden bir birleştirme reaksiyonu karıştırıldı. Bu reaksiyon karışımı U1 snRNA (Şekil 2A, şerit 3) ve U1'e özgü protein U1-70K (Şekil 2B, şerit 3) içeriyordu. Beklendiği gibi, Anti-Gal3 Gal3 çökelme (Şekil 2B, şerit 3). Bu...
Tartışmalar
Bu rapor, Anti-Gal3 kaplı boncuklara sıkışmış bir Gal3 - U1 snRNP kompleksinin mRNA öncesi substrata bağlanabileceğini ve bu üçlü kompleksin bir U1 snRNP tükenmiş NE'ye birleştirme aktivitesini geri getirebileceğini belgeleyen deneysel ayrıntıları sağlar. Gal3, başlangıçta galaktoza özgü karbonhidrat bağlayıcı aktivitesine dayanarak izole edilmiş bir protein ailesinin bir üyesidir23 . Erken immünoresans ve hücre altı fraksiyonasyon çalışmaları Gal3'ün birleşt...
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Bu çalışma National Science Foundation Grant MCB-0092919 ve Michigan State University Intramural Research Grant 09-CDFP-2001 (RJP'ye) ve National Institutes of Health Grant GM-38740 ve Michigan AgBioResearch Project MICL02455 (JLW'ye) tarafından desteklenmiştir.
Birleştirme testlerinde kullanılan MINX pre-mRNA substratı, Dr. Susan Berget'in (Baylor College of Medicine, Houston, TX, ABD) nazik bir hediyesiydi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| anti-U1 snRNP | The Binding Site | Hu ENA-RNP #33471 | human autoimmune serum specific for U1 snRNP |
| bottle top vacuum filter | Fisher Scientific | Corning 431153 (0.22 μm; PES 150 ml) | for filtering solutions containing Tris |
| centrifuge | International Equipment Company | IEC Model PR-6 | for pelletting Sepharose beads in immunoprecipitation |
| diethylpyrocarbonate (DEPC) | Sigma-Aldrich | 159220-5G | for treatment of water used in preparation of all solutions |
| dimethylpimelimidate (DMP) | Sigma-Aldrich | 80490-5G | for cross-linking antibody to Sepharose beads |
| electrophoresis cell | BioRad Laboratories, Inc | Mini-Protean II | for SDS-PAGE separation of proteins |
| ethanolamine | Sigma-Aldrich | 411000-100ml | for blocking after the cross-linking reaction |
| gel electrophoresis system | Hoefer, Inc | HSI SE 500 Series | for separating snRNAs by gel electrophoresis |
| gel slab dryer | BioRad | Model 224 | for drying gel slabs for autoradiography |
| Hybond ECL membrane | GE Healthcare | RPN3032D (0.2 μm; 30 cm x 3 m) | for immunoblotting of proteins on membrane |
| microdialyzer (12 x 100 μl sample capacity) | Pierce | Microdialyzer System 100 | for exchanging the buffer of nuclear extract |
| microdialyzer membranes (8K cutoff) | Pierce | 66310 | for exchanging the buffer of nuclear extract |
| non-fat dry milk | Spartan Stores | Spartan Instant Non-fat Dry Milk | |
| Protein A Sepharose CL-4B | Millipore-Sigma | GE 17-0780-01 | for coupling antibody to beads |
| Proteinase K | Millipore-Sigma | P2308-5mg | for stopping the splicing reaction to isolate the RNAs |
| RNasin | Promega | N2111 | for inhibiting ribonuclease activity |
| rocker/rotator | Lab Industries, Inc | Labquake Shaker 400-110 | for mixing protein solutions in coupling reactions and in immunoprecipitation |
| Safety-Solve | Research Products International Corp. | No. 111177 | scintillation counting cocktail for determination of radioactivity in splicing substrate |
| scintillation counter | Beckman Instruments | LS6000SC | scintillation counter for determination of radioactivity |
| speed vaccum concentrator | Savant | SVC 100H | for drying ethanol-precipitated RNA pellets |
| Transphor electrophoresis unit | Hoefer, Inc | Hoefer TE Series Transphor | for protein transfer from SDS-PAGE to blotting membrane |
Referanslar
- Hoskins, A. A., Moore, M. J. The spliceosome: a flexible, reversible macromolecular machine. Trends In Biochemical Sciences. 37, 179-188 (2012).
- Choi, Y. D., Grabowski, P., Sharp, P. A., Dreyfuss, G. Heterogeneous nuclear ribonucleoproteins: role in RNA splicing. Science. 231, 1534-1539 (1986).
- Lerner, M., Steitz, J. A. Snurps and scyrps. Cell. 25, 298-300 (1981).
- Maniatis, T., Reed, R. The role of small nuclear ribonucleoprotein particles in pre-mRNA splicing. Nature. 325, 673-678 (1987).
- Hoskins, A. A., et al. Ordered and dynamic assembly of single spliceosomes. Science. 331, 1289-1295 (2011).
- Coppin, L., Leclerc, J., Vincent, A., Porchet, N., Pigny, P. Messenger RNA life-cycle in cancer: emerging role of conventional and non-conventional RNA-binding proteins. International Journal of Molecular Sciences. 19, 650-676 (2018).
- Dagher, S. F., Wang, J. L., Patterson, R. J. Identification of galectin-3 as a factor in pre-mRNA splicing. Proceedings of the National Academy of Sciences of the United States of America. 92, 1213-1217 (1995).
- Vyakarnam, A., Dagher, S. F., Wang, J. L., Patterson, R. J. Evidence for a role for galectin-1 in pre-mRNA splicing. Molecular and Cellular Biology. 17, 4730-4737 (1997).
- Wang, W., Park, J. W., Wang, J. L., Patterson, R. J. Immunoprecipitation of spliceosomal RNAs by antisera to galectin-1 and galectin-3. Nucleic Acids Research. 34, 5166-5174 (2006).
- Haudek, K. C., Voss, P. G., Locascio, L. E., Wang, J. L., Patterson, R. J. A mechanism for incorporation of galectin-3 into the spliceosome through its association with U1 snRNP. Biochemistry. 48, 7705-7712 (2009).
- Fritsch, K., et al. Galectin-3 interacts with components of the nuclear ribonucleoprotein complex. BMC Cancer. 16, 502-511 (2016).
- Conway, G. C., Krainer, A. R., Spector, D. L., Roberts, R. J. Multiple splicing factors are released from endogenous complexes during in vitro pre-mRNA splicing. Molecular and Cellular Biology. 9, 5273-5280 (1989).
- Dery, K. J., Yean, S. L., Lin, R. J. Assembly and glycerol gradient isolation of yeast spliceosomes containing transcribed or synthetic U6 snRNA. Methods in Molecular Biology. 488, 41-63 (2008).
- Yoshimoto, R., Kataoka, N., Okawa, K., Ohno, M. Isolation and characterization of post-splicing lariat-intron complexes. Nucleic Acids Research. 37, 891-902 (2009).
- Malca, H., Shomron, N., Ast, G. The U1 snRNP base pairs with the 5' splice site within a penta-snRNP complex. Molecular and Cellular Biology. 23, 3442-3455 (2003).
- Haudek, K. C., Voss, P. G., Wang, J. L., Patterson, R. J. A 10S galectin-3 - snRNP complex assembles into active spliceosomes. Nucleic Acids Research. 44, 6391-6397 (2016).
- Rappsilber, J., Ryder, U., Lamond, A. I., Mann, M. Large-scale proteomic analysis of the human spliceosome. Genome Research. 12, 1231-1245 (2002).
- Jurica, M. S., Moore, M. J. Capturing splicing complexes to study structure and mechanism. Methods. 28, 336-345 (2002).
- Patterson, R. J., Haudek, K. C., Voss, P. G., Wang, J. L. Examination of the role of galectins in pre-mRNA splicing. Methods in Molecular Biology. 1207, 431-449 (2015).
- Dignam, J. D., Lebovitz, R. M., Roeder, R. G. Accurate transcription initiation by RNA polymerase II in a soluble extract from isolated mammalian nuclei. Nucleic Acids Research. 11, 1475-1489 (1983).
- Agarwal, N., Sun, Q., Wang, S. Y., Wang, J. L. Carbohydrate-binding protein 35. I. Properties of the recombinant polypeptide and the individuality of the domains. Journal of Biological Chemistry. 268, 14932 (1993).
- Zillmann, M., Zapp, M. I., Berget, S. M. Gel electrophoretic isolation of splicing complexes containing U1 small nuclear ribonucleoprotein particles. Molecular and Cellular Biology. 8, 814-821 (1988).
- Barondes, S. H., et al. Galectins: a family of animal β-galactoside-binding proteins. Cell. 76, 597-598 (1994).
- Laing, J. G., Wang, J. L. Identification of carbohydrate binding protein 35 in heterogeneous nuclear ribonucleoprotein complex. Biochemistry. 27, 5329-5334 (1988).
- Vyakarnam, A., Lenneman, A. J., Lakkides, K. M., Patterson, R. J., Wang, J. L. A comparative nuclear localization study of galectin-1 with other splicing components. Experimental Cell Research. 242, 419-428 (1998).
- Michaud, S., Reed, R. An ATP-independent complex commits pre-mRNA to the mammalian spliceosome assembly pathway. Genes & Development. 5, 2534-2546 (1991).
- Chiu, Y. -. F., et al. Cwc25 is a novel splicing factor required after Prp2 and Yju2 to facilitate the first catalytic reaction. Molecular and Cellular Biology. 29, 5671-5678 (2009).
- Krishnan, R., et al. Biased Brownian ratcheting leads to pre-mRNA remodeling and capture prior to first-step splicing. Nature Structural and Molecular Biology. 20, 1450-1457 (2013).
- Gray, R. M., et al. Distinct effects on splicing of two monoclonal antibodies directed against the amino-terminal domain of galectin-3. Archives of Biochemistry and Biophysics. 475, 100-108 (2008).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır