A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
عزل خلايا كبد الفئران الأولية مع التحكم في التروية متعدد المعلمات
* These authors contributed equally
In This Article
Summary
يفصل هذا البروتوكول استخدام قسطرة وريدية خاصة ، وأنابيب معقمة موحدة يمكن التخلص منها ، والتحكم في درجة الحرارة تكملها مراقبة في الوقت الفعلي ، ونظام إنذار لإجراء تروية الكولاجيناز المكون من خطوتين لتحسين الاتساق في صلاحية خلايا كبد الفئران الأولية المعزولة وإنتاجيتها ووظائفها.
Abstract
تستخدم خلايا الكبد الأولية على نطاق واسع في البحوث الأساسية حول أمراض الكبد واختبار السمية في المختبر. يعد إجراء تروية الكولاجيناز المكون من خطوتين لعزل خلايا الكبد الأولية تحديا تقنيا ، خاصة في تعليب الوريد البابي. الإجراء عرضة أيضا للتلوث العرضي والاختلافات في ظروف التروية بسبب الصعوبات في تجميع أو تحسين أو صيانة إعداد التروية. هنا ، يتم تقديم بروتوكول مفصل لإجراء محسنة من خطوتين لتروية الكولاجيناز مع التحكم في التروية متعدد المعلمات. تم عزل خلايا كبد الفئران الأولية بنجاح وموثوقية من خلال اتخاذ الاحتياطات التقنية اللازمة في الخطوات الحرجة للإجراء ، وعن طريق الحد من الصعوبة التشغيلية والتخفيف من تباين معلمات التروية من خلال اعتماد قسطرة وريدية خاصة ، وأنابيب معقمة موحدة يمكن التخلص منها ، والتحكم في درجة الحرارة ، ونظام المراقبة والإنذار في الوقت الفعلي. تظهر خلايا كبد الفئران الأولية المعزولة باستمرار قابلية عالية للخلايا (85٪ -95٪) ، والعائد (2-5 × 108 خلايا لكل 200-300 غرام من الفئران) والوظائف (الألبومين واليوريا ونشاط CYP). وقد استكمل هذا الإجراء بنظام متكامل لتروية الدم، وهو مدمج بما يكفي ليتم إعداده في غطاء التدفق الرقائقي لضمان التشغيل المعقم.
Introduction
خلايا الكبد الأولية هي أدوات مهمة للبحوث الأساسية المتعلقة بالكبد ، وعلاج الأمراض ، والتطبيق مثل اختبار المخدرات. المعيار الذهبي الحالي لعزل خلايا الكبد الأولية هو إجراء تروية الكولاجيناز المكون من خطوتين 1،2،3 الذي قدمه Seglen في 1970s4. ومع ذلك ، فإن هذا الإجراء يمثل تحديا تقنيا ولديه معدل فشل مرتفع عند إجرائه من قبل الجراحين المبتدئين. حتى عندما يعتبر التروية ناجحا ، يمكن ملاحظة اختلافات جذرية في صلاحية خلايا الكبد (عادة 60٪ -95٪) والعائد (0.5-5 × 108 لكل 200-300 غرام من الفئران) بين العزلات. وهذا يؤثر على جودة وحجم التجارب النهائية. بصرف النظر عن الإجراء الفني ، فإن إعداد التروية المستخدم في العزل ، سواء كان متاحا تجاريا أو مخصصا ، هو عامل مساهم. يجب إيلاء الاهتمام لتجميع وتحسين وصيانة إعداد التروية. الغرض من هذا البروتوكول هو تحسين معدل النجاح والاستقرار بين عزل خلايا كبد الفئران الأولية من خلال التحكم في التروية متعددة المعلمات للإجراء الفني وإعداد التروية لإجراء تروية الكولاجيناز المكون من خطوتين.
من الجانب التقني ، فإن الخطوة الأكثر صعوبة في الإجراء هي تعليب الوريد البابي. أما بالنسبة للخطوات الأخرى ، إذا لوحظت الممارسة الجيدة وتم اتخاذ الاحتياطات العامة ، يمكن تحسين استقرار العزل. لذلك ، فإن فهم المنطق لكل خطوة مهم حتى يتمكن الجراح من الاستجابة للمتغيرات المختلفة التي قد تحدث أثناء الإجراء.
تم نشر بروتوكولات مختلفة لعزل خلايا الكبد وخلايا الكبد غير المتنية من الفئران والفئران1،2،5،6،7،8،9. كان لإعدادات التروية المستخدمة في هذه البروتوكولات العديد من العيوب ، والتي تشمل إعادة استخدام أنابيب التروية ، ومشاكل في التحكم في درجة الحرارة ، والحاجة إلى التحسين الروتيني لمعلمات التروية ، و / أو استخدام نوع غير مناسب من القسطرة الوريدية (IV) لقنية الوريد البابي. ستزيد إعادة استخدام أنابيب التروية من فرص التلوث ، خاصة إذا لم يتم تنظيف الأنابيب وتطهيرها بشكل صحيح. كما أن إعادة استخدام الأنابيب دون استبدال روتيني سيعرض إعداد التروية لمشاكل مثل الأنابيب أو الموصلات المتسربة ، ومصيدة الفقاعات المسدودة والأنابيب الضيقة ، وكلها ستقلل بشكل كبير من ضغط البيرفوسات ومعدل التدفق ، وبالتالي ، مما يؤثر على كفاءة هضم الكبد. بدون مصدر حرارة ثابت في بعض الإعدادات للتحكم في درجة الحرارة ، سوف تبرد المخازن المؤقتة التي تم تسخينها مسبقا بمرور الوقت ، مما يؤدي إلى انخفاض نشاط الكولاجيناز والهضم. على الرغم من أن الإعدادات الأخرى تستخدم مكثفا زجاجيا مغلفا متصلا بجهاز تدوير المياه لتدفئة المخزن المؤقت ، إلا أنها ضخمة وتتطلب تنظيفا دقيقا. يجب قياس درجة الحرارة والضغط ومعدل تدفق المخزن المؤقت الخارج من القسطرة وتحسينه قبل بدء العزل لضمان حالة تروية مستقرة. حتى بعد التحسين ، لا يزال من الممكن أن تتغير المعلمات في منتصف الطريق أثناء العزل بسبب تصرفات المشغل ، مما يؤدي إلى التروية والهضم دون المستوى الأمثل. معظم أنواع القسطرة الوريدية ليست مناسبة لتعليب الوريد البابي لأنها لا تسمح بالتروية المستمرة أثناء التعليب. إنهم غير قادرين على إبلاغ الجراح على الفور عند نجاح القنية. علاوة على ذلك ، من الصعب تأمين الوريد البابي على القسطرة الناعمة دون تشويهها.
هنا ، نعالج هذه المشكلات باستخدام أنابيب معقمة موحدة يمكن التخلص منها ، وسترة سخان سيليكون للتحكم الدقيق والمستقر في درجة الحرارة ، ونظام المراقبة والإنذار في الوقت الفعلي مع تخزين البيانات وإدارتها واستخدام قسطرة IV خاصة ، والتي تسمح بالتروية المستمرة أثناء ثقب الوريد البابي أثناء التعليب. على حد علمنا ، نحن أول مجموعة تجمع بين كل هذه الميزات في نظام تروية متكامل (IPS) صغير الحجم ، مما يجعله محمولا للغاية وقادرا على وضعه في غطاء تدفق صفحي لضمان التشغيل المعقم.
Protocol
تم تنفيذ جميع الإجراءات وإسكان الحيوانات بموجب البروتوكول رقم R15-0027 و R19-0669 وفقا لمتطلبات اللجنة المؤسسية لرعاية واستخدام الحيوانات (IACUC) التابعة لجامعة سنغافورة الوطنية.
1. إعداد المحاليل والأدوات الجراحية
- قم بإعداد المخازن المؤقتة ووسائط زراعة الخلايا في الجدول 1 باستخدام مياه فائقة النقاء.
- قم بتسخين المخزن المؤقت الخالي من الكالسيوم والكولاجيناز مسبقا إلى 37 درجة مئوية في حمام مائي قبل الاستخدام.
- قم بتعقيم الأدوات الجراحية والمعدات المختبرية التالية: زوج من المقصات الجراحية حادة حادة ، زوج من المقص الجراحي الحاد الحاد ، زوج من المقص الجراحي المنحني ، زوجان من ملقط أنسجة الأسنان ، زوجان من الملقط المنحني ، مشبكان للوريد ، خياطة جراحية حريرية بطول 5 سم 3-0 ، مرشح شبكة نايلون 100 ميكرومتر ، كوب 400 مل ، ومرحلة (رف أنبوب الطرد المركزي العائم).
2. إعداد IPS (انظر الشكل 1)
- امسح غطاء التدفق الرقائقي بنسبة 70٪ من الإيثانول. امسح IPS بنسبة 70٪ من الإيثانول وانقله إلى غطاء التدفق الرقائقي. تعقيم بواسطة الأشعة فوق البنفسجية لمدة >15 دقيقة قبل تشغيل غطاء المحرك.
تحذير: التعرض للأشعة فوق البنفسجية يمكن أن يسبب حروق مؤلمة في العينين والجلد. تأكد من إغلاق الوشاح بالكامل عند تشغيل ضوء الأشعة فوق البنفسجية. - قم بتجميع مجموعة جديدة من الأنابيب التي يمكن التخلص منها على IPS. لف الأنابيب في اتجاه مجرى النهر للمضخة التمعجية في سترة سخان سيليكون. قم بتجميع جهاز مراقبة التروية على الأنابيب في اتجاه مجرى النهر لسترة سخان السيليكون.
- تأكد من أن المشابك الدوارة لكل من مداخل الأنابيب مخففة تماما. قم بتوصيل كل مدخل أنابيب بالطرف المدبب لماصة شفط معقمة سعة 2 مل. اترك كل من ماصات الشفط (المداخل) والقسطرة الوريدية (المخرج) في زجاجة سعة 1 لتر مع مخزن مؤقت خال من الكالسيوم للسماح بإعادة تدوير المخزن المؤقت أثناء خطوات التحضير اللاحقة.
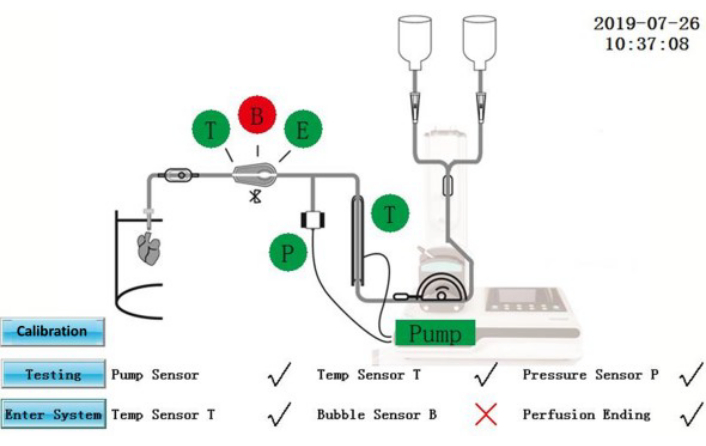
الشكل 2: واجهة الاختبار الذاتي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
- قم بتشغيل IPS. قم بإجراء العمليات التالية على لوحة تحكم الشاشة التي تعمل باللمس. سيقوم البرنامج بإجراء اختبار ذاتي شامل في كل مرة يتم فيها تشغيله.
تنبيه: IPS عبارة عن جهاز كهربائي متصل بمصدر طاقة خارجي. قد تؤدي الانسكابات السائلة على IPS أو كابلات الطاقة إلى مخاطر كهربائية.- تأكد من عرض حالة الاختبار الذاتي على الشاشة (الشكل 2). سيتم عرض المكونات التي اجتازت الاختبار الذاتي باللون الأخضر ؛ سيتم عرض تلك التي فشلت باللون الأحمر. بعد التصحيح، اضغط على أيقونة الاختبار لتكرار الاختبار الذاتي مرة أخرى أو اضغط على أيقونة إدخال النظام للدخول مباشرة إلى واجهة التشغيل.
- انقر في أي مكان على الشاشة لتسجيل الدخول إلى واجهة التشغيل.
- في الزاوية العلوية اليمنى من واجهة التشغيل (الشكل 3)، اضغط على أي من أيقونات الأسهم الدائرية لتعيين اتجاه دوران المضخة التمعجية. في اللوحة اليمنى من الواجهة ، انقر فوق أيقونات الأسهم لأعلى / لأسفل لتعيين قيم للمعلمات المقابلة. اضبط التدفق على وضع التدفق المستمر ؛ درجة حرارة سترة السخان إلى 42 درجة مئوية (يتم تعديلها لضمان الحفاظ على درجة حرارة البيرفوسات عند 37 درجة مئوية) ؛ وسرعة المضخة إلى 38 دورة في الدقيقة لمعدل تدفق ~ 33 مل / دقيقة.
- في اللوحة السفلية اليسرى من واجهة التشغيل، تحقق من حالة إنذار الفقاعة، وتنبيه إيقاف التروية، وأيقونة كتم الصوت.
- تحقق من درجة الحرارة والضغط ومعدل تدفق العطر في اللوحة اليسرى. قم بتعيين الفواصل الزمنية يدويا من خلال النقر على الأسهم لأعلى ولأسفل في أعلى وأسفل الأعمدة. تحقق من البيانات في الوقت الفعلي المعروضة كقيم في منتصف الأعمدة. سيتحول لون العمود من الأخضر إلى الأحمر إذا تحركت البيانات في الوقت الفعلي خارج النطاق المحدد.
- حدد موقع الأيقونات لبدء التروية وإيقافها مؤقتا وإيقافها، والرمز للتبديل من عرض البيانات في الوقت الفعلي إلى وضع المخطط في اللوحة الوسطى. اضغط على أيقونة البدء لبدء التروية وتجهيز الأنابيب بمخزن مؤقت خال من الكالسيوم. سيتم إنشاء سجل جديد. أدخل اسم الملف واسم المستخدم في النافذة المنبثقة (الشكل 4).
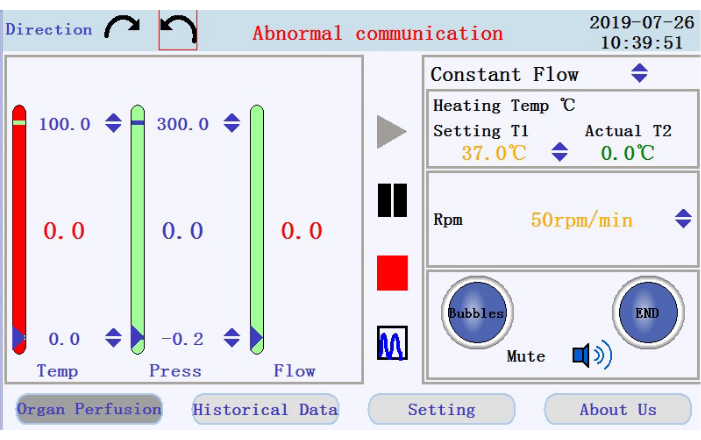
الشكل 3: واجهة التشغيل. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
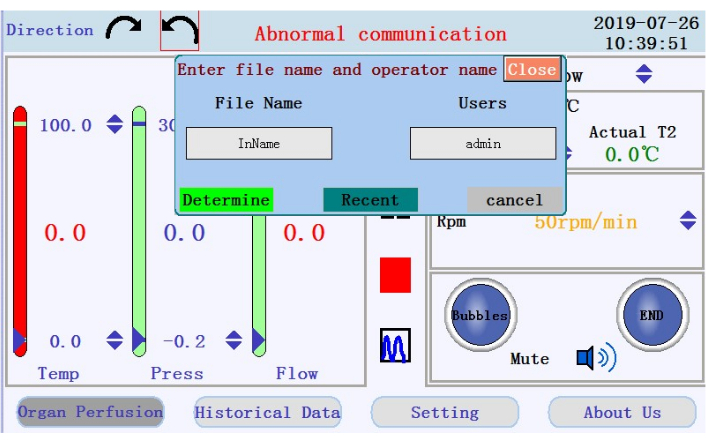
الشكل 4: نافذة منبثقة تطالب باسم الملف واسم المستخدم. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
- املأ غرفة التنقيط إلى نصف ممتلئ. تأكد من عدم وجود جيوب هوائية محاصرة في الأنابيب أثناء التحضير.
- قم بإزالة أي فقاعة تتشكل في اتجاه مجرى مرشح الفقاعة عن طريق النقر على الأنبوب لفصل الفقاعة والسماح بطردها.
ملاحظة: قد تتشكل الفقاعات على طول الأنابيب حيث يتم تسخين المخزن المؤقت بواسطة سترة السخان. - املأ دورقا سعة 400 مل ب 200 مل من الكولاجيناز العازل. ضع المسرح فوق الدورق. دون إدخال أي هواء إلى الأنابيب ، قم بتشديد المشبك الأسطواني بالكامل لأحد مداخل الأنابيب وحرك ماصة الشفط للمدخل إلى الدورق.
3. الإجراء الحيواني
- إعداد الفئران الذكور الشباب البالغين Wistar حوالي 200-300 غرام في وزن الجسم.
ملاحظة: تم تحسين هذا البروتوكول للفئران حوالي 200-300 غرام في وزن الجسم. يفضل ذكور الفئران لأن التغيرات الهرمونية خلال دورة استروس في إناث الفئران ستؤثر على وظيفة خلايا الكبد. - تخدير
- ارسم الحجم المطلوب من الهيبارين المضاد للتخثر (5000 وحدة دولية / مل ؛ 0.2 مل / 100 غرام من وزن الجسم) وكوكتيل تخدير الفئران الكيتامين / الزيلازين (37.5 ملغ / مل كيتامين ، 5 ملغ / مل زيلازين ؛ 0.2 مل / 100 غرام من وزن الجسم) في محاقن 1 مل مع إبرة 27 غرام.
تحذير: التخدير والهيبارين من المواد الضارة. كن حذرا عند التعامل مع الأدوات الحادة. - كبح جماح الفئران. حقن الهيبارين داخل الصفاق متبوعا بكوكتيل الكيتامين / الزيلازين في الربع الأيمن السفلي من البطن.
ملاحظة: لدى caecum احتمال أكبر لوجوده على اليسار. تجنب ثقب الكاكوم أثناء الحقن لتقليل خطر التلوث. - بعد 10 دقائق ، تحقق من عمق التخدير عن طريق تقييم رد فعل الدواسة على قدمي الفئران. استمر في التحقق من وقت لآخر وانتظر حتى لا يستجيب الفئران لقرصات أصابع القدم. يمكن حقن تخدير إضافي ، حسب الضرورة.
- ارسم الحجم المطلوب من الهيبارين المضاد للتخثر (5000 وحدة دولية / مل ؛ 0.2 مل / 100 غرام من وزن الجسم) وكوكتيل تخدير الفئران الكيتامين / الزيلازين (37.5 ملغ / مل كيتامين ، 5 ملغ / مل زيلازين ؛ 0.2 مل / 100 غرام من وزن الجسم) في محاقن 1 مل مع إبرة 27 غرام.
- ضع الفئران في وضع ضعيف مع أطراف ممدودة على منصة البوليسترين المغطاة بورق الألمنيوم أعلى صينية. قم بربط أقدام الفئران وقم بتثبيت الشريط بشكل آمن على المنصة باستخدام إبر 27 G.
- تطهير الصدر والبطن عن طريق رشها وغمرها بنسبة 70٪ من الإيثانول. الحلاقة قبل التطهير اختيارية. ضع الفئران في غطاء محرك السيارة. استمر في الخطوة التالية بينما لا يزال الفراء رطبا.
ملاحظة: الغمر بالإيثانول بنسبة 70٪ يحافظ أيضا على غبار الوبر والفراء إلى الحد الأدنى. - افصل الجلد عن العضلات.
- مع زوج من ملقط أنسجة الأسنان في يد واحدة ، ارفع الجلد بالقرب من قاعدة البطن. مع زوج من المقص الجراحي الحاد الحاد في اليد الأخرى ، قم بقطع جلد الخيام. ادفع الطرف الحاد للمقص تحت الجلد وقم بعمل شق في خط الوسط على الجلد من فوق الساقين الخلفيتين مباشرة إلى أسفل الساقين الأماميتين مباشرة.
- أثناء سحب الجلد وتمديده برفق باستخدام الملقط ، قم بقطع أي نسيج ضام يحمل الجلد على العضلات في الصدر والبطن. لتقليل خطر التلوث ، منع الفراء الفضفاض من السقوط على العضلات. لإزالة الفراء الفضفاض المتراكم على المقص ، امسحه على الجانب الخارجي المطهر من الجلد.
- قم بعمل شقوق جانبية على الجلد ، من خط الوسط إلى جانبي الفئران فوق الساقين الخلفيتين قليلا وأسفل الساقين الأماميتين بقليل. ادفع اللوحات الجلدية إلى الجانبين لفضح العضلات.
- قطع عضلة البطن مفتوحة لفضح الأعضاء.
- مع زوج جديد من ملقط أنسجة الأسنان في يد واحدة ، ارفع العضلات بالقرب من قاعدة البطن. مع زوج من المقص الجراحي الحاد الحاد في اليد الأخرى ، قم بقطع العضلات بعناية دون أن تضرب أي من الأعضاء. قم بعمل شق في خط الوسط على العضلات من أعلى الساقين الخلفيتين قليلا إلى القص.
- قم بعمل شقوق جانبية على العضلات ، من خط الوسط إلى جانبي الفئران فوق الساقين الخلفيتين قليلا وأسفل القفص الصدري مباشرة ، دون أن تضرب أي من الأعضاء. ادفع اللوحات العضلية إلى الجانبين لفضح الأعضاء. تأكد من أن الشقوق الجانبية للجلد والعضلات تصل إلى جانبي الفئران للسماح للدم والمخازن المؤقتة بالتدفق من تجويف البطن في خطوات لاحقة.
- قنية الوريد البابي
- مع الجزء الخلفي من ملقط منحني ، ادفع الأمعاء بلطف إلى اليمين. اقلب فصوص الكبد برفق لأعلى لفضح الوريد البابي.
- استخدم خياطة جراحية حريرية 3-0 لإنشاء رباط فضفاض للغاية حول الوريد البابي بالقرب من الكبد ، قبل فروع الوريد مباشرة إلى اليسار واليمين في فصوص الكبد المختلفة. لا تشد الرباط لتجنب تعطيل تدفق الدم عبر الوريد البابي. يجب اختراق غشاء رقيق جدا أسفل القناة الصفراوية بطرف الملقط المنحني قبل أن يمر الخيط تحته ويدور حول الوريد البابي (والقناة الصفراوية).
- باستخدام أطراف زوجين من الملقط المنحني ، قم بثقب ثقب بعناية عبر الأنسجة الموجودة أسفل الوريد البابي ، دون إتلاف الوريد البابي. افعل ذلك حوالي 2-3 سم في المنبع من الرباط الأول ، قبل أن يتفرع الوريد المعدي مباشرة من الوريد البابي. الأنسجة أرق في هذا الموقع المحدد.
- قم بتمديد الثقب بعناية أكبر باستخدام الملقط. سيسمح هذا الثقب للملقط بدعم الوريد البابي أثناء التعليب.
- قلل من سرعة المضخة إلى 4 دورات في الدقيقة للحصول على معدل تدفق يبلغ ~ 3 مل / دقيقة. تأكد من تقليل تدفق المخزن المؤقت الخالي من الكالسيوم من القسطرة الوريدية إلى تنقيط بطيء.
ملاحظة: تراكم الضغط في الكبد سوف يسبب موت خلايا الكبد. يجب أن يؤدي انخفاض معدل التدفق إلى إبطاء تراكم الضغط في الكبد عند الإدخال الناجح للقنية في الوريد البابي في خطوة لاحقة. - ادعم بلطف الوريد البابي باستخدام الملقط. من ناحية أخرى ، تمسك بالقسطرة الوريدية مع شطبة الإبرة متجهة لأعلى. وجه الإبرة إلى الوريد البابي بزاوية 10-20 درجة وتقدم ببطء حتى يصبح الشطب بأكمله داخل الوريد. بمجرد إدخال الإبرة بشكل صحيح في الوريد البابي ، سيبدأ الكبد في التبييض ويفقد لونه الأحمر الداكن.
ملاحظة: يجب إدخال شطبة الإبرة بالكامل في الوريد لإنشاء ثقب كبير بما يكفي لإدخال الكانيولا. ومع ذلك ، لا تدخل الإبرة بعمق كبير لتجنب ثقب الوريد. - تقدم القنية فوق الإبرة وفي الوريد. ثم ، سحب الإبرة حتى تكون 2-3 مم خلف القنية. يكفي فقط بحيث يكون الطرف الحاد بأمان داخل الكانيولا. استخدم الإبهام والإصبع الأوسط للتمسك بالقسطرة واستخدم السبابة لسحب الجناح إلى الخلف لسحب الإبرة.
- قم بتثبيت الوريد البابي بسرعة على القسطرة باستخدام مشبك الوريد. لا تقم بالتثبيت مباشرة على الفتحة الجانبية للإبرة لتجنب تعطيل تدفق العطريات. بدلا من ذلك ، قص أسفله.
- قطع على الفور الوريد الأجوف السفلي السفلي (IVC) لمنع تراكم الضغط في الكبد. الآن سيتم حجب IVC تحت الراحتي والأوعية الدموية المجاورة بالدم من الوريد البابي. للتأكد من أن IVC قد تم قطعه وقطعه بشكل صحيح ، راقب تدفق الدم في البقول ؛ سوف يتدفق الدم فقط من الأوعية المجاورة.
ملاحظة: إن أخذ وقت طويل جدا لقطع IVC تحت الراحتي بعد القنية أو الفشل في قطعه قبل الانتقال إلى الخطوة التالية سيؤدي إلى موت خلايا الكبد. يتم القتل الرحيم للحيوان تحت التخدير عن طريق الطرد (من خلال قطع IVC) خلال هذه الخطوة. يجب أن يستمر الإجراء أثناء استمرار فقدان الدم. يمكن تأكيد الوفاة من خلال الملاحظة البصرية لتوقف ضربات القلب / التنفس عند فتح تجويف الصدر في خطوة لاحقة. - قم بزيادة سرعة المضخة إلى 38 دورة في الدقيقة للحصول على معدل تدفق يبلغ ~ 33 مل / دقيقة. اغسل الكبد ثلاث مرات عن طريق إغلاق IVC بالملقط لمدة 2-3 ثوان (ولكن ليس لفترة طويلة) وإعادة فتحه.
ملاحظة: أثناء التنظيف ، سوف يتوسع الكبد قليلا قبل العودة إلى طبيعته. التنظيف يسهل نفاذية البيرفوسات في جميع أنحاء الكبد كله. بعد التنظيف ، يجب أن يكون لون الكبد بني فاتح بالكامل. - تأكد من وضع طرف القنية قبل النقطة التي يتفرع فيها الوريد البابي إلى فصوص كبد مختلفة ، لضمان تروية جميع فصوص الكبد. إذا لزم الأمر ، قم بفك وريد البوابة وضبط موضع الكانيولا. أعد القص بعد ذلك.
- شد الرباط الفضفاض حول الوريد البابي ، عند المنبع قليلا من نقطة التفرع. اصنع ثلاث عقد على المكان الذي يتم فيه دعم القنية الناعمة بواسطة إبرة معدنية صلبة ، بين الشطبة والثقب الجانبي. تأكد من أن العقد تثبت القنية في موضعها ، وتثبيتها على الوريد البابي ، ومنع التدفق العكسي للمخازن المؤقتة.
- استئصال الكبد كله سليما.
- قم بدمج الكبد مع مخزن مؤقت خال من الكالسيوم بمعدل تدفق ~ 33 مل / دقيقة لمدة 12 دقيقة التالية (انظر الشكل 5A). في غضون ذلك ، قم بإجراء استئصال الكبد. يمكن تمديد وقت التروية إذا لزم الأمر ولكن تأكد من عدم نفاد المخزن المؤقت الخالي من الكالسيوم.
- باستخدام زوج من المقصات المنحنية ، افصل الوريد البابي بعناية عن الأمعاء عن طريق قطع المساريق الذي يربطهما معا. لا تقم بتنظيف الجهاز الهضمي (المريء والمعدة والأمعاء الدقيقة والغليظة) لضمان عدم حدوث أي تلوث.
ملاحظة: هذا لمنع الوريد البابي من التمزق عند تحريك الكبد أثناء الاستئصال. - فصل الكبد عن الجهاز الهضمي عن طريق قطع الأنسجة الضامة والبنكرياس والمساريق الذي يربط الكبد بالجهاز الهضمي. للفصل ، قم دائما بقص المقص ولا تسحب إلى الدموع. مرة أخرى ، لا أو قطع الجهاز الهضمي.
- اقلب الكبد برفق لأسفل لكشف الحجاب الحاجز. قطع الحجاب الحاجز بعد جدران الأضلاع. تأكد من أن معظم الحجاب الحاجز لا يزال متصلا بالكبد. احرص على عدم كزة أو كدمات الكبد.
- بمجرد فتح تجويف الصدر ، يمكن رؤية قناتين: IVC فوق الكبدي الأبيض على اليسار ، والمريء المصفر على اليمين. قم بقص IVC فوق الكبدي وقطعه فوق المقطع مباشرة. قطع IVC فوق الكبدي اختياري. يمنع تجويف الصدر من الفيضانات.
ملاحظة: راقب بصريا لوقف ضربات القلب / التنفس لتأكيد موت الحيوان. - المريء محاط بالحجاب الحاجز. لعزل المريء عن الحجاب الحاجز ، قم بقطع الحجاب الحاجز من اليمين نحو المريء. قطع أي أنسجة ضامة متبقية تربط المريء والمعدة بالكبد والحجاب الحاجز.
- ادفع الجهاز الهضمي بعيدا إلى اليمين. نقل مشبك الوريد من IVC فوق الكبدي إلى IVC تحت الرهابية. سوف العازلة الآن تنفجر من IVC فوق الكبدي.
ملاحظة: أثناء التروية ، سيتم تغطية القنية و IVC تحت الرهابية بواسطة الكبد. سيساعد التدفق العازل القوي من IVC فوق الكبدي الجراح على استبعاد تسرب التروية. - قطع أي حجاب حاجز متبقي يربط الكبد بتجويف الصدر. قطع الأنسجة التي تربط الكبد بتجويف البطن. احرص على عدم قطع IVC تحت الشبكية فوق المشبك لتجنب فصل المشبك عن الكبد.
- لضمان استئصال الكبد بالكامل ، ارفع الكبد بعناية عن طريق التمسك بالحجاب الحاجز باستخدام الملقط. إذا كان هناك أي أنسجة متبقية تربط الكبد بتجويف البطن ، فقم بقطعها. إذا كانت الكلى والطحال لا يزالان متصلين بالكبد ، فافصلهما.
4. تروية الكبد والهضم
- إذا تم الانتهاء من الاستئصال مبكرا ، فانتظر حتى يتم دمج الكبد مع مخزن مؤقت خال من الكالسيوم لمدة 12 دقيقة.
- تغيير المخزن المؤقت للتروية إلى مخزن كولاجيناز مؤقت. قم بفك المشبك الأسطواني تماما للحصول على مخزن كولاجيناز مؤقت قبل شد المشبك الأسطواني بالكامل للحصول على مخزن مؤقت خال من الكالسيوم (انظر الشكل 5B). بمجرد وصول الكولاجيناز العازل إلى الكبد من خلال الأنابيب ، اغسل الكبد ثلاث مرات عن طريق إغلاق IVC فوق الكبدي لمدة 2-3 ثانية وإعادة فتحه.
- حرك الكبد بعناية إلى المرحلة الموجودة أعلى الكأس لإعادة تدوير الكولاجيناز العازل. حرك الكبد عن طريق التمسك بالحجاب الحاجز باستخدام ملقط مع دعم القسطرة. تجنب السحب على القسطرة لمنع انفصال القسطرة العرضي.
ملاحظة: إذا انفصلت القسطرة وكان الوريد البابي تالفا جدا بحيث لا يمكن إعادة تعبئته، فقم بتعليب IVC فوق الكبدي واسمح للمخزن المؤقت بالخروج من الوريد البابي. تأكد من أن IVC تحت الرحم لا يزال مقطوعا. - هضم الكبد لمدة 12 دقيقة. راقب ظهور بقع / شبكة شفافة حيث يبدأ الكبد في فقدان قوامه البني الناعم. سوف يصبح الكبد أكبر وأكثر ليونة عندما يتم هضمه. بمجرد أن يكون للكبد اتساق طري ، توقف عن التروية. يمكن تمديد وقت الهضم ، إذا لزم الأمر.
ملاحظة: إذا تم كسر كبسولة غليسون، فقد يتحول مخزن الكولاجيناز العازل في الكأس إلى غائم بسبب خلايا الكبد الهاربة.
5. عزل خلايا الكبد
- قم بإزالة القنية بعناية عن طريق قطع الوريد البابي. قم بإزالة المقطع بعناية. انقل الكبد إلى طبق 150 مم يحتوي على 60 مل من وسط النسر المعدل من دولبيكو البارد (DMEM).
- اضغط بلطف على الكبد باستخدام الجانب الخلفي من الملقط المنحني لكسر وتقشير كبسولة غليسون. ثم ، تمايل الكبد بلطف من جانب إلى آخر في DMEM لإطلاق خلايا الكبد. استمر في القيام بذلك حتى يتم فصل خلايا الكبد بالكامل في DMEM.
ملاحظة: في بعض الأحيان يتم هضم الكبد كله أو بعض الفصوص جزئيا فقط. من خلال عدم كشط الكبد الذي سيزيل بالقوة ، ويتلف خلايا الكبد غير المنفصلة ، يمكن الحصول على صلاحية أعلى وأكثر اتساقا للخلايا. - هز بلطف طبق 150 ملم حتى يتم توزيع خلايا الكبد بشكل جيد في DMEM. لإزالة قطع الأنسجة وكتل الخلايا ، صب تعليق الخلية من خلال مرشح شبكة نايلون بحجم 100 ميكرومتر يوضع فوق طبق جديد بحجم 150 مم. شطف الطبق القديم مع 30 مل من DMEM ونقل التعليق إلى مرشح شبكة. اضغط برفق على مرشح الشبكة للسماح لخلايا الكبد المفردة المحاصرة بالمرور.
- قم بإزالة الفلتر الشبكي وقم بهز الطبق الجديد مقاس 150 مم بلطف حتى يتم توزيع خلايا الكبد بشكل جيد. قسم التعليق بالتساوي إلى أنابيب 4 × 50 مل. شطف الطبق مع 30 مل من DMEM وتقسيم التعليق بالتساوي إلى نفس الأنابيب. تأكد من أن كل أنبوب يحتوي على حجم متساو من تعليق الخلايا.
- جهاز طرد مركزي أنابيب 4 × 50 مل من تعليق الخلية عند 50 × غرام لمدة 2 دقيقة عند 4 درجات مئوية. استنشق بعناية supernatant دون إزعاج الكريات فضفاضة. تخلص من السوبرناتانت. أضف 20 مل من DMEM إلى كل أنبوب وهز الأنابيب بلطف لإعادة تعليق حبيبات الخلية. ادمج تعليق الخلية من أربعة أنابيب إلى أنبوبين.
- جهاز طرد مركزي أنابيب 2 × 50 مل عند 20 × جم لمدة دقيقتين عند 4 درجات مئوية. شفط والتخلص من supernatant. أضف 20 مل من DMEM إلى كل أنبوب وهز الأنابيب بلطف لإعادة تعليق حبيبات الخلية. الجمع بين تعليق الخلية من أنبوبين في واحد. حافظ على الخلايا على الجليد حتى الاستخدام.
- تحضير محلول التربان الأزرق عن طريق خلط 400 ميكرولتر من 1x PBS مع 50 ميكرولتر من التربان الأزرق. أضف 50 ميكرولتر من تعليق خلايا الكبد إلى محلول تريبان الأزرق. احسب عدد خلايا الكبد القابلة للحياة والميتة باستخدام مقياس الدم تحت المجهر الضوئي.
6. ثقافة خلايا الكبد
- قم بتنفيذ جميع خطوات زراعة الخلايا في غطاء المحرك. أضف محلول طلاء الكولاجين 1 مل إلى طبق 35 مم واحتضنه لمدة 4 ساعات. شطف الأطباق ثلاث مرات مع 1x PBS.
- تمييع تعليق خلايا الكبد في زراعة خلايا الكبد وسط إلى تركيز 0.8 مليون خلية / مل. أضف 1 مل من تعليق خلايا الكبد المخفف إلى الطبق 35 مم.
ملاحظة: خلايا الكبد حساسة لإجهاد القص أثناء السحب. فكر في استخدام أطراف ماصة واسعة التجويف. - صخرة الطبق لتوزيع خلايا الكبد بالتساوي. احتضان في 37 درجة مئوية ، 5 ٪ CO2 لمدة 3-4 ساعات للسماح لخلايا الكبد بالتعلق.
- لثقافة الشطائر.
- إزالة وسط ثقافة خلايا الكبد. شطف مرة واحدة مع 1 مل من زراعة خلايا الكبد المتوسطة لإزالة الخلايا غير المتصلة. أضف 1 مل من محلول تراكب الكولاجين. أضف محلول تراكب الكولاجين على جدران الطبق لتجنب إدخال فقاعات في المحلول.
- احتضان في 37 درجة مئوية، 5٪ CO2 بين عشية وضحاها للسماح هلام الكولاجين.
- أضف 1 مل من وسط زراعة خلايا الكبد الطازجة. احتضان في 37 درجة مئوية، 5٪ CO2.
- للثقافة أحادية الطبقة.
- بعد الخطوة 6.3 ، قم بإزالة وسط زراعة خلايا الكبد. شطف مرة واحدة مع 1 مل من خلايا الكبد ثقافة الوسط لإزالة الخلايا غير المتصلة.
- أضف 1 مل من وسط زراعة خلايا الكبد الطازجة. احتضان في 37 درجة مئوية، 5٪ CO2.
- تقييم نقاء خلايا الكبد ووظيفتها عن طريق إجراء تلطيخ مناعي للعلامات الخاصة بخلايا الكبد والمقايسات الوظيفية كما هو موضح سابقا10,11.
النتائج
يمكن للجراح معرفة ما إذا كان تروية الكبد تسير بسلاسة من خلال مراقبة النتيجة بعد خطوات معينة. يمكن ملاحظة النتيجة الأولى عند القنية ، وقطع IVC تحت الرهابية ، واستعادة معدل تدفق التروية. يجب أن يكون الكبد قد تغير لونه تماما من الأحمر الداكن إلى البني ، مع الحفاظ على حجمه. إذا كان الكبد يبدو منك?...
Discussion
هناك بعض النقاط التي من المهم بشكل خاص ملاحظتها لإجراء تروية الكولاجيناز المكون من خطوتين بشكل عام. أولا ، يجب إيلاء عناية خاصة عند استئصال الكبد. تأكد من عدم تلف الجهاز الهضمي لأن تسرب المحتويات سيؤدي إلى تلوث بكتيري. بالإضافة إلى ذلك ، تجنب إتلاف كبسولة غليسون ، التي تغطي سطح الكبد أثناء ...
Disclosures
يعلن تشو يان وهانري يو عن مصالح متنافسة لأنهما يمتلكان أسهما في Vasinfuse ، التي تصنع وتسوق نظام التروية المتكامل. يمتلك Hanry Yu أسهما في Histoindex و Invitrocue و Osteopore و Pishon Biomedical و Ants Innovate و Synally Futuristech التي ليس لها مصالح منافسة مع المعلومات الواردة هنا.
Acknowledgements
يتم دعم هذا العمل جزئيا من قبل وزارة التربية والتعليم ARC (MOE2017-T2-1-149) ؛ منحة بذور الابتكار في NUHS 2017 (NUHSRO/2017/051/InnovSeed/02) ؛ معهد علم الأحياء الميكانيكي في سنغافورة (R-714-106-004-135); ومعهد الهندسة الحيوية وتكنولوجيا النانو، مجلس البحوث الطبية الحيوية، وكالة العلوم والتكنولوجيا والبحوث (A*STAR) (أرقام المشاريع IAF-PP H18/01/a0/014، IAF-PP H18/01/a0/K14 و MedCaP-LOA-18-02) تمويل إلى هانري يو. نغ تشان واي هو باحث باحث في جامعة سنغافورة الوطنية. نود أن نشكر وحدة المجهر البؤري ووحدة قياس التدفق الخلوي بجامعة سنغافورة الوطنية على المساعدة والمشورة في تحليل نقاء خلايا الكبد.
Materials
| Name | Company | Catalog Number | Comments |
| Material/Equipment | |||
| 1 mL syringe | Nipro | ||
| 27G needle | Nipro | ||
| Black braided silk non-absorbable, non-sterile surgical suture | Look | SP117 | |
| Bochem 18/10 stainless steel forceps, sharp tip contain bent round tip | Bochem | 10333511 | |
| Disposable Perfusion Set | Vasinfuse | BPF-112 | |
| Floating circular 1.5 mL microcentrifuge tube rack | Sigma-Aldrich | R3133 | |
| German Standard Tissue Forceps, Serrated / 1×2 teeth , 14.5cm | Walentech | ||
| Greiner Cellstar aspirating pipette | Merck | GN710183 | |
| Haemocytometer | |||
| Integrated Perfusion System | Vasinfuse | IPS-001 | |
| Iris Scissors curved, stainless, 11cm | Optimal Medical Products Pte Ltd | CVD | |
| Light microscope with 10X lens | Olympus | ||
| Mesh Sheet 100µM Nylon | Spectra-Teknic(s) Pte Ltd | 06630-75 | |
| Operating Scissors, BL/BL, 13cm | Optimal Medical Products Pte Ltd | STR – BL/BL | |
| Operating Scissors, SH/BL, 13cm | Optimal Medical Products Pte Ltd | STR – SH/BL | |
| Reverse force hemostatic clip | Shanghai Jin Zhong Pte Ltd | XEC230 | |
| Water bath | Grant | ||
| Reagents/Chemicals | |||
| 10X Phosphate buffered saline (PBS) | Sigma-Aldrich | ||
| Bovine serum albumin (BSA) | Sigma-Aldrich | A9056 | |
| CaCl2·2H2O | Merck | 137101 | |
| Collagenase Type IV | Gibco | 17104019 | |
| Dexamethasone | TCI | D1961 | |
| DMEM | Gibco | 31600-034 | |
| Glutamax | Gibco | 35050061 | |
| HEPES | Invitrogen | 11344-041 | |
| Insulin | Sigma-Aldrich | 1-9278 | |
| KCl | VWR | VWRC26764.298 | |
| KH2PO4 | Sigma-Aldrich | P5379 | |
| Linoleic acid | Sigma-Aldrich | L9530 | |
| NaCl | Sigma-Aldrich | S5886 | |
| NaHCO3 | Sigma-Aldrich | S8875 | |
| NaOH | Merck | 106462 | |
| Penicillin-Streptomycin | Sigma-Aldrich | P4333 | |
| Type I bovine collagen | Advanced BioMatrix | 5005-100ml | |
| William’s E Media | Sigma-Aldrich | W1878 |
References
- Shen, L., Hillebrand, A., Wang, D. Q. H., Liu, M. Isolation and primary culture of rat hepatic cells. Journal of Visualized Experiments: JoVE. (64), e3917 (2012).
- Cabral, F., et al. Purification of hepatocytes and sinusoidal endothelial cells from mouse liver perfusion. Journal of Visualized Experiments: JoVE. (132), e56993 (2018).
- Green, C. J., et al. The isolation of primary hepatocytes from human tissue: optimising the use of small non-encapsulated liver resection surplus. Cell and Tissue Banking. 18 (4), 597-604 (2017).
- Seglen, P. O. Preparation of isolated rat liver cells. Methods in Cell Biology. 13, 29-83 (1976).
- Gopalakrishnan, S., Harris, E. N. In vivo liver endocytosis followed by purification of liver cells by liver perfusion. Journal of Visualized Experiments: JoVE. (57), e3138 (2011).
- Wen, J. W., Olsen, A. L., Perepelyuk, M., Wells, R. G. Isolation of rat portal fibroblasts by in situ liver perfusion. Journal of Visualized Experiments: JoVE. (64), e3669 (2012).
- Korelova, K., Jirouskova, M., Sarnova, L., Gregor, M. Isolation and 3D collagen sandwich culture of primary mouse hepatocytes to study the role of cytoskeleton in bile canalicular formation in vitro. Journal of Visualized Experiments: JoVE. (154), e60501 (2019).
- Shi, W., et al. Isolation and purification of immune cells from the liver. International Immunopharmacology. 85 (95), 106632 (2020).
- Salem, E. S. B., et al. Isolation of primary mouse hepatocytes for nascent protein synthesis analysis by non-radioactive L-azidohomoalanine labeling method. Journal of Visualized Experiments: JoVE. (140), e58323 (2018).
- Xia, L., et al. Tethered spheroids as an in vitro hepatocyte model for drug safety screening. Biomaterials. 33 (7), 2165-2176 (2012).
- Kegel, V., et al. Protocol for isolation of primary human hepatocytes and corresponding major populations of non-parenchymal liver cells. Journal of Visualized Experiments: JoVE. (109), e53069 (2016).
- Zhu, L., et al. A vertical-flow bioreactor array compacts hepatocytes for enhanced polarity and functions. Lab on a Chip. 16 (20), 3898-3908 (2016).
- Du, Y., et al. Synthetic sandwich culture of 3D hepatocyte monolayer. Biomaterials. 29 (3), 290-301 (2008).
- Tong, W. H., et al. Constrained spheroids for prolonged hepatocyte culture. Biomaterials. 80, 106-120 (2016).
- Xia, L., et al. Laminar-flow immediate-overlay hepatocyte sandwich perfusion system for drug hepatotoxicity testing. Biomaterials. 30 (30), 5927-5936 (2009).
- Gupta, K., et al. Bile canaliculi contract autonomously by releasing calcium into hepatocytes via mechanosensitive calcium channel. Biomaterials. 259, 120283 (2020).
- Horner, R., et al. Impact of Percoll purification on isolation of primary human hepatocytes. Scientific Reports. 9 (1), 6542 (2019).
- Osypiw, J. C., et al. Subpopulations of rat hepatocytes separated by Percoll density-gradient centrifugation show characteristics consistent with different acinar locations. The Biochemical Journal. 304, 617-624 (1994).
- Beal, E. W., et al. A small animal model of ex vivo normothermic liver perfusion. Journal of Visualized Experiments: JoVE. (136), e57541 (2018).
- Hillebrandt, K., et al. Procedure for decellularization of rat livers in an oscillating-pressure perfusion device. Journal of Visualized Experiments: JoVE. (102), e53029 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved