Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Isolierung primärer Rattenhepatozyten mit Multiparameter-Perfusionskontrolle
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt die Verwendung eines speziellen intravenösen Katalysators, eines standardisierten sterilen Einwegschlauchs, einer Temperaturregelung, die durch Echtzeitüberwachung ergänzt wird, und eines Alarmsystems für ein zweistufiges Kollagenase-Perfusionsverfahren, um die Konsistenz der Lebensfähigkeit, Ausbeute und Funktionalität isolierter primärer Rattenhepatozyten zu verbessern.
Zusammenfassung
Primäre Hepatozyten werden häufig in der Grundlagenforschung zu Lebererkrankungen und für Toxizitätstests in vitro eingesetzt. Das zweistufige Kollagenase-Perfusionsverfahren zur primären Hepatozytenisolierung ist technisch anspruchsvoll, insbesondere bei der Pfortaderkanülierung. Das Verfahren ist auch anfällig für gelegentliche Kontaminationen und Variationen der Perfusionsbedingungen aufgrund von Schwierigkeiten bei der Montage, Optimierung oder Wartung des Perfusionsaufbaus. Hier wird ein detailliertes Protokoll für ein verbessertes zweistufiges Kollagenase-Perfusionsverfahren mit Multiparameter-Perfusionskontrolle vorgestellt. Primäre Rattenhepatozyten wurden erfolgreich und zuverlässig isoliert, indem die notwendigen technischen Vorsichtsmaßnahmen in kritischen Schritten des Verfahrens getroffen und die Betriebsschwierigkeiten verringert und die Variabilität der Perfusionsparameter durch die Einführung eines speziellen intravenösen Katheters, standardisierter steriler Einwegschläuche, Temperaturregelung sowie Echtzeit-Überwachungs- und Alarmsystem gemildert wurden. Die isolierten primären Rattenhepatozyten weisen durchweg eine hohe Zelllebensfähigkeit (85%-95%), Ausbeute (2-5 x 108 Zellen pro 200-300 g Ratte) und Funktionalität (Albumin-, Harnstoff- und CYP-Aktivität) auf. Ergänzt wurde das Verfahren durch ein integriertes Perfusionssystem, das kompakt genug ist, um in der Laminar-Flow-Haube aufgestellt zu werden, um einen aseptischen Betrieb zu gewährleisten.
Einleitung
Primäre Hepatozyten sind wichtige Werkzeuge für die leberbezogene Grundlagenforschung, Krankheitsbehandlung und -anwendung wie Drogentests. Der aktuelle Goldstandard für die primäre Hepatozytenisolierung ist das zweistufige Kollagenase-Perfusionsverfahren1,2,3, das von Seglen in den 1970er Jahreneingeführt wurde 4. Dieses Verfahren ist jedoch technisch anspruchsvoll und hat eine hohe Ausfallrate, wenn es von unerfahrenen Chirurgen durchgeführt wird. Selbst wenn eine Perfusion als erfolgreich angesehen wird, können drastische Unterschiede in der Lebensfähigkeit der Hepatozyten (typischerweise 60%-95%) und Ausbeute (0,5-5 x 108 pro 200-300 g Ratte) zwischen den Isolationen beobachtet werden. Dies beeinflusst die Qualität und den Umfang nachgelagerter Experimente. Abgesehen von der technischen Vorgehensweise ist der für die Isolierung verwendete Perfusionsaufbau, entweder kommerziell erhältlich oder kundenspezifisch, ein beitragender Faktor. Der Montage, Optimierung und Wartung des Perfusionsaufbaus muss Aufmerksamkeit geschenkt werden. Der Zweck dieses Protokolls ist es, die Erfolgsrate und Stabilität zwischen den Isolierungen primärer Rattenhepatozyten durch Multiparameter-Perfusionskontrolle des technischen Verfahrens und Perfusionsaufbau des zweistufigen Kollagenase-Perfusionsverfahrens zu verbessern.
Aus technischer Sicht ist der schwierigste Schritt im Verfahren die Pfortadervernarbung. Was die anderen Schritte betrifft, so kann die Stabilität der Isolierung verbessert werden, wenn bewährte Verfahren beachtet und allgemeine Vorsichtsmaßnahmen getroffen werden. Daher ist es wichtig, die Argumentation für jeden Schritt zu verstehen, damit der Chirurg auf verschiedene Variablen reagieren kann, die während des Eingriffs auftreten können.
Verschiedene Protokolle zur Isolierung von Hepatozyten und nicht-parenchymalen Leberzellen aus Ratte und Maus wurden veröffentlicht 1,2,5,6,7,8,9. Die in diesen Protokollen verwendeten Perfusionsaufbauten hatten mehrere Nachteile, darunter die Wiederverwendung von Perfusionsschläuchen, Probleme bei der Temperaturregelung, die Notwendigkeit einer routinemäßigen Optimierung der Perfusionsparameter und / oder die Verwendung eines ungeeigneten Typs von intravenösem (IV) Katheter für die Pfortaderkanülierung. Die Wiederverwendung von Perfusionsschläuchen erhöht die Wahrscheinlichkeit einer Kontamination, insbesondere wenn der Schlauch nicht ordnungsgemäß gereinigt und desinfiziert wurde. Die Wiederverwendung von Schläuchen ohne routinemäßigen Austausch setzt das Perfusionssetup auch Problemen wie undichten Schläuchen oder Anschlüssen, verstopften Blasenfallen und verengten Schläuchen aus, die den Perfusatdruck und die Durchflussrate erheblich reduzieren und somit die Effizienz der Leberverdauung beeinträchtigen. Ohne eine konstante Wärmequelle in einigen Setups zur Temperaturregelung kühlen vorgewärmte Puffer im Laufe der Zeit ab, was zu einer geringen Kollagenaseaktivität und Verdauung führt. Obwohl andere Setups einen ummantelten Glaskondensator verwenden, der an einen Wasserthermostat angeschlossen ist, um den Puffer zu erwärmen, sind sie sperrig und erfordern eine sorgfältige Reinigung. Temperatur, Druck und Durchflussrate des Puffers, der den Katheter verlässt, müssen vor Beginn der Isolierung gemessen und optimiert werden, um einen stabilen Perfusionszustand zu gewährleisten. Selbst nach der Optimierung könnten sich die Parameter während der Isolierung aufgrund der Aktionen des Bedieners noch halbwegs ändern, was zu einer suboptimalen Perfusion und Verdauung führt. Die meisten Arten von IV-Kathetern sind nicht für die Pfortaderverhornung geeignet, da sie während der Kanülierung keine kontinuierliche Perfusion ermöglichen. Sie sind nicht in der Lage, den Chirurgen sofort zu informieren, wenn die Kanülierung erfolgreich ist. Darüber hinaus ist es eine Herausforderung, die Pfortader am weichen Katheter zu befestigen, ohne ihn zu verformen.
Hier adressieren wir diese Probleme mit standardisierten sterilen Einwegschläuchen, einem Silikonheizmantel für eine präzise und stabile Temperaturregelung, Echtzeit-Überwachungs- und Alarmsystem mit Datenspeicherung und -verwaltung sowie der Verwendung eines speziellen IV-Katheters, der eine kontinuierliche Durchblutung während der Punktion der Pfortader während der Kanülierung ermöglicht. Nach unserem besten Wissen sind wir die erste Gruppe, die all diese Eigenschaften in einem integrierten Perfusionssystem (IPS) kombiniert, das kompakt ist, es sehr portabel macht und in eine laminare Durchflusshaube passt, um einen aseptischen Betrieb zu gewährleisten.
Protokoll
Alle Verfahren und Tierhaltungen wurden unter den Protokollnummern R15-0027 und R19-0669 in Übereinstimmung mit den Anforderungen des Institutional Animal Care and Use Committee (IACUC) der National University of Singapore durchgeführt.
1. Vorbereitung von Lösungen und chirurgischen Instrumenten
- Puffer und Zellkulturmedien in Tabelle 1 werden mit Reinstwasser hergestellt.
- Den kalziumfreien Puffer und Kollagenasepuffer vor Gebrauch in einem Wasserbad auf 37 °C vorwärmen.
- Autoklavieren Sie die folgenden chirurgischen Instrumente und Laborgeräte: eine scharf-stumpfe chirurgische Schere, eine stumpf-stumpfe chirurgische Schere, ein Paar gebogene chirurgische Scheren, zwei Paar Zahngewebezangen, zwei Paare gebogene Pinzetten, zwei Venenclips, eine 5 cm lange 3-0 Seiden-Operationsnaht, ein 100-μm-Nylon-Netzfilter, ein 400-ml-Becherglas, und eine Stufe (schwimmendes Mikrozentrifugenrohrgestell).
2. Einrichtung des IPS (siehe Abbildung 1)
- Wischen Sie die Laminar-Flow-Haube mit 70% Ethanol ab. Wischen Sie das IPS mit 70% Ethanol ab und bewegen Sie es in die Laminar-Flow-Haube. Vor dem Einschalten der Haube >15 min durch UV-Sterilisation sterilisieren.
ACHTUNG: Die Exposition gegenüber UV-Licht kann schmerzhafte Augen und Hautverbrennungen verursachen. Stellen Sie sicher, dass der Flügel vollständig geschlossen ist, wenn das UV-Licht eingeschaltet ist. - Montieren Sie einen neuen Satz Einwegschläuche auf dem IPS. Wickeln Sie den Schlauch nach der Peristaltikpumpe in einen Silikonheizmantel. Montieren Sie den Perfusionsmonitor am Schlauch hinter dem Silikonheizmantel.
- Stellen Sie sicher, dass sich die Rollenklemmen für beide Schlaucheinlässe vollständig lösen. Schließen Sie jeden Schlaucheinlass an das sich verjüngende Ende einer sterilen 2-ml-Aspirationspipette an. Lassen Sie beide Aspirationspipetten (Einlässe) und den IV-Katheter (Auslass) in einer 1-L-Flasche mit kalziumfreiem Puffer, um die Rezirkulation des Puffers während der nachfolgenden Ansaugschritte zu ermöglichen.
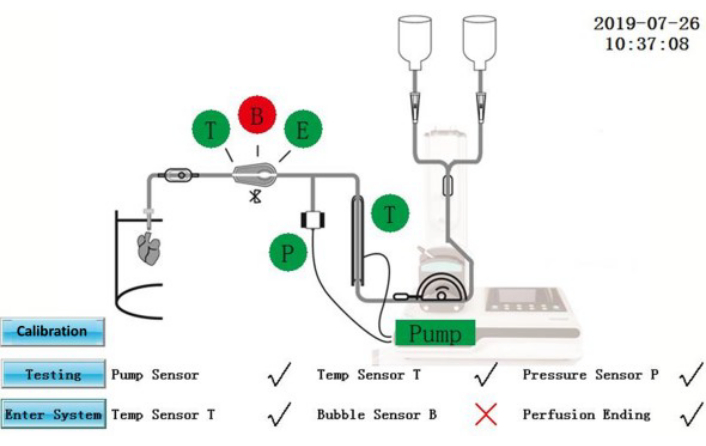
Abbildung 2: Selbsttest-Schnittstelle. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- Schalten Sie das IPS ein. Führen Sie die folgenden Vorgänge auf dem Bedienfeld des Touchscreens aus. Die Software führt bei jedem Start einen umfassenden Selbsttest durch.
ACHTUNG: Das IPS ist ein elektrisches Gerät, das an eine externe Stromquelle angeschlossen ist. Flüssigkeitsverschüttungen auf dem IPS oder Stromkabeln können zu elektrischen Gefahren führen.- Stellen Sie sicher, dass der Selbstteststatus auf dem Bildschirm angezeigt wird (Abbildung 2). Komponenten, die den Selbsttest bestanden haben, werden grün dargestellt; Diejenigen, die versagt haben, werden rot angezeigt. Tippen Sie nach der Korrektur auf das Symbol Testen , um den Selbsttest erneut zu wiederholen, oder tippen Sie auf das Symbol System eingeben , um direkt in die Bedienoberfläche zu gelangen.
- Tippen Sie auf eine beliebige Stelle auf dem Bildschirm, um sich bei der Bedienoberfläche anzumelden.
- Tippen Sie in der oberen linken Ecke der Bedienoberfläche (Abbildung 3) auf eines der kreisförmigen Pfeilsymbole, um die Drehrichtung für die Peristaltikpumpe festzulegen. Tippen Sie im rechten Bereich der Benutzeroberfläche auf die Aufwärts- / Abwärtspfeilsymbole, um Werte für die entsprechenden Parameter festzulegen. Stellen Sie den Fluss in den Modus mit konstantem Fluss ein. Temperatur des Heizmantels bis 42 °C (einzustellen, um sicherzustellen, dass die Temperatur des Perfusats bei 37 °C gehalten wird); und Pumpendrehzahl bis 38 U/min für einen Durchfluss von ~33 mL/min.
- Überprüfen Sie im unteren rechten Bereich der Bedienoberfläche den Status des Blasenalarms, des Perfusionsstoppalarms und des Stummschaltungssymbols.
- Überprüfen Sie die Temperatur, den Druck und die Durchflussrate des Perfusats im linken Bereich. Legen Sie die Intervalle manuell fest, indem Sie auf die Aufwärts-Ab-Pfeile oben und unten in den Spalten klicken. Überprüfen Sie, ob die Echtzeitdaten in der Mitte der Spalten als Werte angezeigt werden. Die Farbe der Spalte wechselt von grün nach rot, wenn sich die Echtzeitdaten über den festgelegten Bereich hinaus bewegen.
- Suchen Sie die Symbole zum Starten, Anhalten und Stoppen der Perfusion und das Symbol zum Wechseln von der Echtzeit-Datenanzeige in den Diagrammmodus im mittleren Bereich. Tippen Sie auf das Startsymbol, um die Durchblutung zu beginnen und den Schlauch mit kalziumfreiem Puffer zu grundieren. Ein neues Protokoll wird erstellt. Geben Sie den Dateinamen und den Benutzernamen in das Popup-Fenster ein (Abbildung 4).
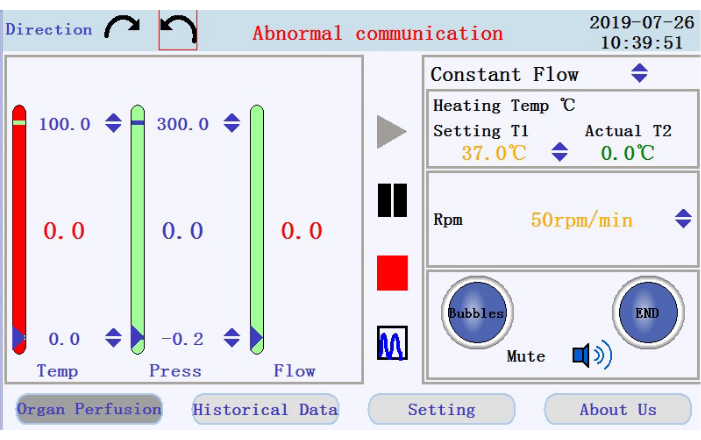
Abbildung 3: Bedienoberfläche. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
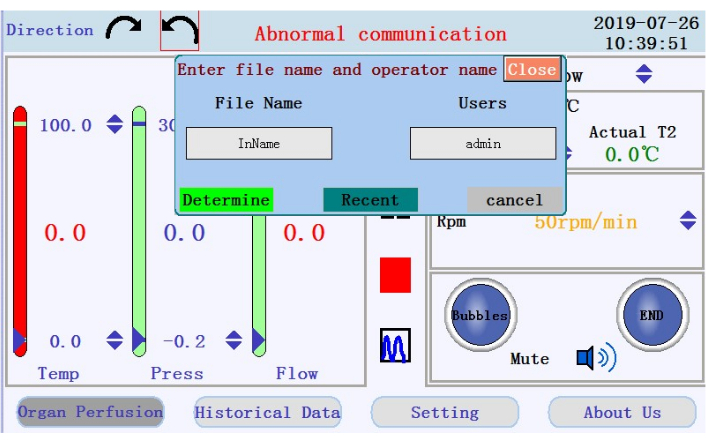
Abbildung 4: Popup-Fenster mit Eingabeaufforderung für Dateiname und Benutzername. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- Füllen Sie die Tropfkammer bis zur Hälfte voll. Stellen Sie sicher, dass sich während der Grundierung keine Lufteinschlüsse im Schlauch befinden.
- Entfernen Sie alle Blasen, die sich stromabwärts des Blasenfilters bilden, indem Sie auf den Schlauch streichen, um die Blase zu lösen und sie ausspülen zu lassen.
HINWEIS: Blasen können sich entlang des Schlauches bilden, wenn der Puffer durch den Heizmantel erwärmt wird. - Füllen Sie ein 400 ml Becherglas mit 200 ml Kollagenasepuffer. Stellen Sie die Bühne auf das Becherglas. Ohne Luft in den Schlauch einzuführen, ziehen Sie die Rollenklemme für einen der Schlaucheinlässe vollständig fest und bewegen Sie die Absaugpipette für den Einlass in den Becher.
3. Tierisches Verfahren
- Bereiten Sie eine junge erwachsene männliche Wistar-Ratte um 200-300 g Körpergewicht vor.
HINWEIS: Dieses Protokoll wurde für Ratten mit einem Körpergewicht von etwa 200-300 g optimiert. Männliche Ratten werden bevorzugt, da hormonelle Veränderungen während des Brunstzyklus bei weiblichen Ratten die Hepatozytenfunktion beeinflussen. - Anästhesie
- Ziehen Sie das erforderliche Volumen an gerinnungshemmendem Heparin (5.000 IE / ml; 0,2 ml / 100 g Körpergewicht) und Rattenanästhesie Ketamin / Xylin-Cocktail (37,5 mg / ml Ketamin, 5 mg / ml Xylazin; 0,2 ml / 100 g Körpergewicht) in 1 ml Spritzen mit 27 G Nadel.
ACHTUNG: Anästhesie und Heparin sind Schadstoffe. Seien Sie vorsichtig beim Umgang mit scharfen Gegenständen. - Halte die Ratte zurück. Intraperitoneal injizieren Sie Heparin, gefolgt von einem Ketamin / Xylazin-Cocktail in den unteren rechten Quadranten des Abdomens.
HINWEIS: Das Caecum hat eine höhere Wahrscheinlichkeit, sich links zu befinden. Vermeiden Sie es, den Blinddarm während der Injektion zu punktieren, um das Risiko einer Kontamination zu verringern. - Überprüfen Sie nach 10 Minuten die Tiefe der Anästhesie, indem Sie den Pedalreflex an beiden Füßen der Ratte beurteilen. Überprüfen Sie von Zeit zu Zeit weiter und warten Sie, bis die Ratte nicht mehr auf Zehenkneifen reagiert. Zusätzliche Anästhesie kann bei Bedarf injiziert werden.
- Ziehen Sie das erforderliche Volumen an gerinnungshemmendem Heparin (5.000 IE / ml; 0,2 ml / 100 g Körpergewicht) und Rattenanästhesie Ketamin / Xylin-Cocktail (37,5 mg / ml Ketamin, 5 mg / ml Xylazin; 0,2 ml / 100 g Körpergewicht) in 1 ml Spritzen mit 27 G Nadel.
- Stellen Sie die Ratte in Rückenlage mit ausgestreckten Gliedmaßen auf eine mit Aluminiumfolie überzogene Styroporplattform auf einem Tablett. Kleben Sie die Füße der Ratte und befestigen Sie das Klebeband mit 27 G-Nadeln sicher auf der Plattform.
- Desinfizieren Sie die Brust und den Bauch, indem Sie sie mit 70% Ethanol besprühen und durchnässen. Die Rasur vor der Desinfektion ist optional. Legen Sie die Ratte in die Kapuze. Fahren Sie mit dem nächsten Schritt fort, während das Fell noch nass ist.
HINWEIS: Das Durchnässen mit 70% Ethanol hält auch Hautschuppen und Pelzstaub auf ein Minimum. - Trennen Sie die Haut vom Muskel.
- Mit einer Zahnteilzange in einer Hand heben Sie die Haut in der Nähe der Bauchbasis an. Mit einer scharf-stumpfen chirurgischen Schere in der anderen Hand schneiden Sie die Zelthaut ab. Drücken Sie das scharfe Ende der Schere unter die Haut und machen Sie einen Mittellinienschnitt auf der Haut von knapp über den Hinterbeinen bis knapp unter die Vorderbeine.
- Während Sie die Haut mit der Pinzette hochziehen und leicht dehnen, schneiden Sie das Bindegewebe, das die Haut auf dem Muskel in Brust und Bauch hält, ab. Um das Risiko einer Kontamination zu verringern, verhindern Sie, dass loses Fell auf den Muskel fällt. Um angesammeltes loses Fell an der Schere zu entfernen, wischen Sie es auf der desinfizierten Außenseite der Haut ab.
- Machen Sie seitliche Einschnitte auf der Haut, von der Mittellinie bis zu beiden Seiten der Ratte leicht über den Hinterbeinen und leicht unter den Vorderbeinen. Drücken Sie die Hautlappen an die Seiten, um den Muskel freizulegen.
- Schneiden Sie den Bauchmuskel auf, um die Organe freizulegen.
- Mit einer neuen Zahnteilzange in einer Hand heben Sie den Muskel in der Nähe der Bauchbasis an. Mit einer stumpf-stumpfen chirurgischen Schere in der anderen Hand, schneiden Sie vorsichtig durch den Muskel, ohne eines der Organe zu stechen. Machen Sie einen Mittellinienschnitt am Muskel von leicht über den Hinterbeinen bis zum Brustbein.
- Machen Sie seitliche Einschnitte am Muskel, von der Mittellinie bis zu beiden Seiten der Ratte leicht über den Hinterbeinen und direkt unter dem Brustkorb, ohne eines der Organe einzustechen. Drücken Sie die Muskelklappen an die Seiten, um die Organe freizulegen. Stellen Sie sicher, dass die seitlichen Schnitte der Haut und des Muskels die Seiten der Ratte erreichen, damit Blut und Puffer bei späteren Schritten aus der Bauchhöhle ausfließen können.
- Pfortader-Kanülierung
- Drücken Sie den Darm mit der Rückseite einer gebogenen Pinzette vorsichtig nach rechts. Drehen Sie die Leberlappen vorsichtig hoch, um die Pfortader freizulegen.
- Verwenden Sie eine 3-0 Seiden-Operationsnaht, um eine sehr lockere Ligatur um die Pfortader in der Nähe der Leber zu machen, kurz bevor sich die Vene links und rechts in verschiedene Leberlappen verzweigt. Ziehen Sie die Ligatur nicht an, um den Blutfluss durch die Pfortader nicht zu stören. Eine sehr dünne Membran unter dem Gallengang muss mit der Spitze der gekrümmten Pinzette durchbrochen werden, bevor die Naht darunter hindurchgehen und um die Pfortader (und den Gallengang) geschlungen werden kann.
- Verwenden Sie die Spitzen von zwei Paaren gebogener Pinzetten und stechen Sie vorsichtig ein Loch durch das Gewebe unter der Pfortader, ohne die Pfortader zu beschädigen. Tun Sie dies etwa 2-3 cm vor der ersten Ligatur, kurz bevor sich die Magenvene von der Pfortader abzweigt. Das Gewebe ist an dieser bestimmten Stelle dünner.
- Dehnen Sie das Loch vorsichtig mit der Pinzette größer. Dieses Loch ermöglicht es der Pinzette, die Pfortader während der Kanülierung zu stützen.
- Reduzieren Sie die Pumpendrehzahl auf 4 U / min für eine Durchflussrate von ~ 3 ml / min. Stellen Sie sicher, dass der Abfluss von kalziumfreiem Puffer aus dem IV-Katheter auf einen langsamen Tropf reduziert wird.
HINWEIS: Druckaufbau in der Leber führt zum Tod von Hepatozyten. Eine geringere Durchflussrate sollte den Druckaufbau in der Leber bei erfolgreichem Einführen der Kanüle in die Pfortader in einem späteren Schritt verlangsamen. - Stützen Sie die Pfortader vorsichtig mit einer Pinzette ab. Mit der anderen Hand den IV-Katheter mit der Fase der Nadel nach oben halten. Führen Sie die Nadel in einem Winkel von 10-20 ° in die Pfortader und bewegen Sie sich langsam, bis sich die gesamte Fase in der Vene befindet. Sobald die Nadel richtig in die Pfortader eingeführt wurde, beginnt die Leber zu blanchieren und verliert ihre dunkelrote Farbe.
HINWEIS: Die gesamte Fase der Nadel muss in die Vene eingeführt werden, um ein Loch zu erzeugen, das groß genug für das Einführen der Kanüle ist. Führen Sie die Nadel jedoch nicht zu tief ein, um eine Überpunktion der Vene zu vermeiden. - Bewegen Sie die Kanüle über die Nadel und in die Vene. Ziehen Sie dann die Nadel zurück, bis sie 2-3 mm hinter der Kanüle liegt. gerade genug, damit die scharfe Spitze sicher in der Kanüle ist. Verwenden Sie den Daumen und den Mittelfinger, um sich am Katheter festzuhalten, und ziehen Sie mit dem Zeigefinger den Flügel zurück, um die Nadel zurückzuziehen.
- Befestigen Sie die Pfortader schnell mit einem Venenclip am Katheter. Nicht direkt am seitlichen Loch der Nadel befestigen, um den perfusaten Fluss nicht zu stören. Schneiden Sie stattdessen darunter aus.
- Schneiden Sie sofort die infrahepatische untere Hohlvene (IVC) ab, um Druckaufbau in der Leber zu verhindern. Inzwischen werden das infrahepatische IVC und die angrenzenden Blutgefäße durch Blut aus der Pfortader verdeckt. Um sicherzustellen, dass die IVC korrekt geschnitten und abgetrennt wurde, achten Sie darauf, dass Blut in Impulsen austritt; Blut rieselt nur aus benachbarten Gefäßen heraus.
HINWEIS: Wenn Sie nach der Kanülierung zu lange brauchen, um die infrahepatische IVC zu schneiden oder sie nicht zu schneiden, bevor Sie mit dem nächsten Schritt fortfahren, führt dies zum Tod der Hepatozyten. Das Tier wird während dieses Schrittes unter Narkose durch Exsanguination (durch das Schneiden des IVC) eingeschläfert. Das Verfahren sollte fortgesetzt werden, während der Blutverlust andauert. Der Tod kann durch visuelle Beobachtung der Beendigung des Herzschlags / der Atmung bestätigt werden, wenn die Brusthöhle in einem späteren Schritt geöffnet wird. - Erhöhen Sie die Pumpendrehzahl auf 38 U / min für eine Durchflussrate von ~ 33 ml / min. Spülen Sie die Leber dreimal, indem Sie die IVC für 2-3 s (aber nicht zu lange) mit einer Pinzette schließen und wieder öffnen.
HINWEIS: Während der Spülung dehnt sich die Leber leicht aus, bevor sie zur Normalität zurückkehrt. Das Spülen erleichtert die Permeation von Perfusat in der gesamten Leber. Nach dem Spülen sollte die Leber vollständig hellbraun gefärbt sein. - Stellen Sie sicher, dass die Kanülenspitze vor dem Punkt platziert wird, an dem sich die Pfortader in verschiedene Leberlappen verzweigt, um die Durchblutung aller Leberlappen sicherzustellen. Falls erforderlich, lösen Sie die Pfortader und passen Sie die Position der Kanüle an. Anschließend erneut clippen.
- Ziehen Sie die lose Ligatur um die Pfortader etwas oberhalb des Verzweigungspunkts fest. Machen Sie drei Knoten an der Stelle, an der die weiche Kanüle von der harten Metallnadel getragen wird, zwischen der Fase und dem Seitenloch. Stellen Sie sicher, dass die Knoten die Kanüle in Position fixieren, sie an der Pfortader befestigen und den Rückfluss von Puffern verhindern.
- Sezieren Sie die ganze Leber intakt.
- Durchbluten Sie die Leber mit kalziumfreiem Puffer bei einer Durchflussrate von ~ 33 ml / min für die nächsten 12 Minuten (siehe Abbildung 5A). In der Zwischenzeit führen Sie eine Leberresektion durch. Die Perfusionszeit kann bei Bedarf verlängert werden, aber sicherstellen, dass der kalziumfreie Puffer nicht ausgeht.
- Lösen Sie mit einer gebogenen Schere vorsichtig die Pfortader vom Darm, indem Sie das Mesenterium durchschneiden, das sie miteinander verbindet. Nicken Sie nicht den Magen-Darm-Trakt (Speiseröhre, Magen und Dünn- und Dickdarm), um sicherzustellen, dass keine Kontamination auftritt.
HINWEIS: Dies soll verhindern, dass die Pfortader reißt, wenn die Leber während der Resektion bewegt wird. - Lösen Sie die Leber vom Magen-Darm-Trakt, indem Sie Bindegewebe, Bauchspeicheldrüse und Mesenterium schneiden, das die Leber mit dem Magen-Darm-Trakt verbindet. Zum Abnehmen immer mit einer Schere schneiden und nicht zum Reißen ziehen. Auch hier sollten Sie den Magen-Darm-Trakt nicht einstechen oder schneiden.
- Drehen Sie vorsichtig die Leber hinunter, um das Zwerchfell freizulegen. Schneiden Sie die Membran nach den Wänden der Rippen ab. Stellen Sie sicher, dass der größte Teil des Zwerchfells mit der Leber verbunden bleibt. Achten Sie darauf, die Leber nicht zu stechen oder zu verletzen.
- Sobald die Brusthöhle geöffnet ist, sind zwei Kanäle zu sehen: der weißliche suprahepatische IVC auf der linken Seite und der gelbliche Ösophagus auf der rechten Seite. Schneiden Sie den suprahepatischen IVC ab und schneiden Sie ihn direkt über den Clip. Das Beschneiden des suprahepatischen IVC ist optional. Es verhindert, dass die Brusthöhle überflutet wird.
HINWEIS: Beobachten Sie visuell die Beendigung des Herzschlags / der Atmung, um den Tod von Tieren zu bestätigen. - Die Speiseröhre ist vom Zwerchfell umgeben. Um die Speiseröhre vom Zwerchfell zu isolieren, schneiden Sie das Zwerchfell von rechts in Richtung Speiseröhre durch. Schneiden Sie das verbleibende Bindegewebe ab, das die Speiseröhre und den Magen mit der Leber und dem Zwerchfell verbindet.
- Schieben Sie den Magen-Darm-Trakt nach rechts weg. Übertragen Sie den Venenclip von der suprahepatischen IVC auf die infrahepatische IVC; Der Puffer wird nun aus dem suprahepatischen IVC heraussickern.
HINWEIS: Während der Perfusion werden die Kanüle und die infrahepatische IVC von der Leber bedeckt. Ein starker Pufferabfluss aus dem suprahepatischen IVC hilft dem Chirurgen, Perfusionsleckagen auszuschließen. - Schneiden Sie das verbleibende Zwerchfell ab, das die Leber mit der Brusthöhle verbindet. Schneiden Sie Gewebe ab, das die Leber mit der Bauchhöhle verbindet. Achten Sie darauf, die infrahepatische IVC über dem Clip nicht zu schneiden, um zu vermeiden, dass der Clip von der Leber gelöst wird.
- Um sicherzustellen, dass die Leber vollständig reseziert wird, heben Sie die Leber vorsichtig an, indem Sie sich mit einer Pinzette am Zwerchfell festhalten. Wenn es Restgewebe gibt, das die Leber mit der Bauchhöhle verbindet, schneiden Sie sie ab. Wenn die Niere und die Milz noch mit der Leber verbunden sind, lösen Sie sie.
4. Leberdurchblutung und Verdauung
- Wenn die Resektion frühzeitig abgeschlossen wurde, warten Sie, bis die Leber 12 Minuten lang mit kalziumfreiem Puffer durchblutet wurde.
- Ändern Sie den Perfusionspuffer in Kollagenasepuffer. Lösen Sie die Rollenklemme für den Kollagenasepuffer vollständig, bevor Sie die Rollenklemme für einen kalziumfreien Puffer vollständig anziehen (siehe Abbildung 5B). Sobald der Kollagenasepuffer die Leber durch den Schlauch erreicht, spülen Sie die Leber dreimal aus, indem Sie die suprahepatische IVC für 2-3 s schließen und wieder öffnen.
- Bewegen Sie die Leber vorsichtig auf die Bühne auf dem Becherglas für die Rezirkulation des Kollagenasepuffers. Bewegen Sie die Leber, indem Sie das Zwerchfell mit einer Pinzette festhalten, während Sie den Katheter stützen. Vermeiden Sie es, am Katheter zu ziehen, um ein versehentliches Ablösen des Katheters zu vermeiden.
HINWEIS: Wenn sich der Katheter löst und die Pfortader für eine erneute Kanülierung zu beschädigt ist, kanülieren Sie die suprahepatische IVC und lassen Sie den Puffer aus der Pfortader heraussickern. Stellen Sie sicher, dass die infrahepatische IVC abgeschnitten bleibt. - Verdauen Sie die Leber für 12 min. Beobachten Sie das Auftreten von durchscheinenden Flecken / Netzwerken, da die Leber beginnt, ihre glatte braune Textur zu verlieren. Die Leber wird größer und weicher, wenn sie verdaut wird. Sobald die Leber eine matschige Konsistenz hat, stoppen Sie die Perfusion. Die Verdauungszeit kann bei Bedarf verlängert werden.
HINWEIS: Wenn die Glisson-Kapsel gebrochen wurde, kann der Kollagenase-Puffer im Becherglas aufgrund entwichener Leberzellen trüb werden.
5. Hepatozyten-Isolierung
- Entfernen Sie vorsichtig die Kanüle, indem Sie die Pfortader abschneiden. Entfernen Sie den Clip vorsichtig. Übertragen Sie die Leber auf eine 150-mm-Schale, die 60 ml kaltes Dulbecco's Modified Eagle Medium (DMEM) enthält.
- Klopfen Sie vorsichtig mit der Rückseite der gekrümmten Pinzette auf die Leber, um die Glisson-Kapsel zu brechen und abzuziehen. Dann schwingen Sie die Leber vorsichtig von Seite zu Seite in DMEM, um Leberzellen freizusetzen. Tun Sie dies so lange, bis die Leberzellen vollständig in das DMEM dissoziiert sind.
HINWEIS: Gelegentlich wird die ganze Leber oder bestimmte Lappen nur teilweise verdaut. Durch das Nichtabkratzen der Leber, die gewaltsam entfernt und undissoziierte Hepatozyten schädigt, kann eine höhere und konsistentere Zelllebensfähigkeit erreicht werden. - Schaukeln Sie die 150-mm-Schale vorsichtig, bis die Leberzellen in DMEM gut verteilt sind. Um Gewebestücke und Zellklumpen zu entfernen, gießen Sie die Zellsuspension durch einen 100 μm porengroßen Nylonnetzfilter, der über einer neuen 150-mm-Schale platziert ist. Spülen Sie die alte Schale mit 30 ml DMEM ab und geben Sie die Suspension in den Netzfilter. Tippen Sie vorsichtig auf den Netzfilter, damit gefangene einzelne Leberzellen passieren können.
- Entfernen Sie den Netzfilter und schaukeln Sie die neue 150-mm-Schale vorsichtig, bis die Leberzellen gut verteilt sind. Teilen Sie die Aufhängung gleichmäßig in 4 x 50 ml Rohre auf. Spülen Sie die Schale mit 30 ml DMEM ab und teilen Sie die Suspension gleichmäßig in die gleichen Röhrchen. Stellen Sie sicher, dass jede Röhre ein gleiches Volumen an Zellsuspension hat.
- Zentrifugieren Sie die 4 x 50 ml Röhrchen Zellsuspension bei 50 x g für 2 min bei 4 °C. Saugen Sie den Überstand vorsichtig ab, ohne das lose Pellet zu stören. Verwerfen Sie den Überstand. Fügen Sie 20 ml DMEM in jede Röhre hinzu und schaukeln Sie die Röhrchen vorsichtig, um das Zellpellet wieder zu suspendieren. Kombinieren Sie die Zellsuspension aus vier Röhrchen zu zwei.
- Die 2 x 50 mL Röhrchen bei 20 x g für 2 min bei 4 °C zentrifugieren. Saugen Sie den Überstand auf und verwerfen Sie ihn. Fügen Sie 20 ml DMEM in jede Röhre hinzu und schaukeln Sie die Röhrchen vorsichtig, um das Zellpellet wieder zu suspendieren. Kombinieren Sie die Zellsuspension aus zwei Röhrchen zu einem. Halten Sie die Zellen bis zum Gebrauch auf Eis.
- Bereiten Sie Trypan Blue Solution vor, indem Sie 400 μL 1x PBS mit 50 μL Trypan Blue mischen. Geben Sie 50 μL Hepatozytenssuspension in die Trypanblaulösung. Zählen Sie die Anzahl der lebensfähigen und toten Hepatozyten mit einem Hämozytometer unter dem Lichtmikroskop.
6. Hepatozyten-Kultur
- Führen Sie alle Zellkulturschritte in der Haube durch. 1 ml Kollagen-Beschichtungslösung in eine 35-mm-Schale geben und 4 h inkubieren. Spülen Sie das Geschirr dreimal mit 1x PBS ab.
- Verdünnte Hepatozytensussuspension in Hepatozytenkulturmedium bis zu einer Konzentration von 0,8 Millionen Zellen/ml. Geben Sie 1 ml verdünnte Hepatozytensussuspension in die 35-mm-Schale.
HINWEIS: Hepatozyten reagieren empfindlich auf Schubspannungen während des Pipettierens. Erwägen Sie die Verwendung von Pipettenspitzen mit breiter Bohrung. - Schaukeln Sie die Schale, um die Hepatozyten gleichmäßig zu verteilen. Inkubieren bei 37 °C, 5% CO2 für 3-4 h, damit sich die Hepatozyten anheften können.
- Für Sandwich-Kultur.
- Hepatozytenkulturmedium entfernen. Einmal mit 1 ml Hepatozytenkulturmedium abspülen, um ungebundene Zellen zu entfernen. Fügen Sie 1 ml Kollagen-Overlay-Lösung hinzu. Fügen Sie Kollagen-Overlay-Lösung auf die Wände der Schale hinzu, um zu vermeiden, dass Blasen in die Lösung eingeführt werden.
- Inkubieren bei 37 °C, 5% CO2 für über Nacht, um Kollagengelation zu ermöglichen.
- Fügen Sie 1 ml frisches Hepatozytenkulturmedium hinzu. Inkubieren bei 37 °C, 5% CO2.
- Für die Monolayer-Kultur.
- Entfernen Sie nach Schritt 6.3 das Hepatozytenkulturmedium. Einmal mit 1 ml Hepatozytenkulturmedium abspülen, um die nicht gebundenen Zellen zu entfernen.
- Fügen Sie 1 ml frisches Hepatozytenkulturmedium hinzu. Inkubieren bei 37 °C, 5% CO2.
- Beurteilung der Reinheit und Funktion von Hepatozyten durch Durchführung von Immunfärmungen für hepatozytenspezifische Marker und funktionelle Assays, wie zuvor beschrieben10,11.
Ergebnisse
Ein Chirurg könnte feststellen, ob die Leberperfusion reibungslos verläuft, indem er das Ergebnis nach bestimmten Schritten beobachtet. Das erste Ergebnis kann bei der Kanülierung, dem Schneiden der infrahepatischen IVC und der Wiederherstellung der Perfusionsflussrate beobachtet werden. Die Leber sollte ihre Farbe vollständig von dunkelrot zu braun geändert haben, während sie ihr Volumen beibehielt. Wenn die Leber leicht entleert aussieht und eine rötliche Tönung oder rote Flecken aufweist, bedeutet dies, dass d...
Diskussion
Es gibt einige Punkte, die für das zweistufige Kollagenase-Perfusionsverfahren im Allgemeinen besonders wichtig sind. Erstens muss bei der Resezierung der Leber besondere Vorsicht geboten werden. Stellen Sie sicher, dass der Magen-Darm-Trakt nicht beschädigt wird, da das Austreten des Inhalts zu einer bakteriellen Kontamination führt. Vermeiden Sie außerdem eine Beschädigung der Glisson-Kapsel, die während des Tiereingriffs die Oberfläche der Leber bedeckt. Wenn der Riss groß genug ist, kann dies eine vorzeitige ...
Offenlegungen
Zhou Yan und Hanry Yu erklären konkurrierende Interessen, da sie Aktien von Vasinfuse halten, das das Integrated Perfusion System herstellt und vermarktet. Hanry Yu hält Aktien von Histoindex, Invitrocue, Osteopore, Pishon Biomedical, Ants Innovate und Synally Futuristech, die keine konkurrierenden Interessen mit den hier berichteten Informationen haben.
Danksagungen
Diese Arbeit wird zum Teil von MOE ARC (MOE2017-T2-1-149) unterstützt; NUHS Innovation Seed Grant 2017 (NUHSRO/2017/051/InnovSeed/02); Mechanobiology Institute of Singapore (R-714-106-004-135); und Institute of Bioengineering and Nanotechnology, Biomedical Research Council, Agency for Science, Technology and Research (A*STAR) (Projektnummern IAF-PP H18/01/a0/014, IAF-PP H18/01/a0/K14 und MedCaP-LOA-18-02) an Hanry Yu. Ng Chan Way ist wissenschaftlicher Mitarbeiter der National University of Singapore. Wir danken der Confocal Microscopy Unit & Flow Cytometry Unit der National University of Singapore für die Hilfe und Beratung bei der Hepatozytenreinheitsanalyse.
Materialien
| Name | Company | Catalog Number | Comments |
| Material/Equipment | |||
| 1 mL syringe | Nipro | ||
| 27G needle | Nipro | ||
| Black braided silk non-absorbable, non-sterile surgical suture | Look | SP117 | |
| Bochem 18/10 stainless steel forceps, sharp tip contain bent round tip | Bochem | 10333511 | |
| Disposable Perfusion Set | Vasinfuse | BPF-112 | |
| Floating circular 1.5 mL microcentrifuge tube rack | Sigma-Aldrich | R3133 | |
| German Standard Tissue Forceps, Serrated / 1×2 teeth , 14.5cm | Walentech | ||
| Greiner Cellstar aspirating pipette | Merck | GN710183 | |
| Haemocytometer | |||
| Integrated Perfusion System | Vasinfuse | IPS-001 | |
| Iris Scissors curved, stainless, 11cm | Optimal Medical Products Pte Ltd | CVD | |
| Light microscope with 10X lens | Olympus | ||
| Mesh Sheet 100µM Nylon | Spectra-Teknic(s) Pte Ltd | 06630-75 | |
| Operating Scissors, BL/BL, 13cm | Optimal Medical Products Pte Ltd | STR – BL/BL | |
| Operating Scissors, SH/BL, 13cm | Optimal Medical Products Pte Ltd | STR – SH/BL | |
| Reverse force hemostatic clip | Shanghai Jin Zhong Pte Ltd | XEC230 | |
| Water bath | Grant | ||
| Reagents/Chemicals | |||
| 10X Phosphate buffered saline (PBS) | Sigma-Aldrich | ||
| Bovine serum albumin (BSA) | Sigma-Aldrich | A9056 | |
| CaCl2·2H2O | Merck | 137101 | |
| Collagenase Type IV | Gibco | 17104019 | |
| Dexamethasone | TCI | D1961 | |
| DMEM | Gibco | 31600-034 | |
| Glutamax | Gibco | 35050061 | |
| HEPES | Invitrogen | 11344-041 | |
| Insulin | Sigma-Aldrich | 1-9278 | |
| KCl | VWR | VWRC26764.298 | |
| KH2PO4 | Sigma-Aldrich | P5379 | |
| Linoleic acid | Sigma-Aldrich | L9530 | |
| NaCl | Sigma-Aldrich | S5886 | |
| NaHCO3 | Sigma-Aldrich | S8875 | |
| NaOH | Merck | 106462 | |
| Penicillin-Streptomycin | Sigma-Aldrich | P4333 | |
| Type I bovine collagen | Advanced BioMatrix | 5005-100ml | |
| William’s E Media | Sigma-Aldrich | W1878 |
Referenzen
- Shen, L., Hillebrand, A., Wang, D. Q. H., Liu, M. Isolation and primary culture of rat hepatic cells. Journal of Visualized Experiments: JoVE. (64), e3917 (2012).
- Cabral, F., et al. Purification of hepatocytes and sinusoidal endothelial cells from mouse liver perfusion. Journal of Visualized Experiments: JoVE. (132), e56993 (2018).
- Green, C. J., et al. The isolation of primary hepatocytes from human tissue: optimising the use of small non-encapsulated liver resection surplus. Cell and Tissue Banking. 18 (4), 597-604 (2017).
- Seglen, P. O. Preparation of isolated rat liver cells. Methods in Cell Biology. 13, 29-83 (1976).
- Gopalakrishnan, S., Harris, E. N. In vivo liver endocytosis followed by purification of liver cells by liver perfusion. Journal of Visualized Experiments: JoVE. (57), e3138 (2011).
- Wen, J. W., Olsen, A. L., Perepelyuk, M., Wells, R. G. Isolation of rat portal fibroblasts by in situ liver perfusion. Journal of Visualized Experiments: JoVE. (64), e3669 (2012).
- Korelova, K., Jirouskova, M., Sarnova, L., Gregor, M. Isolation and 3D collagen sandwich culture of primary mouse hepatocytes to study the role of cytoskeleton in bile canalicular formation in vitro. Journal of Visualized Experiments: JoVE. (154), e60501 (2019).
- Shi, W., et al. Isolation and purification of immune cells from the liver. International Immunopharmacology. 85 (95), 106632 (2020).
- Salem, E. S. B., et al. Isolation of primary mouse hepatocytes for nascent protein synthesis analysis by non-radioactive L-azidohomoalanine labeling method. Journal of Visualized Experiments: JoVE. (140), e58323 (2018).
- Xia, L., et al. Tethered spheroids as an in vitro hepatocyte model for drug safety screening. Biomaterials. 33 (7), 2165-2176 (2012).
- Kegel, V., et al. Protocol for isolation of primary human hepatocytes and corresponding major populations of non-parenchymal liver cells. Journal of Visualized Experiments: JoVE. (109), e53069 (2016).
- Zhu, L., et al. A vertical-flow bioreactor array compacts hepatocytes for enhanced polarity and functions. Lab on a Chip. 16 (20), 3898-3908 (2016).
- Du, Y., et al. Synthetic sandwich culture of 3D hepatocyte monolayer. Biomaterials. 29 (3), 290-301 (2008).
- Tong, W. H., et al. Constrained spheroids for prolonged hepatocyte culture. Biomaterials. 80, 106-120 (2016).
- Xia, L., et al. Laminar-flow immediate-overlay hepatocyte sandwich perfusion system for drug hepatotoxicity testing. Biomaterials. 30 (30), 5927-5936 (2009).
- Gupta, K., et al. Bile canaliculi contract autonomously by releasing calcium into hepatocytes via mechanosensitive calcium channel. Biomaterials. 259, 120283 (2020).
- Horner, R., et al. Impact of Percoll purification on isolation of primary human hepatocytes. Scientific Reports. 9 (1), 6542 (2019).
- Osypiw, J. C., et al. Subpopulations of rat hepatocytes separated by Percoll density-gradient centrifugation show characteristics consistent with different acinar locations. The Biochemical Journal. 304, 617-624 (1994).
- Beal, E. W., et al. A small animal model of ex vivo normothermic liver perfusion. Journal of Visualized Experiments: JoVE. (136), e57541 (2018).
- Hillebrandt, K., et al. Procedure for decellularization of rat livers in an oscillating-pressure perfusion device. Journal of Visualized Experiments: JoVE. (102), e53029 (2015).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten