É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Isolamento de Hepatócitos Primários de Ratos com Controle de Perfusão Multiparâmetro
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Este protocolo detalha o uso de um cateter intravenoso especial, tubos descartáveis estéreis padronizados, controle de temperatura complementado por monitoramento em tempo real e um sistema de alarme para procedimento de perfusão de colagem em duas etapas para melhorar a consistência na viabilidade, rendimento e funcionalidade de hepatócitos primários isolados.
Resumo
Hepatócitos primários são amplamente utilizados em pesquisas básicas sobre doenças hepáticas e para testes de toxicidade in vitro. O procedimento de perfusão de colagem de duas etapas para isolamento primário de hepatócitos é tecnicamente desafiador, especialmente na canulação venosa do portal. O procedimento também é propenso a contaminação ocasional e variações nas condições de perfusão devido a dificuldades na montagem, otimização ou manutenção da configuração de perfusão. Aqui, é apresentado um protocolo detalhado para um procedimento de perfusão de colagem de duas etapas melhorado com controle de perfusão multiparmétrica. Os hepatócitos primários foram isolados com sucesso e confiabilidade, tomando as precauções técnicas necessárias em etapas críticas do procedimento, e reduzindo a dificuldade operacional e mitigando a variabilidade dos parâmetros de perfusão através da adoção de um cateter intravenoso especial, tubos descartáveis estéreis padronizados, controle de temperatura e sistema de monitoramento e alarme em tempo real. Os hepatócitos primários isolados exibem consistentemente alta viabilidade celular (85%-95%), rendimento (2-5 x 108 células por rato de 200-300 g) e funcionalidade (atividade albumina, ureia e CYP). O procedimento foi complementado por um sistema integrado de perfusão, compacto o suficiente para ser configurado na coifa de fluxo laminar para garantir o funcionamento asséptico.
Introdução
Hepatócitos primários são ferramentas importantes para pesquisa básica relacionada ao fígado, tratamento de doenças e aplicação, como testes de drogas. O padrão-ouro atual para o isolamento primário do hepatocito é o procedimento de perfusão de colagem de duas etapas 1,2,3 introduzido pela Seglen na década de 19704. No entanto, este procedimento é tecnicamente desafiador e tem uma alta taxa de falha quando realizado por cirurgiões iniciantes. Mesmo quando uma perfusão é considerada bem sucedida, podem ser observadas diferenças drásticas na viabilidade do hepatocito (tipicamente 60%-95%) e rendimento (0,5-5 x 108 por rato de 200-300 g) entre os isolamentos. Isso influencia a qualidade e a escala dos experimentos a jusante. Além do procedimento técnico, a configuração de perfusão utilizada para o isolamento, seja comercialmente disponível ou personalizada, é um fator contribuinte. Deve-se prestar atenção à montagem, otimização e manutenção da configuração da perfusão. O objetivo deste protocolo é melhorar a taxa de sucesso e a estabilidade entre os isolamentos dos hepatócitos primários de ratos através do controle de perfusão multiparmétrica do procedimento técnico e da configuração de perfusão do procedimento de perfusão de colagenase em duas etapas.
Do ponto de vista técnico, o passo mais difícil no procedimento é a cannulação venosa do portal. Quanto às outras etapas, se forem observadas boas práticas e forem tomadas precauções gerais, a estabilidade do isolamento pode ser melhorada. Portanto, a compreensão do raciocínio de cada passo é importante para que o cirurgião possa responder a diversas variáveis que podem ocorrer durante o procedimento.
Vários protocolos para o isolamento de hepatócitos e células não-parenchímicas hepáticas de ratos e camundongos foram publicados 1,2,5,6,7,8,9. As configurações de perfusão utilizadas nesses protocolos apresentaram diversas desvantagens, que incluem o reaproveitamento da tubulação de perfusão, problemas com controle de temperatura, necessidade de otimização rotineira dos parâmetros de perfusão e/ou uso de tipo inadequado de cateter intravenoso (IV) para cannulação venosa portal. O reaproveitamento da tubulação de perfusão aumentará as chances de contaminação, especialmente se a tubulação não foi limpa e desinfetada corretamente. O reaproveitamento de tubos sem substituição de rotina também exporá a configuração de perfusão a problemas como tubos ou conectores com vazamento, armadilha de bolha entupida e tubulação constrito, que reduzirá substancialmente a pressão e a taxa de fluxo perfusadas, afetando assim a eficiência da digestão hepática. Sem uma fonte de calor constante em algumas configurações para controle de temperatura, os buffers pré-aquecidos esfriarão ao longo do tempo, levando a baixa atividade de colagem e digestão. Embora outras configurações utilizem um condensador de vidro com jaqueta conectado a um circulador de água para aquecer o tampão, eles são volumosos e requerem uma limpeza cuidadosa. A temperatura, pressão e taxa de fluxo de tampão que sai do cateter devem ser medidos e otimizados antes do início do isolamento para garantir a condição estável de perfusão. Mesmo após a otimização, os parâmetros ainda podem mudar na metade durante o isolamento devido às ações do operador, levando assim à perfusão e digestão abaixo do tempo. A maioria dos tipos de cateter IV não são adequados para a cannulação venosa portal porque não permitem perfusão contínua durante a cannulação. Eles são incapazes de informar imediatamente o cirurgião quando a cannulação é bem sucedida. Além disso, é desafiador proteger a veia portal no cateter macio sem deformá-la.
Aqui, abordamos esses problemas usando tubos estéreis descartáveis padronizados, uma jaqueta aquecedora de silicone para controle preciso e estável de temperatura, monitoramento e sistema de alarme em tempo real com armazenamento e gerenciamento de dados e uso de um cateter IV especial, que permite perfusão contínua ao perfurar a veia portal durante a cannulação. Pelo que sabemos, somos o primeiro grupo a combinar todos esses recursos em um sistema integrado de perfusão (IPS) compacto, tornando-o altamente portátil e capaz de ser encaixado em um capô de fluxo laminar para garantir a operação asséptica.
Access restricted. Please log in or start a trial to view this content.
Protocolo
Todos os procedimentos e habitação animal foram realizados nos números do protocolo R15-0027 e R19-0669 de acordo com as exigências do Comitê Institucional de Cuidados e Uso de Animais (IACUC) da Universidade Nacional de Cingapura.
1. Elaboração de soluções e instrumentos cirúrgicos
- Prepare buffers e mídia de cultura celular na Tabela 1 usando água ultrapurada.
- Pré-aqueça o tampão sem cálcio e o tampão de colagem até 37 °C em um banho de água antes de usar.
- Autoclave os seguintes instrumentos cirúrgicos e equipamentos de laboratório: um par de tesouras cirúrgicas afiadas, um par de tesoura cirúrgica sem corte, um par de tesouras cirúrgicas curvas, dois pares de fórceps de tecido dente, dois pares de fórceps curvos, dois clipes de veia, uma sutura cirúrgica de seda de 5 cm de comprimento, um filtro de malha de 100 μmlon ny, um 400 m de comprimento 3-0 de seda cirúrgica, um filtro de malha de 100 μmlon ny, um 400 m de comprimento 3-0 de seda cirúrgica, um filtro de malha de 100 μmlon ny, um 400 m de comprimento 3-0 de seda cirúrgica, um filtro de malha de 100 μmlon ny, um 400 m de comprimento 3-0 de seda cirúrgica, um filtro de malha de ny 100 μmlon, um 400 m de comprimento 3-0 de seda cirúrgica, um filtro de malha de ny 100 μmlon, um 400 m de comprimento 3-0 de seda cirúrgica, um filtro de malha de 100 μmlon ny, um 400 m de comprimento 3-0 de seda cirúrgica, um filtro de malha de 10 e um estágio (rack flutuante de tubo de microcentrifuge).
2. Configuração do IPS (ver Figura 1)
- Limpe o capô de fluxo laminar com 70% de etanol. Limpe o IPS com 70% de etanol e mova-o para o capô de fluxo laminar. Esterilizar por UV por >15 min antes de ligar o capô.
ATENÇÃO: A exposição à luz UV pode causar dores nos olhos e queimaduras na pele. Certifique-se de que a faixa está totalmente fechada quando a luz UV estiver acesa. - Monte um novo conjunto de tubos descartáveis no IPS. Enrole o tubo rio abaixo da bomba peristáltica em uma jaqueta de aquecedor de silicone. Monte o monitor de perfusão na tubulação rio abaixo da jaqueta de aquecedor de silicone.
- Certifique-se de que as travas do rolo para ambas as entradas de tubulação estão completamente soltas. Conecte cada entrada de tubulação à extremidade afilada de uma pipeta de aspiração estéril de 2 mL. Deixe tanto as pipetas de aspiração (entradas) quanto o cateter IV (saída) em uma garrafa de 1 L com tampão sem cálcio para permitir a recirculação do tampão durante as etapas subsequentes de escorvamento.
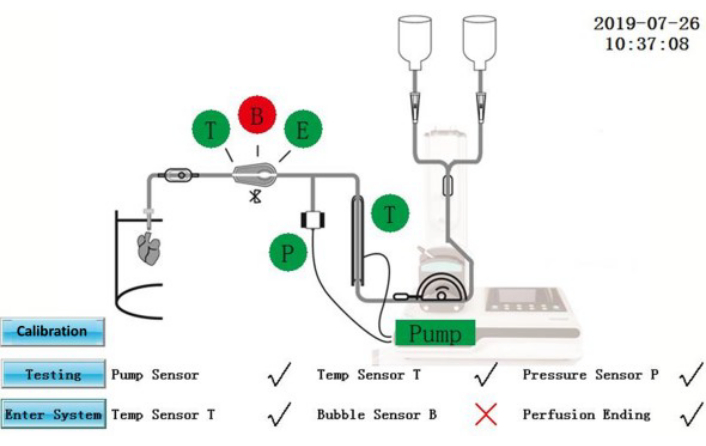
Figura 2: Interface de autoteste. Clique aqui para ver uma versão maior desta figura.
- Ligue o IPS. Execute as seguintes operações no painel de controle da tela de toque. O software realizará um autoteste abrangente toda vez que for iniciado.
ATENÇÃO: O IPS é um equipamento elétrico conectado a uma fonte de energia externa. Derramamentos líquidos nos IPS ou cabos de alimentação podem produzir riscos elétricos.- Certifique-se de que o status do autoteste seja exibido na tela (Figura 2). Os componentes que passaram no autoteste serão mostrados em verde; aqueles que falharam serão mostrados em vermelho. Após a retificação, toque no ícone De teste para repetir o autoteste novamente ou toque no ícone Enter System para inserir diretamente na interface de operação.
- Toque em qualquer lugar da tela para fazer login na interface de operação.
- No canto superior esquerdo da interface de operação (Figura 3), toque em qualquer um dos ícones de seta circular para definir a direção de rotação para a bomba peristáltica. No painel direito da interface, toque nos ícones de seta para cima/para baixo para definir valores para os parâmetros correspondentes. Definir o fluxo para o modo de fluxo constante; temperatura da jaqueta aquecedora a 42 °C (a ser ajustada para garantir que a temperatura do perfusato seja mantida em 37 °C); e velocidade da bomba a 38 rpm para uma vazão de ~33 mL/min.
- No painel inferior direito da interface de operação, verifique o status do alarme de bolha, alarme de parada de perfusão e ícone mudo.
- Verifique a temperatura, pressão e vazão do perfusado no painel esquerdo. Ajuste manualmente os intervalos clicando nas setas para cima na parte superior e inferior das colunas. Verifique os dados em tempo real mostrados como valores no meio das colunas. A cor da coluna passará de verde para vermelho se os dados em tempo real forem além do intervalo definido.
- Localize os ícones para iniciar, pausar e parar a perfusão e o ícone para mudar de exibição de dados em tempo real para o modo gráfico no painel do meio. Toque no ícone iniciar para iniciar a perfusão e prime o tubo com tampão sem cálcio. Um novo log será criado. Digite o nome do arquivo e o nome de usuário na janela pop-up (Figura 4).
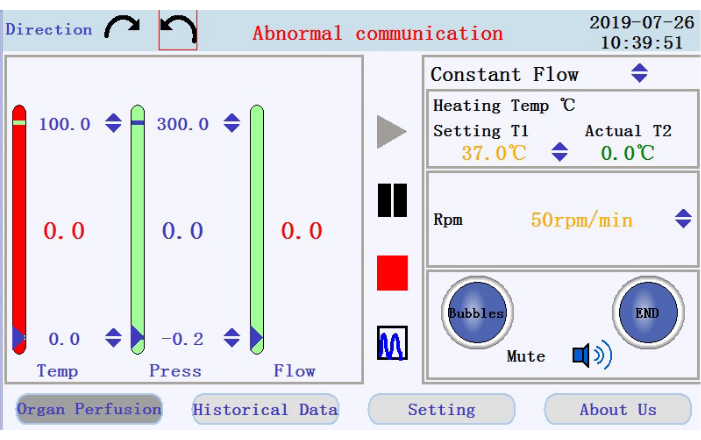
Figura 3: Interface de operação. Clique aqui para ver uma versão maior desta figura.
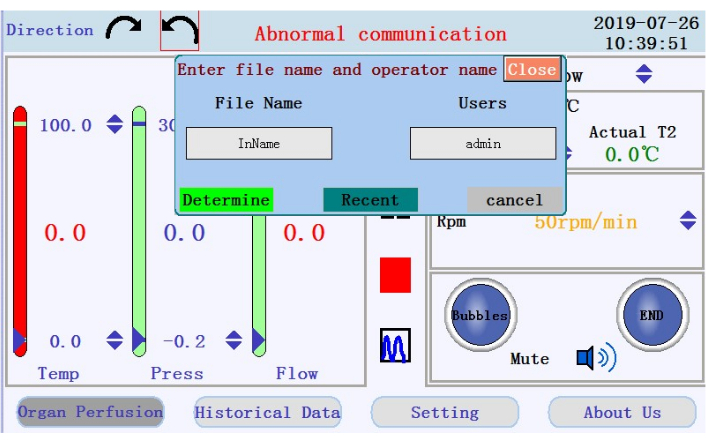
Figura 4: Janela popup solicitando nome de arquivo e nome de usuário. Por favor, clique aqui para ver uma versão maior desta figura.
- Encha a câmara de gotejamento até a metade cheia. Certifique-se de que não há bolsões de ar presos na tubulação durante a escorva.
- Remova qualquer bolha que se forme a jusante do filtro de bolha, piscando na tubulação para desprender a bolha e permitir que ela seja lavada.
NOTA: As bolhas podem se formar ao longo da tubulação à medida que o tampão é aquecido pela jaqueta do aquecedor. - Encha um béquer de 400 mL com 200 mL de tampão de colagenase. Coloque o palco em cima do béquer. Sem introduzir ar na tubulação, aperte completamente o grampo do rolo para uma das entradas de tubulação e mova a pipeta de aspiração para a entrada no béquer.
3. Procedimento animal
- Prepare um rato Wistar macho adulto em torno de 200-300 g em peso corporal.
NOTA: Este protocolo foi otimizado para ratos em torno de 200-300 g em peso corporal. Ratos machos são preferidos, uma vez que alterações hormonais durante o ciclo estrous em ratos fêmeas afetarão a função hepatocita. - Anestesia
- Elaborar o volume necessário de heparina anticoagulante (5.000 UI/mL; 0,2 mL/100 g de peso corporal) e coquetel de cetamina/xilazina de rato (37,5 mg/mL de cetamina, 5 mg/mL de xilazina; 0,2 mL/100 g de peso corporal) em seringas de 1 mL com agulha de 27 G.
ATENÇÃO: Anestesia e heparina são substâncias nocivas. Tenha cuidado ao manusear os sharps. - Contenha o rato. Injetar heparina intraperitoneal seguida de coquetel de cetamina/xilazina no quadrante inferior direito do abdômen.
NOTA: O caecum tem maior probabilidade de estar localizado à esquerda. Evite perfurar o caecum durante a injeção para reduzir o risco de contaminação. - Após 10 min, verifique a profundidade da anestesia avaliando o reflexo do pedal em ambos os pés do rato. Continue verificando de tempos em tempos e espere até que o rato não responda mais aos dedo do dedo do dedo do dedo. Anestesia adicional pode ser injetada, conforme necessário.
- Elaborar o volume necessário de heparina anticoagulante (5.000 UI/mL; 0,2 mL/100 g de peso corporal) e coquetel de cetamina/xilazina de rato (37,5 mg/mL de cetamina, 5 mg/mL de xilazina; 0,2 mL/100 g de peso corporal) em seringas de 1 mL com agulha de 27 G.
- Coloque o rato em uma posição supina com membros estendidos em uma plataforma de poliestireno coberta de papel alumínio em cima de uma bandeja. Grave os pés do rato e fixe a fita firmemente na plataforma com agulhas de 27 G.
- Desinfete o peito e o abdômen pulverizando-os e encharcando-os com 70% de etanol. Barbear-se antes da desinfecção é opcional. Coloque o rato no capô. Continue o próximo passo enquanto a pele ainda estiver molhada.
NOTA: O encharcado com 70% de etanol também mantém o pó de casque e pele ao mínimo. - Separe a pele do músculo.
- Com um par de fórceps de tecido dente em uma mão, levante a pele perto da base do abdômen. Com um par de tesouras cirúrgicas afiadas na outra mão, corte a pele. Empurre a extremidade afiada da tesoura por baixo da pele e faça uma incisão midline na pele de logo acima das patas traseiras para logo abaixo das pernas do ante.
- Ao puxar para cima e esticar levemente a pele com as fórceps, corte qualquer tecido conjuntivo segurando a pele sobre o músculo no peito e abdômen. Para reduzir o risco de contaminação, evite que peles soltas caiam sobre o músculo. Para remover peles soltas acumuladas na tesoura, limpe-as no lado externo da pele desinfetada.
- Faça incisões laterais na pele, da linha média para ambos os lados do rato ligeiramente acima das patas traseiras e ligeiramente abaixo das pernas do ante. Empurre os retalhos da pele para os lados para expor o músculo.
- Abra o músculo abdominal para expor os órgãos.
- Com um novo par de fórceps de tecido dente em uma mão, levante o músculo perto da base do abdômen. Com um par de tesoura cirúrgica sem cortes na outra mão, corte cuidadosamente o músculo sem cortar nenhum dos órgãos. Faça uma incisão no músculo desde um pouco acima das patas traseiras até o esterno.
- Faça incisões laterais no músculo, da linha média para ambos os lados do rato ligeiramente acima das patas traseiras e logo abaixo da caixa torácica, sem cortar nenhum dos órgãos. Empurre os retalhos do músculo para os lados para expor os órgãos. Certifique-se de que as incisões laterais da pele e do músculo cheguem às laterais do rato para permitir que sangue e tampões fluam da cavidade abdominal em etapas posteriores.
- Cannulação venosa portal
- Com a parte de trás das fórceps curvas, empurre suavemente os intestinos para a direita. Vire suavemente os lóbulos do fígado para expor a veia do portal.
- Use uma sutura cirúrgica de seda 3-0 para fazer uma ligadura muito solta ao redor da veia portal perto do fígado, pouco antes dos ramos da veia esquerda e direita em diferentes lóbulos do fígado. Não aperte a ligadura para evitar interromper o fluxo sanguíneo através da veia do portal. Uma membrana muito fina sob o ducto biliar precisará ser quebrada com a ponta dos fórceps curvos antes que a sutura possa passar por baixo e ser enrolada ao redor da veia portal (e do ducto biliar).
- Utilizando as pontas de dois pares de fórceps curvos, puna cuidadosamente um buraco através do tecido sob a veia do portal, sem danificar a veia do portal. Faça isso cerca de 2-3 cm a montante da primeira ligadura, pouco antes da veia gástrica se ramifica da veia portal. O tecido é mais fino neste local específico.
- Estique cuidadosamente o orifício maior com as fórceps. Este orifício permitirá que os fórceps suportem a veia do portal durante a cannulação.
- Reduza a velocidade da bomba para 4 rpm para uma vazão de ~3 mL/min. Certifique-se de que a saída do buffer livre de cálcio do cateter IV seja reduzida a um gotejamento lento.
NOTA: O acúmulo de pressão no fígado causará morte por hepatocitte. Uma taxa de fluxo mais baixa deve retardar o acúmulo de pressão no fígado após a inserção bem sucedida da cânula na veia portal em um passo posterior. - Suporte suavemente a veia do portal usando fórceps. Por outro lado, segure o cateter IV com o bisel da agulha virado para cima. Direcione a agulha para a veia portal em um ângulo de 10-20° e avance lentamente até que todo o bisel esteja dentro da veia. Uma vez que a agulha é inserida corretamente na veia portal, o fígado começará a branquear e perderá sua cor vermelha escura.
NOTA: Todo o bisel da agulha deve ser inserido na veia para criar um orifício grande o suficiente para a inserção da cânula. No entanto, não insira a agulha muito profunda para evitar perfurar a veia. - Avance a cânula sobre a agulha e para a veia. Em seguida, retraia a agulha até que esteja 2-3 mm atrás da cânula; apenas o suficiente para que a ponta afiada esteja segura dentro da cânula. Use o polegar e o dedo médio para segurar o cateter e use o dedo indicador para puxar a asa para puxar a agulha.
- Segure rapidamente a veia do portal no cateter com um grampo de veia. Não corte diretamente no orifício lateral da agulha para evitar interromper o fluxo de perfusato. Em vez disso, clipe abaixo dele.
- Corte imediatamente a veia cava inferior infrahpática (IVC) para evitar o acúmulo de pressão no fígado. Agora, o IVC infra-hepática e os vasos sanguíneos adjacentes serão obscurecidos pelo sangue da veia portal. Para garantir que o IVC foi corretamente cortado e cortado, observe se o sangue jorrava nos pulsos; sangue só vai escorrer para fora de vasos adjacentes.
NOTA: Demorar muito para cortar o IVC infrahático após a cannulação ou falha em cortá-lo antes de passar para o próximo passo causará a morte de hepatócito. O animal é eutanizado sob anestesia por exsanguinação (através do corte do IVC) durante esta etapa. O procedimento deve continuar enquanto a perda de sangue está em andamento. A morte pode ser confirmada pela observação visual da cessação dos batimentos cardíacos/respiração quando a cavidade torácica é aberta em um passo posterior. - Aumente a velocidade da bomba para 38 rpm para uma vazão de ~33 mL/min. Lave o fígado três vezes fechando o IVC com fórceps para 2-3 s (mas não por muito tempo) e reabrindo-o.
NOTA: Durante a lavagem, o fígado se expandirá ligeiramente antes de voltar ao normal. A descarga facilita a permeação de perfusato em todo o fígado. Após a descarga, o fígado deve ser totalmente marrom claro na cor. - Certifique-se de que a ponta da cânula seja colocada antes do ponto onde a veia portal se ramifica em diferentes lóbulos do fígado, para garantir a perfusão de todos os lóbulos do fígado. Se necessário, despreeje a veia do portal e ajuste a posição da cânula. Re-clipe depois.
- Aperte a ligadura solta ao redor da veia do portal, ligeiramente a montante do ponto de ramificação. Faça três nós sobre onde a cânula macia é apoiada pela agulha de metal duro, entre o bevel e o orifício lateral. Certifique-se de que os nós fixam a cânula na posição, protegendo-a na veia do portal e evite o fluxo de buffers.
- Ressecção do fígado inteiro intacto.
- Perfunda o fígado com tampão livre de cálcio na taxa de fluxo de ~33 mL/min para os próximos 12 minutos (ver Figura 5A). Enquanto isso, faça a ressecção hepática. O tempo de perfusão pode ser estendido se necessário, mas certifique-se de que o buffer livre de cálcio não se escora.
- Usando um par de tesouras curvas, desprende cuidadosamente a veia portal dos intestinos cortando a mesenteria que os conecta. Não corte o trato gastrointestinal (esôfago, estômago e intestinos pequenos e grandes) para garantir que não ocorra contaminação.
NOTA: Isto é para evitar que a veia do portal se rasgue quando o fígado é movido durante a ressecção. - Retire o fígado do trato gastrointestinal cortando tecidos conjuntivos, pâncreas e mesenteria que conecta o fígado ao trato gastrointestinal. Para desapegar, corte sempre com uma tesoura e não puxe para rasgar. Novamente, não corte ou corte o trato gastrointestinal.
- Abaixe suavemente o fígado para expor o diafragma. Corte o diafragma seguindo as paredes das costelas. Certifique-se de que a maior parte do diafragma permanece conectada ao fígado. Tenha cuidado para não cutucar ou machucar o fígado.
- Uma vez aberta a cavidade torácica, dois dutos podem ser vistos: o IVC suprahepário esbranquiçado à esquerda, e o esôfago amarelado à direita. Corte o IVC supraháptico e corte-o logo acima do clipe. Cortar o IVC supraháptico é opcional. Evita que a cavidade torácica fique inundada.
NOTA: Observe visualmente a cessação dos batimentos cardíacos/respiração para confirmar a morte animal. - O esôfago está cercado pelo diafragma. Para isolar o esôfago do diafragma, corte o diafragma da direita em direção ao esôfago. Corte todos os tecidos conjuntivos restantes que liguem o esôfago e o estômago ao fígado e diafragma.
- Afaste o trato gastrointestinal para a direita. Transferir o clipe da veia do IVC suprahepático para o IVC infrahético; buffer agora perfuse fora do IVC supraháptico.
NOTA: Durante a perfusão, a cânula e o IVC infrahético serão cobertos pelo fígado. O forte fluxo de buffer do IVC suprahepático ajudará o cirurgião a descartar vazamentos de perfusão. - Corte qualquer diafragma restante que ligue o fígado à cavidade torácica. Corte tecidos que ligam o fígado à cavidade abdominal. Tenha cuidado para não cortar o IVC infrahático acima do clipe para evitar separar o clipe do fígado.
- Para garantir que o fígado esteja completamente ressecado, levante cuidadosamente o fígado segurando o diafragma com fórceps. Se houver algum tecido restante ligando o fígado à cavidade abdominal, corte-os. Se o rim e o baço ainda estiverem ligados ao fígado, desapeça-os.
4. Perfusão e digestão hepática
- Se a ressecção foi concluída mais cedo, espere até que o fígado tenha sido perfundido com tampão livre de cálcio por 12 minutos.
- Altere o tampão de perfusão para o buffer de colagem. Solte completamente o grampo do rolo para o tampão de colagem antes de apertar completamente o grampo do rolo para o tampão livre de cálcio (ver Figura 5B). Uma vez que o tampão de colagem atinge o fígado através da tubulação, lave o fígado três vezes fechando o IVC supraháptico para 2-3 s e reabrindo-o.
- Mova cuidadosamente o fígado para o palco em cima do béquer para recirculação do tampão de colagenase. Mova o fígado segurando o diafragma com fórceps enquanto suporta o cateter. Evite puxar o cateter para evitar o descolamento acidental do cateter.
NOTA: Se o cateter se soltar e a veia portal estiver muito danificada para a re-cannulação, cannulate o IVC suprahepático e permita que o tampão peruuse da veia do portal. Certifique-se de que o IVC infra-hepática permaneça cortado. - Digerir o fígado por 12 minutos. Observe para o aparecimento de manchas translúcidas/rede à medida que o fígado começa a perder sua textura marrom lisa. O fígado vai ficar maior e mais macio à medida que ele é digerido. Uma vez que o fígado tenha uma consistência mole, pare a perfusão. O tempo de digestão pode ser estendido, se necessário.
NOTA: Se a cápsula do Glisson foi quebrada, o tampão de colagem no béquer pode ficar nublado devido a células hepáticas escapou.
5. Isolamento hepatocito
- Remova cuidadosamente a cânula cortando a veia do portal. Remova cuidadosamente o clipe. Transfira o fígado para um prato de 150 mm contendo 60 mL de dulbecco frio do Médio de Águia Modificada (DMEM).
- Bata suavemente o fígado usando a parte de trás das fórceps curvas para quebrar e descascar a cápsula do Glisson. Em seguida, balance suavemente o fígado lado a lado no DMEM para liberar células hepáticas. Continue a fazer isso até que as células hepáticas estejam totalmente dissociadas no DMEM.
NOTA: Ocasionalmente, todo o fígado ou certos lóbulos só serão parcialmente digeridos. Ao não raspar o fígado que removerá à força, e danificar hepatócitos não dissociados, uma viabilidade celular maior e mais consistente pode ser obtida. - Balance suavemente o prato de 150 mm até que as células hepáticas sejam bem distribuídas no DMEM. Para remover pedaços de tecido e aglomerados celulares, despeje a suspensão celular através de um filtro de malha de nylon tamanho 100 μm colocado sobre um novo prato de 150 mm. Enxágüe o prato antigo com 30 mL de DMEM e transfira a suspensão para o filtro de malha. Toque suavemente no filtro de malha para permitir que células hepáticas únicas presas passem.
- Retire o filtro de malha e balance delicadamente o novo prato de 150 mm até que as células hepáticas sejam bem distribuídas. Divida a suspensão igualmente em tubos de 4 x 50 mL. Enxágüe o prato com 30 mL de DMEM e divida a suspensão igualmente nos mesmos tubos. Certifique-se de que cada tubo tenha um volume igual de suspensão celular.
- Centrifugar os tubos de 4 x 50 mL de suspensão celular a 50 x g por 2 min a 4 °C. Aspire cuidadosamente o supernasce sem perturbar a pelota solta. Descarte o supernatante. Adicione 20 mL de DMEM em cada tubo e balance suavemente os tubos para resuspensar a pelota da célula. Misture a suspensão celular de quatro tubos em dois.
- Centrifugar os tubos de 2 x 50 mL a 20 x g por 2 min a 4 °C. Aspire e descarte o supernaspe. Adicione 20 mL de DMEM em cada tubo e balance suavemente os tubos para resuspensar a pelota da célula. Misture a suspensão celular de dois tubos em um. Mantenha as células no gelo até usar.
- Prepare a solução azul trypan misturando 400 μL de 1x PBS com 50 μL de azul trypan. Adicione 50 μL de suspensão de hepatocitte na solução azul trypan. Conte o número de hepatócitos viáveis e mortos com um hemótmetro sob o microscópio de luz.
6. Cultura hepatocita
- Realize todos os passos de cultura celular no capô. Adicione 1 mL de solução de revestimento de colágeno em uma prato de 35 mm e incubar por 4h. Enxágüe os pratos três vezes com 1x PBS.
- Diluir a suspensão do hepatocito em meio de cultura hepatocitada a uma concentração de 0,8 milhões de células/mL. Adicione 1 mL de suspensão de hepatocitado diluída no prato de 35 mm.
NOTA: Os hepatócitos são sensíveis ao estresse da tesoura durante a pipetação. Considere usar pontas largas de pipeta de furo. - Arrase o prato para distribuir os hepatócitos uniformemente. Incubar a 37 °C, 5% de CO2 por 3-4 h para permitir que os hepatócitos se conectem.
- Para a cultura do sanduíche.
- Remova o meio de cultura hepatocita. Enxágüe uma vez com 1 mL de cultura hepatócica para remover células nãoectadas. Adicione 1 mL de solução de sobreposição de colágeno. Adicione a solução de sobreposição de colágeno nas paredes do prato para evitar a introdução de bolhas na solução.
- Incubar a 37 °C, 5% de CO2 durante a noite para permitir a gelação de colágeno.
- Adicione 1 mL de meio de cultura hepatócica fresca. Incubar a 37 °C, 5% de CO2.
- Para a cultura da monocamadas.
- Após a etapa 6.3, remova o meio de cultura hepatocitte. Enxágüe uma vez com 1 mL de cultura hepatócica para remover as células nãoectadas.
- Adicione 1 mL de meio de cultura hepatócica fresca. Incubar a 37 °C, 5% de CO2.
- Avalie a pureza e a função hepatócidas realizando imunostaining para marcador específico de hepatócito e ensaios funcionais, conforme descrito anteriormente10,11.
Access restricted. Please log in or start a trial to view this content.
Resultados
Um cirurgião poderia dizer se a perfusão hepática está acontecendo sem problemas observando o resultado após certos passos. O primeiro desfecho pode ser observado após a canulação, corte do IVC infrahético e restauração da vazão de perfusão. O fígado deve ter mudado completamente a cor do vermelho escuro para o marrom, mantendo seu volume. Se o fígado parece ligeiramente deflacionado e tem uma tonalidade avermelhada ou manchas de vermelho, significa que a taxa de fluxo de perfusão foi definida erroneament...
Access restricted. Please log in or start a trial to view this content.
Discussão
Existem alguns pontos que são particularmente importantes de se observar para o procedimento de coagem de duas etapas em geral. Em primeiro lugar, deve-se dar um cuidado especial ao resseccionar o fígado. Certifique-se de que o trato gastrointestinal não esteja danificado, pois o vazamento do conteúdo resultará em contaminação bacteriana. Além disso, evite danificar a cápsula do Glisson, que cobre a superfície do fígado durante o procedimento animal. Se a lágrima for grande o suficiente, pode permitir a liber...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Zhou Yan e Hanry Yu declaram interesses concorrentes, pois detêm capital próprio em Vasinfuse, que fabrica e comercializa o Sistema Integrado de Perfusão. Hanry Yu detém equidade em Histoindex, Invitrocue, Osteopore, Pishon Biomedical, Ants Inovar e Synally Futuristech que não têm interesses concorrentes com as informações aqui relatadas.
Agradecimentos
Este trabalho é apoiado em parte pelo MOE ARC (MOE2017-T2-1-149); NuHS Innovation Seed Grant 2017 (NUHSRO/2017/051/InnovSeed/02); Instituto de Mecanobiologia de Cingapura (R-714-106-004-135); e Instituto de Bioengenharia e Nanotecnologia, Conselho de Pesquisa Biomédica, Agência de Ciência, Tecnologia e Pesquisa (A*STAR) (Projeto Números IAF-PP H18/01/a0/014, IAF-PP H18/01/a0/K14 e MedCaP-LOA-18-02) para Hanry Yu. Ng Chan Way é um pesquisador da Universidade Nacional de Singapura. Gostaríamos de agradecer à Unidade de Microscopia Confocal & Unidade de Citometria de Fluxo da Universidade Nacional de Cingapura por ajuda e aconselhamento na análise da pureza hepatocyte.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| Material/Equipment | |||
| 1 mL syringe | Nipro | ||
| 27G needle | Nipro | ||
| Black braided silk non-absorbable, non-sterile surgical suture | Look | SP117 | |
| Bochem 18/10 stainless steel forceps, sharp tip contain bent round tip | Bochem | 10333511 | |
| Disposable Perfusion Set | Vasinfuse | BPF-112 | |
| Floating circular 1.5 mL microcentrifuge tube rack | Sigma-Aldrich | R3133 | |
| German Standard Tissue Forceps, Serrated / 1×2 teeth , 14.5cm | Walentech | ||
| Greiner Cellstar aspirating pipette | Merck | GN710183 | |
| Haemocytometer | |||
| Integrated Perfusion System | Vasinfuse | IPS-001 | |
| Iris Scissors curved, stainless, 11cm | Optimal Medical Products Pte Ltd | CVD | |
| Light microscope with 10X lens | Olympus | ||
| Mesh Sheet 100µM Nylon | Spectra-Teknic(s) Pte Ltd | 06630-75 | |
| Operating Scissors, BL/BL, 13cm | Optimal Medical Products Pte Ltd | STR – BL/BL | |
| Operating Scissors, SH/BL, 13cm | Optimal Medical Products Pte Ltd | STR – SH/BL | |
| Reverse force hemostatic clip | Shanghai Jin Zhong Pte Ltd | XEC230 | |
| Water bath | Grant | ||
| Reagents/Chemicals | |||
| 10X Phosphate buffered saline (PBS) | Sigma-Aldrich | ||
| Bovine serum albumin (BSA) | Sigma-Aldrich | A9056 | |
| CaCl2·2H2O | Merck | 137101 | |
| Collagenase Type IV | Gibco | 17104019 | |
| Dexamethasone | TCI | D1961 | |
| DMEM | Gibco | 31600-034 | |
| Glutamax | Gibco | 35050061 | |
| HEPES | Invitrogen | 11344-041 | |
| Insulin | Sigma-Aldrich | 1-9278 | |
| KCl | VWR | VWRC26764.298 | |
| KH2PO4 | Sigma-Aldrich | P5379 | |
| Linoleic acid | Sigma-Aldrich | L9530 | |
| NaCl | Sigma-Aldrich | S5886 | |
| NaHCO3 | Sigma-Aldrich | S8875 | |
| NaOH | Merck | 106462 | |
| Penicillin-Streptomycin | Sigma-Aldrich | P4333 | |
| Type I bovine collagen | Advanced BioMatrix | 5005-100ml | |
| William’s E Media | Sigma-Aldrich | W1878 |
Referências
- Shen, L., Hillebrand, A., Wang, D. Q. H., Liu, M. Isolation and primary culture of rat hepatic cells. Journal of Visualized Experiments: JoVE. (64), e3917(2012).
- Cabral, F., et al. Purification of hepatocytes and sinusoidal endothelial cells from mouse liver perfusion. Journal of Visualized Experiments: JoVE. (132), e56993(2018).
- Green, C. J., et al. The isolation of primary hepatocytes from human tissue: optimising the use of small non-encapsulated liver resection surplus. Cell and Tissue Banking. 18 (4), 597-604 (2017).
- Seglen, P. O. Preparation of isolated rat liver cells. Methods in Cell Biology. 13, 29-83 (1976).
- Gopalakrishnan, S., Harris, E. N. In vivo liver endocytosis followed by purification of liver cells by liver perfusion. Journal of Visualized Experiments: JoVE. (57), e3138(2011).
- Wen, J. W., Olsen, A. L., Perepelyuk, M., Wells, R. G. Isolation of rat portal fibroblasts by in situ liver perfusion. Journal of Visualized Experiments: JoVE. (64), e3669(2012).
- Korelova, K., Jirouskova, M., Sarnova, L., Gregor, M. Isolation and 3D collagen sandwich culture of primary mouse hepatocytes to study the role of cytoskeleton in bile canalicular formation in vitro. Journal of Visualized Experiments: JoVE. (154), e60501(2019).
- Shi, W., et al. Isolation and purification of immune cells from the liver. International Immunopharmacology. 85 (95), 106632(2020).
- Salem, E. S. B., et al. Isolation of primary mouse hepatocytes for nascent protein synthesis analysis by non-radioactive L-azidohomoalanine labeling method. Journal of Visualized Experiments: JoVE. (140), e58323(2018).
- Xia, L., et al. Tethered spheroids as an in vitro hepatocyte model for drug safety screening. Biomaterials. 33 (7), 2165-2176 (2012).
- Kegel, V., et al. Protocol for isolation of primary human hepatocytes and corresponding major populations of non-parenchymal liver cells. Journal of Visualized Experiments: JoVE. (109), e53069(2016).
- Zhu, L., et al. A vertical-flow bioreactor array compacts hepatocytes for enhanced polarity and functions. Lab on a Chip. 16 (20), 3898-3908 (2016).
- Du, Y., et al. Synthetic sandwich culture of 3D hepatocyte monolayer. Biomaterials. 29 (3), 290-301 (2008).
- Tong, W. H., et al. Constrained spheroids for prolonged hepatocyte culture. Biomaterials. 80, 106-120 (2016).
- Xia, L., et al. Laminar-flow immediate-overlay hepatocyte sandwich perfusion system for drug hepatotoxicity testing. Biomaterials. 30 (30), 5927-5936 (2009).
- Gupta, K., et al. Bile canaliculi contract autonomously by releasing calcium into hepatocytes via mechanosensitive calcium channel. Biomaterials. 259, 120283(2020).
- Horner, R., et al. Impact of Percoll purification on isolation of primary human hepatocytes. Scientific Reports. 9 (1), 6542(2019).
- Osypiw, J. C., et al. Subpopulations of rat hepatocytes separated by Percoll density-gradient centrifugation show characteristics consistent with different acinar locations. The Biochemical Journal. 304, Pt 2 617-624 (1994).
- Beal, E. W., et al. A small animal model of ex vivo normothermic liver perfusion. Journal of Visualized Experiments: JoVE. (136), e57541(2018).
- Hillebrandt, K., et al. Procedure for decellularization of rat livers in an oscillating-pressure perfusion device. Journal of Visualized Experiments: JoVE. (102), e53029(2015).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados