Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Isolement des hépatocytes primaires de rat avec contrôle de perfusion multiparamétrique
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Ce protocole détaille l’utilisation d’un cathéter intraveineux spécial, d’un tube jetable stérile standardisé, d’un contrôle de la température complété par une surveillance en temps réel et d’un système d’alarme pour la procédure de perfusion de collagénase en deux étapes afin d’améliorer la cohérence de la viabilité, du rendement et de la fonctionnalité des hépatocytes primaires isolés chez le rat.
Résumé
Les hépatocytes primaires sont largement utilisés dans la recherche fondamentale sur les maladies du foie et pour les tests de toxicité in vitro. La procédure de perfusion de collagénase en deux étapes pour l’isolement primaire des hépatocytes est techniquement difficile, en particulier dans la canulation veineuse porte. La procédure est également sujette à une contamination occasionnelle et à des variations des conditions de perfusion en raison de difficultés d’assemblage, d’optimisation ou de maintenance de la configuration de perfusion. Ici, un protocole détaillé pour une procédure améliorée de perfusion de collagénase en deux étapes avec contrôle de perfusion multiparamétrique est présenté. Les hépatocytes primaires de rat ont été isolés avec succès et de manière fiable en prenant les précautions techniques nécessaires aux étapes critiques de la procédure, en réduisant la difficulté opérationnelle et en atténuant la variabilité des paramètres de perfusion grâce à l’adoption d’un cathéter intraveineux spécial, d’un tube jetable stérile normalisé, d’un contrôle de la température et d’un système de surveillance et d’alarme en temps réel. Les hépatocytes primaires isolés chez le rat présentent systématiquement une viabilité cellulaire élevée (85%-95%), un rendement (2-5 x 108 cellules pour 200-300 g de rat) et une fonctionnalité (activité albumine, urée et CYP). La procédure a été complétée par un système de perfusion intégré, suffisamment compact pour être installé dans la hotte à flux laminaire afin d’assurer un fonctionnement aseptique.
Introduction
Les hépatocytes primaires sont des outils importants pour la recherche fondamentale liée au foie, le traitement des maladies et l’application telles que les tests de dépistage de médicaments. L’étalon-or actuel pour l’isolement primaire des hépatocytes est la procédure de perfusion de collagénase en deux étapes 1,2,3 introduite par Seglen dans les années 1970 4. Cependant, cette procédure est techniquement difficile et a un taux d’échec élevé lorsqu’elle est effectuée par des chirurgiens novices. Même lorsqu’une perfusion est considérée comme réussie, des différences drastiques dans la viabilité des hépatocytes (généralement 60% à 95%) et le rendement (0,5 à 5 x 108 pour un rat de 200 à 300 g) peuvent être observées entre les isolements. Cela influence la qualité et l’échelle des expériences en aval. Outre la procédure technique, la configuration de perfusion utilisée pour l’isolement, disponible dans le commerce ou sur mesure, est un facteur contributif. Une attention particulière doit être accordée à l’assemblage, à l’optimisation et à la maintenance de la configuration de perfusion. Le but de ce protocole est d’améliorer le taux de réussite et la stabilité entre les isolements d’hépatocytes primaires de rat grâce au contrôle de perfusion multiparamétrique de la procédure technique et à la configuration de perfusion de la procédure de perfusion de collagénase en deux étapes.
Du point de vue technique, l’étape la plus difficile de la procédure est la canulation de la veine porte. En ce qui concerne les autres étapes, si les bonnes pratiques sont observées et que des précautions générales sont prises, la stabilité de l’isolement peut être améliorée. Par conséquent, la compréhension du raisonnement pour chaque étape est importante afin que le chirurgien puisse répondre à diverses variables qui peuvent survenir pendant la procédure.
Divers protocoles pour l’isolement des hépatocytes et des cellules non parenchymateuses du foie du rat et de la souris ont été publiés 1,2,5,6,7,8,9. Les configurations de perfusion utilisées dans ces protocoles présentaient plusieurs inconvénients, notamment la réutilisation des tubes de perfusion, des problèmes de contrôle de la température, la nécessité d’une optimisation de routine des paramètres de perfusion et / ou l’utilisation d’un type inapproprié de cathéter intraveineux (IV) pour la canulation veineuse portale. La réutilisation des tubes de perfusion augmentera les risques de contamination, surtout si les tubes n’ont pas été nettoyés et désinfectés correctement. La réutilisation des tubes sans remplacement de routine exposera également la configuration de perfusion à des problèmes tels que des tubes ou des connecteurs qui fuient, un piège à bulles bouché et un tube rétréci, ce qui réduira considérablement la pression et le débit du perfusat, affectant ainsi l’efficacité de la digestion du foie. Sans source de chaleur constante dans certaines configurations pour le contrôle de la température, les tampons préchauffés se refroidiront au fil du temps, ce qui entraînera une faible activité et digestion de la collagénase. Bien que d’autres configurations utilisent un condenseur en verre gainé connecté à un circulateur d’eau pour réchauffer le tampon, elles sont encombrantes et nécessitent un nettoyage minutieux. La température, la pression et le débit du tampon sortant du cathéter doivent être mesurés et optimisés avant le début de l’isolement pour assurer une condition de perfusion stable. Même après optimisation, les paramètres pourraient encore changer à mi-chemin pendant l’isolement en raison des actions de l’opérateur, conduisant ainsi à une perfusion et à une digestion sous-optimales. La plupart des types de cathéter IV ne conviennent pas à la canulation veineuse porte car ils ne permettent pas une perfusion continue pendant la canulation. Ils sont incapables d’informer immédiatement le chirurgien lorsque la canulation est réussie. De plus, il est difficile de fixer la veine porte sur le cathéter souple sans le déformer.
Ici, nous abordons ces problèmes en utilisant des tubes stériles jetables standardisés, une gaine chauffante en silicone pour un contrôle précis et stable de la température, un système de surveillance et d’alarme en temps réel avec stockage et gestion des données et l’utilisation d’un cathéter IV spécial, qui permet une perfusion continue tout en perforant la veine porte pendant la canulation. À notre connaissance, nous sommes le premier groupe à combiner toutes ces caractéristiques dans un système de perfusion intégré (IPS) compact, ce qui le rend très portable et capable d’être intégré dans une hotte à flux laminaire pour assurer un fonctionnement aseptique.
Protocole
Toutes les procédures et le logement des animaux ont été effectués sous les numéros de protocole R15-0027 et R19-0669 conformément aux exigences du Comité institutionnel de soins et d’utilisation des animaux (IACUC) de l’Université nationale de Singapour.
1. Préparation de solutions et d’instruments chirurgicaux
- Préparer les tampons et les milieux de culture cellulaire dans le tableau 1 en utilisant de l’eau ultrapure.
- Préchauffer le tampon sans calcium et le tampon de collagénase à 37 °C au bain-marie avant utilisation.
- Autoclavez les instruments chirurgicaux et l’équipement de laboratoire suivants: une paire de ciseaux chirurgicaux tranchants-émoussés, une paire de ciseaux chirurgicaux émoussés, une paire de ciseaux chirurgicaux incurvés, deux paires de pinces à tissu dentaire, deux paires de pinces incurvées, deux clips veineux, une suture chirurgicale en soie 3-0 de 5 cm de long, un filtre en maille de nylon de 100 μm, un bécher de 400 mL, et une scène (rack de tubes en microcentrifugeuse flottante).
2. Configuration de l’IPS (voir Figure 1)
- Essuyez la hotte à flux laminaire avec 70% d’éthanol. Essuyez l’IPS avec 70% d’éthanol et déplacez-le dans la hotte à flux laminaire. Stériliser par UV pendant >15 min avant d’allumer la hotte.
ATTENTION: L’exposition à la lumière UV peut causer des yeux douloureux et des brûlures de la peau. Assurez-vous que le châssis est complètement fermé lorsque la lumière UV est allumée. - Assemblez un nouvel ensemble de tubes jetables sur l’IPS. Enveloppez le tube en aval de la pompe péristaltique dans une gaine chauffante en silicone. Assemblez le moniteur de perfusion sur le tube en aval de la gaine chauffante en silicone.
- Assurez-vous que les pinces à rouleaux pour les deux entrées de tuyauterie sont complètement desserrées. Raccordez chaque entrée de tuyau à l’extrémité effilée d’une pipette d’aspiration stérile de 2 mL. Laissez les deux pipettes d’aspiration (entrées) et le cathéter IV (sortie) dans un flacon de 1 L avec tampon sans calcium pour permettre la recirculation du tampon pendant les étapes d’amorçage suivantes.
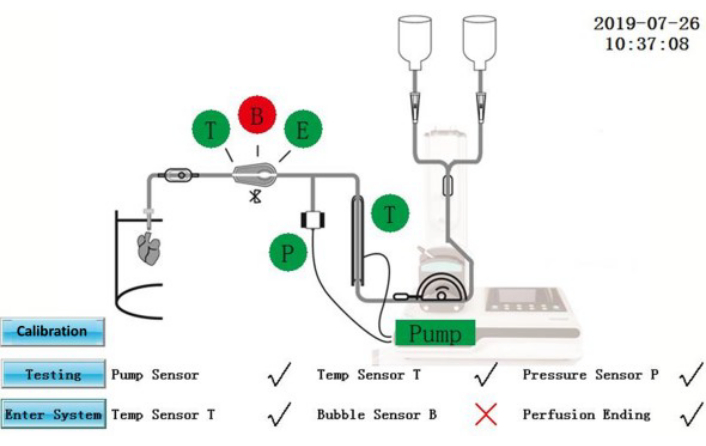
Figure 2 : Interface d’auto-test. Cliquez ici pour afficher une version agrandie de cette figure.
- Allumez l’IPS. Effectuez les opérations suivantes sur le panneau de commande de l’écran tactile. Le logiciel effectuera un auto-test complet chaque fois qu’il est démarré.
ATTENTION : L’IPS est un équipement électrique qui est connecté à une source d’alimentation externe. Les déversements de liquide sur l’IPS ou les câbles d’alimentation peuvent présenter des risques électriques.- Assurez-vous que l’état de l’autotest s’affiche à l’écran (Figure 2). Les composants qui ont réussi l’autotest seront affichés en vert; ceux qui ont échoué seront affichés en rouge. Après la rectification, appuyez sur l’icône Test pour répéter l’auto-test à nouveau ou appuyez sur l’icône Entrer dans le système pour entrer directement dans l’interface d’exploitation.
- Appuyez n’importe où sur l’écran pour vous connecter à l’interface d’exploitation.
- Dans le coin supérieur gauche de l’interface de commande (Figure 3), appuyez sur l’une des icônes fléchées circulaires pour définir le sens de rotation de la pompe péristaltique. Dans le panneau de droite de l’interface, appuyez sur les icônes fléchées haut/bas pour définir les valeurs des paramètres correspondants. Réglez le flux en mode d’écoulement constant; température de la gaine chauffante à 42 °C (à régler pour s’assurer que la température du perfusat est maintenue à 37 °C); et la vitesse de la pompe à 38 tr/min pour un débit d’environ 33 mL/min.
- Dans le panneau inférieur droit de l’interface de commande, vérifiez l’état de l’alarme à bulle, de l’alarme d’arrêt de perfusion et de l’icône de mise en sourdine.
- Vérifiez la température, la pression et le débit du perfusat dans le panneau de gauche. Définissez manuellement les intervalles en cliquant sur les flèches haut-bas en haut et en bas des colonnes. Vérifiez les données en temps réel affichées sous forme de valeurs au milieu des colonnes. La couleur de la colonne passera du vert au rouge si les données en temps réel dépassent la plage définie.
- Localisez les icônes pour démarrer, mettre en pause et arrêter la perfusion, et l’icône pour passer de l’affichage des données en temps réel au mode graphique dans le panneau central. Appuyez sur l’icône de démarrage pour commencer la perfusion et amorcer le tube avec un tampon sans calcium. Un nouveau journal sera créé. Entrez le nom de fichier et le nom d’utilisateur dans la fenêtre contextuelle (Figure 4).
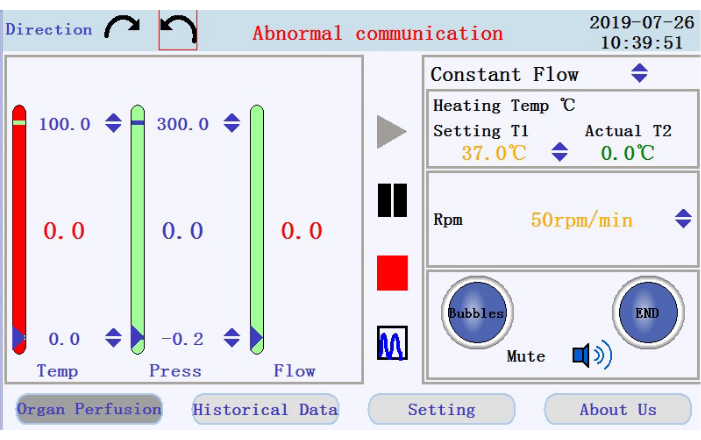
Figure 3 : Interface de fonctionnement. Cliquez ici pour l’agrandir.
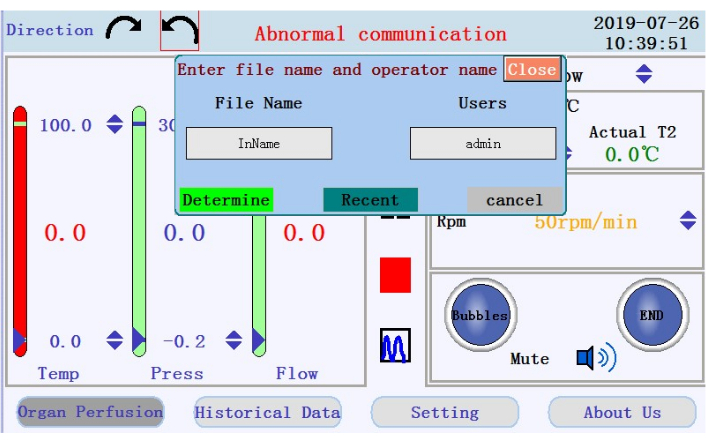
Figure 4 : Fenêtre contextuelle vous invitant à entrer le nom de fichier et le nom d’utilisateur. Cliquez ici pour afficher une version plus grande de cette figure.
- Remplissez la chambre d’égouttement à moitié pleine. Assurez-vous qu’il n’y a pas de poches d’air piégées dans le tuyau pendant l’amorçage.
- Retirez toute bulle qui se forme en aval du filtre à bulles en agitant sur le tube pour détacher la bulle et permettre de la débusquer.
REMARQUE: Des bulles peuvent se former le long du tube lorsque le tampon est réchauffé par la gaine de chauffage. - Remplissez un bécher de 400 mL avec 200 mL de tampon de collagénase. Placez la scène sur le dessus du bécher. Sans introduire d’air dans le tube, serrez complètement la pince à rouleaux pour l’une des entrées de tuyau et déplacez la pipette d’aspiration pour l’entrée dans le bécher.
3. Procédure animale
- Préparez un jeune rat Wistar mâle adulte d’environ 200 à 300 g de poids corporel.
REMARQUE: Ce protocole a été optimisé pour les rats pesant entre 200 et 300 g. Les rats mâles sont préférés car les changements hormonaux au cours du cycle œstral chez les rats femelles affecteront la fonction hépatocytaire. - Anesthésie
- Prélever le volume requis d’héparine anticoagulante (5 000 UI/mL ; 0,2 mL/100 g de poids corporel) et de cocktail de kétamine/xylazine d’anesthésie de rat (37,5 mg/mL de kétamine, 5 mg/mL de xylazine ; 0,2 mL/100 g de poids corporel) dans des seringues de 1 mL avec aiguille de 27 G.
ATTENTION : L’anesthésie et l’héparine sont des substances nocives. Soyez prudent lorsque vous manipulez des objets tranchants. - Retenez le rat. Injecter par voie intrapéritonéalement de l’héparine suivie d’un cocktail kétamine/xylazine dans le quadrant inférieur droit de l’abdomen.
REMARQUE: Le caecum a une probabilité plus élevée d’être situé à gauche. Évitez de perforer le caecum pendant l’injection pour réduire le risque de contamination. - Après 10 min, vérifiez la profondeur de l’anesthésie en évaluant le réflexe de pédale sur les deux pieds du rat. Continuez à vérifier de temps en temps et attendez que le rat ne réponde plus aux pincements d’orteils. Une anesthésie supplémentaire peut être injectée, si nécessaire.
- Prélever le volume requis d’héparine anticoagulante (5 000 UI/mL ; 0,2 mL/100 g de poids corporel) et de cocktail de kétamine/xylazine d’anesthésie de rat (37,5 mg/mL de kétamine, 5 mg/mL de xylazine ; 0,2 mL/100 g de poids corporel) dans des seringues de 1 mL avec aiguille de 27 G.
- Placez le rat en position couchée avec les membres tendus sur une plate-forme en polystyrène recouverte de papier d’aluminium au-dessus d’un plateau. Collez les pieds du rat et épinglez le ruban solidement sur la plate-forme avec des aiguilles de 27 G.
- Désinfectez la poitrine et l’abdomen en les pulvérisant et en les trempant avec de l’éthanol à 70%. Le rasage avant la désinfection est facultatif. Mettez le rat dans le capot. Continuez l’étape suivante pendant que la fourrure est encore mouillée.
REMARQUE: Tremper avec de l’éthanol à 70% réduit également au minimum les squames et la poussière de fourrure. - Séparez la peau du muscle.
- Avec une paire de pinces dents-tissu dans une main, soulevez la peau près de la base de l’abdomen. Avec une paire de ciseaux chirurgicaux tranchants et émoussés dans l’autre main, coupez la peau de la tente. Poussez l’extrémité pointue des ciseaux sous la peau et faites une incision médiane sur la peau juste au-dessus des pattes postérieures jusqu’à juste en dessous des pattes antérieures.
- Tout en tirant vers le haut et en étirant légèrement la peau avec la pince, coupez tout tissu conjonctif qui maintient la peau sur le muscle de la poitrine et de l’abdomen. Pour réduire le risque de contamination, empêchez la fourrure lâche de tomber sur le muscle. Pour enlever la fourrure lâche accumulée sur les ciseaux, essuyez-les sur la face extérieure désinfectée de la peau.
- Faites des incisions latérales sur la peau, de la ligne médiane aux deux côtés du rat légèrement au-dessus des pattes postérieures et légèrement en dessous des pattes antérieures. Poussez les lambeaux de peau sur les côtés pour exposer le muscle.
- Coupez le muscle abdominal pour exposer les organes.
- Avec une nouvelle paire de pinces dents-tissu dans une main, soulevez le muscle près de la base de l’abdomen. Avec une paire de ciseaux chirurgicaux émoussés dans l’autre main, coupez soigneusement à travers le muscle sans entailler aucun des organes. Faites une incision médiane sur le muscle de légèrement au-dessus des pattes postérieures jusqu’au sternum.
- Faites des incisions latérales sur le muscle, de la ligne médiane aux deux côtés du rat légèrement au-dessus des pattes postérieures et juste en dessous de la cage thoracique, sans entailler aucun des organes. Poussez les lambeaux de muscle sur les côtés pour exposer les organes. Assurez-vous que les incisions latérales de la peau et des muscles atteignent les côtés du rat pour permettre au sang et aux tampons de s’écouler de la cavité abdominale à des étapes ultérieures.
- Canulation veineuse portale
- Avec l’arrière de la pince incurvée, poussez doucement les intestins vers la droite. Retournez doucement les lobes du foie pour exposer la veine porte.
- Utilisez une suture chirurgicale en soie 3-0 pour faire une ligature très lâche autour de la veine porte près du foie, juste avant que la veine ne se ramifie à gauche et à droite dans différents lobes du foie. Ne resserrez pas la ligature pour éviter de perturber le flux sanguin dans la veine porte. Une membrane très mince sous le canal biliaire devra être percée avec l’extrémité de la pince incurvée avant que la suture puisse passer en dessous et être enroulée autour de la veine porte (et du canal biliaire).
- À l’aide des extrémités de deux paires de pinces incurvées, perforez soigneusement un trou à travers le tissu sous la veine porte, sans endommager la veine porte. Faites-le environ 2-3 cm en amont de la première ligature, juste avant que la veine gastrique ne se ramifie de la veine porte. Le tissu est plus mince à cet endroit spécifique.
- Étirez soigneusement le trou plus grand avec les pinces. Ce trou permettra aux pinces de soutenir la veine porte pendant la canulation.
- Réduisez la vitesse de la pompe à 4 tr/min pour un débit d’environ 3 mL/min. Assurez-vous que l’écoulement du tampon sans calcium du cathéter IV est réduit à un écoulement lent.
REMARQUE: L’accumulation de pression dans le foie provoquera la mort des hépatocytes. Un débit plus faible devrait ralentir l’accumulation de pression dans le foie lors de l’insertion réussie de la canule dans la veine porte à une étape ultérieure. - Soutenez doucement la veine porte à l’aide de pinces. Avec l’autre main, tenez le cathéter IV avec le biseau de l’aiguille vers le haut. Dirigez l’aiguille dans la veine porte à un angle de 10 à 20 ° et avancez lentement jusqu’à ce que tout le biseau soit à l’intérieur de la veine. Une fois que l’aiguille est insérée correctement dans la veine porte, le foie commencera à blanchir et à perdre sa couleur rouge foncé.
REMARQUE: Le biseau entier de l’aiguille doit être inséré dans la veine pour créer un trou assez grand pour l’insertion de la canule. Cependant, n’insérez pas l’aiguille trop profondément pour éviter de trop perforer la veine. - Avancez la canule sur l’aiguille et dans la veine. Ensuite, rétractez l’aiguille jusqu’à ce qu’elle soit à 2-3 mm derrière la canule; juste assez pour que la pointe pointue soit en toute sécurité dans la canule. Utilisez le pouce et le majeur pour tenir le cathéter et utilisez l’index pour tirer l’aile en arrière et rétracter l’aiguille.
- Fixez rapidement la veine porte sur le cathéter à l’aide d’un clip veineux. Ne pas clipser directement sur le trou latéral de l’aiguille pour éviter de perturber l’écoulement du perfusat. Au lieu de cela, coupez en dessous.
- Coupez immédiatement la veine cave inférieure infrahépatique (IVC) pour empêcher l’accumulation de pression dans le foie. À l’heure actuelle, la CIV infrahépatique et les vaisseaux sanguins adjacents seront obscurcis par le sang de la veine porte. Pour s’assurer que la CIV a été correctement coupée et sectionnée, observez les impulsions de sang; le sang ne s’écoulera que des vaisseaux adjacents.
REMARQUE: Prendre trop de temps pour couper la CIV infrahépatique après la canulation ou ne pas la couper avant de passer à l’étape suivante provoquera la mort des hépatocytes. L’animal est euthanasié sous anesthésie par exsanguination (par la coupe de la CIV) au cours de cette étape. La procédure doit se poursuivre pendant que la perte de sang est en cours. La mort peut être confirmée par l’observation visuelle de l’arrêt du rythme cardiaque / respiration lorsque la cavité thoracique est ouverte à une étape ultérieure. - Augmentez la vitesse de la pompe à 38 tr/min pour un débit d’environ 33 mL/min. Rincez le foie trois fois en fermant la CIV avec une pince pendant 2-3 s (mais pas trop longtemps) et en la rouvrant.
REMARQUE: Pendant les bouffées vasomotrices, le foie va légèrement se dilater avant de revenir à la normale. Le rinçage facilite la perméation du perfusat dans tout le foie. Après le rinçage, le foie doit être entièrement de couleur brun clair. - Assurez-vous que l’extrémité de la canule est placée avant le point où la veine porte se ramifie en différents lobes du foie, pour assurer la perfusion de tous les lobes du foie. Si nécessaire, déclipsez la veine porte et ajustez la position de la canule. Re-clip par la suite.
- Resserrer la ligature lâche autour de la veine porte, légèrement en amont du point de ramification. Faites trois nœuds à l’endroit où la canule souple est soutenue par l’aiguille en métal dur, entre le biseau et le trou latéral. Assurez-vous que les nœuds fixent la canule en position, en la fixant à la veine porte et en empêchant le reflux des tampons.
- Réséquez tout le foie intact.
- Perfuser le foie avec un tampon sans calcium à un débit d’environ 33 mL/min pendant les 12 minutes suivantes (voir la figure 5A). En attendant, effectuez une résection du foie. Le temps de perfusion peut être prolongé si nécessaire, mais assurez-vous que le tampon sans calcium ne s’épuise pas.
- À l’aide d’une paire de ciseaux incurvés, détachez soigneusement la veine porte des intestins en coupant le mésentère qui les relie entre eux. Ne pas entailler le tractus gastro-intestinal (œsophage, estomac et petit et gros intestin) pour vous assurer qu’aucune contamination ne se produit.
REMARQUE: Ceci est pour empêcher la veine porte de se déchirer lorsque le foie est déplacé pendant la résection. - Détachez le foie du tractus gastro-intestinal en coupant les tissus conjonctifs, le pancréas et le mésentère qui relie le foie au tractus gastro-intestinal. Pour vous détacher, coupez toujours avec des ciseaux et ne tirez pas pour vous déchirer. Encore une fois, ne pas entailler ou couper le tractus gastro-intestinal.
- Retournez doucement le foie pour exposer le diaphragme. Coupez le diaphragme en suivant les parois des côtes. Assurez-vous que la majeure partie du diaphragme reste connectée au foie. Veillez à ne pas piquer ou meurtrir le foie.
- Une fois la cavité thoracique ouverte, deux canaux peuvent être vus: le CIV suprahépatique blanchâtre à gauche et l’œsophage jaunâtre à droite. Coupez l’IVC suprahépatique et coupez-le juste au-dessus du clip. L’écrêtage de la CIV suprahépatique est facultatif. Il empêche la cavité thoracique d’être inondée.
REMARQUE: Observez visuellement l’arrêt du rythme cardiaque / de la respiration pour confirmer la mort de l’animal. - L’œsophage est entouré par le diaphragme. Pour isoler l’œsophage du diaphragme, coupez à travers le diaphragme de la droite vers l’œsophage. Coupez tous les tissus conjonctifs restants qui relient l’œsophage et l’estomac au foie et au diaphragme.
- Repoussez le tractus gastro-intestinal vers la droite. Transférer le clip veineux de la CIV suprahépatique vers la CIV infrahépatique; le tampon va maintenant perfuser hors de la CIV suprahépatique.
REMARQUE: Pendant la perfusion, la canule et la CIV infrahépatique seront couvertes par le foie. Un fort écoulement tampon de la CIV suprahépatique aidera le chirurgien à exclure les fuites de perfusion. - Coupez tout diaphragme restant qui relie le foie à la cavité thoracique. Couper les tissus reliant le foie à la cavité abdominale. Veillez à ne pas couper la CIV infrahépatique au-dessus du clip pour éviter de détacher le clip du foie.
- Pour vous assurer que le foie est complètement réséqué, soulevez soigneusement le foie en vous accrochant au diaphragme avec une pince. S’il reste des tissus reliant le foie à la cavité abdominale, coupez-les. Si le rein et la rate sont toujours connectés au foie, détachez-les.
4. Perfusion et digestion du foie
- Si la résection a été terminée tôt, attendez que le foie ait été perfusé avec un tampon sans calcium pendant 12 minutes.
- Remplacez le tampon de perfusion par un tampon de collagénase. Desserrez complètement la pince à rouleaux pour le tampon de collagénase avant de serrer complètement la pince à rouleaux pour le tampon sans calcium (voir Figure 5B). Une fois que le tampon de collagénase atteint le foie à travers le tube, rincez le foie trois fois en fermant la CIV suprahépatique pendant 2-3 s et en la rouvrant.
- Déplacez soigneusement le foie vers l’étage situé sur le dessus du bécher pour la recirculation du tampon de collagénase. Déplacez le foie en tenant le diaphragme avec une pince tout en soutenant le cathéter. Évitez de tirer sur le cathéter pour éviter le détachement accidentel du cathéter.
REMARQUE: Si le cathéter se détache et que la veine porte est trop endommagée pour une nouvelle cannulation, canulez la CIV suprahépatique et laissez le tampon s’imprégner de la veine porte. Assurez-vous que la CIV infrahépatique reste coupée. - Digérer le foie pendant 12 min. Observez l’apparition de taches / réseau translucides lorsque le foie commence à perdre sa texture brune lisse. Le foie deviendra plus gros et plus doux à mesure qu’il sera digéré. Une fois que le foie a une consistance pâteuse, arrêtez la perfusion. Le temps de digestion peut être prolongé, si nécessaire.
REMARQUE: Si la capsule de Glisson a été cassée, le tampon de collagénase dans le bécher peut devenir trouble en raison des cellules hépatiques échappées.
5. Isolement des hépatocytes
- Retirez soigneusement la canule en coupant la veine porte. Retirez soigneusement le clip. Transférer le foie dans un plat de 150 mm contenant 60 mL de milieu d’aigle modifié (DMEM) froid de Dulbecco.
- Tapotez doucement le foie à l’aide de l’arrière de la pince incurvée pour casser et décoller la capsule de Glisson. Ensuite, balancez doucement le foie d’un côté à l’autre dans le DMEM pour libérer les cellules du foie. Continuez à le faire jusqu’à ce que les cellules du foie soient complètement dissociées dans le DMEM.
REMARQUE: Parfois, le foie entier ou certains lobes ne seront que partiellement digérés. En ne grattant pas le foie qui enlèvera de force et endommagera les hépatocytes non dissociés, une viabilité cellulaire plus élevée et plus constante peut être obtenue. - Basculez doucement le plat de 150 mm jusqu’à ce que les cellules hépatiques soient bien réparties dans le DMEM. Pour enlever les morceaux de tissu et les amas de cellules, versez la suspension cellulaire à travers un filtre en maille de nylon de 100 μm de la taille d’un pore placé sur un nouveau plat de 150 mm. Rincez l’ancien plat avec 30 mL de DMEM et transférez la suspension dans le filtre à mailles. Tapotez doucement sur le filtre en maille pour permettre aux cellules hépatiques isolées piégées de passer à travers.
- Retirez le filtre en maille et bercez doucement le nouveau plat de 150 mm jusqu’à ce que les cellules du foie soient bien réparties. Divisez la suspension également en tubes de 4 x 50 mL. Rincez le plat avec 30 mL de DMEM et divisez la suspension également dans les mêmes tubes. Assurez-vous que chaque tube a un volume égal de suspension cellulaire.
- Centrifuger les tubes de 4 x 50 mL de suspension cellulaire à 50 x g pendant 2 min à 4 °C. Aspirer soigneusement le surnageant sans déranger la pastille en vrac. Jetez le surnageant. Ajouter 20 mL de DMEM dans chaque tube et bercer doucement les tubes pour remettre en suspension la pastille de cellule. Combinez la suspension cellulaire de quatre tubes en deux.
- Centrifuger les tubes de 2 x 50 mL à 20 x g pendant 2 min à 4 °C. Aspirer et jeter le surnageant. Ajouter 20 mL de DMEM dans chaque tube et bercer doucement les tubes pour remettre en suspension la pastille de cellule. Mélanger la suspension cellulaire de deux tubes en un seul. Gardez les cellules sur la glace jusqu’à leur utilisation.
- Préparer la solution de bleu de trypan en mélangeant 400 μL de 1x PBS avec 50 μL de bleu de trypan. Ajouter 50 μL de suspension d’hépatocytes dans la solution de bleu de trypan. Comptez le nombre d’hépatocytes viables et morts avec un hémocytomètre au microscope optique.
6. Culture d’hépatocytes
- Effectuez toutes les étapes de culture cellulaire dans le capot. Ajouter 1 mL de solution d’enrobage de collagène dans un plat de 35 mm et incuber pendant 4 h. Rincez la vaisselle trois fois avec 1x PBS.
- Diluer la suspension d’hépatocytes dans un milieu de culture d’hépatocytes à une concentration de 0,8 million de cellules/mL. Ajouter 1 mL de suspension d’hépatocytes diluée dans le plat de 35 mm.
REMARQUE: Les hépatocytes sont sensibles à la contrainte de cisaillement pendant le pipetage. Envisagez d’utiliser des embouts de pipette à large alésage. - Bercez le plat pour répartir les hépatocytes uniformément. Incuber à 37 °C, 5% de CO2 pendant 3-4 h pour permettre aux hépatocytes de se fixer.
- Pour la culture sandwich.
- Retirer le milieu de culture d’hépatocytes. Rincer une fois avec 1 mL de milieu de culture d’hépatocytes pour éliminer les cellules non attachées. Ajouter 1 mL de solution de recouvrement de collagène. Ajoutez une solution de superposition de collagène sur les parois du plat pour éviter d’introduire des bulles dans la solution.
- Incuber à 37 °C, 5% de CO2 pendant la nuit pour permettre la gélification du collagène.
- Ajouter 1 mL de milieu de culture d’hépatocytes frais. Incuber à 37 °C, 5 % de CO2.
- Pour la culture monocouche.
- Après l’étape 6.3, retirer le milieu de culture d’hépatocytes. Rincer une fois avec 1 mL de milieu de culture d’hépatocytes pour enlever les cellules non attachées.
- Ajouter 1 mL de milieu de culture d’hépatocytes frais. Incuber à 37 °C, 5 % de CO2.
- Évaluer la pureté et la fonction des hépatocytes en effectuant des immunocolorations pour les marqueurs spécifiques aux hépatocytes et les tests fonctionnels décrits précédemment10,11.
Résultats
Un chirurgien pourrait dire si la perfusion hépatique se déroule sans heurts en observant le résultat après certaines étapes. Le premier résultat peut être observé lors de la canulation, de la coupe de la CIV infrahépatique et du rétablissement du débit de perfusion. Le foie devrait avoir complètement changé de couleur du rouge foncé au brun, tout en maintenant son volume. Si le foie semble légèrement dégonflé et a une teinte rougeâtre ou des taches de rouge, cela signifie que le débit de perfusion a ...
Discussion
Il y a quelques points qui sont particulièrement importants à observer pour la procédure de perfusion de collagénase en deux étapes en général. Tout d’abord, des précautions particulières doivent être apportées lors de la résection du foie. Assurez-vous que le tractus gastro-intestinal n’est pas endommagé car une fuite du contenu entraînera une contamination bactérienne. De plus, évitez d’endommager la capsule de Glisson, qui recouvre la surface du foie pendant la procédure animale. Si la déchirur...
Déclarations de divulgation
Zhou Yan et Hanry Yu déclarent des intérêts concurrents car ils détiennent des actions dans Vasinfuse, qui fabrique et commercialise le système de perfusion intégré. Hanry Yu détient des participations dans Histoindex, Invitrocue, Osteopore, Pishon Biomedical, Ants Innovate et Synally Futuristech qui n’ont pas d’intérêts concurrents avec les informations rapportées ici.
Remerciements
Ce travail est soutenu en partie par le MINISTÈRE de l’Éducation et de l’Environnement (MOE2017-T2-1-149); Subvention d’amorçage à l’innovation NUHS 2017 (NUHSRO/2017/051/InnovSeed/02); Institut de mécanobiologie de Singapour (R-714-106-004-135); et le financement de Hanry Yu par l’Institut de bioingénierie et de nanotechnologie, Conseil de recherches biomédicales, Agence pour la science, la technologie et la recherche (A*STAR) (numéros de projet IAF-PP H18/01/a0/014, IAF-PP H18/01/A0/K14 et MedCaP-LOA-18-02). Ng Chan Way est chercheur à l’Université nationale de Singapour. Nous tenons à remercier l’unité de microscopie confocale et l’unité de cytométrie en flux de l’Université nationale de Singapour pour leur aide et leurs conseils dans l’analyse de la pureté des hépatocytes.
matériels
| Name | Company | Catalog Number | Comments |
| Material/Equipment | |||
| 1 mL syringe | Nipro | ||
| 27G needle | Nipro | ||
| Black braided silk non-absorbable, non-sterile surgical suture | Look | SP117 | |
| Bochem 18/10 stainless steel forceps, sharp tip contain bent round tip | Bochem | 10333511 | |
| Disposable Perfusion Set | Vasinfuse | BPF-112 | |
| Floating circular 1.5 mL microcentrifuge tube rack | Sigma-Aldrich | R3133 | |
| German Standard Tissue Forceps, Serrated / 1×2 teeth , 14.5cm | Walentech | ||
| Greiner Cellstar aspirating pipette | Merck | GN710183 | |
| Haemocytometer | |||
| Integrated Perfusion System | Vasinfuse | IPS-001 | |
| Iris Scissors curved, stainless, 11cm | Optimal Medical Products Pte Ltd | CVD | |
| Light microscope with 10X lens | Olympus | ||
| Mesh Sheet 100µM Nylon | Spectra-Teknic(s) Pte Ltd | 06630-75 | |
| Operating Scissors, BL/BL, 13cm | Optimal Medical Products Pte Ltd | STR – BL/BL | |
| Operating Scissors, SH/BL, 13cm | Optimal Medical Products Pte Ltd | STR – SH/BL | |
| Reverse force hemostatic clip | Shanghai Jin Zhong Pte Ltd | XEC230 | |
| Water bath | Grant | ||
| Reagents/Chemicals | |||
| 10X Phosphate buffered saline (PBS) | Sigma-Aldrich | ||
| Bovine serum albumin (BSA) | Sigma-Aldrich | A9056 | |
| CaCl2·2H2O | Merck | 137101 | |
| Collagenase Type IV | Gibco | 17104019 | |
| Dexamethasone | TCI | D1961 | |
| DMEM | Gibco | 31600-034 | |
| Glutamax | Gibco | 35050061 | |
| HEPES | Invitrogen | 11344-041 | |
| Insulin | Sigma-Aldrich | 1-9278 | |
| KCl | VWR | VWRC26764.298 | |
| KH2PO4 | Sigma-Aldrich | P5379 | |
| Linoleic acid | Sigma-Aldrich | L9530 | |
| NaCl | Sigma-Aldrich | S5886 | |
| NaHCO3 | Sigma-Aldrich | S8875 | |
| NaOH | Merck | 106462 | |
| Penicillin-Streptomycin | Sigma-Aldrich | P4333 | |
| Type I bovine collagen | Advanced BioMatrix | 5005-100ml | |
| William’s E Media | Sigma-Aldrich | W1878 |
Références
- Shen, L., Hillebrand, A., Wang, D. Q. H., Liu, M. Isolation and primary culture of rat hepatic cells. Journal of Visualized Experiments: JoVE. (64), e3917 (2012).
- Cabral, F., et al. Purification of hepatocytes and sinusoidal endothelial cells from mouse liver perfusion. Journal of Visualized Experiments: JoVE. (132), e56993 (2018).
- Green, C. J., et al. The isolation of primary hepatocytes from human tissue: optimising the use of small non-encapsulated liver resection surplus. Cell and Tissue Banking. 18 (4), 597-604 (2017).
- Seglen, P. O. Preparation of isolated rat liver cells. Methods in Cell Biology. 13, 29-83 (1976).
- Gopalakrishnan, S., Harris, E. N. In vivo liver endocytosis followed by purification of liver cells by liver perfusion. Journal of Visualized Experiments: JoVE. (57), e3138 (2011).
- Wen, J. W., Olsen, A. L., Perepelyuk, M., Wells, R. G. Isolation of rat portal fibroblasts by in situ liver perfusion. Journal of Visualized Experiments: JoVE. (64), e3669 (2012).
- Korelova, K., Jirouskova, M., Sarnova, L., Gregor, M. Isolation and 3D collagen sandwich culture of primary mouse hepatocytes to study the role of cytoskeleton in bile canalicular formation in vitro. Journal of Visualized Experiments: JoVE. (154), e60501 (2019).
- Shi, W., et al. Isolation and purification of immune cells from the liver. International Immunopharmacology. 85 (95), 106632 (2020).
- Salem, E. S. B., et al. Isolation of primary mouse hepatocytes for nascent protein synthesis analysis by non-radioactive L-azidohomoalanine labeling method. Journal of Visualized Experiments: JoVE. (140), e58323 (2018).
- Xia, L., et al. Tethered spheroids as an in vitro hepatocyte model for drug safety screening. Biomaterials. 33 (7), 2165-2176 (2012).
- Kegel, V., et al. Protocol for isolation of primary human hepatocytes and corresponding major populations of non-parenchymal liver cells. Journal of Visualized Experiments: JoVE. (109), e53069 (2016).
- Zhu, L., et al. A vertical-flow bioreactor array compacts hepatocytes for enhanced polarity and functions. Lab on a Chip. 16 (20), 3898-3908 (2016).
- Du, Y., et al. Synthetic sandwich culture of 3D hepatocyte monolayer. Biomaterials. 29 (3), 290-301 (2008).
- Tong, W. H., et al. Constrained spheroids for prolonged hepatocyte culture. Biomaterials. 80, 106-120 (2016).
- Xia, L., et al. Laminar-flow immediate-overlay hepatocyte sandwich perfusion system for drug hepatotoxicity testing. Biomaterials. 30 (30), 5927-5936 (2009).
- Gupta, K., et al. Bile canaliculi contract autonomously by releasing calcium into hepatocytes via mechanosensitive calcium channel. Biomaterials. 259, 120283 (2020).
- Horner, R., et al. Impact of Percoll purification on isolation of primary human hepatocytes. Scientific Reports. 9 (1), 6542 (2019).
- Osypiw, J. C., et al. Subpopulations of rat hepatocytes separated by Percoll density-gradient centrifugation show characteristics consistent with different acinar locations. The Biochemical Journal. 304, 617-624 (1994).
- Beal, E. W., et al. A small animal model of ex vivo normothermic liver perfusion. Journal of Visualized Experiments: JoVE. (136), e57541 (2018).
- Hillebrandt, K., et al. Procedure for decellularization of rat livers in an oscillating-pressure perfusion device. Journal of Visualized Experiments: JoVE. (102), e53029 (2015).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon