A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
בידוד של הפטוציטים ראשוניים של חולדות עם בקרת זלוף רב-פרמטרית
* These authors contributed equally
In This Article
Summary
פרוטוקול זה מפרט את השימוש בצנתר תוך ורידי מיוחד, צינורות חד פעמיים סטריליים סטנדרטיים, בקרת טמפרטורה בתוספת ניטור בזמן אמת, ומערכת אזעקה להליך זלוף קולגןאז דו-שלבי כדי לשפר את העקביות בכדאיות, בתפוקה ובפונקציונליות של הפטוציטים של חולדה ראשונית מבודדת.
Abstract
הפטוציטים ראשוניים נמצאים בשימוש נרחב במחקר בסיסי על מחלות כבד ועל בדיקות רעילות במבחנה. הליך זלוף הקולגאז הדו-שלבי לבידוד הפטוציטים ראשוני הוא מאתגר מבחינה טכנית, במיוחד בתותח ורידים פורטליים. ההליך גם נוטה לזיהום מזדמן ולשינויים בתנאי הזלוף עקב קשיים בהרכבה, אופטימיזציה או תחזוקה של מערך הזלוף. כאן מוצג פרוטוקול מפורט להליך משופר של פיזור קולגן בשני שלבים עם בקרת זלוף מולטיפארמטר. הפטוציטים ראשוניים של חולדות בודדו בהצלחה ובאמינות על ידי נקיטת אמצעי הזהירות הטכניים הדרושים בשלבים קריטיים של ההליך, ועל ידי הפחתת הקושי התפעולי והפחתת השונות של פרמטרי הזלוף באמצעות אימוץ צנתר תוך ורידי מיוחד, צינורות חד פעמיים סטריליים סטנדרטיים, בקרת טמפרטורה ומערכת ניטור ואזעקה בזמן אמת. הפטוציטים של החולדה הראשונית המבודדת מפגינים באופן עקבי כדאיות גבוהה של התאים (85%-95%), תפוקה (2-5 x 108 תאים לכל חולדה של 200-300 גרם) ופונקציונליות (פעילות אלבומין, אוריאה ו-CYP). ההליך הושלם על ידי מערכת פרפוזיה משולבת, שהיא קומפקטית מספיק כדי להיות מוגדרת במכסה הזרימה הלמינרי כדי להבטיח פעולה אספטית.
Introduction
הפטוציטים ראשוניים הם כלים חשובים למחקר בסיסי הקשור לכבד, לטיפול במחלות וליישום כגון בדיקות תרופות. תקן הזהב הנוכחי לבידוד הפטוציטים ראשוני הוא הליך פיזור הקולג'נאז הדו-שלבי 1,2,3 שהוצג על ידי Seglen בשנות ה-704. עם זאת, הליך זה הוא מאתגר מבחינה טכנית ויש לו שיעור כישלון גבוה כאשר הוא מבוצע על ידי מנתחים מתחילים. גם כאשר פרפוזיה נחשבת מוצלחת, ניתן להבחין בהבדלים דרסטיים בכדאיות הפטוציטים (בדרך כלל 60%-95%) ובתפוקה (0.5-5 x 108 לכל 200-300 גרם חולדה) בין בידודים. זה משפיע על האיכות וההיקף של ניסויים במורד הזרם. מלבד ההליך הטכני, מערך הזלוף המשמש לבידוד, זמין מסחרית או בנוי בהתאמה אישית, הוא גורם תורם. יש לתת תשומת לב להרכבה, אופטימיזציה ותחזוקה של הגדרת הזלוף. מטרת פרוטוקול זה היא לשפר את שיעור ההצלחה והיציבות בין בידודים של הפטוציטים ראשוניים של חולדה באמצעות בקרת פרפוזיה מרובת-פרמטרים של ההליך הטכני והתקנת זלוף של הליך פיזור קולגןאז דו-שלבי.
מההיבט הטכני, השלב הקשה ביותר בהליך הוא תותח ורידי הפורטל. באשר לצעדים האחרים, אם נצפה תרגול טוב וננקטים אמצעי זהירות כלליים, ניתן לשפר את יציבות הבידוד. לכן, הבנת ההנמקה לכל שלב חשובה כדי שהמנתח יוכל להגיב למשתנים שונים שעלולים להתרחש במהלך ההליך.
פרוטוקולים שונים לבידוד של הפטוציטים ותאים שאינם פרנכימליים בכבד מחולדה ועכבר פורסמו 1,2,5,6,7,8,9. להגדרות הזלוף ששימשו בפרוטוקולים אלה היו מספר חסרונות, הכוללים שימוש חוזר בצינורות פרפוזיה, בעיות בבקרת טמפרטורה, צורך באופטימיזציה שגרתית של פרמטרי פרפוזיה ו/או שימוש בסוג לא מתאים של צנתר תוך ורידי (IV) עבור תותח ורידי פורטלי. שימוש חוזר בצינורות זלעפות יגדיל את הסיכוי לזיהום, במיוחד אם הצינורות לא נוקו וחוטאו כראוי. שימוש חוזר בצינורות ללא החלפה שגרתית יחשוף גם את מערך הזלוף לבעיות כגון צינורות או מחברים דולפים, מלכודת בועות סתומה וצינורות מכווצים, כל אלה יפחיתו באופן משמעותי את הלחץ וקצב הזרימה של התפשטות, ובכך ישפיעו על יעילות העיכול בכבד. ללא מקור חום קבוע בתצורות מסוימות לבקרת טמפרטורה, מאגרים שחוממו מראש יתקררו עם הזמן, מה שיוביל לפעילות ועיכול נמוכים של קולגן. אף על פי שתצורות אחרות משתמשות במעבה זכוכית מעיל המחובר למפיץ מים כדי לחמם את החיץ, הן מגושמות ודורשות ניקוי קפדני. יש למדוד ולייעל את הטמפרטורה, הלחץ וקצב הזרימה של החיץ היוצא מהקטטר לפני תחילת הבידוד כדי להבטיח מצב זלוף יציב. גם לאחר האופטימיזציה, הפרמטרים עדיין יכולים להשתנות באמצע הדרך במהלך הבידוד עקב פעולות המפעיל, ובכך להוביל לזלוף ועיכול לא אופטימליים. רוב הסוגים של קטטר IV אינם מתאימים לקנלולציה של ורידים בפורטל מכיוון שהם אינם מאפשרים זלוף רציף במהלך תותח. הם אינם מסוגלים להודיע מיד למנתח כאשר התותח מצליח. יתר על כן, זה מאתגר לאבטח את וריד הפורטל על הצנתר הרך מבלי לעוות אותו.
כאן אנו מטפלים בבעיות אלה באמצעות צינורות סטריליים חד פעמיים סטנדרטיים, ז'קט מחמם סיליקון לבקרת טמפרטורה מדויקת ויציבה, מערכת ניטור ואזעקה בזמן אמת עם אחסון וניהול נתונים ושימוש בצנתר IV מיוחד, המאפשר זלוף רציף תוך ניקוב וריד הפורטל במהלך התותח. למיטב ידיעתנו, אנו הקבוצה הראשונה המשלבת את כל התכונות הללו למערכת פרפוזיה משולבת (IPS) קומפקטית, מה שהופך אותה לניידת מאוד ומסוגלת להתאים למכסה מנוע זרימה למינרי כדי להבטיח פעולה אספטית.
Protocol
כל ההליכים ושיכון בעלי החיים בוצעו תחת מספרי פרוטוקול R15-0027 ו- R19-0669 בהתאם לדרישות הוועדה המוסדית לטיפול ושימוש בבעלי חיים (IACUC) של האוניברסיטה הלאומית של סינגפור.
1. הכנת פתרונות ומכשירי ניתוח
- הכינו מאגרים ומדיה לתרביות תאים בטבלה 1 באמצעות מים אולטרה-פוריים.
- מחממים מראש את מאגר הסידן נטול הסידן ואת מאגר הקולגן ל-37 מעלות צלזיוס באמבטיית מים לפני השימוש.
- Autoclave את כלי הניתוח הבאים וציוד מעבדה: זוג מספריים כירורגיים חדים-קהים, זוג מספריים כירורגיים קהים-קהים, זוג מספריים כירורגיים מעוקלים, שני זוגות של מלקחיים של רקמת שיניים, שני זוגות מלקחיים מעוקלים, שני קליפסים ורידיים, תפר כירורגי משי באורך 5 ס"מ 3-0, מסנן רשת ניילון 100 מיקרומטר, 400 מ"ל, ובמה (מתלה צינור מיקרו-סנטריפוג צף).
2. הגדרת ה-IPS (ראו איור 1)
- נגבו את מכסה המנוע של הזרימה הלמינרית ב-70% אתנול. נגבו את ה-IPS עם 70% אתנול והעבירו אותו למכסה המנוע של הזרימה הלמינרית. מעקרים על ידי UV למשך >15 דקות לפני הפעלת מכסה המנוע.
אזהרה: חשיפה לאור UV עלולה לגרום לכוויות כואבות בעיניים ובעור. ודא שהאבנט סגור לחלוטין כאשר נורית ה- UV דולקת. - הרכיבו קבוצה חדשה של צינורות חד פעמיים על גבי ה-IPS. עטפו את הצינורות במורד הזרם של המשאבה הפריסטלטית במעיל חימום מסיליקון. הרכיבו את צג הזלוף על הצינורות במורד הזרם של מעיל החימום מסיליקון.
- ודא שמהדקי הגלילה עבור שני פתחי הצינורות משוחררים לחלוטין. חברו כל פתח צינורות לקצה המחודד של פיפטת שאיפה סטרילית של 2 מ"ל. השאירו הן את פיפטות השאיפה (כניסות) והן את צנתר ה- IV (שקע) בבקבוק 1 ליטר עם חיץ ללא סידן כדי לאפשר סירקולציה של החיץ במהלך שלבי ההזנה הבאים.
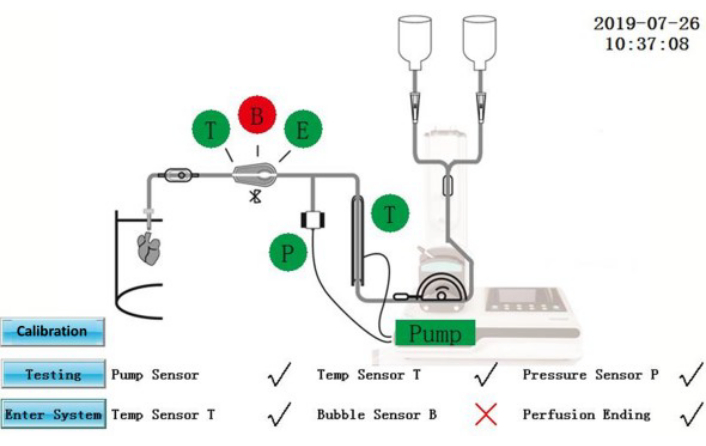
איור 2: ממשק בדיקה עצמית.אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
- הפעל את שב"ס. בצע את הפעולות הבאות בלוח הבקרה של מסך המגע. התוכנה תבצע בדיקה עצמית מקיפה בכל פעם שהיא מופעלת.
אזהרה: ה- IPS הוא ציוד חשמלי המחובר למקור חשמל חיצוני. שפיכת נוזלים על שב"ס או כבלי חשמל עלולה לגרום לסיכונים חשמליים.- ודא שמצב הבדיקה העצמית מוצג על המסך (איור 2). רכיבים שעברו את המבחן העצמי יוצגו בירוק; אלה שנכשלו יוצגו באדום. לאחר התיקון, הקש על סמל הבדיקה כדי לחזור על הבדיקה העצמית שוב או הקש על סמל Enter System כדי להיכנס ישירות לממשק הפעולה.
- הקש במקום כלשהו על המסך כדי להיכנס לממשק הפעולה.
- בפינה השמאלית העליונה של ממשק הפעולה (איור 3), הקישו על אחד מסמלי החצים העגולים כדי לקבוע את כיוון הסיבוב של המשאבה הפריסטלטית. בחלונית השמאלית של הממשק, הקש על סמלי החצים למעלה/למטה כדי להגדיר ערכים עבור הפרמטרים המתאימים. הגדר את הזרימה למצב זרימה קבוע; טמפרטורת מעיל התנור ל 42 מעלות צלזיוס (כדי להיות מותאם כדי להבטיח כי הטמפרטורה של perfusate נשמרת ב 37 °C (76 °F); ומהירות המשאבה ל-38 סל"ד לקצב זרימה של כ-33 מ"ל/דקה.
- בלוח הימני התחתון של ממשק הפעולה, בדוק את מצב אזעקת הבועה, אזעקת עצירת זלוף וסמל ההשתקה.
- בדוק אם יש את הטמפרטורה, הלחץ וקצב הזרימה של ה-perfusate בחלונית השמאלית. הגדר באופן ידני את המרווחים על-ידי לחיצה על החצים למעלה-למטה בחלק העליון והתחתון של העמודות. בדוק אם קיימים נתונים בזמן אמת המוצגים כערכים במרכז העמודות. צבע העמודה יהפוך מירוק לאדום אם הנתונים בזמן אמת יעברו מחוץ לטווח שנקבע.
- אתר את הסמלים כדי להתחיל, להשהות ולעצור את ההזזה, ואת הסמל כדי לעבור מתצוגת נתונים בזמן אמת למצב תרשים בחלונית האמצעית. הקישו על סמל ההתחלה כדי להתחיל את הזלוף ולסדר את הצינורות עם חיץ נטול סידן. יומן חדש ייווצר. הזינו את שם הקובץ ואת שם המשתמש לחלון הקופץ (איור 4).
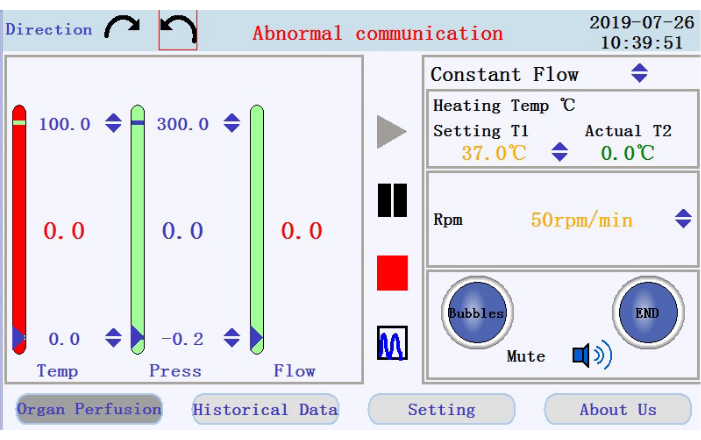
איור 3: ממשק פעולה.אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
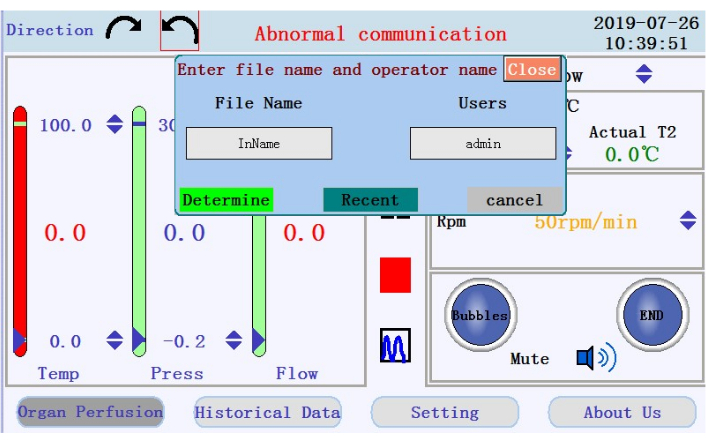
איור 4: חלון קופץ המבקש שם קובץ ושם משתמש. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
- ממלאים את תא הטפטוף לחצי מלא. יש לוודא כי אין כיסי אוויר לכודים בצינורות במהלך ההקפאה.
- הסר כל בועה שנוצרת במורד הזרם של מסנן הבועות על ידי הבהוב על הצינור כדי לנתק את הבועה ולאפשר לה להישטף החוצה.
הערה: בועות עשויות להיווצר לאורך הצינורות כאשר החיץ מתחמם על ידי ז'קט התנור. - מלאו של 400 מ"ל ב-200 מ"ל של מאגר קולגןאז. שים את הבמה על גבי הכוס. מבלי להכניס אוויר לצינורות, הדקו לחלוטין את מהדק הגליל לאחד מכניסות הצינורות והזיזו את פיפטת השאיפה לכניסה לתוך הכוס.
3. הליך בעלי חיים
- הכינו עכברוש Wistar זכר בוגר צעיר בסביבות 200-300 גרם במשקל הגוף.
הערה: פרוטוקול זה הותאם לחולדות בסביבות 200-300 גרם במשקל הגוף. חולדות זכרים מועדפות מכיוון ששינויים הורמונליים במהלך מחזור האסטרוס בחולדות נקבות ישפיעו על תפקוד הפטוציטים. - הרדמה
- ציירו את הנפח הנדרש של הפרין נגד קרישה (5,000 יחב"ל/מ"ל; 0.2 מ"ל/100 גרם משקל גוף) וקוקטייל קטמין/קסילאזין הרדמה של חולדות (37.5 מ"ג/מ"ל קטמין, 5 מ"ג/מ"ל קסילאזין; 0.2 מ"ל/100 גרם משקל גוף) למזרקים של 1 מ"ל עם מחט 27 גרם.
אזהרה: הרדמה והפרין הם חומרים מזיקים. היזהר בעת טיפול בחדות. - לרסן את החולדה. תוך-צפקיטונלית מזריקים הפרין ולאחר מכן קוקטייל קטמין/קסילאזין לתוך הרביע הימני התחתון של הבטן.
הערה: ל- caecum יש סבירות גבוהה יותר להיות ממוקם בצד שמאל. הימנעו מלנקב את הקאקום במהלך ההזרקה כדי להפחית את הסיכון לזיהום. - לאחר 10 דקות, בדקו את עומק ההרדמה על ידי הערכת רפלקס הדוושה בשתי רגלי החולדה. המשיכו לבדוק מפעם לפעם והמתינו עד שהחולדה כבר לא תגיב לצביטות בבוהן. ניתן להזריק הרדמה נוספת, לפי הצורך.
- ציירו את הנפח הנדרש של הפרין נגד קרישה (5,000 יחב"ל/מ"ל; 0.2 מ"ל/100 גרם משקל גוף) וקוקטייל קטמין/קסילאזין הרדמה של חולדות (37.5 מ"ג/מ"ל קטמין, 5 מ"ג/מ"ל קסילאזין; 0.2 מ"ל/100 גרם משקל גוף) למזרקים של 1 מ"ל עם מחט 27 גרם.
- מניחים את החולדה בתנוחת שכיבה עם גפיים מושטות על פלטפורמת פוליסטירן מכוסה בנייר אלומיניום על גבי מגש. הדביקו את רגלי החולדה והצמידו את הסרט היטב לרציף עם מחטי 27 גרם.
- יש לחטא את החזה והבטן על ידי התזתם וטבילתם ב-70% אתנול. גילוח לפני חיטוי הוא אופציונלי. שים את החולדה במכסה המנוע. המשך את השלב הבא בזמן שהפרווה עדיין רטובה.
הערה: טבילה עם 70% אתנול גם שומרת על אבק קשקשים ופרווה למינימום. - להפריד את העור מן השריר.
- עם זוג מלקחיים של רקמת שיניים ביד אחת, הרימו את העור ליד בסיס הבטן. עם זוג מספריים כירורגיים חדים-קהים ביד השנייה, חתכו את עור האוהלים. דוחפים את הקצה החד של המספריים מתחת לעור ועושים חתך בקו האמצע על העור מממש מעל הרגליים האחוריות ועד ממש מתחת לרגליים הקדמיות.
- תוך כדי משיכה כלפי מעלה ומתיחה קלה של העור עם המלקחיים, חותכים כל רקמת חיבור שמחזיקה את העור על השריר בחזה ובבטן. כדי להפחית את הסיכון לזיהום, למנוע פרווה רופפת ליפול על השריר. כדי להסיר פרווה רופפת מובנית על המספריים, נגבו אותן בצד החיצוני של העור המחוטא.
- בצע חתכים רוחביים על העור, מקו האמצע לשני צידי החולדה מעט מעל הרגליים האחוריות ומעט מתחת לרגליים הקדמיות. לדחוף את דשי העור לצדדים כדי לחשוף את השריר.
- חותכים את שריר הבטן כדי לחשוף את האיברים.
- עם זוג חדש של מלקחיים רקמת שיניים ביד אחת, הרימו את השריר ליד בסיס הבטן. עם זוג מספריים כירורגיים קהים-קהים ביד השנייה, חותכים בזהירות את השריר מבלי לנקר אף אחד מהאיברים. בצע חתך בקו האמצע על השריר ממעט מעל הרגליים האחוריות ועד עצם החזה.
- בצע חתכים לרוחב על השריר, מקו האמצע לשני צידי החולדה מעט מעל הרגליים האחוריות וממש מתחת לכלוב הצלעות, מבלי לנקר אף אחד מהאיברים. לדחוף את דשי השרירים לצדדים כדי לחשוף את האיברים. יש לוודא כי החתכים הצדדיים של העור והשרירים מגיעים לצידי החולדה כדי לאפשר לדם ולבוצץ לזרום החוצה מחלל הבטן בשלבים מאוחרים יותר.
- תותח ורידים בפורטל
- עם הגב של מלקחיים מעוקלים, לדחוף בעדינות את המעיים ימינה. הפוך בעדינות את אונות הכבד כדי לחשוף את וריד הפורטל.
- השתמשו בתפר כירורגי משי 3-0 כדי ליצור ליגטורה רופפת מאוד סביב וריד הפורטל קרוב לכבד, רגע לפני שהווריד מסתעף שמאלה וימינה לאונות כבד שונות. אין להדק את הליגטורה כדי למנוע הפרעה לזרימת הדם דרך וריד הפורטל. קרום דק מאוד מתחת לצינור המרה יצטרך להיפרץ עם קצה המלקחיים המעוקלים לפני שהתפר יוכל לעבור מתחתיו ולהיות לולאה סביב וריד הפורטל (וצינור המרה).
- באמצעות קצוות של שני זוגות מלקחיים מעוקלים, נקב בזהירות חור דרך הרקמה שמתחת לווריד הפורטל, מבלי לפגוע בווריד הפורטל. עשו זאת בערך 2-3 ס"מ במעלה הזרם של הליגטורה הראשונה, ממש לפני שווריד הקיבה מסתעף מהווריד הפורטלי. הרקמה דקה יותר במיקום ספציפי זה.
- בזהירות למתוח את החור גדול יותר עם המלקחיים. חור זה יאפשר למלקחיים לתמוך במעלה וריד הפורטל במהלך התותח.
- הפחיתו את מהירות המשאבה ל-4 סל"ד לקבלת קצב זרימה של כ-3 מ"ל לדקה. ודאו שהיציאה של מאגר נטול סידן מצנתר ה-IV מצטמצמת לטפטוף איטי.
הערה: הצטברות לחץ בכבד תגרום למוות הפטוציטים. קצב זרימה נמוך יותר אמור להאט את הצטברות הלחץ בכבד עם החדרה מוצלחת של הצינורית לווריד הפורטל בשלב מאוחר יותר. - תמכו בעדינות במעלה וריד הפורטל באמצעות מלקחיים. עם היד השנייה, החזיקו את קטטר האינפוזיה כששיפוע המחט פונה כלפי מעלה. כוון את המחט לתוך וריד הפורטל בזווית של 10-20° והתקדם באיטיות עד שכל השיפוע נמצא בתוך הווריד. ברגע שהמחט מוחדרת כראוי לווריד הפורטל, הכבד יתחיל להתנשף ולאבד את צבעו האדום הכהה.
הערה: יש להחדיר את כל השיפוע של המחט לווריד כדי ליצור חור גדול מספיק להחדרת הצינורית. עם זאת, אין להכניס את המחט עמוק מדי פנימה כדי למנוע ניקוב יתר של הווריד. - מקדמים את הצינורית מעל המחט ולתוך הווריד. לאחר מכן, חזור במחט עד שהיא 2-3 מ"מ מאחורי הצינורית; מספיק כדי שהקצה החד יהיה בבטחה בתוך הצינורית. השתמש באגודל ובאצבע האמצעית כדי לאחוז בצנתר והשתמש באצבע המורה כדי למשוך את הכנף לאחור כדי לשלוף את המחט.
- אבטח במהירות את וריד הפורטל על הצנתר עם קליפס ורידים. אין לדפוס ישירות את החור הצדדי של המחט כדי למנוע הפרעה לזרימת ההפרעה. במקום זאת, גזרו מתחתיו.
- חותכים מיד את הווריד הנבוב התחתון האינפרא-היפטי קאווה (IVC) כדי למנוע הצטברות לחץ בכבד. בשלב זה ה- IVC התת-היפטי וכלי הדם הסמוכים יוסתרו על ידי דם מווריד הפורטל. כדי להבטיח שה-IVC נחתך ונקטע כהלכה, יש להתבונן בדם המזנק החוצה בפולסים; דם רק יטפטף החוצה מכלי דם סמוכים.
הערה: לקיחת זמן רב מדי לחתוך את ה- IVC האינפרא-הפטי לאחר תותח או כישלון לחתוך אותו לפני המעבר לשלב הבא יגרום למוות הפטוציטים. החיה מורדמת בהרדמה על ידי אקסנגווינציה (באמצעות חיתוך ה- IVC) במהלך שלב זה. ההליך צריך להימשך כל עוד איבוד הדם נמשך. המוות יכול להיות מאושר על ידי תצפית חזותית של הפסקת פעימות הלב / הנשימה כאשר חלל החזה נפתח בשלב מאוחר יותר. - הגדל את מהירות המשאבה ל- 38 סל"ד לקבלת קצב זרימה של ~ 33 מ"ל לדקה. שטפו את הכבד שלוש פעמים על ידי סגירת ה-IVC עם מלקחיים למשך 2-3 שניות (אך לא למשך זמן רב מדי) ופתיחתו מחדש.
הערה: במהלך ההדחה, הכבד יתרחב מעט לפני שיחזור לנורמה. שטיפה מקלה על חלחול של perfusate לאורך כל הכבד. לאחר שטיפה, הכבד צריך להיות בצבע חום בהיר לחלוטין. - יש לוודא שקצה הצינורית ממוקם לפני הנקודה שבה וריד הפורטל מסתעף לאונות כבד שונות, כדי להבטיח זלוף של כל אונות הכבד. במידת הצורך, פתח את וריד הפורטל והתאם את מיקום הצינורית. צלם מחדש לאחר מכן.
- הדקו את הליגטורה הרופפת סביב וריד הפורטל, מעט במעלה הזרם של נקודת ההסתעפות. צרו שלושה קשרים על המקום שבו הצינורית הרכה נתמכת על ידי מחט המתכת הקשה, בין החור השפל לחור הצדדי. ודא שהקשרים מתקנים את הצינורית במקומה, מאבטחים אותה לווריד הפורטל ומונעים זרימה אחורית של מאגרים.
- תנתחו את כל הכבד בשלמותו.
- יש להחדיר לכבד מאגר ללא סידן בקצב זרימה של כ-33 מ"ל/דקה במשך 12 הדקות הבאות (ראו איור 5A). בינתיים, לבצע כריתת כבד. ניתן להאריך את זמן הזלוף במידת הצורך, אך יש לוודא כי המאגר ללא סידן לא ייגמר.
- באמצעות זוג מספריים מעוקלים, נתק בזהירות את וריד הפורטל מהמעיים על ידי חיתוך המסנטריה המחברת אותם יחד. אין לנקות את מערכת העיכול (ושט, קיבה, המעי הדק והמעי הגס) כדי להבטיח שלא יתרחש זיהום.
הערה: הדבר נועד למנוע את קריעת וריד הפורטל כאשר הכבד זז ממקום למקום במהלך הכריתה. - נתקו את הכבד ממערכת העיכול על ידי חיתוך רקמות חיבור, לבלב ומזנטריה המחברת את הכבד למערכת העיכול. כדי לנתק, תמיד לחתוך עם מספריים ולא למשוך לקרוע. שוב, לא ניק או לחתוך את מערכת העיכול.
- הופכים בעדינות את הכבד כדי לחשוף את הסרעפת. חותכים את הסרעפת בעקבות דפנות הצלעות. יש לוודא שרוב הסרעפת נשארת מחוברת לכבד. היזהרו לא לתקוע או לחבל בכבד.
- לאחר פתיחת חלל החזה, ניתן לראות שני צינורות: ה- IVC הסופרהפטי הלבן משמאל, והוושט הצהבהב מימין. חותכים את ה-IVC הסופרהפטי וחותכים אותו ממש מעל הקליפ. חיתוך ה- IVC הסופרהפטי הוא אופציונלי. זה מונע מחלל החזה להציף.
הערה: התבונן חזותית להפסקת פעימות הלב / הנשימה כדי לאשר מוות של בעלי חיים. - הוושט מוקף בסרעפת. כדי לבודד את הוושט מהסרעפת, חותכים דרך הסרעפת מימין לכיוון הוושט. חותכים את כל רקמות החיבור הנותרות המחברות את הוושט והקיבה לכבד ולסרעפת.
- דוחפים את מערכת העיכול ימינה. להעביר את קליפ הווריד מה- IVC הסופרהפטי ל- IVC האינפרא-הפטי; המאגר יתפרץ כעת החוצה מה-IVC הסופרהפטי.
הערה: במהלך פרפוזיה, הצינורית וה- IVC האינפרא-היפטי יכוסו על ידי הכבד. זרימת חיץ חזקה מה-IVC הסופרהפטי תסייע למנתח לשלול דליפות זלוף. - חותכים את כל הסרעפת שנותרה ומחברת את הכבד לחלל החזה. חתכו את הרקמות המחברות את הכבד לחלל הבטן. היזהרו לא לחתוך את ה-IVC האינפרא-הפטי מעל הקליפ כדי להימנע מניתוק הקליפ מהכבד.
- כדי להבטיח כי הכבד הוא חתך לחלוטין, בזהירות להרים את הכבד על ידי החזקת הסרעפת עם מלקחיים. אם נותרו רקמות המחברות את הכבד לחלל הבטן, נתקו אותן. אם הכליה והטחול עדיין מחוברים לכבד, נתקו אותם.
4. זלוף בכבד ועיכול
- אם הכריתה הושלמה מוקדם, יש להמתין עד שהכבד יוחדר עם חיץ ללא סידן למשך 12 דקות.
- משנים את מאגר הזלוף למאגר הקולג'נאז. שחררו לחלוטין את מהדק הרולר למאגר הקולגנאז לפני הידוק מוחלט של מהדק הרולר למאגר נטול סידן (ראו איור 5B). ברגע שחיץ הקולגאז מגיע לכבד דרך הצינורות, שטפו את הכבד שלוש פעמים על ידי סגירת ה-IVC הסופרהפטי למשך 2-3 שניות ופתיחתו מחדש.
- בזהירות להעביר את הכבד לשלב על גבי הכוס לצורך סירקולציה של מאגר קולגןאז. הזיזו את הכבד על ידי אחיזה בסרעפת עם מלקחיים תוך כדי תמיכה בצנתר. יש להימנע מגרירה על הצנתר כדי למנוע ניתוק בשוגג של הצנתר.
הערה: אם הצנתר מתנתק ווריד הפורטל פגום מדי לתותח מחדש, ניתן להשתמש ב- IVC הסופרהפטי ולאפשר למאגר לחלחל החוצה מווריד הפורטל. ודא שה-IVC האינפרא-היפטי נשאר חתוך. - לעכל את הכבד במשך 12 דקות. שימו לב למראה של כתמים/רשת שקופים כאשר הכבד מתחיל לאבד את המרקם החום החלק שלו. הכבד ילך ויגדל יותר ויותר ככל שהוא יתעכל. ברגע שהכבד יש עקביות מטושטשת, יש להפסיק את הזלוף. זמן העיכול ניתן להאריך, במידת הצורך.
הערה: אם הקפסולה של גליסון נשברה, מאגר הקולגנאז בכוס עלול להפוך לעכור עקב תאי כבד שנמלטו.
5. בידוד הפטוציטים
- הסר בזהירות את הצינורית על ידי חיתוך וריד הפורטל. הסר בזהירות את הקליפ. מעבירים את הכבד למנה של 150 מ"מ המכילה 60 מ"ל של מדיום הנשר המתוקן (DMEM) של דולבקו קר.
- הקש בעדינות על הכבד תוך שימוש בחלק האחורי של המלקחיים המעוקלים כדי לשבור ולקלף את הקפסולה של גליסון. לאחר מכן, סובבו בעדינות את הכבד מצד לצד ב-DMEM כדי לשחרר את תאי הכבד. המשיכו לעשות זאת עד שתאי הכבד ינותקו לחלוטין לתוך ה-DMEM.
הערה: מדי פעם כל הכבד או אונות מסוימות יעכלו רק באופן חלקי. על ידי אי גירוד הכבד אשר יסיר בכוח, ויפגע הפטוציטים לא מוסברים, ניתן להשיג כדאיות תאים גבוהה ועקבית יותר. - מנדנדים בעדינות את המנה של 150 מ"מ עד שתאי הכבד מופצים היטב ב-DMEM. כדי להסיר חתיכות רקמות וגושי תאים, יש לשפוך את תרחיף התא דרך מסנן רשת ניילון בגודל 100 מיקרומטר בגודל נקבובית המונח מעל צלחת חדשה בקוטר 150 מ"מ. שטפו את המנה הישנה עם 30 מ"ל של DMEM והעבירו את המתלים למסנן הרשת. הקישו בעדינות על מסנן הרשת כדי לאפשר לתאי כבד בודדים כלואים לעבור דרכם.
- מסירים את מסנן הרשת ומטלטלים בעדינות את המנה החדשה של 150 מ"מ עד שתאי הכבד מופצים היטב. חלקו את המתלים באופן שווה לצינורות של 4 x 50 מ"ל. שטפו את המנה עם 30 מ"ל של DMEM וחלקו את המתלים באופן שווה לאותם צינורות. ודא שלכל צינור יש נפח שווה של תרחיף התא.
- צנטריפוגה צינורות 4 x 50 מ"ל של מתלה התא ב 50 x g במשך 2 דקות ב 4 ° C. שאפו בזהירות את הסופרנטנט מבלי להפריע לכדור הרופף. השליכו את הסופרנאטנט. הוסיפו 20 מ"ל של DMEM לכל צינור וטלטלו בעדינות את הצינורות כדי להחיות את גלולת התא. שלב את תרחיף התא מארבעה צינורות לשניים.
- צנטריפוגה 2 x 50 מ"ל צינורות ב 20 x g במשך 2 דקות ב 4 ° C. לשאוף ולהשליך את ה-supernatant. הוסיפו 20 מ"ל של DMEM לכל צינור וטלטלו בעדינות את הצינורות כדי להחיות את גלולת התא. שלב את תרחיף התא משני צינורות לאחד. שמור את התאים על קרח עד לשימוש.
- הכן תמיסת טריפאן כחולה על ידי ערבוב של 400 μL של 1x PBS עם 50 μL של כחול טריפאן. הוסיפו 50 μL של תרחיף הפטוציטים לתמיסה הכחולה של טריפאן. ספרו את מספר ההפטוציטים בני הקיימא והמתים עם המוסיטומטר מתחת למיקרוסקופ האור.
6. תרבית הפטוציטים
- בצע את כל שלבי תרבית התאים במכסה המנוע. מוסיפים תמיסת ציפוי קולגן 1 מ"ל למנה של 35 מ"מ ודגירה למשך 4 שעות. יש לשטוף את הכלים שלוש פעמים עם 1x PBS.
- דילול תרחיף הפטוציטים במדיום תרבית הפטוציטים לריכוז של 0.8 מיליון תאים/מ"ל. הוסיפו 1 מ"ל של תרחיף הפטוציטים מדולל למנה של 35 מ"מ.
הערה: הפטוציטים רגישים ללחץ גזירה במהלך פיפטינג. שקול להשתמש בטיפים רחבים של פיפטה. - נדנדו את המנה כדי להפיץ את ההפטוציטים באופן שווה. דגירה ב 37 °C (64 °F), 5% CO2 במשך 3-4 שעות כדי לאפשר hepatocytes להתחבר.
- לתרבות הסנדוויץ'.
- הסר את מדיום תרבית הפטוציטים. יש לשטוף פעם אחת עם מדיום תרבית הפטוציטים של 1 מ"ל כדי להסיר תאים לא מחוברים. הוסיפו 1 מ"ל של תמיסת שכבת-על של קולגן. הוסיפו את תמיסת שכבת הקולגן על דפנות המנה כדי להימנע מהכנסת בועות לתמיסה.
- דגירה בטמפרטורה של 37 מעלות צלזיוס, 5% CO2 למשך הלילה כדי לאפשר ג'לציה של קולגן.
- הוסף 1 מ"ל של מדיום תרבית הפטוציטים טרי. אינקובציה ב 37 °C (84 °F), 5% CO2.
- לתרבות חד-שכבתית.
- לאחר שלב 6.3, הסר את מדיום תרבית הפטוציטים. יש לשטוף פעם אחת עם מדיום תרבית הפטוציטים של 1 מ"ל כדי להסיר את התאים שאינם מחוברים.
- הוסף 1 מ"ל של מדיום תרבית הפטוציטים טרי. אינקובציה ב 37 °C (84 °F), 5% CO2.
- הערך את טוהר ותפקוד הפטוציטים על ידי ביצוע שמירה חיסונית עבור סמן ספציפי להפטוציטים ובדיקות תפקודיות כפי שתואר קודם לכן10,11.
תוצאות
מנתח יכול לדעת אם זלוף הכבד מתבצע בצורה חלקה על ידי התבוננות בתוצאה לאחר שלבים מסוימים. ניתן לראות את התוצאה הראשונה עם תותח, חיתוך של ה- IVC האינפרא-היפטי, והשבת קצב זרימת הזלוף. הכבד היה צריך לשנות לחלוטין את צבעו מאדום כהה לחום, תוך שמירה על נפחו. אם הכבד נראה מעט מנופח ויש לו גוון אדמדם או כ?...
Discussion
ישנן מספר נקודות שחשוב במיוחד לבחון עבור הליך זלוף קולגן דו-שלבי באופן כללי. ראשית, יש לתת טיפול מיוחד בעת כריתת הכבד. יש לוודא כי מערכת העיכול אינה ניזוקה שכן דליפה של התוכן תגרום לזיהום חיידקי. בנוסף, הימנעו מפגיעה בקפסולת גליסון, המכסה את פני השטח של הכבד במהלך ההליך החייתי. אם הקרע גדול מ...
Disclosures
ג'ואו יאן והאנרי יו מצהירים על אינטרסים מתחרים מכיוון שהם מחזיקים במניות ב-Vasinfuse, המייצרת ומשווקת את מערכת הפרפוזיה המשולבת. הנרי יו מחזיקה במניות בהיסטויינדקס, Invitrocue, Osteopore, Pishon Biomedical, Ants Innovate ו-Synally Futuristech שאין להן אינטרסים מתחרים עם המידע המדווח כאן.
Acknowledgements
עבודה זו נתמכת בחלקה על ידי MOE ARC (MOE2017-T2-1-149); מענק זרעי חדשנות של NUHS 2017 (NUHSRO/2017/051/InnovSeed/02); המכון למכנוביולוגיה של סינגפור (R-714-106-004-135); והמכון לביו-הנדסה וננו-טכנולוגיה, המועצה למחקר ביו-רפואי, הסוכנות למדע, טכנולוגיה ומחקר (A*STAR) (מספרי פרויקטים IAF-PP H18/01/a0/014, IAF-PP H18/01/a0/K14 ו-MedCaP-LOA-18-02) מימון להנרי יו. נג צ'אן וויי הוא חוקר של האוניברסיטה הלאומית של סינגפור. ברצוננו להודות ליחידת המיקרוסקופיה הקונפוקלית וליחידת הציטומטריה של זרימה של האוניברסיטה הלאומית של סינגפור על עזרה וייעוץ בניתוח טוהר הפטוציטים.
Materials
| Name | Company | Catalog Number | Comments |
| Material/Equipment | |||
| 1 mL syringe | Nipro | ||
| 27G needle | Nipro | ||
| Black braided silk non-absorbable, non-sterile surgical suture | Look | SP117 | |
| Bochem 18/10 stainless steel forceps, sharp tip contain bent round tip | Bochem | 10333511 | |
| Disposable Perfusion Set | Vasinfuse | BPF-112 | |
| Floating circular 1.5 mL microcentrifuge tube rack | Sigma-Aldrich | R3133 | |
| German Standard Tissue Forceps, Serrated / 1×2 teeth , 14.5cm | Walentech | ||
| Greiner Cellstar aspirating pipette | Merck | GN710183 | |
| Haemocytometer | |||
| Integrated Perfusion System | Vasinfuse | IPS-001 | |
| Iris Scissors curved, stainless, 11cm | Optimal Medical Products Pte Ltd | CVD | |
| Light microscope with 10X lens | Olympus | ||
| Mesh Sheet 100µM Nylon | Spectra-Teknic(s) Pte Ltd | 06630-75 | |
| Operating Scissors, BL/BL, 13cm | Optimal Medical Products Pte Ltd | STR – BL/BL | |
| Operating Scissors, SH/BL, 13cm | Optimal Medical Products Pte Ltd | STR – SH/BL | |
| Reverse force hemostatic clip | Shanghai Jin Zhong Pte Ltd | XEC230 | |
| Water bath | Grant | ||
| Reagents/Chemicals | |||
| 10X Phosphate buffered saline (PBS) | Sigma-Aldrich | ||
| Bovine serum albumin (BSA) | Sigma-Aldrich | A9056 | |
| CaCl2·2H2O | Merck | 137101 | |
| Collagenase Type IV | Gibco | 17104019 | |
| Dexamethasone | TCI | D1961 | |
| DMEM | Gibco | 31600-034 | |
| Glutamax | Gibco | 35050061 | |
| HEPES | Invitrogen | 11344-041 | |
| Insulin | Sigma-Aldrich | 1-9278 | |
| KCl | VWR | VWRC26764.298 | |
| KH2PO4 | Sigma-Aldrich | P5379 | |
| Linoleic acid | Sigma-Aldrich | L9530 | |
| NaCl | Sigma-Aldrich | S5886 | |
| NaHCO3 | Sigma-Aldrich | S8875 | |
| NaOH | Merck | 106462 | |
| Penicillin-Streptomycin | Sigma-Aldrich | P4333 | |
| Type I bovine collagen | Advanced BioMatrix | 5005-100ml | |
| William’s E Media | Sigma-Aldrich | W1878 |
References
- Shen, L., Hillebrand, A., Wang, D. Q. H., Liu, M. Isolation and primary culture of rat hepatic cells. Journal of Visualized Experiments: JoVE. (64), e3917 (2012).
- Cabral, F., et al. Purification of hepatocytes and sinusoidal endothelial cells from mouse liver perfusion. Journal of Visualized Experiments: JoVE. (132), e56993 (2018).
- Green, C. J., et al. The isolation of primary hepatocytes from human tissue: optimising the use of small non-encapsulated liver resection surplus. Cell and Tissue Banking. 18 (4), 597-604 (2017).
- Seglen, P. O. Preparation of isolated rat liver cells. Methods in Cell Biology. 13, 29-83 (1976).
- Gopalakrishnan, S., Harris, E. N. In vivo liver endocytosis followed by purification of liver cells by liver perfusion. Journal of Visualized Experiments: JoVE. (57), e3138 (2011).
- Wen, J. W., Olsen, A. L., Perepelyuk, M., Wells, R. G. Isolation of rat portal fibroblasts by in situ liver perfusion. Journal of Visualized Experiments: JoVE. (64), e3669 (2012).
- Korelova, K., Jirouskova, M., Sarnova, L., Gregor, M. Isolation and 3D collagen sandwich culture of primary mouse hepatocytes to study the role of cytoskeleton in bile canalicular formation in vitro. Journal of Visualized Experiments: JoVE. (154), e60501 (2019).
- Shi, W., et al. Isolation and purification of immune cells from the liver. International Immunopharmacology. 85 (95), 106632 (2020).
- Salem, E. S. B., et al. Isolation of primary mouse hepatocytes for nascent protein synthesis analysis by non-radioactive L-azidohomoalanine labeling method. Journal of Visualized Experiments: JoVE. (140), e58323 (2018).
- Xia, L., et al. Tethered spheroids as an in vitro hepatocyte model for drug safety screening. Biomaterials. 33 (7), 2165-2176 (2012).
- Kegel, V., et al. Protocol for isolation of primary human hepatocytes and corresponding major populations of non-parenchymal liver cells. Journal of Visualized Experiments: JoVE. (109), e53069 (2016).
- Zhu, L., et al. A vertical-flow bioreactor array compacts hepatocytes for enhanced polarity and functions. Lab on a Chip. 16 (20), 3898-3908 (2016).
- Du, Y., et al. Synthetic sandwich culture of 3D hepatocyte monolayer. Biomaterials. 29 (3), 290-301 (2008).
- Tong, W. H., et al. Constrained spheroids for prolonged hepatocyte culture. Biomaterials. 80, 106-120 (2016).
- Xia, L., et al. Laminar-flow immediate-overlay hepatocyte sandwich perfusion system for drug hepatotoxicity testing. Biomaterials. 30 (30), 5927-5936 (2009).
- Gupta, K., et al. Bile canaliculi contract autonomously by releasing calcium into hepatocytes via mechanosensitive calcium channel. Biomaterials. 259, 120283 (2020).
- Horner, R., et al. Impact of Percoll purification on isolation of primary human hepatocytes. Scientific Reports. 9 (1), 6542 (2019).
- Osypiw, J. C., et al. Subpopulations of rat hepatocytes separated by Percoll density-gradient centrifugation show characteristics consistent with different acinar locations. The Biochemical Journal. 304, 617-624 (1994).
- Beal, E. W., et al. A small animal model of ex vivo normothermic liver perfusion. Journal of Visualized Experiments: JoVE. (136), e57541 (2018).
- Hillebrandt, K., et al. Procedure for decellularization of rat livers in an oscillating-pressure perfusion device. Journal of Visualized Experiments: JoVE. (102), e53029 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved