Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Primer Sıçan Hepatositlerinin Çok Parametreli Perfüzyon Kontrolü ile İzolasyonu
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Bu protokol, özel bir intravenöz kateter, standartlaştırılmış steril tek kullanımlık tüp, gerçek zamanlı izleme ile tamamlanan sıcaklık kontrolü ve izole primer sıçan hepatositlerinin yaşayabilirliği, verimi ve işlevselliğindeki tutarlılığı artırmak için iki aşamalı kollajenaz perfüzyon prosedürü için bir alarm sisteminin kullanımını detaylandırmaktadır.
Özet
Primer hepatositler, karaciğer hastalıkları üzerine yapılan temel araştırmalarda ve in vitro toksisite testlerinde yaygın olarak kullanılmaktadır. Primer hepatosit izolasyonu için iki aşamalı kollajenaz perfüzyon prosedürü, özellikle portal ven kanülasyonunda teknik olarak zordur. Prosedür ayrıca perfüzyon kurulumunun montajı, optimizasyonu veya bakımındaki zorluklar nedeniyle ara sıra kontaminasyona ve perfüzyon koşullarındaki değişikliklere eğilimlidir. Burada, çok parametreli perfüzyon kontrolü ile geliştirilmiş iki aşamalı kollajenaz perfüzyon prosedürü için ayrıntılı bir protokol sunulmaktadır. Primer sıçan hepatositleri, prosedürün kritik aşamalarında gerekli teknik önlemler alınarak ve özel bir intravenöz kateter, standartlaştırılmış steril tek kullanımlık boru, sıcaklık kontrolü ve gerçek zamanlı izleme ve alarm sisteminin benimsenmesi yoluyla operasyonel zorluğu azaltarak ve perfüzyon parametrelerinin değişkenliğini azaltarak başarılı ve güvenilir bir şekilde izole edildi. İzole primer sıçan hepatositleri sürekli olarak yüksek hücre canlılığı (% 85-% 95), verim (200-300 g sıçan başına 2-5 x 108 hücre) ve işlevsellik (albümin, üre ve CYP aktivitesi) sergiler. Prosedür, aseptik çalışmayı sağlamak için laminer akış davlumbazına kurulabilecek kadar kompakt olan entegre bir perfüzyon sistemi ile tamamlandı.
Giriş
Primer hepatositler, karaciğer ile ilgili temel araştırmalar, hastalık tedavisi ve ilaç testi gibi uygulamalar için önemli araçlardır. Primer hepatosit izolasyonu için mevcut altın standart, Seglen tarafından 1970'lerde tanıtılan iki aşamalı kollajenaz perfüzyon prosedürü 1,2,3'tür 4. Bununla birlikte, bu prosedür teknik olarak zordur ve acemi cerrahlar tarafından yapıldığında yüksek bir başarısızlık oranına sahiptir. Bir perfüzyonun başarılı olduğu düşünülse bile, izolasyonlar arasında hepatosit canlılığında (tipik olarak% 60-95) ve verimde (200-300 g sıçan başına 0.5-5 x 108) ciddi farklılıklar gözlenebilir. Bu, aşağı akış deneylerinin kalitesini ve ölçeğini etkiler. Teknik prosedürün yanı sıra, ticari olarak temin edilebilen veya özel olarak inşa edilen izolasyon için kullanılan perfüzyon kurulumu, katkıda bulunan bir faktördür. Perfüzyon kurulumunun montajına, optimizasyonuna ve bakımına dikkat edilmelidir. Bu protokolün amacı, teknik prosedürün çok parametreli perfüzyon kontrolü ve iki aşamalı kollajenaz perfüzyon prosedürünün perfüzyon kurulumu yoluyla primer sıçan hepatositlerinin izolasyonları arasındaki başarı oranını ve stabiliteyi arttırmaktır.
Teknik açıdan, prosedürdeki en zor adım portal ven kanülasyonudur. Diğer adımlara gelince, iyi uygulamalara uyulması ve genel önlemler alınması durumunda izolasyonun stabilitesi geliştirilebilir. Bu nedenle, cerrahın işlem sırasında ortaya çıkabilecek çeşitli değişkenlere cevap verebilmesi için her adımın mantığının anlaşılması önemlidir.
Hepatositlerin ve karaciğer parankimal olmayan hücrelerin sıçan ve fareden izole edilmesi için çeşitli protokoller yayınlanmıştır 1,2,5,6,7,8,9. Bu protokollerde kullanılan perfüzyon kurulumlarının, perfüzyon borularının yeniden kullanımı, sıcaklık kontrolü ile ilgili problemler, perfüzyon parametrelerinin rutin optimizasyonuna duyulan ihtiyaç ve / veya portal ven kanülasyonu için uygun olmayan intravenöz (IV) kateter tipinin kullanılması gibi çeşitli dezavantajları vardı. Perfüzyon borularının yeniden kullanılması, özellikle boru uygun şekilde temizlenmemiş ve dezenfekte edilmemişse, kontaminasyon olasılığını artıracaktır. Boruların rutin olarak değiştirilmeden yeniden kullanılması, perfüzyon kurulumunu sızdıran boru veya konektörler, tıkanmış kabarcık tuzağı ve daralmış boru gibi sorunlara da maruz bırakacak ve bunların hepsi perfüzyon basıncını ve akış hızını önemli ölçüde azaltacak ve böylece karaciğer sindirim verimliliğini etkileyecektir. Sıcaklık kontrolü için bazı kurulumlarda sabit bir ısı kaynağı olmadan, önceden ısıtılmış tamponlar zamanla soğur ve bu da düşük kollajenaz aktivitesine ve sindirime yol açar. Diğer kurulumlar, tamponu ısıtmak için bir su sirkülatörüne bağlı ceketli bir cam kondenser kullansa da, hacimlidir ve dikkatli temizlik gerektirir. Kateterden çıkan tamponun sıcaklığı, basıncı ve akış hızı, stabil perfüzyon durumunu sağlamak için izolasyon başlamadan önce ölçülmeli ve optimize edilmelidir. Optimizasyondan sonra bile, parametreler operatörün eylemleri nedeniyle izolasyon sırasında yarı yolda değişebilir, böylece yetersiz perfüzyon ve sindirime yol açabilir. Çoğu IV kateter tipi portal ven kanülasyonu için uygun değildir, çünkü kanülasyon sırasında sürekli perfüzyona izin vermezler. Kanülasyon başarılı olduğunda cerrahı hemen bilgilendiremezler. Ayrıca, portal veni yumuşak kateter üzerinde deforme etmeden sabitlemek zordur.
Burada, standartlaştırılmış tek kullanımlık steril boru, hassas ve kararlı sıcaklık kontrolü için silikon ısıtıcı ceket, veri depolama ve yönetimi ile gerçek zamanlı izleme ve alarm sistemi ve kanülasyon sırasında portal damarı delerken sürekli perfüzyona izin veren özel bir IV kateterin kullanımı ile bu sorunları ele alıyoruz. Bildiğimiz kadarıyla, tüm bu özellikleri kompakt bir entegre perfüzyon sisteminde (IPS) birleştiren ilk grubuz, bu da onu son derece taşınabilir hale getiriyor ve aseptik çalışmayı sağlamak için laminer bir akış davlumbazına sığdırılabiliyor.
Access restricted. Please log in or start a trial to view this content.
Protokol
Tüm prosedürler ve hayvan barınağı, Singapur Ulusal Üniversitesi Kurumsal Hayvan Bakımı ve Kullanımı Komitesi'nin (IACUC) gerekliliklerine uygun olarak R15-0027 ve R19-0669 protokol numaraları altında gerçekleştirilmiştir.
1. Solüsyonların ve cerrahi aletlerin hazırlanması
- Ultra saf su kullanarak Tablo 1'deki tamponları ve hücre kültürü ortamlarını hazırlayın.
- Kullanmadan önce kalsiyum içermeyen tamponu ve kollajenaz tamponunu bir su banyosunda 37 ° C'ye ısıtın.
- Aşağıdaki cerrahi aletleri ve laboratuar ekipmanlarını otoklav: bir çift keskin-künt cerrahi makas, bir çift künt-künt cerrahi makas, bir çift kavisli cerrahi makas, iki çift diş dokusu forseps, iki çift kavisli forseps, iki damar klipsi, 5 cm uzunluğunda 3-0 ipek cerrahi sütür, 100 μm naylon örgü filtre, 400 mL beher, ve bir sahne (yüzer mikrosantrifüj tüp rafı).
2. IPS'nin kurulması (bkz. Şekil 1)
- Laminer akış başlığını %70 etanol ile silin. IPS'yi %70 etanol ile silin ve laminer akış başlığına taşıyın. Kaputu açmadan önce >15 dakika UV ile sterilize edin.
DİKKAT: UV ışığına maruz kalmak ağrılı gözlere ve cilt yanıklarına neden olabilir. UV ışığı açıldığında kanadın tamamen kapalı olduğundan emin olun. - IPS üzerine yeni bir tek kullanımlık boru seti monte edin. Boruyu peristaltik pompanın aşağı yönünde silikon bir ısıtıcı cekete sarın. Perfüzyon monitörünü silikon ısıtıcı ceketin çıkış yönündeki boruya monte edin.
- Her iki boru girişi için makaralı kelepçelerin tamamen gevşetildiğinden emin olun. Her boru girişini steril 2 mL aspirasyon pipetinin konik ucuna bağlayın. Hem aspirasyon pipetlerini (girişleri) hem de IV kateteri (çıkış), sonraki astarlama adımlarında tamponun yeniden dolaşımına izin vermek için kalsiyumsuz tamponlu 1 L'lik bir şişede bırakın.
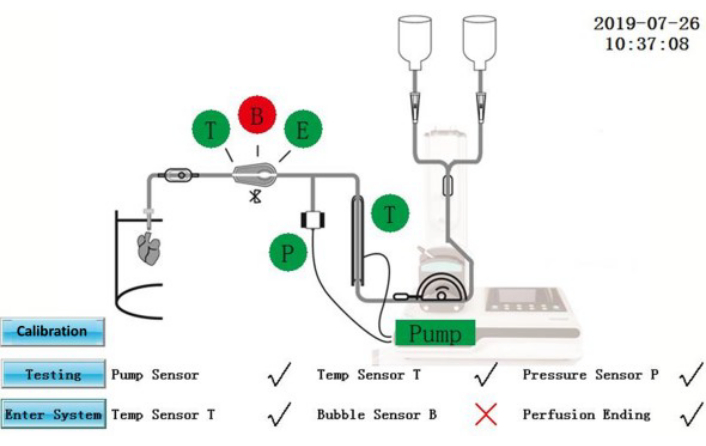
Şekil 2: Kendi kendine test arayüzü. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
- IPS'yi açın. Dokunmatik ekran kontrol panelinde aşağıdaki işlemleri gerçekleştirin. Yazılım, her başlatıldığında kapsamlı bir kendi kendine test gerçekleştirecektir.
DİKKAT: IPS, harici bir güç kaynağına bağlı elektrikli bir ekipmandır. IPS veya güç kablolarındaki sıvı dökülmeleri elektriksel tehlikelere neden olabilir.- Kendi kendine test durumunun ekranda görüntülendiğinden emin olun (Şekil 2). Kendi kendine testi geçen bileşenler yeşil renkle gösterilecektir; başarısız olanlar kırmızı renkle gösterilir. Düzeltmeden sonra, kendi kendine testi tekrarlamak için Test simgesine dokunun veya doğrudan işlem arayüzüne girmek için Sisteme Gir simgesine dokunun.
- İşletim arayüzünde oturum açmak için ekranda herhangi bir yere dokunun.
- İşletim arabiriminin sol üst köşesinde (Şekil 3), peristaltik pompanın dönüş yönünü ayarlamak için dairesel ok simgelerinden birine dokunun. Arayüzün sağ panelinde, ilgili parametrelerin değerlerini ayarlamak için yukarı/aşağı ok simgelerine dokunun. Akışı sabit akış moduna ayarlayın; ısıtıcı ceketinin sıcaklığı 42 ° C'ye kadar (perfüzyonun sıcaklığının 37 ° C'de tutulmasını sağlamak için ayarlanmalıdır); ve ~ 33 mL / dak akış hızı için 38 rpm'ye kadar pompa hızı.
- İşletim arayüzünün sağ alt panelinde, kabarcık alarmının, perfüzyon durdurma alarmının ve sessiz simgesinin durumunu kontrol edin.
- Sol paneldeki perfüzyonun sıcaklığını, basıncını ve akış hızını kontrol edin. Sütunların üstündeki ve altındaki yukarı-aşağı oklara tıklayarak aralıkları manuel olarak ayarlayın. Sütunların ortasında değer olarak gösterilen gerçek zamanlı verileri denetleyin. Gerçek zamanlı veriler ayarlanan aralığın dışına taşınırsa sütunun rengi yeşilden kırmızıya döner.
- Perfüzyonu başlatmak, duraklatmak ve durdurmak için simgeleri ve orta panelde gerçek zamanlı veri görüntülemeden grafik moduna geçmek için simgeyi bulun. Perfüzyona başlamak için başlat simgesine dokunun ve boruyu kalsiyum içermeyen tamponla astarlayın. Yeni bir günlük oluşturulur. Açılır pencereye dosya adını ve kullanıcı adını girin (Şekil 4).
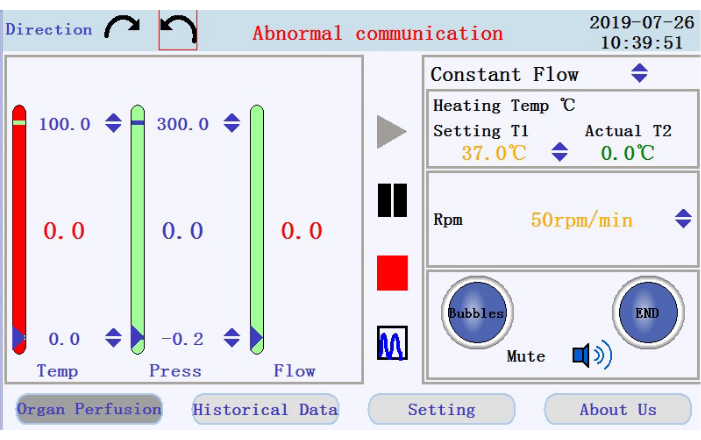
Şekil 3: İşletim arayüzü. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
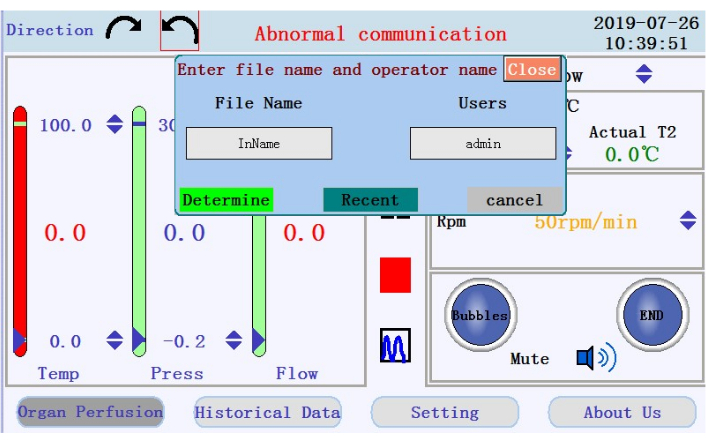
Şekil 4: Dosya adı ve kullanıcı adı isteyen açılır pencere. Bu şeklin daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
- Damlama odasını yarı yarıya doldurun. Astarlama sırasında boruda sıkışmış hava cepleri olmadığından emin olun.
- Kabarcığı çıkarmak ve dışarı atılmasına izin vermek için boruya hafifçe vurarak kabarcık filtresinin aşağı akışını oluşturan kabarcıkları çıkarın.
NOT: Tampon ısıtıcı ceket tarafından ısıtılırken boru boyunca kabarcıklar oluşabilir. - 400 mL'lik bir beheri 200 mL kollajenaz tamponu ile doldurun. Sahneyi kabın üstüne koyun. Boruya herhangi bir hava sokmadan, boru girişlerinden birinin makaralı kelepçesini tamamen sıkın ve giriş için aspirasyon pipetini beherin içine taşıyın.
3. Hayvan prosedürü
- Vücut ağırlığında 200-300 g civarında genç yetişkin bir erkek Wistar sıçanı hazırlayın.
NOT: Bu protokol, vücut ağırlığı 200-300 g civarında sıçanlar için optimize edilmiştir. Erkek sıçanlar tercih edilir, çünkü dişi sıçanlarda östrus döngüsü sırasında hormonal değişiklikler hepatosit fonksiyonunu etkileyecektir. - Anestezi
- Gerekli miktarda pıhtılaştırıcı heparin (5.000 IU / mL; 0.2 mL / 100 g vücut ağırlığı) ve sıçan anestezi ketamin / ksilazin kokteylini (37.5 mg / mL ketamin, 5 mg / mL ksilazin; 0.2 mL / 100 g vücut ağırlığı) 27 G iğne ile 1 mL şırıngalara çekin.
DİKKAT: Anestezi ve heparin zararlı maddelerdir. Keskinlikleri tutarken dikkatli olun. - Sıçanı kısıtlayın. İntraperitoneal olarak heparin ve ardından karnın sağ alt kadranına ketamin / ksilazin kokteyli enjekte edilir.
NOT: Caecum'un solda bulunma olasılığı daha yüksektir. Kontaminasyon riskini azaltmak için enjeksiyon sırasında caecum'u delmekten kaçının. - 10 dakika sonra, sıçanın her iki ayağındaki pedal refleksini değerlendirerek anestezi derinliğini kontrol edin. Zaman zaman kontrol etmeye devam edin ve sıçan artık ayak parmağı sıkışmalarına cevap vermeyene kadar bekleyin. Gerektiğinde ek anestezi enjekte edilebilir.
- Gerekli miktarda pıhtılaştırıcı heparin (5.000 IU / mL; 0.2 mL / 100 g vücut ağırlığı) ve sıçan anestezi ketamin / ksilazin kokteylini (37.5 mg / mL ketamin, 5 mg / mL ksilazin; 0.2 mL / 100 g vücut ağırlığı) 27 G iğne ile 1 mL şırıngalara çekin.
- Sıçanı, bir tepsinin üstündeki alüminyum folyo kaplı polistiren bir platform üzerine uzanmış uzuvlarla sırtüstü bir konuma yerleştirin. Sıçanın ayaklarını bantlayın ve bandı 27 G iğnelerle platforma güvenli bir şekilde sabitleyin.
- Göğsü ve karnı% 70 etanol ile püskürterek ve sürükleyerek dezenfekte edin. Dezenfeksiyondan önce tıraş olmak isteğe bağlıdır. Sıçanı kaputun içine koyun. Kürk hala ıslakken bir sonraki adıma geçin.
NOT: %70 etanol ile damlatma aynı zamanda kepek ve kürk tozunu minimumda tutar. - Cildi kastan ayırın.
- Bir elinizde bir çift diş dokusu forseps ile, cildi karın tabanına yakın bir yere kaldırın. Öte yandan bir çift keskin-künt cerrahi makas ile çadırlı cildi kesin. Makasın keskin ucunu cildin altına itin ve arka bacakların hemen üstünden ön bacakların hemen altına kadar cilt üzerinde orta hat kesisi yapın.
- Forseps ile cildi yukarı çekip hafifçe gererken, cildi göğüs ve karın kaslarına tutan herhangi bir bağ dokusunu kesin. Kirlenme riskini azaltmak için, gevşek kürklerin kas üzerine düşmesini önleyin. Makas üzerindeki birikmiş gevşek kürkleri çıkarmak için, cildin dezenfekte edilmiş dış tarafındaki bunları silin.
- Ciltte, orta hattan sıçanın her iki tarafına kadar arka bacakların biraz üstünde ve ön bacakların biraz altında yanal kesikler yapın. Kasları açığa çıkarmak için cildin kanatlarını yanlara doğru itin.
- Organları açığa çıkarmak için karın kasını kesin.
- Bir elinizde yeni bir çift diş dokusu forseps ile, kası karın tabanına yakın bir yere kaldırın. Öte yandan bir çift künt-künt cerrahi makas ile, hiçbir organı çentiklemeden kası dikkatlice kesin. Kas üzerinde arka bacakların biraz üstünden sternuma kadar bir orta hat kesisi yapın.
- Kas üzerinde, orta hattan sıçanın her iki tarafına kadar, arka bacakların biraz üstünde ve göğüs kafesinin hemen altında, organların hiçbirini çentiklemeden yanal kesikler yapın. Organları açığa çıkarmak için kas kanatlarını yanlara doğru itin. Cildin ve kasın yanal kesiklerinin, daha sonraki adımlarda kan ve tamponların karın boşluğundan dışarı akmasına izin vermek için sıçanın yanlarına ulaştığından emin olun.
- Portal ven kanülasyonu
- Kavisli forsepslerin arkasıyla, bağırsakları yavaşça sağa doğru itin. Portal damarı açığa çıkarmak için karaciğer loblarını yavaşça yukarı çevirin.
- Portal venin etrafında, karaciğere yakın çok gevşek bir ligatür yapmak için, damar farklı karaciğer loblarına sola ve sağa dallanmadan hemen önce 3-0 ipek cerrahi sütür kullanın. Portal damardan kan akışını bozmamak için bağı sıkmayın. Safra kanalının altındaki çok ince bir zarın, dikişin altından geçebilmesi ve portal venin (ve safra kanalının) etrafında ilmek kaydedilebilmesi için kavisli forsepslerin ucuyla kırılması gerekecektir.
- İki çift kavisli forseps uçlarını kullanarak, portal venin altındaki dokudan portal vene zarar vermeden dikkatlice bir delik açın. Bunu, gastrik ven portal venden ayrılmadan hemen önce, ilk ligatürün yaklaşık 2-3 cm yukarısında yapın. Doku bu spesifik yerde daha incedir.
- Forseps ile deliği dikkatlice gerin. Bu delik, forsepslerin kanülasyon sırasında portal damarı desteklemesine izin verecektir.
- ~3 mL/dak debi için pompa hızını 4 rpm'ye düşürün. IV kateterden kalsiyum içermeyen tampon çıkışının yavaş bir damlamaya indirgendiğinden emin olun.
NOT: Karaciğerde basınç birikmesi hepatosit ölümüne neden olur. Daha düşük bir akış hızı, kanülün daha sonraki bir adımda portal ven içine başarılı bir şekilde yerleştirilmesi üzerine karaciğerdeki basınç birikimini yavaşlatmalıdır. - Forseps kullanarak portal damarı nazikçe destekleyin. Öte yandan, IV kateteri iğnenin eğimi yukarı bakacak şekilde tutun. İğneyi portal damara 10-20 ° 'lik bir açıyla yönlendirin ve tüm eğim damarın içine girene kadar yavaşça ilerleyin. İğne portal ven içine doğru bir şekilde yerleştirildikten sonra, karaciğer beyazlamaya ve koyu kırmızı rengini kaybetmeye başlayacaktır.
NOT: Kanülün yerleştirilmesi için yeterince büyük bir delik oluşturmak için iğnenin tüm eğimi damara sokulmalıdır. Bununla birlikte, damarın aşırı delinmesini önlemek için iğneyi çok derine sokmayın. - Kanülü iğnenin üzerinden ve damarın içine doğru ilerletin. Ardından, iğneyi kanülün 2-3 mm arkasına gelene kadar geri çekin; keskin ucun kanül içinde güvenli bir şekilde olması için yeterlidir. Kateteri tutmak için başparmağınızı ve orta parmağınızı kullanın ve iğneyi geri çekmek için kanadı geri çekmek için işaret parmağınızı kullanın.
- Portal damarı bir damar klipsi ile kateter üzerine hızlı bir şekilde sabitleyin. Serpme akışını bozmamak için doğrudan iğnenin yan deliğine klipslemeyin. Bunun yerine, altına kırpın.
- Karaciğerde basınç birikmesini önlemek için hemen infrahepatik inferior vena kavayı (IVC) kesin. Şimdiye kadar infrahepatik IVC ve bitişik kan damarları portal venden gelen kanla gizlenecektir. IVC'nin doğru şekilde kesilmesini ve kesilmesini sağlamak için, nabızlarda dışarı fışkıran kanı gözlemleyin; kan sadece bitişik damarlardan damlar.
NOT: Kanülasyondan sonra infrahepatik IVC'nin kesilmesinin çok uzun sürmesi veya bir sonraki adıma geçmeden önce kesilmemesi hepatosit ölümüne neden olacaktır. Hayvan, bu adımda exsanguination (IVC'nin kesilmesi yoluyla) ile anestezi altında ötenazi yapılır. Kan kaybı devam ederken prosedür devam etmelidir. Ölüm, göğüs boşluğu daha sonraki bir adımda açıldığında kalp atışı / solunumun kesilmesinin görsel olarak gözlemlenmesiyle doğrulanabilir. - ~33 mL/dak akış hızı için pompa hızını 38 rpm'ye yükseltin. IVC'yi forseps ile 2-3 s (ancak çok uzun süre değil) kapatarak ve tekrar açarak karaciğeri üç kez yıkayın.
NOT: Yıkama sırasında, karaciğer normale dönmeden önce hafifçe genişleyecektir. Kızarma, tüm karaciğer boyunca nüfuz etmenin nüfuz etmesini kolaylaştırır. Kızarmadan sonra, karaciğer tamamen açık kahverengi renkte olmalıdır. - Tüm karaciğer loblarının perfüzyonunu sağlamak için kanül ucunun, portal venin farklı karaciğer loblarına dallandığı noktadan önce yerleştirildiğinden emin olun. Gerekirse, portal damarı çıkarın ve kanülün konumunu ayarlayın. Daha sonra tekrar kırpın.
- Portal damarın etrafındaki gevşek bağı dallanma noktasının biraz yukarısında sıkın. Yumuşak kanülün sert metal iğne tarafından desteklendiği yerde, eğim ve yan delik arasında üç düğüm yapın. Düğümlerin kanülü yerine sabitlediğinden, portal damarına sabitlediğinden ve tamponların geri akışını önlediğinden emin olun.
- Tüm karaciğeri bozulmadan rezeke edin.
- Karaciğeri, sonraki 12 dakika boyunca ~ 33 mL / dak akış hızında kalsiyum içermeyen tamponla perfüze edin (bkz. Şekil 5A). Bu arada, karaciğer rezeksiyonu yapın. Perfüzyon süresi gerekirse uzatılabilir, ancak kalsiyum içermeyen tamponun tükenmemesini sağlar.
- Bir çift kavisli makas kullanarak, portal damarı, onları birbirine bağlayan mezenteri keserek bağırsaklardan dikkatlice ayırın. Kontaminasyon oluşmadığından emin olmak için gastrointestinal sistemi (yemek borusu, mide ve ince ve kalın bağırsaklar) tıkamayın.
NOT: Bu, rezeksiyon sırasında karaciğer hareket ettirildiğinde portal venin yırtılmasını önlemek içindir. - Karaciğeri gastrointestinal sisteme bağlayan bağ dokularını, pankreası ve mezenteri keserek karaciğeri gastrointestinal sistemden ayırın. Ayırmak için, daima makasla kesin ve yırtılmak için çekmeyin. Yine, gastrointestinal sistemi kesmeyin veya kesmeyin.
- Diyaframı açığa çıkarmak için karaciğeri yavaşça aşağı çevirin. Kaburgaların duvarlarını takip ederek diyaframı kesin. Diyaframın çoğunun karaciğere bağlı kaldığından emin olun. Karaciğeri dürtmemeye veya çürütmemeye dikkat edin.
- Göğüs boşluğu açıldıktan sonra, iki kanal görülebilir: solda beyazımsı suprahepatik IVC ve sağda sarımsı yemek borusu. Suprahepatik IVC'yi kırpın ve klibin hemen üzerinde kesin. Suprahepatik IVC'nin kesilmesi isteğe bağlıdır. Göğüs boşluğunun su basmasını önler.
NOT: Hayvan ölümünü doğrulamak için kalp atışının / solunumun durmasını görsel olarak gözlemleyin. - Yemek borusu diyaframla çevrilidir. Yemek borusunu diyaframdan izole etmek için, diyaframı sağdan yemek borusuna doğru kesin. Yemek borusunu ve mideyi karaciğere ve diyaframa bağlayan kalan bağ dokularını kesin.
- Gastrointestinal sistemi sağa doğru itin. Damar klipsini suprahepatik IVC'den infrahepatik IVC'ye aktarın; tampon şimdi suprahepatik IVC'den dışarı çıkacaktır.
NOT: Perfüzyon sırasında, kanül ve infrahepatik IVC karaciğer tarafından kaplanacaktır. Suprahepatik IVC'den güçlü tampon çıkışı, cerrahın perfüzyon sızıntılarını dışlamasına yardımcı olacaktır. - Karaciğeri göğüs boşluğuna bağlayan kalan diyaframı kesin. Karaciğeri karın boşluğuna bağlayan dokuları kesin. Klipsin karaciğerden ayrılmasını önlemek için infrahepatik IVC'yi klipsin üzerinde kesmemeye dikkat edin.
- Karaciğerin tamamen rezeke edildiğinden emin olmak için, forseps ile diyaframa tutunarak karaciğeri dikkatlice kaldırın. Karaciğeri karın boşluğuna bağlayan kalan dokular varsa, bunları kesin. Böbrek ve dalak hala karaciğere bağlıysa, onları ayırın.
4. Karaciğer perfüzyonu ve sindirim
- Rezeksiyon erken tamamlanmışsa, karaciğer 12 dakika boyunca kalsiyum içermeyen tampon ile perfüze edilene kadar bekleyin.
- Perfüzyon tamponunu kollajenaz tamponuna değiştirin. Kalsiyum içermeyen tampon için silindir kelepçesini tamamen sıkmadan önce kollajenaz tamponu için silindir kelepçesini tamamen gevşetin (bkz. Şekil 5B). Kollajenaz tamponu tüpten karaciğere ulaştığında, suprahepatik IVC'yi 2-3 s boyunca kapatıp tekrar açarak karaciğeri üç kez yıkayın.
- Kollajenaz tamponunun devridaimi için karaciğeri beherin üstündeki aşamaya dikkatlice hareket ettirin. Kateteri desteklerken forseps ile diyaframı tutarak karaciğeri hareket ettirin. Kazara kateter ayrılmasını önlemek için kateteri çekmekten kaçının.
NOT: Kateter ayrılırsa ve portal ven yeniden kanülasyon için çok hasar görmüşse, suprahepatik IVC'yi kanüle edin ve tamponun portal venden dışarı çıkmasına izin verin. İnfrahepatik IVC'nin kırpılmış kaldığından emin olun. - Karaciğeri 12 dakika boyunca sindirin. Karaciğer pürüzsüz kahverengi dokusunu kaybetmeye başladığında yarı saydam lekelerin / ağın görünümünü gözlemleyin. Karaciğer sindirildikçe daha büyük ve daha yumuşak hale gelecektir. Karaciğer yumuşak bir kıvama ulaştığında, perfüzyonu durdurun. Gerekirse sindirim süresi uzatılabilir.
NOT: Glisson'un kapsülü kırılmışsa, beherdeki kollajenaz tamponu, kaçan karaciğer hücreleri nedeniyle bulanıklaşabilir.
5. Hepatosit izolasyonu
- Portal damarını keserek kanülü dikkatlice çıkarın. Klipsi dikkatlice çıkarın. Karaciğeri, 60 mL soğuk Dulbecco'nun Modifiye Kartal Ortamı (DMEM) içeren 150 mm'lik bir kaba aktarın.
- Glisson'un kapsülünü kırmak ve soymak için kavisli forsepslerin arka tarafını kullanarak karaciğere hafifçe dokunun. Daha sonra, karaciğer hücrelerini serbest bırakmak için DMEM'de karaciğeri yavaşça yan yana sallayın. Karaciğer hücreleri DMEM'ye tamamen ayrışana kadar bunu yapmaya devam edin.
NOT: Bazen tüm karaciğer veya belirli loblar sadece kısmen sindirilir. Ayrışmamış hepatositleri zorla çıkaracak ve zarar verecek karaciğeri kazımayarak, daha yüksek ve daha tutarlı bir hücre canlılığı elde edilebilir. - Karaciğer hücreleri DMEM'de iyi dağılana kadar 150 mm'lik kabı yavaşça sallayın. Doku parçalarını ve hücre kümelerini çıkarmak için, hücre süspansiyonunu 150 mm'lik yeni bir kabın üzerine yerleştirilmiş 100 μm gözenek boyutunda naylon ağ filtresinden geçirin. Eski tabağı 30 mL DMEM ile durulayın ve süspansiyonu ağ filtresine aktarın. Sıkışmış tek karaciğer hücrelerinin geçmesine izin vermek için ağ filtresine hafifçe dokunun.
- Ağ filtresini çıkarın ve karaciğer hücreleri iyi dağılana kadar yeni 150 mm'lik kabı yavaşça sallayın. Süspansiyonu eşit olarak 4 x 50 mL tüplere bölün. Çanağı 30 mL DMEM ile durulayın ve süspansiyonu eşit olarak aynı tüplere bölün. Her tüpün eşit miktarda hücre süspansiyonuna sahip olduğundan emin olun.
- 4 x 50 mL hücre süspansiyon tüplerini 50 x g'de 4 ° C'de 2 dakika boyunca santrifüj edin. Gevşek peleti rahatsız etmeden süpernatantı dikkatlice aspire edin. Süper natantı atın. Her tüpe 20 mL DMEM ekleyin ve hücre peletini yeniden askıya almak için tüpleri hafifçe sallayın. Hücre süspansiyonunu dört tüpten ikiye birleştirin.
- 2 x 50 mL boruları 20 x g'de 4 °C'de 2 dakika boyunca santrifüj yapın. Süper natantı aspire edin ve atın. Her tüpe 20 mL DMEM ekleyin ve hücre peletini yeniden askıya almak için tüpleri hafifçe sallayın. İki tüpten hücre süspansiyonunu bir tüpte birleştirin. Hücreleri kullanana kadar buz üzerinde tutun.
- 400 μL 1x PBS'yi 50 μL tripan mavisi ile karıştırarak tripan mavisi çözeltisi hazırlayın. Tripan mavisi çözeltisine 50 μL hepatosit süspansiyonu ekleyin. Işık mikroskobu altında bir hemositometre ile canlı ve ölü hepatositlerin sayısını sayın.
6. Hepatosit kültürü
- Kaputtaki tüm hücre kültürü adımlarını gerçekleştirin. 35 mm'lik bir kaba 1 mL kollajen kaplama çözeltisi ekleyin ve 4 saat boyunca inkübe edin. Bulaşıkları 1x PBS ile üç kez durulayın.
- Hepatosit kültür ortamındaki hepatosit süspansiyonunu 0.8 milyon hücre / mL konsantrasyonuna kadar seyreltin. 35 mm'lik kaba 1 mL seyreltilmiş hepatosit süspansiyonu ekleyin.
NOT: Hepatositler pipetleme sırasında kayma gerilmesine karşı hassastır. Geniş delikli pipet uçları kullanmayı düşünün. - Hepatositleri eşit olarak dağıtmak için tabağı sallayın. Hepatositlerin yapışmasına izin vermek için 37 ° C'de, 3-4 saat boyunca% 5 CO2'de inkübe edin.
- Sandviç kültürü için.
- Hepatosit kültür ortamını çıkarın. Bağlanmamış hücreleri çıkarmak için 1 mL hepatosit kültür ortamı ile bir kez durulayın. 1 mL kolajen kaplama çözeltisi ekleyin. Çözeltiye kabarcıklar sokmamak için kabın duvarlarına kolajen kaplama çözeltisi ekleyin.
- Kollajen jelasyonuna izin vermek için gece boyunca% 37 ° C'de,% 5 CO2'de inkübe edin.
- 1 mL taze hepatosit kültür ortamı ekleyin. 37 °C'de inkübe edin,% 5 CO2.
- Tek katmanlı kültür için.
- Adım 6.3'ten sonra, hepatosit kültür ortamını çıkarın. Bağlanmamış hücreleri çıkarmak için 1 mL hepatosit kültür ortamı ile bir kez durulayın.
- 1 mL taze hepatosit kültür ortamı ekleyin. 37 °C'de inkübe edin,% 5 CO2.
- Daha önce tarif edildiği gibi hepatosit spesifik belirteç ve fonksiyonel tahliller için immün boyama yaparak hepatosit saflığını ve fonksiyonunu değerlendirin10,11.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Bir cerrah, belirli adımlardan sonra sonucu gözlemleyerek karaciğer perfüzyonunun sorunsuz bir şekilde devam edip etmediğini söyleyebilir. İlk sonuç kanülasyon, infrahepatik IVC'nin kesilmesi ve perfüzyon akış hızının geri kazanılması üzerine gözlemlenebilir. Karaciğer, hacmini korurken koyu kırmızıdan kahverengiye tamamen renk değiştirmiş olmalıdır. Karaciğer hafifçe sönük görünüyorsa ve kırmızımsı bir renk tonu veya kırmızı lekeleri varsa, perfüzyon akış hızının yanlış...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Genel olarak iki aşamalı kollajenaz perfüzyon prosedürü için özellikle dikkat edilmesi gereken birkaç nokta vardır. İlk olarak, karaciğeri rezeke ederken özel dikkat gösterilmelidir. İçeriğin sızması bakteriyel kontaminasyona neden olacağından gastrointestinal sistemin zarar görmediğinden emin olun. Ek olarak, hayvan prosedürü sırasında karaciğerin yüzeyini kaplayan Glisson kapsülüne zarar vermekten kaçının. Yırtık yeterince büyükse, ilişkisiz hepatositlerin kollajenaz tamponuna erke...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Zhou Yan ve Hanry Yu, Entegre Perfüzyon Sistemi'ni üreten ve pazarlayan Vasinfuse'da hisse sahibi oldukları için rakip çıkarlarını beyan ediyorlar. Hanry Yu, burada bildirilen bilgilerle rekabet eden çıkarları olmayan Histoindex, Invitrocue, Osteopore, Pishon Biomedical, Ants Innovate ve Synally Futuristech'te hisse senedine sahiptir.
Teşekkürler
Bu çalışma kısmen MOE ARC (MOE2017-T2-1-149) tarafından desteklenmektedir; NUHS İnovasyon Tohum Hibe 2017 (NUHSRO/2017/051/InnovSeed/02); Singapur Mekanobiyoloji Enstitüsü (R-714-106-004-135); ve Biyomühendislik ve Nanoteknoloji Enstitüsü, Biyomedikal Araştırma Konseyi, Bilim, Teknoloji ve Araştırma Ajansı (A * STAR) (Proje Numaraları IAF-PP H18/01/a0/014, IAF-PP H18/01/a0/K14 ve MedCaP-LOA-18-02) Hanry Yu'ya fon sağladı. Ng Chan Way, Singapur Ulusal Üniversitesi'nde araştırma görevlisidir. Singapur Ulusal Üniversitesi Konfokal Mikroskopi Ünitesi ve Akış Sitometri Ünitesi'ne hepatosit saflık analizinde yardım ve tavsiyeler için teşekkür ederiz.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Material/Equipment | |||
| 1 mL syringe | Nipro | ||
| 27G needle | Nipro | ||
| Black braided silk non-absorbable, non-sterile surgical suture | Look | SP117 | |
| Bochem 18/10 stainless steel forceps, sharp tip contain bent round tip | Bochem | 10333511 | |
| Disposable Perfusion Set | Vasinfuse | BPF-112 | |
| Floating circular 1.5 mL microcentrifuge tube rack | Sigma-Aldrich | R3133 | |
| German Standard Tissue Forceps, Serrated / 1×2 teeth , 14.5cm | Walentech | ||
| Greiner Cellstar aspirating pipette | Merck | GN710183 | |
| Haemocytometer | |||
| Integrated Perfusion System | Vasinfuse | IPS-001 | |
| Iris Scissors curved, stainless, 11cm | Optimal Medical Products Pte Ltd | CVD | |
| Light microscope with 10X lens | Olympus | ||
| Mesh Sheet 100µM Nylon | Spectra-Teknic(s) Pte Ltd | 06630-75 | |
| Operating Scissors, BL/BL, 13cm | Optimal Medical Products Pte Ltd | STR – BL/BL | |
| Operating Scissors, SH/BL, 13cm | Optimal Medical Products Pte Ltd | STR – SH/BL | |
| Reverse force hemostatic clip | Shanghai Jin Zhong Pte Ltd | XEC230 | |
| Water bath | Grant | ||
| Reagents/Chemicals | |||
| 10X Phosphate buffered saline (PBS) | Sigma-Aldrich | ||
| Bovine serum albumin (BSA) | Sigma-Aldrich | A9056 | |
| CaCl2·2H2O | Merck | 137101 | |
| Collagenase Type IV | Gibco | 17104019 | |
| Dexamethasone | TCI | D1961 | |
| DMEM | Gibco | 31600-034 | |
| Glutamax | Gibco | 35050061 | |
| HEPES | Invitrogen | 11344-041 | |
| Insulin | Sigma-Aldrich | 1-9278 | |
| KCl | VWR | VWRC26764.298 | |
| KH2PO4 | Sigma-Aldrich | P5379 | |
| Linoleic acid | Sigma-Aldrich | L9530 | |
| NaCl | Sigma-Aldrich | S5886 | |
| NaHCO3 | Sigma-Aldrich | S8875 | |
| NaOH | Merck | 106462 | |
| Penicillin-Streptomycin | Sigma-Aldrich | P4333 | |
| Type I bovine collagen | Advanced BioMatrix | 5005-100ml | |
| William’s E Media | Sigma-Aldrich | W1878 |
Referanslar
- Shen, L., Hillebrand, A., Wang, D. Q. H., Liu, M. Isolation and primary culture of rat hepatic cells. Journal of Visualized Experiments: JoVE. (64), e3917(2012).
- Cabral, F., et al. Purification of hepatocytes and sinusoidal endothelial cells from mouse liver perfusion. Journal of Visualized Experiments: JoVE. (132), e56993(2018).
- Green, C. J., et al. The isolation of primary hepatocytes from human tissue: optimising the use of small non-encapsulated liver resection surplus. Cell and Tissue Banking. 18 (4), 597-604 (2017).
- Seglen, P. O. Preparation of isolated rat liver cells. Methods in Cell Biology. 13, 29-83 (1976).
- Gopalakrishnan, S., Harris, E. N. In vivo liver endocytosis followed by purification of liver cells by liver perfusion. Journal of Visualized Experiments: JoVE. (57), e3138(2011).
- Wen, J. W., Olsen, A. L., Perepelyuk, M., Wells, R. G. Isolation of rat portal fibroblasts by in situ liver perfusion. Journal of Visualized Experiments: JoVE. (64), e3669(2012).
- Korelova, K., Jirouskova, M., Sarnova, L., Gregor, M. Isolation and 3D collagen sandwich culture of primary mouse hepatocytes to study the role of cytoskeleton in bile canalicular formation in vitro. Journal of Visualized Experiments: JoVE. (154), e60501(2019).
- Shi, W., et al. Isolation and purification of immune cells from the liver. International Immunopharmacology. 85 (95), 106632(2020).
- Salem, E. S. B., et al. Isolation of primary mouse hepatocytes for nascent protein synthesis analysis by non-radioactive L-azidohomoalanine labeling method. Journal of Visualized Experiments: JoVE. (140), e58323(2018).
- Xia, L., et al. Tethered spheroids as an in vitro hepatocyte model for drug safety screening. Biomaterials. 33 (7), 2165-2176 (2012).
- Kegel, V., et al. Protocol for isolation of primary human hepatocytes and corresponding major populations of non-parenchymal liver cells. Journal of Visualized Experiments: JoVE. (109), e53069(2016).
- Zhu, L., et al. A vertical-flow bioreactor array compacts hepatocytes for enhanced polarity and functions. Lab on a Chip. 16 (20), 3898-3908 (2016).
- Du, Y., et al. Synthetic sandwich culture of 3D hepatocyte monolayer. Biomaterials. 29 (3), 290-301 (2008).
- Tong, W. H., et al. Constrained spheroids for prolonged hepatocyte culture. Biomaterials. 80, 106-120 (2016).
- Xia, L., et al. Laminar-flow immediate-overlay hepatocyte sandwich perfusion system for drug hepatotoxicity testing. Biomaterials. 30 (30), 5927-5936 (2009).
- Gupta, K., et al. Bile canaliculi contract autonomously by releasing calcium into hepatocytes via mechanosensitive calcium channel. Biomaterials. 259, 120283(2020).
- Horner, R., et al. Impact of Percoll purification on isolation of primary human hepatocytes. Scientific Reports. 9 (1), 6542(2019).
- Osypiw, J. C., et al. Subpopulations of rat hepatocytes separated by Percoll density-gradient centrifugation show characteristics consistent with different acinar locations. The Biochemical Journal. 304, Pt 2 617-624 (1994).
- Beal, E. W., et al. A small animal model of ex vivo normothermic liver perfusion. Journal of Visualized Experiments: JoVE. (136), e57541(2018).
- Hillebrandt, K., et al. Procedure for decellularization of rat livers in an oscillating-pressure perfusion device. Journal of Visualized Experiments: JoVE. (102), e53029(2015).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır