Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Выделение первичных гепатоцитов крыс с помощью многопараметрического перфузионного контроля
* Эти авторы внесли равный вклад
В этой статье
Резюме
Этот протокол подробно описывает использование специального внутривенного катетера, стандартизированной стерильной одноразовой трубки, контроля температуры, дополненного мониторингом в режиме реального времени, и системы сигнализации для двухэтапной процедуры перфузии коллагеназы для улучшения согласованности жизнеспособности, выхода и функциональности изолированных первичных гепатоцитов крыс.
Аннотация
Первичные гепатоциты широко используются в фундаментальных исследованиях заболеваний печени и для тестирования токсичности in vitro. Двухэтапная процедура перфузии коллагеназы для первичной изоляции гепатоцитов технически сложна, особенно при канюляции воротных вен. Процедура также подвержена случайным загрязнениям и изменениям условий перфузии из-за трудностей в сборке, оптимизации или обслуживании перфузионной установки. Здесь представлен подробный протокол улучшенной двухэтапной процедуры перфузии коллагеназы с многопараметрическим перфузионным контролем. Первичные гепатоциты крыс были успешно и надежно выделены путем принятия необходимых технических мер предосторожности на критических этапах процедуры, а также путем снижения эксплуатационных трудностей и смягчения изменчивости параметров перфузии путем принятия специального внутривенного катетера, стандартизированной стерильной одноразовой трубки, контроля температуры, а также системы мониторинга и сигнализации в режиме реального времени. Изолированные первичные гепатоциты крысы последовательно демонстрируют высокую жизнеспособность клеток (85%-95%), выход (2-5 х 108 клеток на 200-300 г крысы) и функциональность (альбумин, мочевина и активность CYP). Процедура была дополнена интегрированной перфузионной системой, которая достаточно компактна, чтобы быть установленной в ламинарной вытяжке для обеспечения асептической работы.
Введение
Первичные гепатоциты являются важными инструментами для фундаментальных исследований, связанных с печенью, лечения заболеваний и применения, таких как тестирование на наркотики. В настоящее время золотым стандартом первичной изоляции гепатоцитов является двухэтапная процедура перфузии коллагеназы 1,2,3, введенная Сегленом в 1970-хгодах 4. Тем не менее, эта процедура является технически сложной и имеет высокий уровень неудач при выполнении начинающими хирургами. Даже когда перфузия считается успешной, между выделениями могут наблюдаться резкие различия в жизнеспособности гепатоцитов (обычно 60-95%) и выходе (0,5-5 х 108 на 200-300 г крысы). Это влияет на качество и масштаб последующих экспериментов. Помимо технической процедуры, перфузионная установка, используемая для изоляции, либо коммерчески доступная, либо изготовленная на заказ, является способствующим фактором. Необходимо уделить внимание сборке, оптимизации и обслуживанию перфузионной установки. Целью данного протокола является повышение успешности и стабильности между выделениями первичных гепатоцитов крыс посредством многопараметрического перфузионного контроля технической процедуры и перфузионной установки двухэтапной процедуры перфузии коллагеназы.
С технической точки зрения самым сложным этапом процедуры является канюляция воротной вены. Что касается других шагов, то при соблюдении надлежащей практики и принятии общих мер предосторожности стабильность изоляции может быть улучшена. Поэтому понимание причин для каждого шага важно, чтобы хирург мог реагировать на различные переменные, которые могут возникнуть во время процедуры.
Различные протоколы выделения гепатоцитов и непаренхиматозных клеток печени у крыс и мышей были опубликованы 1,2,5,6,7,8,9. Перфузионные установки, используемые в этих протоколах, имели несколько недостатков, которые включают повторное использование перфузионных трубок, проблемы с контролем температуры, необходимость рутинной оптимизации параметров перфузии и / или использование неподходящего типа внутривенного (IV) катетера для канюляции портальных вен. Повторное использование перфузионных трубок увеличит вероятность загрязнения, особенно если трубки не были очищены и продезинфицированы должным образом. Повторное использование трубок без рутинной замены также подвергнет перфузионную установку таким проблемам, как протекающие трубки или соединители, засорение пузырьковой ловушки и суженные трубки, все из которых значительно снизят давление перфусата и скорость потока, тем самым влияя на эффективность пищеварения печени. Без постоянного источника тепла в некоторых установках для контроля температуры предварительно нагретые буферы со временем будут охлаждаться, что приводит к низкой активности коллагеназы и пищеварению. Хотя в других установках используется стеклянный конденсатор с рубашкой, подключенный к циркуляции воды для нагрева буфера, они громоздкие и требуют тщательной очистки. Температура, давление и расход буфера, выходящего из катетера, должны быть измерены и оптимизированы до начала изоляции, чтобы обеспечить стабильное состояние перфузии. Даже после оптимизации параметры все равно могли меняться на полпути во время изоляции из-за действий оператора, что приводило к неоптимальной перфузии и пищеварению. Большинство типов внутривенных катетеров не подходят для канюляции воротных вен, поскольку не допускают непрерывной перфузии во время канюляции. Они не могут немедленно сообщить хирургу, когда канюляция успешна. Кроме того, трудно закрепить воротную вену на мягком катетере, не деформируя ее.
Здесь мы решаем эти проблемы с помощью стандартизированной одноразовой стерильной трубки, силиконовой рубашки нагревателя для точного и стабильного контроля температуры, системы мониторинга и сигнализации в режиме реального времени с хранением и управлением данными и использованием специального катетера IV, который позволяет непрерывную перфузию при прокалывании воротной вены во время канюляции. Насколько нам известно, мы являемся первой группой, которая объединила все эти функции в компактную интегрированную перфузионную систему (IPS), что делает ее очень портативной и способной помещаться в ламинарный проточный капот для обеспечения асептической работы.
Access restricted. Please log in or start a trial to view this content.
протокол
Все процедуры и содержание животных проводились по протокольным номерам R15-0027 и R19-0669 в соответствии с требованиями Институционального комитета по уходу и использованию животных (IACUC) Национального университета Сингапура.
1. Приготовление растворов и хирургических инструментов
- Подготовьте буферы и питательные среды для культивирования клеток в таблице 1 , используя сверхчистую воду.
- Перед использованием предварительно разогрейте буфер без кальция и буфер коллагеназы до 37 °C на водяной бане.
- Автоклав следующих хирургических инструментов и лабораторного оборудования: пара острых тупых хирургических ножниц, пара тупых хирургических ножниц, пара изогнутых хирургических ножниц, две пары зубно-тканевых щипцов, две пары изогнутых щипцов, два зажима для вен, шелковый хирургический шов длиной 5 см 3-0, фильтр нейлоновой сетки 100 мкм, стакан 400 мл, и ступень (плавающая стойка для микроцентрифуги).
2. Настройка IPS (см. рисунок 1)
- Протрите ламинарную вытяжку 70% этанолом. Протрите IPS 70% этанолом и переместите его в ламинарную вытяжку. Стерилизуйте УФ-излучением в течение >15 минут перед включением капота.
ВНИМАНИЕ: Воздействие ультрафиолетового света может вызвать болезненные ожоги глаз и кожи. Убедитесь, что створка полностью закрыта при включении ультрафиолетового излучения. - Соберите новый комплект одноразовых трубок на IPS. Оберните трубку после перистальтического насоса в силиконовую рубашку нагревателя. Соберите монитор перфузии на трубке после силиконовой рубашки нагревателя.
- Убедитесь, что роликовые зажимы для обоих входных отверстий труб полностью ослаблены. Подключите каждое входное отверстие трубки к коническому концу стерильной аспирационной пипетки объемом 2 мл. Оставьте обе аспирационные пипетки (входы) и внутривенный катетер (выходное отверстие) во флаконе объемом 1 л с буфером без кальция, чтобы обеспечить рециркуляцию буфера во время последующих этапов грунтования.
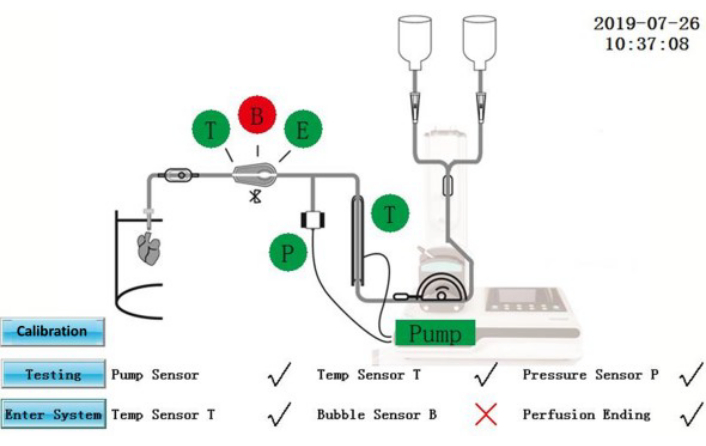
Рисунок 2: Самотестирование интерфейса. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Включите IPS. Выполните следующие операции на сенсорной панели управления. Программное обеспечение будет выполнять комплексное самотестирование каждый раз, когда оно запускается.
ВНИМАНИЕ: IPS - это электрическое оборудование, которое подключено к внешнему источнику питания. Разливы жидкости на IPS или силовых кабелях могут привести к электрическим опасностям.- Убедитесь, что на экране отображается состояние самотестирования (рисунок 2). Компоненты, прошедшие самотестирование, будут показаны зеленым цветом; те, которые потерпели неудачу, будут показаны красным цветом. После исправления коснитесь значка Тестирование , чтобы повторить самотестирование еще раз, или коснитесь значка Вход в систему , чтобы войти непосредственно в интерфейс операции.
- Нажмите в любом месте экрана, чтобы войти в интерфейс операции.
- В левом верхнем углу интерфейса операции (рисунок 3) коснитесь любого из значков круговых стрелок, чтобы задать направление вращения перистальтического насоса. На правой панели интерфейса коснитесь значков со стрелками вверх/вниз, чтобы задать значения для соответствующих параметров. Установите поток в режим постоянного потока; температура рубашки нагревателя до 42 °C (регулируется для обеспечения поддержания температуры перфусата на уровне 37 °C); и скорость насоса до 38 об/мин при расходе ~33 мл/мин.
- На правой нижней панели интерфейса управления проверьте состояние пузырькового сигнала тревоги, сигнала остановки перфузии и значка отключения звука.
- Проверьте температуру, давление и скорость потока перфузата на левой панели. Вручную установите интервалы, нажав на стрелки вверх-вниз в верхней и нижней части столбцов. Проверьте наличие данных в реальном времени, отображаемых в виде значений в середине столбцов. Цвет столбца изменится с зеленого на красный, если данные в реальном времени выйдут за пределы заданного диапазона.
- Найдите значки для запуска, приостановки и остановки перфузии, а также значок для переключения из режима отображения данных в реальном времени в режим графика на средней панели. Коснитесь значка запуска, чтобы начать перфузию и загрунтовать трубку буфером без кальция. Будет создан новый журнал. Введите имя файла и имя пользователя во всплывающее окно (рисунок 4).
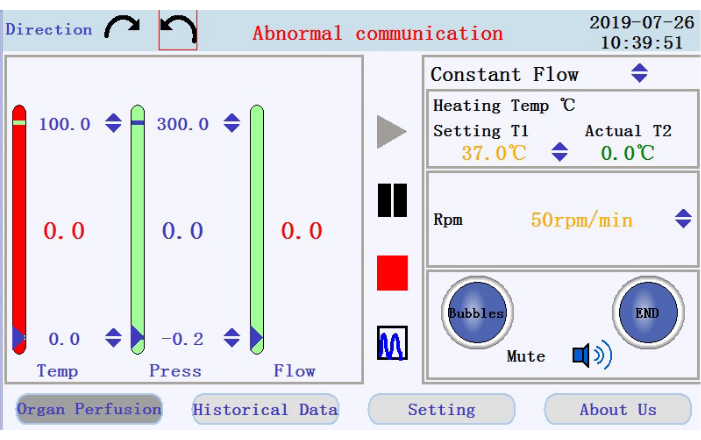
Рисунок 3: Интерфейс управления. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
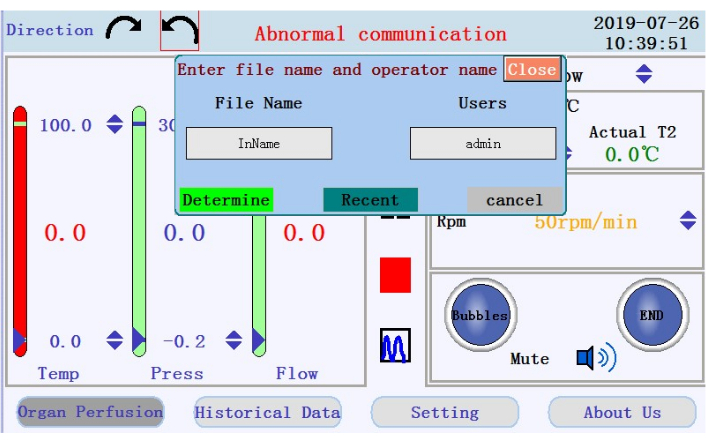
Рисунок 4: Всплывающее окно, запрашивающее имя файла и имя пользователя. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Наполните капельную камеру до полузаполнения. Убедитесь, что во время грунтовки в трубке нет захваченных воздушных карманов.
- Удалите любой пузырь, который образуется после пузырькового фильтра, щелкнув по трубке, чтобы отсоединить пузырь и позволить ему смыться.
ПРИМЕЧАНИЕ: Пузырьки могут образовываться вдоль трубки, когда буфер нагревается рубашкой нагревателя. - Заполните стакан объемом 400 мл 200 мл коллагеназного буфера. Поставьте сцену поверх стакана. Не вводя воздуха в трубку, полностью затяните роликовый зажим для одного из входов трубки и переместите аспирационную пипетку для входа в стакан.
3. Процедура для животных
- Приготовьте молодого взрослого самца крысы Wistar около 200-300 г массы тела.
ПРИМЕЧАНИЕ: Этот протокол был оптимизирован для крыс весом около 200-300 г массы тела. Самцы крыс предпочтительны, так как гормональные изменения во время эстрального цикла у самок крыс влияют на функцию гепатоцитов. - Анестезия
- Стянуть необходимый объем антикоагулянтного гепарина (5000 МЕ/мл; 0,2 мл/100 г массы тела) и коктейля кетамин/ксилазин для анестезии крыс (37,5 мг/мл кетамина, 5 мг/мл ксилазина; 0,2 мл/100 г массы тела) в шприцы по 1 мл с иглой 27 г.
ВНИМАНИЕ: Анестезия и гепарин являются вредными веществами. Будьте осторожны при обращении с острыми предметами. - Сдерживайте крысу. Внутрибрюшинно вводят гепарин с последующим коктейлем кетамин/ксилазин в нижний правый квадрант живота.
ПРИМЕЧАНИЕ: Слепая кишка имеет более высокую вероятность быть расположенной слева. Избегайте прокалывания слепой кишки во время инъекции, чтобы снизить риск загрязнения. - Через 10 мин проверьте глубину анестезии, оценив педальный рефлекс на обеих ногах крысы. Продолжайте проверять время от времени и ждать, пока крыса перестанет реагировать на щипки пальцев ног. Дополнительная анестезия может быть введена, по мере необходимости.
- Стянуть необходимый объем антикоагулянтного гепарина (5000 МЕ/мл; 0,2 мл/100 г массы тела) и коктейля кетамин/ксилазин для анестезии крыс (37,5 мг/мл кетамина, 5 мг/мл ксилазина; 0,2 мл/100 г массы тела) в шприцы по 1 мл с иглой 27 г.
- Поместите крысу в лежачее положение с вытянутыми конечностями на покрытой алюминиевой фольгой полистирольной платформе поверх лотка. Заклейте ноги крысы и надежно прикрепите ленту к платформе с помощью игл 27 G.
- Дезинфицируйте грудную клетку и живот, опрыскивая и обливая их 70% этанолом. Бритье перед дезинфекцией не является обязательным. Положите крысу в капюшон. Продолжайте следующий шаг, пока мех еще мокрый.
ПРИМЕЧАНИЕ: Обливание 70% этанолом также сводит перхоть и меховую пыль к минимуму. - Отделите кожу от мышцы.
- Парой зубно-тканевых щипцов в одной руке поднимите кожу у основания живота. С помощью пары остро-тупых хирургических ножниц в другой руке срежьте шатровую кожу. Надавите острым концом ножниц под кожу и сделайте разрез средней линии на коже от чуть выше задних ног до чуть ниже передних ног.
- Подтягивая и слегка растягивая кожу щипцами, разрезайте любую соединительную ткань, удерживающую кожу на мышцах грудной клетки и живота. Чтобы снизить риск загрязнения, предотвратите попадание рыхлого меха на мышцы. Чтобы удалить накопившийся рыхлый мех на ножницах, протрите их на продезинфицированной внешней стороне кожи.
- Сделайте боковые разрезы на коже, от средней линии до обеих сторон крысы немного выше задних ног и немного ниже передних ног. Отодвиньте лоскуты кожи в стороны, чтобы обнажить мышцу.
- Разрежьте мышцу живота, чтобы обнажить органы.
- С новой парой зубно-тканевых щипцов в одной руке поднимите мышцу у основания живота. С помощью тупо-тупых хирургических ножниц в другой руке аккуратно разрезайте мышцу, не задевая ни один из органов. Сделайте разрез средней линии на мышце от чуть выше задних ног до грудины.
- Сделайте боковые разрезы на мышце, от средней линии до обеих сторон крысы немного выше задних ног и чуть ниже грудной клетки, не задевая ни один из органов. Отодвиньте лоскуты мышц в стороны, чтобы обнажить органы. Убедитесь, что боковые разрезы кожи и мышц достигают боков крысы, чтобы кровь и буферы вытекали из брюшной полости на более поздних этапах.
- Канюляция воротных вен
- Задней частью изогнутых щипцов осторожно оттолкните кишечник вправо. Осторожно переверните доли печени, чтобы обнажить воротную вену.
- Используйте 3-0 шелковый хирургический шов, чтобы сделать очень рыхлую лигатуру вокруг воротной вены близко к печени, непосредственно перед тем, как вена разветвляется влево и вправо в разные доли печени. Не затягивайте лигатуру, чтобы избежать нарушения кровотока через воротную вену. Очень тонкая мембрана под желчным протоком должна быть прорвана кончиком изогнутых щипцов, прежде чем шов сможет пройти под ним и быть закольцованным вокруг воротной вены (и желчного протока).
- Используя кончики двух пар изогнутых щипцов, аккуратно проколите отверстие через ткань под воротной веной, не повредив воротную вену. Сделайте это примерно на 2-3 см выше по течению от первой лигатуры, непосредственно перед тем, как желудочная вена отсоединяется от воротной вены. Ткань тоньше в этом конкретном месте.
- Осторожно растяните отверстие побольше щипцами. Это отверстие позволит щипцам поддерживать воротную вену во время канюляции.
- Уменьшите скорость насоса до 4 об/мин для скорости потока ~3 мл/мин. Убедитесь, что отток безкальцевого буфера из внутривенного катетера уменьшается до медленной капельницы.
ПРИМЕЧАНИЕ: Повышение давления в печени вызовет гибель гепатоцитов. Более низкая скорость потока должна замедлить накопление давления в печени при успешном введении канюли в воротную вену на более позднем этапе. - Осторожно поддерживайте воротную вену с помощью щипцов. Другой рукой держитесь за внутривенный катетер со скосом иглы, обращенным вверх. Направьте иглу в воротную вену под углом 10-20° и медленно продвигайтесь, пока весь скос не окажется внутри вены. Как только игла будет правильно вставлена в воротную вену, печень начнет бланшировать и потеряет свой темно-красный цвет.
ПРИМЕЧАНИЕ: Весь скос иглы должен быть вставлен в вену, чтобы создать отверстие, достаточно большое для введения канюли. Тем не менее, не вставляйте иглу слишком глубоко, чтобы избежать чрезмерного прокалывания вены. - Продвиньте канюлю над иглой и в вену. Затем втянуть иглу до тех пор, пока она не окажется на 2-3 мм позади канюли; ровно настолько, чтобы острый кончик надежно находился внутри канюли. Используйте большой и средний пальцы, чтобы держаться за катетер, и используйте указательный палец, чтобы оттянуть крыло, чтобы втянуть иглу.
- Быстро закрепите воротную вену на катетере с помощью зажима вены. Не зажимайте непосредственно на боковом отверстии иглы, чтобы избежать нарушения потока перфусата. Вместо этого обрежьте под ним.
- Немедленно срежьте инфрахепатическую нижнюю полую вену (IVC), чтобы предотвратить повышение давления в печени. К настоящему времени инфрагепатическая ИВК и прилегающие кровеносные сосуды будут скрыты кровью из воротной вены. Чтобы убедиться, что IVC был правильно разрезан и разорван, наблюдайте за кровью, вырывающейся в импульсах; кровь будет просачиваться только из соседних сосудов.
ПРИМЕЧАНИЕ: Слишком долгое время для разрезания инфрахепатического IVC после каннуляции или неспособность разрезать его перед переходом к следующему этапу приведет к гибели гепатоцитов. Животное усыпляется под наркозом путем экссангинации (через разрезание IVC) на этом этапе. Процедура должна продолжаться, пока продолжается кровопотеря. Смерть может быть подтверждена визуальным наблюдением за прекращением сердцебиения/дыхания при вскрытии грудной полости на более позднем этапе. - Увеличьте скорость насоса до 38 об/мин для скорости потока ~33 мл/мин. Промывайте печень три раза, закрывая IVC щипцами на 2-3 с (но не слишком долго) и вновь открывая ее.
ПРИМЕЧАНИЕ: Во время гиперемии печень будет немного расширяться, прежде чем вернуться к норме. Промывка способствует проникновению перфусата по всей печени. После гиперемии печень должна быть полностью светло-коричневого цвета. - Убедитесь, что кончик канюли размещен перед точкой, где воротная вена разветвляется на различные доли печени, чтобы обеспечить перфузию всех долей печени. При необходимости отстегните воротную вену и скорректируйте положение канюли. Повторите обрезку после этого.
- Затяните рыхлую лигатуру вокруг воротной вены, немного выше по течению от точки ветвления. Сделайте три узла там, где мягкая канюля поддерживается твердой металлической иглой, между скосом и боковым отверстием. Убедитесь, что узлы фиксируют канюлю в нужном положении, закрепляя ее на воротной вене, и предотвращают обратный поток буферов.
- Резекция всей печени неповрежденной.
- Перфузируйте печень безкальцевым буфером со скоростью потока ~33 мл/мин в течение следующих 12 мин (см. Рисунок 5А). Тем временем выполняют резекцию печени. Время перфузии может быть увеличено, если это необходимо, но убедитесь, что буфер без кальция не иссякнет.
- Используя пару изогнутых ножниц, тщательно отделите воротную вену от кишечника, разрезав брыжейку, которая соединяет их вместе. Не повреждайте желудочно-кишечный тракт (пищевод, желудок, тонкий и толстый кишечник), чтобы убедиться, что не происходит загрязнения.
ПРИМЕЧАНИЕ: Это делается для предотвращения разрыва воротной вены при перемещении печени во время резекции. - Отделите печень от желудочно-кишечного тракта путем разрезания соединительных тканей, поджелудочной железы и брыжейки, которая соединяет печень с желудочно-кишечным трактом. Чтобы отсоединиться, всегда режьте ножницами и не тяните, чтобы порвать. Опять же, не стоит обрезать и не перерезать желудочно-кишечный тракт.
- Осторожно переверните печень, чтобы обнажить диафрагму. Вырежьте диафрагму вслед за стенками ребер. Убедитесь, что большая часть диафрагмы остается связанной с печенью. Будьте осторожны, чтобы не тыкать или не ушибать печень.
- Как только грудная полость открыта, можно увидеть два протока: беловатый надхепатический IVC слева и желтоватый пищевод справа. Обрежьте супрахепатический IVC и вырежьте его чуть выше зажима. Обрезка супрахепатического IVC необязательна. Предотвращает затопление грудной полости.
ПРИМЕЧАНИЕ: Визуально наблюдайте за прекращением сердцебиения/дыхания, чтобы подтвердить смерть животного. - Пищевод окружен диафрагмой. Чтобы изолировать пищевод от диафрагмы, прорежьте диафрагму справа в сторону пищевода. Отрежьте все оставшиеся соединительные ткани, которые соединяют пищевод и желудок с печенью и диафрагмой.
- Оттолкните желудочно-кишечный тракт вправо. Переведите зажим вены из надрехепатического IVC в инфрахепатический IVC; буфер теперь будет просачиваться из супрахепатического IVC.
ПРИМЕЧАНИЕ: Во время перфузии канюля и инфрахепатический IVC будут покрыты печенью. Сильный буферный отток из супрахепатического IVC поможет хирургу исключить утечки перфузии. - Отрежьте любую оставшуюся диафрагму, которая соединяет печень с грудной полостью. Отрезают ткани, соединяющие печень с брюшной полостью. Будьте осторожны, чтобы не разрезать инфрахепатический IVC над зажимом, чтобы избежать отрыва клипсы от печени.
- Чтобы убедиться, что печень полностью резецирована, осторожно поднимите печень, держась за диафрагму щипцами. Если остались какие-либо ткани, соединяющие печень с брюшной полостью, отрежьте их. Если почка и селезенка все еще связаны с печенью, отсоедините их.
4. Перфузия и пищеварение печени
- Если резекция была завершена рано, подождите, пока печень не будет перфузирована безкальцевым буфером в течение 12 минут.
- Измените буфер перфузии на буфер коллагеназы. Полностью ослабьте роликовый зажим для буфера коллагеназы перед полным затягиванием роликового зажима для буфера без кальция (см. Рисунок 5B). Как только буфер коллагеназы достигнет печени через трубку, промывайте печень три раза, закрыв супрахепатический IVC на 2-3 с и снова открывая его.
- Осторожно переместите печень в стадию поверх стакана для рециркуляции коллагеназного буфера. Перемещайте печень, держась за диафрагму щипцами, поддерживая катетер. Избегайте потягивания катетера, чтобы предотвратить случайное отсоединение катетера.
ПРИМЕЧАНИЕ: Если катетер отсоединяется и воротная вена слишком повреждена для повторного каннуляции, каннулируйте супрахепатический IVC и позвольте буферу просочиться из воротной вены. Убедитесь, что инфрахепатический IVC остается обрезанным. - Переваривайте печень в течение 12 мин. Наблюдайте за появлением полупрозрачных пятен / сети, когда печень начинает терять свою гладкую коричневую текстуру. Печень будет становиться больше и мягче по мере ее переваривания. Как только печень обретет кашицеобразную консистенцию, прекратите перфузию. Время пищеварения может быть увеличено, если это необходимо.
ПРИМЕЧАНИЕ: Если капсула Глиссона была разорвана, буфер коллагеназы в стакане может стать мутным из-за сбежавших клеток печени.
5. Выделение гепатоцитов
- Аккуратно удалите канюлю, отрезав воротную вену. Аккуратно снимите зажим. Перенесите печень в 150-миллиметровую посуду, содержащую 60 мл холодной модифицированной орлиной среды Dulbecco (DMEM).
- Осторожно постучите по печени, используя заднюю сторону изогнутых щипцов, чтобы сломать и отклеить капсулу Глиссона. Затем осторожно покачайте печень из стороны в сторону в DMEM, чтобы освободить клетки печени. Продолжайте делать это до тех пор, пока клетки печени не будут полностью диссоциированы в DMEM.
ПРИМЕЧАНИЕ: Иногда вся печень или определенные доли будут только частично переварены. Не соскребая печень, которая будет принудительно удаляться, и повреждая недиссоциированные гепатоциты, можно получить более высокую и более последовательную жизнеспособность клеток. - Осторожно раскачайте тарелку толщиной 150 мм до тех пор, пока клетки печени не будут хорошо распределены в DMEM. Чтобы удалить кусочки ткани и комки клеток, вылейте клеточную суспензию через нейлоновый сетчатый фильтр размером 100 мкм, помещенный на новую тарелку диаметром 150 мм. Старое блюдо промыть 30 мл DMEM и перенести суспензию в сетчатый фильтр. Осторожно нажмите на сетчатый фильтр, чтобы пропустить захваченные одиночные клетки печени.
- Снимите сетчатый фильтр и аккуратно покачайте новую тарелку диаметром 150 мм, пока клетки печени не распределятся хорошо. Разделите суспензию поровну на трубки размером 4 х 50 мл. Смойте блюдо 30 мл DMEM и разделите суспензию поровну на одинаковые пробирки. Убедитесь, что каждая трубка имеет равный объем клеточной суспензии.
- Центрифугируйте 4 х 50 мл пробирки клеточной суспензии по 50 х г в течение 2 мин при 4 °C. Осторожно аспирируйте супернатант, не нарушая рыхлую гранулу. Выбросьте супернатант. Добавьте 20 мл DMEM в каждую трубку и осторожно раскачайте трубки, чтобы повторно суспендировать гранулу ячейки. Смешайте клеточную суспензию из четырех пробирок в две.
- Центрифугируйте трубки 2 x 50 мл при 20 x g в течение 2 мин при 4 °C. Аспирировать и выбросить супернатант. Добавьте 20 мл DMEM в каждую трубку и осторожно раскачайте трубки, чтобы повторно суспендировать гранулу ячейки. Смешайте клеточную суспензию из двух пробирок в одну. Держите клетки на льду до использования.
- Приготовьте раствор трипана синего, смешав 400 мкл 1x PBS с 50 мкл трипана синего. Добавьте 50 мкл суспензии гепатоцитов в раствор трипан синего цвета. Подсчитайте количество жизнеспособных и мертвых гепатоцитов с помощью гемоцитометра под световым микроскопом.
6. Культура гепатоцитов
- Выполните все этапы культивирования клеток в капоте. Добавить 1 мл коллагенового покрытия в посуду 35 мм и инкубировать в течение 4 ч. Промыть посуду три раза 1x PBS.
- Разбавляют суспензию гепатоцитов в культуральной среде гепатоцитов до концентрации 0,8 млн клеток/мл. Добавьте 1 мл разбавленной гепатоцитарной суспензии в посуду диаметром 35 мм.
ПРИМЕЧАНИЕ: Гепатоциты чувствительны к напряжению сдвига во время пипетки. Рассмотрите возможность использования наконечников пипеток с широким отверстием. - Раскачайте блюдо, чтобы распределить гепатоциты равномерно. Инкубировать при 37 °C, 5% CO2 в течение 3-4 ч, чтобы позволить гепатоцитам прикрепиться.
- Для культуры сэндвичей.
- Удалить культуральную среду гепатоцитов. Промыть один раз 1 мл гепатоцитарной питательной среды для удаления неприкрепленных клеток. Добавить 1 мл коллагенового накладного раствора. Добавьте коллагеновый раствор на стенки блюда, чтобы избежать введения пузырьков в раствор.
- Инкубировать при 37 °C, 5% CO2 на ночь, чтобы обеспечить гелеобразование коллагена.
- Добавить 1 мл свежей культуральной среды гепатоцитов. Инкубировать при 37 °C, 5% CO2.
- Для однослойной культуры.
- После шага 6.3 удаляют культуральную среду гепатоцитов. Промыть один раз 1 мл гепатоцитарной питательной среды для удаления неприкрепленных клеток.
- Добавить 1 мл свежей культуральной среды гепатоцитов. Инкубировать при 37 °C, 5% CO2.
- Оценка чистоты и функции гепатоцитов путем проведения иммуноокрашивания для гепатоцит-специфических маркерных и функциональных анализов, как описано ранее10,11.
Access restricted. Please log in or start a trial to view this content.
Результаты
Хирург может определить, проходит ли перфузия печени гладко, наблюдая за результатом после определенных шагов. Первый исход можно наблюдать при канюляции, разрезании инфрахепатического ИВК и восстановлении скорости перфузионного потока. Печень должна была полностью изменить цвет с т...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Есть несколько моментов, которые особенно важно соблюдать для двухэтапной процедуры перфузии коллагеназы в целом. Во-первых, необходимо соблюдать особую осторожность при резецировании печени. Убедитесь, что желудочно-кишечный тракт не поврежден, так как утечка содержимого приведет к ...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Чжоу Янь и Ханри Юй заявляют о конкурирующих интересах, поскольку они владеют акциями Vasinfuse, которая производит и продает интегрированную перфузионную систему. Hanry Yu владеет акциями в Histoindex, Invitrocue, Osteopore, Pishon Biomedical, Ants Innovate и Synally Futuristech, которые не имеют конкурирующих интересов с информацией, представленной здесь.
Благодарности
Эта работа частично поддерживается MOE ARC (MOE2017-T2-1-149); Грант NUHS innovation Seed Grant 2017 (NUHSRO/2017/051/InnovSeed/02); Институт механобиологии Сингапура (R-714-106-004-135); и Институт биоинженерии и нанотехнологий, Совет по биомедицинским исследованиям, Агентство по науке, технологиям и исследованиям (A*STAR) (номера проектов IAF-PP H18/01/a0/014, IAF-PP H18/01/a0/K14 и MedCaP-LOA-18-02) финансируют Hanry Yu. Нг Чан Уэй является научным сотрудником Национального университета Сингапура. Мы хотели бы поблагодарить Confocal Microscopy Unit & Flow Cytometry Unit Национального университета Сингапура за помощь и советы в анализе чистоты гепатоцитов.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Material/Equipment | |||
| 1 mL syringe | Nipro | ||
| 27G needle | Nipro | ||
| Black braided silk non-absorbable, non-sterile surgical suture | Look | SP117 | |
| Bochem 18/10 stainless steel forceps, sharp tip contain bent round tip | Bochem | 10333511 | |
| Disposable Perfusion Set | Vasinfuse | BPF-112 | |
| Floating circular 1.5 mL microcentrifuge tube rack | Sigma-Aldrich | R3133 | |
| German Standard Tissue Forceps, Serrated / 1×2 teeth , 14.5cm | Walentech | ||
| Greiner Cellstar aspirating pipette | Merck | GN710183 | |
| Haemocytometer | |||
| Integrated Perfusion System | Vasinfuse | IPS-001 | |
| Iris Scissors curved, stainless, 11cm | Optimal Medical Products Pte Ltd | CVD | |
| Light microscope with 10X lens | Olympus | ||
| Mesh Sheet 100µM Nylon | Spectra-Teknic(s) Pte Ltd | 06630-75 | |
| Operating Scissors, BL/BL, 13cm | Optimal Medical Products Pte Ltd | STR – BL/BL | |
| Operating Scissors, SH/BL, 13cm | Optimal Medical Products Pte Ltd | STR – SH/BL | |
| Reverse force hemostatic clip | Shanghai Jin Zhong Pte Ltd | XEC230 | |
| Water bath | Grant | ||
| Reagents/Chemicals | |||
| 10X Phosphate buffered saline (PBS) | Sigma-Aldrich | ||
| Bovine serum albumin (BSA) | Sigma-Aldrich | A9056 | |
| CaCl2·2H2O | Merck | 137101 | |
| Collagenase Type IV | Gibco | 17104019 | |
| Dexamethasone | TCI | D1961 | |
| DMEM | Gibco | 31600-034 | |
| Glutamax | Gibco | 35050061 | |
| HEPES | Invitrogen | 11344-041 | |
| Insulin | Sigma-Aldrich | 1-9278 | |
| KCl | VWR | VWRC26764.298 | |
| KH2PO4 | Sigma-Aldrich | P5379 | |
| Linoleic acid | Sigma-Aldrich | L9530 | |
| NaCl | Sigma-Aldrich | S5886 | |
| NaHCO3 | Sigma-Aldrich | S8875 | |
| NaOH | Merck | 106462 | |
| Penicillin-Streptomycin | Sigma-Aldrich | P4333 | |
| Type I bovine collagen | Advanced BioMatrix | 5005-100ml | |
| William’s E Media | Sigma-Aldrich | W1878 |
Ссылки
- Shen, L., Hillebrand, A., Wang, D. Q. H., Liu, M. Isolation and primary culture of rat hepatic cells. Journal of Visualized Experiments: JoVE. (64), e3917(2012).
- Cabral, F., et al. Purification of hepatocytes and sinusoidal endothelial cells from mouse liver perfusion. Journal of Visualized Experiments: JoVE. (132), e56993(2018).
- Green, C. J., et al. The isolation of primary hepatocytes from human tissue: optimising the use of small non-encapsulated liver resection surplus. Cell and Tissue Banking. 18 (4), 597-604 (2017).
- Seglen, P. O. Preparation of isolated rat liver cells. Methods in Cell Biology. 13, 29-83 (1976).
- Gopalakrishnan, S., Harris, E. N. In vivo liver endocytosis followed by purification of liver cells by liver perfusion. Journal of Visualized Experiments: JoVE. (57), e3138(2011).
- Wen, J. W., Olsen, A. L., Perepelyuk, M., Wells, R. G. Isolation of rat portal fibroblasts by in situ liver perfusion. Journal of Visualized Experiments: JoVE. (64), e3669(2012).
- Korelova, K., Jirouskova, M., Sarnova, L., Gregor, M. Isolation and 3D collagen sandwich culture of primary mouse hepatocytes to study the role of cytoskeleton in bile canalicular formation in vitro. Journal of Visualized Experiments: JoVE. (154), e60501(2019).
- Shi, W., et al. Isolation and purification of immune cells from the liver. International Immunopharmacology. 85 (95), 106632(2020).
- Salem, E. S. B., et al. Isolation of primary mouse hepatocytes for nascent protein synthesis analysis by non-radioactive L-azidohomoalanine labeling method. Journal of Visualized Experiments: JoVE. (140), e58323(2018).
- Xia, L., et al. Tethered spheroids as an in vitro hepatocyte model for drug safety screening. Biomaterials. 33 (7), 2165-2176 (2012).
- Kegel, V., et al. Protocol for isolation of primary human hepatocytes and corresponding major populations of non-parenchymal liver cells. Journal of Visualized Experiments: JoVE. (109), e53069(2016).
- Zhu, L., et al. A vertical-flow bioreactor array compacts hepatocytes for enhanced polarity and functions. Lab on a Chip. 16 (20), 3898-3908 (2016).
- Du, Y., et al. Synthetic sandwich culture of 3D hepatocyte monolayer. Biomaterials. 29 (3), 290-301 (2008).
- Tong, W. H., et al. Constrained spheroids for prolonged hepatocyte culture. Biomaterials. 80, 106-120 (2016).
- Xia, L., et al. Laminar-flow immediate-overlay hepatocyte sandwich perfusion system for drug hepatotoxicity testing. Biomaterials. 30 (30), 5927-5936 (2009).
- Gupta, K., et al. Bile canaliculi contract autonomously by releasing calcium into hepatocytes via mechanosensitive calcium channel. Biomaterials. 259, 120283(2020).
- Horner, R., et al. Impact of Percoll purification on isolation of primary human hepatocytes. Scientific Reports. 9 (1), 6542(2019).
- Osypiw, J. C., et al. Subpopulations of rat hepatocytes separated by Percoll density-gradient centrifugation show characteristics consistent with different acinar locations. The Biochemical Journal. 304, Pt 2 617-624 (1994).
- Beal, E. W., et al. A small animal model of ex vivo normothermic liver perfusion. Journal of Visualized Experiments: JoVE. (136), e57541(2018).
- Hillebrandt, K., et al. Procedure for decellularization of rat livers in an oscillating-pressure perfusion device. Journal of Visualized Experiments: JoVE. (102), e53029(2015).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены