このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
多パラメータ灌流制御による原発性ラット肝細胞の単離
* これらの著者は同等に貢献しました
要約
このプロトコルは、特別な静脈内カテーテル、標準化された滅菌使い捨てチューブ、リアルタイムモニタリングによって補完される温度制御、および単離された初代ラット肝細胞の生存率、収量、および機能性の一貫性を改善するための2段階コラゲナーゼ灌流手順のための警報システムの使用を詳述する。
要約
初代肝細胞は、肝疾患の基礎研究や インビトロでの毒性試験に広く用いられている。原発性肝細胞単離のための2段階のコラゲナーゼ灌流手順は、特に門脈カニューレにおいて技術的に困難である。この手順はまた、灌流セットアップの組み立て、最適化、またはメンテナンスの困難さのために、時折汚染および灌流条件の変動を起こしやすい。ここでは、多パラメータ灌流制御による改善された2段階コラゲナーゼ灌流手順のための詳細なプロトコールが提示される。初代ラット肝細胞は、手順の重要なステップで必要な技術的予防措置を講じ、特別な静脈内カテーテル、標準化された滅菌使い捨てチューブ、温度制御、およびリアルタイム監視および警報システムの採用を通じて、操作上の困難さを軽減し、灌流パラメータの変動性を緩和することによって、首尾よく確実に単離された。単離された初代ラット肝細胞は、一貫して高い細胞生存率(85%〜95%)、収量(ラット200〜300gあたり2〜5 x108 細胞)および機能性(アルブミン、尿素およびCYP活性)を示す。この手順は、無菌動作を保証するために層流フードにセットアップするのに十分コンパクトな統合灌流システムによって補完された。
概要
初代肝細胞は、肝臓関連の基礎研究、疾患治療、薬物検査などの応用のための重要なツールです。初代肝細胞単離のための現在のゴールドスタンダードは、1970年代にSeglenによって導入された2段階のコラゲナーゼ灌流手順1,2,3である4。しかし、この手順は技術的に困難であり、初心者の外科医によって実行されると高い失敗率を有する。灌流が成功したと考えられる場合でも、単離間で肝細胞の生存率(典型的には60%〜95%)および収量(ラット200〜300gあたり0.5〜5 x108)の劇的な差が観察され得る。これは、下流の実験の品質と規模に影響します。技術的な手順とは別に、市販またはカスタムビルドのいずれかの分離に使用される灌流セットアップが、寄与する要因です。灌流セットアップの組み立て、最適化、およびメンテナンスに注意する必要があります。このプロトコールの目的は、2段階のコラゲナーゼ灌流手順の技術的手順および灌流セットアップの多パラメータ灌流制御を通じて、初代ラット肝細胞の単離間の成功率および安定性を改善することである。
技術的な側面から、手順で最も困難なステップは、門脈カニューレーションです。他のステップに関しては、良い習慣が観察され、一般的な予防措置が取られれば、分離の安定性を改善することができる。したがって、各ステップの推論を理解することは、外科医が処置中に起こり得る様々な変数に応答することができるように重要である。
ラットおよびマウスからの肝細胞および肝臓非実質細胞の単離のための様々なプロトコールが1、2、5、6、7、8、9公開されている。これらのプロトコルで使用される灌流セットアップには、灌流チューブの再利用、温度制御の問題、灌流パラメータの日常的な最適化の必要性、および/または門脈カニューレのための不適切なタイプの静脈内(IV)カテーテルの使用など、いくつかの欠点があった。灌流チューブの再利用は、特にチューブが適切に洗浄および消毒されていない場合、汚染の可能性を高めます。日常的な交換なしでチューブを再利用すると、灌流セットアップは、漏れやすいチューブやコネクタ、詰まったバブルトラップ、くびれたチューブなどの問題にさらされ、そのすべてが灌流液の圧力と流量を大幅に低下させ、肝臓消化効率に影響を与えます。温度制御のためのいくつかのセットアップで一定の熱源がなければ、事前に温められた緩衝液は時間の経過とともに冷却され、コラゲナーゼ活性および消化が低くなる。他のセットアップでは、水循環器に接続されたジャケット付きガラスコンデンサーを使用してバッファーを温めますが、かさばり、慎重な清掃が必要です。カテーテルから出るバッファーの温度、圧力、流量を測定し、最適化してから、安定した灌流状態を確保する必要があります。最適化後でさえ、パラメータはオペレータの行動のために単離中に途中で変化し、それによって最適でない灌流および消化につながる可能性がある。ほとんどのタイプのIVカテーテルは、カニューレ中の連続灌流を許さないため、門脈カニューレには適していません。彼らは、カニューレが成功したときに外科医に直ちに通知することはできません。さらに、軟部カテーテルに門脈を変形させずに固定することは困難である。
ここでは、標準化された使い捨て滅菌チューブ、正確で安定した温度制御のためのシリコーンヒータージャケット、データストレージと管理を備えたリアルタイム監視および警報システム、およびカニューレーション中に門脈を穿刺しながら連続灌流を可能にする特別なIVカテーテルを使用して、これらの問題に対処します。私たちの知る限りでは、私たちはこれらすべての機能をコンパクトな統合灌流システム(IPS)に組み合わせた最初のグループであり、ポータブル性が高く、層流フードに収まり、無菌動作を保証します。
プロトコル
すべての手順と動物の飼育は、シンガポール国立大学の施設動物ケアおよび使用委員会(IACUC)の要件に従って、プロトコル番号R15-0027およびR19-0669の下で実施されました。
1. 溶液および手術器具の調製
- 超純水を用いて 表1 の緩衝液及び細胞培養培地を調製した。
- 使用前に無カルシウム緩衝液及びコラゲナーゼ緩衝液を水浴中で37°Cに予め加温しておく。
- 一対の鋭利な鈍い外科用はさみ、一対の鈍い外科用はさみ、一対の湾曲した外科用はさみ、2対の歯組織鉗子、2対の湾曲した鉗子、2つの静脈クリップ、長さ5cmの3-0シルク外科用縫合糸、100μmのナイロンメッシュフィルター、400mLビーカー、 ステージ(浮遊式微量遠心管ラック)とを備える。
2. IPS のセットアップ ( 図 1 を参照)
- 層流フードを70%エタノールで拭き取ります。IPSを70%エタノールで拭き取り、層流フードに入れます。フードの電源を入れる前に、UVで>15分間滅菌してください。
警告: 紫外線を浴びると、目や皮膚の火傷が痛くなることがあります。UVライトが点灯しているときにサッシが完全に閉じていることを確認します。 - 使い捨てチューブの新しいセットをIPSに組み立てます。ペリスタルティックポンプの下流のチューブをシリコーンヒータージャケットで包みます。灌流モニターをシリコンヒータージャケットの下流のチューブに取り付けます。
- 両方のチューブ入口のローラークランプが完全に緩んでいることを確認します。各チューブ入口を滅菌 2 mL 吸引ピペットのテーパーエンドに接続します。吸引ピペット(入口)とIVカテーテル(出口)の両方をカルシウムフリーのバッファーを含む1 Lボトルに入れ、後続のプライミングステップ中にバッファーを再循環できるようにします。
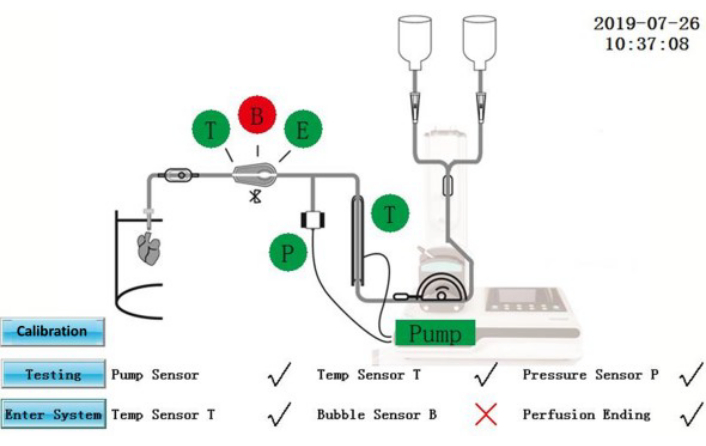
図 2: セルフテスト インターフェイス。 この図の拡大版を表示するには、ここをクリックしてください。
- IPS の電源を入れます。タッチスクリーンコントロールパネルで次の操作を実行します。ソフトウェアは、起動するたびに包括的なセルフテストを実行します。
警告: IPS は、外部電源に接続されている電気機器です。IPSまたは電源ケーブルに液体がこぼれると、電気的な危険が生じる可能性があります。- セルフテストのステータスが画面に表示されていることを確認します(図2)。セルフテストに合格したコンポーネントは緑色で表示されます。失敗したものは赤で表示されます。修正後、テストアイコンをタップしてセルフ テスト をもう一度繰り返すか、 Enter System アイコンをタップして操作インターフェイスに直接入力します。
- 画面上の任意の場所をタップして、操作インターフェースにログインします。
- 操作インターフェースの左上隅(図3)で、円形の矢印アイコンのいずれかをタップして、ペリスタルティックポンプの回転方向を設定します。インターフェイスの右側のパネルで、上/下矢印アイコンをタップして、対応するパラメータの値を設定します。フローを定流量モードに設定します。ヒータージャケットの温度を42°Cにする(灌流液の温度が37°Cに維持されるように調整する);ポンプ速度を38rpmにして、流量を〜33mL/minにします。
- 操作インターフェースの右下パネルで、バブルアラーム、灌流停止アラーム、ミュートアイコンの状態を確認します。
- 左側のパネルで、灌流液の温度、圧力、流量を確認します。列の上部と下部にある上下の矢印をクリックして、間隔を手動で設定します。列の中央に値として表示されるリアルタイム データを確認します。列の色は、リアルタイム データが設定範囲を超えると緑から赤に変わります。
- 中央パネルで、灌流を開始、一時停止、および停止するアイコンと、リアルタイムデータ表示からチャートモードに切り替えるアイコンを見つけます。開始アイコンをタップして灌流を開始し、カルシウムフリーのバッファーでチューブをプライミングします。新しいログが作成されます。ファイル名とユーザー名をポップアップウィンドウに入力します(図4)。
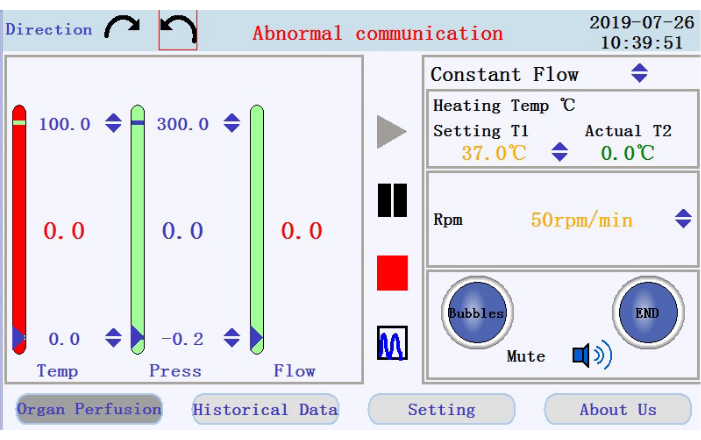
図 3: 操作インターフェイス。 この図の拡大版を表示するには、ここをクリックしてください。
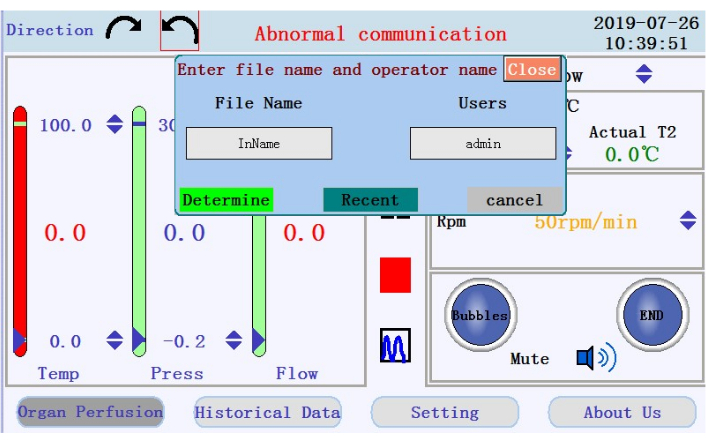
図 4: ファイル名とユーザー名の入力を求めるポップアップ ウィンドウを表示します。 この図の拡大版を表示するには、ここをクリックしてください。
- ドリップチャンバーを半分いっぱいに満たします。プライミング中にチューブにエアポケットがトラップされていないことを確認します。
- チューブをフリックして気泡フィルターの下流に形成される気泡をすべて取り除き、気泡を切り離して洗い流します。
メモ:バッファがヒータージャケットによって暖められると、チューブに沿って気泡が形成されることがあります。 - 400 mL ビーカーに 200 mL のコラゲナーゼバッファーを充填します。ビーカーの上にステージを置きます。チューブに空気を導入せずに、チューブ入口の1つのローラークランプを完全に締め付け、入口用の吸引ピペットをビーカーに移動します。
3. 動物の手続き
- 体重約200〜300gの若年成人男性Wistarラットを準備する。
注:このプロトコルは、体重約200〜300gのラット用に最適化されました。雌ラットの発情周期中のホルモン変化が肝細胞機能に影響を及ぼすので、雄ラットが好ましい。 - 麻酔
- 必要量の抗凝固剤ヘパリン(5,000 IU/mL; 0.2 mL/100 g体重)およびラット麻酔ケタミン/キシラジンカクテル(37.5 mg/mLケタミン、5 mg/mLキシラジン;0.2 mL/100 g体重)を27 G針で1 mLシリンジに引き込む。
警告:麻酔とヘパリンは有害物質です。鋭利な取り扱いには注意してください。 - ラットを拘束する。腹腔内注射ヘパリンに続いてケタミン/キシラジンカクテルを腹部の右下の象限に注入する。
注:カエカムは左側に位置している可能性が高いです。汚染のリスクを減らすために、注射中にカエカムを穿刺しないでください。 - 10分後、ラットの両足のペダル反射を評価して麻酔の深さを確認する。時々チェックを続け、ラットがつま先のピンチに反応しなくなるまで待ちます。必要に応じて、追加の麻酔を注射することができる。
- 必要量の抗凝固剤ヘパリン(5,000 IU/mL; 0.2 mL/100 g体重)およびラット麻酔ケタミン/キシラジンカクテル(37.5 mg/mLケタミン、5 mg/mLキシラジン;0.2 mL/100 g体重)を27 G針で1 mLシリンジに引き込む。
- トレイの上にあるアルミホイルで覆われたポリスチレンプラットフォーム上に手足を伸ばして、ラットを仰臥位に置きます。ラットの足をテープで固定し、27G針でテープをプラットフォームにしっかりと固定します。
- 胸部と腹部を70%エタノールで噴霧して濡らして消毒します。消毒前のシェービングはオプションです。ラットをフードに入れてください。毛皮がまだ濡れている間に次のステップを続けます。
注:70%エタノールで濡らすと、フケや毛皮のほこりも最小限に抑えられます。 - 皮膚を筋肉から分離する。
- 片手に一対の歯組織鉗子を持って、腹部の基部近くの皮膚を持ち上げます。もう一方の手に鋭利な鈍い外科用ハサミのペアで、テントを張った皮膚を切る。はさみの鋭い端を皮膚の下に押し込み、後肢のすぐ上から前足のすぐ下まで皮膚に正中線切開を行います。
- 鉗子で皮膚を引き上げて軽く伸ばしながら、皮膚を胸部と腹部の筋肉に保持している結合組織を切断します。汚染のリスクを減らすために、ゆるい毛皮が筋肉に落ちるのを防ぎます。はさみに蓄積されたゆるい毛皮を取り除くには、消毒された皮膚の外側で拭き取ってください。
- 後肢のわずかに上と前脚のわずかに下方にラットの正中線から両側に向かって、皮膚に横切開を行う。皮膚のフラップを側面に押して筋肉を露出させます。
- 腹筋を切り開いて臓器を露出させます。
- 片手に新しい歯組織鉗子のペアを持って、腹部の付け根近くの筋肉を持ち上げます。もう一方の手に鈍い外科用はさみのペアで、臓器を切らずに筋肉を慎重に切り裂きます。後肢のやや上から胸骨まで筋肉に正中線切開を行います。
- 臓器を切除することなく、後肢のわずかに上および胸郭のすぐ下で、ラットの正中線から両側まで、筋肉に横切開を行う。筋肉のフラップを側面に押して臓器を露出させます。皮膚および筋肉の側方切開部がラットの側面に到達し、血液および緩衝液が後のステップで腹腔から流出することを可能にする。
- 門脈カニューレ
- 湾曲した鉗子の後ろで、腸を静かに右に押します。肝葉を静かにひっくり返して門脈を露出させます。
- 3-0シルク外科用縫合糸を使用して、静脈が左右に分岐して異なる肝葉になる直前に、肝臓に近い門脈の周りに非常に緩い結紮を行います。門脈を通る血流を乱さないように結紮を締めないでください。胆管の下の非常に薄い膜は、縫合糸が下を通過し、門脈(および胆管)の周りにループされる前に、湾曲した鉗子の先端で突き破られる必要があります。
- 2対の湾曲した鉗子の先端を使用して、門脈を損傷することなく、門脈の下の組織を通して慎重に穴をあけます。これを最初の合字の約2〜3cm上流、胃静脈が門脈から分岐する直前に行う。組織は、この特定の位置でより薄くなっている。
- 鉗子で穴を慎重に大きく伸ばします。この穴は、カニューレの間に鉗子が門脈を支えることを可能にする。
- ポンプ速度を 4 rpm に下げて、流量を約 3 mL/分にします。IVカテーテルからのカルシウムフリーバッファーの流出が遅い点滴に減少していることを確認してください。
注:肝臓の圧力蓄積は肝細胞死を引き起こします。より低い流量は、後のステップで門脈へのカニューレの挿入に成功したときに肝臓の圧力蓄積を遅くするはずである。 - 鉗子を使って門脈を優しく支えます。一方の手で、針のベベルを上に向けてIVカテーテルをつかみます。針を門脈に10〜20°の角度で向け、ベベル全体が静脈の内側になるまでゆっくりと前進します。針が門脈に正しく挿入されると、肝臓はブランチングし始め、濃い赤色を失います。
注:カニューレの挿入に十分な大きさの穴を作るために、針のベベル全体を静脈に挿入する必要があります。ただし、静脈を穿刺しすぎないように針を深く挿入しすぎないでください。 - カニューレを針の上から静脈に進めます。次に、カニューレの後ろに2〜3mmになるまで針を引っ込めます。鋭い先端がカニューレの中に安全に入るようにちょうど十分です。親指と中指でカテーテルをつかみ、人差し指で翼を後ろに引いて針を引っ込めます。
- 静脈クリップで門脈をカテーテルに素早く固定します。灌流液の流れを妨げないように、針の側面の穴に直接クリップしないでください。代わりに、その下にクリップします。
- 肝臓の圧力蓄積を防ぐために、肝下大静脈(IVC)を直ちに切断する。今までに、肝外膜IVCおよび隣接する血管は、門脈からの血液によって不明瞭になる。IVCが正しく切断され、切断されたことを確認するために、血液が脈拍で噴出するのを観察します。血液は隣接する血管からのみ流れ出ます。
注:カニューレ後に肝外IVCを切断するのに時間がかかりすぎたり、次のステップに進む前に切断に失敗すると、肝細胞が死に至ります。動物は、このステップの間に放血(IVCの切断を通して)によって麻酔下で安楽死される。失血が進行中の間、手順を継続する必要があります.死亡は、後の段階で胸腔を開いたときの心拍/呼吸の停止を目視で確認することができます。 - ポンプ速度を 38 rpm に上げて、流量を約 33 mL/分にします。IVCを鉗子で2〜3秒間閉じて(ただし、長すぎない)、再度開いて、肝臓を3回洗い流します。
注:フラッシング中、肝臓は正常に戻る前にわずかに拡大します。フラッシングは、肝臓全体に灌流液の浸透を促進する。潮紅後、肝臓は完全に淡褐色でなければなりません。 - カニューレ先端が門脈が異なる肝葉に分岐する点の前に置かれていることを確認し、すべての肝葉の灌流を確実にする。必要に応じて、門脈のクリップを外し、カニューレの位置を調整します。後で再クリップします。
- 門脈の周りの緩い合字を分岐点のわずかに上流で締め付けます。柔らかいカニューレが硬い金属の針で支えられている場所、ベベルとサイドホールの間に3つの結び目を作ります。結び目がカニューレを所定の位置に固定し、門脈に固定し、バッファの逆流を防ぐことを確認します。
- 肝臓全体を無傷で切除する。
- カルシウムを含まない緩衝液で肝臓を約33mL/minの流速で次の12分間灌流します( 図5A参照)。その間に、肝切除を行う。必要に応じて灌流時間を延長することができますが、カルシウムを含まないバッファーが使い果たされないようにしてください。
- 湾曲したはさみのペアを使用して、それらを一緒に接続する腸間膜を切断することによって、門脈を腸から慎重に取り外す。胃腸管(食道、胃、小腸と大腸)を傷つけて、汚染が発生しないようにしないでください。
注:これは、切除中に肝臓が動き回ったときに門脈が裂けるのを防ぐためです。 - 肝臓を胃腸管に接続する結合組織、膵臓、腸間膜を切断することによって、肝臓を胃腸管から切り離す。外すには、必ずハサミで切り、引いて涙を流さないでください。繰り返しますが、胃腸管を切ったり切ったりしないでください。
- 肝臓を静かにひっくり返して横隔膜を露出させます。リブの壁に沿ってダイヤフラムを切断します。横隔膜の大部分が肝臓に接続されたままであることを確認します。肝臓を突いたり打撲傷したりしないように注意してください。
- 胸腔が開かれると、左側に白っぽい肝上IVC、右側に黄色がかった食道の2つの管が見えます。肝上IVCをクリップし、クリップのすぐ上にカットします。肝上IVCのクリッピングは任意である。胸腔が浸水するのを防ぎます。
注:動物の死亡を確認するために、心拍/呼吸の停止を目視で観察してください。 - 食道は横隔膜に囲まれています。横隔膜から食道を隔離するには、横隔膜を右から食道に向かって切り込みます。食道と胃を肝臓と横隔膜に接続する残りの結合組織を切断します。
- 胃腸管を右に押し離します。静脈クリップを肝上IVCから肝外IVCに移す。バッファは、肝上IVCから灌流するようになりました。
注:灌流中、カニューレおよび肝外炎IVCは肝臓で覆われる。肝上IVCからの強力な緩衝流出は、外科医が灌流漏れを排除するのに役立ちます。 - 肝臓を胸腔に接続する残りの横隔膜を切断する。肝臓と腹腔をつなぐ組織を切り取ります。クリップの上の肝外膜IVCを切らないように注意して、クリップを肝臓から外さないように注意してください。
- 肝臓が完全に切除されるようにするには、鉗子で横隔膜をつかんで肝臓を慎重に持ち上げます。肝臓と腹腔をつなぐ組織が残っている場合は、それらを切り取ります。腎臓と脾臓がまだ肝臓に接続されている場合は、それらを切り離してください。
4.肝臓の灌流と消化
- 切除が早期に完了した場合は、肝臓がカルシウムを含まない緩衝液で灌流されるまで12分間待ちます。
- 灌流バッファーをコラゲナーゼバッファーに変更します。ローラークランプ用コラゲナーゼバッファーを完全に緩めてから、カルシウムフリーバッファー用ローラークランプを完全に締め付けます( 図5B参照)。コラゲナーゼ緩衝液がチューブを通して肝臓に到達したら、肝上IVCを2〜3秒間閉じて再び開いて肝臓を3回洗い流す。
- 肝臓をビーカーの上のステージに慎重に移動させ、コラゲナーゼ緩衝液を再循環させる。カテーテルを支えながら横隔膜を鉗子でつかんで肝臓を動かします。偶発的なカテーテルの剥離を防ぐために、カテーテルを引っ張らないでください。
注:カテーテルが剥離し、門脈が損傷しすぎて再カニューレできない場合は、肝上IVCをカニューレし、バッファーが門脈から灌流するのを許してください。肝外膜IVCがクリップされたままであることを確認します。 - 肝臓を12分間消化する。肝臓が滑らかな茶色の質感を失い始めると、半透明の斑点/ネットワークの出現を観察します。肝臓は消化されるにつれて大きくて柔らかくなります。肝臓が粘り気のある一貫性を持つようになったら、灌流を停止します。必要に応じて消化時間を延長することができます。
注:グリッソンのカプセルが壊れている場合、ビーカー内のコラゲナーゼ緩衝液は、逃げた肝細胞のために白濁する可能性があります。
5. 肝細胞の単離
- 門脈を切ってカニューレを慎重に取り除きます。クリップを慎重に取り外します。肝臓を、60mLの冷たいダルベッコ改変イーグル培地(DMEM)を含む150mmディッシュに移す。
- 湾曲した鉗子の裏側を使って肝臓を優しく叩いて、グリッソンのカプセルを壊して剥がします。その後、DMEMで肝臓を左右に穏やかに揺らし、肝細胞を放出する。肝細胞がDMEMに完全に解離するまでこれを続けます。
注:時折、肝臓全体または特定の葉が部分的にしか消化されないことがあります。解離していない肝細胞を強制的に除去し、損傷する肝臓を掻き回さないことにより、より高く、より一貫した細胞生存率が得られる。 - 肝細胞がDMEM中でよく分布するまで、150mmディッシュを静かに揺らす。組織片および細胞凝集塊を除去するために、新しい150mm皿の上に置かれた100μmの孔径ナイロンメッシュフィルターを通して細胞懸濁液を注ぐ。古い皿を30mLのDMEMですすぎ、懸濁液をメッシュフィルターに移します。メッシュフィルターを軽くタップして、閉じ込められた単一の肝細胞が通過できるようにします。
- メッシュフィルターを取り外し、肝細胞がよく分布するまで新しい150 mmディッシュを静かに揺らします。懸濁液を4 x 50 mLチューブに均等に分割する。30mLのDMEMで皿をすすぎ、懸濁液を同じチューブに均等に分割する。各チューブに等量の細胞懸濁液があることを確認してください。
- 細胞懸濁液の4 x 50 mLチューブを50 x g で4°Cで2分間遠心分離する。 緩いペレットを乱すことなく上清を慎重に吸引する。上清を捨てる。各チューブに20mLのDMEMを加え、チューブを静かに揺らして細胞ペレットを再懸濁する。4本のチューブからの細胞懸濁液を2本に結合する。
- 2 x 50 mL チューブを 20 x g で 4 °C で 2 分間遠心分離します。 上清を吸引して捨てる。各チューブに20mLのDMEMを加え、チューブを静かに揺らして細胞ペレットを再懸濁する。2本のチューブからの細胞懸濁液を1つにまとめる。使用時まで細胞を氷の上に保管してください。
- 400 μLの1x PBSと50 μLのトリパンブルーを混合してトリパンブルー溶液を調製する。50μLの肝細胞懸濁液をトリパンブルー溶液に加える。生細胞および死んだ肝細胞の数を光学顕微鏡下で血球計数器でカウントする。
肝細胞培養
- フード内のすべての細胞培養手順を実行します。1mLのコラーゲンコーティング溶液を35mmディッシュに加え、4時間インキュベートする。1x PBSで皿を3回すすいでください。
- 肝細胞懸濁液を肝細胞培養培地中で80万細胞/mLの濃度に希釈する。希釈した肝細胞懸濁液1mLを35mmディッシュに加える。
注:肝細胞は、ピペッティング中のせん断応力に敏感です。ワイドボアピペットチップの使用を検討してください。 - 肝細胞を均等に分配するために皿を揺らす。肝細胞が付着することを可能にするために、37°C、5%CO2 で3〜4時間インキュベートする。
- サンドイッチ培養用。
- 肝細胞培養液を除去する。1mL肝細胞培養培地で1回すすぎ、未接着の細胞を除去した。コラーゲンオーバーレイ溶液1mLを加える。コラーゲンオーバーレイ溶液を皿の壁に追加して、溶液に気泡を導入しないようにします。
- 37°Cでインキュベートし、5%CO2 で一晩、コラーゲンゲル化を可能にした。
- 1mLの新鮮な肝細胞培養培地を加える。37°C、5%CO2でインキュベートする。
- 単層培養用。
- ステップ6.3の後、肝細胞培養液を除去する。1 mL肝細胞培養培地で1回すすぎ、未接着細胞を除去した。
- 1mLの新鮮な肝細胞培養培地を加える。37°C、5%CO2でインキュベートする。
- 先に記載した肝細胞特異的マーカーおよび機能アッセイについて免疫染色を行うことによって肝細胞の純度および機能を評価する10、11。
結果
外科医は、肝臓の灌流がスムーズに進んでいるかどうかは、特定のステップの後に結果を観察することによって知ることができます。最初の結果は、カニューレ、肝外膜IVCの切断、および灌流流量の回復時に観察することができる。肝臓は、その体積を維持しながら、濃い赤から茶色に完全に色を変えたはずです。肝臓がわずかに収縮して見え、赤みがかった色合いまたは赤みの斑点がある?...
ディスカッション
一般的に2段階のコラゲナーゼ灌流手順について観察することが特に重要であるいくつかの点がある。まず、肝臓を切除する際には特別な注意を払わなければなりません。内容物の漏れが細菌汚染につながるため、胃腸管が損傷していないことを確認してください。さらに、動物の処置中に肝臓の表面を覆うグリッソンのカプセルを損傷しないでください。涙液が十分に大きい場合、それはコ...
開示事項
Zhou YanとHanry Yuは、統合灌流システムを製造および販売するVasinfuseの株式を保有しているため、競合する利益を宣言します。Hanry Yuは、Histoindex、Invitrocue、Osteopore、Pishon Biomedical、Ants Innovate、Synally Futuristechの株式を保有しており、ここで報告された情報と競合する利害関係はありません。
謝辞
この作業は、MOE ARC (MOE2017-T2-1-149) によって部分的にサポートされています。NUHS Innovation Seed Grant 2017 (NUHSRO/2017/051/InnovSeed/02);シンガポール機械生物学研究所 (R-714-106-004-135);科学技術研究機構(A*STAR)(プロジェクト番号IAF-PP H18/01/a0/014、IAF-PP H18/01/a0/K14およびMedCaP-LOA-18-02)がHanry Yuに資金提供されました。Ng Chan Wayはシンガポール国立大学の研究者です。シンガポール国立大学の共焦点顕微鏡ユニット&フローサイトメトリーユニットに、肝細胞純度分析における支援とアドバイスをいただいたことに感謝します。
資料
| Name | Company | Catalog Number | Comments |
| Material/Equipment | |||
| 1 mL syringe | Nipro | ||
| 27G needle | Nipro | ||
| Black braided silk non-absorbable, non-sterile surgical suture | Look | SP117 | |
| Bochem 18/10 stainless steel forceps, sharp tip contain bent round tip | Bochem | 10333511 | |
| Disposable Perfusion Set | Vasinfuse | BPF-112 | |
| Floating circular 1.5 mL microcentrifuge tube rack | Sigma-Aldrich | R3133 | |
| German Standard Tissue Forceps, Serrated / 1×2 teeth , 14.5cm | Walentech | ||
| Greiner Cellstar aspirating pipette | Merck | GN710183 | |
| Haemocytometer | |||
| Integrated Perfusion System | Vasinfuse | IPS-001 | |
| Iris Scissors curved, stainless, 11cm | Optimal Medical Products Pte Ltd | CVD | |
| Light microscope with 10X lens | Olympus | ||
| Mesh Sheet 100µM Nylon | Spectra-Teknic(s) Pte Ltd | 06630-75 | |
| Operating Scissors, BL/BL, 13cm | Optimal Medical Products Pte Ltd | STR – BL/BL | |
| Operating Scissors, SH/BL, 13cm | Optimal Medical Products Pte Ltd | STR – SH/BL | |
| Reverse force hemostatic clip | Shanghai Jin Zhong Pte Ltd | XEC230 | |
| Water bath | Grant | ||
| Reagents/Chemicals | |||
| 10X Phosphate buffered saline (PBS) | Sigma-Aldrich | ||
| Bovine serum albumin (BSA) | Sigma-Aldrich | A9056 | |
| CaCl2·2H2O | Merck | 137101 | |
| Collagenase Type IV | Gibco | 17104019 | |
| Dexamethasone | TCI | D1961 | |
| DMEM | Gibco | 31600-034 | |
| Glutamax | Gibco | 35050061 | |
| HEPES | Invitrogen | 11344-041 | |
| Insulin | Sigma-Aldrich | 1-9278 | |
| KCl | VWR | VWRC26764.298 | |
| KH2PO4 | Sigma-Aldrich | P5379 | |
| Linoleic acid | Sigma-Aldrich | L9530 | |
| NaCl | Sigma-Aldrich | S5886 | |
| NaHCO3 | Sigma-Aldrich | S8875 | |
| NaOH | Merck | 106462 | |
| Penicillin-Streptomycin | Sigma-Aldrich | P4333 | |
| Type I bovine collagen | Advanced BioMatrix | 5005-100ml | |
| William’s E Media | Sigma-Aldrich | W1878 |
参考文献
- Shen, L., Hillebrand, A., Wang, D. Q. H., Liu, M. Isolation and primary culture of rat hepatic cells. Journal of Visualized Experiments: JoVE. (64), e3917 (2012).
- Cabral, F., et al. Purification of hepatocytes and sinusoidal endothelial cells from mouse liver perfusion. Journal of Visualized Experiments: JoVE. (132), e56993 (2018).
- Green, C. J., et al. The isolation of primary hepatocytes from human tissue: optimising the use of small non-encapsulated liver resection surplus. Cell and Tissue Banking. 18 (4), 597-604 (2017).
- Seglen, P. O. Preparation of isolated rat liver cells. Methods in Cell Biology. 13, 29-83 (1976).
- Gopalakrishnan, S., Harris, E. N. In vivo liver endocytosis followed by purification of liver cells by liver perfusion. Journal of Visualized Experiments: JoVE. (57), e3138 (2011).
- Wen, J. W., Olsen, A. L., Perepelyuk, M., Wells, R. G. Isolation of rat portal fibroblasts by in situ liver perfusion. Journal of Visualized Experiments: JoVE. (64), e3669 (2012).
- Korelova, K., Jirouskova, M., Sarnova, L., Gregor, M. Isolation and 3D collagen sandwich culture of primary mouse hepatocytes to study the role of cytoskeleton in bile canalicular formation in vitro. Journal of Visualized Experiments: JoVE. (154), e60501 (2019).
- Shi, W., et al. Isolation and purification of immune cells from the liver. International Immunopharmacology. 85 (95), 106632 (2020).
- Salem, E. S. B., et al. Isolation of primary mouse hepatocytes for nascent protein synthesis analysis by non-radioactive L-azidohomoalanine labeling method. Journal of Visualized Experiments: JoVE. (140), e58323 (2018).
- Xia, L., et al. Tethered spheroids as an in vitro hepatocyte model for drug safety screening. Biomaterials. 33 (7), 2165-2176 (2012).
- Kegel, V., et al. Protocol for isolation of primary human hepatocytes and corresponding major populations of non-parenchymal liver cells. Journal of Visualized Experiments: JoVE. (109), e53069 (2016).
- Zhu, L., et al. A vertical-flow bioreactor array compacts hepatocytes for enhanced polarity and functions. Lab on a Chip. 16 (20), 3898-3908 (2016).
- Du, Y., et al. Synthetic sandwich culture of 3D hepatocyte monolayer. Biomaterials. 29 (3), 290-301 (2008).
- Tong, W. H., et al. Constrained spheroids for prolonged hepatocyte culture. Biomaterials. 80, 106-120 (2016).
- Xia, L., et al. Laminar-flow immediate-overlay hepatocyte sandwich perfusion system for drug hepatotoxicity testing. Biomaterials. 30 (30), 5927-5936 (2009).
- Gupta, K., et al. Bile canaliculi contract autonomously by releasing calcium into hepatocytes via mechanosensitive calcium channel. Biomaterials. 259, 120283 (2020).
- Horner, R., et al. Impact of Percoll purification on isolation of primary human hepatocytes. Scientific Reports. 9 (1), 6542 (2019).
- Osypiw, J. C., et al. Subpopulations of rat hepatocytes separated by Percoll density-gradient centrifugation show characteristics consistent with different acinar locations. The Biochemical Journal. 304, 617-624 (1994).
- Beal, E. W., et al. A small animal model of ex vivo normothermic liver perfusion. Journal of Visualized Experiments: JoVE. (136), e57541 (2018).
- Hillebrandt, K., et al. Procedure for decellularization of rat livers in an oscillating-pressure perfusion device. Journal of Visualized Experiments: JoVE. (102), e53029 (2015).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved