È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Isolamento degli epatociti primari di ratto con controllo della perfusione multiparametrica
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questo protocollo descrive l'uso di uno speciale catetere endovenoso, tubi monouso sterili standardizzati, controllo della temperatura integrato da monitoraggio in tempo reale e un sistema di allarme per la procedura di perfusione della collagenasi in due fasi per migliorare la coerenza nella vitalità, nella resa e nella funzionalità degli epatociti primari isolati di ratto.
Abstract
Gli epatociti primari sono ampiamente utilizzati nella ricerca di base sulle malattie del fegato e per i test di tossicità in vitro. La procedura di perfusione della collagenasi in due fasi per l'isolamento primario degli epatociti è tecnicamente impegnativa, specialmente nella cannulazione della vena porta. La procedura è anche soggetta a contaminazione occasionale e variazioni nelle condizioni di perfusione a causa di difficoltà nell'assemblaggio, nell'ottimizzazione o nella manutenzione della configurazione della perfusione. Qui, viene presentato un protocollo dettagliato per una migliore procedura di perfusione di collagenasi in due fasi con controllo della perfusione multiparametrica. Gli epatociti primari di ratto sono stati isolati con successo e in modo affidabile adottando le necessarie precauzioni tecniche nelle fasi critiche della procedura e riducendo la difficoltà operativa e mitigando la variabilità dei parametri di perfusione attraverso l'adozione di uno speciale catetere endovenoso, tubi monouso sterili standardizzati, controllo della temperatura e sistema di monitoraggio e allarme in tempo reale. Gli epatociti primari isolati di ratto mostrano costantemente un'elevata vitalità cellulare (85%-95%), resa (2-5 x 108 cellule per 200-300 g di ratto) e funzionalità (albumina, urea e attività del CYP). La procedura è stata completata da un sistema di perfusione integrato, che è abbastanza compatto da essere installato nella cappa a flusso laminare per garantire il funzionamento asettico.
Introduzione
Gli epatociti primari sono strumenti importanti per la ricerca di base correlata al fegato, il trattamento delle malattie e l'applicazione come i test antidroga. L'attuale gold standard per l'isolamento primario degli epatociti è la procedura di perfusione della collagenasi in due fasi 1,2,3 introdotta da Seglen nel 1970 4. Tuttavia, questa procedura è tecnicamente impegnativa e ha un alto tasso di fallimento se eseguita da chirurghi alle prime armi. Anche quando una perfusione è considerata di successo, si possono osservare drastiche differenze nella vitalità degli epatociti (in genere 60%-95%) e nella resa (0,5-5 x 108 per 200-300 g di ratto) tra gli isolamenti. Ciò influenza la qualità e la scala degli esperimenti a valle. Oltre alla procedura tecnica, la configurazione di perfusione utilizzata per l'isolamento, disponibile in commercio o costruita su misura, è un fattore che contribuisce. Bisogna prestare attenzione all'assemblaggio, all'ottimizzazione e alla manutenzione della configurazione della perfusione. Lo scopo di questo protocollo è quello di migliorare il tasso di successo e la stabilità tra gli isolamenti degli epatociti primari di ratto attraverso il controllo della perfusione multiparametrica della procedura tecnica e la configurazione della perfusione della collagenasi in due fasi.
Dall'aspetto tecnico, il passo più difficile nella procedura è la cannulazione della vena porta. Per quanto riguarda gli altri passaggi, se si osservano buone pratiche e si prendono precauzioni generali, la stabilità dell'isolamento può essere migliorata. Pertanto, la comprensione del ragionamento per ogni passaggio è importante in modo che il chirurgo possa rispondere a varie variabili che possono verificarsi durante la procedura.
Vari protocolli per l'isolamento di epatociti e cellule epatiche non parenchimali da ratti e topi sono stati pubblicati 1,2,5,6,7,8,9. Le configurazioni di perfusione utilizzate in questi protocolli presentavano diversi svantaggi, tra cui il riutilizzo di tubi di perfusione, problemi con il controllo della temperatura, necessità di ottimizzazione di routine dei parametri di perfusione e / o l'uso di un tipo inadatto di catetere endovenoso (IV) per la cannulazione della vena porta. Il riutilizzo dei tubi di perfusione aumenterà le possibilità di contaminazione, soprattutto se il tubo non è stato pulito e disinfettato correttamente. Il riutilizzo dei tubi senza sostituzione di routine esporrà anche la configurazione della perfusione a problemi come tubi o connettori che perdono, trappola a bolle intasata e tubi ristretti, che ridurranno sostanzialmente la pressione e la portata del perfusato, influenzando così l'efficienza della digestione del fegato. Senza una fonte di calore costante in alcune configurazioni per il controllo della temperatura, i tamponi preriscaldati si raffredderanno nel tempo, portando a una bassa attività e digestione della collagenasi. Sebbene altre configurazioni utilizzino un condensatore di vetro rivestito collegato a un circolatore d'acqua per riscaldare il buffer, sono ingombranti e richiedono un'attenta pulizia. La temperatura, la pressione e la portata del tampone in uscita dal catetere devono essere misurate e ottimizzate prima dell'inizio dell'isolamento per garantire condizioni di perfusione stabili. Anche dopo l'ottimizzazione, i parametri potrebbero ancora cambiare a metà strada durante l'isolamento a causa delle azioni dell'operatore, portando così a una perfusione e una digestione non ottimali. La maggior parte dei tipi di catetere IV non sono adatti per la cannulazione della vena porta perché non consentono la perfusione continua durante la cannulazione. Non sono in grado di informare immediatamente il chirurgo quando la cannulazione ha successo. Inoltre, è difficile fissare la vena porta sul catetere morbido senza deformarlo.
Qui, affrontiamo questi problemi utilizzando tubi sterili monouso standardizzati, una camicia riscaldante in silicone per un controllo preciso e stabile della temperatura, monitoraggio e sistema di allarme in tempo reale con memorizzazione e gestione dei dati e l'uso di uno speciale catetere IV, che consente una perfusione continua durante la perforazione della vena porta durante la cannulazione. Per quanto ne sappiamo, siamo il primo gruppo a combinare tutte queste caratteristiche in un sistema di perfusione integrato (IPS) compatto, che lo rende altamente portatile e in grado di essere inserito in una cappa a flusso laminare per garantire il funzionamento asettico.
Protocollo
Tutte le procedure e la stabulazione degli animali sono state eseguite con i numeri di protocollo R15-0027 e R19-0669 in conformità con i requisiti del Comitato istituzionale per la cura e l'uso degli animali (IACUC) dell'Università Nazionale di Singapore.
1. Preparazione di soluzioni e strumenti chirurgici
- Preparare tamponi e terreni di coltura cellulare nella Tabella 1 utilizzando acqua ultrapura.
- Preriscaldare il tampone privo di calcio e il tampone di collagenasi a 37 °C a bagnomaria prima dell'uso.
- Autoclave i seguenti strumenti chirurgici e attrezzature di laboratorio: un paio di forbici chirurgiche affilate,un paio di forbici chirurgiche smussate-smussate, un paio di forbici chirurgiche curve, due paia di pinze per tessuto dentale, due paia di pinze curve, due clip per vene, una sutura chirurgica di seta 3-0 lunga 5 cm, un filtro a rete di nylon da 100 μm, un becher da 400 ml, e un palco (rack tubo microcentrifugale galleggiante).
2. Configurazione dell'IPS (vedere figura 1)
- Pulire la cappa a flusso laminare con etanolo al 70%. Pulire l'IPS con etanolo al 70% e spostarlo nella cappa a flusso laminare. Sterilizzare con UV per >15 minuti prima di accendere la cappa.
ATTENZIONE: L'esposizione alla luce UV può causare dolorose ustioni agli occhi e alla pelle. Assicurarsi che l'anta sia completamente chiusa quando la luce UV è accesa. - Assemblare un nuovo set di tubi monouso sull'IPS. Avvolgere il tubo a valle della pompa peristaltica in una camicia di riscaldamento in silicone. Assemblare il monitor di perfusione sul tubo a valle della camicia del riscaldatore in silicone.
- Assicurarsi che i morsetti a rulli per entrambe le prese d'ingresso dei tubi siano completamente allentati. Collegare ogni ingresso del tubo all'estremità affusolata di una pipetta di aspirazione sterile da 2 ml. Lasciare entrambe le pipette di aspirazione (ingressi) e il catetere IV (uscita) in un flacone da 1 L con tampone privo di calcio per consentire il ricircolo del tampone durante le successive fasi di adescamento.
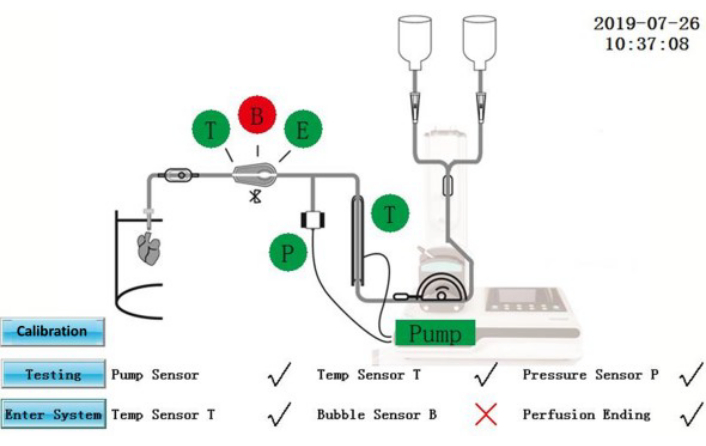
Figura 2: Interfaccia di test automatico. Fare clic qui per visualizzare una versione più grande di questa figura.
- Accendere l'IPS. Eseguire le seguenti operazioni sul pannello di controllo touch screen. Il software eseguirà un autotest completo ogni volta che viene avviato.
ATTENZIONE: l'IPS è un'apparecchiatura elettrica collegata a una fonte di alimentazione esterna. Le fuoriuscite di liquidi sull'IPS o sui cavi di alimentazione possono produrre rischi elettrici.- Assicurarsi che lo stato del test automatico sia visualizzato sullo schermo (Figura 2). I componenti che hanno superato l'autotest saranno mostrati in verde; quelli che hanno fallito verranno mostrati in rosso. Dopo la rettifica, toccare l'icona Test per ripetere nuovamente l'autotest oppure toccare l'icona Inserisci sistema per accedere direttamente all'interfaccia operativa.
- Tocca un punto qualsiasi dello schermo per accedere all'interfaccia operativa.
- Nell'angolo superiore sinistro dell'interfaccia operativa (Figura 3), toccare una delle icone freccia circolari per impostare il senso di rotazione della pompa peristaltica. Nel pannello di destra dell'interfaccia, tocca le icone freccia su/giù per impostare i valori per i parametri corrispondenti. Impostare il flusso in modalità flusso costante; temperatura della camicia del riscaldatore a 42 °C (da regolare per garantire che la temperatura del perfusato sia mantenuta a 37 °C); e velocità della pompa a 38 rpm per una portata di ~33 mL/min.
- Nel pannello in basso a destra dell'interfaccia operativa, verificare lo stato dell'allarme a bolle, dell'allarme di arresto della perfusione e dell'icona di disattivazione dell'audio.
- Controllare la temperatura, la pressione e la portata del perfusato nel pannello di sinistra. Imposta manualmente gli intervalli facendo clic sulle frecce su-giù nella parte superiore e inferiore delle colonne. Verificare la presenza di dati in tempo reale visualizzati come valori al centro delle colonne. Il colore della colonna passerà dal verde al rosso se i dati in tempo reale si spostano oltre l'intervallo impostato.
- Individua le icone per avviare, mettere in pausa e interrompere la perfusione e l'icona per passare dalla visualizzazione dei dati in tempo reale alla modalità grafico nel pannello centrale. Toccare l'icona di avvio per iniziare la perfusione e innescare il tubo con tampone privo di calcio. Verrà creato un nuovo registro. Immettere il nome del file e il nome utente nella finestra popup (Figura 4).
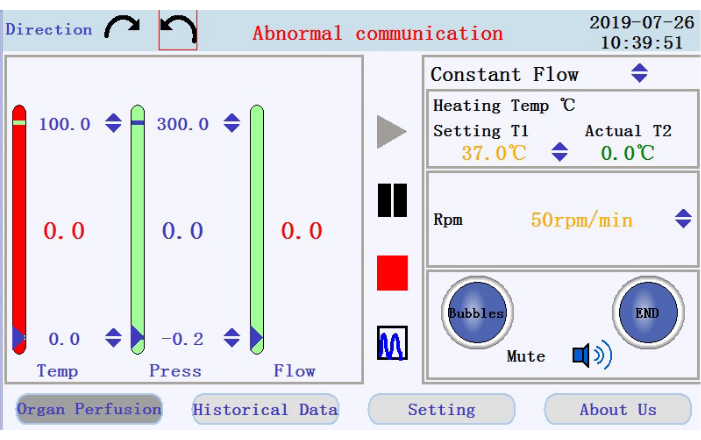
Figura 3: Interfaccia operativa. Fare clic qui per visualizzare una versione più grande di questa figura.
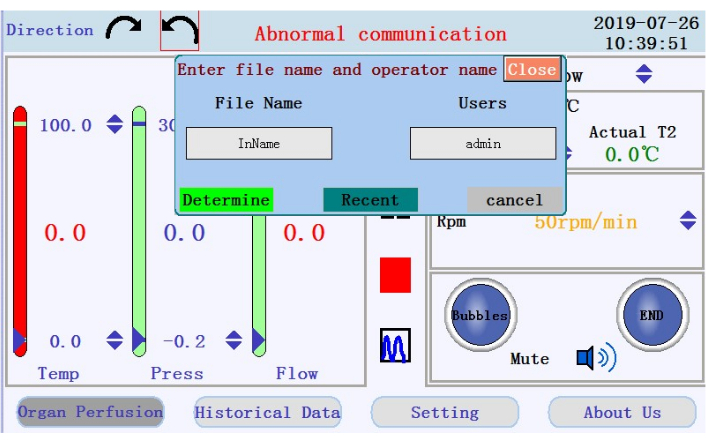
Figura 4: Finestra popup che richiede il nome del file e il nome utente. Fare clic qui per visualizzare una versione più grande di questa figura.
- Riempire la camera di gocciolamento a metà piena. Assicurarsi che non vi siano sacche d'aria intrappolate nel tubo durante l'adescamento.
- Rimuovere qualsiasi bolla che si forma a valle del filtro a bolle scorrendo sul tubo per staccare la bolla e consentirne lo scarico.
NOTA: possono formarsi bolle lungo il tubo mentre il buffer viene riscaldato dalla camicia del riscaldatore. - Riempire un becher da 400 ml con 200 mL di tampone di collagenasi. Metti il palco sopra il becher. Senza introdurre aria nel tubo, stringere completamente il morsetto a rulli per una delle prese del tubo e spostare la pipetta di aspirazione per l'ingresso nel becher.
3. Procedura animale
- Preparare un giovane ratto Wistar maschio adulto intorno ai 200-300 g di peso corporeo.
NOTA: Questo protocollo è stato ottimizzato per i ratti intorno ai 200-300 g di peso corporeo. I ratti maschi sono preferiti poiché i cambiamenti ormonali durante il ciclo estrale nei ratti femmina influenzeranno la funzione degli epatociti. - Anestesia
- Prelevare il volume richiesto di eparina anticoagulante (5.000 UI/ml; 0,2 mL/100 g di peso corporeo) e di cocktail di ketamina/xilazina per anestesia di ratto (37,5 mg/mL di ketamina, 5 mg/mL di xilazina; 0,2 ml/100 g di peso corporeo) in 1 mL di siringhe con ago da 27 G.
ATTENZIONE: L'anestesia e l'eparina sono sostanze nocive. Fai attenzione quando maneggi taglienti. - Trattenere il topo. Iniettare per via intraperitoneale eparina seguita da cocktail di ketamina/xilazina nel quadrante inferiore destro dell'addome.
NOTA: il cieco ha una maggiore probabilità di trovarsi a sinistra. Evitare di forare il cieco durante l'iniezione per ridurre il rischio di contaminazione. - Dopo 10 minuti, controllare la profondità dell'anestesia valutando il riflesso del pedale su entrambi i piedi del ratto. Continua a controllare di tanto in tanto e attendi che il topo non risponda più ai pizzichi delle dita dei piedi. L'anestesia aggiuntiva può essere iniettata, se necessario.
- Prelevare il volume richiesto di eparina anticoagulante (5.000 UI/ml; 0,2 mL/100 g di peso corporeo) e di cocktail di ketamina/xilazina per anestesia di ratto (37,5 mg/mL di ketamina, 5 mg/mL di xilazina; 0,2 ml/100 g di peso corporeo) in 1 mL di siringhe con ago da 27 G.
- Posizionare il ratto in posizione supina con gli arti distesi su una piattaforma di polistirene ricoperta di foglio di alluminio sopra un vassoio. Fissare i piedi del topo e fissare saldamente il nastro sulla piattaforma con aghi da 27 G.
- Disinfettare il torace e l'addome spruzzandoli e inzuppandoli con etanolo al 70%. La rasatura prima della disinfezione è facoltativa. Metti il topo nel cappuccio. Continua il passaggio successivo mentre la pelliccia è ancora bagnata.
NOTA: L'inzuppamento con etanolo al 70% mantiene anche peli e polvere di pelliccia al minimo. - Separare la pelle dal muscolo.
- Con un paio di pinze per il tessuto dentale in una mano, sollevare la pelle vicino alla base dell'addome. Con un paio di forbici chirurgiche affilate nell'altra mano, taglia la pelle tendata. Spingere l'estremità affilata delle forbici sotto la pelle e fare un'incisione della linea mediana sulla pelle da appena sopra le zampe posteriori a appena sotto le zampe anteriori.
- Mentre si tira su e si allunga leggermente la pelle con la pinza, tagliare qualsiasi tessuto connettivo che trattiene la pelle sul muscolo nel torace e nell'addome. Per ridurre il rischio di contaminazione, evitare che la pelliccia sciolta cada sul muscolo. Per rimuovere la pelliccia sciolta accumulata sulle forbici, pulirle sul lato esterno disinfettato della pelle.
- Fai incisioni laterali sulla pelle, dalla linea mediana a entrambi i lati del ratto leggermente sopra le zampe posteriori e leggermente sotto le zampe anteriori. Spingere i lembi di pelle ai lati per esporre il muscolo.
- Tagliare il muscolo addominale per esporre gli organi.
- Con un nuovo paio di pinze per il tessuto dentale in una mano, sollevare il muscolo vicino alla base dell'addome. Con un paio di forbici chirurgiche smussate nell'altra mano, tagliare con cura il muscolo senza graffiare nessuno degli organi. Fai un'incisione della linea mediana sul muscolo da leggermente sopra le zampe posteriori allo sterno.
- Fai incisioni laterali sul muscolo, dalla linea mediana a entrambi i lati del ratto leggermente sopra le zampe posteriori e appena sotto la gabbia toracica, senza graffiare nessuno degli organi. Spingere i lembi del muscolo ai lati per esporre gli organi. Assicurarsi che le incisioni laterali della pelle e del muscolo raggiungano i lati del ratto per consentire al sangue e ai tamponi di fuoriuscire dalla cavità addominale nelle fasi successive.
- Cannulazione della vena porta
- Con la parte posteriore della pinza curva, spingere delicatamente l'intestino a destra. Capovolgere delicatamente i lobi del fegato per esporre la vena porta.
- Utilizzare una sutura chirurgica di seta 3-0 per creare una legatura molto allentata attorno alla vena porta vicino al fegato, poco prima che la vena si ramifichi a sinistra ea destra in diversi lobi del fegato. Non stringere la legatura per evitare di interrompere il flusso sanguigno attraverso la vena porta. Una membrana molto sottile sotto il dotto biliare dovrà essere sfondata con la punta della pinza curva prima che la sutura possa passare sotto ed essere avvolta attorno alla vena porta (e al dotto biliare).
- Utilizzando le punte di due paia di pinze curve, perforare con cura un foro attraverso il tessuto sotto la vena porta, senza danneggiare la vena porta. Fallo circa 2-3 cm a monte della prima legatura, poco prima che la vena gastrica si dirama dalla vena porta. Il tessuto è più sottile in questa posizione specifica.
- Allungare con attenzione il foro più grande con la pinza. Questo foro consentirà alla pinza di sostenere la vena porta durante la cannulazione.
- Ridurre la velocità della pompa a 4 giri/min per una portata di ~3 ml/min. Assicurarsi che il deflusso del tampone privo di calcio dal catetere IV sia ridotto a una flebo lenta.
NOTA: L'accumulo di pressione nel fegato causerà la morte degli epatociti. Una portata inferiore dovrebbe rallentare l'accumulo di pressione nel fegato dopo l'inserimento riuscito della cannula nella vena porta in una fase successiva. - Sostenere delicatamente la vena porta usando una pinza. Con l'altra mano, tenere il catetere IV con la smussatura dell'ago rivolta verso l'alto. Dirigere l'ago nella vena porta con un angolo di 10-20 ° e avanzare lentamente fino a quando l'intera smussatura è all'interno della vena. Una volta che l'ago viene inserito correttamente nella vena porta, il fegato inizierà a sbollentare e perderà il suo colore rosso scuro.
NOTA: L'intera smussatura dell'ago deve essere inserita nella vena per creare un foro abbastanza grande per l'inserimento della cannula. Tuttavia, non inserire l'ago troppo in profondità per evitare di perforare eccessivamente la vena. - Avanzare la cannula sopra l'ago e nella vena. Quindi, ritrarre l'ago fino a quando non è 2-3 mm dietro la cannula; quanto basta in modo che la punta affilata sia al sicuro all'interno della cannula. Usa il pollice e il dito medio per aggrapparti al catetere e usa l'indice per tirare indietro l'ala per ritrarre l'ago.
- Fissare rapidamente la vena porta sul catetere con una clip venosa. Non agganciare direttamente sul foro laterale dell'ago per evitare di interrompere il flusso di perfusato. Invece, clip sotto di esso.
- Tagliare immediatamente la vena cava inferiore infraepatica (IVC) per prevenire l'accumulo di pressione nel fegato. Ormai l'IVC infraepatico e i vasi sanguigni adiacenti saranno oscurati dal sangue proveniente dalla vena porta. Per garantire che l'IVC sia stato correttamente tagliato e reciso, osservare il sangue che sgorga negli impulsi; il sangue fuoriuscirà solo dai vasi adiacenti.
NOTA: Impiegare troppo tempo per tagliare l'IVC infraepatico dopo la cannulazione o il mancato taglio prima di passare al passaggio successivo causerà la morte degli epatociti. L'animale viene sottoposto a eutanasia in anestesia mediante dissanguamento (attraverso il taglio dell'IVC) durante questa fase. La procedura dovrebbe continuare mentre la perdita di sangue è in corso. La morte può essere confermata dall'osservazione visiva della cessazione del battito cardiaco / respirazione quando la cavità toracica viene aperta in una fase successiva. - Aumentare la velocità della pompa a 38 giri/min per una portata di ~33 ml/min. Lavare il fegato tre volte chiudendo l'IVC con una pinza per 2-3 s (ma non troppo a lungo) e riaprendolo.
NOTA: Durante il rossore, il fegato si espanderà leggermente prima di tornare alla normalità. Il rossore facilita la permeazione del perfusato in tutto il fegato. Dopo il rossore, il fegato dovrebbe essere di colore completamente marrone chiaro. - Assicurarsi che la punta della cannula sia posizionata prima del punto in cui la vena porta si ramifica in diversi lobi epatici, per garantire la perfusione di tutti i lobi epatici. Se necessario, sganciare la vena porta e regolare la posizione della cannula. Ritaglia di nuovo in seguito.
- Stringere la legatura sciolta attorno alla vena porta, leggermente a monte del punto di ramificazione. Fai tre nodi su dove la cannula morbida è sostenuta dall'ago di metallo duro, tra la smussatura e il foro laterale. Assicurarsi che i nodi fissino la cannula in posizione, fissandola alla vena porta e impedendo il riflusso dei tamponi.
- Resecare l'intero fegato intatto.
- Perfondere il fegato con tampone privo di calcio alla portata di ~33 ml/min per i successivi 12 minuti (vedere Figura 5A). Nel frattempo, eseguire la resezione epatica. Il tempo di perfusione può essere esteso se necessario, ma assicurarsi che il tampone privo di calcio non si esaurisca.
- Usando un paio di forbici curve, staccare con cura la vena porta dall'intestino tagliando il mesentere che li collega insieme. Non danneggiare il tratto gastrointestinale (esofago, stomaco e intestino tenue e crasso) per garantire che non si verifichi alcuna contaminazione.
NOTA: Questo per evitare che la vena porta si strappi quando il fegato viene spostato durante la resezione. - Staccare il fegato dal tratto gastrointestinale tagliando i tessuti connettivi, il pancreas e il mesentere che collega il fegato al tratto gastrointestinale. Per staccare, tagliare sempre con le forbici e non tirare a strappare. Ancora una volta, non nick o tagliare il tratto gastrointestinale.
- Capovolgere delicatamente il fegato per esporre il diaframma. Tagliare il diaframma seguendo le pareti delle costole. Assicurarsi che la maggior parte del diaframma rimanga collegato al fegato. Fare attenzione a non colpire o lividi il fegato.
- Una volta aperta la cavità toracica, si possono vedere due dotti: l'IVC sopraepatico biancastro a sinistra e l'esofago giallastro a destra. Ritaglia l'IVC sopraepatico e taglialo appena sopra la clip. Il ritaglio dell'IVC sopraepatico è facoltativo. Impedisce alla cavità toracica di allagarsi.
NOTA: Osservare visivamente per la cessazione del battito cardiaco / respirazione per confermare la morte dell'animale. - L'esofago è circondato dal diaframma. Per isolare l'esofago dal diaframma, tagliare il diaframma da destra verso l'esofago. Tagliare tutti i tessuti connettivi rimanenti che collegano l'esofago e lo stomaco al fegato e al diaframma.
- Spingere via il tratto gastrointestinale a destra. Trasferire la clip venosa dall'IVC sopraepatico all'IVC infraepatico; il buffer ora si diffonderà dall'IVC sopraepatico.
NOTA: Durante la perfusione, la cannula e l'IVC infraepatica saranno coperte dal fegato. Un forte deflusso tampone dall'IVC sopraepatico aiuterà il chirurgo a escludere perdite di perfusione. - Tagliare qualsiasi diaframma rimanente che collega il fegato alla cavità toracica. Tagliare i tessuti che collegano il fegato alla cavità addominale. Fare attenzione a non tagliare l'IVC infraepatico sopra la clip per evitare di staccare la clip dal fegato.
- Per garantire che il fegato sia completamente resecato, sollevare con attenzione il fegato aggrappandosi al diaframma con una pinza. Se ci sono tessuti rimanenti che collegano il fegato alla cavità addominale, tagliarli. Se il rene e la milza sono ancora collegati al fegato, staccarli.
4. Perfusione epatica e digestione
- Se la resezione è stata completata in anticipo, attendere che il fegato sia stato perfuso con tampone privo di calcio per 12 minuti.
- Cambiare il tampone di perfusione in tampone di collagenasi. Allentare completamente il morsetto a rulli per il tampone di collagenasi prima di stringere completamente il morsetto a rulli per il tampone privo di calcio (vedere Figura 5B). Una volta che il tampone della collagenasi raggiunge il fegato attraverso il tubo, lavare il fegato tre volte chiudendo l'IVC sopraepatico per 2-3 s e riaprendolo.
- Spostare con attenzione il fegato sul palco sopra il becher per il ricircolo del tampone della collagenasi. Muovi il fegato tenendo il diaframma con una pinza mentre sostieni il catetere. Evitare di tirare il catetere per evitare il distacco accidentale del catetere.
NOTA: Se il catetere si stacca e la vena porta è troppo danneggiata per la ri-cannulazione, puònulare l'IVC sopraepatico e consentire al tampone di perfondersi dalla vena porta. Assicurarsi che l'IVC infraepatico rimanga tagliato. - Digerire il fegato per 12 min. Osservare per la comparsa di macchie traslucide / rete come il fegato inizia a perdere la sua consistenza marrone liscia. Il fegato diventerà più grande e più morbido man mano che viene digerito. Una volta che il fegato ha una consistenza molle, interrompere la perfusione. Il tempo di digestione può essere esteso, se necessario.
NOTA: Se la capsula di Glisson è stata rotta, il tampone della collagenasi nel becher potrebbe diventare torbido a causa delle cellule epatiche sfuggite.
5. Isolamento degli epatociti
- Rimuovere con cura la cannula tagliando la vena porta. Rimuovere con attenzione la clip. Trasferire il fegato in un piatto da 150 mm contenente 60 ml di Dulbecco's Modified Eagle Medium (DMEM) freddo.
- Picchiettare delicatamente il fegato usando la parte posteriore della pinza curva per rompere e staccare la capsula di Glisson. Quindi, oscillare delicatamente il fegato da un lato all'altro nel DMEM per rilasciare le cellule del fegato. Continuare a farlo fino a quando le cellule del fegato sono completamente dissociate nel DMEM.
NOTA: Occasionalmente l'intero fegato o alcuni lobi saranno solo parzialmente digeriti. Non raschiando il fegato che rimuoverà forzatamente e danneggerà gli epatociti non dissociati, si può ottenere una maggiore e più consistente vitalità cellulare. - Scuotere delicatamente il piatto da 150 mm fino a quando le cellule del fegato sono distribuite bene nel DMEM. Per rimuovere pezzi di tessuto e grumi cellulari, versare la sospensione cellulare attraverso un filtro in rete di nylon da 100 μm posizionato su un nuovo piatto da 150 mm. Risciacquare il vecchio piatto con 30 ml di DMEM e trasferire la sospensione al filtro a rete. Toccare delicatamente il filtro a rete per consentire il passaggio di singole cellule epatiche intrappolate.
- Rimuovere il filtro a rete e scuotere delicatamente il nuovo piatto da 150 mm fino a quando le cellule del fegato non sono distribuite bene. Dividere equamente la sospensione in 4 tubi da 50 ml. Risciacquare il piatto con 30 ml di DMEM e dividere equamente la sospensione negli stessi tubi. Assicurarsi che ogni tubo abbia lo stesso volume di sospensione cellulare.
- Centrifugare i tubi 4 x 50 mL di sospensione cellulare a 50 x g per 2 min a 4 °C. Aspirare accuratamente il surnatante senza disturbare il pellet sciolto. Scartare il surnatante. Aggiungere 20 ml di DMEM in ogni tubo e scuotere delicatamente i tubi per risospescere il pellet cellulare. Combinare la sospensione cellulare da quattro tubi in due.
- Centrifugare i tubi 2 x 50 mL a 20 x g per 2 min a 4 °C. Aspirare e scartare il surnatante. Aggiungere 20 ml di DMEM in ogni tubo e scuotere delicatamente i tubi per risospescere il pellet cellulare. Combinare la sospensione cellulare da due tubi in uno. Tenere le cellule sul ghiaccio fino all'uso.
- Preparare la soluzione blu di tripano mescolando 400 μL di 1x PBS con 50 μL di tripano blu. Aggiungere 50 μL di sospensione epatocitaria nella soluzione blu di tripano. Contare il numero di epatociti vitali e morti con un emocitometro al microscopio ottico.
6. Coltura di epatociti
- Eseguire tutte le fasi di coltura cellulare nel cofano. Aggiungere 1 mL di soluzione di rivestimento di collagene in un piatto da 35 mm e incubare per 4 ore. Risciacquare i piatti tre volte con 1x PBS.
- Diluire la sospensione epatocitaria nel terreno di coltura degli epatociti ad una concentrazione di 0,8 milioni di cellule/ml. Aggiungere 1 mL di sospensione epatocitaria diluita nella parabola da 35 mm.
NOTA: gli epatociti sono sensibili allo sforzo di taglio durante il pipettaggio. Prendi in considerazione l'utilizzo di punte per pipette a foro largo. - Scuotere il piatto per distribuire gli epatociti in modo uniforme. Incubare a 37 °C, 5% CO2 per 3-4 ore per consentire agli epatociti di attaccarsi.
- Per la cultura del sandwich.
- Rimuovere il terreno di coltura degli epatociti. Risciacquare una volta con 1 mL di terreno di coltura epatocitaria per rimuovere le cellule non attaccate. Aggiungere 1 mL di soluzione di sovrapposizione di collagene. Aggiungere la soluzione di sovrapposizione di collagene sulle pareti del piatto per evitare di introdurre bolle nella soluzione.
- Incubare a 37 °C, 5% CO2 per la notte per consentire la gelificazione del collagene.
- Aggiungere 1 mL di terreno di coltura di epatociti freschi. Incubare a 37 °C, 5% CO2.
- Per la cultura monostrato.
- Dopo il passaggio 6.3, rimuovere il terreno di coltura degli epatociti. Risciacquare una volta con 1 mL di terreno di coltura epatocitaria per rimuovere le cellule non attaccate.
- Aggiungere 1 mL di terreno di coltura di epatociti freschi. Incubare a 37 °C, 5% CO2.
- Valutare la purezza e la funzione degli epatociti eseguendo immunocolorazione per marcatori specifici per epatociti e saggi funzionali come descritto in precedenza10,11.
Risultati
Un chirurgo potrebbe dire se la perfusione epatica sta procedendo senza intoppi osservando il risultato dopo determinati passaggi. Il primo risultato può essere osservato al momento della cannulazione, del taglio dell'IVC infraepatico e del ripristino della portata di perfusione. Il fegato dovrebbe aver cambiato completamente colore dal rosso scuro al marrone, pur mantenendo il suo volume. Se il fegato sembra leggermente sgonfio e ha una tinta rossastra o macchie di rosso, significa che la portata di perfusione è stata...
Discussione
Ci sono alcuni punti che sono particolarmente importanti da osservare per la procedura di perfusione della collagenasi in due fasi in generale. In primo luogo, è necessario prestare particolare attenzione quando si reseca il fegato. Assicurarsi che il tratto gastrointestinale non sia danneggiato in quanto la perdita del contenuto comporterà la contaminazione batterica. Inoltre, evitare di danneggiare la capsula di Glisson, che copre la superficie del fegato durante la procedura animale. Se la lacrima è abbastanza gran...
Divulgazioni
Zhou Yan e Hanry Yu dichiarano interessi concorrenti in quanto detengono partecipazioni in Vasinfuse, che produce e commercializza il Sistema di Perfusione Integrato. Hanry Yu detiene partecipazioni in Histoindex, Invitrocue, Osteopore, Pishon Biomedical, Ants Innovate e Synally Futuristech che non hanno interessi in competizione con le informazioni riportate qui.
Riconoscimenti
Questo lavoro è supportato in parte da MOE ARC (MOE2017-T2-1-149); NUHS Innovation Seed Grant 2017 (NUHSRO/2017/051/InnovSeed/02); Istituto di meccanobiologia di Singapore (R-714-106-004-135); e Institute of Bioengineering and Nanotechnology, Biomedical Research Council, Agency for Science, Technology and Research (A*STAR) (Project Numbers IAF-PP H18/01/a0/014, IAF-PP H18/01/a0/K14 e MedCaP-LOA-18-02) finanziamenti a Hanry Yu. Ng Chan Way è uno studioso di ricerca della National University of Singapore. Vorremmo ringraziare l'unità di microscopia confocale e l'unità di citometria a flusso dell'Università Nazionale di Singapore per l'aiuto e la consulenza nell'analisi della purezza degli epatociti.
Materiali
| Name | Company | Catalog Number | Comments |
| Material/Equipment | |||
| 1 mL syringe | Nipro | ||
| 27G needle | Nipro | ||
| Black braided silk non-absorbable, non-sterile surgical suture | Look | SP117 | |
| Bochem 18/10 stainless steel forceps, sharp tip contain bent round tip | Bochem | 10333511 | |
| Disposable Perfusion Set | Vasinfuse | BPF-112 | |
| Floating circular 1.5 mL microcentrifuge tube rack | Sigma-Aldrich | R3133 | |
| German Standard Tissue Forceps, Serrated / 1×2 teeth , 14.5cm | Walentech | ||
| Greiner Cellstar aspirating pipette | Merck | GN710183 | |
| Haemocytometer | |||
| Integrated Perfusion System | Vasinfuse | IPS-001 | |
| Iris Scissors curved, stainless, 11cm | Optimal Medical Products Pte Ltd | CVD | |
| Light microscope with 10X lens | Olympus | ||
| Mesh Sheet 100µM Nylon | Spectra-Teknic(s) Pte Ltd | 06630-75 | |
| Operating Scissors, BL/BL, 13cm | Optimal Medical Products Pte Ltd | STR – BL/BL | |
| Operating Scissors, SH/BL, 13cm | Optimal Medical Products Pte Ltd | STR – SH/BL | |
| Reverse force hemostatic clip | Shanghai Jin Zhong Pte Ltd | XEC230 | |
| Water bath | Grant | ||
| Reagents/Chemicals | |||
| 10X Phosphate buffered saline (PBS) | Sigma-Aldrich | ||
| Bovine serum albumin (BSA) | Sigma-Aldrich | A9056 | |
| CaCl2·2H2O | Merck | 137101 | |
| Collagenase Type IV | Gibco | 17104019 | |
| Dexamethasone | TCI | D1961 | |
| DMEM | Gibco | 31600-034 | |
| Glutamax | Gibco | 35050061 | |
| HEPES | Invitrogen | 11344-041 | |
| Insulin | Sigma-Aldrich | 1-9278 | |
| KCl | VWR | VWRC26764.298 | |
| KH2PO4 | Sigma-Aldrich | P5379 | |
| Linoleic acid | Sigma-Aldrich | L9530 | |
| NaCl | Sigma-Aldrich | S5886 | |
| NaHCO3 | Sigma-Aldrich | S8875 | |
| NaOH | Merck | 106462 | |
| Penicillin-Streptomycin | Sigma-Aldrich | P4333 | |
| Type I bovine collagen | Advanced BioMatrix | 5005-100ml | |
| William’s E Media | Sigma-Aldrich | W1878 |
Riferimenti
- Shen, L., Hillebrand, A., Wang, D. Q. H., Liu, M. Isolation and primary culture of rat hepatic cells. Journal of Visualized Experiments: JoVE. (64), e3917 (2012).
- Cabral, F., et al. Purification of hepatocytes and sinusoidal endothelial cells from mouse liver perfusion. Journal of Visualized Experiments: JoVE. (132), e56993 (2018).
- Green, C. J., et al. The isolation of primary hepatocytes from human tissue: optimising the use of small non-encapsulated liver resection surplus. Cell and Tissue Banking. 18 (4), 597-604 (2017).
- Seglen, P. O. Preparation of isolated rat liver cells. Methods in Cell Biology. 13, 29-83 (1976).
- Gopalakrishnan, S., Harris, E. N. In vivo liver endocytosis followed by purification of liver cells by liver perfusion. Journal of Visualized Experiments: JoVE. (57), e3138 (2011).
- Wen, J. W., Olsen, A. L., Perepelyuk, M., Wells, R. G. Isolation of rat portal fibroblasts by in situ liver perfusion. Journal of Visualized Experiments: JoVE. (64), e3669 (2012).
- Korelova, K., Jirouskova, M., Sarnova, L., Gregor, M. Isolation and 3D collagen sandwich culture of primary mouse hepatocytes to study the role of cytoskeleton in bile canalicular formation in vitro. Journal of Visualized Experiments: JoVE. (154), e60501 (2019).
- Shi, W., et al. Isolation and purification of immune cells from the liver. International Immunopharmacology. 85 (95), 106632 (2020).
- Salem, E. S. B., et al. Isolation of primary mouse hepatocytes for nascent protein synthesis analysis by non-radioactive L-azidohomoalanine labeling method. Journal of Visualized Experiments: JoVE. (140), e58323 (2018).
- Xia, L., et al. Tethered spheroids as an in vitro hepatocyte model for drug safety screening. Biomaterials. 33 (7), 2165-2176 (2012).
- Kegel, V., et al. Protocol for isolation of primary human hepatocytes and corresponding major populations of non-parenchymal liver cells. Journal of Visualized Experiments: JoVE. (109), e53069 (2016).
- Zhu, L., et al. A vertical-flow bioreactor array compacts hepatocytes for enhanced polarity and functions. Lab on a Chip. 16 (20), 3898-3908 (2016).
- Du, Y., et al. Synthetic sandwich culture of 3D hepatocyte monolayer. Biomaterials. 29 (3), 290-301 (2008).
- Tong, W. H., et al. Constrained spheroids for prolonged hepatocyte culture. Biomaterials. 80, 106-120 (2016).
- Xia, L., et al. Laminar-flow immediate-overlay hepatocyte sandwich perfusion system for drug hepatotoxicity testing. Biomaterials. 30 (30), 5927-5936 (2009).
- Gupta, K., et al. Bile canaliculi contract autonomously by releasing calcium into hepatocytes via mechanosensitive calcium channel. Biomaterials. 259, 120283 (2020).
- Horner, R., et al. Impact of Percoll purification on isolation of primary human hepatocytes. Scientific Reports. 9 (1), 6542 (2019).
- Osypiw, J. C., et al. Subpopulations of rat hepatocytes separated by Percoll density-gradient centrifugation show characteristics consistent with different acinar locations. The Biochemical Journal. 304, 617-624 (1994).
- Beal, E. W., et al. A small animal model of ex vivo normothermic liver perfusion. Journal of Visualized Experiments: JoVE. (136), e57541 (2018).
- Hillebrandt, K., et al. Procedure for decellularization of rat livers in an oscillating-pressure perfusion device. Journal of Visualized Experiments: JoVE. (102), e53029 (2015).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon