需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
多参数灌注对照分离原代大鼠肝细胞
* 这些作者具有相同的贡献
摘要
该协议详细说明了使用特殊的静脉内导管,标准化的无菌一次性导管,通过实时监测补充的温度控制,以及用于两步胶原酶灌注手术的报警系统,以提高分离的原代大鼠肝细胞的活力,产量和功能的一致性。
摘要
原代肝细胞广泛用于肝病的基础研究和 体外毒性试验。用于原发性肝细胞分离的两步胶原酶灌注手术在技术上具有挑战性,特别是在门静脉插管术中。由于灌注装置的组装、优化或维护困难,该程序也容易偶尔受到污染和灌注条件的变化。在这里,提出了一个改进的两步胶原酶灌注程序与多参数灌注控制的详细方案。通过在手术的关键步骤采取必要的技术预防措施,并通过采用特殊的静脉导管,标准化的无菌一次性导管,温度控制和实时监测和报警系统,降低操作难度和减轻灌注参数的可变性,成功可靠地分离了原代大鼠肝细胞。分离的原代大鼠肝细胞始终表现出高细胞活力(85%-95%),产量(每200-300g大鼠2-5×108 个细胞)和功能(白蛋白,尿素和CYP活性)。该程序由一个集成的灌注系统补充,该系统足够紧凑,可以安装在层流罩中以确保无菌操作。
引言
原代肝细胞是肝脏相关基础研究、疾病治疗和药物检测等应用的重要工具。目前原发性肝细胞分离的金标准是Seglen在20世纪70年代引入的两步胶原酶灌注程序1,2,3 4。然而,这种手术在技术上具有挑战性,并且由新手外科医生进行时失败率很高。即使认为灌注成功,在分离之间也可能观察到肝细胞活力(通常为60%-95%)和产量(每200-300g大鼠0.5-5×108)的巨大差异。这会影响下游实验的质量和规模。除了技术程序之外,用于隔离的灌注装置(无论是市售的还是定制的)也是一个促成因素。必须注意灌注装置的组装、优化和维护。该方案的目的是通过技术程序的多参数灌注控制和两步胶原酶灌注程序的灌注设置来提高原代大鼠肝细胞分离之间的成功率和稳定性。
从技术方面来看,该程序中最困难的步骤是门静脉插管。至于其他步骤,如果遵守良好做法并采取一般预防措施,则可以提高隔离的稳定性。因此,了解每个步骤的推理非常重要,以便外科医生可以对手术过程中可能发生的各种变量做出反应。
已经发表了从大鼠和小鼠中分离肝细胞和肝脏非实质细胞的各种方案1,2,5,6,7,8,9。这些方案中使用的灌注装置有几个缺点,包括重复使用灌注管,温度控制问题,需要常规优化灌注参数,和/或使用不合适的静脉内(IV)导管进行门静脉插管。灌注管的重复使用会增加污染的机会,特别是如果管子没有得到适当的清洁和消毒。在没有常规更换的情况下重复使用管道也会使灌注装置暴露于诸如管道或连接器泄漏,气泡阱塞和管道收缩等问题,所有这些都将大大降低灌注液压力和流速,从而影响肝脏消化效率。在某些温度控制设置中没有恒定的热源,预热缓冲液会随着时间的推移而冷却,导致胶原酶活性和消化率低。虽然其他设置使用连接到水循环器的夹套玻璃冷凝器来加热缓冲器,但它们体积庞大,需要仔细清洁。在分离开始之前,必须测量和优化离开导管的缓冲液的温度、压力和流速,以确保稳定的灌注条件。即使在优化后,由于操作员的行为,参数在隔离期间仍可能中途变化,从而导致灌注和消化欠佳。大多数类型的静脉导管不适合门静脉插管,因为它们不允许在插管期间连续灌注。当插管成功时,他们无法立即通知外科医生。此外,将门静脉固定在软导管上而不使其变形具有挑战性。
在这里,我们使用标准化的一次性无菌管,用于精确稳定温度控制的硅胶加热器夹套,具有数据存储和管理的实时监控和报警系统以及使用特殊的静脉导管来解决这些问题,该导管允许在插管期间刺穿门静脉的同时进行连续灌注。据我们所知,我们是第一个将所有这些功能组合成紧凑的集成灌注系统(IPS)的团队,使其高度便携,能够安装到层流罩中以确保无菌运行。
研究方案
所有程序和动物收容均根据协议编号R15-0027和R19-0669根据新加坡国立大学机构动物护理和使用委员会(IACUC)的要求进行。
1. 溶液和手术器械的制备
- 使用超纯水制备 表1 中的缓冲液和细胞培养基。
- 使用前在水浴中将无钙缓冲液和胶原酶缓冲液预热至37°C。
- 高压灭菌器以下手术器械和实验室设备:一对锋利钝的手术剪刀,一对钝钝手术剪刀,一对弯曲的手术剪刀,两对牙组织钳,两对弯曲的镊子,两个静脉夹,一个5厘米长的3-0丝外科缝合线,一个100μm尼龙网状过滤器,一个400毫升烧杯, 和一个阶段(浮动微量离心管架)。
2. 设置 IPS(请参阅 图 1)
- 用70%乙醇擦拭层流罩。用70%乙醇擦拭IPS并将其移入层流罩中。在打开引擎盖之前,用紫外线消毒>15分钟。
注意:暴露在紫外线下会导致眼睛疼痛和皮肤灼伤。确保在打开紫外光时窗扇完全关闭。 - 将一组新的一次性管子组装到 IPS 上。将蠕动泵下游的管道包裹在硅胶加热器护套中。将灌注监测器安装在硅胶加热器护套下游的管道上。
- 确保两个卡套管入口的滚子夹完全松动。将每个管道入口连接到无菌 2 mL 抽吸移液器的锥形末端。将两个抽吸移液器(入口)和静脉导管(出口)留在带有无钙缓冲液的1L瓶中,以便在随后的启动步骤中使缓冲液再循环。
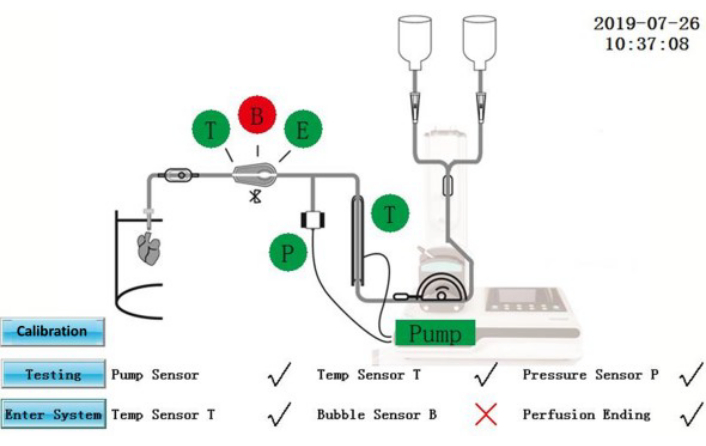
图 2:自检界面。请单击此处查看此图的大图。
- 打开 IPS。在触摸屏控制面板上执行以下操作。该软件将在每次启动时执行全面的自检。
注意:IPS 是连接到外部电源的电气设备。液体溅到 IPS 或电源线上可能会产生电气危险。- 确保屏幕上显示自检状态(图2)。通过自检的组件将显示为绿色;那些失败的将显示为红色。整改后,点击 测试 图标再次重复自检,或点击 进入系统 图标直接进入操作界面。
- 点击屏幕上的任意位置,登录操作界面。
- 在操作界面的左上角(图3),点击任一圆形箭头图标以设置蠕动泵的旋转方向。在界面的右侧面板中,点击向上/向下箭头图标以设置相应参数的值。将流量设置为恒流模式;加热器夹套温度至42°C(要调整以确保灌注液的温度保持在37°C);和泵速高达 38 rpm,流量约为 33 mL/min。
- 在操作界面的右下面板,检查气泡报警、灌注停止报警和静音图标的状态。
- 检查左侧面板中灌注物的温度、压力和流速。通过单击列顶部和底部的向上向下箭头手动设置间隔。检查列中间显示为值的实时数据。如果实时数据超出设置范围,则列的颜色将从绿色变为红色。
- 在中间面板中找到用于开始、暂停和停止灌注的图标,以及用于从实时数据显示切换到图表模式的图标。点击开始图标开始灌注,并用无钙缓冲液为管子打底。将创建一个新日志。在弹出窗口中输入文件名和用户名(图 4)。
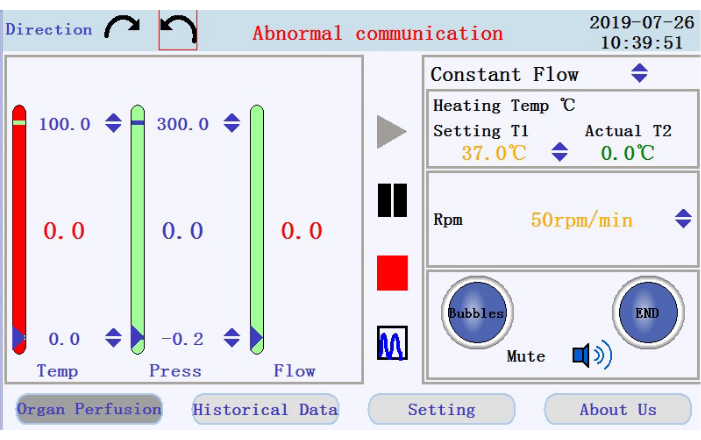
图 3:操作界面。请点击此处查看此图的大图。
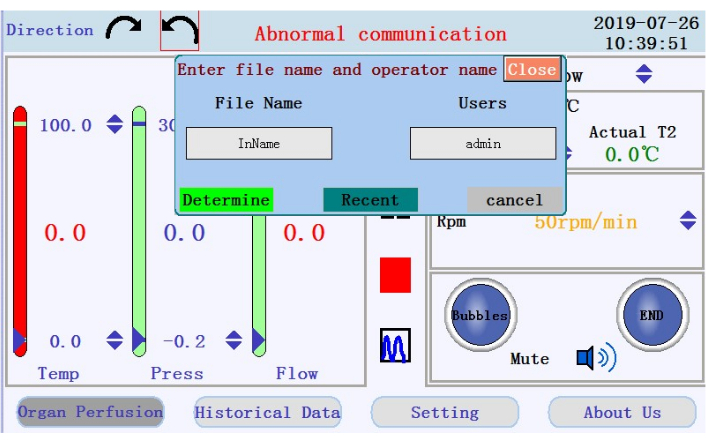
图 4:提示输入文件名和用户名的弹出窗口。请单击此处查看此图的放大版本。
- 将滴灌室填充到半满。确保在启动期间管道中没有卡住的气穴。
- 通过轻拂管道以分离气泡并使其冲洗出来,以清除气泡过滤器下游形成的任何气泡。
注意:当缓冲液被加热器夹套加热时,可能会沿着管道形成气泡。 - 在 400 mL 烧杯中加入 200 mL 胶原酶缓冲液。将舞台放在烧杯的顶部。在不将任何空气引入管道的情况下,完全拧紧其中一个管道入口的滚轮夹,并将入口的抽吸移液器移入烧杯中。
3. 动物程序
- 准备一只体重约200-300克的年轻成年雄性Wistar大鼠。
注意:该方案针对体重约200-300克的大鼠进行了优化。雄性大鼠是优选的,因为雌性大鼠发情周期内的荷尔蒙变化会影响肝细胞功能。 - 麻醉
- 将所需的抗凝血剂肝素(5,000 IU/mL;0.2 mL/100 g 体重)和大鼠麻醉氯胺酮/甲苯噻嗪鸡尾酒(37.5 mg/mL 氯胺酮,5 mg/mL 甲苯噻嗪;0.2 mL/100 g 体重)滴入 1 mL 注射器中,针头为 27 G。
注意:麻醉和肝素是有害物质。处理尖锐物品时要小心。 - 抑制大鼠。腹腔注射肝素,然后注射氯胺酮/甲苯噻嗪鸡尾酒进入腹部右下象限。
注意:盲肠位于左侧的可能性更高。避免在注射过程中刺穿盲肠,以降低污染风险。 - 10分钟后,通过评估大鼠双脚的踏板反射来检查麻醉深度。继续不时检查,等到大鼠不再对脚趾捏起做出反应。如有必要,可以注射额外的麻醉剂。
- 将所需的抗凝血剂肝素(5,000 IU/mL;0.2 mL/100 g 体重)和大鼠麻醉氯胺酮/甲苯噻嗪鸡尾酒(37.5 mg/mL 氯胺酮,5 mg/mL 甲苯噻嗪;0.2 mL/100 g 体重)滴入 1 mL 注射器中,针头为 27 G。
- 将大鼠置于仰卧位,四肢伸展在托盘顶部的铝箔覆盖的聚苯乙烯平台上。用胶带粘住老鼠的脚,并用27 G针将胶带牢固地固定在平台上。
- 通过喷洒并用70%乙醇浸泡胸部和腹部来消毒胸部和腹部。消毒前的剃须是可选的。把老鼠放在引擎盖上。趁皮毛仍然湿润时继续下一步。
注意:用70%乙醇浸渍还可以将皮屑和毛皮粉尘保持在最低限度。 - 将皮肤与肌肉分开。
- 用一只手一对牙齿组织镊子,抬起腹部底部附近的皮肤。另一只手用一把锋利钝的手术剪刀,切开帐篷状的皮肤。将剪刀的锋利端推到皮肤下方,从后腿上方到前腿下方,在皮肤上做一个中线切口。
- 在用镊子向上拉并轻轻拉伸皮肤时,切除任何将皮肤固定在胸部和腹部肌肉上的结缔组织。为了降低污染的风险,防止松散的皮毛掉到肌肉上。要去除剪刀上积聚的松散皮毛,请在皮肤的消毒外侧擦拭干净。
- 在皮肤上做侧切口,从中线到大鼠的两侧,略高于后腿,略低于前腿。将皮瓣推向两侧以暴露肌肉。
- 切开腹部肌肉以暴露器官。
- 用一只手一对新的牙齿组织镊子,抬起腹部底部附近的肌肉。另一只手用一把钝钝的手术剪刀,小心翼翼地切开肌肉,不划伤任何器官。在肌肉上做一个中线切口,从后腿略高于胸骨。
- 在肌肉上做侧切口,从中线到大鼠的两侧,略高于后腿,就在肋骨笼的正下方,而不会划伤任何器官。将肌肉瓣向两侧推以暴露器官。确保皮肤和肌肉的侧切口到达大鼠的侧面,以使血液和缓冲液在后续步骤中从腹腔流出。
- 门静脉插管术
- 用弯曲的镊子的背面,轻轻地将肠道向右推。轻轻翻转肝叶以暴露门静脉。
- 使用3-0丝外科缝合线在靠近肝脏的门静脉周围形成非常松散的结扎,就在静脉分支左右进入不同的肝叶之前。不要收紧结扎,以免扰乱通过门静脉的血流。胆管下方的非常薄的膜需要用弯曲的镊子的尖端穿透,然后缝合线才能通过下方并环绕门静脉(和胆管)。
- 使用两对弯曲镊子的尖端,小心地穿过门静脉下方的组织,而不会损坏门静脉。在第一个结扎的上游约2-3厘米处,在胃静脉从门静脉分支之前这样做。在这个特定位置,组织更薄。
- 用镊子小心地拉伸更大的孔。这个孔将允许镊子在插管期间支撑门静脉。
- 将泵速降至 4 rpm,流量约为 3 mL/min。确保无钙缓冲液从静脉导管流出减少到缓慢滴注。
注意:肝脏中的压力积聚会导致肝细胞死亡。较低的流速应减缓在稍后步骤中成功将套管插入门静脉后肝脏中的压力积聚。 - 使用镊子轻轻支撑门静脉。另一只手,抓住静脉导管,针尖朝上。将针以10-20°角引导至门静脉,缓慢前进,直到整个斜面在静脉内。一旦针头正确插入门静脉,肝脏将开始变白并失去其深红色。
注意:针的整个斜面必须插入静脉,以形成一个足够大的孔来插入套管。但是,不要将针头插入太深,以避免过度刺穿静脉。 - 将套管穿过针头并进入静脉。然后,将针头缩回,直到它在套管后面2-3毫米处;刚好足以使锋利的尖端安全地在套管内。用拇指和中指抓住导管,用食指向后拉动翅膀以缩回针头。
- 用静脉夹快速将门静脉固定在导管上。不要直接夹在针的侧孔上,以免破坏灌注液流动。相反,请夹在它下面。
- 立即切除下腔静脉 (IVC),以防止肝脏压力积聚。到现在为止,静脉下IVC和邻近的血管将被门静脉的血液遮挡。为了确保IVC被正确切割和切断,观察血液在脉搏中喷出;血液只会从邻近的血管中流出。
注意:插管后切除脊髓型IVC的时间太长,或在进入下一步之前未能切除它将导致肝细胞死亡。在此步骤中,动物在麻醉下通过放血(通过切割IVC)进行安乐死。该过程应在失血期间继续进行。通过肉眼观察胸腔在稍后步骤打开时心跳/呼吸停止来确认死亡。 - 将泵速提高到 38 rpm,流量约为 33 mL/min。通过用镊子关闭IVC2-3秒(但不要太长)并重新打开肝脏来冲洗肝脏三次。
注意:在潮红期间,肝脏在恢复正常之前会略微膨胀。冲洗有助于灌注物在整个肝脏中的渗透。潮红后,肝脏的颜色应为全浅棕色。 - 确保套管尖端放置在门静脉分支到不同肝叶的点之前,以确保所有肝叶的灌注。如有必要,松开门静脉并调整套管的位置。之后重新剪辑。
- 收紧门静脉周围的松弛结扎,位于分支点的略微上游。在斜面和侧孔之间由硬金属针支撑软套管的地方打三个结。确保结将套管固定到位,将其固定在门静脉上,并防止缓冲液回流。
- 完整切除整个肝脏。
- 在接下来的12分钟内以〜33mL / min的流速用无钙缓冲液灌注肝脏(见 图5A)。同时,进行肝切除术。如有必要,可以延长灌注时间,但要确保无钙缓冲液不会耗尽。
- 使用一把弯曲的剪刀,通过切割连接它们的肠系膜,小心地将门静脉从肠道中分离出来。不要划伤胃肠道(食道、胃、小肠和大肠),以确保不会发生污染。
注意:这是为了防止门静脉在切除过程中肝脏四处移动时撕裂。 - 通过切割连接肝脏和胃肠道的结缔组织,胰腺和肠系膜,将肝脏从胃肠道中分离出来。要分离,请始终用剪刀剪裁,不要拉扯以撕裂。同样,不要切开或切开胃肠道。
- 轻轻翻转肝脏以暴露横膈膜。沿着肋骨壁切割隔膜。确保大部分隔膜保持与肝脏的连接。注意不要戳或瘀伤肝脏。
- 一旦胸腔打开,可以看到两个导管:左侧为白色的脊上IVC,右侧为淡黄色的食道。剪下上腔IVC并将其剪切到夹子的正上方。剪裁超音阶IVC是可选的。它可以防止胸腔被淹没。
注意:目视观察心跳/呼吸停止以确认动物死亡。 - 食道被横膈膜包围。要将食道与隔膜隔离,请从右侧穿过横膈膜朝食道。切除将食道和胃连接到肝脏和隔膜的任何剩余结缔组织。
- 向右推开胃肠道。将静脉夹从肝上IVC转移到下腔IVC;缓冲区现在将从超腔 IVC 中注入。
注意:在灌注期间,插管和静脉下IVC将被肝脏覆盖。从肝上IVC流出的强缓冲流出将有助于外科医生排除灌注泄漏。 - 切除连接肝脏和胸腔的任何剩余隔膜。切断连接肝脏和腹腔的组织。注意不要将夹子上方的静脉IVC切开,以避免夹子与肝脏分离。
- 为了确保肝脏完全切除,用镊子抓住隔膜小心地抬起肝脏。如果有任何剩余的组织将肝脏连接到腹腔,请将其切断。如果肾脏和脾脏仍然连接到肝脏,请将它们分离。
4. 肝脏灌注和消化
- 如果切除术提前完成,请等到肝脏灌注无钙缓冲液12分钟。
- 将灌注缓冲液改为胶原酶缓冲液。在完全拧紧无钙缓冲液的辊夹之前,完全拧紧胶原酶缓冲液的辊夹(见 图5B)。一旦胶原酶缓冲液通过管子到达肝脏,通过关闭肝上IVC2-3秒并重新打开它来冲洗肝脏三次。
- 小心地将肝脏移动到烧杯顶部的阶段,以进行胶原酶缓冲液的再循环。通过用镊子抓住隔膜来移动肝脏,同时支撑导管。避免拉扯导管,以防止意外导管脱落。
注意:如果导管脱落并且门静脉太损伤而无法再次插管,则对肝上IVC进行插管,并允许缓冲液从门静脉中灌注出来。确保软下 IVC 保持剪切状态。 - 消化肝脏12分钟。观察半透明斑点/网络的外观,因为肝脏开始失去其光滑的棕色质地。肝脏在消化时会变得更大更软。一旦肝脏具有糊状稠度,停止灌注。如有必要,可以延长消化时间。
注意:如果Glisson胶囊已破碎,烧杯中的胶原酶缓冲液可能会由于溢出的肝细胞而变得浑浊。
5. 肝细胞分离
- 通过切断门静脉小心地取下套管。小心地取下夹子。将肝脏转移到含有60毫升冷Dulbecco改良鹰培养基(DMEM)的150毫米培养皿中。
- 使用弯曲镊子的背面轻轻敲击肝脏,以打破并剥离Glisson的胶囊。然后,在DMEM中轻轻左右摆动肝脏以释放肝细胞。继续这样做,直到肝细胞完全解离到DMEM中。
注意:有时整个肝脏或某些肺叶只会被部分消化。通过不刮除肝脏,这将强行移除,并损害未解离的肝细胞,可以获得更高,更一致的细胞活力。 - 轻轻摇动150毫米的培养皿,直到肝细胞在DMEM中分布良好。为了去除组织碎片和细胞团块,将细胞悬浮液通过放置在新的150mm培养皿上的100μm孔径尼龙网过滤器倒入。用30 mL DMEM冲洗旧盘,并将悬浮液转移到网状过滤器中。轻轻敲击网状过滤器,让被困的单个肝细胞通过。
- 取下网状过滤器,轻轻摇晃新的150毫米培养皿,直到肝细胞分布良好。将悬浮液平均分成4 x 50 mL试管。用30 mL DMEM冲洗培养皿,并将悬浮液均匀地分成相同的管中。确保每个管子具有等体积的细胞悬浮液。
- 在4°C下以50× g 离心4×50mL细胞悬浮液管2分钟。 小心地吸出上清液,而不干扰松散的沉淀。弃去上清液。向每个试管中加入20 mL DMEM,并轻轻摇动试管以重悬细胞沉淀。将四管中的细胞悬浮液混合成两个。
- 在4°C下以20× g 离心2×50mL管2分钟。 吸出并丢弃上清液。向每个试管中加入20 mL DMEM,并轻轻摇动试管以重悬细胞沉淀。将两根管子中的细胞悬浮液合二为一。将细胞保持在冰上,直到使用。
- 通过将400μL1x PBS与50μL台盼蓝混合来制备台盼蓝溶液。将50μL肝细胞悬浮液加入台盼蓝溶液中。在光学显微镜下用血细胞计数器计数活细胞和死肝细胞的数量。
6. 肝细胞培养
- 在烟罩中执行所有细胞培养步骤。将1mL胶原包衣溶液加入35mm培养皿中,孵育4小时。用1x PBS冲洗碗碟三次。
- 将肝细胞悬浮液稀释至肝细胞培养基中至80万个细胞/ mL的浓度。将1mL稀释的肝细胞悬浮液加入35mm培养皿中。
注意:肝细胞在移液过程中对剪切应力敏感。考虑使用宽孔径移液器吸头。 - 摇动培养皿以均匀分布肝细胞。在37°C,5%CO2 孵育3-4小时,以使肝细胞附着。
- 用于三明治培养。
- 取出肝细胞培养基。用1mL肝细胞培养基冲洗一次,以除去未连接的细胞。加入1 mL胶原蛋白覆盖溶液。将胶原蛋白覆盖溶液添加到培养皿壁上,以避免将气泡引入溶液中。
- 在37°C,5%CO2 下孵育过夜,以允许胶原蛋白凝胶化。
- 加入1 mL新鲜肝细胞培养基。在37°C,5%CO2下孵育。
- 用于单层培养。
- 步骤6.3后,取出肝细胞培养基。用1mL肝细胞培养基冲洗一次,以除去未连接的细胞。
- 加入1 mL新鲜肝细胞培养基。在37°C,5%CO2下孵育。
- 通过对肝细胞特异性标志物和功能测定进行免疫染色来评估肝细胞纯度和功能,如前文10,11所述。
结果
外科医生可以通过观察某些步骤后的结果来判断肝脏灌注是否顺利进行。第一个结果可以在插管,切割静脉IVC和恢复灌注流速时观察到。肝脏应该已经完全改变颜色从深红色到棕色,同时保持其体积。如果肝脏看起来略微放气,并有红色或红色斑点,则意味着灌注流速设置不正确(太低),或者门静脉没有正确插管。如果肝脏不仅变成棕色,而且变得臃肿和僵硬,则意味着流速设置不正确(太高?...
讨论
对于一般的两步胶原酶灌注手术,有几点特别重要。首先,切除肝脏时必须特别小心。确保胃肠道没有损坏,因为内容物的泄漏会导致细菌污染。此外,避免损坏Glisson的胶囊,该胶囊在动物手术过程中覆盖了肝脏表面。如果撕裂足够大,它可能允许分离的肝细胞过早释放到胶原酶缓冲液中。其次,胶原酶在确保良好的肝细胞活力的同时消化肝脏的能力可能因批号而异。使用的胶原酶量必须针对每...
披露声明
周岩和Hanry Yu宣布了相互竞争的利益,因为他们持有Vasinfuse的股权,Vasinfuse生产和销售集成灌注系统。Hanry Yu持有Histoindex,Invitrocue,Osteopore,Pishon Biomedical,Ants Innovate和Synally Futuristech的股权,这些股权与此处报告的信息没有竞争利益。
致谢
这项工作部分得到了MOE ARC(MOE2017-T2-1-149)的支持;NUHS创新种子拨款2017 (NUHSRO/2017/051/InnovSeed/02);新加坡机械生物学研究所 (R-714-106-004-135);和生物工程和纳米技术研究所,生物医学研究理事会,科学,技术和研究机构(A * STAR)(项目编号IAF-PP H18 / 01 / a0 / 014,IAF-PP H18 / 01 / a0 / K14和MedCaP-LOA-18-02)资助Hanry Yu。Ng Chan Way是新加坡国立大学的研究学者。我们要感谢新加坡国立大学的共聚焦显微镜单元和流式细胞术单元在肝细胞纯度分析方面的帮助和建议。
材料
| Name | Company | Catalog Number | Comments |
| Material/Equipment | |||
| 1 mL syringe | Nipro | ||
| 27G needle | Nipro | ||
| Black braided silk non-absorbable, non-sterile surgical suture | Look | SP117 | |
| Bochem 18/10 stainless steel forceps, sharp tip contain bent round tip | Bochem | 10333511 | |
| Disposable Perfusion Set | Vasinfuse | BPF-112 | |
| Floating circular 1.5 mL microcentrifuge tube rack | Sigma-Aldrich | R3133 | |
| German Standard Tissue Forceps, Serrated / 1×2 teeth , 14.5cm | Walentech | ||
| Greiner Cellstar aspirating pipette | Merck | GN710183 | |
| Haemocytometer | |||
| Integrated Perfusion System | Vasinfuse | IPS-001 | |
| Iris Scissors curved, stainless, 11cm | Optimal Medical Products Pte Ltd | CVD | |
| Light microscope with 10X lens | Olympus | ||
| Mesh Sheet 100µM Nylon | Spectra-Teknic(s) Pte Ltd | 06630-75 | |
| Operating Scissors, BL/BL, 13cm | Optimal Medical Products Pte Ltd | STR – BL/BL | |
| Operating Scissors, SH/BL, 13cm | Optimal Medical Products Pte Ltd | STR – SH/BL | |
| Reverse force hemostatic clip | Shanghai Jin Zhong Pte Ltd | XEC230 | |
| Water bath | Grant | ||
| Reagents/Chemicals | |||
| 10X Phosphate buffered saline (PBS) | Sigma-Aldrich | ||
| Bovine serum albumin (BSA) | Sigma-Aldrich | A9056 | |
| CaCl2·2H2O | Merck | 137101 | |
| Collagenase Type IV | Gibco | 17104019 | |
| Dexamethasone | TCI | D1961 | |
| DMEM | Gibco | 31600-034 | |
| Glutamax | Gibco | 35050061 | |
| HEPES | Invitrogen | 11344-041 | |
| Insulin | Sigma-Aldrich | 1-9278 | |
| KCl | VWR | VWRC26764.298 | |
| KH2PO4 | Sigma-Aldrich | P5379 | |
| Linoleic acid | Sigma-Aldrich | L9530 | |
| NaCl | Sigma-Aldrich | S5886 | |
| NaHCO3 | Sigma-Aldrich | S8875 | |
| NaOH | Merck | 106462 | |
| Penicillin-Streptomycin | Sigma-Aldrich | P4333 | |
| Type I bovine collagen | Advanced BioMatrix | 5005-100ml | |
| William’s E Media | Sigma-Aldrich | W1878 |
参考文献
- Shen, L., Hillebrand, A., Wang, D. Q. H., Liu, M. Isolation and primary culture of rat hepatic cells. Journal of Visualized Experiments: JoVE. (64), e3917 (2012).
- Cabral, F., et al. Purification of hepatocytes and sinusoidal endothelial cells from mouse liver perfusion. Journal of Visualized Experiments: JoVE. (132), e56993 (2018).
- Green, C. J., et al. The isolation of primary hepatocytes from human tissue: optimising the use of small non-encapsulated liver resection surplus. Cell and Tissue Banking. 18 (4), 597-604 (2017).
- Seglen, P. O. Preparation of isolated rat liver cells. Methods in Cell Biology. 13, 29-83 (1976).
- Gopalakrishnan, S., Harris, E. N. In vivo liver endocytosis followed by purification of liver cells by liver perfusion. Journal of Visualized Experiments: JoVE. (57), e3138 (2011).
- Wen, J. W., Olsen, A. L., Perepelyuk, M., Wells, R. G. Isolation of rat portal fibroblasts by in situ liver perfusion. Journal of Visualized Experiments: JoVE. (64), e3669 (2012).
- Korelova, K., Jirouskova, M., Sarnova, L., Gregor, M. Isolation and 3D collagen sandwich culture of primary mouse hepatocytes to study the role of cytoskeleton in bile canalicular formation in vitro. Journal of Visualized Experiments: JoVE. (154), e60501 (2019).
- Shi, W., et al. Isolation and purification of immune cells from the liver. International Immunopharmacology. 85 (95), 106632 (2020).
- Salem, E. S. B., et al. Isolation of primary mouse hepatocytes for nascent protein synthesis analysis by non-radioactive L-azidohomoalanine labeling method. Journal of Visualized Experiments: JoVE. (140), e58323 (2018).
- Xia, L., et al. Tethered spheroids as an in vitro hepatocyte model for drug safety screening. Biomaterials. 33 (7), 2165-2176 (2012).
- Kegel, V., et al. Protocol for isolation of primary human hepatocytes and corresponding major populations of non-parenchymal liver cells. Journal of Visualized Experiments: JoVE. (109), e53069 (2016).
- Zhu, L., et al. A vertical-flow bioreactor array compacts hepatocytes for enhanced polarity and functions. Lab on a Chip. 16 (20), 3898-3908 (2016).
- Du, Y., et al. Synthetic sandwich culture of 3D hepatocyte monolayer. Biomaterials. 29 (3), 290-301 (2008).
- Tong, W. H., et al. Constrained spheroids for prolonged hepatocyte culture. Biomaterials. 80, 106-120 (2016).
- Xia, L., et al. Laminar-flow immediate-overlay hepatocyte sandwich perfusion system for drug hepatotoxicity testing. Biomaterials. 30 (30), 5927-5936 (2009).
- Gupta, K., et al. Bile canaliculi contract autonomously by releasing calcium into hepatocytes via mechanosensitive calcium channel. Biomaterials. 259, 120283 (2020).
- Horner, R., et al. Impact of Percoll purification on isolation of primary human hepatocytes. Scientific Reports. 9 (1), 6542 (2019).
- Osypiw, J. C., et al. Subpopulations of rat hepatocytes separated by Percoll density-gradient centrifugation show characteristics consistent with different acinar locations. The Biochemical Journal. 304, 617-624 (1994).
- Beal, E. W., et al. A small animal model of ex vivo normothermic liver perfusion. Journal of Visualized Experiments: JoVE. (136), e57541 (2018).
- Hillebrandt, K., et al. Procedure for decellularization of rat livers in an oscillating-pressure perfusion device. Journal of Visualized Experiments: JoVE. (102), e53029 (2015).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。